Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях Электрофизиологические измерения крыса локтевого нерва с аксональное возбудимости тестирование
В этой статье
Резюме
Аксональное возбудимости методы обеспечивают мощный инструмент для изучения патофизиологии и биофизических изменения, которые предшествуют необратимые дегенеративные события. Эта рукопись демонстрирует использование этих методов на локтевой нерв наркотизированных крыс.
Аннотация
Электрофизиологии позволяет объективной оценки функции периферических нервов в естественных условиях. Традиционные нервной проводимости меры, такие, как амплитудой и задержкой обнаруживать потери хронический аксона и демиелинизации, соответственно. Аксональное возбудимости методы «, порог слежения» расширить эти меры путем предоставления информации о деятельности ионных каналов, насосов и обменных пунктов, которые касаются острой функции и может предшествовать дегенеративных события. Таким образом использование аксональное возбудимости в животных моделях неврологических расстройств может обеспечить определенную полезную в естественных условиях оценить роман терапевтических вмешательств. Здесь мы описываем экспериментальной установки для нескольких мер мотор аксональное возбудимости методов в крыса локтевой нерв.
Животные находятся под наркозом с изофлюрановая и тщательно контролироваться для обеспечения постоянной и адекватной глубины анестезии. Температура тела, частота дыхания, сердечного ритма и сатурации кислорода в крови постоянно контролируются. Аксональное возбудимости исследования выполняются с использованием чрескожная стимуляция локтевой нерв и запись от гипотенара мышцы лапы передних конечностей. С правильным электрода размещения записывается потенциал действия ясно соединения мышц, что увеличение амплитуды с увеличением интенсивности стимула. Автоматическая программа затем используется для доставки серию электрических импульсов, которые генерируют 5 возбудимости конкретные меры в следующей последовательности: стимул ответ поведение, постоянная времени продолжительность силы, порог electrotonus, ток порог отношения и восстановления цикла.
Представленные здесь данные указывают, что эти меры являются повторяемость и показать сходство между левой и правой локтевой нервы, когда начисленные в тот же день. Ограничение этих методов в этот параметр имеет эффект дозы и времени под наркозом. Для рассмотрения в ходе анализа следует провести тщательный мониторинг и запись этих переменных.
Введение
Использование электрофизиологических методов является важным инструментом для расследования в естественных условиях функции периферических нервов в неврологических расстройств. Методы проведения обычных нерва используют supramaximal стимулы для записи мотор потенциал действия амплитудой и задержкой. Поэтому эти методы обеспечивают полезную информацию на количество проведения волокон и скорости проведения быстрых волокон. Ценный дополнительный инструмент это аксональное возбудимости тестирования. Этот метод использует сложные электрофизиологических стимуляции шаблоны косвенно оценить биофизические свойства периферических нервов, таких, как деятельность ионных каналов, зависящие от энергии насосов, процессов ионного обмена и мембранного потенциала 1.
Аксональное возбудимости тестирования обычно используется в клинических условиях для изучения патофизиологических процессов и последствий терапевтических вмешательств на различных неврологических расстройств. Важно отметить, что меры аксональное возбудимости чувствительны к терапевтических вмешательств, которые влияют на функции периферических нервов, например внутривенного иммуноглобулина (IVIg) терапии2,3 и кальциневрина ингибитора (CNI) химиотерапии 4. Хотя эти исследования предоставили важные идеи, клинические исследования часто исключает исследования ранних признаков заболевания и роман терапевтических варианта5. Таким образом использование этих методов в животных моделях неврологических расстройств недавно получила тяговых6,,78,9. Действительно эти методы предоставляют возможность понять конкретные нерва возбудимости изменения, связанные с этими расстройствами, содействуя тем самым достижению трансляционного исследования.
Процедура, описанная здесь является простой и надежный метод для записи аксональное возбудимости мер на локтевой нервы нетронутыми крысы.
протокол
Все экспериментальные методы, описанные здесь выполнил животное уход и этики Комитета UNSW Сидней и были выполнены в соответствии с национального здравоохранения и медицинских исследований Совета (NHMRC) Австралии правил для экспериментов на животных.
1. Экспериментальная установка
Примечание: 12 неделя старый, женский Лонг-Эванс крыс были использованы в этой процедуре.
- Анестезировать крыса в камеру всасывание с помощью изофлюрановая 4% и 1 Л за скорость потока2 мин O. Подтверждения достаточной анестезии, тестирование для восстанавливающих рефлекс и обеспечить ее отсутствие перед удалением животное из камеры для индукции. Обратите внимание, что различные анестетиков имеют неодинаковое воздействие на нервной возбудимости10.
- Надежно морду животного в носовой конус вложений и доставить поддерживающей дозы 2,5% изофлюрановая и 1 Л в мин O2 скорость потока.
- Подтвердите адекватной анестезии, проверяя для педали вывода и роговицы рефлексов путем сжимать пальцы животного и нежно касаясь ее глаз.
Примечание: Применение ветеринар мазь на глаза, чтобы предотвратить сухость под наркозом, рекомендуется, но не существенно, как процедура обычно занимает 30 минут на одно животное. - Поддерживать температуру тела крыс при 37 ° C с использованием обратной связи контролируемых нагревательный мат и Зонд ректальный термометр. Установите нагревательный мат и датчик температуры комплексной тела до 40 ° C, чтобы предотвратить любые повреждения кожи, которое происходит при более высоких температурах.
Примечание: Рекомендуется контролировать и фиксировать физиологических мер (ЧСС, насыщение кислородом, температуры тела и дыхания) каждый 10s с использованием животных физиологические системы мониторинга. Оптимальной записи процедуры должны включать местные измерения температуры конечностей, как периферийные температура может быть холоднее, чем в основной температуры11 (рис. 1). - В перчатках антисептиком и всегда использовать инструменты, которые были очищены с 70% этанола, для поддержания свободной от возбудителя среды во всей процедуре.
2. Электрофизиологические Настройка
- Для этой процедуры используйте низкий импеданс электроды иглы платиновые электроэнцефалограммы (ЭЭГ).
- Подготовьте электроды иглы записи, вставки записи иглы электрода (рис. 1; указывается в фиолетовый) через гипотенара мышцы и электрод сравнения через спинной части 4-значный (рис. 1, указанных в оранжевый) для записи потенциалы действия соединения мышц (CMAPs).
- Место земли электрод через кожу на Улучшенный аспект предплечья между стимулирования и записи электродов (рис. 1; указывается в Грин). Соблюдайте осторожность при вставке электроды избежать мышечной ткани.
- Подготовить перкутанная стимулирующих электродов иглы, вставив катода (рис. 1; помечены в синий) около 4 мм дистальнее локтевого туннель в локте. Вставить анода (рис. 1; помечены в красный) примерно 1 см проксимальнее через кожу подмышечные области.

Рисунок 1: схема размещения электродов иглы в Передняя конечность крысы. Катода (синий) вставляется около 4 мм дистальнее локтевого туннеля в локте и анода (красный) вставляется примерно 1 см проксимальнее через кожу подмышечные области. Электрод игла земли (зеленый) вставляется через кожу на Улучшенный аспект предплечья между стимулирования и записи электродов. Запись (фиолетовый) и ссылка (оранжевый) электроды иглы вставляются через гипотенара мышцы и спинной части 4-й значный. Датчик температуры (серый) помещается на Улучшенный аспект тенара мышцы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. аксональное возбудимости процедуры
- Выполнять грызунов двигательного нерва TRONDNF протокола с использованием полуавтоматического, компьютерная программа контролируемых аксональное возбудимости (см. таблицу материалы) связан с постоянной текущего стимулятором и усилитель. Удалите избыток 50 Гц электрические помехи с помощью выпрямитель шум 50/60 Гц.
- Запись CMAP от гипотенара мышцы одновременно визуализировать CMAP морфологии и применяя 1 мс площади волны импульса на локтевой нерв с катода электрод игла.
- Для достижения оптимальной записи, тщательно регулировать угол и положение катода до оптимального двухфазный кривой отклика с постоянной амплитуды достигнуто (рисунок 2A.). После того, как была определена оптимальная позиция, стабилизируйте катода с держателем перемещаемый электрода.
Примечание: Программное обеспечение, используемое автоматически обеспечивает стимулы теста, описанных ниже и увеличивает или уменьшает ток, необходимых для достижения порогового значения.
- Для достижения оптимальной записи, тщательно регулировать угол и положение катода до оптимального двухфазный кривой отклика с постоянной амплитуды достигнуто (рисунок 2A.). После того, как была определена оптимальная позиция, стабилизируйте катода с держателем перемещаемый электрода.
- Запись кривой стимул реакция, постепенно увеличивая интенсивность стимул 1 мс импульса 1 мА до достижения максимальной реакции.
Примечание: Фиолетовый и зеленый линия на рисунке 2B и 2C представляет собой постепенное увеличение интенсивности стимула и автоматизированной системы соответственно. Амплитуда Целевой порог слежения автоматически устанавливается на 40% максимальной амплитуды, соответствующий области крутого склона на кривой стимул реакция. Изменения в «порог» (т.е. стимулы, необходимые для получения 40% CMAP) под воздействием различных раздражителей тест является переменной из полученных на протяжении оставшейся части протокола. - Запись нескольких параметров аксональное возбудимости, включая порог electrotonus (TE), ток порог (I / V) отношения и восстановления цикла (RC), как описано в справочнике12.
Примечание: Программа контролируемых аксональное возбудимости компьютер оценивает порог (TE) с 100 мс, подпорогового расшатывания и гиперполяризирующий течения, которая устанавливается на ±20% и ±40% порог управления текущей. Изменение порогового значения после деполяризующий и гиперполяризирующий течения автоматически регистрируется на 14 моменты времени в течение 100 мс, поляризационный текущих и 12 очков после поляризационный текущей. Порог electrotonus косвенно оценивает интермодального проводимости и является маркером мембранного потенциала. I / V отношения оценивается с 200 мс подпорогового принадлежности токи, которые чередуются в интенсивности от 50% до -100% порог управления с шагом в 10%. I / V отношения отличается TE в том, что токи дольше продолжительности, интенсивности поляризации постепенно изменяется от 50% до -100% и порог изменения оценивается в каждом интенсивность 1 мс после поляризационный текущего прекратила. I / V связь обеспечивает проницательность в выпрямляя свойства аксон1. RC оценивается с парных пульс парадигмы, первоначальный supramaximal принадлежности стимул, где применяется последовали серии испытаний стимулов через определенные интервалы от 2,5 мс до 200 мс, этот параметр тесты ряд четко определенных событий, которые происходят в узловой региона аксона, после стимуляции supramaximal. Эти мероприятия включают, инактивации напряжения воротами каналов Na+ который делает его более трудным для получения последующего ответа и количественно Огнеупорность и относительной огнеупорных периода 1. Это сопровождается зарядки в internode и период повышенной возбудимости, посредничестве быстро калиевые каналы, количественно, superexcitability. Наконец медленно активация калиевые каналы посредником поздний период снижение возбудимости, количественно как subexcitability.
- Запись CMAP от гипотенара мышцы одновременно визуализировать CMAP морфологии и применяя 1 мс площади волны импульса на локтевой нерв с катода электрод игла.
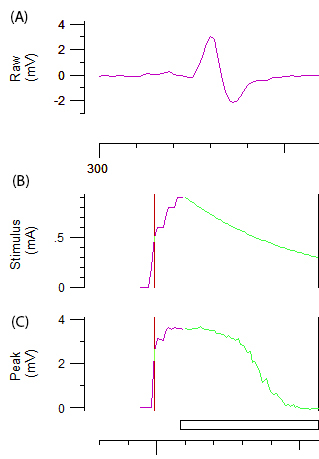
Рисунок 2: необработанные данные от test. аксональное возбудимости Группа A демонстрирует кривой отклика CMAP abiphasic после постепенное увеличение стимуляции на локтевой нерв. Панели, B и C представляют интенсивности стимула (mA) и амплитуда CMAP (mV), соответственно. Зеленый компонент B и C изображает автоматизированных инкрементное уменьшение интенсивности стимула и связанные сигмовидной кишки формы снижение CMAP, необходимые для отслеживания порог.
4. пост электрофизиологии процедуры
- Трансфер крыса в отдельной клетке до тех пор, пока он сознание достаточно для поддержания грудной recumbency. Не оставляйте животное без присмотра и в компании других животных до тех пор, пока он полностью оправился от анестезии. После того, как крысы полностью оправился от наркоза, перенесите его обратно в его оригинальной клетку.
- В завершение исследования усыпить крыса без боли для животных, например смертоносных внутрибрюшинной инъекции барбитуратов (например lethabarb).
Результаты
Электрофизиологические меры крыса локтевого нерва были получены с настоящим Протоколом. Рис. 3 демонстрирует представитель записи из левой локтевой нерв 12 недельных женского пола крыса длинные Эванс. Потенциал действия соединения мышц касается колич...
Обсуждение
Описанная процедура демонстрирует простой и надежный, минимально инвазивные техники позволяет оценки биофизических свойств и мембранный потенциал аксон в короткий период времени. По сравнению с другими более инвазивных методов, которые требуют воздействия нерва, нынешний метод испы...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Проект был поддержан Lundbeck фонд, Фонд Ново Нордиск, датский Совет медицинских исследований, Людвиг и Сара Elsass фонд, Кай Dahlboms фонд и Фонд исследований в области неврологии и Ютте. А поддерживается ранней карьеры после стипендии национального здравоохранения и медицинских исследований Совета Австралии (#1091006)
Материалы
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Ссылки
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены