需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
鸡羽毛角蛋白水解物的制备及其在化妆品中的应用
摘要
该协议的目的是用碱性酶水解法制备鸡羽毛中的角蛋白水解物, 并测试在化妆品软膏基中添加角蛋白水解液是否改善了皮肤屏障功能 (提高水化和减少皮水损失)。对男性和女性志愿者进行测试。
摘要
角蛋白水解物 (KHs) 是建立在头发化妆品的标准成分。了解其保湿效果有利于护肤化妆品。该协议的目标是: (1) 用碱性酶水解法将鸡羽毛加工成一层, 用透析法纯化, (2) 如果将其加入软膏基 (OB), 可增加皮肤的水化, 改善皮肤屏障功能, 减少皮失水 (TEWL)。在碱性酶水解过程中, 在碱性环境下, 先在较高的温度下孵育, 然后在温和的条件下, 用水解酶水解。溶液的透析, 真空干燥, 研磨成细粉。在水乳剂中含有2、4和 6 weight% (基于 OB 重量) 的含油的化妆品配方。在10男性和10妇女的时间间隔内对其保湿性能进行测试, 1、2、3、4、24和 48 h. 试验配方在脱脂掌侧前臂部位分布。通过测量皮肤的电容来评估角质层 (SC) 的皮肤水化, 这是世界上使用最广泛和简单的方法之一。TEWL 的基础是测量每一个定义的区域和从皮肤的时间段的水运输量。这两种方法都是完全无创的。使一个优秀的闭塞;根据添加到 OB, 它带来约30% 减少 TEWL 后, 应用。它也起到了剂的作用, 因为它将水从表皮的下层层束缚到 SC;在 OB 的最佳的增加, 19% 上升在男性和22% 上升妇女发生。
引言
屠宰场、食品工业和制革业每年生产大量的固体角蛋白 by-products--羊毛、羽毛、刚毛、蹄、爪、角等。根据最新的统计数据, 美国的鸡、火鸡、鸭和其他屠宰家禽的活体重为每年625亿磅1;在欧盟, 每年大约有287亿英镑。考虑到羽毛占家禽总重量的 8.5%, 美国每年单独生产大约53亿磅的废弃羽毛2。
角蛋白是一种表现出高耐化学性的蛋白质, 因为它与二硫化桥紧密交联, 使其加工变得困难。获得可溶性产品需要裂解交和可能进行水解的肽键3。二硫化物桥梁的劈裂可以通过硫醇阴离子的反应进行, 根据下面的模式4,5:
sa - + sbsc–↔sb+ s sc-
与一个非常高 pH 水平, 也出现的二硫化物桥梁的水解, 与样式符合6
–SS- +- → s- + –SOH
在温和的条件下 (pH 值约 8), 甚至 sulfitolysis 发生根据以下模式:
–SS– + HSO3- →–SH + –SSO3-
降解角蛋白最经济的方法是微生物分解, 其特点是加工过程中反应条件温和, 击穿效率高 (约 90%)7,8。Keratinases 是由一些从土壤和角蛋白废料中分离出来的细菌产生的9。微生物 keratinases 水解刚性和强交联的角蛋白结构10和所得到的所制备的含有丰富的可溶性蛋白质, 在它的基本氨基酸没有损失, 在它的检测11。
为了在化妆品制剂中加入一种蛋白质 (例如, 如、乳液、乳液和凝胶), 这些要求确保了这种蛋白质在水中是可溶的, 给定的系统是透明的, 并且避免了 re-aggregation 的多肽, 因为疏水相互作用。因此, 一个常见的做法是应用水解蛋白, 如水解胶原蛋白, 弹性蛋白, 和角蛋白。在化妆品乳液中加入水解物时, 采取步骤确保水解液首先溶解于水中。在某些情况下, 它是可取的蛋白质 (或水解物) 是可溶性的酒精或其他有机溶剂12。
通常在洗发水, 调理剂, 乳液, 和营养血清的头发, 以及睫毛, 指甲油, 和眼部化妆品的特点。所宣布的影响通常包括形成保护膜, 平滑头发或指甲结构, 提高可塑性和外观的处理形成, 调节产品的一致性, 并鼓励泡沫的形成13,14. 它也表明, 降低表面张力, 因此补充化妆品可以促进减少乳化剂添加到稳定霜。限制清洁剂 (表面活性剂) 对皮肤、眼睛和毛发的刺激作用, 从而减少清洁剂对组织的潜在副作用 (例如、皮肤脱水、硬度和降低屏障功能皮肤)。同时利用水解物的高缓冲能力来稳定化妆品的 pH 值;较短长度的多肽具有更大的缓冲效果15,16。虽然 KHs 已成为在头发和指甲化妆品的标准成分, 以及在产品中使用的护肤品, 研究的保湿作用, 不出现在当代文学。
碱性酶技术已经发展为加工角蛋白 by-products 成的, 并且活性测试是在过程中的一些化妆品添加剂的效果17,18,19,20,21,22. 二级碱性酶水解利用微生物蛋白酶对鸡羽毛的优越性在温和的反应条件下达到高效, 而在强酸中使用的水解液的质量很高。或碱。在第一阶段, 在碱性环境中, 羽毛会在较高的温度下孵化, 这会部分地扰乱角蛋白结构并使羽毛膨胀;在调整 pH 值后, 在第二阶段, 在温和的条件下, 用水解酶水解羽毛。透析具有高含量的蛋白质。
本文所描述的方法的目的是通过碱性酶水解处理家禽羽毛, 并检测其在化妆品乳液中的保湿性能。用非侵入性方法对体内的保湿性能进行了研究。最常用的测量皮肤水化和屏障功能的方法包括测量皮肤的电学特性 (电导或电容)。研究 SC 水合的不同方法包括近红外多光谱想象方法 (尼姆)、核磁共振光谱学、光学相干断层扫描或瞬态热传导23。sc 的阻隔作用与 sc 的 TEWL 性有关, 采用通风室法、通风室法和开放式室法测定24。
模型配方的性质是使用多探头适配器 MPA 5 和三种探针确定的。第一个, corneometer CM 825, 通过评估皮肤表面的电容量变化来测量皮肤水化;测量电容器显示 corneometric 单位的皮肤表面电容的变化。corneometer 只给出皮肤水化的相对评估25。对于 TEWL, 第二探针, tewameter TM 300, 用于测量水蒸发密度梯度 (在一个开放的房间仪器基于菲克的扩散定律) 从皮肤间接由两对传感器 (温度和相对湿度)表示每一个定义的区域和时间段内运输的水量 (克/米2/小时)。这种方法甚至可以检测到皮肤屏障功能的轻微破坏26。皮肤 pH 值是 SC27的屏障和抗菌功能的一个指标。皮肤地幔的酸度是由 (第三) 皮肤 PH 值905探头连接到 MPA 5 站测量的。这个专门设计的探头由一个平顶的玻璃电极组成, 用于全皮肤接触, 连接到电压表。该系统测量的潜在变化, 由于氢阳离子周围的非常薄层的半固态形式测试顶部的探针。电压的变化显示为 pH 值28。
本实验分为三部分: (1) 用两段碱性酶解法制备鸡羽毛中的水, 并通过透析 (除去盐和低分子分数) 纯化, (2) 化妆品的制备含有2、4和6% 的配方, 以及 (3) 通过测量皮肤水化、TEWL 和皮肤 pH 值来测试其性能。对10名平均年龄为27.2 岁的妇女和平均年龄为26.2 岁的10男子进行了试验。选择志愿者和测试本身的方法是按照国际生物医学研究的伦理原则进行的, 利用人体主体29;在纳入研究之前, 所有的人都给予了他们知情的同意。在测试开始之前, 志愿者们被要求填写一份关于他们健康状况的问卷。志愿者承诺在试验期间和测试期间, 避免在24小时内将任何化妆品应用于试验场和周边地区;此外, 他们只允许短暂的傍晚冲洗自来水。
研究方案
我们大学的员工和学生中都招募了志愿者。该方法的选择是根据 "国际伦理准则的生物医学研究涉及人类的主题。日内瓦国际医学组织理事会 (2002)。是一种常见的化妆品成分, 用于护发产品 (洗发水、调理剂、等), 因此不需要机构审查委员会的批准。
1. 加工鸡毛
- 从家禽饲养场收集鸡毛。
- 用足够多的新鲜跑步 (冷水) 冲洗鸡毛中的不溶性杂质和血液残渣。将羽毛放在平板上, 在50° c 的晚上晾干。
注意: 协议可以在此处暂停。 - 研磨50克干燥的羽毛在一个切割机 (适用于软到中硬样品材料, 和纤维材料) 到最后的细度1.0 毫米. 或者, 研磨羽毛的最后细度可以更高, 但不超过3.0 毫米。
注意: 协议可以在此处暂停。 -
脱脂羽毛
注: 最有效、最经济的脱脂家禽羽毛的方法是使用一种商业化的脂酶。- 在一个不锈钢 27 L 锅炉容器与温度控制, 混合的羽毛与水预热到40±2° c 在重量比率1:75。添加一个脂酶 (活性 100 3/克) 在剂量为 1.5-2.0% (与 weighed-in 干羽毛有关), 并轻轻搅拌的内容与一个头顶搅拌器5分钟。
- 将混合 pH 值调整为9.0 ± 0.2, 通过添加1% 氢氧化钠或 1% H3PO4解决方案, 与脂酶的最大活性相对应的数值。搅拌5分钟的混合物与一个头顶搅拌器, 然后检查和重新调整 ph 值水平使用实验室台的 ph/mV 米。
- 在40±0.5 ° c 时, 用顶置搅拌器轻轻搅拌24小时。另外, 孵育混合物在40±0.5 ° c, 并且在第一 6 h 期间孵育搅动内容在 1 h 间隔时间。
- 通过细筛 (100 µm 大小) 过滤混合物, 用一股新鲜的跑步 (冷水) 洗涤脱脂羽毛。在干燥室过夜, 在50° c 的平盘上晾干羽毛。
注意: 协议可以在此处暂停。
- 执行鸡羽水解的第一阶段。混合羽毛与 0.3% KOH 水溶液在重量比1:50 和轻轻搅拌与一个头顶搅拌器在60±0.5 ° c 为 24 h。在孵化的开始时, 混合物的 pH 值从大约12.5 下降到大约11.0。在完成水解的第一阶段后, 将混合物的 pH 值调整到与蛋白水解酶的最大活性相对应的水平, 10% H3PO4 (本例中为9.0 ± 0.2), 加入1% 氢氧化钠。
- 进行鸡羽水解的第二阶段。添加到混合物中, 水解酶在一剂量为 5.0% (与羽毛的干物质有关, 在第一阶段的 weighed-in 开始时)。轻轻搅拌在60±0.5 ° c 为8小时, 然后加热混合物 (在同一个不锈钢 27-L 锅炉容器) 到沸点 (100 ° c) 和煮沸为 10 min 钝化酵素。
- 将溶残余物 (在步骤1.6 中制备) 的溶液分离出来, 通过傅书礼漏斗上的低密度滤纸过滤, 并有轻微的真空压力;或者, 使用离心机。
注意: 如果在5±1° c 下存储了一个解决方案, 则可以在这里暂停协议几天。 - 在塑料桶 (26 厘米直径 x 26 厘米高) 透析使用 12 K 分子膜去除小肽和盐。将400毫升溶液倒入透析管中, 在室温下透析4升蒸馏水80小时;在18、36和60小时后改变蒸馏水。
- 在粘板上施放透析溶液 (例如, 硅胶) 在500毫升到1000厘米2板块面积的比率, 真空干燥它在一个薄膜在40±0.5 ° c 过夜, 研磨形成一个细粉, 并保持它在一个封闭的船只在干燥。
注意: 如果在干燥的地方储存了这些粉末, 可以在这里暂停协议几个月。
2. 准备化妆品配方
注: 用于测试的 OB 是一个商业亲水的 O/W 奶油基地, 由水、石蜡、石蜡液、c16-18-醇、醚4、氢氧化钠、卡波姆、酯和 propylparaben 组成。
- 准备含有 2, 4 和6% 的配方 (根据软膏的基本重量)。在聚乙烯容器 (7 厘米直径 x 10 厘米高) 中称量粉末的数量, 并在保证配方总重量等于50克的量上加入 OB;请参见表 1中的菜谱。
| 化妆品配方 | 软膏底座重量 [g] | 角蛋白水解物的重量 [g] | 总重量 [g] | |||||
| 软膏底座 | 50 | 0 | 50 | |||||
| 软膏基 + 2% | 49 | 1 | ||||||
| 软膏基 + 4% | 48 | 2 | ||||||
| 软膏基 + 6% | 47 | 3 | ||||||
表 1: Weight-in 量的软膏基和角蛋白水解物准备化妆品配方。
- 质的混合物与一个3叶片的实验室搅拌器为10分钟, 在 134.16 x g 和混合使用机械头顶搅拌器。在5±1° c 下保持准备好的配方, 在室温下加热2小时, 然后使用。
注: 将 OB 与非的混合物均匀化, 也可以用一个混合的搅拌器来完成。在非搅拌器上, 还有比转速 (rpm) 的刻度。轻柔的搅拌将为这一步的最好的工作。
注: 如果配方储存在5±1° c, 则可以在这里暂停长达5月的协议。
3. 通过测量皮肤水化、TEWL 和 pH 值测试其性能
注: 在23±2° c 和相对湿度为56±3% 的条件室中执行所有测量。
- 安置5条滤纸 (大小 2 x 4 cm) 入生理解答 (0.90% 氯化钠) 并且留给他们大约 1 min 在解答。
- 将两条带子应用于右前臂内侧, 三到左前臂内侧, 用胶布固定4小时。这一步是脱脂皮肤和消除个人特征的皮肤在网站上。在 4 h 之后, 卸下带永久笔的区域并丹麦, 请参见图 1。
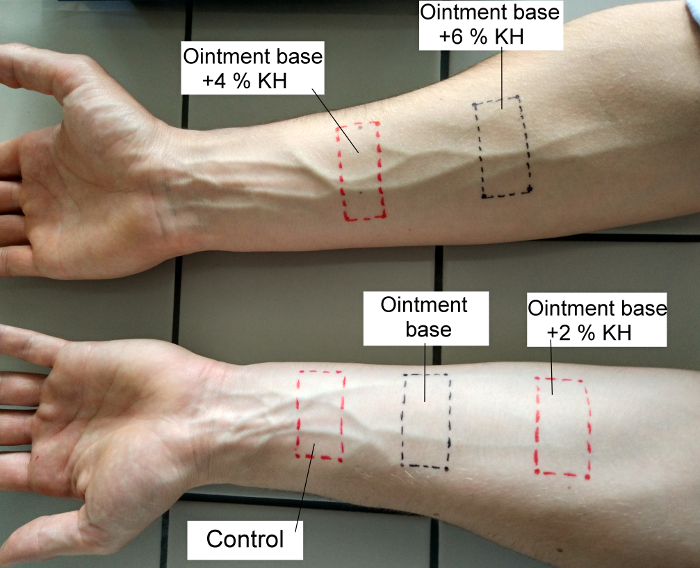
图 1: 左侧和右侧上肢前臂上的试验配方的定位方法.请单击此处查看此图的较大版本.
- 使用注射器在脱脂前臂部位的每个部位应用0.1 毫升的测试配方, 并将其涂抹在整个标记的表面上。在左前臂, 不要对第一个站点应用任何东西 (它是控制), 将 ob 应用到第二个站点, 而 ob + 2% 则是第三个。应用 ob + 4% 和 ob + 6%, 对右臂。
- 测量每个站点和每个间隔的每个样本 (1, 2, 3, 4, 24, 和 48 h), 并采取5读数与皮肤水合仪探头皮肤水化, 15 读数与 TEWL 米探头皮肤 TEWL, 和1阅读与皮肤 ph 计探针皮肤 ph。在测试期间, 不允许志愿者将任何化妆品应用到测试场所和周边地区;他们被允许简要的晚上洗涤用自来水。
注意: 协议可以在此处暂停。 - 使用电子表格软件, 根据描述性统计的基本数字特征处理所产生的读数。从为每个样本测量的5水合读数中, 忽略最低和最高读数, 并只计算算术平均值和标准偏差的3读数。从 15 TEWL 读数测量每个样本, 忽略前 5, 并计算只有10读数的算术平均数和标准差。
结果
根据这里所介绍的程序 (参见图 2) 是黄色的, 容易溶于高蛋白质含量的水中 (无机固体代表 < 2.0%); 1.0% 溶液的 pH 值为 5.3, 满足了化妆品级水解物。50克原料的产量约为30%。通过 SDS 页确定了其分子量分布, 如图 3所示。

讨论
碱性酶水解的优点是可以根据今后的应用进行改性。例如, 在头发护理化妆品应用中, 一个产品的轻微棕褐色不是一个障碍, 更高的温度在水解可以被应用导致更高的收益率。此外, 工艺过程中两个阶段的处理时间越长, 对整个工艺效率的影响越大--其收率上升到85%。
水合测量的结果表明, 在被监测的测量间隔 (1-48 h), 增加2% 的 OB 是最佳的, 因为它导致了 11-19% 增加的 SC 水合为男?...
披露声明
作者没有什么可透露的。
致谢
这篇文章是在 Zlin 的托马斯巴塔大学 IGA/FT/2017/007 项目的支持下编写的。
材料
| Name | Company | Catalog Number | Comments |
| Material or chemicals | |||
| LIPEX 100T | Novozymes | LJP30020 | Lipex - enzyme produced by submerged fermentation of a genetically-modified microorganism, activity 100 KLU/g |
| Savinase Ultra 16L | Novozymes | PXN40001 | Savinase - enzyme produced by submerged fermentation of a genetically-modified microorganism, activity 16 KNPU-S/g |
| Potassium hydroxide, KOH | Sigma-Aldrich | 302510289 | Potassium hydroxide, KOH, 97,0 %, Mr 56,11 |
| Phosphoric acid solution, H3PO4 | Sigma-Aldrich | W290017 | Phosphoric acid solution, H3PO4, 85 wt. % concentration in water, Mr 98,00 |
| Sodium chloride physiological solution | Sigma-Aldrich | 52455 | Tablets of BioUltra NaCl physiological solution; 1 tablet in 1000 mL of water yields 0.9 % NaCl |
| Sodium hydroxide, NaOH | Penta s.r.o. | 40216 | Sodium hydroxide, NaOH, 97,0 %, Mr 40,00 |
| AmiFarm (Cremor base-A) | Fagron | 608425 | Hydrophilic oil in water (O/W) cream base; the composition: aqua, paraffin, paraffin liquid, cetearyl alkohol, Laureth 4, sodium hydroxide, carbomer, methylparaben, propylparaben. |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| IKA EUROSTAR POWER control-visc stirrers | IKA-labortechnik | Z404020 | Digital laboratory stirrer, for tasks up to the high viscosity range, 230V, 1/cs |
| IKA Propeller stirrer, 3-bladed | IKA-labortechnik | R 1381 | Propeller stirrer, 3-bladed, stirrer Ø: 45 mm, shaft Ø: 8 mm, shaft length: 350 mm |
| Dialysis tubing closures | Sigma-Aldrich | Z371017-10EA | Dialysis tubing closures, red, size 110 mm |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9402-100FT | Dialysis tubing cellulose membrane, average flat width 76 mm (3.0 in.) |
| DOMO Pot with stailess, LCD | DOMO Elektronic | DO42325PC | Preserving boiler stainless steel, 2000 W, 27-L container (diameter 37 cm, height 30 cm), temperature control 30-100 ° C, operation LCD display |
| Hettich zentrifugen Universal 32 | Gemini bv | 2770 GS1R | Mid bench centrifuge, speed 18000 rpm |
| LT 3 shaking device | Fischer Scientific | 6470.0002 | Orbital shaking device |
| KERN 440-47N | Kern | 440-47N | Laboratory balance |
| KERN 770 | Kern | 770 -N | Laboratory analytical balance |
| VENTICELL 222 - Komfort | BMT, MMM Group | C 131749 | Drying oven, temperature control 30-100 ° C, air circulation control |
| Vacucell 55 - EVO | BMT, MMM Group | B 050328 | Vacuum drying oven, temperature control 30-100 ° C |
| PULVERISETTE 19 | Fritsch | 19.1030.00 | Universal cutting mill, rotor with V-cutting edges and fixed knives |
| Multi Probe Adapter System MPA 5 | Courage & Kazaka Electronic | 10225237 | MPA 5 Station - equipment for measurement hydratation, TEWL and pH |
| Skin pH-meter PH 905 probe | Courage & Kazaka Electronic | Probe to specifically measure the pH on the skin surface or the scalp | |
| Corneometer CM 825 probe | Courage & Kazaka Electronic | Probe to determine the hydration level of the skin surface (Stratum corneum). | |
| Tewameter TM 300 | Courage & Kazaka Electronic | Probe for the assessment of the transepidermal water loss (TEWL) | |
| Heidolph RZR 2020 | Heidolph | 13-225-007-03-1 | Overhead stirrer, mechanical speed setting and stepless transmission; speed range 40-2000 rpm |
| Heidolph mechanical stirrer BR 10 | Heidolph | Z336688-1EA | Blade impeller crossed stirrer |
| Fagor FS 12 | Fagor | BTT-138 | Laboratory refrigerator with freezer space |
| WTW bench pH/mV meter | WTW | Z313165 | High-performance bench pH and pH/conductivity meters for routine and high precision laboratory measurements in research or quality control laboratories |
| Container | RPC Superfos | 13-L plastic bucket, diameter 26 cm, height 26 cm | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Microsoft Office 2010 | Microsoft | ||
| C+K software | Courage and Khazaka Electronic GmbH | MPA 5 station operating software |
参考文献
- United States Department of Agriculture - National Agricultural Statistics Services. . Poultry Slaughter, 2016 Summary. , (2016).
- McGovern, V. Recycling poultry feathers: more bang for the cluck. Environ.Health Perspect. 108 (8), A336-A339 (2000).
- Gousterova, A., et al. Degradation of keratin and collagen containing wastes by newly isolated thermoactinomycetes or by alkaline hydrolysis. Lett. Appl. Microbiol. 40 (5), 335-340 (2005).
- Yamauchi, K., Yamauchi, A., Kusunoki, T., Khoda, A., Konishi, Y. Preparation of stable aqueous solution of keratins, and physiochemical and biodegradational properties of films. Biomed. Mater. Res. 31 (4), 439-444 (1996).
- Schrooyen, P. M. M., Dijkstra, P. J., Oberthur, R. C., Bantjes, A., Feijen, J. Partially carboxymethylated feather keratins. 2. Thermal and mechanical properties of films. J. Agric. Food Chem. 49 (1), 221-230 (2001).
- Mark, H. F., Gaylord, N. G., Bikales, N. M. . Encyclopedia of Polymer Science Technology: vol. 8: Keratin to Modacrylic Fibers. , (1968).
- Bertsch, A., Cello, N. A biotechnological process for treatment and recycling poultry feathers as a feed ingredient. Bioresour. Technol. 96 (15), 1703-1708 (2005).
- Grazziotin, A., Pimentel, F. A., de Jong, E. V., Brandelli, A. Nutritional improvement of feather protein by treatment with microbial keratinase. Animal Feed Sci. Technol. 126 (1-2), 135-144 (2006).
- Brandelli, A. Bacterial keratinases: useful enzymes for bioprocessing agroindustrial wastes and beyond. Food Bioprocess Technol. 1 (2), 105-116 (2008).
- Gusta, R., Ramnani, P. Microbial keratinases and their prospective applications: an overview. Appl.Microbiol. Biotechnol. 70 (1), 21-33 (2006).
- Vasileva-Tonkova, E., Gousterova, A., Neshev, G. Ecologically safe method for improved feather wastes biodegradation. International Biodeterior & Biodegradation. 63 (8), 1008-1012 (2009).
- Lodén, M., Barel, A. O., Paye, M., Maibach, H. I. Hydrating Substance. Handbook of Cosmetic Science and Technology. , 107-119 (2009).
- Teglia, A., Secchi, G., Goddard, E. D., Gruber, J. V. Chapter 9: Proteins in Cosmetics. Principles of Polymer Science and Technology in Cosmetics and Personal Care. , (1999).
- Magdassi, S. Delivery systems in cosmetics. Colloids and Surfaces A: Physicochem. Engin. Aspects. 123-124, 671-679 (1997).
- Dahms, G., Jung, A. Method for producing a protein hydrolysate. U.S. Patent. , (2014).
- Pons, R., Carrera, I., Erra, P., Kunieda, G., Solans, C. Novel preparation methods for highly concentrated water-in-oil emulsions. Colloids and Surfaces A: Physicochem. Engin. Aspects. 91 (3), 259-266 (1994).
- Mokrejs, P., Hrncirik, J., Janacova, D., Svoboda, P. Processing of keratin waste of meat industry. Asian J. Chem. 24 (4), 1489-1494 (2012).
- Mokrejs, P., Svoboda, P., Hrncirik, J. Processing poultry feathers into keratin hydrolysate through alkaline-enzymatic hydrolysis. Waste Manage. Res. 29 (3), 260-267 (2011).
- Mokrejs, P., Krejci, O., Svoboda, P. Producing keratin hydrolysates from sheep wool. Orient. J. Chem. 27 (4), 1303-1309 (2011).
- Mokrejs, P., Krejci, O., Svoboda, P., Vasek, V. Modeling technological conditions for breakdown of waste sheep wool. Rasayan J. Chem. 4 (4), 728-735 (2011).
- Polaskova, J., Pavlackova, J., Vltavska, P., Mokrejs, P., Janis, R. Moisturizing effect of topical cosmetic products applied to dry skin. J. Cosmet. Sci. 64 (5), 329-340 (2013).
- Polaskova, J., Pavlackova, J., Egner, P. Effect of vehicle on the performance of active moisturizing substances. Skin Res. Technol. 21 (4), 403-412 (2015).
- Verdier-Sévrain, S., Bonté, F. Skin hydration: a review on its molecular mechanisms. J. Cosmet. Dermatol. 6 (2), 75-82 (2007).
- Darlenski, R., Sassning, S., Tsankov, N., Fluhr, J. W. Non-invasive in vivo methods for investigation of the skin barrier physical properties. Eur. J. Pharm. Biopharm. 72 (2), 295-303 (2009).
- Berardesca, E. EEMCO guidance for assessment of stratum corneum hydration: electrical methods. Skin Res. Technol. 3 (2), 126-132 (1997).
- Rogiers, V. EEMCO guidance for the assessment of transepidermal water loss in cosmetic sciences. Skin Pharmacol. Appl. Skin Physiol. 14 (2), 117-128 (2001).
- Ali, S. M., Yosipovitch, G. Skin pH: from basic science to basic skin care. Acta Derm. Venereol. 93 (3), 261-267 (2013).
- Agache, P., Humbert, P. . Measuring the Skin. , (2004).
- Council for International Organizations of Medical Sciences. . International Ethical Guidelines for Biomedical Research Involving Human Subjects. , (2002).
- Ruland, J. K. Transdermal permeability and skin accumulation of amino acids. Int. J. Pharm. 72 (2), 149-155 (1991).
- Draelos, Z. D. Therapeutic moisturizers. Dermatol. Clin. 18 (4), 597-607 (2000).
- Courage and Khazaka Electronic GmbH, Technical Charges. . Information and Operating Instructions for the Multi probe Adapter MPA and its Probe. , (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。