Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung der Keratin-Hydrolysat aus Hühnerfedern und ihre Anwendung in der Kosmetik
In diesem Artikel
Zusammenfassung
Das Ziel des Protokolls ist Keratin Hydrolysat aus Hühnerfedern durch alkalische enzymatische Hydrolyse vorzubereiten und zu testen, ob hinzufügen von Keratin-Hydrolysat in einem Kosmetik Salbe Basis verbessert die Barrierefunktion der Haut (Steigerung der Flüssigkeitszufuhr und abnehmenden transepidermalen Wasserverlust). Tests werden durchgeführt auf Männer und Frauen freiwillige.
Zusammenfassung
Keratin Hydrolysate (KHs) sind bewährte Standardkomponenten in Haarkosmetik. Die feuchtigkeitsspendende Wirkung von KH zu verstehen ist vorteilhaft für Hautpflege Kosmetik. Die Ziele des Protokolls sind: (1) Hühnerfedern in KH durch alkalische enzymatische Hydrolyse zu verarbeiten und reinigen durch Dialyse, und (2) zu testen, ob die Zugabe von KH in eine Salbe-Basis (OB) erhöht die Hydratation der Haut und verbessert die Barrierefunktion der Haut durch abnehmende transepidermalen Wasserverlust (TEWL). Bei alkalischen enzymatische Hydrolyse werden Federn zunächst bei einer höheren Temperatur in einer alkalischen Umgebung und dann unter milden Bedingungen, mit proteolytischen Enzym hydrolysiert inkubiert. Die Lösung von KH wird dialysiert, Vakuum getrocknet und zu feinem Pulver gemahlen. Kosmetische Formulierungen von Öl in Wasser-Emulsion (O/W) mit 2 umfasst, sind 4 und 6 Gew.-% des KH (bezogen auf das Gewicht des OBS) bereit. Prüfung der feuchtigkeitsspendenden Eigenschaften von KH erfolgt auf 10 Männer und 10 Frauen in zeitlichen Intervallen von 1, 2, 3, 4, 24 und 48 h. geprüfte Formulierungen sind an entfettet volar Unterarm Standorten verteilt. Die Hautfeuchte des Stratum corneums (SC) wird durch die Messung der Kapazität der Haut, die gehört zu den weltweit am meisten verwendeten und einfachen Methoden beurteilt. TEWL basiert auf der Messung der Wassermenge pro einen abgegrenzten Gebiet und Zeitraum hinweg von der Haut transportiert. Beide Methoden sind völlig nicht-invasiv. KH sorgt für eine ausgezeichnete Verschlusskrankheit; Je nach der Zugabe von KH in OB bewirkt es eine 30 % Rückgang der TEWL nach Anwendung. KH fungiert auch als ein Feuchthaltemittel wie sie Wasser aus den unteren Schichten der Epidermis an den SC bindet; an die optimale KH-Ergänzung in der OB tritt bis zu 19 % Anstieg der Hydratation bei Männern und 22 % Anstieg der Frauen.
Einleitung
Schlachthöfe, die Lebensmittelindustrie und die Gerbereien produzieren jährlich immense Mengen an festen Keratin Nebenprodukte – Wolle, Federn, Borsten, Klauen, Krallen, Hörner und dergleichen. Nach neuesten statistischen Daten ist die totale Lebendgewicht von Hühner, Puten, Enten und andere geschlachtetem Geflügel in den USA 62,5 Milliarden Pfund pro Jahr1; in der EU ist es ca. 28,7 Milliarden Pfund pro Jahr. Wenn man bedenkt, dass Federn bis zu 8,5 % der gesamten Geflügel Gewicht machen, produziert allein die USA jährlich ca. 5,3 Milliarden Pfund Abfall Federn2.
Keratin ist ein Protein, hohe Chemikalienbeständigkeit ausstellen, weil es stark vernetzt mit Disulfidbrücken, die die Verarbeitung erschweren. Erhalt der lösliche Produkte erfordert Spaltung Querverbindungen und ggf. Durchführung von Hydrolyse der Peptidbindungen3. Spaltung der Disulfidbrücken kann durch eine Reaktion des Thiol-Anions nach dem folgenden Muster4,5gehen Sie vor:
Sein– + – SbSc– ↔ – Sb– + S –einSc–
Mit einem sehr hohen pH-Wert Hydrolyse der Disulfidbrücken wird auch angezeigt, nach dem Muster6
– SS– + → OH– –– S + – SOH
Unter milden Bedingungen (pH-Wert ca. 8) findet auch Sulfitolysis nach dem folgenden Muster:
– SS – + HSO3– → – SH + SSO –3–
Die wirtschaftlichste Art der erniedrigende Keratin ist mikrobiellen Abbau, charakterisiert durch milden Reaktionsbedingungen während der Verarbeitung und hohe Aufschlüsselung Wirkungsgrad (ca. 90 %)7,8. Keratinases werden von einigen Bakterien isoliert vom Boden und Keratin Abfall9produziert. Mikrobielle Keratinases Hydrolyseneigung starr und stark vernetzten Keratin Strukturen10 und die daraus resultierenden KH vorbereitet ist reich an löslichen Proteine, ohne Verlust an essentiellen Aminosäuren, die in ihm erkannt11.
Um ein Protein in kosmetischen Präparaten (z.B., Emulsionen, Lotionen und Gele) zu integrieren, damit die Anforderungen solcher Proteine sind in Wasser löslich, gegebenen Systeme sind transparent, und dieser Re-Aggregation der Peptide wird vermieden, durch hydrophobe Interaktionen. Daher ist eine gängige Praxis, Hydrolysate von Proteinen, wie hydrolysiertes Kollagen, Elastin und Keratin anzuwenden. Beim Hinzufügen von Hydrolysate in kosmetischen Emulsionen werden Maßnahmen ergriffen, um sicherzustellen, dass das Hydrolysat zunächst in Wasser aufgelöst wird. In einigen Fällen ist es wünschenswert, dass das Protein (oder das Hydrolysat) löslich in Alkohol oder anderen organischen Lösungsmitteln12.
KH wird normalerweise in Shampoos, Spülungen, Lotionen und nährende Seren für Haar, ebenso wie Mascara, Nagellack und Augen-Make-up-Agenten vorgestellt. Die KH-Effekte erklärt in der Regel gehören, bilden einen schützenden Film, glätten das Haar oder Nagel-Struktur, erhöhte Plastizität und das Aussehen der behandelten Formation, regulieren die Konsistenz der Produkte, und fördern die Bildung von Schaum13 , 14. es hat auch gezeigt, dass KH reduziert Oberflächenspannung, daher Supplementierung in Kosmetika kann erleichtern, Herabsetzung Emulgator hinzugefügt, um Cremes zu stabilisieren. KH Begrenzung der Auswirkungen der Irritation ausgelöst durch Reinigungsmittel (Tenside), Haut, Augen und Haare, wodurch mögliche Nebenwirkungen von Reinigungsmitteln auf Gewebe (z.B., Austrocknung der Haut, Härte und verminderte Barrierefunktion die Haut). Die hohe Leistungsfähigkeit der Pufferung der Hydrolysate wird auch genutzt, um den pH-Wert von Kosmetika zu stabilisieren; Peptide mit kürzeren Länge haben eine größere Pufferung Wirkung15,16. Obwohl KHs in Haar und Nagel Kosmetik sowie Produkte für die Hautpflege verwendet wird als standard-Komponenten etabliert haben, erscheinen die Studien über die feuchtigkeitsspendende Wirkung von KH nicht in der zeitgenössischen Literatur.
Alkaline-enzymatische Technologie zur Verarbeitung von Keratin Nebenprodukte zu KH entwickelt wurde, und aktive Prüfung ist im Prozess über die Auswirkungen einer Reihe von kosmetischen Zusatzstoffe17,18,19,20 , 21 , 22. der Vorteil der zweistufigen alkalischen enzymatische Hydrolyse mit mikrobiellen Proteasen für Hühnerfedern erreicht eine hohe Effizienz unter milden Reaktionsbedingungen und die Qualität der KH ist sehr hoch im Gegensatz zur Hydrolyse in starke Säuren eingesetzt oder Alkalien. In der ersten Stufe werden Federn bei einer höheren Temperatur in einer alkalischen Umgebung inkubiert, die teilweise stört die Keratin-Struktur und schwillt die Federn; nach Einstellen des pH-Werts, sind die Federn in der zweiten Stufe mit einem proteolytischen Enzym unter milden Bedingungen hydrolysiert. Die dialysierten KH besitzt einen hohen Gehalt an Proteinen.
Im Sinne des hier beschriebenen Verfahrens sind Verarbeitung Geflügelfedern in einem KH durch alkalische enzymatische Hydrolyse und testen die Wirkung der feuchtigkeitsspendenden Eigenschaften von KH auf kosmetische O/W-Emulsion aufgetragen. Die feuchtigkeitsspendenden Eigenschaften werden durch instrumentale nicht-invasive Methoden in Vivountersucht. Die häufigsten Methoden zur Messung der Haut Feuchtigkeit und Barriere Funktion des SC gehören Messung der elektrische Eigenschaften der Haut (Leitwert oder Kapazität). Verschiedene Methoden für die Untersuchung von SC Flüssigkeitszufuhr gehören in der Nähe von Infrarot-multispektralen phantasierende Methode (NIM), magnetischen Kernresonanz-Spektroskopie, optische Kohärenztomographie oder vorübergehende Thermo-Transfer-23. Barrierefunktion der SC korreliert mit der TEWL SC und es wird gemessen, indem die belüfteten Kammer Methode, unbelüfteten Kammer Methode und offene Kammer Methode24.
Eigenschaften der Modell Formulierungen werden bestimmt mit dem Multi-Sonde-Adapter 5 MPA mit drei Arten von Sonden. Die ersten ein, Corneometer CM 825 Haut Maßnahmen Hydratation durch die Beurteilung von Veränderungen in der elektrischen Leistung von der Oberfläche der Haut; der messende Kondensator zeigt Veränderungen in der Kapazität von der Hautoberfläche in Corneometrische Einheiten. Die Corneometer bietet nur eine relative Bewertung der Haut Feuchtigkeit25. Für TEWL die zweite Sonde Tewameter TM 300, dient zur Messung der Dichtegradient der Wasserverdunstung (in offene Kammer Instrument auf der Grundlage Fick'schens Diffusion rechts) von der Haut indirekt durch die beiden Paare von Sensoren (Temperatur und Relative Luftfeuchtigkeit) zeigt die Menge an Wasser pro einem abgegrenzten Gebiet und Zeitraum (g/m2/h) transportiert werden. Diese Methode kann sogar die geringste Störung der Haut-Barriere-Funktion-26erkennen. Haut-pH ist ein Indikator für die Schranke und Anti-mikrobielle Funktion der SC27. Der Säuregehalt der Haut-Mantel wurde durch eine (dritte) Haut PH 905-Sonde angeschlossen an die MPA 5 Station gemessen. Diese speziell entwickelte Sonde besteht aus abgeflachten Glaselektrode für volle Hautkontakt an ein Voltmeter angeschlossen. Das System misst mögliche Veränderungen aufgrund der Aktivität von Wasserstoff-Kationen, die rund um die sehr dünne Schicht halbfeste Formen an der Spitze der Sonde gemessen. Die Änderungen in der Spannung werden als pH28angezeigt.
Wir präsentieren Ihnen Experimente, die in drei Abschnitte unterteilt: (1) Vorbereitung der KH aus Huhn Federn von zweistufigen alkalischen enzymatische Hydrolyse und dessen Reinigung durch Dialyse (Entfernen von Salzen und niedermolekularen Fraktionen), (2) Vorbereitung von kosmetischen Formulierungen mit 2, 4 und 6 % KH, (3) Prüfung der Eigenschaften von KH durch Messung der Haut Hydratation, TEWL, und pH-Wert der Haut. Getestet wurde auf 10 Frauen mit dem Durchschnittsalter von 27,2 Jahre und 10 Männer mit dem Durchschnittsalter von 26,2 Jahre durchgeführt. Die Methode zur Auswahl der Freiwilligen und der Prüfung selbst wurden im Einklang mit internationalen ethischer Prinzipien der Bio-medizinischen Forschung mit menschlichen Probanden29; alle Personen gaben ihre Einwilligung vor Aufnahme in die Studie. Vor der Prüfung begann, waren die Freiwilligen gebeten, einen Fragebogen über ihren Gesundheitszustand auszufüllen. Die Freiwilligen verpflichtet, vermeiden die Anwendung jedes kosmetische Produkts der Teststellen und umliegenden Regionen während der 24 h vor und während der Testphase; Außerdem durften sie nur kurze Abend wäscht mit fließendem Wasser.
Protokoll
Freiwillige wurden unter den Mitarbeitern und Studierenden unserer Universität rekrutiert. Die Methode der Auswahl erfolgte nach "internationale ethische Richtlinien für biomedizinische Forschung Einbeziehung menschlichen Probanden. Rat für internationale Organisationen der medizinischen Wissenschaften, Genf (2002)." KH ist eine häufige kosmetischen Zutat in Haarpflege Produkten (Shampoos, Conditioner, etc.) verwendet und Genehmigung der institutionellen Review Board ist daher nicht erforderlich.
1. Prozess Hühnerfedern in KH
- Sammeln Sie Hühnerfedern aus einer Geflügelfarm.
- Alle unlösliche Verunreinigungen und Blut Reste aus Hühnerfedern mit einem ausreichenden Überschuß laufen (kalte) Wasser auswaschen. Die Federn auf einem flachen Teller legen und über Nacht trocknen bei 50 ° C.
Hinweis: Das Protokoll kann hier angehalten werden. - 50 g getrocknete Federn in einer Schneidmühle (geeignet für weiche bis mittelharte Probenmaterialien und Faserstoffe) in eine Endfeinheit von 1,0 mm. Alternativ zu mahlen, die Endfeinheit geschliffene Federn kann höher, aber nicht mehr als 3,0 mm.
Hinweis: Das Protokoll kann hier angehalten werden. -
Entfetten Sie Federn
Hinweis: Die effektive und wirtschaftliche Methode der Entfettung Geflügel Feder nutzt eine kommerzielle lipolytische Enzym.- Mischen Sie in einer 27-L-Kessel Behälter aus Edelstahl mit Temperaturregelung die Federn mit Wasser vorgewärmt bis zu 40 ± 2 ° C in einem Gewicht-Verhältnis 1: 75. Fügen Sie eine lipolytische Enzym (Aktivität 100 KLU/g) in einer Dosis von 1,5-2,0 % (bezogen auf wog-in trockenen Federn) und sanft rühren Sie den Inhalt mit einem obenliegenden Rührer für 5 min.
- Passen Sie die Mischung pH 9,0 ± 0,2, den Wert der maximalen Aktivität des Enzyms lipolytische durch Zugabe von 1 % NaOH oder 1 % H3PO4 Lösung entsprechend an. Rühren Sie die Mischung für 5 min mit einem obenliegenden Rührer und dann überprüfen Sie und neu stellen Sie des pH-Wertes mit einem Labor Bank pH/mV-Meter ein.
- Rühren Sie die Mischung vorsichtig mit einer obenliegenden Rührer für 24 h bei 40 ± 0,5 ° C. Alternativ inkubieren Sie die Mischung bei 40 ± 0,5 ° C und während den ersten 6 h Inkubation rühren Sie den Inhalt in Abständen von 1 h.
- Filtern Sie die Mischung durch ein feines Sieb (100 µm Größe) und waschen Sie die entfettete Federn mit einem Strom von frischem ausgeführt (kalte) Wasser zu. Trocknen Sie die Federn auf einem flachen Teller bei 50 ° C in einer Trockenkammer über Nacht.
Hinweis: Das Protokoll kann hier angehalten werden.
- Führen Sie die erste Stufe der Huhn Feder Hydrolyse. Mischen Sie die Federn mit 0,3 % KOH-Wasser-Lösung ein Gewicht Verhältnis 01:50 und rühren Sie leicht mit einem obenliegenden Rührer auf 60 ± 0,5 ° C für 24 h. Der pH-Wert des Gemischs sinkt auf ca. 11,0 am Ende der Inkubationszeit von ca. 12,5 zu Beginn der Inkubation. Nach Abschluss der ersten Phase der Hydrolyse, stellen Sie den pH-Wert der Mischung auf die Ebene entsprechend der maximalen Aktivität der proteolytischen Enzyms mit 10 % H3PO4 (in diesem Fall auf ein Niveau von 9,0 ± 0,2) durch Zugabe von 1 % NaOH.
- Führen Sie die zweite Stufe der Huhn Feder Hydrolyse. Fügen Sie die Mischung, die proteolytischen Enzym in einer Dosis von 5,0 % (bezogen auf Trockenmasse Menge Federn wog-in zu Beginn der ersten Stufe der Hydrolyse). Vorsichtig umrühren mit einem obenliegenden Rührer auf 60 ± 0,5 ° C für 8 h und dann erhitzen Sie die Mischung (in den gleichen Behälter aus Edelstahl 27-L-Boiler) um einen Siedepunkt (100 ° C) und kochen für 10 min, das Enzym zu inaktivieren.
- Die Lösung von KH (in Schritt 1.6 vorbereitet) von der ungelösten Rest zu trennen, Filtern sie durch Low-Density Filterpapier auf ein Buchner-Trichter mit leichtem Vakuum-Druck; Alternativ können Sie eine Zentrifuge.
Hinweis: Das Protokoll kann angehalten werden hier für mehrere Tage ist eine Lösung von KH bei 5 gespeichert ± 1 ° C. - In der Kunststoff-Eimer (26 cm Durchmesser 26 cm Höhe) Dialyse der KH mit 12 K MWCO Membran um kleine Peptide und Salze zu entfernen. Dialyse-Schläuche 400 mL der Lösung KH gießen und gegen 4 L destilliertes Wasser für 80 h bei Raumtemperatur Dialyse; ändern Sie das destillierte Wasser nach 18, 36 und 60 h.
- Werfen Sie eine dialysierter Lösung von KH auf eine Anti-Haft-Teller (z.B. Silikon) auf ein Verhältnis von 500 mL bis 1.000 cm2 Teller-Gebiet, Vakuum trocken auf einen dünnen Film auf 40 ± 0,5 ° C über Nacht, zu einem feinen Pulver zermahlen und halten Sie es in einem geschlossenen Gefäß in den Exsikkator gestellt.
Hinweis: Das Protokoll kann hier für mehrere Monate angehalten werden, wenn das KH-Pulver an einem trockenen Ort aufbewahrt wird.
2. bereiten Sie kosmetische Formulierungen mit KH
Hinweis: OB zum Testen verwendet wurde eine kommerzielle hydrophilen O/W-Creme-Basis und bestehend aus Aqua, Paraffin, Paraffin flüssig, Cetearylalkohol Alkohol, Laureth-4, Natriumhydroxid, Carbomer, Methylparaben und Propylparaben.
- Bereiten Sie Formulierungen mit 2, 4 und 6 % KH (in Übereinstimmung mit der Basis Gewicht der Salbe). Wiegen Sie die Menge von KH Pulver in einen Behälter aus Polyethylen (7 cm Durchmesser X 10 cm Höhe) und fügen Sie der OB auf einen Betrag, der das Gesamtgewicht der Formulierung sorgt für 50 g entspricht; Siehe Rezept in Tabelle 1.
| Kosmetischen Formulierung | Gewicht der Basis Salbe [g] | Gewicht des Keratin Hydrolysat [g] | Gewicht [g] | |||||
| Salbe Basis | 50 | 0 | 50 | |||||
| Salbe Basis + 2 % KH | 49 | 1 | ||||||
| Salbe Basis + 4 % KH | 48 | 2 | ||||||
| Salbe Basis + 6 % KH | 47 | 3 | ||||||
Tabelle 1: Gewicht-in Mengen von Salbe Basis und Keratin Hydrolysat kosmetische Formulierungen vorzubereiten.
- Die Mischung mit einem 3-Blatt Labor-Mixer für 10 min bei 134.16 x g zu homogenisieren und mischen mit obenliegenden mechanische Rührer. Pflegen Sie die vorbereitete Formulierungen bei 5 ± 1 ° C und wärmen Sie sie bei Raumtemperatur für 2 Stunden vor Gebrauch.
Hinweis: Die Mischung aus OB mit KH Homogenisieren kann mit Rührer sowie nicht-digitale erfolgen. Auf eine nicht-digitale Rührer gibt es auch Waagen mit die ungefähre Geschwindigkeit (in u/min). Schonenden rühren funktioniert am besten für diesen Schritt.
Hinweis: Das Protokoll kann angehalten werden hier bis zu 5 Monate wenn die Formulierungen, bei 5 gespeichert sind ± 1 ° C.
3. Testen Sie die Eigenschaften des KH durch Messung der Hautfeuchte, TEWL und pH
Hinweis: Führen Sie alle Messungen in einem klimatisierten Raum bei 23 ± 2 ° C und die Relative Luftfeuchtigkeit von 56 ± 3 %.
- Platz 5 Streifen Filterpapier (Größe 2 x 4 cm) in die physiologische Lösung (0,90 % NaCl) und lassen Sie sie für ca. 1 min in der Lösung.
- Zwei Streifen auf der Innenseite des rechten Unterarm und drei an der Innenseite des linken Unterarms anwenden, und für 4 h mit selbstklebenden Pflaster fixieren. Dieser Schritt ist die Haut entfetten und individuelle Eigenschaften der Haut an der Stelle beseitigen. Entfernen Sie nach 4 h die Streifen und die Bereiche mit einem permanenten Stift demarkieren, siehe Abbildung 1.
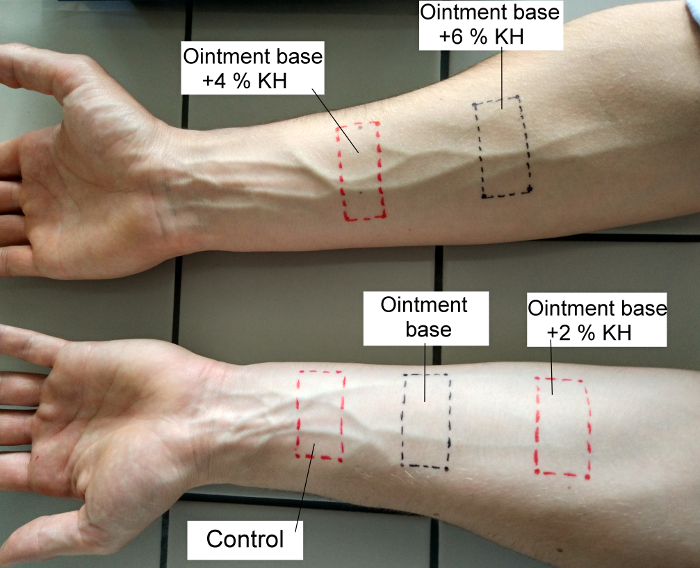
Abbildung 1: Verfahren zur Lage des Test-Formulierungen auf dem Unterarm der linken und rechten oberen Gliedmaßen. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Aufzutragen Sie 0,1 mL der geprüften Formulierungen an jeder Stelle der entfettet Unterarm Websites mit Spritzen und zu verteilen Sie es über die gesamte markierte Fläche. Am linken Unterarm, nicht alles auf die erste Seite (es ist das Steuerelement) anwenden, gelten der OB auf die zweite Seite, und der OB + 2 % KH, die dritte. Anwenden der OB + 4 % KH und OB + 6 % KH am rechten Arm.
- Jede Probe an jedem Standort und jedem Intervall (1, 2, 3, 4, 24 und 48 Stunden) zu messen und die Haut Hydratation Meter Sonde für die Hautfeuchte, 15 Lesungen mit der TEWL Meter Sonde für Haut TEWL und lesen mit den Haut-pH-Meter-Sonde für Haut pH 1 5 Lesungen mitnehmen. Lassen Sie Freiwillige, die jedes kosmetische Produkt für die Teststellen und Umgebung während der Testphase gelten nicht zu; Sie dürfen kurze Abend wäscht mit fließendem Wasser.
Hinweis: Das Protokoll kann hier angehalten werden. - Verarbeitet werden die sich daraus ergebenden Messwerte von grundlegenden numerischen Eigenschaften der deskriptiven Statistik, Tabellenkalkulations-Software verwenden. Aus den 5 Hydratation Lesungen für jede Probe gemessen die niedrigsten und die höchsten Messwerte zu ignorieren und nur 3 Lesungen für den arithmetischen Mittelwert und Standardabweichung zu berechnen. Ignorieren Sie aus den 15 TEWL Lesungen für jede Probe gemessen die ersten 5, und berechnen Sie nur 10 Messungen für arithmetische Mittelwert und die Standardabweichung zu.
Ergebnisse
Die KH nach den hier vorgestellten Verfahren zubereitet (siehe Abbildung 2) ist gelb in der Farbe, leicht löslich in Wasser mit hohem Proteingehalt (anorganische Feststoffe repräsentieren < 2,0 %); der pH-Wert der Lösung 1,0 % der KH ist 5.3 und erfüllt die Anforderungen für Kosmetik-Grade Hydrolysate. Die Ausbeute an KH von 50 g Rohstoff liegt bei ca. 30 %. Die Molekulargewichtsverteilung von KH wurde durch SDS-PAGE bestimmt und ist in
Diskussion
Der Vorteil der alkalischen enzymatische Hydrolyse ist, dass sie nach zukünftige Anwendungen von KH geändert werden kann. Zum Beispiel in Haarpflege Kosmetik Anwendungen, bei denen eine leicht bräunliche Farbe eines Produktes kein Hindernis, eine höhere Temperatur in der Hydrolyse einsetzbar führt zu einer höheren Ausbeute von KH. Darüber hinaus die längere Bearbeitungszeit in beiden Phasen des technologischen Verfahrens erheblich beeinträchtigt den Gesamtprozess Effizienz – Ausbeute an KH steigt auf 85 %.
...Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Dieser Artikel wurde mit Unterstützung des Projekts IGA/FT/2017/007 der Tomas Bata Universität Zlin geschrieben.
Materialien
| Name | Company | Catalog Number | Comments |
| Material or chemicals | |||
| LIPEX 100T | Novozymes | LJP30020 | Lipex - enzyme produced by submerged fermentation of a genetically-modified microorganism, activity 100 KLU/g |
| Savinase Ultra 16L | Novozymes | PXN40001 | Savinase - enzyme produced by submerged fermentation of a genetically-modified microorganism, activity 16 KNPU-S/g |
| Potassium hydroxide, KOH | Sigma-Aldrich | 302510289 | Potassium hydroxide, KOH, 97,0 %, Mr 56,11 |
| Phosphoric acid solution, H3PO4 | Sigma-Aldrich | W290017 | Phosphoric acid solution, H3PO4, 85 wt. % concentration in water, Mr 98,00 |
| Sodium chloride physiological solution | Sigma-Aldrich | 52455 | Tablets of BioUltra NaCl physiological solution; 1 tablet in 1000 mL of water yields 0.9 % NaCl |
| Sodium hydroxide, NaOH | Penta s.r.o. | 40216 | Sodium hydroxide, NaOH, 97,0 %, Mr 40,00 |
| AmiFarm (Cremor base-A) | Fagron | 608425 | Hydrophilic oil in water (O/W) cream base; the composition: aqua, paraffin, paraffin liquid, cetearyl alkohol, Laureth 4, sodium hydroxide, carbomer, methylparaben, propylparaben. |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| IKA EUROSTAR POWER control-visc stirrers | IKA-labortechnik | Z404020 | Digital laboratory stirrer, for tasks up to the high viscosity range, 230V, 1/cs |
| IKA Propeller stirrer, 3-bladed | IKA-labortechnik | R 1381 | Propeller stirrer, 3-bladed, stirrer Ø: 45 mm, shaft Ø: 8 mm, shaft length: 350 mm |
| Dialysis tubing closures | Sigma-Aldrich | Z371017-10EA | Dialysis tubing closures, red, size 110 mm |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9402-100FT | Dialysis tubing cellulose membrane, average flat width 76 mm (3.0 in.) |
| DOMO Pot with stailess, LCD | DOMO Elektronic | DO42325PC | Preserving boiler stainless steel, 2000 W, 27-L container (diameter 37 cm, height 30 cm), temperature control 30-100 ° C, operation LCD display |
| Hettich zentrifugen Universal 32 | Gemini bv | 2770 GS1R | Mid bench centrifuge, speed 18000 rpm |
| LT 3 shaking device | Fischer Scientific | 6470.0002 | Orbital shaking device |
| KERN 440-47N | Kern | 440-47N | Laboratory balance |
| KERN 770 | Kern | 770 -N | Laboratory analytical balance |
| VENTICELL 222 - Komfort | BMT, MMM Group | C 131749 | Drying oven, temperature control 30-100 ° C, air circulation control |
| Vacucell 55 - EVO | BMT, MMM Group | B 050328 | Vacuum drying oven, temperature control 30-100 ° C |
| PULVERISETTE 19 | Fritsch | 19.1030.00 | Universal cutting mill, rotor with V-cutting edges and fixed knives |
| Multi Probe Adapter System MPA 5 | Courage & Kazaka Electronic | 10225237 | MPA 5 Station - equipment for measurement hydratation, TEWL and pH |
| Skin pH-meter PH 905 probe | Courage & Kazaka Electronic | Probe to specifically measure the pH on the skin surface or the scalp | |
| Corneometer CM 825 probe | Courage & Kazaka Electronic | Probe to determine the hydration level of the skin surface (Stratum corneum). | |
| Tewameter TM 300 | Courage & Kazaka Electronic | Probe for the assessment of the transepidermal water loss (TEWL) | |
| Heidolph RZR 2020 | Heidolph | 13-225-007-03-1 | Overhead stirrer, mechanical speed setting and stepless transmission; speed range 40-2000 rpm |
| Heidolph mechanical stirrer BR 10 | Heidolph | Z336688-1EA | Blade impeller crossed stirrer |
| Fagor FS 12 | Fagor | BTT-138 | Laboratory refrigerator with freezer space |
| WTW bench pH/mV meter | WTW | Z313165 | High-performance bench pH and pH/conductivity meters for routine and high precision laboratory measurements in research or quality control laboratories |
| Container | RPC Superfos | 13-L plastic bucket, diameter 26 cm, height 26 cm | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Microsoft Office 2010 | Microsoft | ||
| C+K software | Courage and Khazaka Electronic GmbH | MPA 5 station operating software |
Referenzen
- United States Department of Agriculture - National Agricultural Statistics Services. . Poultry Slaughter, 2016 Summary. , (2016).
- McGovern, V. Recycling poultry feathers: more bang for the cluck. Environ.Health Perspect. 108 (8), A336-A339 (2000).
- Gousterova, A., et al. Degradation of keratin and collagen containing wastes by newly isolated thermoactinomycetes or by alkaline hydrolysis. Lett. Appl. Microbiol. 40 (5), 335-340 (2005).
- Yamauchi, K., Yamauchi, A., Kusunoki, T., Khoda, A., Konishi, Y. Preparation of stable aqueous solution of keratins, and physiochemical and biodegradational properties of films. Biomed. Mater. Res. 31 (4), 439-444 (1996).
- Schrooyen, P. M. M., Dijkstra, P. J., Oberthur, R. C., Bantjes, A., Feijen, J. Partially carboxymethylated feather keratins. 2. Thermal and mechanical properties of films. J. Agric. Food Chem. 49 (1), 221-230 (2001).
- Mark, H. F., Gaylord, N. G., Bikales, N. M. . Encyclopedia of Polymer Science Technology: vol. 8: Keratin to Modacrylic Fibers. , (1968).
- Bertsch, A., Cello, N. A biotechnological process for treatment and recycling poultry feathers as a feed ingredient. Bioresour. Technol. 96 (15), 1703-1708 (2005).
- Grazziotin, A., Pimentel, F. A., de Jong, E. V., Brandelli, A. Nutritional improvement of feather protein by treatment with microbial keratinase. Animal Feed Sci. Technol. 126 (1-2), 135-144 (2006).
- Brandelli, A. Bacterial keratinases: useful enzymes for bioprocessing agroindustrial wastes and beyond. Food Bioprocess Technol. 1 (2), 105-116 (2008).
- Gusta, R., Ramnani, P. Microbial keratinases and their prospective applications: an overview. Appl.Microbiol. Biotechnol. 70 (1), 21-33 (2006).
- Vasileva-Tonkova, E., Gousterova, A., Neshev, G. Ecologically safe method for improved feather wastes biodegradation. International Biodeterior & Biodegradation. 63 (8), 1008-1012 (2009).
- Lodén, M., Barel, A. O., Paye, M., Maibach, H. I. Hydrating Substance. Handbook of Cosmetic Science and Technology. , 107-119 (2009).
- Teglia, A., Secchi, G., Goddard, E. D., Gruber, J. V. Chapter 9: Proteins in Cosmetics. Principles of Polymer Science and Technology in Cosmetics and Personal Care. , (1999).
- Magdassi, S. Delivery systems in cosmetics. Colloids and Surfaces A: Physicochem. Engin. Aspects. 123-124, 671-679 (1997).
- Dahms, G., Jung, A. Method for producing a protein hydrolysate. U.S. Patent. , (2014).
- Pons, R., Carrera, I., Erra, P., Kunieda, G., Solans, C. Novel preparation methods for highly concentrated water-in-oil emulsions. Colloids and Surfaces A: Physicochem. Engin. Aspects. 91 (3), 259-266 (1994).
- Mokrejs, P., Hrncirik, J., Janacova, D., Svoboda, P. Processing of keratin waste of meat industry. Asian J. Chem. 24 (4), 1489-1494 (2012).
- Mokrejs, P., Svoboda, P., Hrncirik, J. Processing poultry feathers into keratin hydrolysate through alkaline-enzymatic hydrolysis. Waste Manage. Res. 29 (3), 260-267 (2011).
- Mokrejs, P., Krejci, O., Svoboda, P. Producing keratin hydrolysates from sheep wool. Orient. J. Chem. 27 (4), 1303-1309 (2011).
- Mokrejs, P., Krejci, O., Svoboda, P., Vasek, V. Modeling technological conditions for breakdown of waste sheep wool. Rasayan J. Chem. 4 (4), 728-735 (2011).
- Polaskova, J., Pavlackova, J., Vltavska, P., Mokrejs, P., Janis, R. Moisturizing effect of topical cosmetic products applied to dry skin. J. Cosmet. Sci. 64 (5), 329-340 (2013).
- Polaskova, J., Pavlackova, J., Egner, P. Effect of vehicle on the performance of active moisturizing substances. Skin Res. Technol. 21 (4), 403-412 (2015).
- Verdier-Sévrain, S., Bonté, F. Skin hydration: a review on its molecular mechanisms. J. Cosmet. Dermatol. 6 (2), 75-82 (2007).
- Darlenski, R., Sassning, S., Tsankov, N., Fluhr, J. W. Non-invasive in vivo methods for investigation of the skin barrier physical properties. Eur. J. Pharm. Biopharm. 72 (2), 295-303 (2009).
- Berardesca, E. EEMCO guidance for assessment of stratum corneum hydration: electrical methods. Skin Res. Technol. 3 (2), 126-132 (1997).
- Rogiers, V. EEMCO guidance for the assessment of transepidermal water loss in cosmetic sciences. Skin Pharmacol. Appl. Skin Physiol. 14 (2), 117-128 (2001).
- Ali, S. M., Yosipovitch, G. Skin pH: from basic science to basic skin care. Acta Derm. Venereol. 93 (3), 261-267 (2013).
- Agache, P., Humbert, P. . Measuring the Skin. , (2004).
- Council for International Organizations of Medical Sciences. . International Ethical Guidelines for Biomedical Research Involving Human Subjects. , (2002).
- Ruland, J. K. Transdermal permeability and skin accumulation of amino acids. Int. J. Pharm. 72 (2), 149-155 (1991).
- Draelos, Z. D. Therapeutic moisturizers. Dermatol. Clin. 18 (4), 597-607 (2000).
- Courage and Khazaka Electronic GmbH, Technical Charges. . Information and Operating Instructions for the Multi probe Adapter MPA and its Probe. , (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten