需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
扁平哺乳动物皮层皮质模块的可视化研究
摘要
本文介绍了一个详细的方法, 以获得从哺乳动物皮层扁平切切面和可视化皮层模块使用组织化学和免疫组织化学方法。
摘要
哺乳动物大脑的皮质被 parcellated 成不同的子结构或模块。皮质模块通常与皮质板平行, 可以用某些组织化学和免疫组织化学方法来描述。在这项研究中, 我们突出了一种方法, 分离的皮层从哺乳动物的大脑, 并铺平他们获得的部分平行的皮质板。我们进一步强调选定的组织化学和免疫组织化学方法, 以处理这些扁平切切面, 以可视化皮层模块。在各种哺乳动物的体感皮层, 我们执行细胞色素氧化酶组织化学, 以揭示身体的地图或皮层模块代表动物身体的不同部位。在嗅皮层中, 我们利用免疫组织化学方法来突出细胞, 在皮层片中排列成一个网格模式, 在多个物种中形成一个晶格单元。总的来说, 我们提供了一个框架, 以隔离和准备层明智的扁平皮层切片, 并可视化皮质模块使用组织化学和免疫组化方法在哺乳动物的大脑广泛。
引言
在脑皮质中, 可以观察到脑组织在系统发展史上最显著的变化。尽管有很大的差异, 动物的皮层遵循一个共同的模式, 可以大致分为两种不同的方式, 由层和区域1。皮质层与大脑的表面平行, 在爬行动物皮层的3层中有不同的数量,2到哺乳动物皮层的6层, 即1。另一方面, 皮质区是皮层的不同区域, 主要对应于不同的功能,例如, 体感皮层参与触觉的感觉或视觉输入过程中的视皮层。这些皮质区通常可以细分为补丁或模块3, 这是定期重复解剖结构, 基本上发现平行于大脑的脑膜表面。皮质模块可以被限制在一个特定的层4, 或者延伸到多个层5。
大脑的标准切片方法涉及大脑表面正常的部分, 如冠状或矢状。虽然这些方法可以用来可视化皮层模块, 许多有趣的功能可以揭示, 当皮质模块的可视化, 在一个平面平行的大脑表面。例如, 在啮齿动物大脑中代表胡须的体感模组, 在大脑表面正常的情况下显示为桶, 因此区域会产生名称桶皮层。然而, 在以切线方向对桶进行可视化时, 它们揭示了一个晶须图, 其中的桶被布置在一个地形方向上, 反映了外部体表的晶须的精确布局。在某些情况下, 当以非切线的方式进行可视化时, 模块式排列甚至有相当长的时间逃脱检测。内侧嗅皮层, 是已知的存在的网格细胞, 神经元在正常的六边形模式时, 动物正在穿越环境。尽管这是一个研究范围很大的区域, 直到最近, 在内侧嗅皮层中存在的补丁或单元模块, 它们在六角形图案6中被物理地布置, 却逃过了检测。这些模块的存在和安排, 在大鼠大脑中, 通过制作内侧嗅皮层的切线部分, 并以一层聪明的方式调查细胞。
在切片之后, 皮层模块可视化的特定方面也可以通过多种方式实现。典型地, 研究根据细胞密度或纤维布局1划定了模块。另一个流行的方法是使用细胞色素氧化酶组织化学, 这揭示了更高的活动领域8。新的方法包括寻找基因上确定的细胞类型, 根据他们的蛋白质表达谱6,8进行区分。
在这项研究中, 我们强调的方法, 以分离的皮层从哺乳动物的大脑, 获得扁平切切面, 并可视化皮层模块的细胞色素氧化酶组织化学和免疫组化的特定蛋白。
研究方案
所有的实验程序都是按照德国在地方伦理委员会 (LaGeSo) 监督下的动物福利准则进行的。人和蝙蝠脑数据来自瑙曼et al.5对雄性成年大鼠 (菌株: RJHan: WI) 执行以下步骤。
1. 灌注和脑部提取
注: 为了获得一个 homogenously 固定和无血脑, transcardial 灌注的动物是高度鼓励, 因为残血增加不背景信号在染色。然而, 也可以从非灌注标本中获得扁平切片, 并对其进行染色。处理试样的容易程度随所用固定剂浓度的不同而变化。太少的固定增加了在扁平化和切割过程中处理大脑损伤的风险, 而过高的浓度则降低了拼合的灵活性和染色信号的质量。
- Transcardially 用23G 针灌注动物。有关更详细的指南, 请参阅量具et al.9
- 使用磷酸盐缓冲盐水10 (PBS; 0.02 米; pH 值 7.4) 从动物的大脑和身体中冲洗出血液。继续, 直到输液液体显示清楚, 至少150毫升 PBS 通过血管系统注入。
注: 最佳的结果是达到的压力类似的生理血压的动物被灌流 (如, 鼠: 120-130 柱)。(可选) 将肝素 (10 U/毫升) 添加到溶液中, 以避免凝血11。 - 为了修复大脑, transcardially 注入了至少100毫升甲醛12 (粉煤灰, 4%; 在0.1 米磷酸盐缓冲 (PB)13), 直到动物的颈部僵硬。
注意: 粉煤灰是一种潜在的致癌物质。
注: 当使用2% 的粉煤灰时, 获得了组织化学活性染色的最佳结果, 如细胞色素氧化酶。其他染色, 如免疫组织化学, 4% 粉煤灰是首选。
- 使用磷酸盐缓冲盐水10 (PBS; 0.02 米; pH 值 7.4) 从动物的大脑和身体中冲洗出血液。继续, 直到输液液体显示清楚, 至少150毫升 PBS 通过血管系统注入。
- 从头骨中提取大脑
注意: 请参阅量具et al.有关详细信息, 请9 。- 用大剪刀或骨剪隔离头部。
- 使用细剪刀, 沿中线切开皮肤从脖子到鼻子。把皮肤拉开, 露出颅骨。用细剪刀除去颈部和颞肌。
- 使中线切开通过 interparietal 骨从孔万能到顶骨。
- 用 Rongeurs 剥去 interparietal 骨。沿矢状缝合处滑动细剪刀, 从顶骨的后端切开至额骨前端。
- 使用 Rongeurs 剥离的顶骨和额骨。或者, 用镊子把骨头抬起来。用勺子切开腹神经线, 取出大脑。将大脑转移到 PB (0.1 米; pH 值 7.4)。
- 在4° c 的情况下, 用4% 的煤灰浸泡1-3 小时来修复不灌注的大脑 (根据大脑大小和探针: 泼妇: ~ 1 h, 人: ~ 3 h)。
注意: 对于像人类这样的大而 gyrencephalic 的大脑, 隔离并切除感兴趣的区域以减少固定时间。 - 要在一节中获得较大的皮层区域, 在进一步的后固定之前将大脑扁平化;继续执行步骤2。然而, 要获得部分更难到达的区域, 如内侧嗅皮质, 后修复4% 粉煤灰24小时的大脑, 然后继续步骤2。
2. 大脑解剖和扁平化
- 使用刀片 (lissencephalic 大脑) 或手术刀 (gyrencephalic 大脑) 分离大脑半球。
注意: 如果大脑没有固定后, 它就容易受到处理的伤害。 - 辅助后续分区注册和收缩估计的可选步骤:
- 在非感兴趣的区域穿刺皮质, 与皮质表面的35G 针正常。沿皮层板的定义距离重复步骤两次。要确定皮质板上的距离, 请使用固定长度的预切螺纹 (如, 5 mm), 并将其放置在皮层表面以确定穿刺点。
- Lissencephalic 大脑: 使用解剖刮刀去除皮层下的结构。关键: 在整个手术过程中, 保持大脑与 PB (0.1 米, pH 7.4) 的湿润。
- 抓住小脑的大脑, 轻轻地插入刮刀, 打开胼胝体的解剖平面。铲刀的圆尖应该从皮质点离开。
- 进一步滑动刮刀, 轻轻地拉, 直到刮刀在丘脑和皮层之间。用划伤动作分离皮层下结构。
- 检查半球的厚度是否均匀。
注意: 任何不平坦的区域都可能导致切片过程中的跨层渐变。对于切线切片, 使用手术刀, 使一个干净的切割通过大脑, 平行于脑膜表面的区域, 从它的切线部分是需要的。 - 提高拼合质量的可选步骤:
- 通过纹状体、伏隔核和前额皮质进行清洁切割, 因为它们增加了侧区皮质的厚度。另外, 在前额叶皮层的内侧区域增加一个减压切口, 这可以使皮质的中间部分展开。
- 将半球 (皮层朝下) 放在玻璃滑梯上。继续执行步骤2.6。
- Gyrencephalic 大脑: 移除白色物质展开回 (有关详细的协议, 请参见: Sincich et al.14;Tootell 和15)。关键: 使用 PB (0.1 米; pH 值 7.4) 来保持大脑的湿润。
- 把感兴趣的区域放在一张大的培养皿中的潮湿滤纸上, 皮质朝上。
- 用两个镊子将蛛网膜和 pia 取出。
- 使用湿棉签, 在每个沟中轻轻插入, 以分离回之间的粘连。
- 用另一张湿滤纸把大脑转过来。
- 使用两个弯曲的微铲子展开单回。使用铲子的凸面来逗出白质, 直到靠近回尾的凹端。使用湿棉签, 并进行旋转运动, 以达到凹尾回。
- 戏弄除了单一的回。如有必要, 如果紧张程度太高, 增加小的减压。
- 在培养皿或类似容器中拼合展开的大脑。
- (可选) 将较大的大脑放在滤纸覆盖的海绵上, 以确保区域不干涸。
- 把两块粘土放在两边。关键: 由于粘土的厚度定义了半球可以被夷为平地的程度, 确保粘土比联合国扁平的皮层薄10-20%。
- 轻轻地按下第二个玻片/小培养皿在大脑皮层, 直到半球完全平坦。为了获得所需区域的最佳效果, 请先将玻璃幻灯片放在相应区域上。为了获得最好的结果, lissencephalic 的大脑, 将玻璃滑动切向侧部的第一个和应用集中的压力在这个地区。
- 在玻璃玻片/培养皿上放一个重量 (例如, 一个陶瓷手表玻璃), 在 PB 的4° c 下将半球压扁3-5 小时。
- 为后固定, 释放压力, 并删除玻璃幻灯片。在4° c 的振动器上把扁平半球放在粉煤灰 (自由浮动) 24 小时。
注: 在使用1% 的粉煤灰时, 染色的组织化学活性达到最佳效果。对于其他染色, 如免疫组织化学, 对非灌注脑的人, 可以使用2% 的粉煤灰。
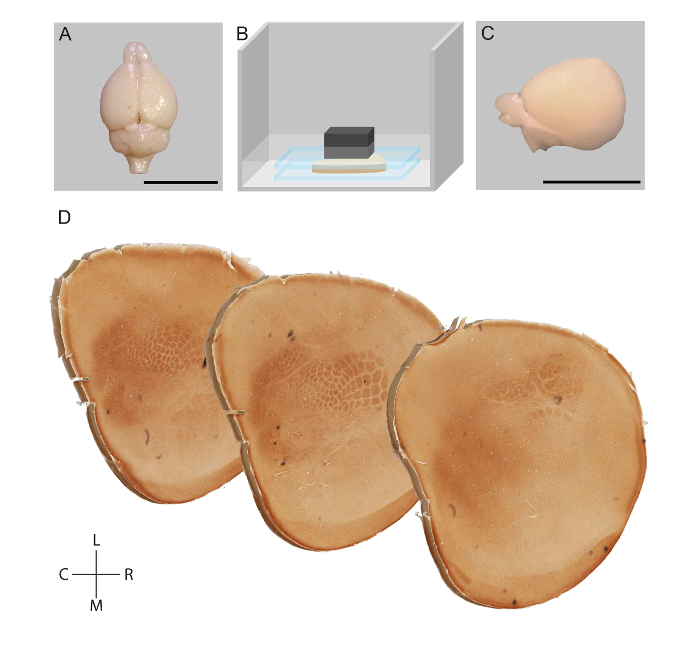
图 1: 大鼠皮质半球扁平化工作流的示意图表示和体感皮层模块的可视化.在 transcardial 灌注后, 解剖了一只老鼠的大脑 (a)。皮层下结构被移除, 在磷酸盐缓冲中的两个玻片之间的皮层被扁平化 (B)。扁平半球 (C) 是后固定的, 切切的切片, 染色细胞色素氧化酶活性 (D)。刻度条 = 1 厘米 R: 侧, C: 尾, L: 侧面, M: 内侧。图改编自马特·劳尔et al.23请单击此处查看此图的较大版本.
3. 切切截面
注: 根据染色规程的要求, 切割过程和厚度可以调整。vibratome 被用来切割半球进一步组织化学处理 (步骤 3.2) 在80-150 µm。然而, 对于免疫组化处理, 更薄的部分是需要和一个冻结切片用于剖切 (步骤 3.3) 在10-60 µm。请参见视频 1。
- 用 PB (0.1M; pH 值 7.4) 洗涤扁平半球, 15 分钟。
- 把这个半球 vibratome。
- 将半球切向切片持有者。(可选) 在将其固定在位置 (例如和强力) 之前, 请用玻璃幻灯片轻轻地再次按下。
注: 尽量减少使用胶水的数量, 因为切割工件可能是由于扁平半球的厚度小造成的。 - 将半球从较厚和更稳定的一端切向较薄的一端 (在前面, 在这里后) 在所需的厚度。继续执行步骤3.4。
注: 如果使用低固定浓度, 以慢速和高振幅切割。
- 将半球切向切片持有者。(可选) 在将其固定在位置 (例如和强力) 之前, 请用玻璃幻灯片轻轻地再次按下。
- 在冰冻的切片上切开这个半球
- Cryoprotect 把它浸泡在30% 蔗糖溶液中 (PB), 直到它下沉。
注意: 根据 cryoprotected 的组织大小, 溶液中的下沉范围从几个小时到几天不等。为更大的脑子选择冻方法可能被考虑 (参见 Rosene et al.16)。 - 在结冰的切片上形成一个冰基来安装大脑。在冻结切片的块面上, 通过冻结 PB 来构造冰基。关键: 确保冰基的表面与切片叶片平行。要做到这一点, 用切片刀片切割空的冰基, 使其与切削表面平行的冰基完全对准。
- 将大脑嵌入冷冻介质, 并将其安装到切片的块面上, 与块面平行的感兴趣区域。面对脑膜表面的切片。关键: 根据样品大小调整冷冻温度;更高的温度确保切片时更好的剖面完整性, 但较大的部分需要较低的温度来均匀地冻结样品。
- 切割大脑在所需的厚度 (缓慢和统一的切割速度, 导致最好的部分质量)。
- Cryoprotect 把它浸泡在30% 蔗糖溶液中 (PB), 直到它下沉。
- 在一个振动筛上清洗15分钟 PB 的部分。

视频 1: 从大鼠内侧嗅皮层切向切片的示意图视频, 以及 parasubicular 和嗅模块的布局.啮齿动物大脑的内侧嗅皮质位于皮层的后端, 并向内侧和腹侧倾斜。切线部分是通过定向刀沿这个角度。因此, 适当的细胞型特异性染色揭示了模块化结构在内侧嗅皮层和毗邻 parasubiculum。视频改编自雷和布莱希特8。请单击此处查看此视频。(右键单击可下载.
4. 使用细胞色素氧化酶染色的皮质模块的可视化
注: 已开发出不同的染色方案的细胞色素氧化酶活性的组织化学检测,例如, 首先是由 Wong-莱利17和后来修改的迪瓦茨et al.18此协议基于一个迪瓦茨et al.18, 因为使用镍-硫酸铵 (尼亚斯) 产生了更高的对比度和更好的定义的模块在染色皮层区。
- 制备细胞色素氧化酶染色液 (见迪瓦茨et al.18). 对于10毫升的溶液, 添加:10 毫升 HEPES 缓冲液 (0.1 米, pH 7.4), 400 毫克蔗糖, 12.5 毫克尼亚斯, 2 毫克细胞色素 C, 6 毫克 diaminobenzidine (民建联)。
注意: 民建联和尼亚斯是致癌的。
注: 在部分孵化前加入民建联。 - 将 HEPES 缓冲液 (0.1 米, pH 7.4) 的部分洗涤在一个振动筛上15分钟。
- 在一个振动筛的室温下孵育染色液中的切片。
注意: 观察染色的速度。如果没有明显的反应, 在37° c 时改变为孵育。根据固定量, 染色可以观察后10分钟或几个小时。 - 通过加入4% 的粉煤灰来停止反应;这可以防止不必要的再死和增加背景信号。
- 使用 HEPES 缓冲10分钟, 三次洗涤部分。
- 在玻璃滑梯上安装和烘干部分。
- 脱水部分以增加的酒精列:
- 用60% 的乙醇清洗1分钟的幻灯片. 用80% 乙醇洗掉1分钟的幻灯片, 用96% 分钟的乙醇清洗幻灯片2分钟, 用100% 分洗净, 3 分钟, 用异丙醇冲洗幻灯片5分钟. 在二甲苯中洗涤幻灯片5分。
- 立即添加一个快速硬化安装介质, 并添加一个片。关键: 不要使用基于水的安装介质, 因为尼亚斯将被冲出并降解染色。
- 保持4° c 的长期贮存部分。
5. 利用免疫组织化学染色对皮质模块进行可视化
注: 多个协议可用于免疫组织化学, 优化的标本和类型的探针。适应可以根据需要, 通过不同浓度的抗体, permeabilizing 剂, 和孵化时间。通过荧光探针检测大范围的抗体和可视化, 可以得到良好的结果。
- 将 PBS (0.1 米; pH 7.4) 中的部分洗涤15分钟。
- 可选: 使用水浴 (基于焦et al.进行抗原检索以揭开表位。19;有关其他方法, 请参见 Pileri et al.20)。
- 将水浴预热到80° c。准备三钠柠檬酸缓冲液19 (pH 值 8.0), 并在水浴中预热到80° c。
- 将切片转换为三钠柠檬酸缓冲液。在80° c 下孵育30分钟的剖面
- 冷却部分到室温
- 将 PBS 中的部分洗涤15分钟。
- 在 pbs x (0.5% 海卫一 x, 在 0.1 M pbs) 洗涤部分二次为 15 min。
- 在 PBS 中, 通过孵育牛血清白蛋白 (BSA; 2.5%) 和海卫 x (0.75%) 的溶液中的不表位, 以 2 h。
- 孵育主要抗体的切片,例如, Calbindin D28k (1:5, 000, 1% BSA 在 PBS x), 在2-3 天在一个振动筛在4° c。
注意: 主要抗体的最佳稀释取决于所使用的特定抗体。请参考制造商的信息以获得特定抗体的稀释标准。多种抗体可以一起使用, 但必须针对不同物种提出。 - 在 PBS 中洗涤三次, 每节15分钟。
- 在一个振荡器上, 在4° c 的二次抗体 (PBS 中 1:200, 1% BSA) 夜间孵育切片。
注意: 如果使用多种主抗体, 可在不同的光谱中使用多种二次抗体。 - 清洗二次抗体通过洗涤部分三次在 PBS 为10分钟每。
- 将玻璃切片上的部分装入和烘干, 以供显微镜观察。
注意: 在安装片之前, 剖面仍应保持湿润。 - 在组织切片上应用适合荧光染料的安装介质, 并应用片。
- 干燥1小时的部分。
- 长期贮存时, 用指甲油密封片, 在4° c 时保持黑暗。
结果
我们获得了各种大脑体感皮层的扁平皮层切片, 并对其进行细胞色素氧化酶组织化学处理, 以可视化 somatotopic 模块代表不同的身体部位。这种比较方法允许研究形状皮层的进化力,例如, 显示 mystacial 触须在啮齿动物和兔中的高度保守的表示, 如桶21 (图 2)。相比之下, 其他身体部位, 如爪子和生殖器显示其相对大小的变化, 并反映...
讨论
在大脑皮层的模块化已被确定使用各种技术。最早的研究通常通过可视化细胞稠密区或缺乏纤维1来识别皮质模块。随后的方法利用了树突丛的存在24, 传入从特定区域25, 或富集神经递质26。在这里我们展示了两种技术, (i) 细胞色素氧化酶组织化学和 (ii) 免疫组织化学染色。
细胞色素氧化酶染色是最常用的...
披露声明
提交人声明, 这项研究是在没有任何商业或财务关系的情况下进行的, 可被理解为潜在的利益冲突。
致谢
这项工作得到了洪堡大学祖柏林, 伯恩斯坦计算神经科学中心柏林, 德国神经退行性疾病中心 (DZNE), 德国联邦教育和研究部 (BMBF, Förderkennzeichen01GQ1001A), NeuroCure, 和戈特弗里德的 DFG 奖。我们感谢藤新平西山优秀的平面设计和 Juliane Diederichs 优秀的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
参考文献
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。