Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Görselleştirme düzleştirilmiş memeli Cortices'deki kortikal modülleri
Bu Makalede
Özet
Bu makalede, düzleştirilmiş teğet bölümleri memeli cortices elde etmek ve histochemical kullanarak kortikal modülleri ve immunohistokimyasal yöntemleri görselleştirmek için detaylı bir metodoloji.
Özet
Memeli beyin korteksi farklı ayarlamış veya modüller içine parcellated olduğunu. Kortikal Modüller genellikle kortikal sayfasına paralel yalan ve bazı histochemical ve immunohistokimyasal yöntemlerle belirlendi. Bu çalışmada, bir yöntem üzerinden memeli beyin korteksi yalıtmak ve onları bölümleri paralel kortikal sayfasına almak için Düzleştir'i vurgulayın. Daha ayrıntılı vurgulamak seçilen histochemical ve bunlar işlemeye immunohistokimyasal yöntemleri basık kortikal modülleri görselleştirmek için teğet bölümleri. Çeşitli memeliler somatosensor korteks vücut haritalar veya hayvan vücudun farklı parçaları temsil eden kortikal modülleri ortaya çıkarmak için sitokrom oksidaz histochemistry gerçekleştiriyoruz. Medial entorhinal korteks, ızgara hücreleri burada üretilen, bir alanı modülleri bir düzende kılavuz-kortikal sayfasında çeşitli türler arasında düzenlenmiş olan genetik olarak belirlenen nöronların vurgulamak için immunohistokimyasal yöntemleri kullanmak. Genel olarak, biz yalıtmak ve layer-wise hazırlamak için bir çerçeve kortikal bölümleri basık ve histochemical kullanarak kortikal modülleri ve immunohistokimyasal yöntemleri çok çeşitli memeli beyni görselleştirmek sağlar.
Giriş
Phylogeny genelinde beyin yapısındaki en büyük değişikliklerden bazıları serebral korteks görülebilmektedir. Önemli farklılıklara rağmen korteks hayvanların ortak bir desen takip ediyor ve genel olarak iki farklı şekilde, Katmanlar ve alanları1tarafından ayrılabilir. Kortikal katmanları beyin yüzeyine paralel yalan ve memeli cortices16 kat arası sürüngen cortices2 3 kat sayı değişir. Kortikal alanlarda diğer yandan büyük ölçüde farklı işlevleri için örneğinkarşılık gelen farklı korteks bölgelerinde, somatosensor korteks touch veya görsel girdi işleme görsel korteksin hissi ilgilenmektedir. Bu kortikal alanlarda genellikle yamalar veya modülleri3, hangi temelde beyin pial yüzeyine paralel bulunan anatomik yapılar, düzenli tekrarlanan bölünmüştür. Kortikal modülleri çeşitli katmanları5arasında genişletebilir veya belirli katman4sınırlı.
Standart parça yöntemleri beyin koronal veya sagittal gibi beyin yüzeye normal bölümler içerir. Bu yöntemler kortikal modülleri görselleştirmek için kullanılan iken, kortikal modülleri yüzeysel, beyin yüzeyine paralel düzlemdeki görüntülenir zaman ilginç özellikleri çok sayıda açığa çıkarılabilir. Örneğin, bıyık, temsil eden kemirgen beyin somatosensor modüllerde beyin yüzeye normal görüntülenir zaman varil olarak görünür ve böylece bölgeleri isim varil korteks türetmek. Ancak, varil teğet yönde görüntülenmesi, aynı bir bıyık harita Topografik bir yönde bıyık dış vücut yüzeyi tam düzenini yansıtması laid dışarı varil ile ortaya koyuyor. Belirli durumlarda, modüler düzenleme bile önemli dönemlerini için algılama kaçtı ne zaman teğet olmayan bir şekilde görüntülenir. Medial entorhinal korteks ızgara hücreleri, bir hayvan bir ortamda çaprazlayan bağlandığınızda bir düzenli altıgen şeklinde ateş nöronlar varlığı için bilinir. Son zamanlarda, yamalar varlığı veya medial entorhinal korteks hücrelerinin modülleri kadar ağır incelenen bir alan olmasına rağmen hangi fiziksel olarak bir Altıgen desen6' da koyulur kaçtı algılama. Varlığı ve bu modüllerde sıçan beyin düzenlenmesi medial entorhinal korteks teğet bölümlerini yapma ve cytoarchitecture layer-wise bir şekilde araştırıyor tarafından kolaylaştırdı.
Kesit ardından, görselleştirme kortikal modüllerin belirli durumuyla aynı zamanda birden fazla yoldan gerçekleştirilebilir. Klasik, çalışmalar modüller hücre yoğunluğu veya lif düzeni üzerinde1dayalı tarif. Başka bir popüler yaklaşım daha yüksek etkinlik8alanlarında ortaya koymaktadır sitokrom oksidaz histochemistry kullanılır. Genetik olarak belirlenen hücre tipleri, onların protein ifade profilleri6,8temel alınarak ayırt bakarak yeni bir yaklaşım içerir.
Bu çalışmada, biz üzerinden memeli beyin korteksi izole, düzleştirilmiş teğet bölümler almak ve kortikal modülleri sitokrom oksidaz histochemistry ve hücre tipi belirli proteinlerin immünhistokimya göre görselleştirmek için yöntemler vurgulayın.
Protokol
Tüm deneysel yordamları yerel etik Komiteleri (LaGeSo) gözetimi altında hayvan refahı üzerinde Alman esaslarına göre yapıldı. İnsan ve yarasa beyin verileri Naumann ve ark. elde 5 erkek yetişkin Wistar fare üzerinde aşağıdaki yordamı gerçekleştirilir (yük: RJHan:WI).
1. perfüzyon ve beyin çıkarma
Not: Artık kan boyama sırasında belirsiz arka plan sinyal arttıkça homojen sabit ve kan-Alerjik beyin elde etmek için transcardial perfüzyon hayvan çok teşvik. Yine de, düzleştirilmiş bölümleri un perfused numune almak ve onları leke mümkündür. Örnek kullanım kolaylığı sabitleştirici kullanılan konsantrasyon ile değişir. Çok az fiksasyon düzleştirme ve düzleştirme için esneklik ve boyama sinyal kalitesi çok yüksek konsantrasyonları düşük iken, kesim sırasında beynin zarar görmesi işleme riskini artırır.
- Transcardially sıvı hayvan, 23 G iğne kullanarak. Daha ayrıntılı bir kılavuz için bkz: Gage vd. 9
- Fosfat tampon tuzlu10 (PBS; 0,02 M; pH 7,4) beyin ve vücut hayvan kan dışarı floş için kullanın. İnfüzyon sıvı açık, en az 150 mL damar sistemi infüzyon PBS ile görünene kadar devam edin.
Not: Fizyolojik kan basıncı periosteum hayvan aralığına benzer bir basınçta en iyi sonuçlar elde edilir (örneğin, fare: 120-130 mmHg). İsteğe bağlı olarak, heparin (10 U/mL) kan pıhtılaşması11önlemek için ekleyin. - Beyin düzeltmek için transcardially demlemek en az 100 mL paraformaldehyde12 (PFA, % 4; (PB)130.1 M fosfat tampon) hayvan boyun sert olana.
Dikkat: PFA olası kanserojen olduğu.
Not: En iyi sonuç için histochemical etkinlik, boyama gibi sitokrom oksidaz, gelince, % 2 kullanılırken elde edilir PFA. Diğer boyama, immünhistokimya gibi % 4 İngiltere'de yılın tercih edilir.
- Fosfat tampon tuzlu10 (PBS; 0,02 M; pH 7,4) beyin ve vücut hayvan kan dışarı floş için kullanın. İnfüzyon sıvı açık, en az 150 mL damar sistemi infüzyon PBS ile görünene kadar devam edin.
- Beyin kafatasından ayıklayın.
Not: Bkz: Gage vd. Ayrıntılar için 9 .- Büyük makas veya kemik makası kullanarak kafa yalıtmak.
- İyi makas kullanırken, burun boynundan orta çizgi boyunca deriyi kesme. Kafatası ortaya çıkarmak için cilt ayır. Boyun ve temporal kas iyi makas kullanarak kaldırın.
- Paryetal kemik kadar deliği magnum başlayarak interparietal kemik kesme bir orta çizgi olun.
- İnterparietal kemikten soymak için Rongeurs kullanın. İyi makas sagittal dikiş boyunca kaydırın ve posterior parietal sonundan itibaren ön frontal kemik sonuna kadar kesilmiş.
- Paryetal ve frontal kemik soyma için Rongeurs kullanın. Alternatif olarak, uzak forseps kullanarak kemik kaldırın. Bir kaşık ventral sinir telleri kesip beyin kaldırmak için kullanın. Beyin PB (0.1 M; pH 7,4) aktarın.
- Un perfused beyin % 4 daldırma sabitleyin PFA için 1-3 h 4 ° C'de (beyin boyutuna ve prob: sivri faresi: ~ 1 h, insan: ~ 3 h).
Not: İçin büyük ve gyrencephalic beyin beğenmek insana ilişkin, izole ve fiksasyon süresini azaltmak için ilgi alanı kesti. - Bir bölüm daha büyük kortikal alanlarda elde etmek için daha fazla sonrası fiksasyon önce beyin dümdüz; Adım 2'ye gidin. Ancak, bölümleri medial entorhinal korteks gibi alanlarda ulaşmak daha zor elde etmek için beyin % 4 ve sonrası tamir PFA adım 2 geçmeden önce 24 h için.
2. beyin diseksiyon ve düzleştirme
- Beyin hemisferlerin bir tıraş bıçağı (lissencephalic Brain) veya neşter (gyrencephalic Brain) kullanarak ayırın.
Not: Eğer beyin sonrası sabit değil, işleyerek zarar duyarlı. - Sonraki bölüm kayıt ve büzülme tahmini yardım için isteğe bağlı adım:
- Korteks faiz dışı sahip bir bölgede kortikal yüzeye normal 35 G iğne ile delik. İki kez mesafelerde tanımlanmış kortikal sayfası boyunca yineleyin. Kortikal sayfası boyunca mesafeyi belirlemek için sabit uzunlukta (örneğin, 5 mm) önceden kesilmiş bir iş parçacığı kullanın ve ponksiyon noktaları belirlemek için kortikal yüzeyi boyunca yatıyordu.
- Lissencephalic beyin: kaldırmak subcortical yapıları parçalanmış bir spatula kullanarak. Kritik: beyin tüm prosedürü boyunca PB (0.1 M; pH 7,4) ile nemli tutmak.
- Beyin beyincik tarafından tutun ve yavaşça bir diseksiyon uçak corpus callosum açmak için spatula yerleştirin. Spatula yuvarlak uç uzaklaş kortekse işaret etmelidir.
- Spatula daha fazla slayt ve spatula talamus ve korteks arasında olana yavaşça çekin. Hareketleri tırmalamak ile ayrı yapıya subcortical.
- Hatta kalınlık Yarımküre bakarak kontrol edin.
Not: Herhangi bir düzensiz bölgeler trans-katman Gradyanda kesit sırasında neden olabilir. Teğet kesit için neşterden temiz bir kesik beynine kendisinden teğet bölümleri istenen bölge pial yüzeyine paralel olun - Düzleştirme kalitesini artırmak için isteğe bağlı adımları:
- Lateral bölgede korteks kalınlığını artırmak striatum, nucleus accumbens ve orbitofrontal korteks, temiz bir kesim yapmak. Ayrıca, medial kortekse bölümlerini unfolding sağlar prefrontal korteksin iç bölge temelini giderici bir kesim ekleyin.
- Bir cam slayt üzerinde Yarımküre (korteks aşağı bakacak şekilde) yerleştirin. 2.6 adıma geçin.
- Gyrencephalic beyin: kaldırmak beyaz gyri açılmak için madde (detaylı iletişim kuralları için bkz: Sincich vd. 14; Tootell ve Silverman15). Kritik: Kullanım PB (0.1 M; pH 7,4) beyin nemli her zaman tutmak için.
- Yukarı dönük olacak şekilde korteks ile büyük bir petri, nemli bir filtre kağıt üzerinde ilgi alanı koymak.
- Araknoid membran ve pia iki forseps kullanarak kaldırın.
- Bir ıslak pamuk bez kullanın ve yapışıklıklar gyri arasında ayırmak için her sulkus yavaşça koyun.
- Beynin başka bir nemli filtre kağıdı kullanarak arkanı dön.
- Tek gyri açılmak için iki eğri mikro spatula kullanın. Ayrı içbükey gyrus sonuna yakın erişene dek beyaz madde kızdırmak için spatula dışbükey tarafını kullanıyorsunuz. Bir ıslak pamuk bez kullanın ve içbükey gyrus sonuna ulaşmak için dönen hareketleri ile devam edin.
- Apart tek gyri alay. Gerekirse, gerilim çok yüksek ise küçük rahatlatma keser ekleyin.
- Petri kabına veya benzer bir kapsayıcı gelişeceğini beyinde düzleştirin.
- İsteğe bağlı olarak, daha büyük beyin bölgeleri kurumasına olduğunu emin olmak için bir filtre kağıdı kaplı sünger yerleştirin.
- İki haddelenmiş kil her iki tarafta alin. Kritik: Kil kalınlığı ne kadar Yarımküre basık tanımlar gibi kil % 10-20 olması un düzleştirilmiş korteks daha ince.
- Yavaşça Yarımküre tamamen düz gelene kadar ikinci cam slayt/küçük bir Petri kabına korteks üzerinde basın. İstenen bölge için en iyi sonuçları elde etmek için cam slayt ilk ilgili yerleştirin. Lissencephalic beyin için en iyi sonuçları elde etmek için cam slayt yüzeysel yanal bölümü birinci ve bu bölge yoğun basınç uygulayın.
- Bir ağırlık (örneğin, izle cam seramik) cam slaytlar/Petri kabına üzerinde koymak ve PB 4 ° C'de 3-5 h için Yarımküre düzleştirin.
- Sonrası fiksasyon için basınç ve cam slayt kaldırın. Düzleştirilmiş Yarımküre bir shaker 4 ° C'de 24 saat (ücretsiz yüzen) PFA koymak
Not: %1 kullanırken histochemical faaliyet stainings için en iyi sonuçlar elde edilir PFA. Diğer stainings için immünhistokimya, un perfused beyin, %2 PFA-ebilmek var olmak kullanılmış için gibi.
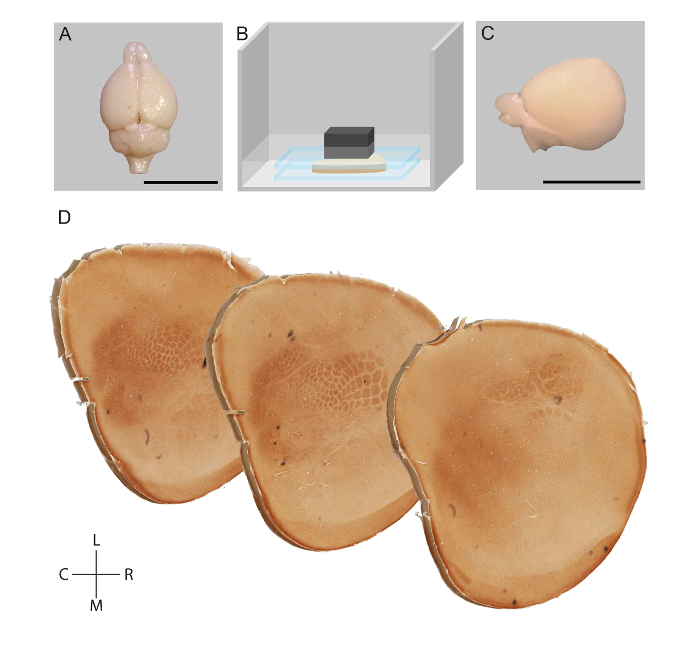
Resim 1: bir fare kortikal Yarımküre ve görselleştirme somatosensor kortekste modüllerin düzleştirme için iş akışının şematik gösterim. Transcardial perfüzyon sonraki bir fare beyni disseke(a). Subcortical yapıları kaldırılmıştır ve korteks fosfat tampon (B) iki cam slayda dümdüz. Düzleştirilmiş Yarımküre (C) sonrası sabit, yüzeysel kesitli ve sitokrom oksidaz aktivitesi (D) lekeli. Ölçek çubukları 1 cm. R: = Rostral, C: Caudal, L: Lateral, M: Medial. Lauer vd. adapte şekil 23 Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
3. kesme teğet bölümleri
Not: boyama protokolleri gereksinimlerine bağlı olarak, kesme yordamı ve kalınlığı adapte edilebilir. Bir vibratome daha fazla histochemical işleme (Adım 3.2) hemisferlerin 80-150 µm kesmek için kullanıldı. Ancak, immunohistokimyasal işlenmek ince kesitler istenen ve dondurucu microtome parça (3,3) vasıl adım 10-60 µm için kullanıldı. Video 1bkz.
- Düzleştirilmiş Yarımküre karton kapak yıkayın (0.1M; pH 7,4) 15 dakika.
- Yarımküre üzerinde bir vibratome kesin.
- Yarımküre yüzeysel yer Dilimleme tutucu üzerinde. İsteğe bağlı olarak, yeniden basın (örneğin, yapıştırıcı ile) pozisyon sabitleme önce hafifçe bir cam slayt ile.
Not: kesme eserler düzleştirilmiş hemisferlerin küçük kalınlığı nedeniyle neden olabilir çünkü kullanılan, tutkal miktarını en aza indirmek. - Daha kalın ve daha istikrarlı sonuna doğru daha ince sonuna (posterior anterior için burada) yarımküreden gerekli kalınlığı kes. 3.4 adıma geçin.
Not: düşük fiksasyon konsantrasyonları kullandıysanız, yavaş hız ve yüksek genlik kes artık.
- Yarımküre yüzeysel yer Dilimleme tutucu üzerinde. İsteğe bağlı olarak, yeniden basın (örneğin, yapıştırıcı ile) pozisyon sabitleme önce hafifçe bir cam slayt ile.
- Yarımküre üzerinde bir dondurucu microtome kesti.
- Cryoprotect kadar çözümde bir % 30 sukroz (PB) çeker tarafından beyin lavabolar.
Not: cryoprotected olmak doku boyutuna bağlı olarak, çözüm içinde batan bir kaç saat için bir kaç gün arasında olabilir. Daha büyük beyin yerine alternatif cryoprotection yöntemler kabul edilebilir (bkz: Rosene vd. 16). - Bir buz dondurucu microtome üzerinde beyin takmak için temel oluşturur. Temel buz dondurucu microtome blok yüzünde PB dondurarak oluşturmak. Kritik: buz Bankası yüzeyine microtome bıçak paralel olduğundan emin olun. Bunu yapmak için boş buz temel tam olarak kesme yüzeyine paralel buz Bankası hizalamak için microtome bıçak kullanarak kesmek.
- Beynin orta buz gibi embed ve microtome blok yüz blok yüze paralel ilgi alanı ile monte edin. Beyin microtome blok yüzü doğru pial yüzeyinin yüz. Kritik: örnek boyutuna bağlı olarak donma sıcaklığı ayarlayın; daha yüksek sıcaklıklarda daha iyi bölüm kesit süre bütünlüğünü, ancak daha büyük bölümler örnek düzgün dondurmak için düşük sıcaklıklarda gerektirir.
- Yüzeysel gerekli kalınlığı (daha yavaş ve düzgün kesme hızları en iyi bölüm kalitesine neden), beyin kesti.
- Cryoprotect kadar çözümde bir % 30 sukroz (PB) çeker tarafından beyin lavabolar.
- PB bölümlerde bir shaker üzerinde 15 dakika yıkayın.

Video 1: teğet sıçan medial entorhinal korteks ve parasubicular ve entorhinal modüllerin düzenini kesit şematik video. Medial entorhinal korteks bir kemirgen beynin korteks posterior sonunda yer alan ve medial ve ventral tarafı yönünde hareket ettirildiğinde. Teğet bölümleri bir bıçak bu açı boyunca yönlendirme tarafından elde edilir. Sonuç olarak, uygun hücre tipi özel boyama medial entorhinal korteks ve bitişik parasubiculum modüler yapılar ortaya koymaktadır. Video Ray ve Brecht8uyarlanmıştır. Bu videoyu izlemek için lütfen buraya tıklayın. (İndirmek için sağ tıklatın.)
4. kortikal modülleri sitokrom oksidaz boyama kullanarak görselleştirme
Not: Farklı boyama protokoller sitokrom oksidaz aktivitesi, örneğin, histochemical tespiti için ilk Wong-Riley17 tarafından geliştirilmiş ve Divac vd tarafından değişikliğin 18 bu iletişim kuralı tarafından Divac ve ark. temel alır 18, nikel-amonyum sülfat (NiAS) kullanımı beri bir daha yüksek kontrast ve daha iyi tanımlanmış modülleri lekeli kortikal alanlarda olmaktadır.
- Çözüm boyama sitokrom oksidaz hazırlamak (bkz: Divac vd. 18). çözüm 10 mL için eklemek: 10 mL HEPES tampon (0.1 M, pH 7,4), 400 mg sukroz, 12.5 mg NiAS, 2 mg sitokrom C, 6 mg diaminobenzidine (DAB).
Dikkat: DAB ve NiAS kanserojen.
Not: DAB sadece bölümleri kuluçka önce ekleyin. - Bir shaker 15dk için üzerinde HEPES tampon (0.1 M, pH 7,4) bölümlerinde yıkayın.
- Bir shaker üzerinde oda sıcaklığında boyama çözüm bölümlerde kuluçkaya.
Not: boyama hızını gözlemlemek. Görünür hiçbir tepki ise, kuluçka 37 ° C'de değiştirin Fiksasyon miktarına bağlı olarak, boyama 10 dk sonra veya birkaç saat içinde görülebilir. - Reaksiyon % 4 ekleyerek durdurmak PFA; Bu istenmeyen yeniden ölüyor ve arka plan sinyal artış önler.
- Bölüm üç kez 10 dakikadır HEPES tampon kullanarak yıkayın.
- Dağ ve cam slaytlardaki bölümler kuru.
- Bir artan alkol satır bölümlerle kurutmak:
- 1 dk. yıkamak için slaytları % 96 etanol içinde 2 dk. yıkamak için slaytları % 100 etanol içinde 3 dk. yıkamak için slaytlar isopropanol içinde 5 dk. yıkamak için slaytları 5 min için Ksilen içinde % 60 etanol 1 dk. yıkama slaytları slaytlar % 80 etanol içinde yıkayın.
- Hemen hızlı bir sertleşme-montaj orta ekleyin ve bir coverslip ekleyin. Kritik: NiAS yıkanmış ve boyama aşağılamak gibi su bazlı montaj ortamlar, kullanmayın.
- Uzun süreli depolama için 4 ° C'de bölümleri tutmak.
5. kortikal modülleri immunohistokimyasal boyama kullanarak görselleştirme
Not: Birden çok iletişim kuralı immünhistokimya, numune ve sonda türü için en iyi duruma getirilmiş kullanılabilir. Uyarlamalar yapılabilir gerektirdiği gibi antikor, permeabilizing ajanlar ve kuluçka süreleri değişik konsantrasyonlarda. Aşağıdaki iletişim kuralı çok sayıda antikor ve görselleştirme tarafından floresan problar algılamak için iyi sonuçlar yol açar.
- PBS (0.1 M; pH 7,4) bölümlerinde 15 dakika yıkayın.
- İsteğe bağlı: bir su banyosu (Jiao ve ark. üzerinde dayalı kullanarak bir epitope meydana çıkarmak için antijen alma gerçekleştirmek 19; bkz: alternatif yöntemleri için Pileri vd. 20).
- Bir su banyosu ile 80 ° c Onceden Tri sodyum sitrat arabellek19 (pH 8.0) hazırlamak ve su banyosu ile 80 ° c Onceden
- Bölümleri tri sodyum sitrat arabelleğe aktarın. 80 ° C'de 30 dk için bölümleri kuluçkaya
- Bölümleri aşağı oda sıcaklığına serin
- PBS bölümlerde 15 dakika yıkayın.
- Bölümlerde iki kez PBS-X yıkayın (% 0.5 Triton-X, 0.1 M PBS) 15 dakika.
- Belirsiz epitopları 2 h sığır Serum Albumin (BSA; % 2.5) ve Triton-X (% 0.75) PBS bir çözüm bölümlerde kuluçka tarafından engelleyin.
- Birincil antikor, örneğin, Calbindin - D28k bölümlerde kuluçkaya (1:5, 000, % 1 BSA PBS-x), bir shaker 4 ° C'de 2-3 gün boyunca
Not: Birincil antikor için en uygun seyreltme spesifik antikor kullanılan üzerinde bağlıdır. Spesifik bir antikor ölçütlerini seyreltme elde etmek için üretici bilgilerine bakın. Birden çok antikorlar birlikte kullanılabilir ama karşı farklı türler olarak yükseltilmiş olması gerekir. - Balıklarda üç kez PBS 15 dakika yıkayın.
- Bir shaker üzerinde 4 ° C'de ikincil antikor (1: 200, PBS % 1 BSA) gecede bölümlerde kuluçkaya.
Not: Eğer birden çok birincil antikorlar kullanılan birden çok ikincil antikorlar farklı spectra kullanılabilir. - İkincil antikor bölümlerde PBS 10 min için üç kez yıkayarak yıkayın.
- Mount ve bir cam slayt mikroskopi için bölümlerde kuru.
Not: Bölümleri hala coverslip montaj önce nemli olmalıdır. - Doku bölümlerinde floresan boyalar için uygun montaj orta uygulamak ve bir coverslip uygulayın.
- 1 h için bölümleri kuru.
- Uzun süreli depolama için tırnak cilası kullanarak coverslip mühür ve 4 ° C'de anlatmamanı
Sonuçlar
Biz beyin çeşitli somatosensor korteksin düzleştirilmiş kortikal bölümler elde edilen ve onlar için farklı vücut parçaları temsil eden somatotopic modülleri görselleştirmek sitokrom oksidaz histochemistry işlenir. Karşılaştırmalı bu yaklaşım son derece korunmuş mystacial vibrissae gösterimi kemirgenler ve Tavşanımsılar varil21 (Şekil 2) gösterilen örneğin, bu şekil korteks evrimsel Kuvvetleri e...
Tartışmalar
Serebral korteks modülerlik çeşitli teknikler kullanarak olduğu belirlendi. Her iki görselleştirme tarafından erken genellikle tespit çalışmaları kortikal modülleri yoğun bölgeler veya lifleri1olmayışı hücre. Sonraki yöntemleri dendritik demetleri24, belirli Bölge25afferents varlığı veya zenginleştirme nörotransmitter26kullanılan. Burada iki teknik, sitokrom oksidaz (i) histochemistry ve (ii) immunohi...
Açıklamalar
Yazarlar araştırma potansiyel bir çatışması olarak yorumlanamaz herhangi bir ticari veya mali ilişkileri yokluğunda yapılmıştır bildirin.
Teşekkürler
Bu eser Humboldt Universität zu Berlin, hesaplamalı nörolojik Berlin Bernstein Merkezi, Alman Merkezi tarafından nörodejeneratif hastalıklar (DZNE), Alman Federal Bakanlığı Eğitim ve araştırma (BMBF, Förderkennzeichen için desteklenmiştir 01GQ1001A), NeuroCure ve Gottfried Wilhelm Leibniz Ödülü DFG. Shimpei Ishiyama için mükemmel grafik tasarım ve Juliane Diederichs mükemmel teknik destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
Referanslar
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır