É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Visualização de módulos corticais em córtices mamíferos achatadas
Neste Artigo
Resumo
Este artigo descreve uma metodologia detalhada para obter secções tangenciais achatadas de mamíferos córtices e Visualizar módulos corticais usando histochemical e métodos de imuno-histoquímica.
Resumo
O córtex do cérebro dos mamíferos é parcellated em subestruturas distintas ou módulos. Módulos corticais normalmente mentem paralelos à folha cortical e podem ser delineados por certos métodos histoquímicos e imuno-histoquímica. Neste estudo, destaca-se um método para isolar o córtex do cérebro de mamíferos e achate-os para obter paralelo de seções para a folha de cortical. Nós ainda mais destaque selecionado histochemical e métodos de imuno-histoquímica para processar estas achatada tangenciais seções para visualizar módulos corticais. No córtex somatossensorial de vários mamíferos, realizamos a citocromo oxidase histoquímica para revelar o corpo mapas ou módulos corticais que representam diferentes partes do corpo do animal. No córtex entorhinal medial, uma área onde as células da grade são geradas, utilizamos métodos de imuno-histoquímica para destacar os módulos de neurônios geneticamente determinados, que estão dispostos em um padrão de grade na planilha de cortical através de várias espécies. No geral, nós fornecemos um quadro para isolar e preparar layer-wise achatado seções corticais e visualize corticais módulos usando histochemical e métodos de imuno-histoquímica em uma ampla variedade de cérebros de mamíferos.
Introdução
Algumas das alterações mais significativas na estrutura do cérebro através de filogenia podem ser observadas no córtex cerebral. Apesar de diferenças significativas, o córtex dos animais segue um padrão comum e pode ser dividido em duas maneiras distintas, por camadas e áreas1. Camadas corticais mentem paralelas à superfície do cérebro e variam em número de 3 camadas em reptiliano córtices2 a 6 camadas em mamíferos córtices1. Áreas corticais, por outro lado, são regiões distintas do córtex, que em grande parte correspondem às funcionalidades distintas, por exemplo, o córtex somatossensorial está envolvido com a sensação de toque ou o córtex visual no processamento visuais entradas. Estas áreas corticais podem muitas vezes ser subdivididas em patches ou módulos3, que são regularmente repetindo estruturas anatômicas, encontradas essencialmente paralelas à superfície pial do cérebro. Módulos corticais podem ser confinados a uma determinada camada4ou estendem através de várias camadas5.
Métodos de corte padrão do cérebro envolvem seções normais à superfície do cérebro, como coronal ou sagital. Enquanto estes métodos podem ser usados para visualizar os módulos corticais, uma multiplicidade de características interessantes pode ser revelada quando os módulos corticais são visualizados tangencialmente, em um plano paralelo à superfície do cérebro. Por exemplo, módulos somatossensorial do cérebro de roedor representando bigodes, aparecem como barris quando visualizado normal à superfície do cérebro, e, portanto, as regiões derivam o córtex de barril de nome. No entanto, na visualização dos barris em uma orientação tangencial, eles revelam whisker-mapa, com os barris sendo colocados para fora em uma orientação topográfica espelhamento o layout dos bigodes na superfície externa do corpo. Em certos casos, o arranjo modular escapou mesmo deteção por períodos consideráveis, quando visualizado de forma não-tangencial. O córtex entorhinal medial, é conhecida pela presença de grade de células, neurônios que dispara em um padrão hexagonal regular quando um animal está atravessando um ambiente. Mesmo que seja uma área fortemente investigada, até recentemente, a presença de manchas ou módulos de células no córtex entorhinal medial, que fisicamente são dispostas em um padrão hexagonal6, tinha escapado a deteção. A presença e a disposição destes módulos, em cérebro de ratos, foi facilitada pela fazendo seções tangenciais do córtex entorhinal medial e investigar a cytoarchitecture de forma layer-wise.
Logo após o corte, o aspecto particular de visualização de módulos corticais também pode ser realizado de várias formas. Classicamente, os estudos foram delineados módulos baseados em célula densidade ou fibra layout1. Outra abordagem popular é o uso da histoquímica de citocromo oxidase, que revela as áreas de maior atividade8. Abordagens mais recentes incluem a olhar para os tipos de células geneticamente determinada, distinguidos-se com base em sua proteína expressão perfis6,8.
Neste estudo, destaca-se métodos para isolar o córtex do cérebro de mamíferos, obter secções tangenciais achatadas e Visualizar corticais módulos baseados em citocromo oxidase histoquímica e imuno-histoquímica das proteínas específicas do tipo de célula.
Protocolo
Todos os procedimentos experimentais foram realizados de acordo com as diretrizes alemãs sobre o bem-estar animal, sob a supervisão das comissões de ética locais (LaGeSo). Humano e morcego cérebro dados foram derivados de Naumann et al 5 o procedimento a seguir é realizado em um rato de Wistar adulto macho (estirpe: RJHan:WI).
1. perfusão e extração do cérebro
Nota: A fim de obter um cérebro homogênea fixo e livre de sangue, transcardial perfusão do animal é altamente incentivado, como sangue residual aumenta o sinal de fundo inespecíficos durante coloração. No entanto, também é possível obter seções achatadas do espécime un-perfundido e manchá-las. A facilidade de manipulação da amostra varia com a concentração de fixador usado. Fixação muito pouco aumenta o risco de manipulação danos ao cérebro durante o nivelamento e corte, enquanto também altas concentrações menor a flexibilidade para o achatamento e a qualidade do sinal de coloração.
- Transcardially perfundir o animal, usando uma agulha 23G. Para um guia mais detalhado, ver Gage et al 9
- Use fosfato reserva o da salina10 (PBS, 0,02 M, pH 7,4) para retirar o sangue do cérebro e do corpo do animal. Continue até o líquido de infusão aparece claro, pelo menos 150 mL de PBS sendo infundido através do sistema vascular.
Nota: Os melhores resultados são obtidos com uma pressão semelhante à faixa da pressão arterial fisiológica do animal sendo perfundido (por exemplo, rato: 120-130 mmHg). Opcionalmente, adicione a solução para evitar a coagulação de sangue11heparina (10 U/mL). - Para corrigir o cérebro, transcardially infundir um mínimo de 100 mL paraformaldeído12 (PFA, 4%; em fosfato 0,1 M de buffer (PB)13) até o pescoço do animal é duro.
Cuidado: PFA é um potencial cancerígeno.
Nota: Melhor para a atividade histoquímicas de coloração, tais como para citocromo oxidase, resultado, quando usando 2% PFA. Para outras manchas, tais como a imuno-histoquímica, 4% PFA é preferencial.
- Use fosfato reserva o da salina10 (PBS, 0,02 M, pH 7,4) para retirar o sangue do cérebro e do corpo do animal. Continue até o líquido de infusão aparece claro, pelo menos 150 mL de PBS sendo infundido através do sistema vascular.
- Extraia o cérebro do crânio.
Nota: Ver Gage et al 9 para mais detalhes.- Isole a cabeça usando tesouras grandes ou tesouras do osso.
- Com uma boa tesoura, cortar a pele ao longo da linha mediana do pescoço ao nariz. Separe a pele para expor a caveira. Remova o pescoço e os músculos temporais usando tesouras bem.
- Faça uma linha média cortar através do osso interparietal a partir do forame magno até o osso parietal.
- Use ruginas para descascar o osso interparietal. Deslize a tesoura bem ao longo da sutura sagital e corte da extremidade posterior do parietal à extremidade anterior dos ossos frontal.
- Use ruginas para descascar o parietal e ossos frontais. Alternativamente, levante os ossos usando fórceps. Use uma colher para cortar cordas ventral do nervo e remover o cérebro. Transferi o cérebro para PB (0,1 M, pH 7,4).
- Consertar o cérebro un-perfundido por imersão em 4% PFA para 1-3 h a 4 ° C (dependendo do tamanho do cérebro e da sonda: musaranho: ~ 1h, humanos: ~ 3 h).
Nota: Para grandes e gyrencephalic cérebros como os humanos, isolar e cortar a área de interesse para reduzir o tempo de fixação. - Para obter maiores áreas corticais em uma seção, achatar o cérebro antes da pós-fixação mais; Prossiga para a etapa 2. No entanto, para obter as seções da mais difícil de alcançar áreas como o córtex entorhinal medial, fixar o cérebro em 4% PFA para 24h antes de prosseguir para a etapa 2.
2. dissecção e achatamento do cérebro
- Separe os hemisférios do cérebro usando uma lâmina de barbear (lissencephalic brains) ou bisturi (gyrencephalic brains).
Nota: O cérebro não foi pós-fixado, se suscetíveis a danos por manipulação. - Passo opcional para ajudar seção subsequente registo e encolhimento da estimativa:
- Perfure o córtex em uma área de juros, com uma agulha de 35G normal à superfície cortical. Repita a etapa duas vezes em distâncias definidas ao longo da folha cortical. Para determinar a distância ao longo da folha cortical, usar um segmento pré-cortado em um comprimento fixo (por exemplo, 5 mm) e coloque-o ao longo da superfície cortical para determinar pontos de punção.
- Cérebros Lissencephalic: remover estruturas subcorticais, usando uma espátula de dissecação. Crítica: Manter o cérebro húmido com PB (0,1 M, pH 7,4) durante todo o processo.
- Segure o cérebro, pelo cerebelo e insira cuidadosamente a espátula para abrir um avião de dissecação no corpo caloso. A ponta redonda da espátula deve apontar longe do córtex.
- Deslize a espátula ainda mais e puxe suavemente até a espátula é entre o tálamo e o córtex. Estruturas subcorticais separadas com movimentos de coçar.
- Inspecione o hemisfério para a espessura do mesmo.
Nota: Quaisquer regiões desiguais podem resultar em um gradiente de trans-camada durante o corte. Para o corte tangencial, use um bisturi para fazer um corte limpo através do cérebro, paralela à superfície pial da região da qual tangenciais seções são desejadas. - Etapas opcionais para melhorar a qualidade do nivelamento:
- Faça um corte limpo através do corpo estriado, núcleo accumbens e córtex orbitofrontal, uma vez que eles aumentam a espessura do córtex na região lateral. Além disso, adicione um alívio corte na base da região interna do córtex pré-frontal, que permite o desdobramento das porções medial do córtex.
- Coloque o hemisfério (córtex virado para baixo) sobre uma lâmina de vidro. Prossiga para a etapa 2.6.
- Cérebros Gyrencephalic: remover matéria branca para desdobrar corticais (para protocolos detalhados, consulte: Sincich et al 14. o; Tootell e Silverman15). Crítica: Uso PB (0,1 M, pH 7,4) para manter o cérebro húmida em todos os tempos.
- Colocar a área de interesse em um papel de filtro úmido em um grande prato de Petri, com o córtex virada para cima.
- Remova a membrana aracnoide e da pia, usando duas pinças.
- Utilize um cotonete úmido e inserir suavemente em cada sulco para desanexar aderências entre corticais.
- Vire o cérebro usando outro papel de filtro úmido.
- Use duas espátulas micro curvas para desdobrar o único corticais. Use o lado convexo das espátulas para arreliar pedaços de matéria branca até chegar perto do lado côncavo de giro do. Utilize um cotonete úmido e proceder com turbilhão moções para alcançar o lado côncavo do giro do.
- Tease separados único corticais. Se necessário, adicione aliviando pequenos cortes se a tensão é muito alta.
- Achate o cérebro desdobrado na prato de Petri ou um recipiente similar.
- Opcionalmente, coloque uma esponja coberta de papel de filtro, para garantir que as regiões não secar cérebros maiores.
- Coloque dois pedaços de laminados de barro em ambos os lados. Crítica: Como a espessura da argila define quanto o hemisfério pode ser achatado, certifique-se de que a argila é 10-20% mais fino que o córtex un-achatado.
- Pressione suavemente um segundo slide de vidro/pequeno prato de Petri no córtex até o hemisfério é totalmente plano. Para obter os melhores resultados para a região desejada, coloque a lâmina de vidro, primeiro, na área respectiva. Para obter os melhores resultados para cérebros lissencephalic, coloque a lâmina de vidro tangencialmente na porção lateral primeiro e aplicar pressão concentrada nesta região.
- Coloque um peso (por exemplo, um vidro de relógio de cerâmico) sobre a corrediças de vidro/Petri e achatar o hemisfério para 3-5 h a 4 ° C em PB.
- Para fixação de pós, liberar a pressão e retire as lâminas de vidro. Colocar o hemisfério achatado em PFA (livre flutuante) por 24 h num agitador a 4 ° C.
Nota: Os melhores resultados para colorações histoquímicas atividade são alcançados quando usando 1% PFA. Para outras colorações, tais como a imuno-histoquímica, un-perfundidos oca, 2% PFA pode ser usado.
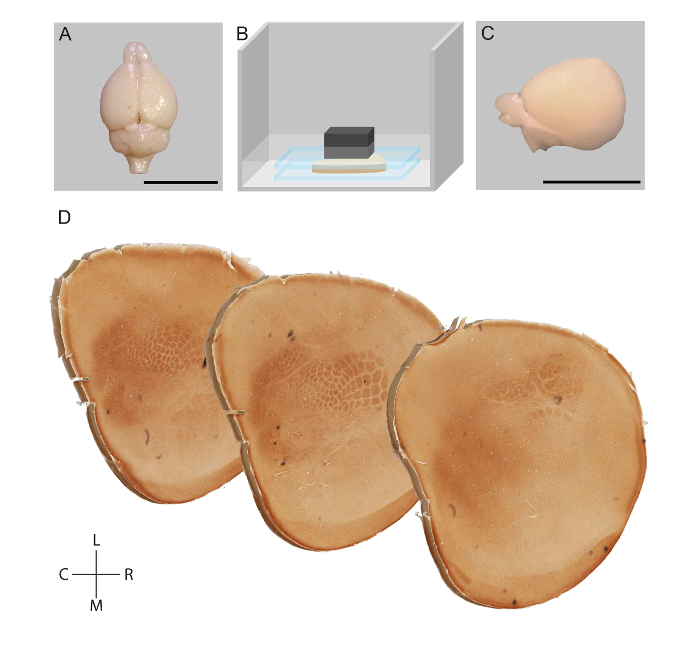
Figura 1: representação esquemática do fluxo de trabalho para o achatamento de um hemisfério cortical de rato e visualização de módulos no córtex somatossensorial. Após a perfusão de transcardial, o cérebro de um rato foi dissecado (A). Estruturas subcorticais foram removidas e córtex foi aplainado entre duas lâminas de vidro em tampão fosfato (B). Hemisfério achatado (C) foi pós-fixado, tangencialmente seccionado e manchado para atividade de citocromo oxidase (D). Barras de escala = 1 cm. r: Rostral, Caudal de c:, l: Lateral, Medial m:. Figura adaptada de Lauer et al 23 Clique aqui para ver uma versão maior desta figura.
3. corte tangencial seções
Nota: Dependendo das exigências dos protocolos de coloração, o processo de corte e a espessura podem ser adaptados. Um vibratome foi usado para cortar os hemisférios para mais histochemical processamento (passo 3.2) em 80-150 µm. No entanto, para o processamento de imuno-histoquímica, seções mais finas são desejadas e um micrótomo de congelação foi usado para corte (passo 3.3), em 10-60 µm. Veja o vídeo 1.
- Lave o hemisfério achatado em PB (0.1M; pH 7,4) por 15 min.
- Corte o hemisfério em uma vibratome.
- Lugar do hemisfério tangencialmente no suporte da corte. Opcionalmente, pressione novamente suavemente com uma lâmina de vidro antes de corrigi-lo em posição (por exemplo, com cola).
Nota: Minimize a quantidade de cola utilizada, porque artefatos de corte podem resultar devido a pequena espessura dos hemisférios achatadas. - Corte o hemisfério da extremidade mais grossa e mais estável no final mais fino (posterior para anterior, aqui) a densidade desejada. Prossiga para a etapa 3.4.
Nota: Se foram utilizadas concentrações de baixa fixação, corte-o em uma velocidade lenta e uma grande amplitude.
- Lugar do hemisfério tangencialmente no suporte da corte. Opcionalmente, pressione novamente suavemente com uma lâmina de vidro antes de corrigi-lo em posição (por exemplo, com cola).
- Corte o hemisfério em um micrótomo de congelação.
- Crioproteção o cérebro por imersão em uma solução de sacarose a 30% (em PB) até que ele afunda.
Nota: Dependendo do tamanho do tecido a ser cryoprotected, afundando na solução pode variar de algumas horas a alguns dias. Para cérebros maiores podem ser considerados métodos alternativos de cryoprotection (ver. Alessandro et al 16). - Forma um base sobre o micrótomo de congelação para montar o cérebro de gelo. Construa o base de gelo por congelamento PB na face do bloco do micrótomo de congelação. Crítica: Certifique-se que a superfície da base de gelo é paralela à lâmina do micrótomo. Para fazer isso, corte o gelo vazio base usando a lâmina micrótomo para alinhar exactamente a base de gelo paralela à superfície de corte.
- Incorporar o cérebro no meio de congelação e montá-lo no rosto de bloco do micrótomo com a área de interesse paralelo à face do bloco. Enfrenta a superfície pial do cérebro para a face do bloco do micrótomo. Crítica: Ajustar a temperatura de congelamento dependendo do tamanho da amostra; temperaturas mais altas assegurar melhor integridade de seção ao seccionamento, mas seções maiores exigem temperaturas mais baixas para congelar amostra uniformemente.
- Corte o cérebro tangencialmente a densidade desejada (velocidades de corte mais lento e uniforme resultam em melhor qualidade de seção).
- Crioproteção o cérebro por imersão em uma solução de sacarose a 30% (em PB) até que ele afunda.
- Lave as seções em PB por 15 min em uma coqueteleira.

Vídeo 1: vídeo esquemático de corte tangencial de um córtex de rato entorhinal medial e o layout dos módulos parasubicular e entorhinal. O córtex entorhinal medial de um cérebro de roedor situa-se na extremidade posterior do córtex e se inclina para o lado medial e ventral. Tangenciais seções são obtidas por orientar uma faca ao longo deste ângulo. Por conseguinte, apropriado do tipo de célula coloração específica revela estruturas modulares no córtex entorhinal medial e parasubiculum adjacente. Vídeo adaptado do Ray e Brecht8. Por favor clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)
4. visualização de módulos corticais usando coloração citocromo Oxidase
Nota: Protocolos de coloração diferentes foram desenvolvidos para histochemical deteção da atividade de citocromo oxidase, por exemplo, primeiro por Wong-Riley17 e mais tarde modificados por Divac et al 18 este protocolo é baseado de Divac et al 18, desde que o uso de sulfato de níquel-amónio (NiAS) resulta em um maior contraste e melhor módulos definidos em áreas corticais manchadas.
- Preparar o citocromo oxidase coloração solução (ver Divac et al 18). para 10 mL da solução, adicionar: tampão de 10ml HEPES (0,1 M, pH 7,4), sacarose 400 mg, 12,5 mg NiAS, citocromo 2mg C, 6mg diaminobenzidina (DAB).
Cuidado: DAB e NiAS são cancerígenos.
Nota: Adicione DAB apenas antes da incubação das seções. - Lave as seções em tampão HEPES (0,1 M, pH 7,4) num agitador por 15 min.
- Incube as seções na solução de coloração, à temperatura ambiente em um shaker.
Nota: Observe a velocidade da coloração. Se não houver nenhuma reação visível, alterar a incubação a 37 ° C. Dependendo da quantidade de fixação, coloração pode ser observada após 10 min ou em várias horas. - Pare a reação adicionando 4% PFA; Isso impede que re-morrendo indesejados e aumento do sinal de fundo.
- Lave as seções três vezes usando tampão HEPES por 10 min.
- Montar e secar as seções sobre lâminas de vidro.
- Desidrata-se as seções com uma linha crescente de álcool:
- Lave as lâminas em etanol a 60% por 1 min. Lave os slides em etanol a 80% por 1 min. lavar as lâminas em etanol a 96% para 2 min. lavar as lâminas em etanol 100% por 3 min. lavar as lâminas em isopropanol por 5 min. Lave os slides em xilol por 5 min.
- Imediatamente adicione um meio de endurecimento-montagem rápido e adicione uma lamela. Crítica: Não use meios de montagem à base de água, como NiAS vai ser lavado para fora e degradar a coloração.
- Manter as seções em 4 ° C para armazenamento a longo prazo.
5. visualização de módulos corticais usando coloração imuno-histoquímica
Nota: Vários protocolos estão disponíveis para imuno-histoquímica, otimizado para a amostra e o tipo de sonda. Adaptações podem ser feitas conforme necessário, por diferentes concentrações de anticorpos, agentes permeabilizing e tempos de incubação. O protocolo seguinte leva a bons resultados para a detecção de uma grande variedade de anticorpos e visualização por sondas fluorescentes.
- Lave as seções em PBS (0,1 M, pH 7,4) por 15 min.
- Opcional: Executar a recuperação do antígeno para desmascarar um epítopo usando um banho de água (baseado no Jiao et al 19. o; para métodos alternativos, consulte Pileri et al 20).
- Pré-aqueça o banho de água a 80 ° C. Preparar o tri-sódio citrato reserva19 (pH 8.0) e aqueça-o banho de água a 80 ° C.
- Transferi as seções para tampão de citrato de sódio-tri. Incubar as seções por 30 min a 80 ° C
- Fixe as seções até à temperatura
- Lave as seções em PBS por 15 min.
- Lave as seções duas vezes em PBS-X (0,5% Triton-X, em PBS 0,1 M) por 15 min.
- Bloco epitopos inespecíficos incubando-se as seções em uma solução de albumina de soro bovino (BSA; 2,5%) e Triton-X (0,75%) em PBS por 2 h.
- Incubar as secções no anticorpo primário, por exemplo, muscular - D28k (1:5, 000, BSA 1% em PBS-X), por 2-3 dias num agitador a 4 ° C.
Nota: A diluição ideal para o anticorpo primário depende o anticorpo específico usado. Consulte informações do fabricante para obter critérios de diluição de um anticorpo específico. Múltiplos anticorpos podem ser usados juntos, mas devem ser disparados contra diferentes espécies. - Lave as seções três vezes em PBS por 15 min cada.
- Incube as secções pernoite no anticorpo secundário (1: 200, 1% de BSA em PBS) a 4 ° C, um agitador.
Nota: Vários anticorpos secundários podem ser usados em diferentes espectros se vários anticorpos primários foram utilizados. - Lave o anticorpo secundário lavando as seções três vezes em PBS por 10 min cada.
- Montar e secar as seções sobre uma lâmina de vidro para microscopia.
Nota: As seções ainda devem estar úmidas antes de montar a lamela. - Aplique meio de montagem adequado para fluorescência corantes sobre as seções de tecido e uma lamela.
- Seque as seções por 1h.
- Para armazenamento a longo prazo, selar a lamela usando esmaltes e manter no escuro a 4 ° C.
Resultados
Nós obtidos achatadas seções corticais do córtex somatossensorial em uma variedade de cérebros e processadas para citocromo oxidase histoquímica Visualizar os módulos de somatotopic que representam diferentes partes do corpo. Esta abordagem comparativa permite estudar as forças evolutivas que córtex de forma, por exemplo, mostrando a representação altamente conservada de vibrissae mystacial em roedores e lagomorfos como barris21 (
Discussão
Modularidade no córtex cerebral foi identificada usando uma variedade de técnicas. Os primeiros estudos normalmente identificados cortical módulos ou visualizando célula regiões densas, ou uma ausência de fibras1. Utilizaram-se métodos subsequentes a presença de feixes dendríticas24, afferents de uma determinada região25, ou enriquecimento de neurotransmissores26. Aqui vamos demonstrar duas técnicas, coloração (ii...
Divulgações
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que poderia ser interpretado como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pela Humboldt-Universität zu Berlin, o centro de Bernstein para Berlim de neurociência computacional, o centro alemão para doenças neurodegenerativas (DZNE), o Ministério Federal alemão de educação e pesquisa (BMBF, Förderkennzeichen 01GQ1001A), NeuroCure e a Gottfried Wilhelm Leibniz prêmio da DFG. Agradecemos Shimpei Ishiyama para design gráfico excelente e Juliane Diederichs para assistência técnica excelente.
Materiais
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
Referências
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados