Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Visualización de módulos corticales en cortezas mamíferos aplanados
En este artículo
Resumen
Este artículo describe una metodología detallada para obtener secciones tangenciales aplastadas de cortezas mamíferas y visualizar los módulos corticales mediante histoquímica y métodos inmunohistoquímicos.
Resumen
La corteza del cerebro mamífero es parcellated en distintas subestructuras o módulos. Módulos corticales normalmente mienten paralelos a la lámina cortical y pueden estar delineados por ciertos métodos histoquímicos e immunohistochemical. En este estudio, podemos destacar un método para aislar la corteza del cerebro mamífero y aplanar para obtener URL de secciones a la hoja de la cortical. Lo más resaltado seleccionado histoquímicos y aplanado de métodos inmunohistoquímicos para procesar estas secciones tangenciales para visualizar los módulos corticales. En la corteza somatosensorial de varios mamíferos, realizamos histoquímica de la citocromo oxidasa para mostrar mapas de cuerpo o módulos corticales que representan diferentes partes del cuerpo del animal. En la corteza del entorhinal medial, un área donde se generan las células de la red, utilizamos métodos inmunohistoquímicos para resaltar módulos de neuronas genéticamente determinadas que se arreglan en un patrón de cuadrícula en la hoja de cortical a través de varias especies. En general, ofrecemos un marco para aislar y preparar layer-wise aplanado secciones corticales y visualizar los módulos corticales mediante histoquímica y métodos inmunohistoquímicos en una amplia variedad de cerebros mamíferos.
Introducción
Algunos de los cambios más significativos en la estructura del cerebro a través de la filogenia pueden observarse en la corteza cerebral. A pesar de diferencias significativas, la corteza de los animales sigue un patrón común y se puede dividir ampliamente en dos maneras distintas, por capas y áreas1. Capas corticales se encuentran paralelas a la superficie del cerebro y varían en número de 3 capas de cortezas reptiles2 a 6 capas de cortezas mamíferos1. Áreas corticales por el contrario son distintas regiones de la corteza que en gran parte corresponden a diferentes funcionalidades, por ejemplo, la corteza somatosensorial está implicada en la sensación de tacto o la corteza visual en el procesamiento de entradas visuales. Estas áreas corticales pueden a menudo ser subdivididas en parches o módulos de3, que regularmente están repitiendo las estructuras anatómicas, encontradas esencialmente paralelas a la superficie pial del cerebro. Módulos corticales pueden limitarse a un determinado nivel4, o extienden a través de varias capas5.
Métodos estándar de seccionamiento del cerebro involucran las secciones normales a la superficie del cerebro, como coronal o sagital. Aunque estos métodos pueden utilizarse para visualizar los módulos corticales, una multitud de características interesantes puede ser revelada cuando los módulos corticales se visualizan tangencialmente, en un plano paralelo a la superficie del cerebro. Por ejemplo, módulos somatosensoriales en el cerebro de roedor que representa bigotes, aparecen como barriles cuando es visualizado normal a la superficie del cerebro, y así las regiones derivan de la corteza del cañón de nombre. Sin embargo, en la visualización de los barriles en una orientación tangencial, revelan un mapa de barba, con los barriles que están establecidos en una orientación topográfica reflejando la disposición exacta de los bigotes en la superficie externa del cuerpo. En ciertos casos, arreglo modular incluso ha escapado detección durante periodos considerables, cuando es visualizado de manera no tangencial. La corteza del entorhinal medial, se caracteriza por la presencia de células de la red, las neuronas que cuando un animal mueve por medio del fuego en un patrón regular hexagonal. Aunque es un área muy investigada, hasta recientemente, la presencia de parches o módulos de células en la corteza del entorhinal medial, que físicamente se presentan en un patrón hexagonal6, había escapado detección. La presencia y la disposición de estos módulos, en el cerebro de la rata, fue facilitada por hacer secciones tangenciales de la corteza del entorhinal medial e investigar la Citoarquitectura de manera capa-sabio.
Después de seccionar, el aspecto particular de visualización de módulos corticales también puede realizarse de múltiples maneras. Clásicamente, los estudios han delineado módulos basados en células densidad o fibra de diseño1. Otro método popular es el uso de histoquímica de la citocromo oxidasa, que revela las áreas de mayor actividad8. Enfoques más recientes incluyen mirar tipos de células genéticamente determinada, distinguidos sobre la base de su proteína expresión perfiles6,8.
En este estudio, se destacan los métodos para aislar la corteza del cerebro mamífero, obtener secciones tangenciales aplastadas y visualizar módulos corticales basados en citocromo oxidasa histoquímica e inmunohistoquímica de proteínas específicas de tipo celular.
Protocolo
Todos los procedimientos experimentales fueron realizados según las directrices alemanas sobre el bienestar de los animales bajo la supervisión de los comités de ética locales (LaGeSo). Humanos y murciélagos cerebro datos fueron derivados de Naumann et al. 5 el siguiente procedimiento se realiza en rata Wistar macho adulto (cepa: RJHan:WI).
1. perfusión y extracción de cerebro
Nota: Para obtener un cerebro fijado homogéneamente y sin sangre, las transcardial la perfusión del animal es muy animada, como sangre residual aumenta la señal de fondo no específica durante la coloración. Sin embargo, también es posible obtener secciones aplanadas del espécimen no perfundido y les mancha. La facilidad de manipulación de la muestra varía con la concentración de fijador utilizado. Fijación insuficiente aumenta el riesgo de manejar el daño en el cerebro durante aplanar y cortar, mientras que concentraciones demasiadas menor flexibilidad para aplanar y la calidad de la señal de tinción.
- Transcardially perfusión el animal, utilizando una aguja de 23G. Para una información más detallada, véase Gage et al. 9
- Uso de fosfato buffer salino10 (PBS 0.02 M; pH 7,4) a eliminar sangre desde el cerebro y el cuerpo del animal. Continúe hasta que el líquido de infusión aparece clara, con al menos 150 mL PBS ser infundida a través del sistema vascular.
Nota: Se consiguen mejores resultados a una presión similar a la gama de la presión arterial fisiológica del animal siendo perfundido (p. ej., rata: 120-130 mmHg). Opcionalmente, añadir heparina (10 U/mL) a la solución para evitar la coagulación de sangre11. - Para fijar el cerebro, transcardially infundir un mínimo de 100 mL paraformaldehido12 (PFA, 4%; en fosfato de 0.1 M tampón (PB)13) hasta que el cuello del animal es rígido.
PRECAUCIÓN: El PFA es un carcinógeno potencial.
Nota: Para la actividad histoquímica de la coloración, tales como la citocromo oxidasa, se consiguen mejores resultados, al utilizar 2% PDA. Para otras manchas, como inmunohistoquímica, 4% PFA es preferido.
- Uso de fosfato buffer salino10 (PBS 0.02 M; pH 7,4) a eliminar sangre desde el cerebro y el cuerpo del animal. Continúe hasta que el líquido de infusión aparece clara, con al menos 150 mL PBS ser infundida a través del sistema vascular.
- Extraer el cerebro del cráneo.
Nota: Ver Gage et al. 9 para más detalles.- Aislar la cabeza con grandes tijeras o los esquileos del hueso.
- Con unas tijeras finas, cortar la piel a lo largo de la línea media del cuello a la nariz. Separe la piel para exponer el cráneo. Quitar el cuello y los músculos temporales con unas tijeras finas.
- Haga una línea media a través del hueso interparietal desde el foramen magnum hasta el hueso parietal.
- Uso de gubias de pelar el hueso interparietal. Deslice las tijeras finas a lo largo de la sutura sagital y corte desde el extremo posterior del parietal en el extremo anterior de los huesos frontales.
- Uso de gubias de pelar los huesos frontal y parietal. Por otra parte, levantar los huesos lejos con unas pinzas. Use una cuchara para cortar cuerdas ventrales del nervio y quitar el cerebro. Transferir el cerebro a PB (0,1 M; pH 7,4).
- Reparar cerebros no perfundidos por inmersión en el 4% PFA para 1-3 h a 4 ° C (dependiendo del tamaño del cerebro y sonda: musaraña: ~ 1 h, humanos: ~ 3 h).
Nota: Para grandes y gyrencephalic cerebros como los seres humanos, aislar y cortar el área de interés para reducir el tiempo de fijación. - Para obtener las áreas corticales más grandes en una sección, aplane el cerebro antes de la fijación más; proceda al paso 2. Sin embargo, para obtener secciones de más difícil llegar a zonas como la corteza del entorhinal medial, después arreglar el cerebro en el 4% PFA por 24 h antes de proceder al paso 2.
2. disección y aplanamiento del cerebro
- Separar los hemisferios del cerebro mediante una hoja de afeitar (lissencephalic cerebro) o un bisturí (gyrencephalic cerebro).
Nota: Si el cerebro no se ha corregido después, es susceptible a daños por manejo. - Paso opcional para ayudar a la estimación de sección posterior registro y contracción:
- La corteza en un área de interés no la punción con una aguja de 35G normal a la superficie cortical. Repita el paso dos veces a distancias definidas a lo largo de la lámina cortical. Para determinar la distancia a lo largo de la lámina cortical, utilice un hilo de corte a longitud fija (por ejemplo, 5 mm) y colóquela a lo largo de la superficie cortical para determinar puntos de punción.
- Cerebros lissencephalic: quitar las estructuras subcorticales usando una espátula de disección. Crítica: Mantenga el cerebro húmedo con PB (0,1 M; pH 7,4) a lo largo de todo el procedimiento.
- Mantenga el cerebro por el cerebelo e inserte suavemente la espátula para abrir un plano de disección en el cuerpo calloso. La punta redonda de espátula debe apuntar a la corteza.
- Deslizar la espátula más lejos y tirar suavemente hasta que la espátula esté entre el tálamo y la corteza. Distintas estructuras subcorticales con movimientos de rascado.
- Inspeccione el hemisferio para incluso el grueso.
Nota: Regiones irregulares pueden resultar en un gradiente trans-capa durante el seccionamiento. Para corte tangencial, utilice un bisturí para hacer un corte limpio a través del cerebro, paralelo a la superficie pial de la región de la cual se desean secciones tangenciales. - Pasos opcionales para mejorar la calidad del acoplamiento:
- Hacer un corte limpio por el cuerpo estriado, Núcleo accumbens y corteza orbitofrontal, puesto que aumentan el espesor de la corteza en la región lateral. También, añadir un corte de alivio en la base de la región interna de la corteza prefrontal, que permite el despliegue de las porciones mediales de la corteza.
- Coloque el hemisferio (corteza hacia abajo) sobre un portaobjetos de vidrio. Proceda al paso 2.6.
- Cerebros Gyrencephalic: Quite la materia blanca para desplegar las convoluciones del cerebro (para protocolos detallados, vea: Soledad et al. 14; Tootell y Silverman15). Crítica: Uso PB (0,1 M; pH 7,4) a mantener el cerebro húmedo en todo momento.
- Poner el área de interés en un papel filtro húmedo en un gran plato de Petri, con la corteza hacia arriba.
- Quitar la membrana aracnoide y pia usando dos pinzas.
- Utilice un hisopo de algodón húmedo y suavemente inserte en cada surco para separar las adherencias entre las convoluciones del cerebro.
- La vuelta del cerebro mediante el uso de otro papel de filtro húmedo.
- Utilizar dos espátulas curvas de micro para desplegar solo convoluciones del cerebro. Utilice el lado convexo de las espátulas para embromar aparte la materia blanca hasta llegar cerca del extremo cóncavo de la convolución del cerebro. Utilice un hisopo de algodón húmedo y continuar con movimientos de remolinos para llegar al extremo cóncavo de la convolución del cerebro.
- Embromar apartes solo convoluciones del cerebro. Si es necesario, agregue aliviar pequeños cortes si la tensión es demasiado alta.
- Aplana el cerebro desplegado en la caja Petri o un recipiente similar.
- Opcionalmente, lugar cerebros más grandes en una esponja de filtro de papel cubierto, para garantizar que las regiones no se resequen.
- Coloque dos piezas laminados de la arcilla en ambos lados. Crítica: Como el grueso de la arcilla define cuánto el hemisferio puede ser aplanado, asegurarse de que la arcilla es 10-20% más delgada que la corteza no aplanada.
- Presione suavemente hasta que el hemisferio esté completamente plano una segundo cristal diapositiva pequeña caja de Petri en la corteza. Para obtener los mejores resultados para una región deseada, coloque el portaobjetos de cristal primero en el área respectiva. Para obtener los mejores resultados para cerebros lissencephalic, coloque el portaobjetos de cristal tangencialmente en la porción lateral primero y aplique presión concentrada en esta región.
- Poner un peso (por ejemplo, un vidrio de reloj cerámica) sobre el portaobjetos de vidrio/Petri y aplanar el hemisferio durante 3-5 h a 4 ° C en PB.
- Para la fijación, suelte la presión y retire el portaobjetos. Poner el hemisferio aplanado en PFA (libre flotación) por 24 h en un agitador a 4 ° C.
Nota: Se consiguen mejores resultados para los stainings histoquímicos actividad cuando se usa 1% PFA. Para otros los stainings, como inmunohistoquímica, para cerebros sin perfusión, PFA se puede utilizar el 2%.
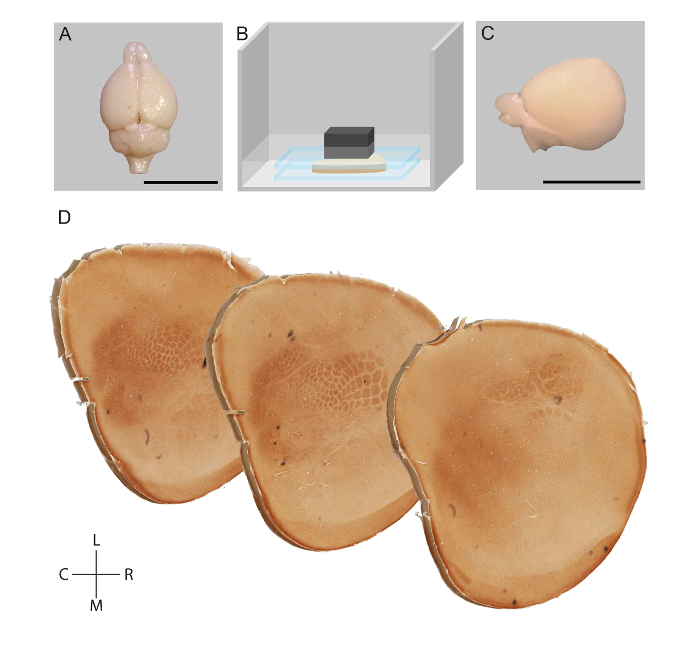
Figura 1: representación esquemática del flujo de trabajo para aplanar de un hemisferio cortical de la rata y la visualización de los módulos en la corteza somatosensorial. Después de la perfusión de transcardial, el cerebro de un ratón fue diseccionado (A). Fueron quitadas estructuras subcorticales y la corteza fue aplanada entre dos portaobjetos en tampón de fosfato (B). Hemisferio aplanado (C) post fijo, seccionado tangencialmente y manchado para la actividad de citocromo oxidasa (D). Barras de escala = 1 cm. R: Rostral, Caudal C:, L: Lateral, Medial de la M:. Figura adaptada de Lauer et al. 23 Haga clic aquí para ver una versión más grande de esta figura.
3. cortar secciones tangencial
Nota: Dependiendo de los requerimientos de los protocolos de tinción, el procedimiento de corte y el grueso pueden ser adaptados. Un vibratome fue utilizado para cortar los hemisferios más histoquímicas procesamiento (paso 3.2) a 80-150 μm. Sin embargo, para el procesamiento de immunohistochemical, secciones más delgadas son las deseadas y un micrótomo de congelación fue utilizado para seccionamiento (paso 3.3) en 10-60 μm. Ver Video 1.
- Lave el hemisferio aplanado en PB (0.1M, pH 7.4) durante 15 minutos.
- Un vibratome corte del hemisferio.
- Lugar del hemisferio tangencialmente en el titular de la corte. Opcionalmente, pulse de nuevo suavemente con un portaobjeto antes de fijar en la posición (por ejemplo, con superglue).
Nota: Minimizar la cantidad de pegamento utilizado, porque podrían resultar en artefactos de corte debido al pequeño espesor de hemisferios aplanados. - Corte el hemisferio desde el extremo más grueso y más estable hacia el extremo más delgado (posterior a la anterior, aquí) en el espesor requerido. Continúe con el paso 3.4.
Nota: Si se utilizaron concentraciones bajas de fijación, corte a baja velocidad y alta amplitud.
- Lugar del hemisferio tangencialmente en el titular de la corte. Opcionalmente, pulse de nuevo suavemente con un portaobjeto antes de fijar en la posición (por ejemplo, con superglue).
- Corte del hemisferio en un micrótomo de congelación.
- Cryoprotect el cerebro sumergiéndolo en una solución de sacarosa al 30% (en PB) hasta que se hunde.
Nota: Dependiendo del tamaño del tejido es cryoprotected, se hunde en la solución puede ir desde unas horas hasta unos días. Para cerebros más grandes podrían considerar métodos alternativos de crioprotección (véase Rosene et al. 16). - Forma de un hielo en el micrótomo de congelación para montar el cerebro. Construir el base del hielo por congelación de PB en la cara del bloque del micrótomo de congelación. Crítica: Asegúrese que la superficie de la base del hielo es paralela a la cuchilla de micrótomo. Para ello, cortar el hielo vacío base usando la cuchilla para Microtomo para alinear exactamente la base de hielo paralela a la superficie de corte.
- Incrustar el cerebro en medio de congelación y montarlo en la cara del bloque del micrótomo con el área de interés paralela a la cara del bloque. Se enfrentan a la superficie pial del cerebro hacia la cara del bloque del microtomo. Crítica: Ajustar la temperatura de congelación dependiendo del tamaño de la muestra; temperaturas más altas garantizar integridad sección mejor de seccionamiento, pero secciones más grandes requieren temperaturas más bajas para congelar la muestra uniformemente.
- Cortar el cerebro tangencialmente en el espesor requerido (velocidades de corte más lento y uniforme resultan en mejor calidad de sección).
- Cryoprotect el cerebro sumergiéndolo en una solución de sacarosa al 30% (en PB) hasta que se hunde.
- Lávese las secciones en PB durante 15 min en un agitador.

Video 1: video esquemático de secciones tangenciales de una corteza del entorhinal medial de ratas y el diseño de los módulos parasubicular y entorrinal. La corteza del entorhinal medial de un cerebro de roedor está situada en el extremo posterior de la corteza y se inclina hacia el lado medial y ventral. Secciones tangenciales se obtienen por un cuchillo a lo largo de este ángulo de orientación. Por lo tanto, apropiado tipo de célula específico tinción revela estructuras modulares en la corteza entorrinal medial y parasubiculum contigua. Video adaptado de Ray y Brecht8. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
4. visualización de módulos corticales mediante citocromo oxidasa tinción
Nota: Protocolos de tinción diferentes se han desarrollado para la detección histoquímica de la actividad de la citocromo oxidasa, por ejemplo, primero por Wong-Riley17 y más tarde modificado por Divac et al. 18 este protocolo se basa en la una por Divac et al. 18, ya que el uso de sulfato de amonio de níquel (NiAS) resulta en un mayor contraste y mejores definidos módulos de áreas corticales teñidas.
- Preparar la solución de tinción de citocromo oxidasa (ver Divac et al. 18). para 10 mL de solución, añadir: tampón HEPES 10 mL (0.1 M, pH 7.4), sacarosa de 400 mg, 12,5 mg NiAS, citocromo C, 6 mg diaminobenzidina (DAB) de 2 mg.
PRECAUCIÓN: DAB y NiAS son cancerígenos.
Nota: Agregar DAB justo antes de la incubación de las secciones. - Lávese las secciones en tampón HEPES (0.1 M, pH 7.4) en un agitador durante 15 minutos.
- Incubar las secciones en la solución de tinción a temperatura ambiente en un agitador.
Nota: Observe la velocidad de la tinción. Si no hay reacción visible, cambiar a incubación a 37 ° C. Dependiendo de la cantidad de fijación, tinción puede observarse después de 10 minutos o varias horas. - Detener la reacción agregando 4% PDA; Esto evita que vuelva a morir y el aumento de señal de fondo no deseados.
- Lavar las secciones tres veces con tampón HEPES durante 10 minutos.
- Monte y secar las secciones sobre portaobjetos de vidrio.
- Deshidratar las secciones con una fila cada vez mayor del alcohol:
- Lave los portaobjetos en etanol al 60% durante 1 minuto lavar los portaobjetos en etanol al 80% por 1 minuto lavar los portaobjetos en etanol al 96% por 2 minutos Lave los portaobjetos en etanol al 100% por 3 minutos Lave el portaobjetos en isopropanol para 5 minutos Lave el portaobjetos en xileno durante 5 minutos.
- Inmediatamente un medio de montaje de endurecimiento rápido y añadir un cubreobjetos. Crítica: No utilice medios de montaje a base de agua, como NiAS será eliminada y degradar la tinción.
- Mantener las secciones de 4 ° C para almacenamiento a largo plazo.
5. visualización de módulos corticales mediante tinción inmunohistoquímica
Nota: Varios protocolos están disponibles para immunohistochemistry, optimizado para la muestra y el tipo de sonda. Adaptaciones se pueden hacer como sea necesario, por concentraciones variables de anticuerpos, agentes permeabilizing y tiempos de incubación. El siguiente protocolo conduce a buenos resultados para la detección de una amplia gama de anticuerpos y la visualización de sondas fluorescentes.
- Lávese las secciones en PBS (0,1 M; pH 7.4) durante 15 minutos.
- Opcional: Realice el antígeno para desenmascarar a un epitopo mediante un baño de agua (basado en Jiao et al. 19; para métodos alternativos, vea Pileri et al. 20).
- Precaliente un baño de agua a 80 ° C. Prepara tri-sodio citrato buffer19 (pH 8.0) y precalentamiento en baño María a 80 ° C.
- Transferencia de las secciones a tampón de tri-sodio citrato. Incubar las secciones durante 30 min a 80 ° C
- Enfriar las secciones a temperatura ambiente
- Lávese las secciones en PBS durante 15 minutos.
- Lávese las secciones dos veces en PBS-X (0,5% Triton-X, en PBS de 0,1 M) durante 15 minutos.
- Bloquear epitopos inespecíficas por las secciones en una solución de albúmina de suero bovino (BSA; 2,5%) y Triton-X (0,75%) en PBS durante 2 h de incubación.
- Incubar las secciones de anticuerpo primario, por ejemplo, Calbindin - D28k (1:5, 000, 1% de BSA en PBS-X), para 2-3 días en un agitador a 4 ° C.
Nota: La dilución óptima para el anticuerpo primario depende del anticuerpo específico utilizado. Consulte la información del fabricante para obtener criterios de dilución de un anticuerpo específico. Anticuerpos múltiples pueden ser usados juntos pero deben elevarse contra especies diferentes. - Lávese las secciones tres veces en PBS durante 15 minutos.
- Incubar las secciones durante la noche en el anticuerpo secundario (1: 200, 1% de BSA en PBS) a 4 ° C en un agitador.
Nota: Múltiples anticuerpos secundarios pueden utilizarse en diversos espectros si se utilizaron varios anticuerpos primarios. - Lave el anticuerpo secundario lavando las secciones tres veces en PBS durante 10 minutos.
- Monte y secar las secciones en un portaobjetos de vidrio para microscopio.
Nota: Las secciones deben estar húmedas antes de montar el cubreobjetos. - Medio de montaje para fluorescencia colorantes en las secciones de tejido se aplica y se aplica un cubreobjetos.
- Secar las secciones para 1 h.
- Para almacenamiento a largo plazo, sello el cubreobjetos usando esmalte de uñas y mantener en la oscuridad a 4 ° C.
Resultados
Obtenidos de las secciones corticales aplanadas de la corteza somatosensorial en una variedad de cerebros y procesado por histoquímica de la citocromo oxidasa visualizar los módulos somatotópicos representando partes del cuerpo diferentes. Este enfoque comparativo permite estudiar las fuerzas evolutivas forma la corteza, por ejemplo, mostrando muy conservada representación de mistacial vibrissae en roedores y lagomorfos como barriles21 (
Discusión
Modularidad en la corteza cerebral se ha identificado con una variedad de técnicas. Los primeros módulos corticales estudios típicamente identificados ya sea visualizando la célula regiones densas, o la ausencia de fibras1. Métodos posteriores han utilizado la presencia de paquetes dendríticas24, aferentes de una región particular25o enriquecimiento de neurotransmisores26. Aquí muestran dos técnicas de histoquímica d...
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pueda interpretarse como un potencial conflicto de interés.
Agradecimientos
Este trabajo fue apoyado por la Humboldt Universität zu Berlin, el centro de Bernstein para Berlín de neurociencia computacional, del centro alemán para enfermedades neurodegenerativas (DZNE), el Ministerio Federal alemán de educación e investigación (BMBF, Förderkennzeichen 01GQ1001A), NeuroCure y Gottfried Wilhelm Leibniz Premio del DFG. Agradecemos a Shimpei Ishiyama de excelente diseño gráfico y Juliane Diederichs excelente asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
Referencias
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados