È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Visualizzazione dei moduli corticali nelle cortecce dei mammiferi appiattite
In questo articolo
Riepilogo
Questo articolo descrive una metodologia dettagliata per ottenere sezioni appiattite tangenziale da cortecce dei mammiferi e visualizzare moduli corticali usando istochimiche e immunohistochemical metodi.
Abstract
La corteccia del cervello dei mammiferi è parcellated in sottostrutture distinte o moduli. Moduli corticali in genere siano parallele al foglio corticale e possono essere delineate da alcuni metodi istochimici e immunohistochemical. In questo studio, segnaliamo un metodo per isolare la corteccia dai cervelli dei mammiferi e appiattirli per ottenere parallelo di sezioni al foglio corticale. Abbiamo ulteriormente evidenziare selezionato istochimiche e immunohistochemical metodi per elaborare questi appiattito tangenziale sezioni per visualizzare moduli corticale. Nella corteccia somatosensory di vari mammiferi, eseguiamo la citocromo ossidasi istochimica per rivelare il corpo mappe o corticale moduli che rappresenta diverse parti del corpo dell'animale. Nella corteccia entorinale mediale, un'area dove vengono generate le celle della griglia, utilizziamo metodi di immunohistochemical per evidenziare i moduli dei neuroni geneticamente determinati, che sono organizzati in un modello di griglia nel foglio di corticale attraverso le diverse specie. Nel complesso, mettiamo a disposizione un framework per isolare e preparare layer-wise appiattito sezioni corticale e la visualizzazione di corticale moduli utilizzando istochimiche e immunohistochemical metodi in un'ampia varietà dei cervelli dei mammiferi.
Introduzione
Alcuni dei più significativi cambiamenti nella struttura del cervello attraverso la filogenesi può essere osservata nella corteccia cerebrale. Nonostante le differenze significative, la corteccia degli animali segue uno schema comune e possa essere suddivisi in due modi distinti, di strati e zone1. Strati corticali siano parallele alla superficie del cervello e variano in numero da 3 strati in cortecce rettile2 a 6 strati in cortecce dei mammiferi1. Aree corticali sono invece distinte regioni della corteccia che corrispondono in gran parte alle funzionalità distinte, ad esempio, la corteccia somatosensoriale è coinvolto nella sensazione di tocco o la corteccia visiva nell'elaborazione di input visivi. Queste aree corticali possono spesso essere suddivisi patch o moduli3, che si ripetono regolarmente strutture anatomiche, essenzialmente trovati parallele alla superficie pial del cervello. Moduli corticale possono essere limitati a un particolare livello4o estendono in diversi strati5.
Metodi standard di sezionamento del cervello coinvolgono sezioni normale alla superficie del cervello, come coronale e sagittale. Mentre questi metodi possono essere utilizzati per visualizzare moduli corticale, una moltitudine di caratteristiche interessanti possa essere rivelata quando i moduli corticali sono visualizzati tangenzialmente, in un piano parallelo alla superficie del cervello. Per esempio, somatosensoriali moduli nel cervello del roditore che rappresenta baffi, appaiono come barili quando visualizzato normale alla superficie del cervello, e così le regioni derivano la corteccia di canna di nome. Sulla visualizzazione le botti in un orientamento tangenziale, esse però rivelano una baffo-mappa, con le canne essendo disposti in un orientamento topografico del mirroring l'esatta disposizione dei baffi sulla superficie esterna del corpo. In alcuni casi, disposizione modulare è sfuggito anche rilevamento per lunghi periodi, quando visualizzati in un modo non tangente. La corteccia di entorhinal mediale, è noto per la presenza di celle della griglia, i neuroni che il fuoco in un reticolo esagonale regolare quando un animale attraversa un ambiente. Anche se è una zona fortemente indagata, fino a poco tempo fa, la presenza di patch o moduli di cellule nella corteccia entorinale mediale, che sono fisicamente disposti in un reticolo esagonale6, era fuggito il rilevamento. La presenza e la disposizione di questi moduli, nel cervello del ratto, è stata facilitata effettuando sezioni tangenziali della corteccia entorinale mediale e indagando la citoarchitettura in maniera strato-saggio.
A seguito di sezionamento, il particolare aspetto della visualizzazione dei moduli corticale può essere realizzato anche in più modi. Classicamente, gli studi hanno delineato moduli basati sul cellulare densità o fibra di formato1. Un altro approccio popolare è l'uso di istochimica di citocromo ossidasi, che rivela le aree di maggiore attività8. Approcci più recenti includono guardando tipi di cellule geneticamente determinata, distinti sulla base della loro espressione di proteina profili6,8.
In questo studio, evidenziamo i metodi per isolare la corteccia dai cervelli dei mammiferi, ottenere sezioni tangenziali appiattite e visualizzare corticale moduli basati sul citocromo ossidasi istochimica e immunoistochimica di proteine specifiche del tipo di cella.
Protocollo
Tutte le procedure sperimentali sono state eseguite secondo le linee guida tedesche sul benessere degli animali sotto la supervisione dei comitati etici locali (LaGeSo). Umano e pipistrello cervello dati sono stati derivati da Naumann et al. 5 la procedura riportata di seguito viene eseguita su un ratto adulto maschio di Wistar (ceppo: RJHan:WI).
1. aspersione ed estrazione del cervello
Nota: Al fine di ottenere un cervello omogeneamente fisso e privo di sangue, perfusione perfusione dell'animale è fortemente incoraggiata, come residui di sangue aumenta il segnale di fondo non specifico durante la colorazione. Tuttavia, è anche possibile ottenere sezioni appiattite dall'ONU-irrorato esemplare e li macchia. La facilità di movimentazione del campione varia con la concentrazione di fissativo utilizzato. Troppo poco fissazione aumenta il rischio di gestione danni al cervello durante la spianatura e taglio, mentre troppo alte concentrazioni abbassare la flessibilità per l'appiattimento e la qualità del segnale colorazione.
- Via irrorare l'animale, utilizzando un ago di 23G. Per una guida più dettagliata, vedere Gage et al. 9
- Utilizzare fosfato tampone salino10 (PBS; 0,02 M; pH 7.4) per scovare il sangue dal cervello e il corpo dell'animale. Continuare fino a quando il liquido di infusione appare chiaro, con almeno 150 mL di PBS viene infusa attraverso il sistema vascolare.
Nota: I risultati migliori si ottengono ad una pressione simile all'intervallo della pressione sanguigna fisiologica dell'animale viene irrorato (ad es., ratto: 120-130 mmHg). Facoltativamente, aggiungere alla soluzione per evitare la coagulazione di sangue11eparina (10 U/mL). - Per correggere il cervello, via infondere un minimo di 100 mL paraformaldeide12 (PFA, 4%; in fosfato 0,1 M di tampone (PB)13) fino a quando il collo dell'animale è rigido.
Attenzione: PFA è un potenziale cancerogeno.
Nota: Migliori risultati istochimici attività colorazione, ad esempio per la citocromo ossidasi, si ottengono, quando si utilizza 2% PFA. Per altro la macchiatura, come immunohistochemistry, 4% PFA è preferito.
- Utilizzare fosfato tampone salino10 (PBS; 0,02 M; pH 7.4) per scovare il sangue dal cervello e il corpo dell'animale. Continuare fino a quando il liquido di infusione appare chiaro, con almeno 150 mL di PBS viene infusa attraverso il sistema vascolare.
- Estrarre il cervello dal cranio.
Nota: Vedere Gage et al. 9 per i dettagli.- Isolare la testa con le grandi forbici o cesoie dell'osso.
- Utilizzando le forbici bene, tagliare la pelle lungo la linea mediana dal collo al naso. Tirare la pelle per esporre il cranio. Rimuovere il collo e dei muscoli temporali utilizzando forbici bene.
- Rendere un midline tagliare attraverso l'osso interparietale a partire dal magnum di orifizio fino all'osso parietale.
- Utilizzare Pinze ossivore per staccare l'osso interparietale. Far scorrere bene forbici lungo la sutura sagittale e tagliare dalla parte posteriore del parietale all'estremità anteriore delle ossa frontali.
- Utilizzare Pinze ossivore per staccare parietali e ossa frontali. In alternativa, sollevare le ossa distanza usando il forcipe. Utilizzare un cucchiaio per tagliare le corde del nervo ventrale e rimuovere il cervello. Trasferire il cervello al PB (0,1 M; pH 7.4).
- Difficoltà cervelli ONU-irrorati mediante immersione in 4% PFA per 1-3 h a 4 ° C (a seconda delle dimensioni del cervello e la sonda: toporagno: ~ 1h, umani: ~ 3 h).
Nota: Per grandi e girencefalici cervelli come gli esseri umani, isolare e tagliare fuori la zona di interesse per ridurre i tempi di fissazione. - Per ottenere più grandi aree corticali in una sezione, appiattire il cervello prima della post-fissazione ulteriore; procedere al passaggio 2. Tuttavia, per ottenere sezioni di più difficile da raggiungere aree come la corteccia di entorhinal mediale, post-fissare il cervello nel 4% PFA per 24 h prima di procedere al passaggio 2.
2. dissezione e appiattimento del cervello
- Separare gli emisferi del cervello utilizzando una lama di rasoio (lissencephalic cervelli) o bisturi (girencefalici cervelli).
Nota: Se il cervello post-non è stato risolto, è suscettibile ai danni di movimentazione. - Passaggio facoltativo per favoreggiamento stima di registrazione ed il restringimento di sezione successiva:
- La corteccia in un'area di non-interesse, la puntura con un ago di 35G normale alla superficie corticale. Ripetere il passaggio due volte alle distanze definite lungo il foglio corticale. Per determinare la distanza lungo il foglio corticale, utilizzare un thread pre-tagliato a lunghezza fissa (ad es., 5mm) e posarlo lungo la superficie corticale per determinare i punti di foratura.
- Lissencephalic cervelli: rimuovere le strutture subcortical utilizzando una spatola per dissezione. Critico: Mantenere umido con PB (0,1 M; pH 7.4) durante l'intera procedura il cervello.
- Tenere il cervello dal cervelletto e inserire delicatamente la spatola per aprire un piano di dissezione in callosum del corpus. La punta rotonda di spatola dovrebbe puntare lontano la corteccia.
- Far scorrere la spatola ulteriormente e tirare delicatamente fino a quando la spatola è tra il talamo e la corteccia. Strutture subcortical separate con movimenti di graffiare.
- Ispezionare l'emisfero per anche lo spessore.
Nota: Qualsiasi regioni irregolare potrebbero comportare un gradiente trans-strato durante il sezionamento. Per il sezionamento tangenziali, utilizzare un bisturi per fare un taglio pulito attraverso il cervello, parallela alla superficie pial della regione da cui sezioni tangenziali sono desiderati. - Passaggi facoltativi per migliorare la qualità di conversione della trasparenza:
- Fare un taglio pulito attraverso il corpo striato, nucleo accumbens e nella corteccia orbitofrontal, poiché aumentano lo spessore della corteccia nella regione laterale. Inoltre, aggiungere un alleviamento taglio alla base della regione interna della corteccia prefrontale, che permette il dispiegarsi delle porzioni mediale della corteccia.
- Posizionare l'emisfero (corteccia rivolto verso il basso) su un vetrino. Procedere al punto 2.6.
- Girencefalici cervelli: rimuovere la materia bianca a svolgersi i gyri (per protocolli dettagliati, vedere: Sincich et al. 14; Tootell e Silverman15). Critico: Uso PB (0,1 M; pH 7.4) per mantenere il cervello umido in tutti i tempi.
- Mettere l'area di interesse su una carta da filtro umida in un grande piatto di Petri, con la corteccia rivolto verso l'alto.
- Rimuovere la membrana aracnoide e la pia utilizzando due pinze.
- Utilizzare un batuffolo di cotone umido e inserire delicatamente in ogni solco per staccare aderenze tra circonvoluzioni.
- Girare il cervello intorno utilizzando un'altra carta da filtro umido.
- Utilizzare due curve micro spatole per dispiegare i gyri singoli. Utilizzare il lato convesso delle spatole per stuzzicare a pezzi la materia bianca fino ad arrivare vicino l'estremità concava del gyrus. Utilizzare un batuffolo di cotone umido e procedere con movimenti vorticosi di raggiungere l'estremità concava del gyrus.
- Stuzzicare apart gyri singoli. Se necessario, aggiungere alleviare piccoli tagli se la tensione è troppo alta.
- Appiattire il cervello spiegato nella capsula di Petri o un contenitore simile.
- Facoltativamente, posto di cervelli più grandi su una spugna filtro carta coperta, per garantire che le regioni non asciugarsi.
- Posizionare due pezzi arrotolati di argilla su entrambi i lati. Critico: Come lo spessore dell'argilla definisce quanto l'emisfero può essere appiattito, assicurarsi che l'argilla è 10-20% più sottile di corteccia del ONU-appiattita.
- Premere delicatamente una seconda diapositiva vetro/piccola capsula di Petri sulla corteccia finché l'emisfero è completamente piatto. Per ottenere i migliori risultati per una regione desiderata, posizionare il vetrino prima sulla zona rispettiva. Per ottenere i migliori risultati per i cervelli lissencephalic, posizionare il vetrino tangenzialmente alla parte laterale prima e applicare una pressione concentrata su questa regione.
- Mettere un peso (per esempio, un vetro da orologio in ceramica) sulle diapositive di vetro/Petri e appiattire l'emisfero per 3-5 h a 4 ° C in PB.
- Per post-fissazione, rilasciare la pressione e rimuovere le diapositive di vetro. Mettere l'emisfero appiattito in PFA (mobile) per 24 h in un agitatore a 4 ° C.
Nota: Si ottengono migliori risultati per colorazioni istochimiche attività quando si utilizza 1% PFA. Per altre colorazioni, come immunohistochemistry, al posto del cervello non perfusi, 2% PFA può essere utilizzato.
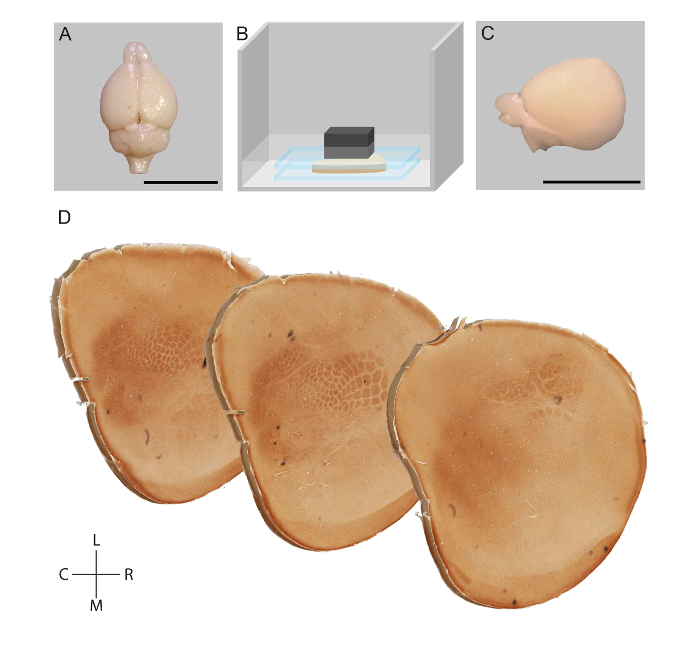
Figura 1: rappresentazione schematica del flusso di lavoro per l'appiattimento di un emisfero corticali del ratto e la visualizzazione dei moduli nella corteccia somatosensoriale. Successivamente la perfusione di perfusione, il cervello di un topo è stato dissecato (A). Strutture subcortical sono stati rimossi e corteccia è stato appiattito fra due vetrini in tampone fosfato (B). Appiattito emisfero (C) era post-fisso, tangenzialmente sezionato e macchiato per attività dell'ossidasi del citocromo (D). Scala bar = 1 cm. r: rostrale, c: Caudal, l: laterale, m: mediale. Figura adattata da Lauer et al. 23 Clicca qui per visualizzare una versione più grande di questa figura.
3. taglio di sezioni tangenziali
Nota: A seconda delle esigenze dei protocolli di colorazione, la procedura di taglio e lo spessore possono essere adattati. Un vibratomo è stato usato per tagliare gli emisferi per un'ulteriore elaborazione istochimica (punto 3.2) a 80-150 µm. Tuttavia, per l'elaborazione di immunohistochemical, sezioni più sottili sono desiderati e un congelamento microtomo è stato usato per sezionamento (punto 3.3) a 10-60 µm. Guarda il Video 1.
- Lavare l'emisfero appiattito in PB (0.1 m; pH 7.4) per 15 min.
- Tagliare l'emisfero su un vibratomo.
- Mettete l'emisfero tangenzialmente sul supporto per affettare. Facoltativamente, premere di nuovo delicatamente con un vetrino prima di fissarla in posizione (ad es., con colla a presa rapida).
Nota: Ridurre al minimo la quantità di colla utilizzata, perché gli artefatti di taglio potrebbero essere causa il piccolo spessore degli emisferi appiattiti. - Tagliare l'emisfero dall'estremità più spessa e più stabile verso l'estremità più sottile (posteriore a anteriore, qui) lo spessore desiderato. Procedere al punto 3.4.
Nota: Se le concentrazioni basse di fissazione sono state usate, tagliato ad una velocità lenta e un'elevata ampiezza.
- Mettete l'emisfero tangenzialmente sul supporto per affettare. Facoltativamente, premere di nuovo delicatamente con un vetrino prima di fissarla in posizione (ad es., con colla a presa rapida).
- Tagliare l'emisfero su un congelamento microtomo.
- Cryoprotect il cervello immergendolo in una soluzione di saccarosio al 30% (in PB) fino a quando si affonda.
Nota: A seconda delle dimensioni del tessuto essere prelevate, affondando nella soluzione può variare da poche ore ad alcuni giorni. Per i più grandi cervelli crioprotezione alternativi metodi potrebbero essere considerati (Vedi Antonella et al. 16). - Formare un ghiaccio base del congelamento microtomo per montare il cervello. Costruire il base di ghiaccio di congelamento PB sul viso di blocco del congelamento microtomo. Critico: Assicurarsi che la superficie della base del ghiaccio sia parallela alla lama del microtomo. Per effettuare questa operazione, tagliare il ghiaccio vuoto base utilizzando la lama del microtomo per allineare esattamente la base di ghiaccio parallela alla superficie di taglio.
- Incorporare il cervello in mezzo di congelamento e montarlo sul viso di blocco del microtomo con l'area di interesse parallelo alla faccia del blocco. Faccia la superficie pial del cervello verso la faccia di blocco del microtomo. Critica: Regolare la temperatura di congelamento a seconda delle dimensioni del campione; temperature più elevate assicurano migliore sezione integrità durante il sezionamento, ma più grandi sezioni richiedono temperature più basse per congelare il campione in modo uniforme.
- Tagliare il cervello tangenzialmente allo spessore richiesto (velocità di taglio più lento e uniforme risultato nella migliore qualità di sezione).
- Cryoprotect il cervello immergendolo in una soluzione di saccarosio al 30% (in PB) fino a quando si affonda.
- Lavare le sezioni in PB per 15 minuti su un agitatore.

Video 1: video schematico della tangenziale di sezionamento da una corteccia di entorhinal mediale del ratto e il layout dei moduli Parasubiculare ed entorinale. La corteccia di entorhinal mediale di un cervello del roditore è situata all'estremità posteriore della corteccia ed è inclinata verso il lato mediale e ventrale. Sezioni tangenziali sono ottenute con un coltello lungo questo angolo di orientamento. Di conseguenza, colorazione specifica cellula-tipo appropriato rivela strutture modulari nella corteccia di entorhinal mediale e Parasubiculare adiacente. Video tratto da Ray e Brecht8. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)
4. visualizzazione dei moduli corticali usando la macchiatura dell'ossidasi del citocromo
Nota: Diversi protocolli di colorazione sono stati sviluppati per il rilevamento di istochimica di attività dell'ossidasi del citocromo, ad es., in primo luogo da Wong-Riley17 e successivamente modificati da Divac et al. 18 il presente protocollo è basato su quello di Divac et al. 18, poiché l'uso di solfato di nichel-ammonio (NiAS) si traduce in un maggiore contrasto e meglio definiti moduli in aree corticali macchiate.
- Preparare il citocromo ossidasi soluzioni di colorante (Vedi Divac et al. 18). per 10 mL di soluzione, aggiungere: 10 mL di tampone HEPES (0,1 M, pH 7.4), 400 mg di saccarosio, 12,5 mg NiAS, citocromo C, 6mg diaminobenzidina (DAB) di 2 mg.
Attenzione: DAB e NiAS sono cancerogene.
Nota: Aggiungere DAB appena prima dell'incubazione delle sezioni. - Lavare le sezioni nel tampone HEPES (0,1 M, pH 7.4) su un agitatore per 15 min.
- Incubare le sezioni nella soluzione colorante a temperatura ambiente in un agitatore.
Nota: Osservare la velocità della colorazione. Se non c'è nessuna reazione visibile, modificare in incubazione a 37 ° C. A seconda della quantità di fissazione, la colorazione può essere osservata dopo 10 min o in diverse ore. - Fermare la reazione aggiungendo 4% PFA; Questo impedisce indesiderate ri-morire e aumento del segnale di fondo.
- Lavare le sezioni tre volte utilizzando tampone HEPES per 10 min.
- Montare e asciugare le sezioni sulle lastre di vetro.
- Disidratare le sezioni con una riga di alcol crescente:
- Lavare i vetrini in etanolo al 60% per 1 min. lavare i vetrini in etanolo di 80% per 1 min. lavare i vetrini in etanolo al 96% per 2 min. lavare i vetrini in etanolo al 100% per 3 min. lavare i vetrini in isopropanolo per 5 min. lavare i vetrini in xilene per 5 min.
- Immediatamente aggiungere un mezzo di montaggio a indurimento rapido e un vetrino coprioggetti. Critica: Non usare mezzi di montaggio a base acqua, come NiAS sarà lavato e degradare la colorazione.
- Mantenere le sezioni a 4 ° C per la conservazione a lungo termine.
5. visualizzazione dei moduli corticali usando la macchiatura Immunohistochemical
Nota: Protocolli multipli sono disponibili per l'immunoistochimica, ottimizzato per il campione e il tipo di sonda. Gli adattamenti possono essere fatto come richiesto, dalla variazione delle concentrazioni di anticorpi, agenti permeabilizing e tempi di incubazione. Il seguente protocollo porta a buoni risultati per la rilevazione di una vasta gamma di anticorpi e la visualizzazione di sonde fluorescenti.
- Lavare le sezioni in PBS (0,1 M; pH 7.4) per 15 min.
- Facoltativo: Eseguire ricupero dell'antigene per smascherare un epitopo usando un bagno di acqua (basato su Jiao et al. 19; per metodi alternativi, vedere Pileri et al. 20).
- Preriscaldare un bagno di acqua a 80 ° C. Preparare tri-sodio citrato buffer19 (pH 8.0) e preriscaldarlo nel bagno d'acqua a 80 ° C.
- Trasferire le sezioni in tampone citrato tri-sodio. Incubare le sezioni per 30 min a 80 ° C
- Raffreddare le sezioni fino a temperatura ambiente
- Lavare le sezioni in PBS per 15 min.
- Lavare le sezioni due volte in PBS-X (0,5% Triton-X, in 0.1 M PBS) per 15 min.
- Bloccare gli epitopi aspecifici incubando le sezioni in una soluzione di albumina di siero bovino (BSA; 2,5%) e Triton-X (0,75%) in PBS per 2 h.
- Incubare le sezioni in anticorpo primario, ad esempio, calbindina - D28k (1:5, 000, 1% BSA in PBS-X), per 2-3 giorni su un agitatore a 4 ° C.
Nota: Una diluizione ottimale per l'anticorpo primario dipende l'anticorpo specifico utilizzato. Fare riferimento alle informazioni del fabbricante per ottenere criteri di diluizione per un anticorpo specifico. Anticorpi multipli possono essere utilizzati insieme, ma devono essere sollevati contro diverse specie. - Lavare le sezioni tre volte in PBS per 15 minuti ciascuno.
- Incubare le sezioni pernottamento in anticorpo secondario (1: 200, 1% BSA in PBS) a 4 ° C in un agitatore.
Nota: Più anticorpi secondari possono essere utilizzati a differenti spettri se gli anticorpi primari multipli sono stati usati. - Lavare l'anticorpo secondario lavando le sezioni tre volte in PBS per 10 minuti ciascuno.
- Montare e asciugare le sezioni su un vetrino per microscopio.
Nota: Le sezioni devono ancora essere umide prima di montare il vetrino coprioggetto. - Applicare liquido di montaggio adatto per fluorescenza coloranti su sezioni di tessuto e applicare un vetrino coprioggetti.
- Asciugare le sezioni per 1 h.
- Per l'archiviazione a lungo termine, sigillare il coprioggetto con smalto e tenere al buio a 4 ° C.
Risultati
Abbiamo ottenuto sezioni appiattite corticali della corteccia somatosensory in una varietà di cervelli ed elaborato li per la citocromo ossidasi istochimica visualizzare i moduli somatotopica che rappresenta diverse parti del corpo. Questo approccio comparativo permette di studiare le forze evolutive che corteccia forma, ad esempio, risultati altamente conservata rappresentazione delle vibrisse baffi in roditori e lagomorpha come botti21 (
Discussione
Modularità nella corteccia cerebrale è stato identificato usando una varietà di tecniche. I primi studi in genere identificati corticale moduli o visualizzando delle cellule dense regioni, o un'assenza di fibre1. I metodi successivi hanno utilizzato la presenza di fasci dendritiche24, afferenze da una particolare regione25, o l'arricchimento di neurotrasmettitori26. Qui dimostriamo due tecniche, l'istochimica (i) del citocr...
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato da Humboldt Universität zu Berlin, il Bernstein Center for Computational Neuroscience Berlino, il centro tedesco per Malattie Neurodegenerative (DZNE), il Ministero federale tedesco dell'istruzione e ricerca (BMBF, Förderkennzeichen 01GQ1001A), NeuroCure e Gottfried Wilhelm Leibniz premio del DFG. Ringraziamo Shimpei Ishiyama per la progettazione grafica eccellente e Juliane Diederichs per l'eccellente assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Cytochrome oxidase staining | |||
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| 3,3'Diaminobenzidine tetrahydrochloride hydrate | Sigma-Aldrich | D5637 | |
| D(+)-Saccharose | Carl Roth | 4621.1 | |
| Ammonium nickel(II) sulfate hexahydrate | Sigma-Aldrich | A1827 | |
| HEPES | Carl Roth | 9105.4 | |
| Name | Company | Catalog Number | Comments |
| Antigen retrieval | |||
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | |
| Citric acid monohydrate | Sigma-Aldrich | C1909 | |
| Name | Company | Catalog Number | Comments |
| Phosphate buffer/phosphate-buffered saline/prefix/PFA | |||
| Potassium dihydrogen phosphate | Carl Roth | 3904.2 | |
| Sodium chloride | Carl Roth | 9265.1 | |
| Di-Sodium hydrogen phosphate dihydrate | Carl Roth | 4984.3 | |
| Paraformaldehyde | Carl Roth | 0335.3 | |
| TRITON-X 100 | Carl Roth | 3051.3 | |
| Name | Company | Catalog Number | Comments |
| Immunohistochemistry | |||
| Calbindin D-28k puriefied from chicken gut, Mouse monoclonal | Swant | RRID: AB_10000347 | |
| Calbindin D-28k from recombinant rat calbindin D-28k, Rabbit polyclonal | Swant | RRID: AB_10000340 | |
| Albumin Fraction V, biotin free | Carl Roth | 0163.4 | |
| Name | Company | Catalog Number | Comments |
| Mounting or freezing media | |||
| Fluoromount (immunofluorescence) | Sigma-Aldrich | F4680 | |
| Eukitt (histochemistry) | Sigma-Aldrich | 03989 | |
| Tissue freezing medium | Leica Biosystems | NC0696746 | |
| Name | Company | Catalog Number | Comments |
| Alcohol dehydration | |||
| Ethanol 100% | Carl Roth | 9065.3 | |
| Ethanol 96% | Carl Roth | P075.3 | |
| 2-Propanol | Carl Roth | 6752.4 | |
| Xylene substitute | Fluka | 78475 | |
| Name | Company | Catalog Number | Comments |
| Devices/tools | |||
| Microm HM 650V | Thermo Scientific | ||
| Jung RM2035 | Leica Biosystems | ||
| Dumont #55 Forceps - Inox | Fine Science Tools | 11255-20 | |
| Dumont #5 Forceps - Inox Biology Tip | Fine Science Tools | 11252-30 | |
| Dumont #5SF Forceps - Inox Super Fine Tip | Fine Science Tools | 11252-00 | |
| Bone Shears - 24 cm | Fine Science Tools | 16150-24 | |
| Friedman Rongeur | Fine Science Tools | 16000-14 | |
| Blunt Scissors | Fine Science Tools | 14000-18 | |
| Surgical Scissors - Large Loops | Fine Science Tools | 14101-14 | |
| Surgical Scissors - Sharp-Blunt | Fine Science Tools | 14001-13 | |
| Fine Iris Scissors | Fine Science Tools | 14094-11 |
Riferimenti
- Brodmann, K. . Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues. , (1909).
- Naumann, R. K., et al. The reptilian brain. Curr Biol. 25 (8), R317-R321 (2015).
- Kaas, J. H. Evolution of columns, modules, and domains in the neocortex of primates. Proc Natl Acad Sci U S A. 109 (Supplement 1), 10655-10660 (2012).
- Woolsey, T. A., Van der Loos, H. The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex: the description of a cortical field composed of discrete cytoarchitectonic units. Brain Res. 17 (2), 205-242 (1970).
- Naumann, R. K., Ray, S., Prokop, S., Las, L., Heppner, F. L., Brecht, M. Conserved size and periodicity of pyramidal patches in layer 2 of medial/caudal entorhinal cortex. J Comp Neurol. 524 (4), 783-806 (2016).
- Ray, S., Naumann, R., Burgalossi, A., Tang, Q., Schmidt, H., Brecht, M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 343 (6173), 891-896 (2014).
- Wong-Riley, M. T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. Trends Neurosci. 12 (3), 94-101 (1989).
- Ray, S., Brecht, M. Structural development and dorsoventral maturation of the medial entorhinal cortex. Elife. 5, e13343 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- . Phosphate-buffered saline (PBS). Cold Spring Harb. Protoc. , (2006).
- Olson, S. T., Chuang, Y. J. Heparin activates antithrombin anticoagulant function by generating new interaction sites (exosites) for blood clotting proteinases. Trends Cardiovasc Med. 12 (8), 331-338 (2002).
- . Paraformaldehyde (PFA; 4%). Cold Spring Harb. Protoc. , (2009).
- . Sodium phosphate (PB). Cold Spring Harb. Protoc. , (2006).
- Sincich, L. C., Adams, D. L., Horton, J. C. Complete flatmounting of the macaque cerebral cortex. Visual Neurosci. 20 (6), 663-686 (2003).
- Tootell, R. B., Silverman, M. S. Two methods for flat-mounting cortical tissue. J Neurosci Methods. 15 (3), 177-190 (1985).
- Rosene, D. L., Roy, N. J., Davis, B. J. A cryoprotection method that facilitates cutting frozen sections of whole monkey brains for histological and histochemical processing without freezing artifact. J Histochem Cytochem. 34 (10), 1301-1315 (1986).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Divac, I., Mojsilovic-Petrovic, J., López-Figueroa, M. O., Petrovic-Minic, B., Møller, M. Improved contrast in histochemical detection of cytochrome oxidase: metallic ions protocol. J Neurosci Methods. 56 (2), 105-113 (1995).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Pileri, S. A., et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 183 (1), 116-123 (1997).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of the SmL face cortex with special reference to the occurrence of "barrels" in layer IV. J Comp Neurol. 164 (1), 79-94 (1975).
- Krubitzer, L. The organization of neocortex in mammals: are species differences really so different?. Trends Neurosci. 18 (9), 408-417 (1995).
- Lauer, S. M., Lenschow, C., Brecht, M. Sexually selected size differences and conserved sexual monomorphism of genital cortex. J Comp Neurol. , (2017).
- Fleischhauer, K., Petsche, H., Wittkowski, W. Vertical bundles of dendrites in the neocortex. Anat Embryol. 136 (2), 213-223 (1972).
- Bernardo, K. L., Woolsey, T. A. Axonal trajectories between mouse somatosensory thalamus and cortex. J Comp Neurol. 258 (4), 542-564 (1987).
- Ray, S., Burgalossi, A., Brecht, M., Naumann, R. K. Complementary Modular Microcircuits of the Rat Medial Entorhinal Cortex. Front Syst Neurosci. 11, (2017).
- Livingstone, M. S., Hubel, D. H. Thalamic inputs to cytochrome oxidase-rich regions in monkey visual cortex. Proc Natl Acad Sci U S A. 79 (19), 6098-6101 (1982).
- Land, P. W., Simons, D. J. Cytochrome oxidase staining in the rat SmI barrel cortex. J Comp Neurol. 238 (2), 225-235 (1985).
- Welker, C., Woolsey, T. A. Structure of layer IV in the somatosensory neocortex of the rat: description and comparison with the mouse. J Comp Neurol. 158 (4), 437-453 (1974).
- Retzius, G. Die Cajal'schen zellen der grosshirnrinde beim menschen und bei säugetieren. Biol Unters. 5, 1-9 (1893).
- Cajal, S. R. . Histologie du Systeme Nerveux de l'Homme et des vertébrés. , (1911).
- Chapin, J. K., Lin, C. S. Mapping the body representation in the SI cortex of anesthetized and awake rats. J Comp Neurol. 229 (2), 199-213 (1984).
- Löwel, S., Freeman, B., Singer, W. Topographic organization of the orientation column system in large flat-mounts of the cat visual cortex: A 2-deoxyglucose study. J Comp Neurol. 255 (3), 401-415 (1987).
- Tang, Q., et al. Functional architecture of the rat parasubiculum. J Neurosci. 36 (7), 2289-2301 (2016).
- Snyder, J. P. . Map projections--A working manual (Vol. 1395). , (1987).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Renier, N., Wu, Z., Simon, D. J., Yang, J., Ariel, P., Tessier-Lavigne, M. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon