Method Article
单分子力谱中蛋白质共价固定化的研究
* 这些作者具有相同的贡献
摘要
本协议描述了 heterobifunctional 硅烷偶联剂在硅氧化物表面上的共价固定化, 其作用是以原子力显微镜为基础的单分子力光谱学为例。RrgA (pilus-1 尖黏附)与纤连蛋白的相互作用。
摘要
近年来, 原子力显微镜 (AFM) 基于单分子力谱 (smf) 扩展了我们对分子性质和功能的理解。它使我们有机会探索生物物理机制的多样性,例如, 细菌 adhesins 如何更详细地绑定到宿主表面受体。除其他因素之外, smf 实验的成功取决于固体表面和 AFM 尖端的生物分子的功能性和本地固定性。在这里, 我们描述了一个简单的协议, 蛋白质与硅表面的共价耦合, 用硅烷-PEG-羧基和建立良好的 n-hydroxysuccinimid/1-3-(3-二甲基氨基丙基) carbodiimid (EDC/NHS) 化学, 以目的探讨 pilus-1 黏附 RrgA 与细胞外基质蛋白纤维结合体 (Fn) 在革兰阳性菌肺炎链球菌中的相互作用。我们的结果表明, 表面功能化导致 Fn 在玻璃表面的均匀分布, 并在 AFM 悬臂尖的适当浓度 RrgA, 明显的目标值高达20% 的互动事件在 smf测量和揭示, RrgA 绑定到 Fn 的平均力量 52 pN。该协议可以调整到夫妇通过网站特定的自由硫醇组。这将导致预定义的蛋白质或分子方向, 并适用于除 smf 之外的其他生物物理应用。
引言
在光学和磁性镊子旁边, 原子力显微镜 (AFM)1,2已经成为一个有用的工具来分析和操纵分子和探测它们的性质和功能, 包括它们对外力的反应3 ,4。与酶联免疫吸附试验 (ELISA)、表面等离子体共振 (SPR) 或石英晶体天平 (QCM) 设置的方法相比, AFM 允许测量单分子 (smf)5和单细胞水平 (SCFS) 6 的相互作用..这些技术对诸如大肠杆菌pilus 蛋白 FimH 与甘露糖7的相互作用、或由金黄色葡萄球菌结合蛋白形成的串联β拉链重复等约束机制有很有价值的洞察力。绑定到 Fn8时。我们最近能够表明, pilus-1 黏附 RrgA9,10从革兰氏阳性菌肺炎链球菌(肺炎)11能够绑定到纤连蛋白12它的两个终端域。这揭示了一个新的双域绑定机制, 它不同于串联β拉链, 并可能使 piliated 肺炎球菌形成和保持一个瞬态接触到纤维连接蛋白-包含主机表面13。
smf 实验的成功取决于固体表面和 AFM 尖端的生物分子的功能性和本地固定性。由于在 smf 测量过程中可能发生高作用力, 因此蛋白质最好是共价键耦合到表面。有许多不同的联结方法为固定化蛋白质和其他生物分子, 并且整个细胞在 (无机) 固体表面, 纳米微粒和其他设备描述在文献14,15 ,16,17,18,19,20,21,22,23,24, 25,26,27。这些协议经常使用有害物质, 很难执行和/或需要特殊设备 (例如, 等离子清洗器)。将分子与玻璃结合的一个简单方法是, 将 heterobifunctional 交联剂的较厚的聚合物层附着在一侧的硅烷反应基团上, 另一侧为胺反应基团。根据应用情况, 偶联剂可以包括可变长度的柔性水碳链,如polyethylenglycol (PEG)。它们压制修饰表面的非特定相互作用 (如疏水性、静电和 van-范德华相互作用), 并可提供耦合分子旋转自由。
在这里, 我们描述了一个通用的协议, 包括一个或多个自由氨基组 (-NH2) 的蛋白质共价耦合的玻璃表面和氮化硅 AFM 小贴士通过heterobifunctional 乙氧基硅烷-PEG-羧基 (-COOH)。该协议可用于 smf 实验, 这是基于 RrgA 和细胞外基质蛋白 Fn 相互作用的例证 (见图 1为概览)。
第一步是表面的硅烷化28,29,30,31。它涉及偶联剂中乙氧基基团的水解, 以形成高活性的 SiOH 基团。这些可能与基板上的 SiOH 组发生反应。在最初的凝结步骤中, 这些 silanols 形成氢键并在基体上扩散。在二次冷凝反应 (通常需要热量或真空去除水), 硅氧烷债券形成。这导致在共价键附上有机硅烷层数。
第二步是蛋白质与功能 (-COOH) 组的耦合, 从聚合物32扩展。首先, 酸转化为反应性 n-hydroxysuccinimid (nhs) 酯中间体, 这是通过建立良好的 nhs/EDC (1-乙基 3-3-dimethylaminopropyl) carbodiimid 化学33 , 并进行亲核替代最后形成一个酰胺键与主要胺在蛋白质。
这样, RrgA 被耦合到氮化硅原子力显微镜的尖端和人类 Fn 到玻璃基底上的随机方向和他们的相互作用的力量, 分析了单一分子水平。我们的研究结果表明, 所描述的表面化学导致 Fn 在玻璃表面的均匀分布和在尖端的适当浓度的 RrgA, 明显的目标值20% 的互动事件在 smf 测量。这种化学减少了非特定的背景相互作用, 在数据采集过程中很少发生变化, 因此非常适合于精确的 smf 实验。
研究方案
1.通过功能性硅烷偶联剂固定蛋白质
注:图 1给出了在本协议中应用的表面化学的概述。
注意: 在下面的协议中, 使用具有腐蚀性和皮肤刺激性特性的不同化学物质。在准备解决方案时, 应佩戴足够 (耐酸) 手套、安全护目镜和实验室外套, 并在通风罩下工作, 以避免吸入蒸汽。
- 硅烷偶联剂对玻璃表面和氮化硅悬臂的功能化研究
- 用异丙醇和无起毛的精密湿巾去除玻璃滑块中的粗尘和污染物, 并切割所需尺寸的幻灯片 (可选)。
注: 在玻璃旁边, 固体表面可以是二氧化硅、石英和铝、铜、锡、钛、铁、铬、锆、镍、锌等氧化物。
注意: 切割玻璃幻灯片可能会造成尖锐的边缘。 - 将玻片放在充满盐酸 (33% HCl) 的染色罐中, 用双蒸馏水 (ddH2O) 稀释至 3-5% (v/v), 用适当的盖子关闭罐子, 在室温下将其放在超声波浴中90分钟。
注: 所用的罐子直径为6厘米, 近似大小为65-70 毫升。适量的稀释 HCl 为罐是50毫升含有5毫升 33% HCl 和45毫升的 ddH2O。HCl 有效地去除无粘结金属离子, 特别是钠、钾和钙, 并降低硅以产生羟基饱和玻璃表面。
注意: HCl 具有腐蚀性和皮肤刺激性。在准备溶液时, 应佩戴适当的耐酸手套、安全护目镜和实验室外套, 并在通风罩下工作, 以避免吸入蒸气。 - 将氮化硅 AFM 悬臂探头放在一个干净的玻璃滑块上, 顶端朝上, 上面的紫外线照射至少90分钟。
注: 对于单分子力谱, 悬臂与公称弹簧常数0.01 到 0.1 N m-1是适当的。用紫外光照射悬臂表面, 可以去除有机污染物, 主要是脂肪物质, 并使其在一侧有亲水性。如果另一侧受到严重污染--不应该是这种情况, 或者如果悬臂探头是从供应商箱中新鲜使用的, 它可能会影响 smf 的测量。在许多研究34中使用的食人鱼溶液彻底清洗整个悬臂芯片可能有帮助。
注意: UV 光对眼睛有害;因此, 在紫外光防渗室中应进行悬臂探头的辐照。食人鱼溶液具有极强的反应性, 可燃烧皮肤、纸张等有机物质。不要使用塑料容器。如果放在盘子或罐子里, 即使有少量的有机表面污染物 (例如, 从以前的使用), 它可能会迅速反应。 - 在染色罐中用 ddH2O 代替盐酸, 不让玻璃表面干燥, 再将罐子放回超声波浴中, 再换10分钟. 分别更换两次水, 以适当冲洗盐酸。酸。
- 同时, 将乙氧基硅烷聚乙二醇酸 (Si (OC2H5)3-COOH) 混合在乙醇和 ddH2O (v/v 95%/5%, pH 4.6 调整为乙酸) 到最终浓度0.1 毫克毫升-1。贮存溶液密封, 以避免乙醇的蒸发。
注: 硅烷偶联剂对水分和温度敏感。因此, 它们应储存在惰性气体 (N2), 在低温 (-20 °c) 和在干燥条件下。在打开烧瓶之前, 确保烷已经达到室温, 以最小化水化, 从而使反应基团钝化。Heterobifunctional PEG 偶联剂可提供多种不同的功能组和不同的间隔长度。对于通过游离氨基酸组 (NH2) 进行随机固定的蛋白质, 如本协议所述, 乙氧基硅烷的附加功能组必须是 NHS 酯。除了购买的硅烷剂与 nhs 酯, 一个简单的方法获得这样的 nhs 酯是激活一个羧基组 (-COOH) 与 1-乙基 3-(3-dimethylaminopropyl) carbodiimid (EDC) 和 NHS (见 1.2.1. 和 1.2.2)。
注意: 乙醇是易燃的, 皮肤刺激性。醋酸是易燃和腐蚀性的。注意不要把反应烷到皮肤上或眼睛里。佩戴足够的手套、安全护目镜和实验室外套, 在通风罩下工作, 以避免吸入蒸汽。 - 将硅烷溶液倒入两个独立的培养皿中, 分别将准备好的悬臂探头和玻璃片放在一个培养皿中, 密封 (如parafilm), 以避免乙醇蒸发, 在90分钟内孵化静止。室温。
注: 培养皿的最佳尺寸取决于悬臂探头的数量和应具有功能性的玻璃滑梯的尺寸。直径大小为好处理和低试剂容量是50-60 毫米。为避免在穿透空气水界面时悬臂弯曲, 悬臂应在90°角与空气-水界面保持。玻璃滑梯 (而不是悬臂探头) 的孵化可以选择在轨道振动筛上进行。 - 在连续三烧杯中, 用纯乙醇冲洗悬臂和玻璃片, 完全冲洗掉未绑定的硅烷化合物。
注: 为避免悬臂在穿透空气水界面时产生不理想的弯曲, 应在90°角度举行悬臂。 - 将功能化的玻璃幻灯片放在染色罐和悬臂上的清洁玻璃滑动和治疗在110°c 30 分钟。
注意: 热固化会导致共价硅氧烷键的形成和水的去除。由于玻璃幻灯片只是在一侧的功能, 确保正确地表明涂层的一面。 - 将硅烷化玻璃样品和悬臂探头存放在真空干燥中长达一周。
注意: 协议可以在这里暂停。
- 用异丙醇和无起毛的精密湿巾去除玻璃滑块中的粗尘和污染物, 并切割所需尺寸的幻灯片 (可选)。
- 硅烷化玻璃与氮化硅悬臂上蛋白质的随机固定化
注: 为了避免悬臂的弯曲, 在穿透任何空气-水界面时, 悬臂探头应在90°角度举行。- 在标准磷酸盐缓冲盐水 (PBS; 137 毫米氯化钠, 2.7 毫米氯化钾, 10 毫米 Na2HPO4, 1.8 毫米, 20 毫升2, pH 4) 中, 准备一个含有42毫克 ml-1和毫克 ml-1 NHS 的溶液.
注意: EDC 具有腐蚀性和皮肤刺激性, 会引起严重的眼部损伤。佩戴足够的手套、安全护目镜和实验室大衣。 - 用溶液覆盖硅烷涂层玻璃片, 并在硅烷化和 NHS 溶液中放置悬臂探头, 室温下孵化10分钟。
注: 对于悬臂探头的孵化, 原悬臂箱是合适的。为了将蛋白质通过他们的游离氨基酸组羧基 (-COOH) 的 heterobifunctional 硅烷 PEG 剂, COOH 组被激活与广泛使用的 EDC/NHS 化学。医疗保健夫妇对羧酸, 形成一个 "稳定的" nhs 酯, 使有效共轭的主要胺在生理 pH 值的下一步。 - 在连续三烧杯中, 用 PBS 彻底冲洗悬臂和玻璃滑块, 以彻底冲洗掉过量的亚健康保险。
注意: 这个洗涤步骤是至关重要的, 因为剩余的 EDC/NHS 可以交联蛋白, 从而改变其功能。 - 在室温下的湿室中, 在所需的蛋白质溶液的水滴中孵化出活化的玻璃滑块和悬臂探头。蛋白质浓度和培养时间应适应实验要求。一般情况下, 浓度介于0.5 至1毫克毫升-1之间, 潜伏期从30分钟到2小时, 适用于大多数蛋白质。在纤维连接蛋白 (玻璃滑动) 和 pilus-1 尖端蛋白质 RrgA (悬臂) 的情况下, 摩尔浓度分别为1.5 µM 和3µM, 孵化时间为2小时。
- 在三连续烧杯中, 用 PBS 彻底清洗玻璃滑梯和悬臂探头, 以清除未绑定的蛋白质。
- 在室温下将探针放入三缓冲盐水 (tb; 50 毫米三, 150 毫米氯化钠, pH 7.6) 上, 使剩余的 NHS 酯与三 (羟甲基) aminomethan 饱和。
注意: 这一步减少了在 AFM 尖端和玻璃的功能表面之间的不期望的蛋白质共价键耦合, 因为三个氨基组可以绑定到悬臂和基板表面上剩余的活化 COOH 组。 - 用 pbs 彻底清洗玻璃滑梯和悬臂探头, 并将其存储在 pbs 中的单独的培养皿中, 直到使用。
注: 样品应新鲜准备, 并在同一天使用。
- 在标准磷酸盐缓冲盐水 (PBS; 137 毫米氯化钠, 2.7 毫米氯化钾, 10 毫米 Na2HPO4, 1.8 毫米, 20 毫升2, pH 4) 中, 准备一个含有42毫克 ml-1和毫克 ml-1 NHS 的溶液.
2. 基于原子力显微镜的单分子力谱法
注: 在这项工作中, 使用了 JPK 仪器的原子力显微镜, 用力 RampDesigner 定义了获得力距离曲线的设置 ups。
- 用热噪声法进行悬臂标定35
注: 对于悬臂校准, 请按照制造商手册中的步骤操作。大多数悬臂供应商的状态是一个近似的弹簧常数, 通常由公称悬臂形状 (长度、宽度、厚度) 计算, 因此不太可靠。由于正确的弹簧常数是至关重要的, 因此, 最好进行三种以上描述的悬臂标定, 并使用光杠杆灵敏度和弹簧常数的平均值。利用光杠杆灵敏度和弹簧常数均值, 在实验过程中用伏特 (V) 的方法记录悬臂挠度, 并将其转换为力 (pN) 是很有用的。在实验之前和/或之后, 只要激光位置在悬臂上没有改变 (在光电二极管上可以重新调整反射激光器的位置), 就可以确定弹簧常数和光学杠杆灵敏度。- 在 AFM 样品架上固定一个干净的, 新鲜的玻璃滑块, 并用 PBS 缓冲器盖住它。
注: 校准应在硬表面 (如玻璃) 上进行, 并在与实际实验相同的缓冲区中进行。 - 将准备好的悬臂探头固定在悬臂架上, 将其放在 AFM 头中, 用一滴 PBS 缓冲液仔细地将悬臂拖干。
注: 悬臂的润湿减少了在校准玻片上的 PBS 缓冲器穿透过程中出现的表面张力, 从而降低了悬臂的不良弯曲。 - 慢慢地将悬臂移动到校准表面, 直到悬臂完全浸入 PBS 缓冲器, 但仍远离校准表面。
- 使用 afm 的上观光学显微镜或 (如果可用) 显微镜下的倒置镜将 afm 的激光定位在悬臂的背面。将激光光斑置于悬臂的末端附近, 靠近尖端的位置。
注: 激光光斑应位于悬臂末端附近, 但仍应完全在悬臂上。如果没有光学显微镜可用, 使用一张纸为可见光激光二极管或激光探测器卡为红外激光二极管, 把它放在 AFM 头下面, 将激光点移向悬臂芯片的边缘, 在其中悬臂位于, 直到你看到纸张或探测器卡上的斑点。然后将激光平行移动到边缘。当斑点消失时, 它就在悬臂上。对于线性悬臂, 将该点移动到拉杆臂的末端, 直到它出现在纸张/探测器卡上并将其移回, 直到它再次在拉杆臂上 (从纸张/卡上消失)。对于三角形, 将点放在悬臂的两臂中间, 将其移动到悬臂的末端, 直到它从纸/卡上消失。通过将点垂直于悬臂长轴, 检查悬臂的中间。 - 调整原子力显微镜四象限探测器光电二极管的位置, 使反射的激光束定位在光电二极管的中心。
注: 按如下方式进行: 使用探测器二极管附近的千分尺螺钉将二极管移动到水平和垂直方向, 直到所有四象限的总和信号最大化为止。然后沿垂直方向移动二极管, 直到垂直偏转信号为零, 并在水平方向上移动二极管, 直到侧向偏转信号为零。氮化硅悬臂通常具有金镀层, 因此是双金属, 具有两种不同的热膨胀系数。这导致热漂移 (明显在垂直偏转信号) 特别是在解答。为了减少测量过程中的漂移, 在开始校准之前, 让整个系统平衡几分钟。 - 在 AFM 软件中打开校准管理器, 用热噪声法对悬臂的悬臂灵敏度和弹簧常数进行标定。
- 小心地接近基体表面并记录一个力-距离曲线。
- 通过将直线与缩进力曲线的最陡部分 (尖端与基板表面接触) 来确定在 nm/V 中的光学杠杆灵敏度。灵敏度使悬臂弹簧常数转换为 pN/nm。
注: 回缩曲线的斜率为压电行程距离与光电二极管电压的变化 (以 nm/V 为单位)。 - 记录几个悬臂的热噪声谱与悬臂约100µm 或更多远离表面, 以排除任何表面阻尼。
- 通过将 AFM 软件提供的谐振子与热噪声谱进行拟合, 确定 pN/V 悬臂的弹簧常数。
- 慢慢收回悬臂, 从溶液中取出。
- 用含有固定化蛋白的试样表面替代用于悬臂标定的玻璃表面。请确保悬臂和样品表面 (以及蛋白质) 在改变玻璃幻灯片时不干。
- 在 AFM 样品架上固定一个干净的, 新鲜的玻璃滑块, 并用 PBS 缓冲器盖住它。
- 单蛋白水平的相互作用力实验研究
- 慢慢地将湿悬臂移向试样表面, 直到悬臂完全由 PBS 缓冲器覆盖, 但仍远离基体表面。
注: 为了减少实验过程中的热漂移, 让整个系统设置几分钟后开始力谱测量。 - 在样品表面的不同位置接近表面并记录多力距离曲线 (≥ 500), 接触力为 250 pN, 接触时间为1秒, 收缩长度为2µm, 收缩速度为1µm s-1。
注: 一般力谱调整, 按照制造商手册。变化: 收缩速度可以在0.1 和5µm-1之间变化, 根据增加的力负荷计算动力学数据。相互作用的时间可以变化, 以分析时间依赖的债券强化。而不是保持缩回速度恒定, 你可能保持力量恒定 (力量夹子方式)。
- 慢慢地将湿悬臂移向试样表面, 直到悬臂完全由 PBS 缓冲器覆盖, 但仍远离基体表面。
- 数据分析
注: 使用数据处理软件进行数据分析。根据固定化的蛋白质, 接触时间或退缩速度, 无论足迹是被纳入或不和其他可变参数, 力距离曲线包含多个不同的信息。数据分析和解释在不同的 smf 实验之间可能相差很大, 因此不能在这里详细描述。对于 RrgA 和 Fn 的交互作用, 下面的协议可以作为分析 smf 数据的第一步。- 通过选择打开的批强制扫描图标并按如下方式处理力距离曲线, 打开测量的力曲线文件:
- 通过调整灵敏度和弹簧常数图标, 通过选择 (Re) 校准 V 偏转, 将悬臂偏转 (v) 转换为直接比例力 (F)。
注: 如果在实验前进行悬臂标定, 则将数值保存在力扫描文件中, 并在 V 型偏转校准过程中自动使用。如果在实验后进行校准, 软件将使用默认值, 可以将其更改为测量值。 - 从远离曲面的力曲线区域中减去缩进通道的基线, 通过选择图标基线减法来设置零力水平。
注: 在某些情况下, 缩进可能没有相同的恒定力值, 曲线可能显示线性倾斜, 可以通过选择偏移 + 倾斜来移除。 - 通过选择 "接触点确定" 图标, 定义笔尖与样本接触的点。
- 通过选择尖端样本分离图标, 将高度信号转换为刀尖样本分离。本程序除减去接触点位置外, 还可减去悬臂弯曲, 计算基体表面与 AFM 尖端之间的距离。
注: 对于拟合的聚合物弹性模型, 如可扩展的蠕虫样链模型, 以及相互作用长度的确定, 需要对悬臂弯曲的尖端试样分离进行修正。为了确定受力曲线斜率和 z 压电速度的载荷速率, 应采用未修正的力曲线。 - 在 70 nm (拉伸 PEG 间隔的长度)36的断裂长度上发生的力峰的距离迹线, 选择非特异的相互作用, 并将可扩展的蠕虫样链模型应用于选定的峰值, 方法是选取适合一个聚合物链模型图标, 并选择了可扩展的蠕虫样链模型。在收缩力曲线上的峰值将被拟合, 并得到断裂力和长度, 以及聚合物的弹性参数。
- 将数据显示为显示力和长度分布的直方图。对直方图至少使用100个解除绑定事件。
结果
这里描述的协议导致蛋白质的共价键固定化通过他们容易接近的主要胺以随机取向 (图 1)。图 2显示了一个硅烷化玻璃表面的 AFM 图像 (左) 和没有 (右) Fn 固定, 记录后脱水的样品在温和的氮气流。硅烷聚合物层数仅显示小表面波纹以大约2-5 毫微米的高度 (图 2, 正确), 而在表面官能化与 Fn, 大约10毫微米高 Fn 分子是明显的 (图 2, 左)。在特写中, 可以识别 Fn 的二聚体结构。Fn 分子似乎是紧凑的高度 4-5 毫微米以上的 PEG 表面涂层和长度约 120 nm (见插入)。
为了研究 RrgA 与 Fn 的相互作用, 最近我们的小组13详细描述了 RrgA, 并将其与氮化硅 AFM 尖端和人 Fn 耦合到玻璃基板上 (图 3a)。图 3显示了有代表性的尖端样品分离曲线的 RrgA 与 Fn 的相互作用记录在拉速1µm s-1。使用的表面化学导致了低背景相互作用和好形状的单一 (或双重) 相互作用事件 (图 3a), 使用可扩展的蠕虫象链子 (eWLC) 模型 (红色曲线) 安装。绘制拟合结果 (断裂力和-长度, 见图 4) 表明, 克服了 AFM 尖端和基体之间的非特定表面相互作用, 并拉伸 PEG 连接器 (> 70 nm), 多达19% 的力曲线显示破裂RrgA-Fn 相互作用的平均断裂力的事件-52 pN 在尖端-样品距离大约100毫微米。与此相反, 不适用的表面化学 (这里, 被省去的三个缓冲盐水图 3b) 将阻碍对单一相互作用事件的清楚的评估由于不特异的相互作用, 多蛋白质捆绑 (踪影2和 3) 和/或者样品表面与 AFM 悬臂尖端蛋白质的共价键耦合。这导致高断裂力量 (踪影 1) 可能伴随由蛋白质 (Fn) 领域的展开 (踪影4和 5)。
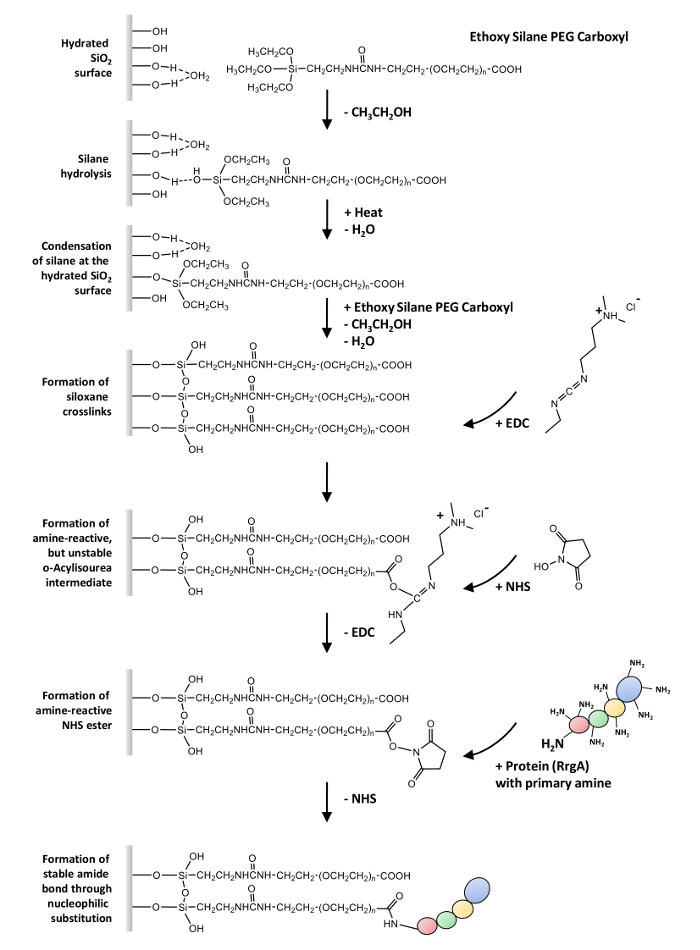
图 1: 概述在表面化学.乙氧基硅烷-PEG-羧基的水解, 其次是其在水合玻璃表面的凝结和硅烷 crosslinks 的形成。acylisourea 与羧基基团的反应导致了反应性o型--氨基-反应中间体, 在水溶液中具有极短的半衰期 (水解)。中间体是稳定的, 由一个 NHS 酯的形成, 经过亲核替代最终形成酰胺键与主要胺的蛋白质。请单击此处查看此图的较大版本.
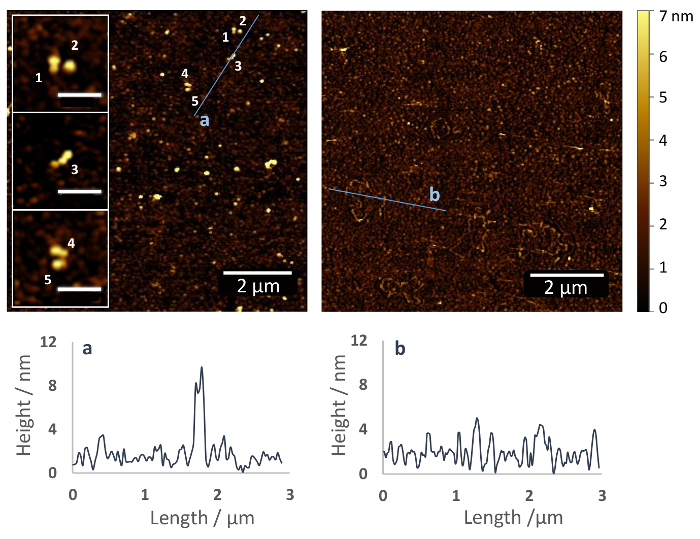
图 2:通过heterobifunctional 乙氧基硅烷 PEG 羧基偶联剂固定玻璃基体上的纤维连接蛋白。AFM 图像的功能性玻璃表面与 (左) 和没有 (右) fn. 数字表明单个 Fn 分子, 在基板表面 (插入) 均匀分布。分子采用二聚体和紧凑的结构, 高度为4-5 毫微米以上的 PEG 涂层和长度 > 100 nm。这类似于在解决方案中 Fn 的结构, 与以前在其他表面上的 AFM 数据一致,例如,云母 (嵌片 = 500 nm)37。在 afm 图像的下面, 是沿 afm 图像中所示直线的高度剖面。请单击此处查看此图的较大版本.
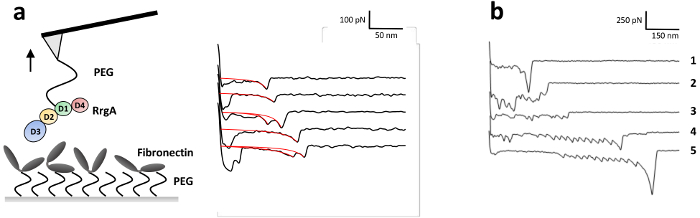
图 3: smf 实验的插图和 RrgA-Fn 相互作用的代表力距离曲线.(a) RrgA 和 Fn 分别通过heterobifunctional 乙氧基硅烷 PEG 羧基偶联剂连接到氮化硅 AFM 悬臂尖端和玻璃表面。显示了 RrgA-fn 相互作用的代表 smf 力距离曲线, 其1µm s-1的收缩速度与描述的 RrgA 和 Fn 的固定化有关。红色曲线代表了可扩展的蠕虫状链拟合, 用于获得断裂力和长度。这个数字已经从贝克,等等, ACSnano 201813。(b) 具有代表性的 smf 力距离曲线, 为 RrgA-Fn 相互作用而非用三缓冲盐水淬火。在这种情况下, 三的主胺是缺席的, 使剩余的活性 NHS 酯在实验中留下不饱和。这导致多蛋白质结合 (踪影2和 3) 和蛋白质夹紧在表面和 AFM 尖端导致高断裂力量伴随 (Fn) 领域展开 (踪影 1, 4 和 5; 注意不同的刻度)。请单击此处查看此图的较大版本.
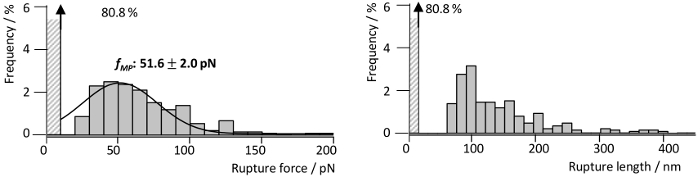
图 4: 单个 RrgA-Fn 相互作用的力和长度分布.断裂力和相应的断裂长度直方图从 RrgA-Fn smf 相互作用测量 (n = 1400) 在1µm s-1的缩回速度。直方图揭示了一个最可能的断裂力fMP 51.6 pN (高斯拟合, 黑线) 和累积的断裂长度约 100 nm。该图已从贝克, et, ACSnano, 201813修改。请单击此处查看此图的较大版本.
讨论
自采用 AFM 为基础的 smf 以来, 它发展成为一种广泛使用的技术, 直接探测单个蛋白质、核酸和其他生物分子3、4、5的内和分子间力。对于成功的 smf 实验, 适当的表面耦合策略是一个先决条件。为了探测天然和合成聚合物中的分子内作用力, 聚合物可以直接耦合到基体表面和 AFM 尖端36,38,39,40,41。然而, 对于分子间相互作用的研究, 例如分子键, 最好使用灵活的链接分子, 如异双 PEG 连接器或多肽链, 将相互作用的伙伴连接到 AFM 尖端和承印物表面, 为了允许正确的取向的结合伙伴, 克服短距离表面力和避免变性和展开的蛋白质21,22,23, 24,25,26,27,42。因此, 我们描述了一个简单和直接的前协议, 以共价键固定的蛋白质通过其可接触的主要胺使用异双 PEG 间隔。
我们证明了它的适用性, 研究黏附 RrgA 之间的相互作用的肺炎和细胞外基质蛋白 Fn, 最近详细描述了13。
表面化学的建立和分析和相似的方法已经成功地用于多个 smf 实验19,42,43,44,45。用于将硅烷聚合物与表面耦合的 silylether, 受水解。水解程度取决于形成的硅氧烷键的数量, 在硅烷化过程中可以控制。如果在 smf 测量过程中预期有高相互作用力 (≥ 1000 pN), 硅烷化应通过气相沉积30来完成, 从而形成连续的硅氧烷层。至于许多实验 (例如, 许多蛋白质-蛋白质相互作用), 相互作用的力量是在几个百 pN 范围之内, 并且被描述的做法, 硅氧烷形成由沉积从水阶段和未绑定有机烷用乙醇 (步 1.1.7) 冲洗, 然后用热固化 (步骤 1.1.8), 是足够的。
另一个关键步骤是将其余的1.2.3 和 NHS 分子从表面上清洗 (步进), 因为剩饭剩馀会导致蛋白质上的羧基基团活化。这可能会导致在同一表面上的蛋白质交联, 这可以改变其功能或共价键夫妇活化蛋白的其他蛋白质在相反的表面。这可能导致夹紧的蛋白质之间的表面和 AFM 尖端, 这导致高断裂力可能伴随的领域展开 (见图 3b, 跟踪 1, 4 和 5, 展开的 Fn 域)46。如果 PEG 间隔的活性 NHS 酯不饱和, 同样的问题也会发生。因此, 推荐用三缓冲盐水孵化 (步 1.2.6), 作为三止渴的主要胺的剩余氨基反应基团。
随着协议的逐步形成, 硅烷化玻璃表面的 Fn 的均匀分布 (见图 2), 留下了蛋白质的二聚体形式。这类似于解决方案中的 Fn´s 结构, 与以前的 AFM 数据在其他样品表面37相一致。此外, 还获得了 AFM 尖端上适当浓度的 RrgA, 它在 smf 测量过程中产生了20% 个定义良好的交互事件的目标值 (图 3和图 4)。另一种优雅的方法来控制耦合到样品基板和悬臂尖端的分子量, 除了改变蛋白质浓度和/或孵化时间, 是硅烷-剂与不同的次级功能组的组合。通过改变由 PEG 聚合物延伸的蛋白质活性基团的比例, 固定化蛋白的数量可以控制在15、16、17、18。
这里描述的协议也可以用来固定其他 NH2含有分子或调整到夫妇的蛋白质, 其他硅氧化物表面, 除了玻璃和氮化硅。根据蛋白质的设计, 胺反应羧基可改为巯基反应基团 (如maleimide 或邻吡啶基二硫醚),通过其自由–SH 组对蛋白质进行耦合。对于 Fn, 这将导致预定义的方向13、17、20。
总之, 该协议可以调整, 以满足不同的要求, 并适用于其他生物物理应用, 除了单分子力光谱学实验。
披露声明
作者没有什么可透露的。
致谢
结核病和 HG 通过欧洲研究理事会承认财政支持 "Cellufuel, 高级赠款294438号"。HCS 承认联邦教育和研究部通过 Innovationsallianz Technofunktionale Proteine (TeFuProt) 提供的财政支持, 党卫军承认巴法力亚国家科学和教育部提供的财政支持。通过研究重点 "Herstellung 和 biophysikalische Charakterisierung dreidimensionaler Gewebe 慢跑"。我们感谢康尼 Hasselberg 和玛蒂娜 Hörig 的技术支持
材料
| Name | Company | Catalog Number | Comments |
| Material | |||
| 2-Propanol | Carl Roth | 6752 | |
| 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide | Sigma-Aldrich | 03450 | EDC |
| Acetic acid | Carl Roth | 3738 | 100 %; analytical purity |
| Doubly distilled water | |||
| Ethanol | Carl Roth | 9065 | ≥ 99.8 %; analytical purity |
| Ethoxy silane polyethylene glycol acid | Nanocs | PG2-CASL-5k | 5 kDa; COOH-PEG-Si(OC2H5)3 |
| Hydrochloric acid | Carl Roth | X896 | 32 % |
| N-Hydroxysuccinimid | Merck | 804518 | NHS; for synthesis |
| Phosphate Buffered Saline - Dulbecco | Biochrom | L1825 | PBS |
| Probe molecule e.g. Fibronectin, human plasma | Sigma-Aldrich | F1056 | |
| Probe molecule e.g. RrgA | Produced in laboratory | ||
| Sodiumchlorid | Carl Roth | 9265 | NaCl |
| Tris(hydroxymethyl)-aminomethan | Carl Roth | AE15 | ≥ 99,3 %; TRIS; Buffer Grade |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Beakers | |||
| Glass cutter | |||
| Glass slides | Carl Roth | 0656 | |
| Inert gas desiccator | Sicco | ||
| Inverted Microscope - Zeiss Axiovert 200 | Zeiss | ||
| JPK NanoWizard 1 | JPK Instruments | ||
| JPK NanoWizard SPM and DP software | JPK Instruments | ||
| Laboratory oven | Binder | ||
| Magnetic stirrer | IKA | ||
| Micro spatula | |||
| Microcentrifuge tubes | |||
| Microsoft Excel | Microsoft | ||
| Parafilm M | Brand | 701606 | |
| Petri dishes | |||
| pH-meter | Knick | ||
| Pipettes | Starlab | 10-100 µl, 50-200 µl, 100-1000 µl | |
| Precision balance | Acculab | ||
| Silicon nitride cantilever - MLCT | Bruker AXS S.A.S | Spring constant ≤ 100 pN/nm | |
| Sonication bath | Bandelin | ||
| Staining jar | |||
| Stereo microscope - Zeiss Stemi | Zeiss | ||
| Stir bar | |||
| Kimtech science precision wipes | Kimberly-Clark | ||
| Twezzers | |||
| UV PenRay | UVP, LLC | 90-0012-01 | Mercury spectrum with the primary energy at 254 nm |
| Vacuum desiccator | |||
| Vacuum pump | |||
| Vortex mixer | VWR | ||
| Weighing paper | Carl Roth | TP64 |
参考文献
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Neuman, K. C., Nagy, A. Single-Molecule Force Spectroscopy: Optical Tweezers, Magnetic Tweezers and Atomic Force Microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Dufrene, Y. F. Atomic Force Microscopy, a Powerful Tool in Microbiology. Journal of Bacteriology. 184 (19), 5205-5213 (2002).
- Muller, D. J., Dufrene, Y. F. Atomic Force Microscopy as a Multifunctional Molecular Toolbox in Nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Hinterdorfer, P., Dufrene, Y. F. Detection and Localization of Single Molecular Recognition Events Using Atomic Force Microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Dufrene, Y. F. Sticky Microbes: Forces in Microbial Cell Adhesion. Trends in Microbiology. 23 (6), 376-382 (2015).
- Yakovenko, O., et al. FimH Forms Catch Bonds That Are Enhanced by Mechanical Force Due to Allosteric Regulation. The Journal of Biological Chemistry. 283 (17), 11596-11605 (2008).
- Casillas-Ituarte, N. N., et al. Amino Acid Polymorphisms in the Fibronectin-Binding Repeats of Fibronectin-Binding Protein A Affect Bond Strength and Fibronectin Conformation. The Journal of Biological Chemistry. 292 (21), 8797-8810 (2017).
- Hilleringmann, M., et al. Molecular Architecture of Streptococcus Pneumoniae TIGR4 Pili. The EMBO Journal. 28 (24), 3921-3930 (2009).
- Izore, T., et al. Structural Basis of Host Cell Recognition by the Pilus Adhesin from Streptococcus Pneumoniae. Structure. 18 (1), 106-115 (2010).
- Henriques-Normark, B., Tuomanen, E. I. The Pneumococcus: Epidemiology, Microbiology, and Pathogenesis. Cold Spring Harbor Perspectives in Medicine. 3 (7), a010215 (2013).
- Henderson, B., Nair, S., Pallas, J., Williams, M. A. Fibronectin: a Multidomain Host Adhesin Targeted by Bacterial Fibronectin-Binding Proteins. FEMS Microbiology Reviews. 35 (1), 147-200 (2011).
- Becke, T. D., et al. Single Molecule Force Spectroscopy Reveals Two-Domain Binding Mode of Pilus-1 Tip Protein RrgA of Streptococcus Pneumoniae to Fibronectin. ACS nano. 12 (1), 549-558 (2018).
- Herman-Bausier, P., Pietrocola, G., Foster, T. J., Speziale, P., Dufrene, Y. F. Fibrinogen Activates the Capture of Human Plasminogen by Staphylococcal Fibronectin-Binding Proteins. mBio. 8 (5), e01067 (2017).
- Vitry, P., Valotteau, C., Feuillie, C., Bernard, S., Alsteens, D., Geoghegan, J. A., Dufrene, Y. F. Force-Induced Strengthening of the Interaction between Staphylococcus aureus Clumping Factor B and Loricrin. mBio. 8 (6), e01748 (2017).
- Milles, L. F., Schulten, K., Gaub, H. E., Bernardi, R. C. Molecular Mechanism of Extreme Mechanostability in a Pathogen Adhesin. Science. 359 (6383), 1527-1533 (2018).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating Receptor-Ligand Systems of the Cellulosome with AFM-Based Single-Molecule Force Spectroscopy. Journal of Visualized Experiments. (82), e50950 (2013).
- Stetter, F. W., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456 (2015).
- Schmidt, S. W., Christ, T., Glockner, C., Beyer, M. K., Clausen-Schaumann, H. Simple Coupling Chemistry Linking Carboxyl-Containing Organic Molecules to Silicon Oxide Surfaces under Acidic Conditions. Langmuir: the ACS journal of surfaces and colloids. 26 (19), 15333-15338 (2010).
- Zimmermann, J. L., Nicolaus, T., Neuert, G., Blank, K. Thiol-Based, Site-Specific and Covalent Immobilization of Biomolecules for Single-Molecule Experiments. Nature Protocols. 5 (6), 975-985 (2010).
- Ott, W., Jobst, M. A., Schoeler, C., Gaub, H. E., Nash, M. A. Single-Molecule Force Spectroscopy on Polyproteins and Receptor-Ligand Complexes: The Current Toolbox. Journal of Structural Biology. 197 (1), 3-12 (2017).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS nano. 11 (6), 6346-6354 (2017).
- Ebner, A., et al. A New, Simple Method for Linking of Antibodies to Atomic Force Microscopy Tips. Bioconjugate Chemistry. 18 (4), 1176-1184 (2007).
- Kufer, S. K., et al. Covalent Immobilization of Recombinant Fusion Proteins with hAGT for Single Molecule Force Spectroscopy. European Biophysics Journal with Biophysics Letters. 35 (1), 72-78 (2005).
- Hinterdorfer, P., Baumgartner, W., Gruber, H. J., Schilcher, K., Schindler, H. Detection and Localization of Individual Antibody-Antigen Recognition Events by Atomic Force Microscopy. Proceedings of the National Academy of Sciences of the United States of America. 93 (8), 3477-3481 (1996).
- Hinterdorfer, P., Schilcher, K., Gruber, H. J., Schindler, H. Conjugation of Biomolecules to Tip and Probe Surfaces for Molecular Recognition in Atomic Force Microscopy. European Journal of Cell Biology. 74, 72 (1997).
- Riener, C. K., et al. Heterobifunctional Crosslinkers for Tethering Single Ligand Molecules to Scanning Probes. Analytica Chimica Acta. 497 (1-2), 101-114 (2003).
- Metwalli, E., Haines, D., Becker, O., Conzone, S., Pantano, C. G. Surface Characterizations of Mono-, Di-, and Tri-Aminosilane Treated Glass Substrates. Journal of Colloid and Interface Science. 298 (2), 825-831 (2006).
- Beyer, D., Knoll, W., Ringsdorf, H., Elender, G., Sackmann, E. Covalently Attached Polymer Mono- and Multilayers on Silanized Glass Substrates. Thin Solid Films. 284, 825-828 (1996).
- Hermanson, G. T. Chapter 13 - Silane Coupling Agents. Bioconjugate Techniques. 3, 535-548 (2013).
- Howarter, J. A., Youngblood, J. P. Optimization of Silica Silanization by 3-aminopropyltriethoxysilane. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (26), 11142-11147 (2006).
- Hermanson, G. T. Chapter 6 - Heterobifunctional Crosslinkers. Bioconjugate Techniques. 3, 299-339 (2013).
- Sehgal, D., Vijay, I. K. A Method for the High Efficiency of Water-Soluble Carbodiimide-Mediated Amidation. Analytical Biochemistry. 218 (1), 87-91 (1994).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions Towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Butt, H. J., Jaschke, M. Calculation of Thermal Noise in Atomic Force Microscopy. Nanotechnology. 6, 1-7 (1995).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single Molecule Force Spectroscopy by AFM Indicates Helical Structure of Poly(ethylene-glycol) in Water. New Journal of Physics. 1 (1), 6 (1999).
- Gugutkov, D., Gonzalez-Garcia, C., Rodriguez Hernandez, J. C., Altankov, G., Salmeron-Sanchez, M. Biological Activity of the Substrate-Induced Fibronectin Network: Insight Into the Third Dimension Through Electrospun Fibers. Langmuir: the ACS Journal of Surfaces and Colloids. 25 (18), 10893-10900 (2009).
- Rief, M., Oesterhelt, F., Heymann, B., Gaub, H. E. Single Molecule Force Spectroscopy on Polysaccharides by Atomic Force Microscopy. Science. 275 (5304), 1295-1297 (1997).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Marszalek, P. E., Oberhauser, A. F., Pang, Y. P., Fernandez, J. M. Polysaccharide Elasticity Governed by Chair-Boat Transitions of the Glucopyranose Ring. Nature. 396 (6712), 661-664 (1998).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical Stability of Single DNA Molecules. Biophysical Journal. 78 (4), 1997-2007 (2000).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-Molecule Force-Clamp Experiments Reveal Kinetics of Mechanically Activated Silyl Ester Hydrolysis. ACS nano. 6 (2), 1314-1321 (2012).
- Schmidt, S. W., Beyer, M. K., Clausen-Schaumann, H. Dynamic Strength of the Silicon-Carbon Bond Observed Over Three Decades of Force-Loading Rates. Journal of the American Chemical Society. 130 (11), 3664-3668 (2008).
- Schmidt, S. W., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Mechanically Activated Rupture of Single Covalent Bonds: Evidence of Force Induced Bond Hydrolysis. Physical Chemistry Chemical Physics. 13 (13), 5994-5999 (2011).
- Schmidt, S. W., Pill, M. F., Kersch, A., Clausen-Schaumann, H., Beyer, M. K. Mechanically Induced Silyl Ester Cleavage Under Acidic Conditions Investigated by AFM-Based Single-Molecule Force Spectroscopy in the Force-Ramp Mode. Faraday Discussions. 170, 357-367 (2014).
- Rief, M., Gautel, M., Gaub, H. E. Unfolding Forces of Titin and Fibronectin Domains Directly Measured by AFM. Advances in Experimental Medicine and Biology. 481, 129-136 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。