Method Article
단일 분자 힘 분광학에 대 한 단백질의 화학식 동원 정지
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜에 설명 합니다 heterobifunctional 실 란 커플링 에이전트와 원자 힘 현미경 검사 법 기반 단일 분자 힘 분광학을 위한 실리콘 산화물 표면에 의해 궁 행 되는 단백질의 화학식 동원 정지는 RrgA의 상호 작용 (pilus-1 팁 adhesin의 S. 균) fibronectin 함께.
초록
최근 몇 년 동안, 원자 힘 현미경 (AFM) 단일 분자 힘 분광학 (SMF) 분자 속성 및 기능에 대 한 우리의 이해를 확장을 기반으로. 그것은 우리에 게 자세히 호스트 표면 수용 체에 어떻게 세균 adhesins 바인딩 생물 메커니즘, 예를 들면의 다양성을 탐구 하는 기회를 주었다. 다른 요인 들 중 고체 표면 및 AFM 팁에 대 한 관심의 생체의 기능 및 기본 immobilization SMF 실험의 성공에 의하여 달려 있다. 여기, 우리가 순서로 silane-말뚝-carboxyls와 잘 설립 N-hydroxysuccinimid/1-ethyl-3-(3-dimethyl-aminopropyl)carbodiimid (EDC/NHS) 화학을 사용 하 여 실리콘 표면에 단백질의 공유 결합에 대 한 간단한 프로토콜 설명 에 세포 외 기질 단백질 fibronectin (Fn)와 그람 양성 박테리아 구 균 (S. 균)에서 pilus-1 adhesin RrgA의 상호 작용을 찾아보기. 우리의 결과 표면 기능화 리드 유리 표면에 균일 분포 Fn SMF 중 상호 작용 이벤트의 최대 20%의 대상 값에 의해 명백한 AFM 캔틸레버 끝에 RrgA의 적절 한 농도를 보여합니다 측정 계시 RrgA 52 pN의 평균 힘 Fn에 바인딩합니다. 프로토콜 몇 사이트를 통해 특정 무료 thiol 그룹을 조정할 수 있습니다. 이 미리 정의 된 단백질 또는 분자 방향 귀착되 고 SMF 외 다른 생물 응용 프로그램에 대 한 적합 합니다.
서문
광학 및 자기 핀셋, 옆에 원자 힘 현미경 (AFM)1,2 유용한 도구를 분석 하 고 분자 조작으로 떠오르고 있다 및 그들의 속성 및 기능, 외부 힘3에 그들의 응답을 포함 하 여 조사 ,4. 반면 효소 연결 된 immunosorbent 분석 결과 (ELISA) 같은 방법, 표면 플라스몬 공명 (SPR) 또는 석 영 크리스탈 중량 (QCM) 설정, AFM 수 단일 분자 (SMF)5 및 단일 셀 수준 (SCFS)6에 상호 작용을 측정 하 . 이러한 기술은 나왔고 캐치 채권 S. 구 균에서에서 Fn 바인딩 단백질에 의해 형성 된 대장균 pilus 단백질만 노 오 스7, 또는 협동 β-지퍼 FimH 반복의 상호 작용에 대 한 발견 처럼 바인딩 메커니즘에 대 한 값진 통찰력 바인딩 Fn8시. 최근 pilus-1 adhesin RrgA9,10 그람 양성 박테리아 구 균 (S. 균)11 에서 fibronectin12 에 바인딩할 수는 보여줄 수 있었습니다. 와 그것의 2 개의 터미널 도메인. 이 새로운 2-도메인 바인딩 메커니즘을 탠덤 β-지퍼에서 다른 고 수 있습니다 형성 하 고 유지 과도 fibronectin 포함 된 연락처 호스트 표면13piliated pneumococci는 밝혔다.
SMF 실험의 성공을 비판적으로 고체 표면 및 AFM 팁에 생체의 기능 및 기본 동원 정지에 따라 달라 집니다. 높은 힘 SMF 측정 하는 동안 발생할 수 있습니다, 단백질 해야 선호 covalently 결합 표면에. 많은 단백질 등의 생체는 물론 (무기) 고체 표면, 나노 입자와 문학14,15에서에서 설명 하는 다른 장치에 전체 셀의 동원 정지에 대 한 다른 연결 방법 ,16,17,18,19,20,,2122,23,24, 25,,2627. 이러한 프로토콜은 자주 확인 유해 물질의 사용, 수행 및 특수 장비 (예를 들어, 플라즈마 클리너)를 필요로 하기 어렵습니다. 한쪽에 silane 반응 그룹 및 그들의 다른 쪽에는 아민 반응 그룹 heterobifunctional crosslinkers의 두꺼운 폴리머 레이어를 연결할 몇 분자 유리를 하는 간단한 방법이입니다. 어플리케이션, 커플링 에이전트 가변 길이, 예의 유연한 하이드로-탄소 사슬을 함유 할 수 있다., polyethylenglycol (나무 못). 그들은 수정 된 표면 (예를 들어, 소수 성, 정전기 그리고 van der Waals 상호 작용)의 일반적인 상호 작용을 억제 하 고 결합 된 분자 회전 자유를 제공할 수 있습니다.
여기, 우리는 공유 결합을 포함 하는 하나 이상의 무료 아미노 그룹 단백질의 일반적인 프로토콜 설명 (-NH2) 유리를 표면 및 실리콘 나이트 라 이드 AFM 팁 통해 는 heterobifunctional ethoxy silane 못 carboxyl (-COOH). 이 프로토콜은 RrgA와 세포 외 기질 단백질 Fn의 상호 작용에 따라 궁 행 하는 SMF 실험, 사용할 수 있습니다 (에 대 한 개요 그림 1 참조).
첫 번째 단계는 표면28,29,,3031의 silanization 이다. 그것은 반응성이 매우 높은 SiOH 그룹을 형성 하기 위하여 커플링 에이전트의 ethoxy 그룹의 가수분해를 포함. 이 기판에 SiOH 그룹으로 반응 수 있습니다. 기본 응축에, 이러한 silanols 양식 수소 결합을 기판에 확산 있습니다. (요구 하는 일반적으로 열 또는 물을 제거 하는 진공) 보조 응축 반응, 실록 산 결합 형성 된다. Covalently 연결 된 유기 실 란 계층 결과.
두 번째 단계는 단백질 기능을 결합 (-COOH) 폴리머32에서 확장 하는 그룹. 첫째, 산 성은 반응 N-hydroxysuccinimid (NHS) 에스테 르 중간, 기초가 튼튼한 보 건국/EDC를 통해 얻은 변환 됩니다 (1-에틸-3-(3-dimethylaminopropyl) carbodiimid 화학33 및 대체를 겪 습 및 마지막으로 단백질에 1 차 아민과 아 미드 유대를 형성 한다.
이 방법에서는, 실리콘 질 화물 AFM 팁 및 무작위 방향에서 유리 기판에 인간의 Fn RrgA 결합 했다 그리고 그들의 상호 작용 힘 단일 분자 수준에서 분석 했다. 우리의 결과 설명된 표면 화학은 유리 표면에 균일 분포 Fn SMF 측정 중 상호 작용 이벤트의 최대 20%의 대상 값에 의해 명백한 끝에 RrgA의 적절 한 농도를 보여 줍니다. 이 화학 일반적인 배경 상호 작용을 감소, 데이터 수집 기간 동안 작은 변경 적용 이며 따라서 무척 정확한 SMF 실험에 적합.
프로토콜
1. 기능성 실 란 커플링 에이전트를 통해 단백질의 동원 정지
참고: 그림 1 통해 표면 화학이이 프로토콜에 적용 한 개요를 제공 합니다.
주의: 다음 프로토콜에서 부식성과 속성을 자극 하는 피부와 다른 화학 물질 사용 됩니다. 적절 한 (산 성) 장갑, 안전 고글, 및 실험실 외 투를 착용 하 고 증기의 흡입을 방지 하기 위해 솔루션을 준비 하는 동안 증기 두건에서 작동.
- 유리 표면과 실 란 커플링 에이전트와 실리콘 나이트 라 이드 캔틸레버의 기능화
- 거친 먼지를 제거 하 고 소 프로 파 놀과 보풀 정밀 유리 슬라이드에서 오염 물티슈 고 슬라이드에 원하는 크기 (선택 사항).
참고: 옆에 유리, 단단한 표면 수 실리 카, 석 영, 알루미늄, 구리, 주석, 티타늄, 철, 크롬, 지르코늄, 니켈, 그리고 아연의 산화물.
주의: 유리 슬라이드를 절단 날카로운 모서리를 발생할 수 있습니다. - 장소 얼룩 항아리에 슬라이드 유리 염 산으로 가득 (33 %HCl) 이중 증류수 (ddH2O) 3-5% (v/v)을 희석, 적절 한 뚜껑과 항아리 닫고 실 온에서 90 분 동안 초음파 목욕에.
참고: 사용된 항아리는 6 cm의 직경 및 65-70 mL의 대략적인 크기. 병에 대 한 희석된 HCl의 적절 한 볼륨 50 mL 5 mL를 포함 하는 33 %HCl ddH2오 45 mL HCl은 효과적으로 비 바인딩 금속 이온, 특히 나트륨, 칼륨 및 칼슘을 제거 하 고 실리콘 수 포화 유리 표면 생성 하기 위하여 감소 시킨다.
주의: HCl은 부식성과 피부 자극. 적절 한 부식 방지 장갑을 착용, 안전 고글과 실험실 코트와 증기의 흡입을 방지 하기 위해 솔루션을 준비 하는 동안 증기 두건에서 작동. - 실리콘 나이트 라 이드 AFM 팁을 위쪽으로 향하게 깨끗 한 유리 슬라이드에 프로브를 외팔보와 울트라 바이올렛 적어도 90 분 위에서 빛을 비추는 장소.
참고: 단일 분자 힘 분광학에 대 한 공칭 스프링 상수 0.01 0.1 N m-1 의 캔틸레버는 적당 하다. 캔틸레버 표면 자외선과 방사선, 주로 지방 물질, 유기 오염 물질을 제거 하 고 한쪽에 친수성 렌더링 것 이다. 다른 쪽이 무 겁 게 오염-어떤 경우에, 해서는 안 또는 SMF 측정에 영향을 미칠 수 있습니다 외팔보 프로브는 공급자의 상자-신선한를 사용 하는 경우. 많은 연구34에서 사용 되었습니다, 피 솔루션을 사용 하 여 전체 외팔보 칩의 철저 한 정리에 도움이 될 수 있습니다.
주의: UV 라이트는 눈; 따라서, 외팔보 감지기의 방사선 조사는 UV 빛 불 침투성 챔버에 밖으로 실행 되어야 한다. 피 라 솔루션 반응성이 매우 높은 이며 피부, 종이 및 다른 유기 물질을 구울 수 있습니다. 플라스틱 용기를 사용 하지 마십시오. 요리 또는 적은 양의 유기 표면 오염 (예를 들어, 이전 사용에서) 함께 항아리에 배치 하는 경우 빠르게 반응할 수 있습니다. - DdH2O 유리 표면 건조 하 고 다시 다른 10 분에 대 한 초음파 목욕에에서 항아리를 배치 시키기 없이 얼룩 항아리에 염 산 대체 물 두 번 더는 염 제대로 씻어 각각 10 분 교체 산입니다.
- 한편, ethoxy (또는 methoxy) 실 란 폴 리 에틸렌 글리콜 산을 녹 (Si (OC2H5)3-말뚝-COOH) (v/v 95% / 5%, pH 4.6 초 산 조정) 에탄올과 ddH2O의 혼합물에서 0.1 mg mL의 최종 농도에 -1. 에탄올의 증발을 방지 하기 위해 밀폐 봉인 솔루션을 저장 합니다.
참고: 실 란 커플링 에이전트 습기와 온도에 민감합니다. 따라서, 그들은 저장 되어야 한다 불활성 가스 (N2), 아래에 낮은 온도 (-20 ° C) 및 건조 조건 하에서. 플라스 크를 열기 전에 실 화를 최소화 하기 위해 실내 온도 도달 했습니다 있는지 확인 함으로써 반응 그룹의 패 시 베이 션. Heterobifunctional 말뚝 커플링 에이전트 수많은 다른 기능 그룹 및 다른 공백 길이 함께 사용할 수 있습니다. 통해 단백질의 무작위 동원 정지에 대 한 그들의 무료 아미노 그룹 (NH2),이 프로토콜 기능 그룹 ethoxy/methoxy silane에 추가에 설명 된 대로 NHS 에스테 르 이어야 합니다. NHS 에스테 르 silane 에이전트의 구입, 옆에 같은 NHS 에스테 르를 얻을 수 있는 간단한 방법이 carboxyl 그룹을 활성화 하는 (-COOH)와 1-ethyl-3-(3-dimethylaminopropyl) carbodiimid (EDC) 및 보 건국 (1.2.1 참조. 및 1.2.2.).
주의: 에탄올은 인화성 및 피부 자극. 아세트산은 가연성 및 부식성. 반응 실 피부 또는 눈에를 얻을 수 없는 주의. 적절 한 장갑, 보안 경 및 실험실 외 투를 착용 하 고 증기의 흡입을 방지 하기 위해 증기 두건에서 작동. - 두 개의 별도 접시에 실 란 솔루션을 부 어, 1 개의 페 트리 접시에 준비 된 캔틸레버 프로브 및 유리 슬라이드를 각각 장소, 밀폐 봉인 (예를 들어, parafilm) 에탄올의 증발을 방지 하 고 90 분에 대 한 문구를 품 어 방 온도입니다.
참고: 페 트리 접시의 최적의 크기 외팔보 프로브 수와 functionalized 해야 유리 슬라이드의 크기에 따라 달라 집니다. 좋은 처리 및 낮은 시 볼륨에 대 한 직경 크기 50-60 m m 이다. 않도록 원치 않는 캔틸레버의 캔틸레버는 공기 물 인터페이스를 통해 침투 하는 동안 공기-물 인터페이스를 90 ° 각도에서 개최 한다. 유리 슬라이드 (하지만 하지 외팔보 프로브)의 외피 궤도 셰이 커에 선택적으로 실시 수 있습니다. - 완전히 언바운드 silane 화합물을 씻어 순수 에탄올을 포함 하는 3 연속 비 커에 캔틸레버와 유리 슬라이드를 씻어.
참고: 않도록 원치 않는 캔틸레버의 공기 물 인터페이스를 통해 침투 하는 동안, 캔틸레버는 90 ° 각도로 붙들어 야 한다. - 착 색 병에 깨끗 한 유리 슬라이드와 30 분 동안 110 ° C에서 치료에 외팔보 기능성된 유리 슬라이드를 놓습니다.
참고: 공유 실록 산의 형성과 물의 제거 유도 열 치료 합니다. 유리 슬라이드 했다만 기능성 1 개의 측에, 확인 제대로 코팅된 면을 나타냅니다. - Silanized 유리 샘플을 저장 하 고 최대 1 주일 동안 진공 desiccator에 프로브를 외팔보.
참고: 프로토콜 수 수 일시 중지 여기.
- 거친 먼지를 제거 하 고 소 프로 파 놀과 보풀 정밀 유리 슬라이드에서 오염 물티슈 고 슬라이드에 원하는 크기 (선택 사항).
- Silanized 유리 및 실리콘 나이트 라 이드 캔틸레버에 단백질의 무작위 동원 정지
참고: 않도록 원치 않는 캔틸레버의, 외팔보 조사 해야 개최 90 ° 각도에서 모든 공기-물 인터페이스를 관통 하는 동안.- 솔루션 포함 42 mg mL-1 edc와 20 mg mL-1 보 건국 버퍼링 표준 인산 염 (PBS, 137 mM NaCl, 2.7 m m KCl, 10mm 나2HPO4, 1.8 m m KH2포4, pH 7.4)에 준비 합니다.
주의: EDC 부식성과 피부 자극 이며 심각한 눈 손상 될 수 있습니다. 적절 한 장갑, 안전 고글과 실험실 코트를 착용. - 솔루션 실 란 코팅 된 유리 슬라이드를 커버 하 고 silanized 외팔보 프로브 EDC/NHS 솔루션의 한 방울 넣어 실 온에서 10 분 동안 품 어.
참고: 외팔보 감지기의 보육에 대 한 원래 외팔보 상자는 적당 하다. carboxyls을 그들의 자유 아미노 그룹 단백질 을 통해 몇 가지를 (-COOH) heterobifunctional silane 못 에이전트의-COOH 그룹 널리 EDC/NHS 화학으로 활성화 됩니다. EDC는 다음 단계에서 생리 적 pH에서 1 차 아민을 효율적인 활용을 가능 하 게 "안정" NHS 에스테 르 형성 carboxylic 산에 보 건국 커플. - 린스 철저 하 게 PBS와 캔틸레버와 유리 슬라이드 3 연속 비 커에 완전히 과도 한 EDC/NHS 떨어져 세척 하기 위하여.
참고:이 세척 단계 나머지 EDC/NHS 수 crosslink 단백질 만큼 중요 하 고 그로 인하여 그들의 기능을 변경. - 와 활성화 된 유리 슬라이드를 품 어 고 실 온에서 젖은 챔버에 원하는 단백질 해결책의 물방울에 캔틸레버 프로브. 단백질 농도 및 부 화 시간 실험의 요구 사항에 맞게 적응 해야 합니다. 일반적으로, 0.5 ~ 1 mg mL-1 과 보육 시간 30 분에서 2 시간 사이 농도 대부분 단백질에 적합 합니다. (유리 슬라이드)에 fibronectin 및 pilus-1 팁 단백질 RrgA (캔틸레버)에, 1.5 µ M와 3 µ M의 어 금 니 농도 각각, 2 h의 부 화 시간이 있으며 충분 한.
- 유리 슬라이드를 세척 하 고 캔틸레버 조사 철저 하 게 3 연속 비 커에 PBS를 가진 언바운드 단백질 떨어져 세척 하기 위하여.
- 나머지 NHS 에스테 르 트리 스 (hydroxymethyl) 포화-tris 버퍼 염 분 (TBS, 50 mM Tris, 150 mM NaCl, pH 7.6) 실 온에서 20 분에 프로브를 배치 하 여 aminomethan.
참고:이 단계 감소 AFM 팁의 기능성된 표면 사이의 유리, 단백질의 원치 않는 공유 결합 때문에 트리 스 아미노 그룹 캔틸레버와 기판 표면에 남은 활성화 COOH 그룹에 바인딩할 수 있습니다. - 유리 슬라이드를 세척 하 고 캔틸레버 PBS와 별도 접시에 그들 사용까지 PBS에 덮여가 철저 하 게 조사.
참고: 샘플 갓 준비 해야 하 고 같은 날 사용.
- 솔루션 포함 42 mg mL-1 edc와 20 mg mL-1 보 건국 버퍼링 표준 인산 염 (PBS, 137 mM NaCl, 2.7 m m KCl, 10mm 나2HPO4, 1.8 m m KH2포4, pH 7.4)에 준비 합니다.
2. 원자 힘 현미경 기반 단일 분자 힘 분광학
참고:이 작품에서 JPK 악기에서 원자 힘 현미경 사용 되었다 세트 강제로 RampDesigner로 정의 했다 힘 거리 곡선을 얻기 위한 업.
- 캔틸레버 교정 열 잡음 방법35
참고: 외팔보 교정 단계는 제조업체의 설명서에 따릅니다. 대부분 외팔보 공급 업체 상태는 대략적인 스프링 상수는 일반적으로 공칭 외팔보 모양 (길이, 폭, 두께)에서 계산 되 고 매우 신뢰할 수 있다 그러므로. 정확한 스프링 상수 결정적으로, 3 중에 아래 설명 된 캔틸레버 교정 수행 광학 레버 감도의 평균 값을 사용 하 고 상수 봄 적당 하다. 그것은 볼트 (V)에 외팔보 편향 실험 및 변환 (pN) 나중에, 광학 레버 감도 사용 하 여 강제로 상수 봄을 값을 의미 하는 동안 기록 유용할 수 있습니다. 봄 상수 및 광학 레버 감도 (반사 레이저의 위치는 광다이오드에 재조정 될 수 있습니다) 하는 캔틸레버에 레이저 위치는 변경 되지 않습니다 하기 전에 또는 실험 후 확인할 수 있습니다.- AFM 샘플 홀더에 깨끗 하 고 신선한 유리 슬라이드를 수정 하 고 PBS 버퍼와 그것을 커버.
참고: 보정 (예를 들어, 유리) 하드 표면에와 실제 실험으로 동일한 버퍼에 밖으로 실행 되어야 한다. - 캔틸레버 홀더에 준비 된 캔틸레버 프로브를 수정, AFM 머리에 고 PBS 버퍼의 드롭 캔틸레버를 신중 하 게 젖은.
참고: 캔틸레버의 일로 교정 유리 슬라이드와 캔틸레버의 그로 인하여 바람직하지 않은 절곡에 PBS 버퍼에 침투 하는 동안 나타나는 표면 장력을 감소 시킨다. - 캔틸레버 완전히 하지만 여전히 교정 표면에서 PBS 버퍼에 잠기 다 때까지 천천히 외팔보 교정 표면 쪽으로 이동 합니다.
- AFM의 상위 뷰 광학 현미경을 사용 하 여 (가능한 경우) 또는 거꾸로 한 현미경 AFM 캔틸레버의 뒷면에 레이저 AFM의 위치를 아래. 레이저 팁이 있는 곳 가까이 캔틸레버의 끝 근처 자리 배치 합니다.
참고: 레이저 자리는 캔틸레버의 끝 가까이 위치 해 있어야 하지만 그것은 아직도 완전히 캔틸레버에 있어야 한다. 없는 광학 현미경을 사용할 수 있는 경우 한 장의 종이 사용 하 여 보이는 레이저 다이오드 또는 적외선 레이저 다이오드 레이저 탐지기 카드, AFM 머리 아래 넣고 캔틸레버 있는 외팔보 칩의 가장자리 쪽으로 레이저 자리 이동 종이 또는 검출기 카드에 자리를 볼 때까지. 다음 레이저 가장자리에 평행 하 게 이동 합니다. 자리 사라지면 그것은 캔틸레버 팔 에입니다. 선형 캔틸레버에 대 한 종이/검출기 카드에 이동 될 때까지 다시 (종이/카드에서 사라집니다) 레버 팔에 다시 나타날 때까지 레버 팔의 끝 쪽으로 자리를 이동 합니다. 대 한 삼각형, 캔틸레버의 두 팔 사이 중간에 자리를 배치 하 고, 캔틸레버의 끝으로 이동 하는 종이/카드에서 사라질 때까지. 캔틸레버 중간 자리 수직 캔틸레버의 긴 축에 이동 하 여 확인 하십시오. - 반사 레이저 빔 광다이오드의 중앙에 배치 되는 방식에 AFM의 4 개의 사분면 검출기 광다이오드의 위치를 조정 합니다.
참고: 다음을 수행: 검출기 다이오드 근처 마이크로미터 나사를 사용 하 여 모든 4 개의 사분면에서 합계 신호 최대화 될 때까지 다이오드 수평 및 수직 방향으로 이동. 다음 다이오드 수직 방향, 수직 편향도 신호를 0 때까지 이동 다이오드 수평 방향으로 측면 편향 신호는 0이 될 때까지. 실리콘 나이트 라 이드 캔틸레버 일반적으로 골드 코팅 되며 따라서 바이메탈 열 확장의 2 개의 다른 계수와. 이 솔루션에서 특히 열 드리프트 (수직 편향도 신호에 명백한) 결과. 측정 하는 동안이 드리프트를 줄이기 위해, 보정을 시작 하기 전에 몇 분 동안 equilibrate 전체 시스템을 보자. - AFM 소프트웨어에서 교정 관리자를 열고 열 잡음 방법 외팔보 감도 캔틸레버의 스프링 상수를 다음과 같이 보정 합니다.
- 조심 스럽게 기판 표면에 접근 하 고 힘 거리 곡선을 기록 합니다.
- 팁 기판 표면 접촉은 피팅 철회 힘 곡선의 가파른 부분을 직선으로 nm/v에서 광학 레버 감도 결정 합니다. 감도 pN/nm 외팔보 스프링 상수를 변환할 수 있습니다.
참고: 철회 곡선의 기울기는 압 전 여행 거리 대는. (nm/V에서 측정 되는) 포토 다이오드 전압의 변화. - 어떤 표면 댐핑을 제외 하기 위해 표면에서 캔틸레버 약 100 µ m 이상의 캔틸레버의 여러 열 잡음 스펙트럼을 기록 합니다.
- 열 잡음 스펙트럼을 AFM 소프트웨어에서 제공 하는 고조파 발진기를 피팅 하 여 pN/V에서 캔틸레버의 스프링 상수를 확인 합니다.
- 천천히 캔틸레버를 철회 하 고 솔루션에서 그것을 철회.
- 대체 유리 표면 고정된 단백질을 포함 하는 샘플 표면 외팔보 캘리브레이션에 사용 합니다. 있는지 확인 캔틸레버와 샘플 표면 (고 단백질) 유리 슬라이드를 변경 하는 동안 건조 하지 마십시오.
- AFM 샘플 홀더에 깨끗 하 고 신선한 유리 슬라이드를 수정 하 고 PBS 버퍼와 그것을 커버.
- 상호 작용 강제로 단일 단백질 수준에 대 한 실험
- PBS 버퍼에 의해 하지만 여전히 기판 표면에서 캔틸레버 완전히 덮여 때까지 서서히 촉촉한 외팔보 샘플 표면 쪽으로 이동 합니다.
참고: 실험 기간 동안 열 드리프트를 줄이기 위해, 전체 시스템 힘 분광학 측정을 시작 하기 전에 몇 분 동안 설정 하자. - 표면에 접근 하 고 기록 250 pN의 접촉 힘으로 샘플 표면의 서로 다른 위치에 여러 개의 힘 거리 곡선 (≥ 500) 1의 연락처 시간 s, 2 µ m의 철회 길이 1 µ m s-1의 수 축력 속도.
참고: 일반적인 힘 분광학 조정에 대 한 제조업체의 따라. 유사: 철회 속도 수 수 변화 0.1 5 µ m s-1 사이 증가 힘 부하에 따라 kinetical 데이터를 계산 하. 상호 작용 시간 시간 종속 유대 강화를 분석 하는 다양 한 수 있습니다. 대신 수 축력 속도 일정 유지, 힘 상수 (포스 클램프 모드)을 유지 수 있습니다 하나.
- PBS 버퍼에 의해 하지만 여전히 기판 표면에서 캔틸레버 완전히 덮여 때까지 서서히 촉촉한 외팔보 샘플 표면 쪽으로 이동 합니다.
- 데이터 분석
참고: 데이터 분석 데이터 처리 소프트웨어를 사용 하 여 실행 되었다. 에 따라 고정된 단백질, 접촉 시간 또는 철회 속도, 발자국 안 통합 여부 및 다른 가변 매개 변수, 힘 거리 곡선 여러 다른 정보가 포함 됩니다. 데이터 분석 및 해석 다른 SMF 실험 사이 크게 달라질 수 있습니다 고 수 따라서 설명 하지 여기에. RrgA와 Fn의 상호 작용에 관해서는 다음 프로토콜 SMF 데이터의 분석에 대 한 첫 번째 단계를 수 있습니다.- 오픈 배치의 강제 검색 아이콘을 선택 하 여 측정 된 힘 곡선 파일을 열고 다음과 같이 힘 거리 곡선 처리:
- (재) 보정 V-편향 감도 조정 및 봄 일정 아이콘을 선택 하 여 직접 비례 힘 (F)에 외팔보 편향 (V)를 변환 합니다.
참고: 외팔보 교정 실험 전에 실시 됐다, 값 힘 스캔 파일에 저장 되 고 V-편향의 교정 하는 동안 자동으로 사용 됩니다. 교정 실험 후 실시, 소프트웨어 측정된 된 값으로 변경할 수 있습니다 기본 값을 사용 합니다. - 기본 빼기아이콘을 선택 하 여 제로 포스 레벨을 설정 하려면 표면까지 힘 곡선의 영역에서 철회 채널의 기준선을 뺍니다.
참고: 일부 경우에는 철회 없을 수 있습니다 동일한 상수 힘 값 그리고 곡선 선형 기울기, 오프셋 + 기울기를 선택 하 여 제거 될 수 있는 표시 될 수 있습니다. - 어디 끝 지점 결정 문의 아이콘을 선택 하 여 샘플에 접촉 되 면 포인트를 정의 합니다.
- Tip 샘플 분리 아이콘을 선택 하 여 팁 샘플 분리를 높이 신호를 변환 합니다. 접점 위치를 빼기 뿐만 아니라이 절차는 AFM 팁 및 기판 표면 사이의 거리를 계산 하는 절곡 캔틸레버를 뺍니다.
참고: 확장 가능한 웜 같은 체인 모델 및 상호 작용 길이 결정 같은 폴리머 탄성 모델 피팅 외팔보 절곡에 대 한 해결 팁 샘플 분리 필요 합니다. 힘 힘 z 피 속도의 기울기에서 로드 하는 속도 확인 하려면 수정 되지 않은 힘 곡선을 사용 한다. - 일반적인 상호 작용을 밖으로 정렬 및 선택 하 여 선택한 봉우리에 확장 가능한 웜 같은 체인 모델을 적용할 70 nm (뻗어 못 스페이서의 길이)36 위 파열 길이에서 발생 하는 힘 봉우리의 힘 거리 추적 화면에서 폴리머 체인 모델에 맞게 아이콘 하 고 확장 웜 같은 체인 모델을선택 했다. 철회 힘 곡선에 봉우리가이 모델 장착 하 고 파열 힘 및 길이, 함께 획득 폴리머 탄성 매개 변수.
- 힘 및 길이 분포를 보여주는 히스토그램으로 데이터를 표시 합니다. 적어도 100 바인딩 해제 이벤트를 사용 하 여 히스토그램에 대 한.
결과
프로토콜 설명 여기 를 통해 단백질의 화학식 동원 정지에 결과 임의의 방향 (그림 1) 액세스할 수 있는 그들의 1 차 아민. 그림 2 (왼쪽)와 silanized 유리 표면의 AFM 이미지를 보여줍니다 그리고 질소의 부드러운 스트림 아래 샘플의 탈수 후 (오른쪽) Fn 움직일 수 없이 기록. Silane 폴리머 레이어 Fn와 기능성된 표면에만 작은 표면 파형 높이 약 2-5 nm (그림 2, 오른쪽), 동안, 약 10 nm 높은 Fn 분자는 명백한 (그림 2, 왼쪽). 클로즈업, Fn의 dimeric 구조를 인식할 수 있습니다. Fn 분자 말뚝 표면 코팅 위에 4-5 nm의 높이와 길이의 소형 것 같다 ~ 120 nm (삽입 참조).
조사는 최근 자세히 설명 우리의 그룹13, Fn와 RrgA의 상호 작용 힘에 RrgA 실리콘 질 화물 AFM 팁과 유리 기판 (그림 3a)에 인간의 Fn에 결합 했다. 그림 3 샘플 분리 곡선 Fn 1 µ m s-1의 당기 속도에서 기록 된 RrgA의 상호 작용의 대표적인 팁을 보여 줍니다. 사용 된 표면 화학 상호 작용을 낮은 배경 및 체인 (eWLC) 모델 (빨간 곡선) 같은 확장 가능한 벌레를 사용 하 여 장착 했다 (그림 3a), 잘 모양된 (또는 2) 상호 작용 이벤트에. AFM 팁과 기판, 스트레칭 못 링커 (> 70 nm), 일반적인 표면 상호 작용까지 극복 후 보여줍니다 적합 (파열 힘 및-길이 그림 4참조)의 결과 플롯 ~ 19% 힘 곡선의 파열을 보여주었다 말은 파열 된 이벤트 RrgA-Fn의 상호 작용에 대 한 강제 ~ 약 100의 팁-샘플 거리에서 52 pN nm. 반면, 부적당 한 표면 화학 (여기, 염 분 그림 3b버퍼링 트리 스와 냉각 하는 생략) 여러 단백질 바인딩 (추적 2와 3) 난다 상호 작용으로 인해 단일 상호 작용 이벤트에 대 한 명확한 평가 방해 것 이다 / 샘플 표면 및 AFM 캔틸레버 끝 사이의 단백질의 카 하 플 공유 링 높은 파열 힘 (추적 1) 단백질 (Fn) 도메인 (추적 4와 5)의 전개와 함께 가능 하 게이 리드.
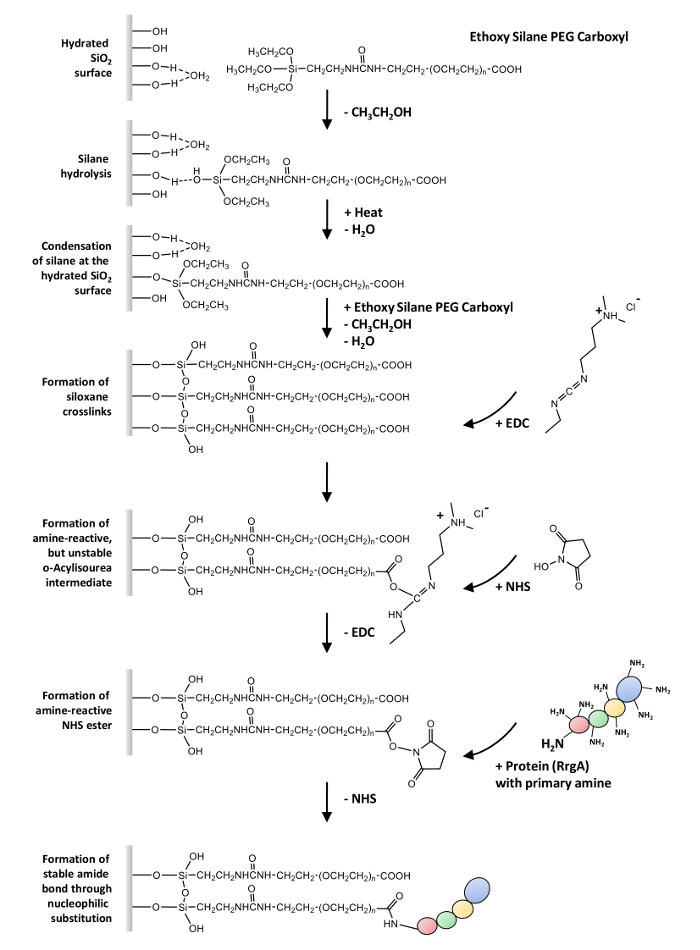
그림 1: 표면 화학을 통해 개요. Ethoxy silane-말뚝-carboxyl의 가수분해 실록 crosslinks의 형성과 수산화 유리 표면에서의 결로 옵니다. Carboxyl 그룹 EDC의 반응 반응 o-acylisourea, 수성 해결책 (가수분해) 매우 짧은 반감기를 가진 아민 반응 중간 결과. 중간을 겪 습 및 대체 마지막으로 단백질에 1 차 아민과 아 미드 유대를 형성 하는 NHS 에스테 르의 형성에 의해 안정 이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
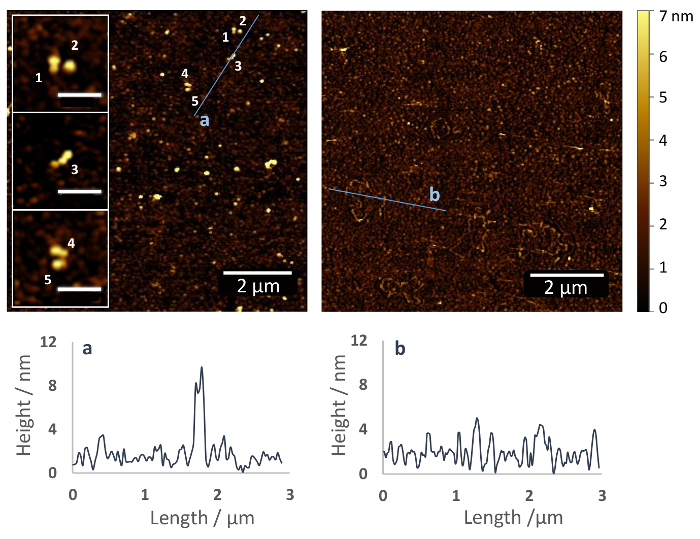
그림 2: 동원 정지의 한 유리 기판 통해 heterobifunctional ethoxy silane 말뚝에 fibronectin carboxyl 커플링 에이전트. 기능성된 유리의 AFM 이미지 (왼쪽)와 표면 및 (오른쪽) 없이 Fn. 숫자 (삽입) 기판 표면에 균질 분산 개별 Fn 분자를 나타냅니다. 분자는 말뚝 위에 4-5 nm의 높이 dimeric이 고 컴팩트한 구조 채택 코팅과의 길이 > 100 nm. 이 솔루션에서 Fn의 구조를 닮 고 다른 표면, 예를 들어, 운 모에 이전 AFM 데이터와 일치 (눈금 막대의 상 = 500 nm)37. AFM 아래 이미지는 AFM 이미지에 표시 된 라인을 따라 높이 프로필. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
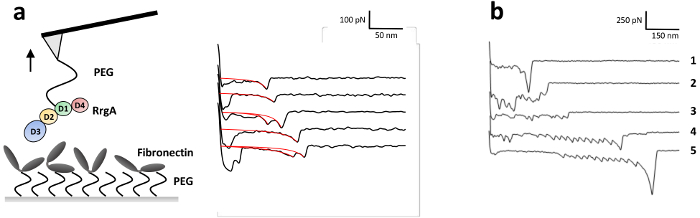
그림 3: SMF 실험 및 대표 일러스트 힘 거리 곡선 RrgA-Fn 상호 작용의. (a) RrgA와 Fn covalently 연결을 통해 heterobifunctional ethoxy silane 못 했다 carboxyl 커플링 에이전트 실리콘 나이트 라 이드 AFM 외팔보 팁과 유리 표면, 각각. 대표 SMF 힘 거리 곡선 RrgA-Fn와 상호 작용 수 축력 속도에 1 µ m s-1 의 RrgA와 Fn의 설명된 동원 정지에 대 한 얻은 표시 됩니다. 빨간 곡선 파열 힘 및 길이에 적용 된 확장 가능한 웜 같은 체인 맞는 나타냅니다. 그림은 Becke, 그 외 여러분, ACSnano 201813에서 수정 되었습니다. (b) 대표 SMF 힘 거리 곡선 RrgA-Tris 버퍼와 냉각 없이 Fn 상호 작용에 대 한 얻은 염 분. 이 경우에, 트리 스의 1 차 아민은 결 석 활성 남아 있도록 NHS 에스테 르 남았다 불포화 실험 기간 동안. 이것은 다중 단백질 바인딩 (추적 2와 3) 하며 단백질 표면 사이의 높은 파열을 초래한 AFM 팁의 클램핑 (Fn-) 함께 도메인 전개 (추적 1, 4, 5; 다른 비늘을 참고). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
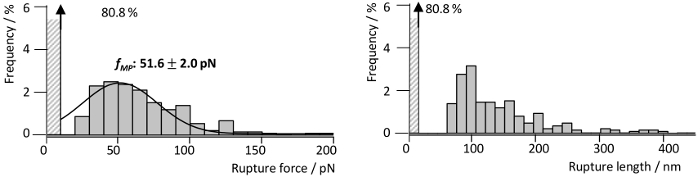
그림 4: 단일 RrgA-Fn 상호 작용의 힘 및 길이 분포. 힘 및 RrgA-Fn SMF 상호 작용 측정에서에서 얻은 해당 파열 길이 히스토그램 파열 (n = 1400) 1 µ m s-1의 상승 속도에. 히스토그램 공개 51.6 pN (가우스 적합, 검은 선)의 가능성이 가장 높은 파열 힘 fMP 와 축적의 파열 길이 약 100 nm. 그림은 Becke 외., ACSnano, 201813에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
AFM의 도입 기반을 SMF, 그것을 직접 내 고 intermolecular 개별 단백질, 핵 산 및 다른 생체3,,45의 널리 사용된 기법으로 진화. 성공적인 SMF 실험에 대 한 전략을 결합 하는 적절 한 표면 필수입니다. 천연 및 합성 폴리머에 intramolecular 힘을, 중합체는 기판 표면 및 AFM 팁36,,3839,40,41직접 결합 될 수 있습니다. 그러나 분자 채권 등 간 분자 상호 작용의 수사를 위해, 그것입니다 이종 bifunctional 못 링커 등 polypeptide 사슬, 유연한 링커 분자 AFM 팁을 상호 파트너를 연결 하 고 수 있도록 바인딩 파트너의 올바른 방향에 대 한 단거리 표면 힘을 극복 하 고 변성 그리고 단백질21,,2223의 전개를 피하기 위해 기판 표면 24,25,26,,2742. 우리 따라서 이종 bifunctional 못 스페이서를 사용 하 여 그들의 접근 주 아민 통해 단백질의 화학식 동원 정지에 대 한 간단 하 고 곧장 앞으로 프로토콜을 설명 합니다.
우리가 그것의 적용을 보여주는 상호 작용의 수사 adhesin 미 균 에서 RrgA와 세포 외 기질 단백질 Fn, 사이 힘 최근에 자세히 설명 다른 곳13.
표면 화학 잘 설립 하 고 분석 하 고 유사한 접근 여러 SMF 실험19,,4243,44,45에서 성공적으로 사용 되었습니다. 표면에 폴리머 실 란 커플링 사용 하는 silylether는 가수분해. 가수분해의 정도 silanization 과정에서 통제 될 수 있다 형성된 된 실록 산 결합의 금액에 따라 달라 집니다. 높은 상호 작용 힘 (≥ 1000 pN)는 SMF 측정 하는 동안 예상 하는 경우는 silanization 수행 통해 -기상 증 착30 낮아집니다의 지속적인 층의 형성 귀착되는 해야 합니다. 많은 실험 (예를 들어, 많은 단백질-단백질 상호 작용), 상호 작용 힘 몇 백 pN 및 설명된 절차는 실록 형성 수성 단계에서 증 착에 의해 실시 및 언바운드의 범위에는 유기 실 에탄올 (단계 1.1.7) 열 (단계 1.1.8) 치료 다음 씻어 신중 하 게, 충분 하다.
또 다른 중요 한 단계 나머지 EDC를 세척 하 고 보 건국 분자 표면 (1.2.3 단계)에서 남은 단백질에 carboxyl 그룹의 활성화로 이어질 것입니다. 이 기능을 변경할 수 있습니다 동일한 표면에 단백질의 가교에서 어느 결과 또는 몇 반대 표면에 다른 단백질에 단백질을 활성화 하는 covalently. 이 단백질 표면 사이의 도메인 전개 동반 가능성이 높은 파열 힘 귀착되는 AFM 팁의 클램핑 이어질 수 있습니다 ( 그림 3b, 추적 1, 4 및 5 참조 Fn 도메인의 전개)46. 못 스페이서의 활성 NHS 에스테 르는 불포화 경우 같은 문제가 발생할 수 있습니다. 따라서, Tris 버퍼 식 염 수를 가진 외피는 좋습니다 (단계 1.2.6), 트리 스의 1 차 아민 냉각 나머지 아미노 반응 그룹으로.
Silanized 유리에 Fn의 균일 분포를 리드 stepwise 프로토콜에 따라 표면 ( 그림 2참조), 단백질의 dimeric 형태를 떠나. 이 솔루션에서 Fn´s 구조를 닮 고 다른 샘플 표면37에 이전 AFM 데이터와 일치. 또한, AFM 팁에 RrgA의 적절 한 농도, 얻어진 다는 SMF 측정 (그림 3 및 그림 4) 동안 잘 정의 된 상호 작용 이벤트 ~ 20%의 대상 값을 생성. 또 다른 우아한 방법은 다양 한 단백질 농도 및 부 화 번 외 샘플 기판 및 캔틸레버 끝에 결합 하는 분자의 양을 제어 실-대리인 다른 보조 기능 그룹의 조합입니다. 못-폴리머에서 연장 하는 단백질 반응 그룹의 비율을 변경 하 여 고정된 단백질의 수는 제어15,16,,1718수 있습니다.
여기에 설명 된 프로토콜 또한 다른-NH2 포함 된 분자를 무력화 하거나 유리 및 실리콘 질 화물 외 다른 실리콘 산화물 표면에 몇 단백질 조정 사용할 수 있습니다. 단백질 디자인 따라 아민 반응 carboxyl 그룹으로 변경할 수 있습니다 통해 단백질 하 sulfhydryl 반응 그룹 (예를 들어, maleimide 또는 pyridyl 직교 이황화) 무료-SH 그룹. Fn,이 미리 정의 된 방향13,,1720결과.
요약 하자면,이 프로토콜 다른 요구 사항을 제공 하기 위해 조정 될 수 있다 고 단일 분자 힘 분광학 실험 외 다른 생물 응용 프로그램에 적합 합니다.
공개
저자는 공개 없다.
감사의 말
TB와 HG 유럽 연구 위원회 "Cellufuel, 고급 보조금 번호 294438"를 통해 재정 지원을 인정 한다. SS 금융 인정 HCS 인정 교육 및 Innovationsallianz Technofunktionale Proteine (TeFuProt)를 통해 연구에 대 한 연방 정부에서 재정 지원, 과학 교육에 대 한 바이에른 주 교육부에서 지원 통해 연구 초점 "Herstellung und biophysikalische Charakterisierung dreidimensionaler Gewebe-캔터". 우리는 기술 지원에 대 한 코니 Hasselberg-크리스토프와 마르티나 Hörig 감사
자료
| Name | Company | Catalog Number | Comments |
| Material | |||
| 2-Propanol | Carl Roth | 6752 | |
| 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide | Sigma-Aldrich | 03450 | EDC |
| Acetic acid | Carl Roth | 3738 | 100 %; analytical purity |
| Doubly distilled water | |||
| Ethanol | Carl Roth | 9065 | ≥ 99.8 %; analytical purity |
| Ethoxy silane polyethylene glycol acid | Nanocs | PG2-CASL-5k | 5 kDa; COOH-PEG-Si(OC2H5)3 |
| Hydrochloric acid | Carl Roth | X896 | 32 % |
| N-Hydroxysuccinimid | Merck | 804518 | NHS; for synthesis |
| Phosphate Buffered Saline - Dulbecco | Biochrom | L1825 | PBS |
| Probe molecule e.g. Fibronectin, human plasma | Sigma-Aldrich | F1056 | |
| Probe molecule e.g. RrgA | Produced in laboratory | ||
| Sodiumchlorid | Carl Roth | 9265 | NaCl |
| Tris(hydroxymethyl)-aminomethan | Carl Roth | AE15 | ≥ 99,3 %; TRIS; Buffer Grade |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Beakers | |||
| Glass cutter | |||
| Glass slides | Carl Roth | 0656 | |
| Inert gas desiccator | Sicco | ||
| Inverted Microscope - Zeiss Axiovert 200 | Zeiss | ||
| JPK NanoWizard 1 | JPK Instruments | ||
| JPK NanoWizard SPM and DP software | JPK Instruments | ||
| Laboratory oven | Binder | ||
| Magnetic stirrer | IKA | ||
| Micro spatula | |||
| Microcentrifuge tubes | |||
| Microsoft Excel | Microsoft | ||
| Parafilm M | Brand | 701606 | |
| Petri dishes | |||
| pH-meter | Knick | ||
| Pipettes | Starlab | 10-100 µl, 50-200 µl, 100-1000 µl | |
| Precision balance | Acculab | ||
| Silicon nitride cantilever - MLCT | Bruker AXS S.A.S | Spring constant ≤ 100 pN/nm | |
| Sonication bath | Bandelin | ||
| Staining jar | |||
| Stereo microscope - Zeiss Stemi | Zeiss | ||
| Stir bar | |||
| Kimtech science precision wipes | Kimberly-Clark | ||
| Twezzers | |||
| UV PenRay | UVP, LLC | 90-0012-01 | Mercury spectrum with the primary energy at 254 nm |
| Vacuum desiccator | |||
| Vacuum pump | |||
| Vortex mixer | VWR | ||
| Weighing paper | Carl Roth | TP64 |
참고문헌
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Neuman, K. C., Nagy, A. Single-Molecule Force Spectroscopy: Optical Tweezers, Magnetic Tweezers and Atomic Force Microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Dufrene, Y. F. Atomic Force Microscopy, a Powerful Tool in Microbiology. Journal of Bacteriology. 184 (19), 5205-5213 (2002).
- Muller, D. J., Dufrene, Y. F. Atomic Force Microscopy as a Multifunctional Molecular Toolbox in Nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Hinterdorfer, P., Dufrene, Y. F. Detection and Localization of Single Molecular Recognition Events Using Atomic Force Microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Dufrene, Y. F. Sticky Microbes: Forces in Microbial Cell Adhesion. Trends in Microbiology. 23 (6), 376-382 (2015).
- Yakovenko, O., et al. FimH Forms Catch Bonds That Are Enhanced by Mechanical Force Due to Allosteric Regulation. The Journal of Biological Chemistry. 283 (17), 11596-11605 (2008).
- Casillas-Ituarte, N. N., et al. Amino Acid Polymorphisms in the Fibronectin-Binding Repeats of Fibronectin-Binding Protein A Affect Bond Strength and Fibronectin Conformation. The Journal of Biological Chemistry. 292 (21), 8797-8810 (2017).
- Hilleringmann, M., et al. Molecular Architecture of Streptococcus Pneumoniae TIGR4 Pili. The EMBO Journal. 28 (24), 3921-3930 (2009).
- Izore, T., et al. Structural Basis of Host Cell Recognition by the Pilus Adhesin from Streptococcus Pneumoniae. Structure. 18 (1), 106-115 (2010).
- Henriques-Normark, B., Tuomanen, E. I. The Pneumococcus: Epidemiology, Microbiology, and Pathogenesis. Cold Spring Harbor Perspectives in Medicine. 3 (7), a010215 (2013).
- Henderson, B., Nair, S., Pallas, J., Williams, M. A. Fibronectin: a Multidomain Host Adhesin Targeted by Bacterial Fibronectin-Binding Proteins. FEMS Microbiology Reviews. 35 (1), 147-200 (2011).
- Becke, T. D., et al. Single Molecule Force Spectroscopy Reveals Two-Domain Binding Mode of Pilus-1 Tip Protein RrgA of Streptococcus Pneumoniae to Fibronectin. ACS nano. 12 (1), 549-558 (2018).
- Herman-Bausier, P., Pietrocola, G., Foster, T. J., Speziale, P., Dufrene, Y. F. Fibrinogen Activates the Capture of Human Plasminogen by Staphylococcal Fibronectin-Binding Proteins. mBio. 8 (5), e01067 (2017).
- Vitry, P., Valotteau, C., Feuillie, C., Bernard, S., Alsteens, D., Geoghegan, J. A., Dufrene, Y. F. Force-Induced Strengthening of the Interaction between Staphylococcus aureus Clumping Factor B and Loricrin. mBio. 8 (6), e01748 (2017).
- Milles, L. F., Schulten, K., Gaub, H. E., Bernardi, R. C. Molecular Mechanism of Extreme Mechanostability in a Pathogen Adhesin. Science. 359 (6383), 1527-1533 (2018).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating Receptor-Ligand Systems of the Cellulosome with AFM-Based Single-Molecule Force Spectroscopy. Journal of Visualized Experiments. (82), e50950 (2013).
- Stetter, F. W., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456 (2015).
- Schmidt, S. W., Christ, T., Glockner, C., Beyer, M. K., Clausen-Schaumann, H. Simple Coupling Chemistry Linking Carboxyl-Containing Organic Molecules to Silicon Oxide Surfaces under Acidic Conditions. Langmuir: the ACS journal of surfaces and colloids. 26 (19), 15333-15338 (2010).
- Zimmermann, J. L., Nicolaus, T., Neuert, G., Blank, K. Thiol-Based, Site-Specific and Covalent Immobilization of Biomolecules for Single-Molecule Experiments. Nature Protocols. 5 (6), 975-985 (2010).
- Ott, W., Jobst, M. A., Schoeler, C., Gaub, H. E., Nash, M. A. Single-Molecule Force Spectroscopy on Polyproteins and Receptor-Ligand Complexes: The Current Toolbox. Journal of Structural Biology. 197 (1), 3-12 (2017).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS nano. 11 (6), 6346-6354 (2017).
- Ebner, A., et al. A New, Simple Method for Linking of Antibodies to Atomic Force Microscopy Tips. Bioconjugate Chemistry. 18 (4), 1176-1184 (2007).
- Kufer, S. K., et al. Covalent Immobilization of Recombinant Fusion Proteins with hAGT for Single Molecule Force Spectroscopy. European Biophysics Journal with Biophysics Letters. 35 (1), 72-78 (2005).
- Hinterdorfer, P., Baumgartner, W., Gruber, H. J., Schilcher, K., Schindler, H. Detection and Localization of Individual Antibody-Antigen Recognition Events by Atomic Force Microscopy. Proceedings of the National Academy of Sciences of the United States of America. 93 (8), 3477-3481 (1996).
- Hinterdorfer, P., Schilcher, K., Gruber, H. J., Schindler, H. Conjugation of Biomolecules to Tip and Probe Surfaces for Molecular Recognition in Atomic Force Microscopy. European Journal of Cell Biology. 74, 72 (1997).
- Riener, C. K., et al. Heterobifunctional Crosslinkers for Tethering Single Ligand Molecules to Scanning Probes. Analytica Chimica Acta. 497 (1-2), 101-114 (2003).
- Metwalli, E., Haines, D., Becker, O., Conzone, S., Pantano, C. G. Surface Characterizations of Mono-, Di-, and Tri-Aminosilane Treated Glass Substrates. Journal of Colloid and Interface Science. 298 (2), 825-831 (2006).
- Beyer, D., Knoll, W., Ringsdorf, H., Elender, G., Sackmann, E. Covalently Attached Polymer Mono- and Multilayers on Silanized Glass Substrates. Thin Solid Films. 284, 825-828 (1996).
- Hermanson, G. T. Chapter 13 - Silane Coupling Agents. Bioconjugate Techniques. 3, 535-548 (2013).
- Howarter, J. A., Youngblood, J. P. Optimization of Silica Silanization by 3-aminopropyltriethoxysilane. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (26), 11142-11147 (2006).
- Hermanson, G. T. Chapter 6 - Heterobifunctional Crosslinkers. Bioconjugate Techniques. 3, 299-339 (2013).
- Sehgal, D., Vijay, I. K. A Method for the High Efficiency of Water-Soluble Carbodiimide-Mediated Amidation. Analytical Biochemistry. 218 (1), 87-91 (1994).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions Towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Butt, H. J., Jaschke, M. Calculation of Thermal Noise in Atomic Force Microscopy. Nanotechnology. 6, 1-7 (1995).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single Molecule Force Spectroscopy by AFM Indicates Helical Structure of Poly(ethylene-glycol) in Water. New Journal of Physics. 1 (1), 6 (1999).
- Gugutkov, D., Gonzalez-Garcia, C., Rodriguez Hernandez, J. C., Altankov, G., Salmeron-Sanchez, M. Biological Activity of the Substrate-Induced Fibronectin Network: Insight Into the Third Dimension Through Electrospun Fibers. Langmuir: the ACS Journal of Surfaces and Colloids. 25 (18), 10893-10900 (2009).
- Rief, M., Oesterhelt, F., Heymann, B., Gaub, H. E. Single Molecule Force Spectroscopy on Polysaccharides by Atomic Force Microscopy. Science. 275 (5304), 1295-1297 (1997).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Marszalek, P. E., Oberhauser, A. F., Pang, Y. P., Fernandez, J. M. Polysaccharide Elasticity Governed by Chair-Boat Transitions of the Glucopyranose Ring. Nature. 396 (6712), 661-664 (1998).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical Stability of Single DNA Molecules. Biophysical Journal. 78 (4), 1997-2007 (2000).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-Molecule Force-Clamp Experiments Reveal Kinetics of Mechanically Activated Silyl Ester Hydrolysis. ACS nano. 6 (2), 1314-1321 (2012).
- Schmidt, S. W., Beyer, M. K., Clausen-Schaumann, H. Dynamic Strength of the Silicon-Carbon Bond Observed Over Three Decades of Force-Loading Rates. Journal of the American Chemical Society. 130 (11), 3664-3668 (2008).
- Schmidt, S. W., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Mechanically Activated Rupture of Single Covalent Bonds: Evidence of Force Induced Bond Hydrolysis. Physical Chemistry Chemical Physics. 13 (13), 5994-5999 (2011).
- Schmidt, S. W., Pill, M. F., Kersch, A., Clausen-Schaumann, H., Beyer, M. K. Mechanically Induced Silyl Ester Cleavage Under Acidic Conditions Investigated by AFM-Based Single-Molecule Force Spectroscopy in the Force-Ramp Mode. Faraday Discussions. 170, 357-367 (2014).
- Rief, M., Gautel, M., Gaub, H. E. Unfolding Forces of Titin and Fibronectin Domains Directly Measured by AFM. Advances in Experimental Medicine and Biology. 481, 129-136 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유