Method Article
Kovalente Immobilisierung von Proteinen für die Einzelmolekül-Spektroskopie Kraft
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die kovalente Immobilisierung von Proteinen mit einer Heterobifunctional Silan Haftvermittler auf Siliziumoxid Oberflächen für die atomic Force Mikroskopie basierend Einzelmolekül Kraft Spektroskopie entwickelt die am Beispiel der Interaktion von RrgA (Pilus-1 Tipp adhäsin des Streptococcus Pneumoniae) mit Fibronektin.
Zusammenfassung
In den letzten Jahren basierte Rasterkraftmikroskopie (AFM) Einzelmolekül-Kraft-Spektroskopie (SMF) erweitert das Verständnis der molekularen Eigenschaften und Funktionen. Es gab uns die Möglichkeit, eine Vielzahl von biophysikalischen Mechanismen, z. B., wie bakterielle Adhesins binden an Host Oberfläche Rezeptoren genauer zu erkunden. Neben anderen Faktoren hängt der Erfolg SMFS Experimente auf die funktionale und native Immobilisierung von Biomolekülen auf festen Oberflächen und AFM-Tipps. Hier beschreiben wir eine einfache Protokoll für die kovalente Kopplung von Proteinen zu Silizium-Oberflächen mit Silan-PEG-Carboxyls und die etablierten N-hydroxysuccinimid/1-ethyl-3-(3-dimethyl-aminopropyl)carbodiimid (EDC/NHS) Chemie in Ordnung Das Zusammenspiel von Pilus-1 adhäsin RrgA aus dem gram-positiven Bakterium Streptococcus Pneumoniae (Streptococcus Pneumoniae) mit der extrazellulären Matrix Protein Fibronektin (Fn) zu erkunden. Unsere Ergebnisse zeigen, dass die Oberfläche Funktionalisierung zu einer homogenen Verteilung der Fn auf der Glasoberfläche und eine entsprechende Konzentration von RrgA auf der AFM Cantilever Spitze, offensichtlich durch den Zielwert von bis zu 20 % der Interaktion Ereignissedes SMFS führt Messungen und ergab, dass RrgA mit einer mittleren Kraft von 52 pN an Fn bindet. Das Protokoll kann Paar über bestimmte freie Thiol Websitegruppen eingestellt werden. Dies führt zu einer vordefinierten Protein oder Molekül Ausrichtung und eignet sich für andere biophysikalischen Anwendungen neben dem SMF.
Einleitung
Neben optischen und magnetischen Pinzette der Rasterkraft-Mikroskop (AFM)1,2 entstanden als ein nützliches Tool zum Analysieren und Bearbeiten von Molekülen und Sonde, ihren Eigenschaften und Funktionen, einschließlich ihrer Reaktion auf externe Kraft3 ,4. Im Gegensatz zu Methoden wie das Enzym verknüpften Immunosorbentprobe Assay (ELISA), Oberfläche Plasmon-Resonanz (SPR) oder Quarz Kristall Mikrowaage (QCM) Setups, AFM ermöglicht zu Interaktionen auf die einzelnen Moleküls (SMF)5 und Einzelzelle (SKSF)6 Messen . Diese Technologien ergab wertvolle Einblicke in die Bindung Mechanismen wie die Fang-Anleihen für die Interaktion von E. Coli Pilus Protein FimH mit Mannose7oder Tandem β-Reißverschluss wiederholt durch Fn-bindende Proteine aus S. Aureus gebildet gefunden bei der Bindung an Fn8. Wir waren vor kurzem in der Lage zu zeigen, dass der Pilus-1 adhäsin RrgA9,10 aus dem gram-positiven Bakterium Streptococcus Pneumoniae (Streptococcus Pneumoniae)11 ist in der Lage, an Fibronektin12 binden mit seinen zwei terminal-Domains. Dies ergab einen neuen zwei-Domain Bindungsmechanismus unterscheidet sich von der Tandem-β-Reißverschluss und Piliated Pneumokokken zu bilden und zu pflegen eine vorübergehende Kontakt zum Fibronektin-haltigen Host Oberflächen13ermöglichen kann.
Der Erfolg des SMFS Experimente hängt entscheidend von der funktionalen und native Immobilisierung von Biomolekülen auf festen Oberflächen und AFM-Tipps. Wie hohe Kräfte bei SMFS Messungen auftreten können, sollte die Proteine bevorzugt kovalent an die Oberfläche gekoppelt. Es gibt eine große Anzahl von verschiedenen Kupplung Methoden für die Immobilisierung von Proteine und andere Biomoleküle als auch ganze Zellen auf (anorganisch) festen Oberflächen, Nano-Partikeln und anderen Geräten beschrieben in der Literatur14,15 ,16,17,18,19,20,21,22,23,24, 25,26,27. Diese Protokolle machen oft gefährlicher Stoffe zu verwenden, sind schwer zu führen und/oder erfordern spezielle Ausrüstung (z.B. Plasma Reiniger). Eine einfache Möglichkeit, paar Moleküle auf Glas ist Befestigung eine dickere Polymerschicht Heterobifunctional Vernetzer mit einem Silan-reaktive Gruppe auf der einen Seite und einem Amin-reaktive Gruppe auf ihrer anderen Seite. Abhängig von der Anwendung der Haftvermittler können umfassen flexible Hydro-Kohlenstoffketten mit variabler Länge, z. B.., Polyäthylenglycol (PEG). Sie unterdrücken unspezifische Wechselwirkungen der modifizierten Oberflächen (z.B., hydrophobe, elektrostatische und van-der-Waals-Wechselwirkungen) und der gekoppelten Molekül Rotationsfreiheit vorsehen.
Hier beschreiben wir ein allgemeines Protokoll für die kovalente Kopplung von Proteinen enthält einen oder mehrere freie Aminogruppen (-NH2) Glas Oberflächen und Siliziumnitrid AFM Tipps über eine Heterobifunctional Ethoxy Silan-PEG-Carboxylgruppen (-COOH). Dieses Protokoll kann in SMFS Experimente, die beispielhaft ist basierend auf dem Zusammenspiel von RrgA und das extrazelluläre Matrix Protein Fn verwendet werden (siehe Abbildung 1 für eine Übersicht).
Der erste Schritt ist der Silanisierung der Oberfläche28,29,30,31. Es geht um die Hydrolyse der Ethoxy-Gruppen von der Haftvermittler um hochreaktive SiOH-Gruppen bilden. Diese können mit SiOH-Gruppen auf dem Substrat reagieren. In einem primären Kondensation Schritt, diese Silanolen Form Wasserstoffbindungen und ausgebreitet auf dem Substrat. In einer sekundären Kondensationsreaktion (das erfordert in der Regel Hitze oder Vakuum, um Wasser zu entfernen), Siloxan Anleihen gebildet werden. Daraus resultiert eine kovalent verbunden Organo-Silan-Schicht.
Der zweite Schritt ist die Kopplung von Proteinen zum funktionalen (-COOH) Gruppen, die aus dem Polymer-32erweitern. Erstens wird in eine reaktive N-Hydroxysuccinimid (NHS) Ester Mittelstufe, die durch die etablierten NHS/EDC gewonnen wird die Säure umgewandelt (1-Ethyl - 3-(3-Dimethylaminopropyl) Carbodiimid Chemie33 und erfährt Nucleophilen Substitution endlich eine Amid-Bindung mit primären Aminen der Proteine zu bilden.
Auf diese Weise RrgA mit Silizium-Nitrid-AFM-Tipps und menschlichen Fn auf Glassubstraten in einer wirrlage gekoppelt war und ihre Interaktion Kräfte wurden auf der Einzelmolekül-Ebene analysiert. Unsere Ergebnisse zeigen, dass die beschriebenen Oberflächenchemie zu einer homogenen Verteilung der Fn auf der Glasoberfläche und eine entsprechende Konzentration von RrgA an der Spitze, offensichtlich durch den Zielwert von bis zu 20 % der Interaktion Ereignissedes SMFS Messungen führt. Diese Chemie reduziert die unspezifischen Hintergrund Interaktionen, wenig Veränderung während der Datenerfassung unterliegt und eignet sich daher hervorragend für präzise SMFS Experimente.
Protokoll
(1) Immobilisierung von Proteinen über funktionelle Silane Haftvermittler
Hinweis: Abbildung 1 gibt einen Überblick über die Oberflächenchemie in diesem Protokoll angewendet.
Achtung: Im folgenden Protokoll sind verschiedene Chemikalien mit korrosiven und Haut irritierend Eigenschaften verwendet. Tragen Sie angemessene (säurebeständig) Handschuhe, Schutzbrille und Laborkittel und arbeiten unter dem Abzug und erarbeiten von Lösungen zur Vermeidung von Inhalation von dämpfen.
- Funktionalisierung von Glasoberflächen und Silizium-Nitrid Freischwinger mit Silan Kopplung Agenten
- Entfernen Sie groben Staub und Verschmutzungen von Glas-Objektträger mit Isopropanol und fusselfreien Präzision wischt und schneiden Sie die Folien in der gewünschten Größe (optional).
Hinweis: Neben Glas, kann die feste Oberfläche Kieselsäure, Quarz und die Oxide von Aluminium, Kupfer, Zinn, Titan, Eisen, Chrom, Zirkonium, Nickel und Zink sein.
Achtung: Die Glas-Folien schneiden verursachen scharfe Kanten. - Stelle das Glas in einem Färbung Glas gleitet gefüllt mit Salzsäure (33 % HCl) verdünnt mit doppelt destilliertem Wasser (DdH2O) auf 3 bis 5 % (V/V), schließen Sie das Glas mit entsprechenden Deckel und legen Sie sie in ein Ultraschallbad für 90 min bei Raumtemperatur.
Hinweis: Das verwendete Glas hat einen Durchmesser von 6 cm und eine ungefähre Größe von 65-70 mL. Einem entsprechenden Volumen der verdünnte HCl für das Glas ist 50 mL mit 5 mL 33 % HCl und 45 mL DdH2O. Die HCl effektiv entfernt unverbindliche Metall-Ionen, vor allem Natrium, Kalium und Kalzium und verringert das Silizium um eine Hydroxyl-gesättigten Glas-Oberfläche zu erzeugen.
Achtung: HCl ist ätzend und Haut reizen. Angemessene säureresistente Handschuhe, Schutzbrille und Labor Mantel und arbeiten unter dem Abzug während der Vorbereitung der Lösung um das Einatmen der Dämpfe zu vermeiden. - Legen Sie die Siliziumnitrid AFM freitragende Sonden auf einem sauberen Objektträger mit der Spitze nach oben und bestrahlen mit Licht von oben für mindestens 90 min ultra Violet.
Hinweis: Für die Einzelmolekül-Kraft-Spektroskopie eignen sich Kragarme mit einem nominalen Federkonstante von 0,01 bis 0,1 N m-1 . Bestrahlung der Freischwinger Oberfläche mit UV-Licht entfernt organische Verunreinigungen, vor allem Fettstoffe und hydrophilen auf der einen Seite zu rendern. Wenn die andere Seite wird stark verschmutzt - was nicht der Fall sein sollte oder wenn die Cantilever-Sonden Auspacken der Lieferanten - frische verwendet werden es die SMFS Messung beeinflussen kann. Eine gründliche Reinigung des gesamten Cantilever Chips mit Piranha-Lösung, die in vielen Studien34verwendet worden ist, kann helfen.
Achtung: UV-Licht ist schädlich für die Augen; Bestrahlung der Freischwinger Sonden sollten daher in einer UV-Licht undurchlässigen Kammer durchgeführt werden. Piranha-Lösung ist hoch reaktiv und kann brennen, Haut, Papier und anderes organisches Material. Verwenden Sie keine Kunststoff-Behälter. Wenn im Geschirr oder Gläser auch mit geringen Mengen an organischen Oberflächen Verschmutzungen (z. B.von Vornutzung) platziert, kann es schnell zu reagieren. - Ersetzen die Salzsäure in der Färbung Glas mit DdH2O ohne die Glasoberfläche Trocknen und legen Sie das Glas wieder im Ultraschallbad für eine weitere 10 min. ersetzen Sie das Wasser zwei Mal für 10 min bzw. in der Salzsäure richtig abwaschen Säure.
- In der Zwischenzeit auflösen Ethoxy (oder Methoxy) Silan Polyethylenglykol Säure (Si (OC2H5)3-PEG-COOH) in einer Mischung aus Ethanol und DdH2O (V/V 95 % / 5 %, pH 4.6 mit Essigsäure eingestellt), eine Endkonzentration von 0,1 mg mL -1. Speichern Sie die Lösung, die hermetisch versiegelt, um die Verdunstung des Ethanols zu vermeiden.
Hinweis: Silan Kopplungsmittel reagieren empfindlich auf Feuchtigkeit und Temperatur. Daher sollten sie unter Schutzgas (N2), bei niedriger Temperatur (-20 ° C) und trocken gelagert werden. Vor dem Öffnen der Flasche, stellen Sie sicher, dass die Silane Raumtemperatur zur Minimierung von Hydratation erreicht haben und damit Passivierung von reaktiven Gruppen. Heterobifunctional PEG Haftvermittler sind mit zahlreichen unterschiedlichen Funktionsgruppen und verschiedene Abstandhalter Längen erhältlich. Für zufällige Immobilisierung der Proteine über muss ihre freie Aminogruppen (NH2), wie beschrieben in diesem Protokoll, die funktionelle Gruppe zusätzlich zu den Ethoxy/Methoxy-Silan ein NHS-Ester. Neben dem Kauf von einem Silan-Agent mit NHS Ester, soll eine einfache Möglichkeit, solche NHS Ester gewinnen aktivieren eine Carboxylgruppe (-COOH) mit 1-ethyl-3-(3-dimethylaminopropyl) Carbodiimid (EDC) und NHS (siehe 1.2.1. und 1.2.2.).
Achtung: Ethanol ist entzündlich und Haut irritierend. Essigsäure ist brennbar und ätzend. Achten Sie darauf, nicht reaktiven Silanen auf Haut oder in die Augen bekommen. Tragen Sie geeignete Handschuhe, Schutzbrille und Laborkittel und unter dem Abzug arbeiten Sie, um das Einatmen von Dämpfen vermeiden. - Füllen Sie die Silan-Lösung in zwei separaten Petrischalen, legen Sie die vorbereitete Freischwinger Sonden und Glas-Objektträger bzw. in einer Petrischale, hermetisch verschließen (z.B. Parafilm) zur Vermeidung von Verdampfung des Ethanols und inkubieren Sie stationär für 90 min bei Raumtemperatur.
Hinweis: Die optimale Größe der Petrischale richtet sich nach der Anzahl der Cantilever-Sonden und die Größe der Glas-Folien die funktionalisiert werden sollte. Ein Durchmesser für gutes Handling und niedrigen Reagenz Volumen beträgt 50-60 mm. Zur Vermeidung von unerwünschten Biegung des nadelträgers während durchdringt die Luft-Wasser-Grenzfläche der Cantilever sollten in einem 90 ° Winkel zur Luft-Wasser-Grenzfläche stattfinden. Die Inkubation von Glas-Objektträger (aber nicht die Cantilever-Sonden) kann wahlweise auf einem Orbitalschüttler durchgeführt werden. - Spülen Sie die Freischwinger und Glas Folien in drei aufeinander folgenden Becher mit reinem Ethanol völlig ungebunden Silan-Verbindungen abwaschen.
Hinweis: Zur Vermeidung von unerwünschten Biegung des nadelträgers während durchdringt die Luft-Wasser-Grenzfläche sollte der Cantilever in einem 90 ° Winkel gehalten werden. - Legen Sie die funktionalisierten Glas-Folien in der Färbung Jar und der Cantilever auf einem sauberen Objektträger und Heilung bei 110 ° C für 30 min.
Hinweis: Heilen mit Wärme induziert die Bildung von Siloxan kovalente Bindungen und der Entfernung von Wasser. Als das Glas Folien waren nur auf der einen Seite funktionalisiert, achten Sie darauf, die beschichtete Seite richtig anzuzeigen. - Speichern der silanisiert glasmuster und Cantilever-Sonden in einem Vakuum Exsikkator bis zu einer Woche.
Hinweis: Das Protokoll kann hier angehalten werden.
- Entfernen Sie groben Staub und Verschmutzungen von Glas-Objektträger mit Isopropanol und fusselfreien Präzision wischt und schneiden Sie die Folien in der gewünschten Größe (optional).
- Zufällige Immobilisierung von Proteinen auf silanisiert Glas und Silizium-Nitrid-Freischwinger
Hinweis: Zur Vermeidung von unerwünschten Biegung des nadelträgers sollte die Cantilever-Sonde in einem 90 ° Winkel gehalten werden beim Eindringen von Luft-Wasser-Schnittstellen.- Bereiten Sie eine Lösung mit 42 mg mL-1 von EDC und 20 mg mL-1 NHS in standard Phosphat gepufferte Kochsalzlösung (PBS; 137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 1,8 mM KH2PO4, pH 7.4).
Achtung: EDC ist ätzend und reizt Haut und schwere Augenschäden verursachen kann. Tragen Sie geeignete Handschuhe, Schutzbrille und Laborkittel. - Decken Sie die Silan beschichteten Objektträger mit der Lösung und silanisiert Freischwinger Sonden in einen Tropfen der Lösung EDC/NHS und 10 min bei Raumtemperatur inkubieren.
Hinweis: Für die Inkubation der Cantilever-Sonden eignet sich die Originalverpackung Freischwinger. Um Proteine über ihre freie Aminogruppen an die Carboxyls koppeln (-COOH) der Heterobifunctional Silan-PEG Agenten, die - COOH Gruppe mit der weit verbreiteten EDC/NHS-Chemie aktiviert ist. EDC Paare NHS an der Carbonsäure bilden eine "stabile" NHS Ester ermöglicht effiziente Konjugation zu primären Aminen bei physiologischen pH-Wert in einem nächsten Schritt. - Spülen Sie die Freischwinger und Glas Folien gründlich mit PBS in drei aufeinander folgenden Becher um übermäßige EDC/NHS vollständig abwaschen.
Hinweis: Dieser Waschschritt ist entscheidend als verbleibende EDC/NHS kann Crosslink Proteine und damit deren Funktionalität zu verändern. - Die aktivierte Glasobjektträger mit brüten und die Cantilever-Sonden in einem Tropfen des gewünschten Proteinlösung in einer feuchten Kammer bei Raumtemperatur. Die Protein-Konzentration und Inkubation Zeit sollte an die Anforderungen des Experiments angepasst werden. In der Regel eine Konzentration zwischen 0,5 bis 1 mg mL-1 und Inkubation Zeiten von 30 min bis 2 h eignen sich für die meisten Proteine. Im Falle von Fibronektin (auf Glasobjektträger) und Pilus-1 Tipp Eiweiß RrgA (Cantilever) eine molare Konzentration von 1,5 µM und 3 µM bzw. eine Inkubationszeit von 2 h sind ausreichend.
- Die Glasobjektträger waschen und der Cantilever Sonden gründlich mit PBS in drei aufeinander folgenden Becher um ungebundene Proteine abwaschen.
- Tränken Sie die restlichen NHS Ester mit Tris (Hydroxymethyl)-Aminomethan indem man die Sonden in Tris gepufferte Kochsalzlösung (TBS; 50 mM Tris, 150 mM NaCl, pH 7.6) für 20 min bei Raumtemperatur.
Hinweis: Dieser Schritt reduziert unerwünschte kovalente Kopplung von Proteinen zwischen der funktionalisierten Oberfläche der AFM-Spitze und das Glas, da Aminogruppen des Tris an die übrigen aktivierten COOH-Gruppen auf der Oberfläche Freischwinger und Substrat binden können. - Die Glasobjektträger waschen und der Cantilever Sonden gründlich mit PBS und speichern sie in separaten Petrischalen mit PBS-Puffer bis zum Gebrauch abgedeckt.
Hinweis: Die Proben sollten frisch zubereitet und am selben Tag verwendet.
- Bereiten Sie eine Lösung mit 42 mg mL-1 von EDC und 20 mg mL-1 NHS in standard Phosphat gepufferte Kochsalzlösung (PBS; 137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 1,8 mM KH2PO4, pH 7.4).
(2) Rasterkraftmikroskopie basierte Einzelmolekül-Kraft-Spektroskopie
Hinweis: In dieser Arbeit wurde ein Rasterkraftmikroskop von JPK Instruments verwendet und das Set ups für Kraft-Weg-Kurven zu erhalten mit der Kraft RampDesigner definiert wurde.
- Freischwinger-Kalibrierung mit der thermischen Rauschen Methode35
Hinweis: Für Freischwinger Kalibrierung, folgen Sie den Schritt in das Handbuch des Herstellers. Die meisten freitragende Lieferanten Zustand eine ungefähre Federkonstante, die in der Regel berechnet sich aus der nominalen Cantilever-Form (Länge, Breite, Dicke) und ist daher nicht sehr zuverlässig. Da die richtige Federkonstante entscheidend ist, ist es ratsam, die Cantilever-Kalibrierung in dreifacher Ausfertigung beschrieben durchzuführen und verwenden die Mittelwerte der optischen Hebel Empfindlichkeit und Federkonstante. Es kann nützlich sein, die Cantilever-Durchbiegung in Volt (V) aufzeichnen während des Experiments und konvertieren es zu erzwingen (pN) danach mit der optischen Hebel Empfindlichkeit und Federkonstante Mittelwerte. Die Frühling Konstante und optische Hebel Empfindlichkeit kann vor und/oder nach dem Experiment bestimmt werden, solange die Laserposition nicht auf den Cantilever geändert wird (die Position des reflektierten Laser kann auf die Fotodiode nachgestellt werden).- Befestigen Sie eine sauberes, frisches Glas-Folie auf der AFM-Probenhalter und bedecken Sie es mit PBS-Puffer.
Hinweis: Die Kalibrierung sollte auf eine harte Unterlage (z.B. Glas) und in den gleichen Puffer als die eigentlichen Experimente durchgeführt werden. - Die vorbereiteten Cantilever-Sonde am Freischwinger Halter zu beheben, legen Sie sie in der AFM-Spitze und sorgfältig nass der Cantilever mit einem Rückgang von PBS-Puffer.
Hinweis: Die Benetzung des nadelträgers reduziert die Oberflächenspannung, die beim Eindringen in die PBS-Puffer auf die Kalibrierung Objektträger und damit unerwünschte Biegung des nadelträgers erscheinen. - Langsam bewegen der Cantilever zur Kalibrierung Oberfläche, bis der Cantilever in der PBS-Puffer, aber immer noch von der Kalibrierung Oberfläche vollständig eingetaucht ist.
- Verwenden Sie die Draufsicht Lichtmikroskop der AFM oder (falls vorhanden) der inversen Mikroskop unter die AFM, den Laser der AFM auf der Rückseite des nadelträgers zu positionieren. Ort der Laserpunkt am Ende der Cantilever in der Nähe befindet sich die Spitze.
Hinweis: Der Laserpunkt sollte kurz vor dem Ende der Cantilever gefunden werden, aber es sollte vollständig auf den Freischwinger. Wenn keine optisches Mikroskop zur Verfügung steht, verwenden Sie ein Stück Papier für sichtbare Laserdioden oder eine Laser-Detektor-Karte für Infrarot-Laserdioden, steckte es unter dem AFM-Kopf und bewegen der Laserpunkt auf den Rand der Cantilever-Chip, befinden sich die Kragarme , bis Sie die Stelle auf dem Papier oder Detektor Karte zu sehen. Dann bewegen Sie den Laser parallel zur Kante. Wenn der Fleck verschwindet, ist es auf einem Freischwinger-Arm. Bewegen Sie für lineare Kragarme die Stelle am Ende des Hebelarms bis es auf den Papier/Detektor Karte und bewegen Sie es zurück erscheint, bis es wieder auf den Hebelarm (verschwindet aus der Papierkarte). Für dreieckige, legen Sie den Spot in der Mitte zwischen zwei Armen des nadelträgers und gegen Ende der Cantilever zu bewegen, bis sie von der Papierkarte verschwindet. Überprüfen Sie in der Mitte der Cantilever durch Verschieben der Punkt senkrecht zur Längsachse des nadelträgers. - Passen Sie die Position der vier-Quadranten-Detektor Fotodiode der AFM in einer Weise, dass der reflektierte Laserstrahl in der Mitte der Fotodiode positioniert ist.
Hinweis: Gehen Sie wie folgt vor: Verwenden Sie die Mikrometer-Schrauben in der Nähe der Detektor Diode, um die Diode in horizontaler und in vertikaler Richtung zu bewegen, bis das Summensignal aus allen vier Quadranten maximiert wird. Dann bewegen Sie die Diode in vertikaler Richtung, bis die vertikale Verformung Signal gleich NULL ist, und bewegen Sie die Diode in horizontaler Richtung, bis das seitliche Ablenkung Signal gleich NULL ist. Silizium-Nitrid kragarmen in der Regel haben eine gold-Beschichtung und sind daher ein Bimetall mit zwei unterschiedlichen thermischen Ausdehnungskoeffizienten. Daraus resultiert ein Temperaturdrift (ersichtlich in der vertikalen Ablenkung Signal) vor allem in Lösung. Um diese Drift bei Messungen zu verringern, lassen Sie das ganze System für ein paar Minuten vor Beginn der Kalibrierung equilibrate. - Öffnen Sie die kalibrierungsmanager in der AFM-Software und Kalibrieren Sie der Freischwinger Empfindlichkeit und Federkonstante des nadelträgers mit der thermischen Rauschen-Methode wie folgt.
- Vorsichtig nähern Sie sich die Substratoberfläche und zeichnen Sie eine Kraft-Weg-Kurve auf.
- Bestimmen Sie die optische Hebel Empfindlichkeit in nm/V durch den Einbau einer geraden Linie auf den steilsten Teil der Retraktion Kraftverlauf, wo ist die Spitze in Kontakt mit der Substratoberfläche. Die Empfindlichkeit ermöglicht die Federkonstante Freischwinger in pN/nm zu konvertieren.
Hinweis: Die Steigung der Kurve einfahren ist der Piezo Reisen Abstand Vs. die Änderung der Photodiode Spannung (gemessen in nm/V). - Zeichnen Sie mehrere Thermisches Rauschen Spektren der Freischwinger mit Freischwinger ca. 100 µm oder mehr von der Oberfläche Weg um jede Oberfläche Dämpfung auszuschließen.
- Bestimmen Sie die Federkonstante der Freischwinger in pN/V durch den Einbau eines harmonischen Oszillators der AFM-Software für das thermische Rauschen-Spektren.
- Langsam zurückziehen Sie der Cantilever und entziehen Sie die Lösung.
- Ersatz der Glasoberfläche verwendet für Freischwinger Kalibrierung mit der Probenoberfläche, die immobilisierten Proteine enthalten. Stellen Sie sicher, dass der Nadelträger und Probenoberfläche (und damit die Proteine) Trocknen nicht beim Wechsel der Glas-Folien.
- Befestigen Sie eine sauberes, frisches Glas-Folie auf der AFM-Probenhalter und bedecken Sie es mit PBS-Puffer.
- Interaktion zu zwingen Experimente auf die einzelnen Protein-Ebene
- Bewegen Sie langsam die feuchte Freischwinger in Richtung der Probenoberfläche bis die Freischwinger von PBS-Puffer, aber immer noch von der Substratoberfläche vollständig bedeckt ist.
Hinweis: Um die Temperaturdrift während des Experiments zu reduzieren, lassen Sie das ganze System für ein paar Minuten vor dem Start der Spektroskopie Kraftmessungen festgelegt. - Nähern sich die Oberfläche und nehmen mehrere Kraft-Weg-Kurven (≥ 500) an unterschiedlichen Orten der Probenoberfläche, mit eine Kontaktkraft von 250 pN einer Kontaktzeit von 1 s, eine Retraktion Länge von 2 µm und eine Retraktion Geschwindigkeit von 1 µm s-1.
Hinweis: Für allgemeine Kraft-Spektroskopie Anpassungen, folgen Sie Handbuch des Herstellers. Variationen: Die Einzugsgeschwindigkeit kann zwischen 0,1 und 5 µm s-1 variiert werden, um kinetical Daten in Abhängigkeit von der zunehmenden Kraftbelastung zu berechnen. Die Interaktionszeit kann variiert werden, um Zeit abhängige Bindung stärken zu analysieren. Statt die Einzugsgeschwindigkeit konstant zu halten, kann man die Kraftkonstante (Klemme Modus erzwingen) behalten.
- Bewegen Sie langsam die feuchte Freischwinger in Richtung der Probenoberfläche bis die Freischwinger von PBS-Puffer, aber immer noch von der Substratoberfläche vollständig bedeckt ist.
- Datenanalyse
Hinweis: Analyse der Daten erfolgte mit Hilfe der EDV-Software. Die Kraft-Weg-Kurven enthalten je nach die immobilisierten Proteine, die Einwirkzeit oder Einzugsgeschwindigkeit, ob ein Fußabdruck aufgenommen wurde oder nicht und andere Variablen Parametern mehrere unterschiedlichen Informationen. Datenanalyse und Interpretation können variieren stark zwischen verschiedenen SMFS Experimenten und können daher nicht im Detail hier beschrieben werden. Für das Zusammenspiel von RrgA und Fn kann das folgende Protokoll ein erster Schritt zur Analyse von SMF-Daten sein.- Öffnen Sie die gemessene Kraft-Kurve-Dateien durch Auswahl des Symbols Offenen Stapel von zwingen Scannen und verarbeiten Sie die Kraft-Weg-Kurven wie folgt:
- Direkt proportionale Kraft (F) umwandeln Sie die Cantilever-Auslenkung (V) durch Auswahl des Symbols (Re) kalibrieren V-Ablenkung durch Anpassung der Empfindlichkeit und Frühling Konstante .
Hinweis: Wenn Freischwinger Kalibrierung vor dem Experiment durchgeführt wurde, die Werte werden in der Kraft-Scan-Dateien gespeichert und werden automatisch bei der Kalibrierung der V-Durchbiegung verwendet. Wenn die Kalibrierung nach dem Experiment durchgeführt wurde, verwendet die Software Standardwerte, die auf die gemessenen Werte geändert werden können. - Subtrahieren Sie die Basislinie des Kanals in einer Region der Kraftverlauf weit von der Oberfläche Null Kraft einstellen durch Auswahl des Symbols Baseline Subtraktioneinfahren.
Hinweis: In einigen Fällen das einfahren haben nicht den gleichen Wert der Konstante Kraft und die Kurve kann eine lineare Neigung, die entfernt werden können, durch die Auswahl Offset + kippenanzuzeigen. - Definieren Sie den Punkt, wo die Spitze in Kontakt mit der Probe wird durch Auswahl des Symbols Zeigen Entschlossenheit zu kontaktieren .
- Umwandeln Sie die Höhe Signal durch Auswahl des Symbols Tipp-Sample Trennung Spitze-Probe-Trennung. Zusätzlich zu subtrahieren die Kontaktstelle Position, subtrahiert dieses Verfahren der Cantilever biegen um den Abstand zwischen Substratoberfläche und AFM-Spitze zu berechnen.
Hinweis: Zur Montage von Polymer elastischer Modelle, wie das erweiterbare Wurm-ähnliche-Chain-Modell und die Bestimmung der Interaktion Längen ist Spitze-Probe-Trennung, die für die Freischwinger Biegung korrigiert wird, erforderlich. Um die Kraft, die Rate von der Piste der Kraftverlauf und die Z-Piezo-Geschwindigkeit laden zu bestimmen, sollte die unkorrigierte Kraft Kurven verwendet werden. - Bildschirm die Kraft-Weg-Spuren für Kraftspitzen beim Bruch Längen über 70 nm (Länge der gestreckten PEG Abstandhalter)36 zu sortieren, unspezifische Interaktionen und gelten die erweiterbare Wurm-ähnliche-Chain-Modell zu den ausgewählten Gipfeln durch die Auswahl der Eine Polymer-Chain-Modell passen -Symbol und wählen Sie Extensible Endlosschraube-wie-Chain-Modell. Die Gipfel der Retraktion Kraftverlauf werden mit diesem Modell und Bruch Kräfte und Längen erhältlich, zusammen mit den elastischen Parametern des Polymers.
- Anzeigen der Daten als Histogramme zeigen die Kraft und Länge Distributionen. Verwenden Sie mindestens 100 unverbindliche Ereignisse für die Histogramme.
Ergebnisse
Das Protokoll beschriebenen hier Ergebnisse in eine kovalente Immobilisierung der Proteine über ihre zugänglich primäre Amine mit wirrlage (Abbildung 1). Abbildung 2 zeigt ein AFM-Bild einer silanisiert Glasfläche mit (links) und ohne (rechts) Fn immobilisiert, aufgenommen nach der Austrocknung der Proben unter einen sanften Strom von Stickstoff. Die Silan Polymerschicht zeigt nur kleine Oberfläche Wellen mit einer Höhe von ca. 2-5 nm (Abbildung 2, rechts), während auf der Oberfläche funktionalisiert mit Fn, etwa 10 nm hohe Fn Moleküle sind erkennbar (Abbildung 2, Links). In Nahaufnahmen kann die dimeres Struktur des Fn erkannt werden. Die Fn-Moleküle scheinen kompakt mit einer Höhe von ca. 4-5 nm über die PEG-Oberflächenbeschichtung und einer Länge von ~ 120 nm (siehe Beilagen).
Um die Wechselwirkungskräfte der RrgA mit Fn, zu untersuchen, die vor kurzem im Detail von unserer Gruppe13beschrieben wurde, war RrgA ein Silizium-Nitrid AFM Tipp und menschlichen Fn auf Glassubstrat (Abbildung 3a) gekoppelt. Abbildung 3 zeigt repräsentative Tipp Probe Trennung Kurven der Wechselwirkung von RrgA mit Fn mit einer Zugkraft Geschwindigkeit von 1 µm s-1aufgezeichnet. Die verwendeten Oberflächenchemie führte zu einer niedrigen Hintergrund Interaktion und wohlgeformten einzeln (oder doppelt) Interaktion Veranstaltungen (Abbildung 3a), die ausgestattet waren mit einem erweiterbaren Wurm wie Chain (eWLC)-Modell (rote Kurve). Plotten der Ergebnisse der Passung (Bruch Kraft und -Länge, siehe Abbildung 4) zeigt, dass nach Überwindung unspezifische Oberfläche Wechselwirkungen zwischen AFM-Spitze und Substrat und Dehnung der PEG-Linker (> 70 nm) bis ~ 19 % der Kraft Kurven zeigten Bruch Veranstaltungen mit einem mittleren Bruch zu zwingen, für die RrgA - Fn Zusammenspiel von ~ 52 pN an eine Spitze-Probe-Entfernungen von etwa 100 nm. Im Gegensatz dazu eine unanwendbar Oberflächenchemie (hier weggelassenen abschrecken mit Tris gepuffert saline Abb. 3 b) wird eine klare Bewertung einzelne Interaktion Veranstaltungen durch unspezifische Interaktionen verhindern mehrere Protein binden (Spur 2 und 3) und/oder Kovalente Kopplung von Proteinen zwischen der Probenoberfläche und der AFM Cantilever Spitze. Dies führt zu hohen Bruch Kräfte (Spur 1) eventuell begleitet von Entfaltung der Protein (Fn) Domains (Spur 4 und 5).
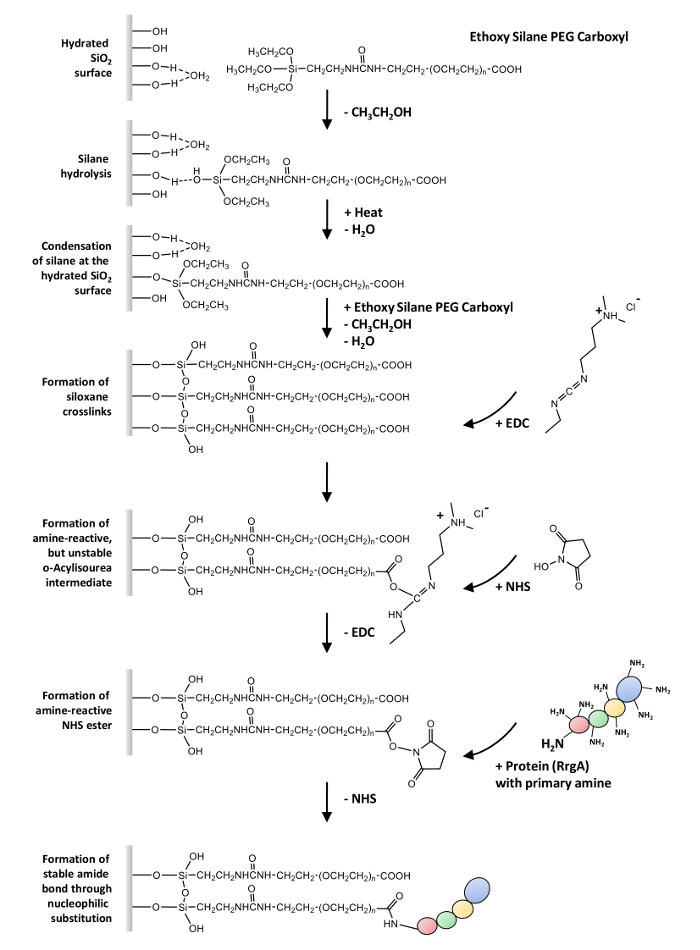
Abbildung 1: Übersicht über die Oberflächenchemie. Die Hydrolyse von Ethoxy Silan-PEG-Carboxylgruppen folgt die Kondensation an der hydratisierten Glasoberfläche und die Bildung von Siloxan Querverbindungen. Die Reaktion von EDC mit der Carboxylgruppen führt zu einer reaktiven o- Acylisourea, Amin-reaktives Zwischenprodukt mit einer extrem kurzen Halbwertszeit in wässriger Lösung (Hydrolyse). Das Zwischenprodukt ist durch die Bildung von einem NHS Ester stabilisiert, erfährt der Nucleophilen Substitution um endlich eine Amid-Bindung mit primären Aminen auf die Proteine zu bilden. Bitte klicken Sie hier für eine größere Version dieser Figur.
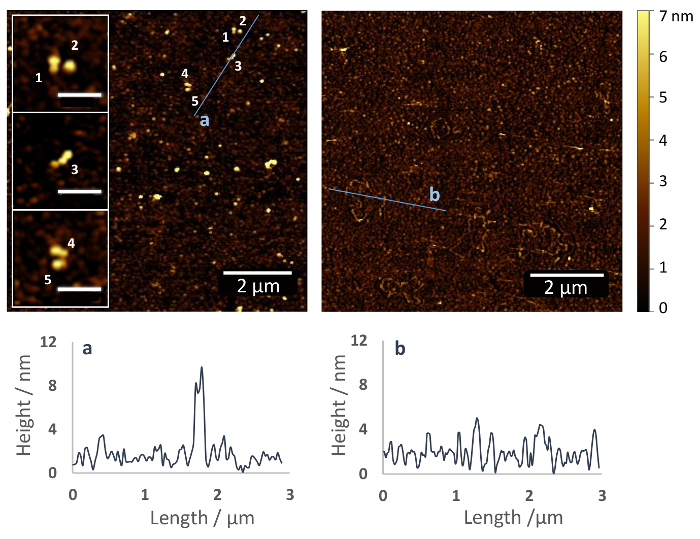
Abbildung 2: Immobilisierung von Fibronektin auf ein Glas Substrat über Heterobifunctional Ethoxy Silan PEG Carboxylgruppen Haftvermittler. AFM Bilder von funktionalisierten Glas Oberflächen mit (links) und ohne (rechts) FN Zahlen einzelnen Fn-Moleküle, die auf der Substratoberfläche (Einsätze) homogen verteilt sind. Die Moleküle nehmen eine dimeres und kompakte Struktur mit einer Höhe von ca. 4-5 nm über die PEG-Beschichtung und einer Länge von > 100 nm. Dies ähnelt die Struktur des Fn in Lösung und steht im Einklang mit früheren AFM-Daten auf anderen Oberflächen, z. B. Glimmer (Maßstabsleiste Inlays = 500 nm)37. Unterhalb der AFM sind Bilder Höhenprofile entlang der Linien in der AFM-Bilder angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
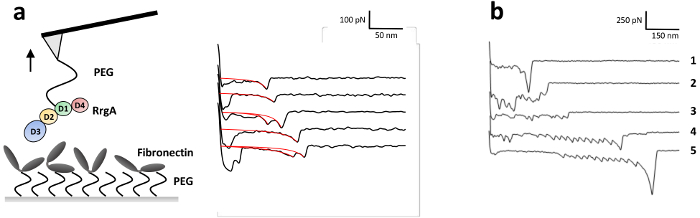
Abbildung 3: Abbildung eines SMFS Experiment und Vertreter zwingen Abstand Kurven des RrgA - Fn Interaktion. (a) RrgA und Fn waren kovalent verknüpfte über Heterobifunctional Ethoxy Silan PEG Carboxylgruppen Haftvermittler zu einer Siliziumnitrid AFM freitragende Spitze und einer Glasoberfläche bzw.. Vertreter SMFS zwingen Abstand, die Kurven für die RrgA - Fn Interaktion mit einer Retraktion Geschwindigkeit von 1 µm s-1 mit den beschriebenen Immobilisierung von RrgA und Fn angezeigt werden. Rote Kurven repräsentieren die erweiterbare Wurm-ähnliche Kette passt angewendet, um Bruch Kräfte und Längen zu erhalten. Die Figur wurde von Becke, Et Al., ACSnano 201813geändert. (b) Vertreter SMFS zwingen Abstand Kurven erhalten für die RrgA - Fn-Interaktion ohne abschrecken mit Tris gepufferte Kochsalzlösung. In diesem Fall das primäre Amin Tris abwesend war, dass aktive verbleibenden NHS Ester blieben ungesättigten während des Experiments. Dies führte zu Multi Protein binden (Spur 2 und 3) und die Klemmung der Proteine zwischen der Oberfläche und der AFM-Spitze führte zu hohen Bruch zwingt Begleitung (Fn)-Domäne Entfaltung (Spur 1, 4 und 5; beachten Sie die unterschiedlichen Skalierungen). Bitte klicken Sie hier für eine größere Version dieser Figur.
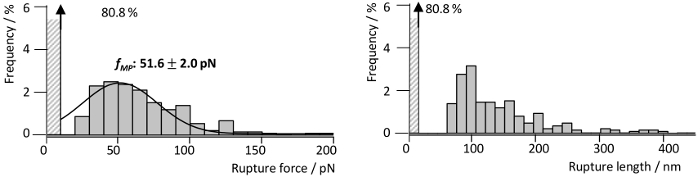
Abbildung 4: Kraft und Länge Verteilung der einzelnen RrgA - Fn Interaktionen. Bruch, Kraft und entsprechenden Bruch Länge Histogramme gewonnenen RrgA - Fn SMFS Interaktion Messungen (n = 1400) mit einer Retraktion Geschwindigkeit von 1 µm s-1. Die Histogramme zeigen eine wahrscheinlichste Bruch Kraft fMP von 51,6 pN (Gauss passen, schwarze Linie) und eine Ansammlung von Bruch Längen rund 100 nm. Die Figur wurde von Becke, Et Al., ACSnano, 201813geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Seit die Einführung des AFM SMFS basierend, entwickelte es sich zu eine weit verbreitete Technik, Intra- und intermolekularen Kräfte der einzelnen Proteine, Nukleinsäuren und andere Biomoleküle3,4,5direkt zu erforschen. Für erfolgreiche SMFS Experimente ist eine geeignete Oberfläche Kupplung Strategie eine Voraussetzung. Um die Intramolekulare Kräfte in natürlichen und synthetischen Polymeren Sonde, können die Polymere direkt auf die Substratoberfläche und AFM Tipp36,38,39,40,41gekoppelt sein. Für die Untersuchung von Inter molekulare Interaktionen, wie Molekulare Bindungen, aber es ist ratsam, flexible Linker Moleküle wie Hetero-bifunktionelle PEG linker oder Polypeptidketten, mithilfe der Interaktionspartner an die AFM-Spitze befestigen und die Substratoberfläche, um die korrekte Ausrichtung der Bindungspartner, Short-Range Oberfläche Kräfte zu überwinden und zur Vermeidung von Denaturierung und Entfaltung der Proteine21,22,23zu ermöglichen, 24,25,26,27,42. Wir beschrieben daher einfach und geradlinig Protokoll für die kovalente Immobilisierung der Proteine über ihre zugänglich primäre Amine mit Hetero-bifunktionelle PEG Abstandhalter.
Wir zeigten ihre Anwendbarkeit bei der Untersuchung der Wechselwirkung zwischen adhäsin RrgA von S. Pneumoniae und das extrazelluläre Matrix Protein Fn, erst ausführlich beschrieben an anderer Stelle13.
Die Oberflächenchemie ist gut etabliert und analysiert und ähnliche Ansätze erfolgreich in mehreren SMFS Experimente19,42,43,44,45verwendet wurden. Die Silylether zur Kopplung des Silan Polymers an der Oberfläche ist abhängig von Hydrolyse. Der Grad der Hydrolyse hängt die Menge des gebildeten Siloxan-Anleihen, die während des Prozesses der Silanisierung gesteuert werden kann. Wenn hohe Wechselwirkungskräfte (≥ 1000 pN) während SMFS Messungen zu erwarten sind, sollte der Silanisierung durchgeführt über Dampf-Phase Deposition30 führt zu der Bildung von eine ununterbrochene Schicht der Siloxane. Wie bei vielen Experimenten (z.B. viele Protein-Protein-Wechselwirkungen) sind die Wechselwirkungskräfte im Bereich von wenigen hundert pN und das beschriebene Verfahren, in denen, das Siloxan Bildung erfolgt durch Ablagerung von einer wässrigen Phase und ungebunden Organo-Silane werden sorgfältig mit Ethanol (Schritt 1.1.7) gefolgt von Härtung mit Wärme (Schritt 1.1.8) abgewaschen, ist ausreichend.
Ein weiterer wichtiger Schritt ist, die restlichen EDC waschen und NHS-Moleküle aus der Oberfläche (Schritt 1.2.3), wie Reste der Aktivierung von Carboxylgruppen der Proteine führen werden. Dies kann entweder Ergebnis in Vernetzung von Proteinen auf der gleichen Fläche, die ihre Funktionalität verändern können oder kovalent paar aktiviert Proteine an andere Proteine auf der gegenüberliegenden Fläche. Dies kann zu spannen der Proteine zwischen der Oberfläche und der AFM-Spitze, führt zu hohen Bruch Kräfte, eventuell begleitet von Domäne Entfaltung führen (siehe Abb. 3 b, Spur 1, 4 und 5, Entfaltung des Fn-Domänen)46. Das gleiche Problem kann auftreten, wenn die aktive NHS Ester der PEG Abstandhalter ungesättigten übrig sind. Daher ist die Inkubation mit Tris gepufferte Kochsalzlösung (Schritt 1.2.6) empfohlen, da das primäre Amin Tris die restlichen reaktive Aminogruppen stillt.
Nach dem Protokoll schrittweise führt zu einer homogenen Verteilung der Fn auf dem silanisiert Glas Oberfläche (siehe Abbildung 2), so dass eine dimeres Form des Proteins. Dies ähnelt Fn´s Struktur in Lösung und steht im Einklang mit früheren AFM-Daten auf andere Probe Oberflächen37. Darüber hinaus wird eine entsprechende Konzentration des RrgA auf die AFM-Spitze erreicht, die erzeugt eines Zielwert von ~ 20 % der klar definierten Interaktion Ereignisse während des SMFS Messungen (Abbildung 3 und Abbildung 4). Eine andere elegante Möglichkeit, Steuern Sie die Anzahl der Moleküle gekoppelt mit der Probe Substrat und Cantilever Spitze neben unterschiedlichen Protein Konzentration und/oder Inkubation Zeit, ist die Kombination von Silan-Agenten mit unterschiedlichen sekundären Funktionsgruppen. Durch die Änderung des Verhältnis von Protein reaktivgruppen erstreckt sich von der PEG-Polymer, kann die Zahl der immobilisierten Proteine gesteuerte15,16,17,18.
Das hier beschriebene Protokoll einsetzbar auch anderen -NH2 enthaltenden Molekülen zu immobilisieren oder paar Proteine auf andere Siliziumoxid Fläche neben Glas und Siliziumnitrid angepasst werden. Abhängig von der Protein-Design der Amine reaktive Carboxylgruppe kann geändert werden zu einer Sulfhydryl reaktive Gruppe (z.B., Maleimide oder ortho-Pyridyl Disulfid) Protein über koppeln sein freies – SH-Gruppen. Für Fn führt dies zu einer vordefinierten Orientierung13,17,20.
Zusammenfassend lässt sich sagen dieses Protokoll kann angepasst werden, um verschiedenen Anforderungen zu bedienen und eignet sich für andere biophysikalischen Anwendungen neben Einzelmolekül-Kraft-Spektroskopie-Experimenten.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
TB und HG anerkennen, finanziellen Unterstützung durch den Europäischen Forschungsrat "Cellufuel, Advanced Grant Nr. 294438". HCS erkennt finanziellen Unterstützung des Bundesministeriums für Bildung und Forschung durch die Innovationsallianz Technofunktionale Anthocyane (TeFuProt), SS erkennt finanzielle Unterstützung durch das Bayerische Staatsministerium für Wissenschaft und Bildung durch den Forschungsschwerpunkt "Zugespitzt Und Biophysikalische Charakterisierung Dreidimensionaler Gewebe - Galopp". Wir danken Conny Hasselberg-Christoph und Martina Hörig für technischen support
Materialien
| Name | Company | Catalog Number | Comments |
| Material | |||
| 2-Propanol | Carl Roth | 6752 | |
| 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide | Sigma-Aldrich | 03450 | EDC |
| Acetic acid | Carl Roth | 3738 | 100 %; analytical purity |
| Doubly distilled water | |||
| Ethanol | Carl Roth | 9065 | ≥ 99.8 %; analytical purity |
| Ethoxy silane polyethylene glycol acid | Nanocs | PG2-CASL-5k | 5 kDa; COOH-PEG-Si(OC2H5)3 |
| Hydrochloric acid | Carl Roth | X896 | 32 % |
| N-Hydroxysuccinimid | Merck | 804518 | NHS; for synthesis |
| Phosphate Buffered Saline - Dulbecco | Biochrom | L1825 | PBS |
| Probe molecule e.g. Fibronectin, human plasma | Sigma-Aldrich | F1056 | |
| Probe molecule e.g. RrgA | Produced in laboratory | ||
| Sodiumchlorid | Carl Roth | 9265 | NaCl |
| Tris(hydroxymethyl)-aminomethan | Carl Roth | AE15 | ≥ 99,3 %; TRIS; Buffer Grade |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Beakers | |||
| Glass cutter | |||
| Glass slides | Carl Roth | 0656 | |
| Inert gas desiccator | Sicco | ||
| Inverted Microscope - Zeiss Axiovert 200 | Zeiss | ||
| JPK NanoWizard 1 | JPK Instruments | ||
| JPK NanoWizard SPM and DP software | JPK Instruments | ||
| Laboratory oven | Binder | ||
| Magnetic stirrer | IKA | ||
| Micro spatula | |||
| Microcentrifuge tubes | |||
| Microsoft Excel | Microsoft | ||
| Parafilm M | Brand | 701606 | |
| Petri dishes | |||
| pH-meter | Knick | ||
| Pipettes | Starlab | 10-100 µl, 50-200 µl, 100-1000 µl | |
| Precision balance | Acculab | ||
| Silicon nitride cantilever - MLCT | Bruker AXS S.A.S | Spring constant ≤ 100 pN/nm | |
| Sonication bath | Bandelin | ||
| Staining jar | |||
| Stereo microscope - Zeiss Stemi | Zeiss | ||
| Stir bar | |||
| Kimtech science precision wipes | Kimberly-Clark | ||
| Twezzers | |||
| UV PenRay | UVP, LLC | 90-0012-01 | Mercury spectrum with the primary energy at 254 nm |
| Vacuum desiccator | |||
| Vacuum pump | |||
| Vortex mixer | VWR | ||
| Weighing paper | Carl Roth | TP64 |
Referenzen
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Neuman, K. C., Nagy, A. Single-Molecule Force Spectroscopy: Optical Tweezers, Magnetic Tweezers and Atomic Force Microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Dufrene, Y. F. Atomic Force Microscopy, a Powerful Tool in Microbiology. Journal of Bacteriology. 184 (19), 5205-5213 (2002).
- Muller, D. J., Dufrene, Y. F. Atomic Force Microscopy as a Multifunctional Molecular Toolbox in Nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Hinterdorfer, P., Dufrene, Y. F. Detection and Localization of Single Molecular Recognition Events Using Atomic Force Microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Dufrene, Y. F. Sticky Microbes: Forces in Microbial Cell Adhesion. Trends in Microbiology. 23 (6), 376-382 (2015).
- Yakovenko, O., et al. FimH Forms Catch Bonds That Are Enhanced by Mechanical Force Due to Allosteric Regulation. The Journal of Biological Chemistry. 283 (17), 11596-11605 (2008).
- Casillas-Ituarte, N. N., et al. Amino Acid Polymorphisms in the Fibronectin-Binding Repeats of Fibronectin-Binding Protein A Affect Bond Strength and Fibronectin Conformation. The Journal of Biological Chemistry. 292 (21), 8797-8810 (2017).
- Hilleringmann, M., et al. Molecular Architecture of Streptococcus Pneumoniae TIGR4 Pili. The EMBO Journal. 28 (24), 3921-3930 (2009).
- Izore, T., et al. Structural Basis of Host Cell Recognition by the Pilus Adhesin from Streptococcus Pneumoniae. Structure. 18 (1), 106-115 (2010).
- Henriques-Normark, B., Tuomanen, E. I. The Pneumococcus: Epidemiology, Microbiology, and Pathogenesis. Cold Spring Harbor Perspectives in Medicine. 3 (7), a010215 (2013).
- Henderson, B., Nair, S., Pallas, J., Williams, M. A. Fibronectin: a Multidomain Host Adhesin Targeted by Bacterial Fibronectin-Binding Proteins. FEMS Microbiology Reviews. 35 (1), 147-200 (2011).
- Becke, T. D., et al. Single Molecule Force Spectroscopy Reveals Two-Domain Binding Mode of Pilus-1 Tip Protein RrgA of Streptococcus Pneumoniae to Fibronectin. ACS nano. 12 (1), 549-558 (2018).
- Herman-Bausier, P., Pietrocola, G., Foster, T. J., Speziale, P., Dufrene, Y. F. Fibrinogen Activates the Capture of Human Plasminogen by Staphylococcal Fibronectin-Binding Proteins. mBio. 8 (5), e01067 (2017).
- Vitry, P., Valotteau, C., Feuillie, C., Bernard, S., Alsteens, D., Geoghegan, J. A., Dufrene, Y. F. Force-Induced Strengthening of the Interaction between Staphylococcus aureus Clumping Factor B and Loricrin. mBio. 8 (6), e01748 (2017).
- Milles, L. F., Schulten, K., Gaub, H. E., Bernardi, R. C. Molecular Mechanism of Extreme Mechanostability in a Pathogen Adhesin. Science. 359 (6383), 1527-1533 (2018).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating Receptor-Ligand Systems of the Cellulosome with AFM-Based Single-Molecule Force Spectroscopy. Journal of Visualized Experiments. (82), e50950 (2013).
- Stetter, F. W., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456 (2015).
- Schmidt, S. W., Christ, T., Glockner, C., Beyer, M. K., Clausen-Schaumann, H. Simple Coupling Chemistry Linking Carboxyl-Containing Organic Molecules to Silicon Oxide Surfaces under Acidic Conditions. Langmuir: the ACS journal of surfaces and colloids. 26 (19), 15333-15338 (2010).
- Zimmermann, J. L., Nicolaus, T., Neuert, G., Blank, K. Thiol-Based, Site-Specific and Covalent Immobilization of Biomolecules for Single-Molecule Experiments. Nature Protocols. 5 (6), 975-985 (2010).
- Ott, W., Jobst, M. A., Schoeler, C., Gaub, H. E., Nash, M. A. Single-Molecule Force Spectroscopy on Polyproteins and Receptor-Ligand Complexes: The Current Toolbox. Journal of Structural Biology. 197 (1), 3-12 (2017).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS nano. 11 (6), 6346-6354 (2017).
- Ebner, A., et al. A New, Simple Method for Linking of Antibodies to Atomic Force Microscopy Tips. Bioconjugate Chemistry. 18 (4), 1176-1184 (2007).
- Kufer, S. K., et al. Covalent Immobilization of Recombinant Fusion Proteins with hAGT for Single Molecule Force Spectroscopy. European Biophysics Journal with Biophysics Letters. 35 (1), 72-78 (2005).
- Hinterdorfer, P., Baumgartner, W., Gruber, H. J., Schilcher, K., Schindler, H. Detection and Localization of Individual Antibody-Antigen Recognition Events by Atomic Force Microscopy. Proceedings of the National Academy of Sciences of the United States of America. 93 (8), 3477-3481 (1996).
- Hinterdorfer, P., Schilcher, K., Gruber, H. J., Schindler, H. Conjugation of Biomolecules to Tip and Probe Surfaces for Molecular Recognition in Atomic Force Microscopy. European Journal of Cell Biology. 74, 72 (1997).
- Riener, C. K., et al. Heterobifunctional Crosslinkers for Tethering Single Ligand Molecules to Scanning Probes. Analytica Chimica Acta. 497 (1-2), 101-114 (2003).
- Metwalli, E., Haines, D., Becker, O., Conzone, S., Pantano, C. G. Surface Characterizations of Mono-, Di-, and Tri-Aminosilane Treated Glass Substrates. Journal of Colloid and Interface Science. 298 (2), 825-831 (2006).
- Beyer, D., Knoll, W., Ringsdorf, H., Elender, G., Sackmann, E. Covalently Attached Polymer Mono- and Multilayers on Silanized Glass Substrates. Thin Solid Films. 284, 825-828 (1996).
- Hermanson, G. T. Chapter 13 - Silane Coupling Agents. Bioconjugate Techniques. 3, 535-548 (2013).
- Howarter, J. A., Youngblood, J. P. Optimization of Silica Silanization by 3-aminopropyltriethoxysilane. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (26), 11142-11147 (2006).
- Hermanson, G. T. Chapter 6 - Heterobifunctional Crosslinkers. Bioconjugate Techniques. 3, 299-339 (2013).
- Sehgal, D., Vijay, I. K. A Method for the High Efficiency of Water-Soluble Carbodiimide-Mediated Amidation. Analytical Biochemistry. 218 (1), 87-91 (1994).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions Towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Butt, H. J., Jaschke, M. Calculation of Thermal Noise in Atomic Force Microscopy. Nanotechnology. 6, 1-7 (1995).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single Molecule Force Spectroscopy by AFM Indicates Helical Structure of Poly(ethylene-glycol) in Water. New Journal of Physics. 1 (1), 6 (1999).
- Gugutkov, D., Gonzalez-Garcia, C., Rodriguez Hernandez, J. C., Altankov, G., Salmeron-Sanchez, M. Biological Activity of the Substrate-Induced Fibronectin Network: Insight Into the Third Dimension Through Electrospun Fibers. Langmuir: the ACS Journal of Surfaces and Colloids. 25 (18), 10893-10900 (2009).
- Rief, M., Oesterhelt, F., Heymann, B., Gaub, H. E. Single Molecule Force Spectroscopy on Polysaccharides by Atomic Force Microscopy. Science. 275 (5304), 1295-1297 (1997).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Marszalek, P. E., Oberhauser, A. F., Pang, Y. P., Fernandez, J. M. Polysaccharide Elasticity Governed by Chair-Boat Transitions of the Glucopyranose Ring. Nature. 396 (6712), 661-664 (1998).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical Stability of Single DNA Molecules. Biophysical Journal. 78 (4), 1997-2007 (2000).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-Molecule Force-Clamp Experiments Reveal Kinetics of Mechanically Activated Silyl Ester Hydrolysis. ACS nano. 6 (2), 1314-1321 (2012).
- Schmidt, S. W., Beyer, M. K., Clausen-Schaumann, H. Dynamic Strength of the Silicon-Carbon Bond Observed Over Three Decades of Force-Loading Rates. Journal of the American Chemical Society. 130 (11), 3664-3668 (2008).
- Schmidt, S. W., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Mechanically Activated Rupture of Single Covalent Bonds: Evidence of Force Induced Bond Hydrolysis. Physical Chemistry Chemical Physics. 13 (13), 5994-5999 (2011).
- Schmidt, S. W., Pill, M. F., Kersch, A., Clausen-Schaumann, H., Beyer, M. K. Mechanically Induced Silyl Ester Cleavage Under Acidic Conditions Investigated by AFM-Based Single-Molecule Force Spectroscopy in the Force-Ramp Mode. Faraday Discussions. 170, 357-367 (2014).
- Rief, M., Gautel, M., Gaub, H. E. Unfolding Forces of Titin and Fibronectin Domains Directly Measured by AFM. Advances in Experimental Medicine and Biology. 481, 129-136 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten