Method Article
Proteinler kovalent immobilizasyon için tek molekül kuvvet spektroskopisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu iletişim kuralı ile örneklenir bir heterobifunctional silane Bağlantı Aracısı atomik kuvvet mikroskobu dayalı tek molekül kuvvet spektroskopisi için tasarlanmış silikon-oksit yüzeyler için proteinlerin immobilizasyon kovalent açıklar RrgA etkileşim (pilus-1 İpucu adhesin, S. pneumoniae) fibronektin ile.
Özet
Son yıllarda, atomik kuvvet mikroskobu (AFM) bizim anlayış moleküler özellikleri ve işlevleri genişletilmiş tek molekül kuvvet spektroskopisi (SMFS) temel. Bize bir çokluğu biyofiziksel mekanizmaları, Örneğin, ana bilgisayar yüzey reseptörlerinin daha ayrıntılı nasıl bakteriyel adhesins bağlama keşfetme fırsatı verdi. Diğer faktörler arasında katı yüzeyler ve AFM ipuçları üzerinde ilgi biomolecules fonksiyonel ve yerel immobilizasyon SMFS deneyler başarısı bağlıdır. Burada, silikon yüzeylere silane-PEG-carboxyls ve köklü N-hydroxysuccinimid/1-ethyl-3-(3-dimethyl-aminopropyl)carbodiimid (EDC/NHS) Kimya sırada kullanarak proteinlerin kovalent kaplin için basit bir protokol tanımlayan pilus-1 adhesin RrgA arasındaki etkileşimin gram-pozitif bakteri Streptococcus pneumoniae (S. pneumoniae) hücre dışı matriks proteini fibronektin (Fn) ile keşfetmek için. Yüzey functionalization Fn homojen bir dağılım cam yüzeyi ve RrgA uygun bir konsantrasyon ucunda AFM prensibine göre hedef değeri ile etkileşim olaylar sırasında SMFS % 20'e kadar belirgin yol bizim sonuçları göster ölçümleri ve RrgA 52 pN bir kaba kuvvet ile Fn için bağlar ortaya koydu. Protokol çift üzerinden site belirli ücretsiz thiol grupları için ayarlanabilir. Bu önceden tanımlanmış bir protein veya molekül yönde sonuçlar ve SMFS yanı sıra biyofiziksel diğer uygulamalar için uygundur.
Giriş
Cımbız, optik ve manyetik yanında atomik kuvvet mikroskobu (AFM)1,2 analiz ve molekülleri işlemek için yararlı bir araç olarak ortaya çıkmıştır ve kendi özellikleri ve işlevleri, onların yanıt-e doğru dış güç3 de dahil olmak üzere araştırma ,4. Buna ek olarak enzim bağlantılı immunosorbent assay (ELISA) gibi yöntemler için plasmon rezonans (SPR) veya kuvars kristal microbalance (QCM) kurulumları, AFM sağlar etkileşimleri tek molekül (SMFS)5 ve tek hücre düzeyi (SCFS)6 ölçmek için yüzey . Bu teknolojiler bağlama düzenekleri Fn proteinler S. aureus üzerinden oluşturduğu FIMH mannoz7veya tandem β-fermuar ile yinelenen denetim E. coli pilus protein etkileşim için bulunan catch tahvil gibi değerli fikir vermiştir bağlama Fn8üzerine. Pilus-1 adhesin RrgA9,10 gram-pozitif bakteri Streptococcus pneumoniae (S. pneumoniae)11 dan fibronektin12 ' ye bağlamak mümkün olduğunu göstermek son zamanlarda başardık onun iki terminal etki alanı ile. Bu tandem β-fermuar farklıdır ve piliated görevi oluşturur ve bir geçici fibronektin içeren iletişim ana yüzeyler13sürdürmek izin verebilir yeni bir iki etki alanı bağlama mekanizması ortaya.
SMFS deneyler başarısı biomolecules katı yüzeyler ve AFM ipuçları üzerinde fonksiyonel ve yerel immobilizasyon eleştirel bağlıdır. Yüksek güçler SMFS ölçümler sırasında oluşabilir gibi proteinler tercihen kovalent yüzeye birleştiğinde olabilir. Orada çok sayıda immobilizasyon proteinleri ve diğer biomolecules, hem de nano parçacıklar ve edebiyat14' te,15 açıklanan diğer cihazlar (inorganik) katı yüzeyler üzerinde tüm hücreler için farklı bağlantı yöntemleri ,16,17,18,19,20,21,22,23,24, 25,26,27. Bu protokoller kez yapmak tehlikeli maddelerin kullanımı, gerçekleştirmek ve/veya yangın önleyici donatım (Örneğin, plazma temizleyici) gerektiren zordur. Çift moleküllere cam için basit bir yol silane reaktif grup bir tarafta ve diğer yan Amin-reaktif bir grup ile heterobifunctional crosslinkers daha kalın bir polimer tabaka eklemektir. Uygulamaya bağlı olarak, değişken uzunlukta, e.gesnek hidro-karbon zincirlerinin kaplin ajanlar kapsayabilir., polyethylenglycol (PEG). Non-spesifik etkileşim (Örneğin, hidrofobik, elektrostatik ve van-der-Waals etkileşimleri) değiştirilmiş yüzeylerin bastırmak ve eşleşmiş molekül dönme özgürlük sağlayabilir.
Burada, bir veya daha fazla ücretsiz amino grubu içeren proteinlerin kovalent kaplin için genel bir iletişim kuralı tanımlamak (-NH2) cam yüzeyler ve silikon nitrür AFM ipuçları üzerinden bir heterobifunctional ethoxy silane-PEG-karboksil (-COOH). RrgA ve hücre dışı matriks proteini Fn etkileşimi dayalı hangi örneklenir SMFS deneylerde, bu protokolü kullanılabilir (genel bir bakış için bkz: Şekil 1 ).
Yüzey28,29,30,31silanization ilk adımdır. Bu büyük ölçüde reaktif SiOH grupları oluşturmak üzere kaplin Ajan ethoxy grupları hidroliz içerir. Bunlar substrat SiOH grup ile tepki verebilir. Birincil bir yoğunlaşma adım, bu silanols formu hidrojen bağları ve substrat yayıldı. (Bu genellikle ısı veya su kaldırmak için vakum gerektirir) ikincil yoğunlaşma tepki siloxane bağları kurdu. Bu bir kovalent bağlı organo-silane katmanda olur.
Kaplin için işlevsel proteinlerin ikinci adımdır (-COOH) polimer32kişiden genişletmek grupları. İlk olarak, asit köklü NHS/EDC ile kazanan bir reaktif N-hydroxysuccinimid (NHS) ester orta, dönüştürülür (1-etil - 3-(3-dimethylaminopropyl) carbodiimid Kimya33 ve nükleofilik ikame geçer sonunda bir Amid bağı proteinler üzerinde birincil aminler ile form.
Bu şekilde RrgA silikon nitrür AFM ipuçları ve cam yüzeylerde rastgele yönde için insan Fn birleştiğinde ve etkileşim kuvvetleri tek molekül düzeyde analiz edildi. Bizim sonuçları açıklanan yüzey kimyası Fn homojen bir dağılım cam yüzeyi ve RrgA uygun bir konsantrasyon ucunda belirgin etkileşim olaylar SMFS ölçümler sırasında % 20'e kadar hedef değerine göre yol gösteriyor. Bu kimya belirsiz arka plan etkileşimleri azaltır, veri toplama sırasında küçük değişiklik tabidir ve bu nedenle mükemmel kesin SMFS deneyler için uygundur.
Protokol
1. immobilizasyon ajanların proteinler ile fonksiyonel Silane kaplin
Not: Resim 1 bu protokol için uygulanan yüzey kimyası üzerine genel bir bakış verir.
Dikkat: aşağıdaki protokol farklı kimyasallar aşındırıcı ve özellikleri rahatsız edici cilt ile kullanılır. Yeterli (aside dayanıklı) eldiven, koruyucu gözlük ve laboratuvar ceket giymek ve buharlar teneffüs önlemek için çözümler hazırlarken duman başlık altında çalışır.
- Cam yüzeyler ve silikon nitrür konsol ajanlar kaplin silane ile functionalization
- Kaba toz kaldırmak ve contaminations isopropanol ve hav bırakmayan hassasiyet ile cam slaytlardan mendil ve slaytları istediğiniz boyuta kesme (isteğe bağlı).
Not: cam, silika, kuvars ve alüminyum, bakır, kalay, titanyum, demir, krom, Zirkonyum, nikel ve çinko oksit katı yüzey olabilir.
Dikkat: cam slayt kesim keskin kenarları neden olabilir. - Cam boyama bir kavanoza slaytlar yer dolu hidroklorik asit ile (% 33 HCl) 3-%5 (v/v) (GKD2O) iki kat distile su ile seyreltilmiş, uygun kapaklı kavanoz kapatın ve 90 dakika oda sıcaklığında bir ultrasonik banyo yerleştirebilirsiniz.
Not: Kullanılan kavanoz 6 cm çapında ve 65-70 mL yaklaşık bir boyutu vardır. Bir uygun seyreltik HCL kavanoz için 50 mL 5 mL içeren birimdir %33 HCl ve 45 mL GKD2O. HCl etkin bir şekilde kaldırır bağlayıcı olmayan metal iyonları, özellikle sodyum, potasyum ve kalsiyum ve hidroksil doymuş cam yüzey üretmek için silikon azaltır.
Dikkat: HCl aşındırıcı ve cildi tahriş olduğunu. Yeterli aside dayanıklı eldiven, koruyucu gözlük ve laboratuvar ceket ve buharlar teneffüs önlemek için çözüm hazırlarken duman başlık altında çalışmak. - AFM probları temiz cam slayt üzerindeki yukarı bakacak şekilde ucu ile konsol ve ultra violet için en az 90 dakika ışık yukarıdan ile ışınlatayım silikon nitrür yerleştirin.
Not: 0,01-0,1 N m-1 bir nominal bahar sabiti ile cantilevers tek molekül kuvvet spektroskopisi için uygundur. Işınlama prensibine göre yüzey UV ışığıyla organik kirletici maddeler, özellikle yağlı maddeler, kaldırmak ve hidrofilik bir tarafta render. Eğer diğer tarafta ağır suç birde - hangi durumda olmamalı veya konsol probları taze tedarikçiler kutudan - kullandıysanız SMFS ölçüm etkileyebilir. Birçok çalışmalar34kullanılmıştır, piranha çözüm kullanarak tüm konsol çip temizlik yardımcı olabilir.
Dikkat: UV ışık gözlere zararlıdır; Bu nedenle, konsol probları ışınlama bir UV ışık geçirmez odada yapılmalıdır. Piranha çözüm büyük ölçüde reaktif ve deri, kağıt ve diğer organik maddeler yanabilir. Plastik kaplar kullanın. Yemekleri veya kavanoz bile az miktarda organik yüzey contaminations (Örneğin, önceki kullanımdan) ile girdiyseniz, hızla tepki. - Cam yüzey kuru ve başka bir 10 dakika süreyle ultrasonik banyoda geri kavanoz yerleştirin izin olmadan GKD2O ile boyama kavanoza hidroklorik asit yerine su iki sırasıyla yıkama düzgün hidroklorik için 10 dakika için daha fazla kez değiştir asit.
- Bu arada, ethoxy (veya metoksi) silane Polietilen glikol asit dağıtılması (Si (OC2H5)3-PEG-COOH) etanol ve GKD2O bir karışımı (v/v %95 / % 5, asetik asit ile ayarlanır pH 4.6) 0.1 mg mL nihai bir konsantrasyon için -1. Hermetik etanol buharlaşma önlemek için kapalı çözüm saklayın.
Not: Silane kaplin nem ve sıcaklık duyarlı ajanlardır. Bu nedenle, onlar inert gaz (N2), altında düşük sıcaklıkta (-20 ° C) ve kuru koşullarda saklanmalıdır. Şişeyi açmadan önce silanes oda sıcaklığında hidrasyon en aza indirmek için ulaştınız emin olun ve böylece pasivasyon reaktif grup. Çok sayıda farklı fonksiyonel gruplar ve farklı spacer uzunlukları ile Heterobifunctional PEG kaplin ajanlar kullanılabilir. Proteinler ile rastgele immobilizasyon için onların özgür amino grupları (NH2), bu iletişim kuralı, fonksiyonel grup ethoxy/metoksi silane ek açıklandığı gibi bir NHS ester olması gerekir. Bir silane Ajan NHS ester ile satın alma, böyle NHS ester kazanmak için basit bir şekilde bir karboksil grubuna etkinleştirmektir (-COOH) 1-ethyl-3-(3-dimethylaminopropyl) carbodiimid (EDC) ile ve NHS (1.2.1 bkz. ve 1.2.2.).
Dikkat: Etanol yanıcı ve cildi tahriş olduğunu. Asetik asit yanıcı ve aşındırıcı. Reaktif silanes cilt üzerine veya gözlerinin içine değil almak için özen gösterin. Yeterli eldiven, koruyucu gözlük ve laboratuvar ceket giymek ve buharlar teneffüs önlemek için duman başlık altında çalışır. - İki ayrı Petri yemeklerinde silane solüsyonu dökün, hazırlanan konsol sonda ve cam slaytlar bir kabında sırasıyla yerleştirin, sıkıca kapatın (Örneğin, parafilm ve etanol buharlaşma önlemek için sabit 90 dk az için kuluçkaya) Oda sıcaklığında.
Not: Petri kabına en uygun boyutu konsol probları sayısı ve hangi functionalized cam slayt boyutunu bağlıdır. 50-60 mm düşük reaktif hacmi ve iyi işleme bir çapı boyutudur. İstenmeyen konsol konsol hava su arabirimi üzerinden nüfuz ederken eğilmesini önlemek için hava-su arabirimi için 90 ° açıyla tutulmalı. Kuluçka cam slaytlar (ama değil konsol probları) isteğe bağlı olarak bir orbital çalkalayıcı üzerinde yürütülen olabilir. - Konsol ve cam slayt tamamen ilişkisiz silane bileşikler yıkamak için saf etanol içeren üç ardışık şişeler içinde yıkayın.
Not: istenmeyen prensibine göre hava su arabirimi üzerinden nüfuz ederken eğilmesini önlemek için konsol bir 90 ° açıyla tutulmalı. - Functionalized cam slaytlar boyama kavanoz ve temiz cam slayt ve tedavi için 30 dk 110 ° C'de prensibine göre yerleştirin.
Not: ısı ile kür kovalent siloxane tahvil oluşumu ve su temizleme neden olmaktadır. Cam slaytlar sadece bir tarafta functionalized olarak, düzgün kaplı yan belirtmek emin olun. - Silanized cam örnekleri depolamak ve konsol içinde bir vakum desiccator bir hafta kadar sondalar.
Not: Protokol burada duraklatılmış.
- Kaba toz kaldırmak ve contaminations isopropanol ve hav bırakmayan hassasiyet ile cam slaytlardan mendil ve slaytları istediğiniz boyuta kesme (isteğe bağlı).
- Proteinlerin silanized cam ve silikon nitrür konsol üzerinde rasgele immobilizasyon
Not: konsol istenmeyen eğilmesini önlemek için konsol sonda 90 ° açıyla herhangi bir hava-su arabirimleri penetran tutulmalıdır.- Bir çözüm içeren 42 mg mL-1 in EDC ve 20 mg mL-1 NHS standart fosfat tamponlu tuz (PBS; 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7,4) içinde hazır olun.
Dikkat: EDC aşındırıcı ve cildi tahriş ve ciddi göz hasara neden olabilir. Yeterli eldiven, koruyucu gözlük ve laboratuvar ceket giymek. - Silane kaplı cam slaytlar çözüm ile kapak ve EDC/NHS çözüm bir düşüş silanized konsol probları koymak ve oda sıcaklığında 10 dakika için kuluçkaya.
Not: konsol probları kuluçka için özgün konsol kutusu uygundur. Proteinler üzerinden ücretsiz amino gruplarına carboxyls için çift için (-COOH) heterobifunctional silane-PEG ajanların - COOH grup yaygın olarak kullanılan EDC/NHS kimya ile etkinleştirilir. EDC NHS için karboksilik asit, bir sonraki adımda fizyolojik pH Birincil aminler için verimli konjugasyon sağlayan bir "kararlı" NHS ester şekillendirme çiftler. - PBS ile iyice konsol ve cam slaytlar içinde üç ardışık şişeler tamamen aşırı EDC/NHS yıkamak için durulayın.
Not: Bu çamaşır adım kalan EDC/NHS can crosslink proteinleri olarak önemlidir ve böylece onların işlevini değiştirme. - Aktif cam slaytlar ile kuluçkaya ve oda sıcaklığında ıslak bir odasında istenen protein çözümün bir damlacık içinde konsol sondalar. Protein konsantrasyonu ve kuluçka süresi deneme gereksinimlerini karşılamak için adapte olmalıdır. Genel olarak, bir konsantrasyon 0.5-1 mg mL-1 ve kuluçka süreleri 30 dk dan 2 h arasında daha çoğu proteinler için uygundur. Fibronektin (üzerinde cam slayt) ve pilus-1 İpucu protein RrgA (konsol) durumunda, 1,5 µM ve 3 µM, molar konsantrasyon sırasıyla ve 2 h bir kuluçka süresi yeterli.
- Cam slaytlar yıkama ve konsol iyice üç ardışık kadehler PBS ile ilişkisiz proteinler yıkamak için sondalar.
- Kalan NHS ester tris (hydroxymethyl) ile emdirmek-tris arabelleğe alınmış serum (TBS; 50 mM Tris, 150 mM NaCl, pH 7,6) Oda sıcaklığında 20 dakika içinde sonda yerleştirerek aminomethan.
Not: Tris amino grupları konsol ve substrat yüzeyinde kalan aktif COOH grupları bağlayabilirsiniz için bu adımı proteinler arasında AFM ipucu functionalized yüzeyi ve cam istenmeyen kovalent kaplin azaltır. - Cam slaytlar yıkama ve konsol iyice PBS ve onları ayrı Petri yemeklerinde kullanmak kadar PBS içinde kaplı mağaza ile sondalar.
Not: Örnekleri taze hazırlanmalı ve aynı gün kullanılır.
- Bir çözüm içeren 42 mg mL-1 in EDC ve 20 mg mL-1 NHS standart fosfat tamponlu tuz (PBS; 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7,4) içinde hazır olun.
2. atomik kuvvet mikroskobu tek molekül kuvvet spektroskopisi dayalı
Not: Bu çalışmada, bir atomik kuvvet mikroskobu JPK aletleri üzerinden kullanılan ve set ups için kuvvet-mesafe eğriler elde etme ile zorla RampDesigner tanımlanmıştır.
- Konsol kalibrasyon termal gürültü yöntemi35
Not: konsol kalibrasyon için üreticinin el kitabındaki adımı izleyin. Çoğu genellikle nominal konsol şekilden (uzunluk, genişlik, kalınlığı) hesaplanır ve bu nedenle çok güvenilir değil yaklaşık bahar sabiti tedarikçiler devlet konsol. Doğru bahar sabiti çok önemli olduğu için aşağıda açıklanan nüsha konsol kalibrasyon yürütmek ve optik kolu duyarlılık Ortalama değerlerini kullanmak ve sürekli bahar önerilir. Deney ve değerleri anlama (pN) daha sonra optik kolu hassasiyeti kullanarak zorla ve sürekli bahar için dönüştürme sırasında volt (V) prensibine göre saptırma kaydetmek yararlı olabilir. Lazer (yansıyan lazer konumunu fotodiyot yeniden) konsol üzerinde konumlandırılır değil sürece bahar sürekli ve optik kolu duyarlılık önce ve/veya deneme sonra belirlenebilir.- AFM örnek tutucu üzerinde temiz, taze cam slayt düzeltmek ve PBS arabellek ile kaplayın.
Not: Kalibrasyon sert bir yüzey (Örneğin, cam) ve aynı tampon olarak gerçek deneyler yapılmalıdır. - Hazırlanan konsol sonda konsol sahibi düzeltmek, AFM kafasından yerleştirin ve dikkatle konsol PBS arabellek bir damla ile ıslak.
Not: Konsol ıslatma kalibrasyon cam slayt ve böylece istenmeyen prensibine göre bükme PBS arabellekte penetrasyon sırasında görünen yüzey gerilimi azaltır. - Prensibine göre tamamen PBS arabellekte ama hala uzak kalibrasyon yüzey batırılır kadar yavaş doğru kalibrasyon yüzey prensibine göre hareket edin.
- AFM üstten görünüm optik mikroskop kullanın veya (varsa) ters mikroskop altında konsol arka AFM lazer konumlandırmak için AFM. Lazer ipucu olduğu yakın konsol sonuna nokta koyun.
Not: Lazer nokta konsol sonuna yakın yerleştirilmemesi gerekir ama hala tamamen konsol üzerinde olmalıdır. Hiçbir optik mikroskop varsa, bir kağıt parçası görünür lazer diyot veya kızılötesi lazer diyot için bir lazer dedektörü kart kullanmak, AFM başının koy ve cantilevers yerleştirildiği lazer nokta konsol-chip kenarına doğru hareket , kağıt veya Dedektör kartına spot görünceye kadar. Sonra lazer kenarına paralel hareket. Spot kaybolur, bir konsol kolunda olmasıdır. Kağıt/dedektörü kartı ve yine (kağıt/kartından kaybolur) kolu kolundaki o kadar geri hareket görünene kadar doğrusal cantilevers için kolu kolu sonuna doğru noktaya taşıyın. İçin üçgen, konsol iki kolu arasında orta yerinde yerleştirin ve kağıt/kartından kaybolana kadar prensibine göre sonuna doğru hareket. Konsol uzun ekseninin spot dik hareket ettirerek konsol ortasında olduğundan emin olun. - Böyle bir şekilde yansıyan lazer ışını fotodiyot ortasına yerleştirilir AFM dört çeyreği dedektörü fotodiyot konumunu ayarlamak.
Not: aşağıdaki adımları izlemelisin: her dört tarafta topla sinyalini ekranı diyot yatay ve düşey yönde, alıncaya kadar dedektörü diyot yakınındaki mikrometre vidaları kullanın. Sonra dikey saptırma sinyal sıfır olana diyot dikey yönde hareket ettirin ve yanal saptırma sinyal sıfır olana diyot yatay yönde hareket ettirin. Silikon nitrür cantilevers genellikle bir altın kaplama ve bu nedenle bir bimetal iki farklı termal genleşme katsayıları ile vardır. Özellikle çözümde bir termal drift (dikey saptırma sinyal belirgin) sonuçlanır. Ölçümler sırasında bu drift azaltmak için tüm sistemi kalibrasyon başlamadan önce birkaç dakika için equilibrate izin ver. - AFM yazılım kalibrasyon Yöneticisi'ni açın ve konsol duyarlılık ve konsol bahar sabiti ile termal gürültü yöntemi aşağıdaki gibi kalibre.
- Dikkatle substrat yüzey yaklaşım ve bir kuvvet-mesafe eğrisi kaydedin.
- Optik kolu duyarlılık nm/v retraksiyon kuvvet eğrisi en dik parçası için düz bir çizgi ucunu substrat yüzeyi ile temas nerede yaklaştırarak belirlemek. Duyarlılık pN/nm için konsol bahar sabit dönüştürmek sağlar.
Not: Geri çekilmesi eğrinin eğimini piezo seyahat etmek mesafe vs' dir. (nm/V ölçülür) fotodiyot voltaj değişikliği. - Birkaç termal gürültü spectra prensibine göre yaklaşık 100 µm veya daha fazla yüzey uzak konsol ile herhangi bir yüzey sönümleme dışlamak için kaydedin.
- Konsol pN/v bahar sabiti termal gürültü spectra AFM yazılım tarafından sağlanan bir Harmonik osilatör yaklaştırarak belirlemek.
- Yavaş yavaş prensibine göre geri çekmek ve eriyik--dan çekilme.
- Yerine cam yüzey immobilize protein içeren örnek yüzeyle prensibine göre ayarlaması için kullanılır. Emin olmak konsol ve örnek yüzey (ve dolayısıyla protein) cam slayt değiştirme sırasında kuru değil.
- AFM örnek tutucu üzerinde temiz, taze cam slayt düzeltmek ve PBS arabellek ile kaplayın.
- Etkileşim kuvvet tek protein seviyesi üzerinde deneyler
- Konsol tamamen PBS arabellek ama hala uzak substrat yüzeyi kaplı kadar yavaş doğru örnek yüzey nemli prensibine göre hareket edin.
Not: kuvvet spektroskopisi ölçümleri başlamadan önce birkaç dakika için ayarla tüm sistem termal drift deneme sırasında azaltmak için izin verin. - Yüzey yaklaşım ve birden fazla kuvvet-mesafe eğrileri (≥ 500) 250 pN, kişi bir güçle örnek yüzeyinin farklı konumlarda 1 kişi bir zamanını kaydetmek s, 2 µm retraksiyon uzunluğunda ve 1 µm s-1bir geri çekme hızı.
Not: genel kuvvet spektroskopisi düzeltmeleri için üreticinin kılavuz izleyin. Çeşitleri: Geri çekme hızı 0.1 ve 5 µm s-1 arasında artan kuvvet yüküne bağlı olarak kinetical verileri hesaplamak için değiştirilebilir. Etkileşim zaman zaman bağımlı bond güçlendirilmesi analiz etmek için çeşitli olabilir. Geri çekme hızı sabit tutmak yerine bir kuvvet sabit (kelepçe modunu zorla) devam edebilir.
- Konsol tamamen PBS arabellek ama hala uzak substrat yüzeyi kaplı kadar yavaş doğru örnek yüzey nemli prensibine göre hareket edin.
- Veri Analizi
Not: Veri analizi veri işleme yazılımı kullanılarak yapılmıştır. İmmobilize proteinler, iletişim zaman veya geri çekme hızı, bir ayak izi ya da değil dahil oldu ve diğer değişken parametreleri bağlı olarak, kuvvet-mesafe eğrileri birden çok farklı bilgiler içerir. Veri analizi ve yorumu arasında farklı SMFS deneyler büyük ölçüde değişebilir ve bu nedenle burada ayrıntılı olarak tarif edilebilir değil. RrgA ve Fn etkileşimi gelince, aşağıdaki iletişim kuralı SMFS veri çözümlemesi için bir ilk adım olabilir.- Açık toplu iş, kuvvet tarama simgesini seçerek ölçülen kuvvet eğrisi dosyaları açmak ve kuvvet-mesafe eğrileri aşağıdaki gibi işlem:
- Konsol saptırma (V) (Re) Ayarla'ya V-saptırma ayarlama hassasiyeti ve bahar sürekli simgesini seçerek doğrudan orantılı güç (F) dönüştürün.
Not: konsol kalibrasyon deneme önce yürütüldü ise değerleri kuvvet inceden inceye gözden geçirmek eğe içinde kaydedilir ve otomatik olarak V-saptırma kalibrasyon sırasında kullanılır. Kalibrasyon deneyden sonra yürütüldü ise yazılım için ölçüm değerleri değiştirilebilen varsayılan değerleri kullanır. - Temel güç eğrisi Temel çıkarmasimgesini seçerek sıfır güç düzeyini ayarlamak için yüzey uzak bir bölgede retraksiyon kanalının çıkarma.
Not: bazı durumlarda, geri çekilmesi aynı sabit kuvvet değeri olmayabilir ve eğri hangi-ebilmek var çıkarmak yanında seçme ofset + eğimlidoğrusal bir tilt görüntüleyebilir. - Nerede Temas noktası belirlenmesi simgesini seçerek ucu ile temas örnek alır noktasını tanımlayın.
- Yükseklik sinyal İpucu-örnek ayırma için İpucu-örnek ayırma simgesini seçerek dönüştürün. İrtibat noktası konumu çıkarılarak ek olarak, bu yordamı substrat yüzeyinde ve AFM-uç arasındaki uzaklığı hesaplamak için bükme konsol çıkarır.
Not: Genişletilebilir solucan gibi zinciri modeli ve etkileşim uzunlukları, belirlenmesi gibi polimer elastik modelleri uygun için konsol bükme için düzeltilmiş olup, uç-örnek ayırma gereklidir. Oranı güç eğrisi ve z-piezo hız eğimi yükleme kuvvet belirlemek için düzeltilmemiş kuvvet eğrileri kullanılmalıdır. - Spesifik olmayan etkileşimleri sıralamak ve seçerek seçili tepeler için Genişletilebilir solucan gibi zinciri modeli uygulamak için 70 nm (uzatılmış PEG spacer uzunluğu)36 yukarıda rüptürü uzunluklarında meydana gelen kuvvet doruklarına kuvvet-mesafe izlerini ekran Bir polimer zinciri modeli uygun simge ve seçilmek Genişletilebilir solucan benzeri zinciri modeli. Geri çekme kuvvet eğrisi Peaks'e bu model ile monte edilebilir ve kopma kuvvetleri ve uzunlukları, polimer elastik parametreler ile birlikte elde edilir.
- Kuvvet ve uzunluğu dağıtımları gösterilen çubuk grafikler gibi verileri görüntüleyin. En az 100 bağdaştırıcısından olayları çubuk grafikler için kullanın.
Sonuçlar
Protokol ile rasgele yönlendirme (Şekil 1) erişilebilir onların Birincil aminler proteinler aracılığıyla , kovalent bir immobilizasyon sonuçlarında burada açıklanan. Resim 2 (solda) ile bir silanized cam yüzey AFM görüntüsünü gösterir ve azot nazik akışı altında örnekleri susuzluktan sonra (sağda) Fn immobilize olmadan kaydedildi. Fn ile functionalized yüzey üzerinde sadece küçük yüzey levha yüksekliği yaklaşık Nm (Şekil 2, sağ), 2-5 silane polimer katmanı gösterir, yaklaşık 10 nm yüksek Fn belirgin (Şekil 2, sol) moleküllerdir. Yakın çekimler, Fn dimerik yapısını kabul edilebilir. Fn molekülleri 4-5 nm PEG yüzey kaplama yukarıda yüksekliği ve uzunluğu ile kompakt gibi görünüyor ~ 120 nm (ekler bakın).
RrgA son zamanlarda ayrıntılı olarak bizim grup13tarafından tanımlanmıştır, Fn ile etkileşim kuvvetleri araştırmak için RrgA bir silikon nitrür AFM ipucu ve cam alt katman (Şekil 3a) için insan Fn birleştiğinde. Şekil 3 örnek ayırma eğrileri 1 µm s-1çekerek bir hızda kaydedilen Fn ile RrgA arasındaki etkileşimin temsilcisi ipucunu gösterir. Alçak arka plan etkileşim ve genişletilebilir bir solucan zinciri (eWLC) modeli (kırmızı eğrileri) gibi kullanarak monte edildi iyi şekilli tek (veya çift) etkileşim Olaylar (Şekil 3a), kullanılan yüzey kimyası. Uyum (rüptürü kuvveti ve - uzunluk, bkz. Şekil 4) sonuçlarını komplo gösterir bu kadar non-spesifik yüzey etkileşimleri AFM ipucu ve substrat ve PEG vurgulamaktadır (> 70 nm), germe arasında üstesinden sonra ~ %19 kuvvet eğrilerinin gösterdi rüptürü olaylar bir ortalama kopma ile zorla RrgA için - Fn etkileşiminin ~ 52 pN yaklaşık 100 İpucu-örnek mesafelerde nm. Buna karşılık, geçerli bir yüzey kimyası (burada, belirtilmemişse Tris ile Şoklama tuzlu Şekil 3barabelleğe) tek etkileşim olayları nedeniyle belirsiz etkileşimleri, açık bir şekilde değerlendirilmesi birden fazla protein (izle 2 ve 3) bağlama engel olacak ve/veya proteinlerin örnek yüzey ve AFM prensibine göre uç arasında kovalent kancası. Muhtemelen protein (Fn) etki alanından (izle 4 ve 5) unfolding tarafından eşliğinde yüksek kopma Kuvvetleri (izle 1) Bu yol açar.
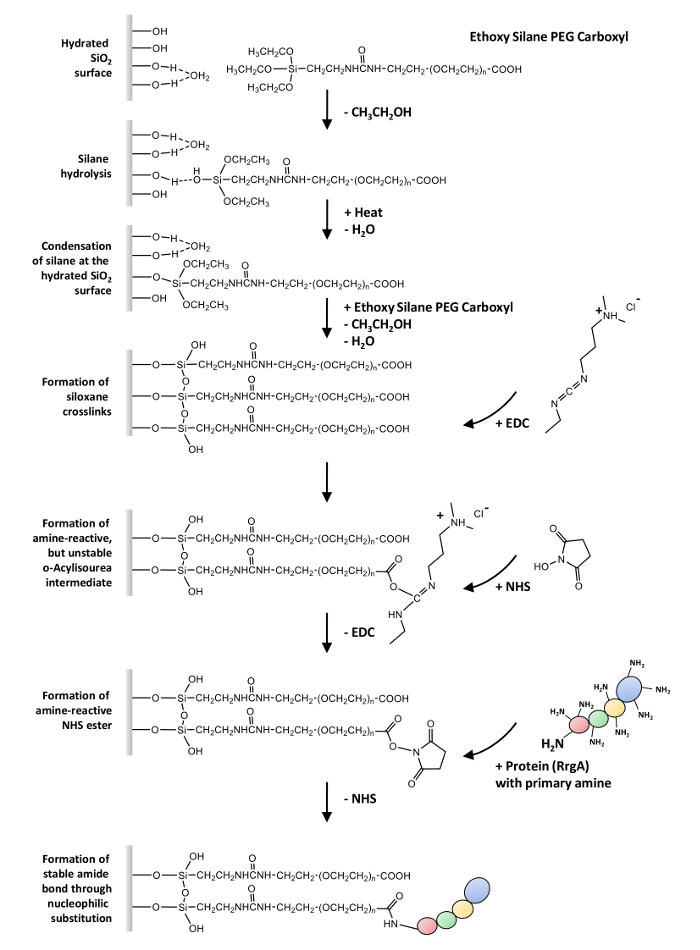
Şekil 1: genel bakış yüzey kimyası üzerine. Ethoxy silane-PEG-karboksil hidroliz sulu cam yüzey ve siloxane Glossar oluşumu, yoğunlaşma izler. EDC tepki karboksil grupları ile bir reaktif o- acylisourea, Amin-reaktif orta sulu çözüm (hidroliz) son derece kısa bir half-life ile sonuçlanır. Orta hangi nükleofilik ikame sonunda proteinler üzerinde birincil aminler ile bir Amid bağ kurmaya uğrar bir NHS ester oluşumu tarafından stabilize. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
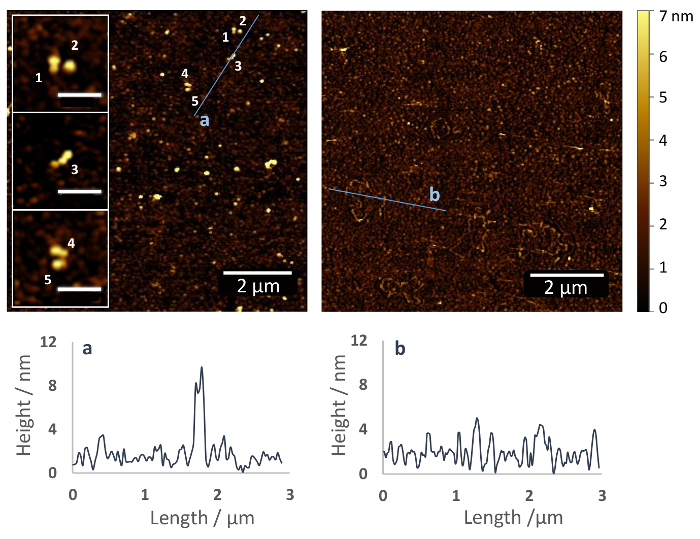
Resim 2: İmmobilizasyon fibronektin üzerinde bir cam yüzey yolu ile heterobifunctional ethoxy silane PEG, karboksil kaplin Ajan. AFM görüntüleri functionalized cam yüzeyler (sol) ve olmayan (sağ) Fn. sayılar, homojen substrat yüzeyinde (ekler) dağıtılır bireysel Fn moleküllerin gösterir. Molekülleri dimerik ve kompakt yapısı ile 4-5 nm PEG yukarıda yüksekliğini kabul kaplama ve uzunluğu > 100 nm. Bu çözüm Fn yapısında benzer ve diğer yüzeylerde, Örneğin, Mika önceki AFM veri ile uyumlu (ölçek çubuğu, dişlerin = 500 nm)37. AFM yükseklik profilleri AFM Albümdeki belirtilen doğrultuda görüntülerdir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
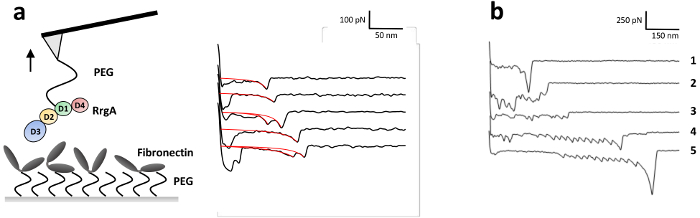
Şekil 3: SMFS deney ve temsilcisi çizimi zorla RrgA - Fn etkileşim mesafe eğrileri. (a) RrgA ve Fn vardı kovalent bağlı yolu ile heterobifunctional ethoxy silane PEG karboksil Bağlantı Aracısı bir silikon nitrür AFM ile konsol ipucu ve cam yüzey, anılan sıraya göre. Temsilcisi SMFS RrgA - Fn retraksiyon hızla 1 µm s-1 ile etkileşimi RrgA ve Fn açıklanan immobilizasyon için elde edilen eğriler gösterilir mesafe zorlamak. Kırmızı eğrileri kopma kuvvetleri ve uzunlukları elde etmek için uygulanan Genişletilebilir solucan benzeri zincir uygun temsil eder. Rakam Becke, vd., ACSnano 201813değiştirildi. (b) temsilcisi SMFS mesafe eğrileri RrgA - arabelleğe alınmış Tris ile Şoklama olmadan Fn etkileşim için elde edilen tuzlu zorlamak. Bu durumda, Tris birincil Amin yoktu böylece etkin kalan NHS esterleri deneme sırasında doymamış kalmıştı. Bu çok protein (izle 2 ve 3) bağlama açtı ve proteinler arasında yüzey ve yüksek kopma sonuçlanan AFM ipucu sıkma eşlik (Fn-) etki alanı açılım (izle 1, 4 ve 5 farklı ölçeklerde Not;) zorlar. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
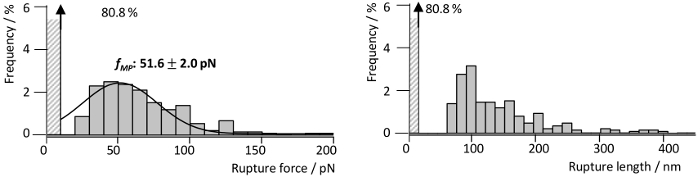
Şekil 4: tek RrgA - Fn etkileşimleri güç ve uzunluk dağılımı. Rüptürü kuvvet ve RrgA - Fn SMFS etkileşim ölçümler elde edilen karşılık gelen kopma uzunluğu çubuk (n = 1400) 1 µm s-1in geri çekilmesi hızda. Histogramlar bir en olası rüptürü kuvveti fMP 51,6 pN (Gauss uygun, siyah çizgi) ve kopma uzunluğu 100 civarında bir birikimi ortaya nm. Rakam Becke, vd., ACSnano, 201813değiştirildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
AFM SMFS dayalı olduğundan, doğrudan içi ve bireysel proteinler, nükleik asitler ve diğer biomolecules3,4,5cins güçleri soruşturma için yaygın olarak kullanılan bir teknik gelişti. Başarılı SMFS deneyleri için uygun bir yüzey strateji kaplin bir önkoşuldur. Doğal ve sentetik polimerler intramolecular kuvvetlerinde soruşturma için polimerler doğrudan substrat yüzey ve AFM İpucu36,38,39,40,41birleştiğinde. Moleküler bağlar gibi arası moleküler etkileşimleri incelenmesi için ancak, bu etkileşim ortakları için AFM ucu eklemek için esnek bağlayıcı molekülleri heteroseksüel bifonksiyonel PEG bağlayıcı veya polipeptid zincirleri, gibi kullanmak için tavsiye edilir ve substrat yüzey, bağlama ortakları doğru yönlendirmeye daha kısa menzilli yüzey kuvvetlerin üstesinden gelmek ve denatürasyon ve proteinler21,22,23unfolding önlemek için izin vermek için 24,25,26,27,42. Bu nedenle heteroseksüel bifonksiyonel PEG çubukları kullanarak erişilebilir onların Birincil aminler, proteinler ile kovalent immobilizasyon için sade ve düz ön protokol nitelendirdi.
Biz onun uygulanabilirliği gösterdiği etkileşimi soruşturmaya güçleri arasında adhesin RrgA S. pneumoniae üzerinden ve hücre dışı matriks proteini Fn, son açıklanan ayrıntılı olarak başka bir yerde13.
Yüzey kimyası iyi kurulmuş ve analiz ve benzer yaklaşımlar başarıyla birden fazla SMFS deneyler19,42,43,44,$45kullanılmıştır. Silane polimer yüzeye, kaplin için kullanılan silylether hidroliz tabi var. Silanization işlemi sırasında kontrol edilebilir kurulan siloxane tahvil tutarı hidroliz derecesine bağlıdır. Yüksek etkileşim kuvvetleri (≥ 1000 pN) SMFS ölçümler sırasında bekleniyor, silanization siloxanes sürekli bir tabaka oluşumuna neden olan gerçekleştirilen üzerinden buharı fazlı ifade30 olmalıdır. Birçok deney (Örneğin, birçok protein-protein etkileşimleri) gelince etkileşim kuvvetleri birkaç yüz pN ve hangi siloxane oluşumu bir sulu faz üzerinden ifade tarafından yürütülen ve ilişkisiz açıklanan yordamın aralığında bulunmaktadır. Organo-silanes düşünceli (adım 1.1.8) ısı ile kür tarafından takip etanol (adım 1.1.7) ile yıkanır, yeterli.
Başka bir önemli adım kalan EDC yıkayın etmektir ve yemek artıkları üzerinde proteinler karboksil grupları harekete geçirmek yol açacak gibi yüzey (1.2.3. adım) NHS molekülleri kapalı. Bu çapraz ya sonuçta işlevselliğini değiştirebilir aynı yüzeyi proteinlerin olabilir veya kovalent çift diğer proteinlere karşı yüzeyi proteinleri harekete geçirmek. Bu yüzey ve muhtemelen etki alanı unfolding tarafından eşliğinde yüksek kopma kuvvetleri sonuçlanan AFM ucu arasında proteinlerin sıkma için neden olabilir ( Şekil 3b, 1, 4 ve 5, izleme Bkz: Fn etki alanından unfolding)46. PEG spacer etkin NHS esterleri doymamış bırakılırsa aynı sorun ortaya çıkabilir. (Tris birincil Amin kalan amino reaktif grup quenches gibi bu nedenle, arabelleğe alınan Tris salin ile kuluçka adım 1.2.6), önerilir.
Kademeli protokol sonrası yol açar Fn homojen bir dağılım için silanized cama (bkz. Şekil 2) yüzey, protein dimerik şeklinde bırakarak. Bu çözüm yapısında Fn´s benzer ve önceki AFM veriler diğer örnek yüzeyler37ile tutarlıdır. Buna ek olarak, RrgA uygun bir konsantrasyon AFM ucunda, hangi SMFS ölçümler sırasında (Şekil 3 ve Şekil 4) ~ %20 iyi tanımlanmış etkileşim olayların hedef değeri oluşturur elde edilir. Silane-farklı ikincil fonksiyonel grupların ajanlarla kombinasyonu yanı sıra protein konsantrasyonu ve/veya kuluçka kez değişen örnek substrat ve konsol ucu birleştiğinde molekülleri miktarını denetlemek için başka bir zarif yolu var. Protein reaktif grup PEG-polimer uzanan oranını değiştirerek, immobilize proteinler sayısı kontrollü15,16,17,18olabilir.
Burada açıklanan protokol diğer -NH2 içeren molekülleri hareketsiz veya çift proteinlere cam ve silikon nitrür yanı sıra diğer silisyum oksit yüzeye ayarlanması için kullanılabilir. Protein tasarımına bağlı olarak, Amin reaktif karboksil grubu protein ile çift için bir sulfhydryl reaktif gruba (Örneğin, maleimide veya pyridyl ortho disülfür) onun özgür-ebilmek çevrilmek-SH gruplar. FN için bu sonuç bir önceden tanımlanmış yönlendirme13,17,20.
Özetle, bu protokol farklı gereksinimleri hizmet için ayarlanabilir ve yanı sıra tek molekül kuvvet spektroskopisi deneyler biyofiziksel diğer uygulamalar için uygundur.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
TB ve HG Avrupa Araştırma Konseyi "Cellufuel, gelişmiş Grant No 294438" mali desteğini kabul edersiniz. HCS Federal Bakanlığı mali desteği eğitim ve araştırma Innovationsallianz Technofunktionale hasta (TeFuProt) yoluyla kabul eder, SS mali kabul eder bilim ve eğitim için Bavyera Devlet Bakanlıktan destek araştırma odağı "Herstellung und biophysikalische Charakterisierung dreidimensionaler Gewebe - CANTER". Biz Conny Hasselberg-Christoph ve Martina Hörig teknik destek için teşekkür ederiz
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material | |||
| 2-Propanol | Carl Roth | 6752 | |
| 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide | Sigma-Aldrich | 03450 | EDC |
| Acetic acid | Carl Roth | 3738 | 100 %; analytical purity |
| Doubly distilled water | |||
| Ethanol | Carl Roth | 9065 | ≥ 99.8 %; analytical purity |
| Ethoxy silane polyethylene glycol acid | Nanocs | PG2-CASL-5k | 5 kDa; COOH-PEG-Si(OC2H5)3 |
| Hydrochloric acid | Carl Roth | X896 | 32 % |
| N-Hydroxysuccinimid | Merck | 804518 | NHS; for synthesis |
| Phosphate Buffered Saline - Dulbecco | Biochrom | L1825 | PBS |
| Probe molecule e.g. Fibronectin, human plasma | Sigma-Aldrich | F1056 | |
| Probe molecule e.g. RrgA | Produced in laboratory | ||
| Sodiumchlorid | Carl Roth | 9265 | NaCl |
| Tris(hydroxymethyl)-aminomethan | Carl Roth | AE15 | ≥ 99,3 %; TRIS; Buffer Grade |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Beakers | |||
| Glass cutter | |||
| Glass slides | Carl Roth | 0656 | |
| Inert gas desiccator | Sicco | ||
| Inverted Microscope - Zeiss Axiovert 200 | Zeiss | ||
| JPK NanoWizard 1 | JPK Instruments | ||
| JPK NanoWizard SPM and DP software | JPK Instruments | ||
| Laboratory oven | Binder | ||
| Magnetic stirrer | IKA | ||
| Micro spatula | |||
| Microcentrifuge tubes | |||
| Microsoft Excel | Microsoft | ||
| Parafilm M | Brand | 701606 | |
| Petri dishes | |||
| pH-meter | Knick | ||
| Pipettes | Starlab | 10-100 µl, 50-200 µl, 100-1000 µl | |
| Precision balance | Acculab | ||
| Silicon nitride cantilever - MLCT | Bruker AXS S.A.S | Spring constant ≤ 100 pN/nm | |
| Sonication bath | Bandelin | ||
| Staining jar | |||
| Stereo microscope - Zeiss Stemi | Zeiss | ||
| Stir bar | |||
| Kimtech science precision wipes | Kimberly-Clark | ||
| Twezzers | |||
| UV PenRay | UVP, LLC | 90-0012-01 | Mercury spectrum with the primary energy at 254 nm |
| Vacuum desiccator | |||
| Vacuum pump | |||
| Vortex mixer | VWR | ||
| Weighing paper | Carl Roth | TP64 |
Referanslar
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Neuman, K. C., Nagy, A. Single-Molecule Force Spectroscopy: Optical Tweezers, Magnetic Tweezers and Atomic Force Microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Dufrene, Y. F. Atomic Force Microscopy, a Powerful Tool in Microbiology. Journal of Bacteriology. 184 (19), 5205-5213 (2002).
- Muller, D. J., Dufrene, Y. F. Atomic Force Microscopy as a Multifunctional Molecular Toolbox in Nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Hinterdorfer, P., Dufrene, Y. F. Detection and Localization of Single Molecular Recognition Events Using Atomic Force Microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Dufrene, Y. F. Sticky Microbes: Forces in Microbial Cell Adhesion. Trends in Microbiology. 23 (6), 376-382 (2015).
- Yakovenko, O., et al. FimH Forms Catch Bonds That Are Enhanced by Mechanical Force Due to Allosteric Regulation. The Journal of Biological Chemistry. 283 (17), 11596-11605 (2008).
- Casillas-Ituarte, N. N., et al. Amino Acid Polymorphisms in the Fibronectin-Binding Repeats of Fibronectin-Binding Protein A Affect Bond Strength and Fibronectin Conformation. The Journal of Biological Chemistry. 292 (21), 8797-8810 (2017).
- Hilleringmann, M., et al. Molecular Architecture of Streptococcus Pneumoniae TIGR4 Pili. The EMBO Journal. 28 (24), 3921-3930 (2009).
- Izore, T., et al. Structural Basis of Host Cell Recognition by the Pilus Adhesin from Streptococcus Pneumoniae. Structure. 18 (1), 106-115 (2010).
- Henriques-Normark, B., Tuomanen, E. I. The Pneumococcus: Epidemiology, Microbiology, and Pathogenesis. Cold Spring Harbor Perspectives in Medicine. 3 (7), a010215 (2013).
- Henderson, B., Nair, S., Pallas, J., Williams, M. A. Fibronectin: a Multidomain Host Adhesin Targeted by Bacterial Fibronectin-Binding Proteins. FEMS Microbiology Reviews. 35 (1), 147-200 (2011).
- Becke, T. D., et al. Single Molecule Force Spectroscopy Reveals Two-Domain Binding Mode of Pilus-1 Tip Protein RrgA of Streptococcus Pneumoniae to Fibronectin. ACS nano. 12 (1), 549-558 (2018).
- Herman-Bausier, P., Pietrocola, G., Foster, T. J., Speziale, P., Dufrene, Y. F. Fibrinogen Activates the Capture of Human Plasminogen by Staphylococcal Fibronectin-Binding Proteins. mBio. 8 (5), e01067 (2017).
- Vitry, P., Valotteau, C., Feuillie, C., Bernard, S., Alsteens, D., Geoghegan, J. A., Dufrene, Y. F. Force-Induced Strengthening of the Interaction between Staphylococcus aureus Clumping Factor B and Loricrin. mBio. 8 (6), e01748 (2017).
- Milles, L. F., Schulten, K., Gaub, H. E., Bernardi, R. C. Molecular Mechanism of Extreme Mechanostability in a Pathogen Adhesin. Science. 359 (6383), 1527-1533 (2018).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating Receptor-Ligand Systems of the Cellulosome with AFM-Based Single-Molecule Force Spectroscopy. Journal of Visualized Experiments. (82), e50950 (2013).
- Stetter, F. W., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456 (2015).
- Schmidt, S. W., Christ, T., Glockner, C., Beyer, M. K., Clausen-Schaumann, H. Simple Coupling Chemistry Linking Carboxyl-Containing Organic Molecules to Silicon Oxide Surfaces under Acidic Conditions. Langmuir: the ACS journal of surfaces and colloids. 26 (19), 15333-15338 (2010).
- Zimmermann, J. L., Nicolaus, T., Neuert, G., Blank, K. Thiol-Based, Site-Specific and Covalent Immobilization of Biomolecules for Single-Molecule Experiments. Nature Protocols. 5 (6), 975-985 (2010).
- Ott, W., Jobst, M. A., Schoeler, C., Gaub, H. E., Nash, M. A. Single-Molecule Force Spectroscopy on Polyproteins and Receptor-Ligand Complexes: The Current Toolbox. Journal of Structural Biology. 197 (1), 3-12 (2017).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS nano. 11 (6), 6346-6354 (2017).
- Ebner, A., et al. A New, Simple Method for Linking of Antibodies to Atomic Force Microscopy Tips. Bioconjugate Chemistry. 18 (4), 1176-1184 (2007).
- Kufer, S. K., et al. Covalent Immobilization of Recombinant Fusion Proteins with hAGT for Single Molecule Force Spectroscopy. European Biophysics Journal with Biophysics Letters. 35 (1), 72-78 (2005).
- Hinterdorfer, P., Baumgartner, W., Gruber, H. J., Schilcher, K., Schindler, H. Detection and Localization of Individual Antibody-Antigen Recognition Events by Atomic Force Microscopy. Proceedings of the National Academy of Sciences of the United States of America. 93 (8), 3477-3481 (1996).
- Hinterdorfer, P., Schilcher, K., Gruber, H. J., Schindler, H. Conjugation of Biomolecules to Tip and Probe Surfaces for Molecular Recognition in Atomic Force Microscopy. European Journal of Cell Biology. 74, 72 (1997).
- Riener, C. K., et al. Heterobifunctional Crosslinkers for Tethering Single Ligand Molecules to Scanning Probes. Analytica Chimica Acta. 497 (1-2), 101-114 (2003).
- Metwalli, E., Haines, D., Becker, O., Conzone, S., Pantano, C. G. Surface Characterizations of Mono-, Di-, and Tri-Aminosilane Treated Glass Substrates. Journal of Colloid and Interface Science. 298 (2), 825-831 (2006).
- Beyer, D., Knoll, W., Ringsdorf, H., Elender, G., Sackmann, E. Covalently Attached Polymer Mono- and Multilayers on Silanized Glass Substrates. Thin Solid Films. 284, 825-828 (1996).
- Hermanson, G. T. Chapter 13 - Silane Coupling Agents. Bioconjugate Techniques. 3, 535-548 (2013).
- Howarter, J. A., Youngblood, J. P. Optimization of Silica Silanization by 3-aminopropyltriethoxysilane. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (26), 11142-11147 (2006).
- Hermanson, G. T. Chapter 6 - Heterobifunctional Crosslinkers. Bioconjugate Techniques. 3, 299-339 (2013).
- Sehgal, D., Vijay, I. K. A Method for the High Efficiency of Water-Soluble Carbodiimide-Mediated Amidation. Analytical Biochemistry. 218 (1), 87-91 (1994).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions Towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Butt, H. J., Jaschke, M. Calculation of Thermal Noise in Atomic Force Microscopy. Nanotechnology. 6, 1-7 (1995).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single Molecule Force Spectroscopy by AFM Indicates Helical Structure of Poly(ethylene-glycol) in Water. New Journal of Physics. 1 (1), 6 (1999).
- Gugutkov, D., Gonzalez-Garcia, C., Rodriguez Hernandez, J. C., Altankov, G., Salmeron-Sanchez, M. Biological Activity of the Substrate-Induced Fibronectin Network: Insight Into the Third Dimension Through Electrospun Fibers. Langmuir: the ACS Journal of Surfaces and Colloids. 25 (18), 10893-10900 (2009).
- Rief, M., Oesterhelt, F., Heymann, B., Gaub, H. E. Single Molecule Force Spectroscopy on Polysaccharides by Atomic Force Microscopy. Science. 275 (5304), 1295-1297 (1997).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Marszalek, P. E., Oberhauser, A. F., Pang, Y. P., Fernandez, J. M. Polysaccharide Elasticity Governed by Chair-Boat Transitions of the Glucopyranose Ring. Nature. 396 (6712), 661-664 (1998).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical Stability of Single DNA Molecules. Biophysical Journal. 78 (4), 1997-2007 (2000).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-Molecule Force-Clamp Experiments Reveal Kinetics of Mechanically Activated Silyl Ester Hydrolysis. ACS nano. 6 (2), 1314-1321 (2012).
- Schmidt, S. W., Beyer, M. K., Clausen-Schaumann, H. Dynamic Strength of the Silicon-Carbon Bond Observed Over Three Decades of Force-Loading Rates. Journal of the American Chemical Society. 130 (11), 3664-3668 (2008).
- Schmidt, S. W., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Mechanically Activated Rupture of Single Covalent Bonds: Evidence of Force Induced Bond Hydrolysis. Physical Chemistry Chemical Physics. 13 (13), 5994-5999 (2011).
- Schmidt, S. W., Pill, M. F., Kersch, A., Clausen-Schaumann, H., Beyer, M. K. Mechanically Induced Silyl Ester Cleavage Under Acidic Conditions Investigated by AFM-Based Single-Molecule Force Spectroscopy in the Force-Ramp Mode. Faraday Discussions. 170, 357-367 (2014).
- Rief, M., Gautel, M., Gaub, H. E. Unfolding Forces of Titin and Fibronectin Domains Directly Measured by AFM. Advances in Experimental Medicine and Biology. 481, 129-136 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır