Method Article
Immobilisation covalente de protéines pour la spectroscopie de Force seule molécule
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit l’immobilisation covalente de protéines avec un hétérobifonctionnel agent de couplage silane aux surfaces d’oxyde de silicium conçu pour la spectroscopie de force force atomique microscopie basée seule molécule qui est illustrée par la interaction de RrgA (adhésine pilus-1 pointe de S. pneumoniae) avec la fibronectine.
Résumé
Ces dernières années, microscopie à force atomique (AFM) a basé la spectroscopie de force seule molécule (SMF) élargie notre compréhension des fonctions et des propriétés moléculaires. Il nous a donné l’occasion d’explorer la multiplicité des mécanismes biophysiques, par exemple, comment bactérienne adhésines et la lier à des récepteurs de surface hôte plus en détail. Entre autres facteurs, le succès des expériences de SMF dépend de l’immobilisation fonctionnelle et native de la biomolécules d’intérêt sur des surfaces solides et des conseils de l’AFM. Nous décrivons ici un protocole simple pour le couplage covalent des protéines sur des surfaces de silicium à l’aide de silane-PEG-carboxyles et la chimie de N-hydroxysuccinimid/1-ethyl-3-(3-dimethyl-aminopropyl)carbodiimid (EDC/NHS) bien établie dans l’ordre d’étudier l’interaction des adhésines pilus-1 RrgA de la bactérie Gram positive Streptococcus pneumoniae (S. pneumoniae) avec la matrice extracellulaire protéines la fibronectine (Fn). Nos résultats montrent que la fonctionnalisation de surface conduit à une répartition homogène des Fn sur la surface vitrée et à une concentration appropriée de RrgA sur la pointe de cantilever AFM, apparente par la valeur de cible de jusqu'à 20 % des événements d’interaction au cours de la SMF mesures et a révélé que RrgA se lie à la Fn avec une force moyenne de 52 AP. Le protocole peut être ajusté pour couple via site spécifique gratuit groupes thiols. Cela se traduit par une orientation prédéfinie de protéine ou d’une molécule et est adapté pour d’autres applications biophysiques outre les SMF.
Introduction
À côté des pinces optiques et magnétiques, la force atomique (AFM) de microscope1,2 a émergé comme un outil utile pour analyser et manipuler les molécules et sonder leurs propriétés et fonctions, y compris leur réponse à la force externe3 ,4. En revanche de méthodes telles que le dosage immunoenzymatique (ELISA), surface résonance plasmon (SPR) ou configurations de cristal de quartz de microbalance (QCM), AFM permet de mesurer les interactions sur la molécule unique (SMF)5 et niveau unicellulaire (FCS)6 . Ces technologies ont donné de précieuses informations sur les mécanismes contraignants comme les obligations prises trouvées pour l’interaction d’e. coli pilus protéine que FIMH avec mannose7ou le tandem β-fermeture à glissière répète formé par les protéines de liaison des Fn de S. aureus lors de la liaison à la Fn8. Nous avons récemment pu montrer que l’adhésine pilus-1 RrgA9,10 de la bactérie Gram positive Streptococcus pneumoniae (S. pneumoniae)11 est capable de se lier à la fibronectine12 avec ses deux domaines de terminales. Cela a révélé un nouveau mécanisme de liaison de deux domaines qui diffère de la β-fermeture à glissière en tandem et peut permettre des pneumocoques Pili à former et à maintenir un hôte contact contenant la fibronectine transitoire surfaces13.
Le succès des expériences de SMF dépend l’immobilisation fonctionnelle et native de la biomolécules sur des surfaces solides et des conseils de l’AFM. Comme forces élevées peuvent se produire lors des mesures de SMF, les protéines devraient préférablement être par covalence couplées à la surface. Il y a un grand nombre de méthodes de couplage différent pour l’immobilisation de protéines et autres biomolécules, ainsi que des cellules entières sur des surfaces solides (inorganiques), des nano-particules et autres dispositifs décrits dans la littérature14,15 ,16,17,18,19,20,21,22,23,24, 25,26,27. Ces protocoles font souvent l’utilisation de substances dangereuses, sont difficiles à effectuer et/ou nécessitent des équipements spéciaux (p. ex., plasma cleaner). Un moyen simple de molécules de couple au verre est d’attacher une couche plus épaisse de polymère de hétérobifonctionnel agents réticulants avec un groupe silane-réactif sur un côté et un groupe amine-réactif sur leurs revers. Selon l’application, les agents de couplage peuvent comporter des chaînes d’hydrocarbures flexibles de longueur variable, par exemple., polyethylenglycol (PEG). Ils suppriment les interactions non spécifiques des surfaces modifiées (par exemple, hydrophobe, électrostatiques et les interactions de van-der-Waals) et peuvent fournir la liberté de rotation de la molécule couplée.
Nous décrivons ici un protocole général pour le couplage covalent des protéines contenant un ou plusieurs groupes aminés libres (-NH2) au verre des surfaces et de nitrure de silicium AFM conseils via un hétérobifonctionnel éthoxy silane-PEG-carboxylique (-COOH). Ce protocole peut être utilisé dans les expériences de SMF, qui est basés sur l’interaction entre RrgA et la protéine de la matrice extracellulaire Fn (voir la Figure 1 pour un aperçu).
La première étape est la silanisation la surface28,29,30,31. Il s’agit de l’hydrolyse des groupes éthoxy de l’agent de couplage afin de former des groupes de SiOH hautement réactifs. Ceux-ci peuvent réagir avec les groupes SiOH sur le substrat. Dans une condensation primaire étape, ces silanols former des liaisons hydrogène et répartis sur le substrat. Dans une réaction de condensation secondaire (qui nécessite habituellement la chaleur ou vide pour éliminer l’eau), liaisons siloxane sont forment. Cela se traduit par une couche de covalence attaché organo-silane.
La deuxième étape est le couplage des protéines de fonctionnement (-COOH) les groupes qui s’étendent de la polymère32. Tout d’abord, l’acide est converti en un ester réactif N-hydroxysuccinimid (NHS) intermédiaire, qui est acquise par le NHS/EDC bien établie (1-éthyl - 3-(3-dimethylaminopropyl) carbodiimid chimie33 et subit une substitution nucléophile pour finalement former une liaison amide avec des amines primaires sur les protéines.
De cette façon, RrgA a été couplé au conseils AFM NITRURE silicium et Fn humaine à des substrats de verre dans une orientation aléatoire et leurs forces d’interaction ont été analysés au niveau de la molécule. Nos résultats montrent que la chimie de surface décrite conduit à une répartition homogène des Fn sur la surface vitrée et à une concentration appropriée de RrgA sur la pointe, apparente par la valeur de cible de jusqu'à 20 % des événements d’interaction lors des mesures de SMF. Cette chimie réduit les interactions non spécifiques à fond, est sous réserve de modifications peu lors de l’acquisition de données et convient donc parfaitement pour des expériences précises de SMF.
Protocole
1. immobilisation des protéines via Agents de couplage Silane fonctionnelle
Remarque : La Figure 1 donne un aperçu sur la chimie de surface appliquée dans le présent protocole.
ATTENTION : Dans le protocole suivant, différents produits chimiques corrosifs et peau irritante de propriétés sont utilisés. Porter des gants adéquats (résistant à l’acide), des lunettes de sécurité et de laboratoire enrober et travaillent sous la hotte tout en préparant des solutions afin d’éviter l’inhalation des vapeurs.
- Fonctionnalisation de surfaces vitrées et cantilever de nitrure de silicium du silane agents de couplage
- Éliminez la poussière grossière et contaminations de lames de verre d’isopropanol et de précision pelucheux lingettes et couper les diapositives dans la taille souhaitée (facultatif).
Remarque : À côté du verre, la surface solide peut être silice, quartz et les oxydes d’aluminium, cuivre, étain, titane, fer, chrome, zirconium, nickel et zinc.
ATTENTION : Couper les lames de verre peut-être causer des arêtes vives. - Placer le verre glisse dans un pot de coloration rempli avec de l’acide chlorhydrique (33 % HCl) dilué avec de l’eau bidistillée (ddH2O) 3-5 % (v/v), fermer le bocal avec couvercle approprié et le placer dans un bain à ultrasons pendant 90 min à température ambiante.
Remarque : Le bocal utilisé a un diamètre de 6 cm et d’une taille approximative de 65-70 mL. Un volume approprié de HCl dilué pour le pot est de 50 mL contenant 5 mL 33 % HCl et 45 mL de ddH2O. L’HCl efficacement élimine les ions métalliques non contraignant, en particulier le sodium, le potassium et le calcium et réduit le silicium afin de produire une surface de verre saturée de hydroxyle.
ATTENTION : HCl est corrosif et irritant de la peau. Porter des gants résistant aux acides adéquates, des lunettes de sécurité et de laboratoire manteau et travaillent sous la hotte pendant la préparation de la solution afin d’éviter l’inhalation des vapeurs. - Placez le nitrure de silicium AFM cantilever sondes sur une lame de verre propre avec la pointe vers le haut et irradier avec ultra-violet lumière d’en haut pendant au moins 90 min.
Remarque : Pour la spectroscopie de force seule molécule, poutres en porte-à-faux avec une constante de ressort nominale de 0,01 à 0,1 N m-1 sont utiles. Irradiation de la surface en porte-à-faux avec la lumière UV supprime les contaminants organiques, principalement les substances grasses et, ce qui la rend hydrophile sur un côté. Si l’autre côté est fortement contaminée - qui ne devrait pas être le cas, ou si les sondes en porte-à-faux sont utilisées fraîches Déballage du fournisseur - elle peut affecter la mesure de la SMF. Un nettoyage en profondeur de la puce toute en porte-à-faux à l’aide de la solution de piranha, qui a été utilisée dans nombreuses études34, peut aider.
ATTENTION : Le rayonnement UV sont nocif pour les yeux ; par conséquent, irradiation des sondes en porte-à-faux devrait être effectuée dans une enceinte imperméable lumière UV. Solution de Piranha est très réactive et peut brûler la peau, de papier et d’autres matières organiques. N’utilisez pas de récipients en plastique. S’il est placé dans des plats ou en pots de même avec de petites quantités de contaminations organiques de surface (p. ex., depuis l’usage précédent), il peut réagir rapidement. - Remplacer l’acide chlorhydrique dans le bocal de coloration avec FD2O sans laisser la surface sécher et placer le récipient dans le bain à ultrasons pour encore 10 min. Remplacez l’eau deux fois plus pendant 10 min respectivement à laver correctement le chlorhydrique acide.
- Pendant ce temps, dissoudre éthoxy (ou méthoxy) acide de polyéthylène glycol de silane (Si (OC2H5)3-PEG-COOH) dans un mélange d’éthanol et FD2O (v/v 95 % / 5 %, pH 4,6, ajusté à l’acide acétique) à une concentration finale de 0,1 mg mL -1. Conserver la solution hermétiquement fermée afin d’éviter l’évaporation de l’éthanol.
Remarque : Les agents de couplage Silane sont sensibles à l’humidité et de température. Par conséquent, ils doivent être stockés sous gaz inerte (N2), à basse température (-20 ° C) et dans des conditions sèches. Avant d’ouvrir le flacon, assurez-vous que les silanes ont atteint la température de la pièce afin de minimiser l’hydratation et, partant, passivation des groupes réactifs. Agents de couplage hétérobifonctionnel PEG sont disponibles avec de nombreux différents groupes fonctionnels et de longueurs différentes entretoise. Pour l’immobilisation au hasard des protéines via leurs groupes aminés libres (NH2), tel que décrit dans le présent protocole, le groupe fonctionnel supplémentaire pour le silane éthoxy/méthoxy doivent être un ester du NHS. À côté de l’achat d’un agent de silane avec ester NHS, un moyen simple d’obtenir tel ester NHS est d’activer un groupe carboxyle (-COOH) avec 1-ethyl-3-(3-dimethylaminopropyl) carbodiimid (EDC) et le NHS (voir 1.2.1. et 1.2.2.).
ATTENTION : L’éthanol est inflammable et irritant de la peau. L’acide acétique est corrosif et inflammable. Prendre soin de ne pas pour obtenir des silanes réactifs sur la peau ou dans les yeux. Porter des gants adéquats, des lunettes de sécurité et manteau de laboratoire et de travailler sous la hotte afin d’éviter l’inhalation des vapeurs. - Verser la solution de silane dans deux boîtes de Pétri distinct, placer les sondes préparés en porte-à-faux et les lames de verre dans une boîte de Pétri respectivement, fermer hermétiquement (p. ex., parafilm) pour éviter l’évaporation de l’éthanol et incuber stationnaire pendant 90 min à température de la pièce.
Remarque : La taille optimale de la boîte de Pétri dépend du nombre de sondes en porte-à-faux et la taille des lames de verre qui devrait être fonctionnalisés. Une taille de diamètre pour une bonne maniabilité et le réactif de faible volume est de 50-60 mm. Pour éviter de plier intempestif du levier tout en pénétrant par le biais de l’interface d’air de l’eau le cantilever se tiendrait à un angle de 90° à l’interface air-eau. L’incubation des lames de verre (mais pas les sondes en porte-à-faux) peut éventuellement être effectuée dans un agitateur orbital. - Rincer les lames en porte-à-faux et verre dans trois béchers consécutifs contenant de l’éthanol pur laver complètement les composés non lié au silane.
Remarque : Pour éviter de plier intempestif du levier tout en pénétrant à travers l’interface d’air de l’eau, le cantilever se tiendrait à un angle de 90°. - Déposer les lames de verre fonctionnalisés dans le pot de coloration et de la luge sur une lame de verre propre et cure à 110 ° C pendant 30 min.
Remarque : Séchage avec chaleur induit la formation de liaisons covalentes siloxane et l’élimination de l’eau. Comme les lames de verre ont été fonctionnalisés seulement d’un côté, assurez-vous de bien indiquer le côté enduit. - Stocker les échantillons de verre silanisée et cantilever sondes dans un dessiccateur à vide pendant une semaine.
Remarque : Le protocole peut être suspendu ici.
- Éliminez la poussière grossière et contaminations de lames de verre d’isopropanol et de précision pelucheux lingettes et couper les diapositives dans la taille souhaitée (facultatif).
- Immobilisation au hasard des protéines sur cantilever de nitrure silicium et verre silanisée
Remarque : Pour éviter de plier intempestif du levier, la sonde en porte-à-faux se tiendrait à un angle de 90° tout en pénétrant toutes les interfaces air-eau.- Préparer une solution contenant 42 mg mL-1 d’EDC et mg 20 mL-1 NHS dans une solution saline tamponnée au phosphate standard (PBS ; 137 mM NaCl, KCl 2,7 mM, 10 mM Na2HPO4, 1,8 mM KH2PO4, pH 7,4).
ATTENTION : EDC est corrosif et irritant de la peau et peut causer des lésions oculaires graves. Porter des gants adéquats, des lunettes de sécurité et manteau de laboratoire. - Couvrir les lames de verre silane enduit avec la solution et silanisée cantilever sondes une goutte de la solution d’EDC/NHS et incuber pendant 10 min à température ambiante.
Remarque : Pour l’incubation des sondes en porte-à-faux, la boîte d’origine en porte-à-faux est adaptée. D’atteler les protéines via leurs groupes aminés libres aux carboxyles (-COOH) des agents hétérobifonctionnel silane-PEG, le groupe - COOH est activé avec la chimie EDC/NHS largement utilisée. EDC a couple NHS à l’acide carboxylique, formant un ester NHS « stable », qui permet la conjugaison efficace d’amines primaires au pH physiologique dans une prochaine étape. - Rincer les lames en porte-à-faux et verre soigneusement avec du PBS dans trois béchers consécutives sur afin de laver complètement excessive EDC/NHS.
Remarque : Cette étape de lavage est critique que les autres protéines de réticulation can EDC/NHS et ainsi altérer leur fonctionnalité. - Incuber les lames de verre activé avec et le cantilever sondes dans une goutte de la solution de la protéine désirée dans une chambre humide à température ambiante. Le temps de concentration et d’incubation de protéine devraient être adapté pour répondre aux exigences de l’expérience. En général, une concentration comprise entre 0,5 et 1 mg mL-1 et incubation fois de 30 min à 2 h conviennent à la plupart des protéines. Dans le cas de la fibronectine (sur lame de verre) et les protéines de pilus-1 pointe RrgA (sur cantilever), une concentration molaire de 1,5 µM et 3 µM, respectivement et un temps d’incubation de 2 h suffisent.
- Laver les lames de verre et le cantilever sondes soigneusement avec du PBS dans trois béchers consécutives afin de laver les éléments non fixés.
- Saturer l’ester restante de NHS de tris (hydroxyméthyl)-aminomethan en plaçant les sondes en tampon tris salin (SCT ; 50 mM Tris, 150 mM NaCl, pH 7,6) pendant 20 min à température ambiante.
Remarque : Cette étape réduit intempestif de couplage covalent des protéines entre la surface fonctionnalisée de la pointe de l’AFM et le verre, car des groupes aminés de Tris peuvent se lier aux autres groupes COOH activés sur la surface en porte-à-faux et substrat. - Laver les lames de verre et le cantilever sondes soigneusement avec PBS et conserver leur en Pétri séparé couvert dans du PBS jusqu'à utilisation.
Remarque : Les échantillons doivent être fraîchement préparées et utilisé le même jour.
- Préparer une solution contenant 42 mg mL-1 d’EDC et mg 20 mL-1 NHS dans une solution saline tamponnée au phosphate standard (PBS ; 137 mM NaCl, KCl 2,7 mM, 10 mM Na2HPO4, 1,8 mM KH2PO4, pH 7,4).
2. atomic Force Microscopy base seule molécule Force Spectroscopy
Remarque : Le microscope à force atomique de JPK Instruments a été utilisé dans ce travail, ainsi que l’ensemble ups pour obtenir des courbes de force-distance a été défini avec le RampDesigner de Force.
- Étalonnage en porte-à-faux avec le bruit thermique méthode35
Remarque : Pour l’étalonnage en porte-à-faux, suivez l’étape dans le manuel du fabricant. La plupart cantilever État fournisseurs une constante approximative de printemps, qui est généralement calculée à partir de la forme nominale en porte-à-faux (longueur, largeur, épaisseur) et n’est donc pas très fiable. Comme la constante de ressort correcte est cruciale, il est conseillé d’effectuer l’étalonnage en porte-à-faux, décrit ci-dessous, en triple exemplaire et utiliser les valeurs moyennes de sensibilité optique levier et au printemps constante. Il peut être utile d’enregistrer le débattement en porte-à-faux en volts (V) au cours de l’expérience et de la convertir à forcer (pN) par la suite, en utilisant la sensibilité optique levier et le ressort de constante de valeurs moyennes. La sensibilité de levier constant et d’optique de printemps peut être déterminée avant et/ou après l’expérience, tant que la position de laser n’est pas changé sur le cantilever (la position du laser réfléchie peut être réajustée sur la photodiode).- Fixer une lame de verre propre et fraîche sur le porte-échantillon AFM et couvrez-le avec le tampon PBS.
Remarque : L’étalonnage doit être effectué sur une surface dure (p. ex., verre) et dans le même tampon comme les expériences réelles. - Fixer la sonde préparés en porte-à-faux à la titulaire en porte-à-faux, placez-le dans la tête de l’AFM et mouillez soigneusement le cantilever avec une goutte de la solution tampon PBS.
Remarque : Le mouillage du levier réduit la tension superficielle apparaissant lors de la pénétration dans le tampon PBS sur la lame de verre de calibrage et de cintrage ainsi indésirables du levier. - Déplacer lentement le levier vers la surface d’étalonnage jusqu'à ce que le levier est complètement immergé dans le tampon PBS, mais encore loin de la surface de l’étalonnage.
- Utiliser le microscope optique vue de dessus de l’AFM ou (si disponible) le microscope inversé sous l’AFM pour positionner le laser de l’AFM sur la face arrière du levier. Placer le laser spot près de l’extrémité du levier à proximité où se trouve la pointe.
Remarque : Le faisceau laser doit être situé près de l’extrémité du levier, mais il doit toujours être complètement sur le levier. Si aucun microscope optique n’est disponible, utiliser un morceau de papier pour diodes laser visible ou une carte de détecteur de laser à diodes laser infrarouge, le mettre sous la tête de l’AFM et déplacer le faisceau laser vers le bord de la puce en porte-à-faux, où se trouvent les leviers , jusqu'à ce que vous voyez l’endroit sur la carte papier ou détecteur. Puis déplacez le laser parallèle à l’arête. Lorsque la tache disparaît, c’est sur un bras en porte-à-faux. Pour linéaires cantilevers, déplacer le spot vers la fin du bras du levier jusqu'à ce qu’il apparaît sur la carte de papier/détecteur et la déplacer de nouveau jusqu'à ce qu’il est de nouveau sur le bras de levier (disparaît de la carte de papier /). Pour triangulaire, placez le spot dans le milieu entre deux bras du levier et déplacez-le vers la fin du levier, jusqu'à ce qu’il disparaisse de la carte de papier /. Vérifiez que vous êtes au milieu de la luge en déplaçant la tache perpendiculaire à l’axe longitudinal du levier. - Ajustez la position de la photodiode de détecteur de quatre quadrants de l’AFM, de telle sorte que le faisceau laser réfléchi est placé au centre de la photodiode.
Remarque : Procédez comme suit : utilisez les vis de micromètre près la diode détecteur pour déplacer la diode en horizontal et dans le sens vertical, jusqu'à ce que le signal de la somme de tous les quatre quadrants est maximisé. Puis déplacez la diode dans le sens vertical, jusqu'à ce que le signal de la déviation verticale est égale à zéro et déplacez la diode dans le sens horizontal, jusqu'à ce que le signal de déviation latérale est égale à zéro. Leviers de nitrure de silicium généralement ont un revêtement or et sont par conséquent un bimétal avec deux différents coefficients de dilatation thermique. Il en résulte une dérive thermique (apparente dans le signal de la déviation verticale) surtout en solution. Pour réduire cette dérive pendant les mesures, laissez l’ensemble du système équilibrer pendant quelques minutes avant de commencer l’étalonnage. - Ouvrez le gestionnaire de calibration dans le logiciel de l’AFM et calibrer la sensibilité en porte-à-faux et la constante du ressort du levier avec la méthode de bruit thermique comme suit.
- Attentivement l’approche de la surface du substrat et enregistrer une courbe force-distance.
- Déterminer la sensibilité optique levier en nm/V en installant une ligne droite jusqu'à la partie la plus raide de la courbe de force de rétraction, où l’embout est en contact avec la surface du substrat. La sensibilité permet de convertir la constante du ressort cantilever à pN/nm.
Remarque : La pente de la courbe de rétraction est le piezo voyage distance vs. le changement de tension de photodiode (mesurée en nm/V). - Enregistrer plusieurs spectres de bruit thermique du levier avec le porte-à-faux environ 100 µm ou plus loin de la surface afin d’exclure toute surface amortissement.
- Déterminer la constante de ressort du levier en pN/V en installant un oscillateur harmonique fourni par le logiciel de l’AFM pour les spectres de bruit thermique.
- Lentement se rétracter le cantilever et sortez-la de la solution.
- Membre suppléant de la surface de verre utilisés pour l’étalonnage de cantilever avec la surface de l’échantillon contenant les protéines immobilisées. S’assurer que le levier et la surface de l’échantillon (et donc les protéines) ne pas faire sécher tout en changeant les lames de verre.
- Fixer une lame de verre propre et fraîche sur le porte-échantillon AFM et couvrez-le avec le tampon PBS.
- Interaction force expériences au niveau de la seule protéine
- Déplacer lentement le levier vers la surface de l’échantillon humide jusqu'à ce que le levier est entièrement recouvert de tampon PBS, mais encore loin de la surface du substrat.
Remarque : Pour réduire la dérive thermique pendant l’expérience, laisser tout le système durcir durant quelques minutes avant le début des mesures de spectroscopie de force. - L’approche de la surface et d’enregistrer plusieurs courbes de force-distance (≥ 500) à différents endroits de la surface de l’échantillon, avec une force de contact du pN 250, un temps de contact de 1 s, une longueur de rétraction de 2 µm et une vitesse de rétraction de 1 µm s-1.
Remarque : Pour les ajustements de force générale de spectroscopie, suivez le manuel du constructeur. Variantes : La vitesse de rétraction peut varier entre 0,1 et 5 µm s-1 pour calculer les données de cinétique selon la charge croissante de la force. Le temps d’interaction peut varier pour analyser le renforcement de la liaison dépendante temps. Au lieu de maintenir la vitesse de rétraction constante, il peut garder la constante de force (force de serrage mode).
- Déplacer lentement le levier vers la surface de l’échantillon humide jusqu'à ce que le levier est entièrement recouvert de tampon PBS, mais encore loin de la surface du substrat.
- Analyse des données
Remarque : L’analyse des données a été effectué en utilisant le logiciel de traitement de données. Selon les protéines immobilisées, le temps de contact ou la vitesse de rétraction, savoir si une empreinte a été incorporée ou non et autres paramètres variables, les courbes de force-distance contiennent plusieurs informations différentes. Interprétation et analyse des données peuvent varier considérablement entre les différentes expériences de SMF et ne peuvent donc pas être décrite en détail ici. En ce qui concerne l’interaction entre RrgA et le Fn, le protocole suivant peut être une première étape pour l’analyse des données SMF.- Ouvrez les fichiers de courbe de force mesurée en sélectionnant l’icône Ouverte lot de forcer Scan et traiter les courbes force-distance comme suit :
- Convertir la déviation en porte-à-faux (V) la force directement proportionnelle (F) en sélectionnant l’icône de (Re) calibrer le V-débattement de réglage de sensibilité et printemps constante .
Remarque : Si en porte-à-faux étalonnage a été effectué avant l’expérience, les valeurs sont enregistrées dans les fichiers d’analyse force et sont automatiquement utilisés lors de l’étalonnage de la V-déviation. Si l’étalonnage a été effectué après l’expérience, le logiciel utilise les valeurs par défaut, qui peuvent être remplacées par les valeurs mesurées. - Soustraire la ligne de base du canal dans une région de la courbe de force loin de la surface pour définir le niveau de force zéro en sélectionnant l’icône Baseline soustractionrétraction.
Remarque : Dans certains cas, la rétraction ne peut pas avoir la même valeur de constante de force et de la courbe peut afficher une inclinaison linéaire, qui peut être enlevée en sélectionnant Offset + inclinaison. - Définissez le point où la pointe est en contact avec l’échantillon en sélectionnant l’icône de Détermination de Point de Contact .
- Convertir le signal de la hauteur à séparation pointe-échantillon en sélectionnant l’icône de Séparation pointe-échantillon . En plus de la soustraction de la position du point de contact, cette procédure soustrait le cantilever flexion pour calculer la distance entre la surface du substrat et pointe d’AFM.
Remarque : Pour le montage des modèles polymère élastique, comme le modèle de ver-comme-chaîne extensible et la détermination des longueurs de l’interaction, la séparation de la pointe-échantillon, qui est corrigée pour la flexion en porte-à-faux, est nécessaire. Pour déterminer la force de taux de charge de la pente de la courbe de la force et la vitesse de z-piezo, les courbes de force non corrigée doivent être utilisés. - Les traces de distance-force pour force de pics qui se produisent à des longueurs de rupture au-dessus de 70 nm (longueur de l’entretoise de PEG étirée)36 de démêler des interactions et d’appliquer le modèle de ver-comme-chaîne extensible vers les sommets sélectionnés en sélectionnant l’écran le Icône correspond à un modèle de chaîne de polymère et a choisi Extensible ver-comme modèle de la chaîne. Les pics de la courbe de force de rétraction seront équipées de ce modèle et les forces de rupture et de longueurs sont obtenues, ainsi que les paramètres élastiques du polymère.
- Afficher les données en histogrammes illustrant la répartition de la force et la longueur. Utilisez au moins 100 événements sans engagement pour les histogrammes.
Résultats
Le protocole décrit ici entraîne une immobilisation covalente de protéines via leurs amines primaires accessibles avec orientation aléatoire (Figure 1). La figure 2 montre une image AFM d’une surface de verre silanisée avec (de gauche) et sans (à droite) Fn immobilisée, enregistré après la déshydratation des échantillons sous un léger courant d’azote. La couche de polymère de silane montre seulement petites ondulations surfaces avec une hauteur d’environ 2 à 5 nm (Figure 2, droite), tandis que sur la surface fonctionnalisée avec Fn, environ 10 nm haute Fn molécules sont apparentes (Figure 2, gauche). En gros plan, on peut reconnaître la structure dimérique de la Fn. Les molécules de Fn semblent être compact avec une hauteur de 4-5 nm au-dessus du revêtement de surface de PEG et une longueur de ~ 120 nm (voir encarts).
Afin d’étudier les forces d’interaction de RrgA avec le Fn, qui a été récemment décrite en détail par notre groupe13, RrgA a été couplée à une pointe d’AFM NITRURE silicium et Fn humaine sur le substrat de verre (Figure 3 a). La figure 3 illustre représentant pointe courbes de séparation d’échantillon de l’interaction de RrgA FN enregistrés à une vitesse de traction de 1 µm s-1. La chimie de surface utilisée ont conduit à une interaction faible bruit de fond et les événements d’interaction bien en forme de simple (ou double) (Figure 3 a), qui ont été ajustées à l’aide d’une vis sans fin extensible comme modèle de la chaîne (eWLC) (courbes rouges). Traçant les résultats de l’ajustement (force de rupture et - longueur, voir Figure 4) montre qu’après avoir surmonté les surfaces interactions non spécifiques entre pointe d’AFM et substrat et étirant les linkers PEG (> 70 nm), jusqu'à environ 19 % des courbes de force ont démontré la rupture événements avec une rupture moyenne forcer pour la RrgA - interaction entre Fn ~ pN 52 à une distance de pointe-échantillon d’environ 100 nm. En revanche, une chimie de surface inapplicable (ici, omis de trempe avec Tris buffered saline Figure 3 b) empêche une évaluation claire des événements d’interaction unique en raison des interactions non spécifiques, plusieurs protéines liant (trace 2 et 3) ou couplage covalent des protéines entre la surface de l’échantillon et la pointe d’AFM en porte-à-faux. Ce qui conduit à des forces de rupture élevée (trace 1) éventuellement accompagnés par déroulement des domaines protéiques (Fn) (trace 4 et 5).
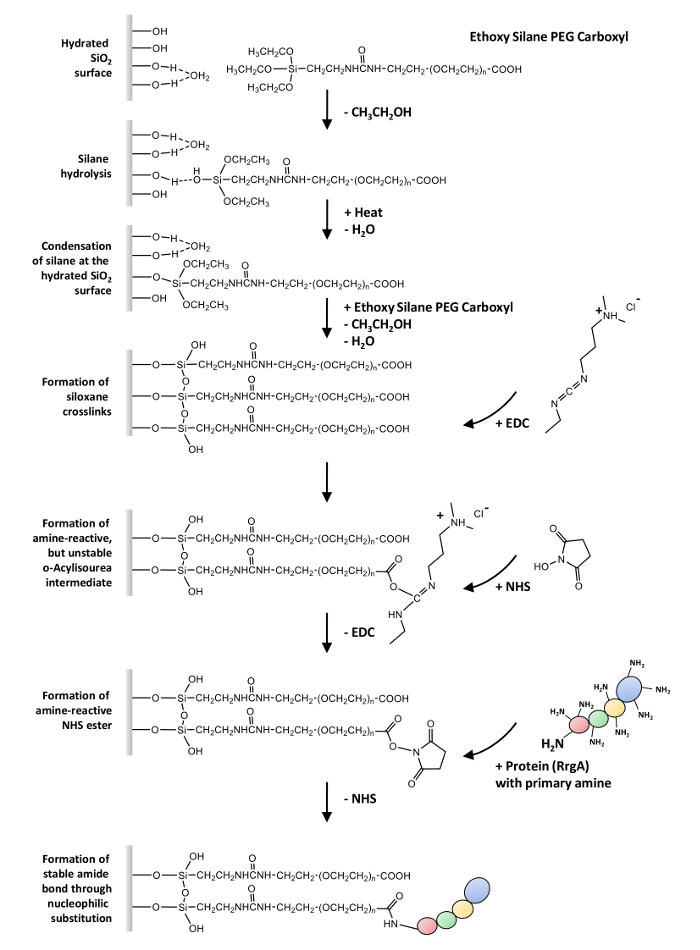
Figure 1 : vue d’ensemble sur la chimie de surface. L’hydrolyse d’éthoxy silane-PEG-carboxyle est suivie de sa condensation à la surface de verre hydraté et la formation de liaisons transversales siloxane. La réaction d’EDC avec les groupes carboxyles entraîne un réactif o- acylisourea, un intermédiaire amine-réactif avec une demi-vie très courte en solution aqueuse (hydrolyse). L’intermédiaire est stabilisé par la formation d’un ester de NHS qui subit une substitution nucléophile pour finalement former une liaison amide avec des amines primaires sur les protéines. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
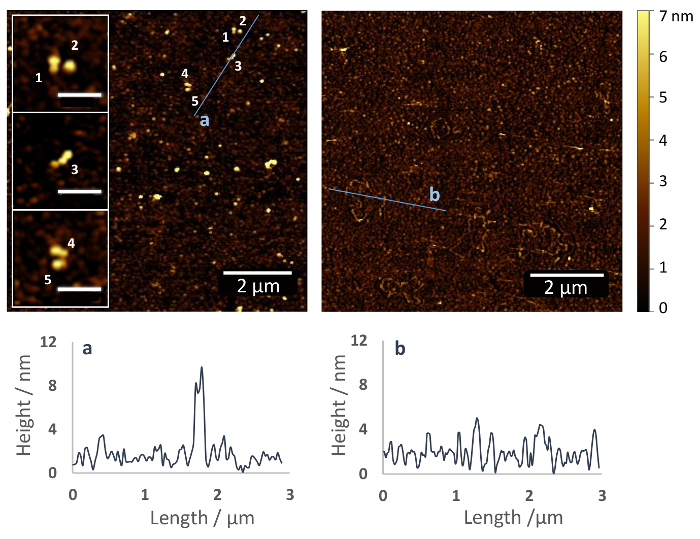
Figure 2 : Immobilisation de la fibronectine sur un verre substrat via hétérobifonctionnel éthoxy silane PEG agent de couplage carboxyle. Images AFM de verre fonctionnalisé surfaces avec (de gauche) et sans (à droite) rem. chiffres correspondent à des molécules individuelles de Fn, qui sont distribués de façon homogène sur la surface du substrat (inserts). Les molécules d’adoptent une structure de dimère et compacte avec une hauteur de 4-5 nm au-dessus de la cheville de revêtement et une longueur de > 100 nm. Cela ressemble à la structure du Fn en solution et est compatible avec les données précédentes de AFM sur d’autres surfaces, par exemple, mica (Echelle d’inlays = 500 nm)37. L’AFM images Voici les profils de hauteur selon les modalités indiquées dans les images de l’AFM. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
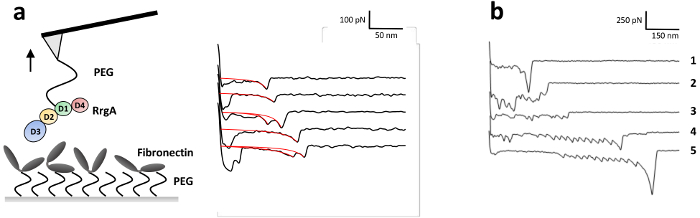
Figure 3 : Illustration d’une expérience de la SMF et représentant la force courbes de distance de la RrgA - interaction Fn. (a) RrgA et le Fn étaient liés de façon covalente via le silane d’éthoxy hétérobifonctionnel PEG agent de couplage carboxyle à un nitrure de silicium AFM cantilever de pointe et une surface vitrée, respectivement. SMFS représentant la force distance figurent les courbes obtenues pour RrgA - interaction Fn à une vitesse de rétraction de 1 µm s-1 avec l’immobilisation décrite des RrgA et des Fn. Les courbes rouges représentent les fit extensible ver-comme chaîne appliquées pour obtenir les longueurs et les forces de rupture. La figure a été modifiée par Becke, et al., ACSnano 201813. (b) SMFS représentant la force courbes distance obtenues pour la RrgA - interaction Fn sans la trempe avec Tris mis en mémoire tamponné saline. Dans ce cas, l’amine primaire de Tris était absent afin que restant actif esters du NHS ont été laissés non saturés pendant l’expérience. Cela a conduit à multi protéines liant (trace 2 et 3) et le serrage de protéines entre la surface et la pointe de l’AFM qui a abouti à la rupture élevée forces domaine accompagné (Fn-) qui se déroule (trace 1, 4 et 5 ; Notez les différentes échelles). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
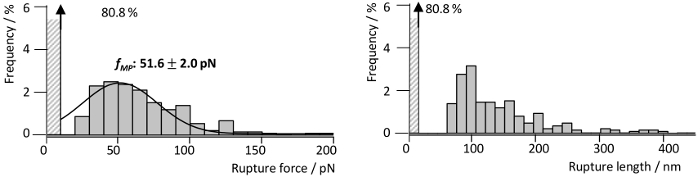
Figure 4 : distribution Force et la longueur de RrgA unique - interactions Fn. Force et histogrammes de longueur rupture correspondant provenant de RrgA - mesures d’interaction Fn SMF de rupture (n = 1400) à une vitesse de rétraction de 1 µm s-1. Les histogrammes révèlent une plus probable de force de rupture fMP de 51,6 pN (Gauss fit, ligne noire) et une accumulation de longueurs de rupture autour de 100 nm. La figure a été modifiée par Becke, et al., ACSnano, 201813. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Depuis l’introduction du manuel de vol basé SMF, s’est transformé en une technique largement utilisée pour sonder directement intra et intermoléculaires forces de différentes protéines, acides nucléiques et autres biomolécules3,4,5. Pour les expériences réussies de SMF, une surface appropriée, stratégie de couplage est une condition préalable. Pour sonder les forces intramoléculaires dans les polymères naturels et synthétiques, les polymères peuvent être couplés directement à la surface du substrat et l’AFM pointe36,38,39,40,41. Pour l’étude de leurs interactions, telles que les liaisons moléculaires, cependant, il est conseillé d’utiliser des molécules flexibles linker comme hétéro-bifonctionnels PEG linkers ou chaînes polypeptidiques, pour fixer les partenaires d’interaction à la pointe de l’AFM et la surface du substrat, afin de permettre la bonne orientation des partenaires liaison, pour vaincre les forces de surface à courte portée et d’éviter la dénaturation et déroulement des protéines21,22,23, 24,25,26,27,,42. Donc, nous avons décrit un protocole simple et franche pour l’immobilisation covalente de protéines via leurs amines primaires accessibles à l’aide de hétéro-bifonctionnels PEG entretoises.
Nous avons démontré son applicabilité avec l’enquête de l’interaction des forces entre l’adhésine RrgA de S. pneumoniae et la protéine de la matrice extracellulaire Fn, comme l’a récemment décrit en détail ailleurs13.
La chimie de surface est bien établie et approches analysées et similaires ont été utilisées avec succès dans plusieurs expériences de SMF19,42,43,44,45. Le silylether utilisé pour coupler le polymère de silane à la surface, est soumis à l’hydrolyse. Le degré d’hydrolyse dépend de la quantité de liaisons formées siloxane, qui peut être contrôlé au cours du processus de silanisation. Si les forces d’interaction forte (≥ 1000 AP) sont attendus pendant les mesures de la SMF, la silanisation devrait être effectué via vapor phase dépôt30 qui se traduit par la formation d’une couche continue de siloxanes. Comme pour beaucoup d’expériences (par exemple, plusieurs protéines – interactions protéine), les forces d’interaction sont de l’ordre de quelques centaines pN et la procédure décrite, dans laquelle siloxane formation est effectuée par le dépôt d’une phase aqueuse et non consolidée organo-silanes sont soigneusement lavé avec de l’éthanol (étape 1.1.7) suivie de séchage avec chaleur (étape 1.1.8), est suffisantes.
Une autre étape critique est de se laver l’EDC restant et molécules NHS hors de la surface (étape 1.2.3), comme restes entraînera l’activation des groupes carboxyles sur les protéines. Cela peut-être un résultat dans la réticulation des protéines sur la même surface, qui peuvent altérer leur fonctionnalité ou par liaison covalente couple activée protéines à d’autres protéines à la surface opposée. Cela peut conduire à la fixation des protéines entre la surface et la pointe de l’AFM, qui se traduit par les forces de rupture élevé éventuellement accompagnés par domaine se déroule (voir Figure 3 b, trace 1, 4 et 5, déroulement des domaines Fn)46. Le même problème peut se produire, si les esters de NHS actives de l’entretoise de PEG sont laissés non saturés. Par conséquent, l’incubation avec une solution saline tamponnée de Tris est recommandée (étape 1.2.6), comme l’amine primaire de Tris étanche aminés groupes réactifs restants.
Suivant le protocole progressif conduit à une répartition homogène du Fn sur le verre silanisée surface (voir Figure 2), laissant une forme dimérique de la protéine. Cela ressemble à la structure de la Fn´s en solution et est conforme aux données AFM précédentes sur les autres surfaces d’échantillon37. En outre, une concentration appropriée de RrgA sur la pointe de l’AFM est obtenue, ce qui génère une valeur cible d’environ 20 % des événements d’interaction bien définis lors des mesures de SMF (Figure 3 et Figure 4). Une autre façon élégante pour contrôler la quantité de molécules couplée à la pointe de substrat et en porte-à-faux d’échantillon outre variant les temps de concentration et/ou d’incubation de protéine, est la combinaison de silane-agents avec différents groupes fonctionnels secondaires. En changeant le ratio des groupes réactifs protéiques qui s’étend de la PEG-polymère, le nombre de protéines immobilisées peut être contrôlé15,16,17,18.
Le protocole décrit ici permet également d’immobiliser les autres molécules contenant du2 -NH ou être ajusté aux protéines de couple à toute autre surface d’oxyde de silicium en dehors de nitrure de silicium et de verre. Selon la conception de protéines, la fonction carboxyle réactifs amine peut être changée pour un groupe réactif sulfhydryle (p. ex., maléimide ou ortho-pyridyl disulfure) de coupler la protéine via son libre – groupes SH. Pour le Fn, il en résulte une orientation prédéfinies13,17,20.
En résumé, ce protocole peut être ajusté pour répondre aux différents besoins et est adapté pour d’autres applications biophysiques en plus des expériences de spectroscopie de force seule molécule.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Tuberculose et HG reconnaissent financièrement par le Conseil européen de la recherche « Cellufuel, Advanced Grant no 294438 ». HCS reconnaît le soutien financier du ministère fédéral pour l’éducation et la recherche par le biais de la Proteine de Technofunktionale Innovationsallianz (TeFuProt), SS reconnaît financial support du ministère d’Etat bavarois pour la Science et l’éducation par l’intermédiaire de l’axe de recherche « Herstellung und biophysikalische Charakterisierung dreidimensionaler Gewebe - CANTER ». Nous remercions Conny Hasselberg-Christoph et Martina Hörig pour le support technique
matériels
| Name | Company | Catalog Number | Comments |
| Material | |||
| 2-Propanol | Carl Roth | 6752 | |
| 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide | Sigma-Aldrich | 03450 | EDC |
| Acetic acid | Carl Roth | 3738 | 100 %; analytical purity |
| Doubly distilled water | |||
| Ethanol | Carl Roth | 9065 | ≥ 99.8 %; analytical purity |
| Ethoxy silane polyethylene glycol acid | Nanocs | PG2-CASL-5k | 5 kDa; COOH-PEG-Si(OC2H5)3 |
| Hydrochloric acid | Carl Roth | X896 | 32 % |
| N-Hydroxysuccinimid | Merck | 804518 | NHS; for synthesis |
| Phosphate Buffered Saline - Dulbecco | Biochrom | L1825 | PBS |
| Probe molecule e.g. Fibronectin, human plasma | Sigma-Aldrich | F1056 | |
| Probe molecule e.g. RrgA | Produced in laboratory | ||
| Sodiumchlorid | Carl Roth | 9265 | NaCl |
| Tris(hydroxymethyl)-aminomethan | Carl Roth | AE15 | ≥ 99,3 %; TRIS; Buffer Grade |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Beakers | |||
| Glass cutter | |||
| Glass slides | Carl Roth | 0656 | |
| Inert gas desiccator | Sicco | ||
| Inverted Microscope - Zeiss Axiovert 200 | Zeiss | ||
| JPK NanoWizard 1 | JPK Instruments | ||
| JPK NanoWizard SPM and DP software | JPK Instruments | ||
| Laboratory oven | Binder | ||
| Magnetic stirrer | IKA | ||
| Micro spatula | |||
| Microcentrifuge tubes | |||
| Microsoft Excel | Microsoft | ||
| Parafilm M | Brand | 701606 | |
| Petri dishes | |||
| pH-meter | Knick | ||
| Pipettes | Starlab | 10-100 µl, 50-200 µl, 100-1000 µl | |
| Precision balance | Acculab | ||
| Silicon nitride cantilever - MLCT | Bruker AXS S.A.S | Spring constant ≤ 100 pN/nm | |
| Sonication bath | Bandelin | ||
| Staining jar | |||
| Stereo microscope - Zeiss Stemi | Zeiss | ||
| Stir bar | |||
| Kimtech science precision wipes | Kimberly-Clark | ||
| Twezzers | |||
| UV PenRay | UVP, LLC | 90-0012-01 | Mercury spectrum with the primary energy at 254 nm |
| Vacuum desiccator | |||
| Vacuum pump | |||
| Vortex mixer | VWR | ||
| Weighing paper | Carl Roth | TP64 |
Références
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Neuman, K. C., Nagy, A. Single-Molecule Force Spectroscopy: Optical Tweezers, Magnetic Tweezers and Atomic Force Microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Dufrene, Y. F. Atomic Force Microscopy, a Powerful Tool in Microbiology. Journal of Bacteriology. 184 (19), 5205-5213 (2002).
- Muller, D. J., Dufrene, Y. F. Atomic Force Microscopy as a Multifunctional Molecular Toolbox in Nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Hinterdorfer, P., Dufrene, Y. F. Detection and Localization of Single Molecular Recognition Events Using Atomic Force Microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Dufrene, Y. F. Sticky Microbes: Forces in Microbial Cell Adhesion. Trends in Microbiology. 23 (6), 376-382 (2015).
- Yakovenko, O., et al. FimH Forms Catch Bonds That Are Enhanced by Mechanical Force Due to Allosteric Regulation. The Journal of Biological Chemistry. 283 (17), 11596-11605 (2008).
- Casillas-Ituarte, N. N., et al. Amino Acid Polymorphisms in the Fibronectin-Binding Repeats of Fibronectin-Binding Protein A Affect Bond Strength and Fibronectin Conformation. The Journal of Biological Chemistry. 292 (21), 8797-8810 (2017).
- Hilleringmann, M., et al. Molecular Architecture of Streptococcus Pneumoniae TIGR4 Pili. The EMBO Journal. 28 (24), 3921-3930 (2009).
- Izore, T., et al. Structural Basis of Host Cell Recognition by the Pilus Adhesin from Streptococcus Pneumoniae. Structure. 18 (1), 106-115 (2010).
- Henriques-Normark, B., Tuomanen, E. I. The Pneumococcus: Epidemiology, Microbiology, and Pathogenesis. Cold Spring Harbor Perspectives in Medicine. 3 (7), a010215 (2013).
- Henderson, B., Nair, S., Pallas, J., Williams, M. A. Fibronectin: a Multidomain Host Adhesin Targeted by Bacterial Fibronectin-Binding Proteins. FEMS Microbiology Reviews. 35 (1), 147-200 (2011).
- Becke, T. D., et al. Single Molecule Force Spectroscopy Reveals Two-Domain Binding Mode of Pilus-1 Tip Protein RrgA of Streptococcus Pneumoniae to Fibronectin. ACS nano. 12 (1), 549-558 (2018).
- Herman-Bausier, P., Pietrocola, G., Foster, T. J., Speziale, P., Dufrene, Y. F. Fibrinogen Activates the Capture of Human Plasminogen by Staphylococcal Fibronectin-Binding Proteins. mBio. 8 (5), e01067 (2017).
- Vitry, P., Valotteau, C., Feuillie, C., Bernard, S., Alsteens, D., Geoghegan, J. A., Dufrene, Y. F. Force-Induced Strengthening of the Interaction between Staphylococcus aureus Clumping Factor B and Loricrin. mBio. 8 (6), e01748 (2017).
- Milles, L. F., Schulten, K., Gaub, H. E., Bernardi, R. C. Molecular Mechanism of Extreme Mechanostability in a Pathogen Adhesin. Science. 359 (6383), 1527-1533 (2018).
- Jobst, M. A., Schoeler, C., Malinowska, K., Nash, M. A. Investigating Receptor-Ligand Systems of the Cellulosome with AFM-Based Single-Molecule Force Spectroscopy. Journal of Visualized Experiments. (82), e50950 (2013).
- Stetter, F. W., Kienle, S., Krysiak, S., Hugel, T. Investigating Single Molecule Adhesion by Atomic Force Spectroscopy. Journal of Visualized Experiments. (96), e52456 (2015).
- Schmidt, S. W., Christ, T., Glockner, C., Beyer, M. K., Clausen-Schaumann, H. Simple Coupling Chemistry Linking Carboxyl-Containing Organic Molecules to Silicon Oxide Surfaces under Acidic Conditions. Langmuir: the ACS journal of surfaces and colloids. 26 (19), 15333-15338 (2010).
- Zimmermann, J. L., Nicolaus, T., Neuert, G., Blank, K. Thiol-Based, Site-Specific and Covalent Immobilization of Biomolecules for Single-Molecule Experiments. Nature Protocols. 5 (6), 975-985 (2010).
- Ott, W., Jobst, M. A., Schoeler, C., Gaub, H. E., Nash, M. A. Single-Molecule Force Spectroscopy on Polyproteins and Receptor-Ligand Complexes: The Current Toolbox. Journal of Structural Biology. 197 (1), 3-12 (2017).
- Ott, W., et al. Elastin-like Polypeptide Linkers for Single-Molecule Force Spectroscopy. ACS nano. 11 (6), 6346-6354 (2017).
- Ebner, A., et al. A New, Simple Method for Linking of Antibodies to Atomic Force Microscopy Tips. Bioconjugate Chemistry. 18 (4), 1176-1184 (2007).
- Kufer, S. K., et al. Covalent Immobilization of Recombinant Fusion Proteins with hAGT for Single Molecule Force Spectroscopy. European Biophysics Journal with Biophysics Letters. 35 (1), 72-78 (2005).
- Hinterdorfer, P., Baumgartner, W., Gruber, H. J., Schilcher, K., Schindler, H. Detection and Localization of Individual Antibody-Antigen Recognition Events by Atomic Force Microscopy. Proceedings of the National Academy of Sciences of the United States of America. 93 (8), 3477-3481 (1996).
- Hinterdorfer, P., Schilcher, K., Gruber, H. J., Schindler, H. Conjugation of Biomolecules to Tip and Probe Surfaces for Molecular Recognition in Atomic Force Microscopy. European Journal of Cell Biology. 74, 72 (1997).
- Riener, C. K., et al. Heterobifunctional Crosslinkers for Tethering Single Ligand Molecules to Scanning Probes. Analytica Chimica Acta. 497 (1-2), 101-114 (2003).
- Metwalli, E., Haines, D., Becker, O., Conzone, S., Pantano, C. G. Surface Characterizations of Mono-, Di-, and Tri-Aminosilane Treated Glass Substrates. Journal of Colloid and Interface Science. 298 (2), 825-831 (2006).
- Beyer, D., Knoll, W., Ringsdorf, H., Elender, G., Sackmann, E. Covalently Attached Polymer Mono- and Multilayers on Silanized Glass Substrates. Thin Solid Films. 284, 825-828 (1996).
- Hermanson, G. T. Chapter 13 - Silane Coupling Agents. Bioconjugate Techniques. 3, 535-548 (2013).
- Howarter, J. A., Youngblood, J. P. Optimization of Silica Silanization by 3-aminopropyltriethoxysilane. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (26), 11142-11147 (2006).
- Hermanson, G. T. Chapter 6 - Heterobifunctional Crosslinkers. Bioconjugate Techniques. 3, 299-339 (2013).
- Sehgal, D., Vijay, I. K. A Method for the High Efficiency of Water-Soluble Carbodiimide-Mediated Amidation. Analytical Biochemistry. 218 (1), 87-91 (1994).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions Towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Butt, H. J., Jaschke, M. Calculation of Thermal Noise in Atomic Force Microscopy. Nanotechnology. 6, 1-7 (1995).
- Oesterhelt, F., Rief, M., Gaub, H. E. Single Molecule Force Spectroscopy by AFM Indicates Helical Structure of Poly(ethylene-glycol) in Water. New Journal of Physics. 1 (1), 6 (1999).
- Gugutkov, D., Gonzalez-Garcia, C., Rodriguez Hernandez, J. C., Altankov, G., Salmeron-Sanchez, M. Biological Activity of the Substrate-Induced Fibronectin Network: Insight Into the Third Dimension Through Electrospun Fibers. Langmuir: the ACS Journal of Surfaces and Colloids. 25 (18), 10893-10900 (2009).
- Rief, M., Oesterhelt, F., Heymann, B., Gaub, H. E. Single Molecule Force Spectroscopy on Polysaccharides by Atomic Force Microscopy. Science. 275 (5304), 1295-1297 (1997).
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Marszalek, P. E., Oberhauser, A. F., Pang, Y. P., Fernandez, J. M. Polysaccharide Elasticity Governed by Chair-Boat Transitions of the Glucopyranose Ring. Nature. 396 (6712), 661-664 (1998).
- Clausen-Schaumann, H., Rief, M., Tolksdorf, C., Gaub, H. E. Mechanical Stability of Single DNA Molecules. Biophysical Journal. 78 (4), 1997-2007 (2000).
- Schmidt, S. W., Filippov, P., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Single-Molecule Force-Clamp Experiments Reveal Kinetics of Mechanically Activated Silyl Ester Hydrolysis. ACS nano. 6 (2), 1314-1321 (2012).
- Schmidt, S. W., Beyer, M. K., Clausen-Schaumann, H. Dynamic Strength of the Silicon-Carbon Bond Observed Over Three Decades of Force-Loading Rates. Journal of the American Chemical Society. 130 (11), 3664-3668 (2008).
- Schmidt, S. W., Kersch, A., Beyer, M. K., Clausen-Schaumann, H. Mechanically Activated Rupture of Single Covalent Bonds: Evidence of Force Induced Bond Hydrolysis. Physical Chemistry Chemical Physics. 13 (13), 5994-5999 (2011).
- Schmidt, S. W., Pill, M. F., Kersch, A., Clausen-Schaumann, H., Beyer, M. K. Mechanically Induced Silyl Ester Cleavage Under Acidic Conditions Investigated by AFM-Based Single-Molecule Force Spectroscopy in the Force-Ramp Mode. Faraday Discussions. 170, 357-367 (2014).
- Rief, M., Gautel, M., Gaub, H. E. Unfolding Forces of Titin and Fibronectin Domains Directly Measured by AFM. Advances in Experimental Medicine and Biology. 481, 129-136 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon