Method Article
神经科学中透射电镜切片采样的一种无偏方法
摘要
我们介绍了一种新的脑组织电子显微镜研究工作流程。该方法允许用户以无偏见的方式检查神经元特征。对于元素分析, 我们还提供了一个脚本, 该脚本自动化了随机采样的大部分工作流。
摘要
只有用电子显微镜才能研究神经元及其突触的超微结构特征。特别是对于这些特征的密度和分布变化的比较研究, 无偏采样协议对于可靠的结果至关重要。在这里, 我们提出了一个工作流程的图像采集的大脑样本。工作流允许在定义的大脑区域内进行系统统一的随机抽样, 并且可以使用检测器对图像进行分析。该技术比串行截面的广泛检测要快得多, 但仍为估计超微结构特征的密度和分布提供了一种可行的方法。在嵌入之前, 用染色振动段作为识别正在调查的大脑区域的参考, 这有助于加快整个标本的制备过程。该方法用于比较研究, 研究环境对小鼠大脑中几种超微结构参数的影响。在成功使用工作流的基础上, 我们对其进行了调整, 以便对大脑样本进行元素分析。我们根据用户交互的时间对协议进行了优化。通过为开源软件 SerialEM 编译脚本来自动化所有耗时的步骤, 可帮助用户专注于获取元素映射的主要工作。与原始工作流程一样, 我们注重无偏采样方法, 以保证可靠的结果。
引言
在电子显微镜中, 在各部分中对有代表性的区域进行采样通常是很有挑战性的。作为观察员, 我们经常偏向于通过样本的显著特征来看待提请我们注意的特定区域, 从而防止了一个分布良好、无偏见的抽样。只有当感兴趣区域的每个部分都有相同的机会最终进入电子显微镜1时, 才能避免采样偏差。在没有软件解决方案的情况下, 可以避免采样偏差, 例如, 在不查看图像的情况下手动推下显微镜的轨迹球, 以便在舞台停止的任何位置选择采样区域。但严格地说, 这不是一个随机的过程, 因为, 有意识或潜意识, 用户可以对舞台的运动有影响, 而且, 这不是一个复杂的方式来选择采样区域。如果使用对截面来评估某个体积中的结构数量, 随机采样就变得特别重要, 例如, 对于立体学1, 它需要对截面, 即已知的距离。也可以只看一个部分, 估计具体结构的数量 2, 但有了这种方法, 调查人员往往高估了较大结构的数值密度, 除非这些结构在与截面厚度的比较。另一种方法是从连续截面重建组织体积, 从而获得所需的数据3。但这是非常耗时的, 不是一个可行的方法 (较大) 的比较研究。
为了克服这些问题, 我们开发了一个工作流程, 允许研究人员自动选择样本, 以便在超薄截面内以固定的间距获得电子显微镜。电子显微镜的位置是随机的, 允许无偏采样。该方法既适用于确定结构的数值密度 (例如, 特定神经 pil 卷 4,5内的突触), 也适用于结构特征的尺寸 (例如, 突触裂隙的宽度,或突触后密度的直径4,5)。
工作流使用定制的随机点采样 (RPS) 软件 (使用我们显微镜提供的脚本软件用 Java 脚本编写), 该软件在超薄截面上自动计算预定义区域内的网格位置。RPS 软件将电子显微镜的各个阶段移动到这些预定义的点, 以便在每个点上都能制作出电子显微镜。首先, 用户在薄截面中定义感兴趣的区域。接下来, RPS 软件计算此区域内的网格位置。第一个位置的 xy 坐标是随机创建的, 其余位置相对于第一个位置按固定的网格间隔放置。由于感兴趣区域的每个部分都有相同的机会被检查, 这允许最小的数据收集。这种抽样方法也称为系统统一随机抽样 (更多细节见参考 6,7 )。
为了确定结构的数值密度, 我们使用的是已知距离的截面对。在从预定位置的第一部分获得电子显微镜后, TEM 串行部分软件 (由我们的电子显微镜提供的软件包的一部分) 移动到第二部分的对应点, 以便得到相应位置的电子显微镜。这对于预定网格中的每个位置重复。在我们的方法中, 一个检测器用于计算每一对电子显微镜8,9中的粒子数量。一个分解器由一对计数帧组成, 每个部分8,9一个。对象的数值密度仅由在第一节 (或参考部分) 上可见的计数对象确定, 而不是由第二节 (或查找部分) 上可见的计数对象确定。这样就可以快速有效地估计物体的数值密度8,9。此外, 在单截面上, 还可以测量二维结构特征。
我们成功地应用了这一工作流程来评估暴露在丰富环境 (ee) 住房条件下的小鼠海马突触数与标准环境 (se) 住房条件的差异 4,5,并评价在 SE 和 EE5下的野生 (wt) 小鼠与神经肽 y (npy) ko 小鼠的超微结构差异。我们的目标是特别研究神经元的结构特征, 如数字突触密度、横截面活动区的长度和突触后密度、突触裂隙的宽度以及突触囊泡的数量,以评估不同实验条件之间神经元连接和激活的变化。此外, 我们感兴趣的数字密度密度的致密核囊泡 (DCV) 在神经元, 以确定在一定的大脑区域储存的神经肽的数量。
基于我们在上述研究中的成功之处, 在下一步, 我们调整了工作流程, 以选择在人脑样本中进行无偏元素分析的区域。这是为了成像铁, 它储存在铁蛋白分子中的神经元和胶质细胞。为此, 我们编译了一个脚本, 使我们能够自动执行大多数操作, 对定义区域中的大脑部分进行随机筛选。
研究方案
所有实验都得到了奥地利共和国联邦科学和研究部道德委员会的批准 (Bmwf-80.100.--2-brgt 2007 和 Bwf-66.0. 01--I"-ib 2013), 或格拉茨医科大学道德委员会, 编号 28-549 ex1516, 根据欧洲共同体理事会1986年11月24日的指令 (86件/609eec) 和欧洲议会和理事会2010年9月22日的指令 (201-63/eu) 进行。动物实验的设计和执行方式是尽量减少使用的动物数量。
1. 组织的解剖和固定
- 通过注射 150 mg/kg 的内腹腔, 对小鼠 (21周大, 雌性 C57BL/6J-6n 小鼠和 C57BL/6J 小鼠; 雄性 WT 和 NPY ko 小鼠分别在混合 C57BL/6J svj (1:1) 背景下) 进行安乐死。
- 从头骨上取下大脑, 立即将其切成两半 (将左与右半球分开)--使用手术刀。
- 立即将一半放入玻璃容器中, 在 0.1 m cacodyyyyyyyy光缓冲液 (CH3) 2 aso2 Na·3H 2o中, ph 值调整为 7.4, 为 4M nacl), 在4°c 时 ph 7.4.
注意: 固定装置是有毒的, 应小心处理。仅与防护手套和通风罩下使用。 - 在4°C 下将大脑一半固定 2天, 并在同一缓冲液中冲洗至少 24小时, 也在4°C 下冲洗。缓冲液的体积应为试样体积的十倍左右。
2. 通过将振动组部分与鼠标大脑图集 10中的参考部分进行比较, 确定大脑中的感兴趣区域
- 将大脑样本放在振动体上。确保大脑的方向是正确的 (在这种情况下, 为海马体选择了日冕方向)。
- 修剪, 直到达到大脑中感兴趣的区域 (ROI)。在较大的厚度 (例如, 100μm) 切割部分, 直到到达大脑中具有感兴趣区域的部分, 并将每个部分扔掉。
- 开始使用 ROI 在大脑部分的开头切割厚度为20μm 的振动部分, 并将振动部分放置在玻璃滑梯上。将其染色 (Nsl 染色), 将切片放入0.05% 的醋酸硫氨酸酸酸钠缓冲液中, pH 值 4.2 1分钟 (图 1ai)。
- 使用光学显微镜将染色部分与小鼠大脑地图集进行比较, 并继续切割和染色, 直到达到所需的大脑坐标。
3. 获取嵌入的采样区域
- 一旦确定了正确的区域, 就开始用振动体切割厚度为150微米的一段。
- 在立体显微镜下用剃须刀片对这个振动部分进行微解剖。减少投资回报率周围的部分。该部分应具有合适的尺寸, 用于传输电子显微镜 (TEM) 的以下制备步骤 (不大于 1 x 1 毫米2)。
4. TEM 制剂-嵌入、超薄切片和染色
- 嵌入
- 室温 (RT) 下2小时的四氧化二铬后固定。使用体积覆盖至少10倍于样品体积的样品, 但避免使用过量的固定剂, 以防止不必要的有毒废物。
注意: 四氧化二钼毒性很强, 应小心处理。仅与防护手套和通风罩下使用。 - 使用 EM 级醇的脱水步骤为 20分钟, 使用的体积大于前一步 (50%、70%、80%、96% 和100% 乙醇)。
- 在 RT 放置在环氧丙烷中 40分钟, 放入环氧丙烷树脂 (1: 2) 的混合物中, 在 RT 处 2小时, 在4°C 下过夜, 时间为1:2。
注意: 环氧丙烷剧毒, 应谨慎处理。仅与防护手套和通风罩下使用。 - 将样品嵌入100% 树脂中, 60分钟后更换树脂 2次, 90分钟后更换一次树脂 (均在 45°c)。
- 最后, 将样品放入适当的模具中, 让树脂在90°c 下聚合 3天 (图 1aii)。
- 室温 (RT) 下2小时的四氧化二铬后固定。使用体积覆盖至少10倍于样品体积的样品, 但避免使用过量的固定剂, 以防止不必要的有毒废物。
- 超微体上的修剪和切片。
- 修剪块, 确保两侧尽可能平滑, 使各部分彼此粘附 (图 1aiii)。
- 使用超微体生产55纳米超薄系列切片 (应为银灰色)。使用带有 pioloform 的插槽网格 (插槽宽度 1 x 2 mm) (图 1aiv)。
- 在 RT 中使用2% 醋酸铀30分钟和柠檬酸铅 30分钟 (这是标准的电子显微镜方法11), 在插槽网格上对超薄切片进行反染色。
注意: 醋酸铀是剧毒的, 应避免任何直接接触。只有使用防护手套才能处理。硝酸铅吞咽或吸入是有毒的, 应非常小心地处理。
5. 结合软件包在 TEM 上的参考和查找部分成像相应的 Roi
- 使用 TEM 检查网格上的节段, 使用低放大倍率 (取决于节的大小) 确定方向, 并评估节的质量。
- 启动软件 (TEM 图像分析软件包, 或 tia, 由显微镜提供), 通过存储部分的角点生成部分的虚拟图像。这使得软件能够在每个部分找到投资回报率的相应位置。
- 转到"部分",然后选择"插入" 以添加参考和查找部分的角点。按照弹出窗口的说明进行操作。从参考部分开始, 然后继续查找部分。确保输入与下一节平行的部分边缘作为点1和 2 (图 1bi)。
- 在低放大倍率下可视化参考部分, 以识别感兴趣的区域, 并使用参考部分上的 tia 将显微镜阶段移动到投资回报率的多个角点, 以创建投资回报率的轮廓。
- 使用Rps软件记录生成的多边形的坐标。为此, 请在Rps软件的对话框中按多边形的每个点的 "添加坐标", 这是在该部分中概述 roi 所必需的 (图 1bii)。
- 为Rps软件中的采样区域和区域之间的距离定义并输入合适的大小 (在所介绍的研究中, 采样区域的大小为 7μm, 它们之间的距离为 20μm, 因此在 rps 软件中至少有20个采样区域。投资回报率)。按"计算栅格", 然后软件以系统统一的随机方式为微观图形在多边形内的位置生成采样区域坐标 (图 1biii)。
注: 为了更好的方向, Rps软件可以显示多边形和多边形内的采样区域 (图 1biv)。
- 使用rps软件和tem 串行部分软件将采样点存储在参考和查找部分。这些是在11点之后记录的蒙太奇的坐标。
- 在 RPS 软件中, 按go 到下一个位置, 将显微镜阶段移动到参考部分中每个采样区域的 x 坐标。转到"位置"和"插入" , 在参考部分的软件中导入这些坐标。对所有坐标重复此操作。
- 要将参考部分中的坐标镜像到查找部分, 请转到"节 ", 然后按 "转到" 节 ".在对话框窗口中输入查找部分的编号 (通常为 "2")。
- 有关蒙太奇的记录 (请参阅下一步), 请在前面描述的参考部分和查找部分之间切换, 并使用"位置 " 和 "转到数字" 更改参考部分上的位置。在对话框窗口中选择下一个坐标。
- 对于每个采样坐标处的 SerialEM 蒙太奇, 转到"文件" , 然后从下拉菜单中选择"新建蒙太奇"。在对话框窗口中选择合适的磁贴数和重叠百分比。对于本研究, 5000X 的放大倍率足以识别正在研究的突触特征, 但 CCD 摄像机的有限视野需要制作 2 x 2 张图像。蒙太奇是用序列器制作的。
- 在录制每个蒙太奇之前, 请重新调整焦点 (或者, 如果可能, 在录制软件中激活自动对焦选项)。选择保存蒙太奇文件的文件夹, 并通过按 "序列化" 左侧蒙太奇子菜单中的"开始" 开始录制蒙太奇。
6. 利用Imagej对 tem 图像进行分析, 记录超微结构特征。
注: 为此, 从参考和查找部分创建对齐的图像堆栈非常重要。
- 将带有Image-pairs 图像的图像对转换为堆栈文件, 并将图像与stackreg 对齐(必须从 beg-epfl http://sites.imagej.net/BIG-EPFL/安装; 在本案中, 算法是使用)。为了获得蜂窝结构特征的数值密度, 定制的 ImageJ 宏探测器生成一个大小为 5.5 x 5.5μm 的计数帧, 该计数帧以随机角度随机放置在图像上。
- 启动宏迁移器 ( imagej菜单中的位置取决于保存宏的目录), 并根据需要定义参数 (计数帧的大小、段数) (图 1cii)。
- 使用 "检测器" 计数突触/μm 2 的数量.对计数框架中在引用部分中可见但在查找部分中不可见的每个突触进行计数。省略与检测器的两条 "禁止线" 相交的突触;但在相反的 "接受线" 上, 确实会计算突触。为此, 请使用Imagej工具栏中的多点工具(图 2a,图 2b)。
- 对于测量突触参数, 只选择横截面上的突触裂隙突触 (在参考部分; 在用于检测器的同一图像帧内)。
- 从下拉菜单 (图 2a) 通过插件启动 imagej 中的插件objectj 分析。从 ObjectJ 下拉对话框中打开一个新项目。这将打开一个窗口, 允许用户使用标记工具勾勒出和标记结构 (图 2b, 红色圆圈)。下面的步骤介绍了用于这里介绍的实验的突触参数。
- 使用标记工具沿结构绘制一条线, 测量突触前膜的长度和突触后密度长度 (图 2b, 红色圆圈)。
- 通过绘制覆盖突触前膜和突触后膜的多边形, 获得突触裂隙的平均宽度, 其中具有直线平行的边和整条线, 与两个膜等距。
- 为了确定对接囊泡的数量, 计算与一个囊泡直径或更小的突触前膜有最大距离的所有囊泡。
- 为了确定未停靠的囊泡的数量, 计算那些囊泡的最大距离一个囊泡直径与对接或其他未停靠的囊泡在同一突触。
7. 为光学显微镜制作半薄截面, 以记录 TEM 调查所选择的相同 ROI 中的宏观特征 (在本例中为细胞编号)。
- 在切割 TEM 的超薄截面后, 立即切割两个半薄截面, 厚度为0.5 微米, 彼此紧邻。放置在玻璃滑块上, 并使用0.5% 的甲苯胺蓝色溶液对其进行染色。在部分上放置盖板 (使用 DPX 安装介质, 由异丁烯、增塑剂 (磷酸三甲酯) 和二甲苯组成)。这两个部分用于计数单元格号。
- 用光学显微镜以低放大倍率拍摄半薄部分。
注: 所调查的结构必须在图像中可识别。在本研究中, 20X 放大用于识别细胞体。如有必要, 可以将多个图像与图像处理软件拼接在一起。 - 将两个连续半薄部分的对与图像处理软件 (例如 , imagej) 对齐。
注: 旋转和大小的差异 (可能是由于切片过程引入的压缩工件而出现的) 应进行调整, 以完美地覆盖这两个部分。 - 在光学显微镜图像上标记 ROI 的边框。ROI 必须与 TEM 图像使用的 ROI 相对应。为此, 将图像加载到Imagej 中, 并从工具栏中选择多边形选择 (图 2a)。
- 通过打开"分析", 使用 ImageJ 在整个图像上生成网格工具类网格并根据需要设置参数。
- 根据感兴趣区域内的网格点数量和截面厚度计算多边形的面积和体积 (体积= n cs * a gs * h st );Ncs = 计数横截面;Gs = 网格大小;hst = 截面厚度)。
- 如果 ROI 中的神经元细胞体只存在于一个部分, 则数一数它们的细胞核数量。从工具栏中选择Imagej中的"多点工具" 并标记单元格。在计算了每个部分上的单元格后, 计算每个卷的单元
 格数 (;C密度= 细胞密度;C计数= 单元格计数)。
格数 (;C密度= 细胞密度;C计数= 单元格计数)。 - 在"Objectj 结果" 窗口中记录所有测量值 (图2 c)。导出并保存它们以供进一步使用。
8. 使用序列板扫描脚本与数字显微镜 (DM, 配有成像过滤器) 相结合, 优化脑样品中的元素分析。
- 图像滤波器 (GIF) 的优化。
- 将样品加载到 TEM 中, 然后使用轨迹球或显微镜的操纵杆进入样品中的一个孔进行 GIF 调整。
- 在dm软件/或 dm 中切换到能量过滤 tem (EFTEM), 并在 dm 中选择 ccd 摄像机。
- 选择放大倍率进行元素分析 (放大倍率取决于感兴趣的结构区域; 在本例中, 放大倍率设置为从 76 k 到 125 k)。将曝光时间设置为0.001 秒, 然后开始查看.
- 小心地聚焦光束, 直到可以看到边缘, 并将光束居中。减小 c2/的目标光圈, 直到光圈的边缘可见, 并将光束与光束的轨迹球居中。
- 降低光束 (约 C2 46.2, 调整的曝光时间应在0.05 左右), 并通过按下 Zlp按钮找到零损耗峰值 (zlp)。按下 "全调"按钮开始调整过程。
- 获取随机采集点。
- 切换回 TEM 成像模式并选择"相机", 并在放大倍率 10 k 处检查对焦 (调整 z 轴并将脱焦设置为零)。
- 选择 LM 75X 放大倍率, 并检查相机是否未插入 (否则无法由 SerialEM 软件控制)。
- 启动序列化程序并打开一个新项目。
- 打开导航器。检查相机 & 脚本控件(用于查看和录制) 和开始查看(相机自动插入) 中的相机设置。
- 要制作超薄截面的角图, 请在 "导航" 窗口中选择"添加点"。
- 在超薄截面的边缘设置角点。按住鼠标右键, 将舞台移动到角点。当到达节的一个角时, 使用鼠标左键单击添加一个角点。重复此过程, 再添加3个角点。确保在导航器窗口中, 为拐角点的框 c勾选存储点的框 c。
- 要启动角蒙太奇 (最好在放大 LM 75 时), 请转到 "序列板菜单" 菜单栏中的"导航器", 然后从下拉菜单中选择"& 网格和安装角蒙太奇".
注: 将显示所选记录参数的最佳拟合设置。如果需要, 请更改它们。在本案中, 只有重叠百分比改为20%。
- 概述蒙太奇图像上的部分/roi。在导航器窗口中选择"添加多边形", 并通过多次右鼠标单击来勾画该部分的轮廓。在导航器下拉菜单中选择"添加点网格" , 并定义点之间的距离 (距离取决于实验问题;例如, 10Μm,图 3)。
- 按照脚本命令操作。输入导航器中显示的网格点数, 并输入采集点的数量 (例如, 20)。
- 设置照明阈值, 以便脚本可以避免网格栏。按照脚本命令操作, 并手动移动舞台, 使用网格栏将视野覆盖四分之一。根据显示的值, 输入阈值照明值 (应高于显示的值)。
- 等待, 直到获得点被选中, 烹饪例程完成。
注: 这需要很长时间, 可以在一夜之间完成;脚本在完成烹饪动作后将显微镜置于待机状态;烹饪常规对于稳定电子束中的截面非常重要。
- 能量过滤 TEM (EFTEM) 元素分析
- 在tiaydm中选择eftem模式, 在dm 中选择ccd 摄像机。
- 将光束居中, 并按照脚本命令操作, 该脚本命令将舞台移动到每个采样坐标。
注: 将询问用户是否应将该阶段移动到下一个坐标。 - 将零损耗峰值 (ZLP) 对齐, 并将c2 设置为~ 46.2%。
- 将能量设置为 60 eV (在这种情况下, 值设置为检测 Fe m 边缘), 在 10 eV 时设置缝隙, 曝光时间设置为 0.4秒. 插入缝隙, 将 C2 设置为 ~ 43.9%。
- 开始查看和对焦图像。
- 将C2设置为 46.2%, 对齐 zlp, 并将c2设置回43.9%。
- 获取元素特定设置的元素图。
注: 可以在采集对话框中使用默认设置, 但如果可能, 建议事先测试这些设置。图4显示了经过筛选的图像示例。 - 将C2设置为 46.2%, 并获取厚度图。
- 对所有确定的采集点重复上述步骤 (步骤 8.3.2-8.3.12)。
- 按照脚本的说明, 得到采集点的单个电子显微镜或蒙太奇。选择放大倍率, 以便所有 (超) 结构信息都是可见的。
- 保存 LOG 文件、导航器和结果窗口, 并删除缝隙。
- 关闭阀门, 取出样品并关闭 TEM。
结果
在这里, 我们描述了一个工作流, 以自动和无偏见的方式选择 TEM 的区域。用户在 TEM 下的超薄部分中选择感兴趣的区域, 并为工作流使用多种软件解决方案, 包括我们的 Rps软件, 该软件自动计算区域内20个采样区域的坐标。兴趣。然后, 将 TEM 阶段移动到每个采样区域进行摄影。这既可以用于分析单个部分, 也可以用于分析对截面的分析, 即已知的距离, 这允许在没有调查员偏见的情况下选择成像区域。
在记录小鼠大脑第4、5节的超微结构特征时, 这一工作流程被证明是有价值的。在这些研究中, 齿状回 (Dentate) 的多形细胞层被作为感兴趣的区域进行了研究。我们的方法被证明适用于检查 DG, 因为背侧 DG (Bregma-1.3) 的冠状部分适合超薄部分, 其轮廓在低放大倍率下很容易识别。如果要检查其他大脑区域, 在规划实验之前, 一定要检查它们的大小和特征。
应用此处描述的工作流程表明, EE 外壳在 DGpl4 中相对于标准住房条件而言, 显著增加了突触裂隙的宽度。此外, 在 ae 宿主动物4中, 致密的核囊泡数量显著减少, 这表明神经肽家族的变化。当 WT 和 NPY 敲除小鼠在 EE 条件下保持时, DGpl 中的神经元数量增加, 而 DCV 的密度相对于 se 外壳5而言而降低.相比之下, NPY 淘汰赛导致与住房条件无关的储备池 (未停靠突触泡) 中突触泡显著增加 5.EE 对 NPY KO 组突触裂隙宽度的影响发生逆转, 导致 ee 固定的 WT 和 NPY KO 小鼠5之间存在显著差异。结合 WT 和 NPY 淘汰赛动物在两种住房条件下的行为研究, 这表明 NPY 对 EE5的神经生物学效应具有至关重要的作用。
为了可视化储存在人脑中的铁, 为 SerialEM 软件编写了一个脚本, 从整个超薄截面内随机选择采集点, 目的是在这些点中的每一个点获得能量过滤电子显微镜.将切片加载到电子显微镜后, 脚本在一夜之间执行了部分的稳定 (即"特殊烹饪" 例程)。然后, 脚本从图 3中标记为光栅的点随机选择了用户预定义的一些点。通过生成测试微图并检查其灰度, 脚本检查所选点是否位于节的可见部分, 拒绝落在网格栏上的点。大多数工作流都是由脚本处理的, 用户的交互最小。但是, 不可能自动记录能量过滤的显微图像 (使用此设置), 因为对于 SerialEM 的自动对焦例程来说, 光线太少。因此, 我们切换到 DM 软件的脚本已移动阶段到每个点, 调整焦点的手, 并使 EFTEM 的铁图像。图 4显示了来自人类大脑死后的 eftem 铁图像的一个示例。
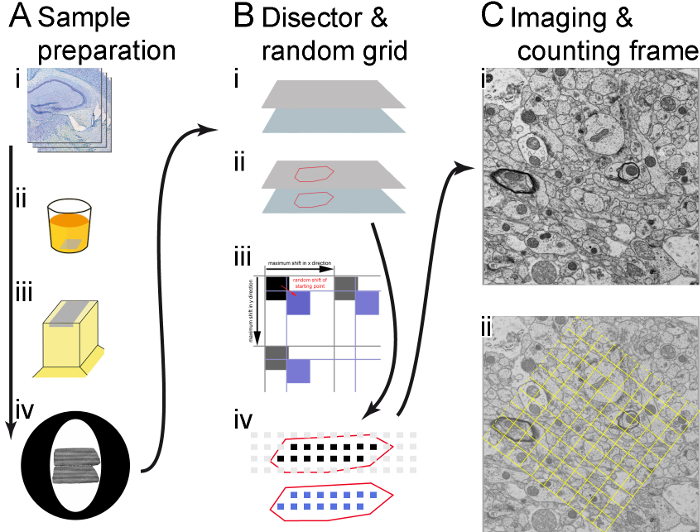
图 1。工作流的插图.(A)显示了样品制备的主要步骤 (箭头方向): 振动部分 (i)、嵌入 (ii)、切割半薄和超薄部分 (iii) 以及在铜网格上捕捉超薄部分对 (iv)。(B)使用显微镜供应商的软件和定制的 rps 软件来创建采样区域坐标, 以确定记录位置。部分的角点存储在显微镜软件中, 并概述了 ROI (在半薄部分的帮助下确定) (i);在 ROI 上生成采样区域的网格, 在 x 和 y 中引入随机移位 (红色箭头)。移位小于采样区域之间的距离 (黑色箭头), 因此, 使用随机移动的蓝色方块不是没有移位的黑色方块 (ii);仅使用 ROI 边界内的采样区域 (绘制为黑色和蓝色方块) 进行记录。在参考部分 (黑色正方形) 和查找部分 (蓝色正方形) (iii) 中的相应位置都进行了微图。(C)在每个采样区域以足够的放大倍率制作显微镜;由多个合并图像组成的蒙太奇, 如果需要 (在这种情况下, 2 x 2 图像合并在一起) (i);将生成计数帧并将其显示为图像中的叠加, 框架内的结构和 "接受线" (虚线) 上的结构将被计数, 但不会对 "禁止线" (实心帧线) (ii) 上的结构进行计数。请点击这里查看此图的较大版本.
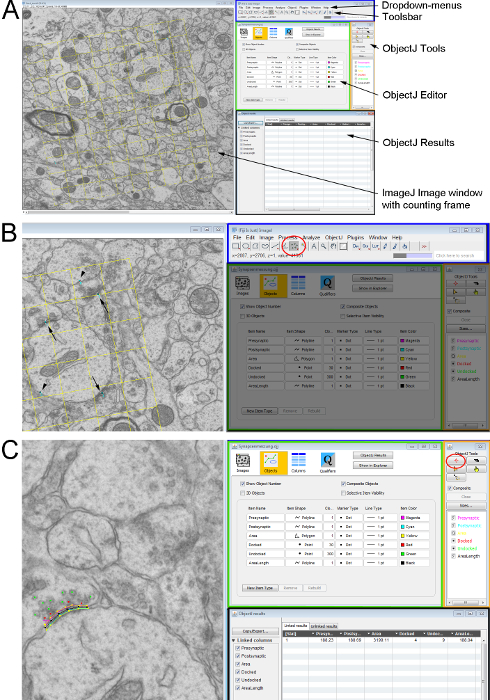
图 2.测量具有无偏数帧的一对超薄截面上的超微结构参数。(A)用于计数和分析细胞结构的 ImageJ 窗口概述。左手边显示了以计数框架为叠加的电子显微镜。右侧: ImageJ 用户界面 (蓝色矩形), 带有下拉菜单 (顶部) 和工具栏 (如下所示);对象编辑器 (绿色矩形);对象工具窗口 (橙色矩形), 其中可以选择测量工具和objectj 结果窗口 (黑色矩形), 其中记录了所有测量。(B) a 中显示电子显微镜上有标记的突触的细节 (两个部分上的突触----箭头; 仅在查找部分----箭头上的突触)。这些标记使用 "图像 j" 中工具栏中的"多点工具" (红色圆圈)。(C)突触特征的名称和测量参数是使用Objectj 工具定义的。选择了 "标记工具" 和感兴趣的功能, 并通过沿结构向左单击鼠标在图像中绘制轮廓。请点击这里查看此图的较大版本.

图 3。选择能量过滤透射电子显微镜投资回报率内元素映射的采样区域。序列板用于选择感兴趣的区域, 并建议在固定间距 (图像 A 和 B 中的粉红色交叉) 的大量采样区域。脚本然后随机选择要获取的采样区域 (从这些预定义的坐标)。在 ROI 范围内选择了20个照明良好的采样区域后, 将拒绝照明较差的采样区域, 以避免网格条, 脚本将立即停止。(A)概述了整个感兴趣的区域, 由多边形概述, 有大量可能的采样区域用 x . (b) a 的详细信息显示随机选择之前的采样区域。请点击这里查看此图的较大版本.

图 4。元素图 (eftem) 采集示例。(A)采集点周围区域的明亮场 tem 显微图。随机选择的区域用于获取元素图, 并以黑色矩形进行标记。(B)在随机选择的区域内制作的前边缘窗口图像。(C) eftem 后边缘窗口图像在同一区域制作。(D)同一地区 (m 边) 的铁元素图。请点击这里查看此图的较大版本.
讨论
这里介绍的工作流程允许研究人员以公正的方式获取有关超微结构特征的数据。与串行部分的批量调查相比, 这耗费的时间要短得多。为实现这一目标, 使用了几种不同的应用程序。首先, 我们定制的Rps软件 (有关可用性的详细信息, 请联系相应的作者) 用于引入随机阶段转换来选择采样区域坐标。这样就可以对 ROI 进行系统统一的随机抽样。接下来, 对于特定结构的计数, 我们采用了分解方法, 以一种新的方式比较了两个已知距离的连续部分, 与以前的研究13,14, 15 相比,我们使用我们的定制的 RPS 软件, 用于系统均匀的随机抽样。与从串行截面进行三维重构整个卷相比, 这节省了时间。定制的 RPS 软件是专门为一种类型的显微镜开发的, 它是复制工作流的限制因素。此特定软件的另一种方法是允许编写脚本并与其他显微镜模型兼容的应用程序。
我们成功地将这种方法用于比较研究4,5。在神经元组织的超薄部分上, 概述了感兴趣的区域, 并在该区域内进行了系统均匀的随机抽样, 拍摄了图像。必须指出的是, 感兴趣的区域, 齿状回的多形性层, 是一个相当小的研究区域, 这可能有利于我们的方法。在随机放置的检测器中, 我们评估了位于 SE 和 EE 中的成年小鼠 DGpl 中 dgpl 中 dgpl 中 DGCV 的数量和突触的几种超微结构特征, 以及成年 WT 小鼠与成年 NPY 敲除小鼠的数量。使用我们的方法, 收集到的数据显示了一些被调查参数的变化。这些发现证实了其他类似研究的少年动物2。
此工作流的实验用法的一个缺点可能是, 这种多应用程序方法在用户友好性方面并不理想, 因为用户需要适应不同的用户界面 (在我们的情况下, 用户界面, TEM 串行节), RPS 软件和序列化程序软件)。学会以高效的方式处理所有应用程序是耗时的, 应该加以考虑。然而, 投入时间学习使用此工作流仍然是有利的时间, 这是需要分析整个卷与串行部分 TEM。在感兴趣的区域内使用系统均匀随机抽样放置的检测器的方法足以提供可靠的数据1 , 而无需研究大量的分段体积。
为了在我们的研究中最大限度地发挥结果, 在样品制备过程中必须小心, 因为组织和结构的保存不仅对评估结构特征至关重要, 而且对明确确定感兴趣的领域也至关重要。这种方法的一个关键因素, 也许也是另一个缺点, 就是需要高质量的超薄截面对: 在任何一个截面上, 都必须没有覆盖被调查区域的洞或皱纹, 并且截面厚度必须是保持均匀。研究人员必须在超微切除术方面有良好的培训。在对 TEM 中的截面进行成像时, 也必须小心, 因为这些截面对电子束损伤很敏感, 很容易撕裂。此外, 在 ROI 中选择合适的采样区域数量也很重要。根据实验目的, 电子显微镜的放大倍率必须仔细设置。具体对于我们的实验, 计算中枢神经系统中的突触, 面积为 30.25μm2的一个部分上的20个感兴趣的区域是最佳的。建议对人员进行良好的培训, 以识别相关特征 (在我们的情况下, 突触, 突触特征和 DCV), 以获得可靠的结果。为了识别突触, 突触囊泡必须是可识别的, 这需要至少10纳米的分辨率。为此, 5000X 的放大倍率是最佳的, 但必须注意的是, 放大倍率取决于硬件参数, 如相机的类型和位置, 需要适应其他显微镜和/或相机类型。还必须注意的是, 协议使用的应用程序特定于一个 TEM, 具有其他模型的用户必须考虑设置中的差异。
我们相信, 只要研究问题需要系统的统一, 我们的工作流程不仅可以适应神经科学的许多其他应用, 还可以适应生物科学和材料科学的广泛领域 (当需要 TEM 的高分辨率时)随机抽样和要检查的样本量要求有一个时间效率的分析方法。例如, 我们目前对在人脑中本地化铁储存感兴趣。为此, 我们最近调整了我们的工作流程, 以便能够对随机选择的区域中的超薄截面进行元素分析。为了最大限度地减少工作流所需的应用程序数量, 我们的目标是仅使用 SerialEM 软件, 因为可以对其进行编程, 以便将舞台移动到可随机选择的预设点。我们创建了自定义脚本来控制 TEM, 目的是使工作流完全自动化。这证明是可行的, 但在滤波成像模式下自动对焦, 没有得到满意的结果。因此, 我们使用 DM 软件进行聚焦和获取能量过滤图像。
总之, 我们提出的软件解决方案, 以帮助获得电子显微镜在一个公正的方式。
披露声明
作者没有什么可透露的。
致谢
由奥地利科学基金资助, FWF, 项目编号 P 29370 B27
材料
| Name | Company | Catalog Number | Comments |
| Pentobarbital | SigmaAldrich | P3761 | |
| Formaldehyde | Merck | 1040051000 | 1kg |
| Glutardialdehyde | Science Services | E 16210 | 25%; 100ml; EM grade |
| cacodylate buffer | Merck | C4945 | 250g; Dimethylarsinic acid sodium trihydrate |
| Thionine acetate/Ceristain | Merck | 861340 | |
| acetic acid | Merck | 1000631000 | 1 L |
| Sodium hydroxide | Merck | 1064951000 | 1 kg, pellets |
| osmium tetraoxide | Science Services | E 19110 | 10x1g |
| TAAB embedding resin | Science Services | TAT001 | 500g |
| DMP-30 | Science Services | TAD024 | 100g |
| DDSA | Science Services | TAD025 | 500g |
| Uranyl acetate dihydrate | Plano GmbH | 19481 | depleted, 25g |
| Ultrastain 2 | Leica | 16707235 | Lead citrate |
| Toluidine blue solution | Agar Scientific | AGR1727 | 10g |
| Pioloform | Plano GmbH | R1275 | 10g Powder |
| Proylenoxide | SigmaAldrich | 82320-1L | 1L |
| DPX embedding medium | Plano GmbH | R1320 | embedding medium for semi-thin sections on glass slide, 50 ml |
| Vibratome, Leica VT 1000 | Leica Microsystems, Vienna, Austria | ||
| Leica Ultracut UCT, ultramicrotom | Leica Microsystems, Wetzlar, Germany | ||
| Tecnai G2 20 | FEI,Eindhoven, Netherlands | ||
| Megaview wide angle camera | Olympus Soft Imaging Solution, Münster, Germany | ||
| US 1000 digital camera | Gatan, Pleasanton, USA | ||
| TEM Imaging Analysis Software | FEI,Eindhoven, Netherlands | ||
| FEI Serial Section Software | FEI,Eindhoven, Netherlands | ||
| Fiji, ImageJ 1.52e | National Institute of Health, USA | ||
| SPSS 20.0 | SPSS Inc., Chicago, IL, USA | ||
| SerialEM | Regents of the University of Colorado | ||
| RPS (random point sampling) software 0.9a | custom-made | ||
| Disector v1.0.2 (ImageJ macro) | custom-made | ||
| EFTEMSerialEM (SerialEM script) | custom-made |
参考文献
- Howard, V., Reed, M. . Unbiased Stereology: Three-Dimensional Measurement in Microscopy. , (1998).
- Nakamura, H., Kobayashi, S., Ohashi, Y., Ando, S. Age-changes of brain synapses and synaptic plasticity in response to an enriched environment. Journal of Neuroscience Research. 56 (3), 307-315 (1999).
- Landers, M. S., Knott, G. W., Lipp, H. P., Poletaeva, I., Welker, E. Synapse formation in adult barrel cortex following naturalistic environmental enrichment. Neuroscience. 199, 143-152 (2011).
- Reichmann, F., et al. A novel unbiased counting method for the quantification of synapses in the mouse brain. Journal of Neuroscience Methods. 240, 13-21 (2015).
- Reichmann, F., et al. Environmental enrichment induces behavioural disturbances in neuropeptide Y knockout mice. Scientific Report. 6, 28182 (2016).
- Mayhew, T. M. Taking Tissue Samples from the Placenta: An Illustration of Principles and Strategies. Placenta. 29, 1-14 (2008).
- Ferguson, S., Steyer, A. M., Mayhew, T. M., Schwab, Y., Lucocq, J. M. Quantifying Golgi structure using EM: combing volume-SEM and stereology for higher throughput. Histochemistry and Cell Biology. 147, 653-669 (2017).
- Sterio, D. C. The unbiased estimation of number and sizes of arbitrary particles using the disector. Journal of Microscopy. 134 (2), 127-136 (1984).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96 (10), 857-881 (1988).
- Franklin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Lewis, P. R., Knight, D. P. . Staining Methods for Sectioned Material. , (1988).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. J Struct Biol. 152 (1), 36-51 (2005).
- Rampon, C., Tang, Y. P., Goodhouse, J., Shimizu, E., Kyin, M., Tsien, J. Z. Enrichment induces structural changes and recovery from nonspatial memory deficits in CA1 NMDAR1-knockout mice. Nature Neuroscience. 3 (3), 238-244 (2000).
- Xu, X., Ye, L., Ruan, Q. Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats. Experimental Biology and Medicine. 234 (3), 296-305 (2009).
- Lonetti, G., et al. Early environmental enrichment moderates the behavioral and synaptic phenotype of MeCP2 null mice. Biological Psychiatry. 67 (7), 657-665 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。