Method Article
Un enfoque imparcial del muestreo secciones TEM en Neurociencia
En este artículo
Resumen
Se introduce un nuevo flujo de trabajo para investigaciones de microscopia electrónica del tejido de cerebro. El método permite al usuario examinar características neuronales de una manera imparcial. Para el análisis elemental, también presentamos un script que automatiza la mayor parte del flujo de trabajo para el muestreo al azar.
Resumen
Las investigaciones de las características ultraestructurales de las neuronas y sus sinapsis sólo son posibles con microscopia electrónica. Especialmente para estudios comparativos de los cambios en las densidades y distribuciones de tales características, un protocolo de muestreo imparcial es vital para obtener resultados fiables. Presentamos un flujo de trabajo para la adquisición de imágenes de muestras de cerebro. El flujo de trabajo permite sistemático muestreo aleatorio uniforme dentro de una región definida del cerebro y las imágenes pueden ser analizadas utilizando un disector. Esta técnica es mucho más rápida que una examinación extensa de las secciones seriales pero aún presenta un enfoque factible para estimar las densidades y distribuciones de características ultraestructura. Antes de incrustar, secciones manchadas vibratome fueron utilizadas como referencia para identificar la región del cerebro bajo investigación, proceso que ayudó a acelerar la preparación de la muestra total. Este acercamiento fue utilizado para estudios comparativos investigando el efecto de un ambiente enriquecido de vivienda en varios parámetros ultraestructurales en el cerebro de ratón. Basado en el uso acertado del flujo de trabajo, adaptado a los efectos de análisis elemental de muestras de cerebro. Hemos optimizado el protocolo en el momento de la interacción del usuario. Automatizar todos los pasos lentos al compilar una secuencia de comandos para el software de código abierto SerialEM ayuda al usuario a centrarse en el trabajo principal de la adquisición de los mapas elementales. Como en el flujo de trabajo original, hemos prestado atención al enfoque de muestreo imparcial para garantizar resultados confiables.
Introducción
En microscopia electrónica, es a menudo desafiante a regiones representativas dentro de las secciones de la muestra. Nosotros, como observador, estamos a menudo sesgadas para examinar regiones específicas señala a nuestra atención por las características llamativas de la muestra, impidiendo una muestra imparcial, bien distribuida. Sesgo de muestreo sólo puede ser evitada si cada parte de la región de interés es la misma probabilidad de acabar en una micrografía electrónica1. Es posible evitar el sesgo de muestreo sin una solución de software, por ejemplo, presionando el trackball del microscopio manualmente sin mirar la imagen, con el fin de seleccionar las regiones de muestreo donde se detiene la etapa. Pero estrictamente hablando, esto no es un procedimiento al azar, porque, consciente o inconscientemente, el usuario puede tener una influencia en el movimiento de la etapa, y, además, no es una manera sofisticada de selección de regiones de muestreo. Muestreo al azar se vuelve especialmente importante si pares de secciones se utilizan para determinar el número de estructuras en un volumen determinado, por ejemplo, estereología1, que requiere pares de secciones, una distancia conocida. También sería posible sólo en una sola sección y estimar el número de estructuras específicas2, pero con este enfoque los investigadores tienden a sobreestimar la densidad numérica de estructuras más grandes, a menos que las estructuras son muy pequeñas en comparación con el espesor de la sección. Enfoques alternativos son reconstruir volúmenes de tejido a partir de secciones seriadas y así obtener los datos deseados3. Pero esto es muy tiempo consumiendo y no un enfoque factible para estudios comparativos (más grandes).
Para superar estos problemas, hemos desarrollado un flujo de trabajo que permite al investigador seleccionar automáticamente las muestras para la obtención de micrografías electrónicas en el espaciamiento regular en secciones muy finas. La posición de los micrográfos de electrón es aleatoria, lo que permite el muestreo imparcial. El enfoque es adecuado tanto para la determinación de la densidad numérica de estructuras (por ejemplo, el sinapsis dentro de un cierto neuropil volumen4,5) y las dimensiones de características estructurales (por ejemplo, la anchura de la hendidura sináptica, o el diámetro de la densidad postsináptica4,5).
El flujo de trabajo usa un punto al azar por encargo (RPS) software (escrito en Java script mediante Scripting software suministrado con el microscopio) que calcula automáticamente las posiciones en la parrilla dentro de una región predefinida de interés en un ultra finos de la sección de muestreo. El software RPS mueve la etapa del microscopio electrónico a estos puntos predefinidos, de modo que una micrografía electrónica se puede hacer en cada momento. En primer lugar, el usuario define una región de interés dentro de la sección delgada. A continuación, el software RPS calcula posiciones en la parrilla dentro de esta región. El x / y coordenadas de la primera posición se crean al azar, y los restantes puestos se colocan en intervalos regulares de la red con respecto a la primera posición. Porque cada parte de la región de interés tiene la misma probabilidad de ser examinado, esto permite recolección de datos mínima. Este enfoque de muestreo también se le llama muestreo aleatorio uniforme sistemático (ver referencia6,7 para más detalles).
Para la determinación de la densidad numérica de estructuras, trabajamos con pares de secciones que están a una distancia conocida. Después de obtener un micrográfo de electrón de la primera sección en una de las posiciones predeterminadas, software sección serie TEM (parte del paquete de software suministrado con el microscopio electrónico) se mueve hasta el punto correspondiente a la segunda sección, a fin de obtener una micrografía electrónica de la ubicación correspondiente. Esto se repite para cada localización en la red predeterminada. En nuestro enfoque, un disector se utiliza para contar el número de partículas en cada par de micrográfos de electrón de8,9. Un disector consiste en un par de cuenta marcos, uno para cada sección8,9. La densidad numérica de los objetos está determinada por solamente contar objetos visibles en la primera sección (o sección de referencia) pero no en la segunda sección (o sección de búsqueda). Esto permite para estimar la densidad numérica de los objetos de una manera rápida y eficiente8,9. Además en cada sección, se pueden medir dos dimensiones características estructurales.
Hemos aplicado este flujo de trabajo con éxito para evaluar las diferencias en el número de sinapsis en el hipocampo de ratones expuestos a ambiente enriquecido (EE) en comparación con el entorno estándar (SE) vivienda condiciones4,5, de las condiciones de vivienda y también evaluar las diferencias ultraestructurales entre ratones de tipo salvaje (WT) y neuropéptido Y (NPY) KO ratones SE y EE5. Nuestro objetivo era mirar específicamente características estructurales de las neuronas, como la densidad sináptica numérica, la longitud de la zona activa en cortes transversales y de la densidad postsináptica, la anchura de la hendidura sináptica y el número de vesículas sinápticas, con el fin de evaluar los cambios en la conectividad neuronal y la activación entre las diferentes condiciones experimentales. Además, nos interesó la densidad numérica de vesículas de núcleo denso (DCV) en las neuronas para determinar la cantidad de neuropéptidos almacenado en cierta área del cerebro.
El éxito de nuestro enfoque de los estudios descritos anteriormente, en nuestro siguiente paso, hemos adaptado nuestro flujo de trabajo para seleccionar áreas para imparciales análisis elementales en muestras de cerebro humano. Esto se hizo al hierro de la imagen, que se almacena en moléculas de ferritina en neuronas y células gliales. Para ello, compilamos un script que nos ha permitido automatizar la mayoría de las operaciones de un proceso de selección al azar de secciones del cerebro en un área definida.
Protocolo
Todos los experimentos fueron aprobados por un Comité de ética en el Ministerio Federal de ciencia y la investigación de la República de Austria (BMWF-80.104/2-BrGT/2007 y BMWF-66.010/0037-II/3b/2013), o Comisión de ética de la Universidad médica de Graz, número 28-549 ex 15/16 y realizados según la Directiva del Consejo de comunidades europeas de 24 de noviembre de 1986 (86/609/CEE) y la Directiva del Parlamento Europeo y el Consejo de September2010 22 (2010/63/UE). Los experimentos con animales fueron diseñados y realizados de tal manera que se minimice el número de animales utilizados.
1. disección y fijación del tejido
- Eutanasia ratones (21 semanas de edad, ratones C57BL/6J y C57BL/6N ratones, ratones machos de la WT y NPY KO en un mixto C57BL / 6:129 / SvJ (1:1) Fondo respectivamente) mediante la inyección de 150 mg/kg de pentobarbital por vía intraperitoneal.
- Saque los sesos del cráneo e inmediatamente córtalos por la mitad (separa el hemisferio derecho con la izquierda) - con un bisturí.
- Inmediatamente colocar las mitades en recipientes de vidrio con 2% de formaldehído y glutaraldehído al 2.5% en 0.1 M cacodilato buffer (CH3)2AsO2Na·3H2O, pH ajustado a 7,4 con 1 M de NaCl), pH 7,4 a 4 ° C.
PRECAUCIÓN: Los fijadores son tóxicos y deben manipularse con gran cuidado. Usar solamente con guantes de protección y bajo la campana. - Fijar las mitades del cerebro durante 2 días a 4 º C y enjuague en el mismo buffer durante al menos 24 h, también a 4 ° C. El volumen del buffer debe ser en sobre diez veces el volumen de la muestra.
2. identificar la región de interés dentro del cerebro mediante la comparación de secciones de Vibratome con referencia secciones desde el ratón cerebro Atlas10
- Coloque la muestra de cerebro en un vibratome. Asegurar que la orientación del cerebro es correcto (en este caso, una orientación coronal fue elegida para el hipocampo).
- Recortar hasta llega a la región de interés (ROI) en el cerebro. Corte las secciones en un gran espesor (por ej., 100 μm) hasta que la parte del cerebro con la región de interés es llegar y tirar cada sección.
- Comienza a cortar las secciones de vibratome con 20 μm de grosor en el inicio de la parte del cerebro con el ROI y colocar los elementos de vibratome sobre un portaobjetos de vidrio. Mancha les (tinción de Nissl) mediante la colocación de las secciones en acetato de tionina de 0.05% en buffer acetato de sodio, pH 4.2 durante 1 minuto (figura 1Ai).
- Comparar las secciones manchadas con el atlas del cerebro de ratón utilizando un microscopio de luz y continuar corte y coloración hasta llegar a las coordenadas deseadas del cerebro.
3. obtención de una región de muestra para empotrar
- Tan pronto como se identifica el área derecha, empezar una sección de corte en 150 μm de grosor con el vibratome.
- Microdissect esta sección vibratome con una cuchilla de afeitar debajo del microscopio estéreo. Corte las piezas alrededor del ROI. La sección debe tener un tamaño adecuado para los siguientes pasos de preparación para microscopía electrónica de transmisión (TEM) (no mayor de 1 x 1 mm2).
4. preparación TEM - incrustación, ultra delgada, corte y tinción
- Incrustación de
- La solución para 2 h en tetróxido de osmio 2% a temperatura ambiente (RT). Utilice un volumen para cubrir la muestra con al menos 10 veces el volumen de muestra, pero evite el uso de exceso fijador para evitar residuos tóxicos innecesarios.
PRECAUCIÓN: tetróxido de osmio es altamente tóxica y debe manipularse con gran cuidado. Usar solamente con guantes de protección y bajo la campana. - Deshidratar con alcoholes de grado EM en pasos de 20 minutos uso un volumen mayor que en el paso anterior (50%, 70%, 80%, 96% y 100% etanol).
- Colocar en óxido de propileno por 40 min en lugar de excelencia en una mezcla de resina / incrustación de óxido de propileno (1:2) por 2 h a temperatura ambiente y 1:3 durante la noche a 4 ° C.
PRECAUCIÓN: Óxido de propileno es altamente tóxico y debe manipularse con gran cuidado. Usar solamente con guantes de protección y bajo la campana. - Incrustar las muestras en resina 100% cambiando la resina 2 veces después de 60 min y 90 min (todos a 45 ° C) una vez.
- Por último, coloque las muestras en los moldes adecuados y dejar que la resina polimerice a 90 ° C durante 3 días (figura 1Aii).
- La solución para 2 h en tetróxido de osmio 2% a temperatura ambiente (RT). Utilice un volumen para cubrir la muestra con al menos 10 veces el volumen de muestra, pero evite el uso de exceso fijador para evitar residuos tóxicos innecesarios.
- Corte y seccionamiento en un ultramicrótomo.
- Cortar el bloque, asegurando que los lados son tan suaves como sea posible para las secciones a adherirse entre sí (figura 1Aiii).
- Producto 55 nm ultra delgadas secciones seriales (debe ser plata gris) utilizando un ultramicrótomo. Utilizar una cuadrícula de ranura (anchura de ranura de 1 x 2 mm) con pioloform (figura 1Aiv).
- Contratinción secciones ultra finas en las rejillas de ranura con acetato de uranilo 2% por 30 min y citrato de plomo de 30 s a temperatura ambiente (esto es método de microscopia electrónica estándar11).
PRECAUCIÓN: El acetato de uranilo es altamente tóxico y debe evitarse cualquier contacto directo. Manejar con guantes de protección. Nitrato de plomo es tóxico si se ingiere o inhala y deben ser manejados con gran cuidado.
5. la proyección de imagen de ROIs correspondientes en la referencia y consulta secciones TEM con paquetes de Software
- Examinar las secciones de la red con el TEM con una ampliación baja (dependiendo del tamaño de las secciones) para la orientación y evaluar la calidad de las secciones.
- Inicie el software (un paquete de Software de análisis de imágenes de TEM, o TIA, suministrado con el microscopio) para generar imágenes virtuales de las secciones mediante el almacenamiento de los puntos de la esquina de las secciones. Que permite el software para encontrar las posiciones correspondientes del ROI de cada sección.
- Ir a sección y elija Insertar para agregar los puntos de esquina para la sección de referencia y consulta. Siga las instrucciones de la ventana emergente. Comenzar con la sección de referencia y luego continúe con la sección de búsqueda. Asegúrese de que los bordes de la sección que son paralelos a la siguiente sección como puntos 1 y 2 (figura 1Bi) se introducen.
- Visualizar la sección de referencia en baja magnificación para identificar la región de interés y de mover la platina del microscopio usando la TIA en la sección de referencia a varios puntos de la esquina del retorno de la inversión para crear un contorno del ROI.
- Registrar las coordenadas del polígono resultante utilizando el software de RPS . Para ello, pulse agregar coordenadas en el cuadro de diálogo del software RPS en cada punto del polígono que se necesita para indicar el retorno de la inversión en la sección (figura 1Bii).
- Definir y entrar en un tamaño conveniente para las áreas de muestreo y distancias entre las áreas en software RPS (en el estudio presentado, el tamaño de las áreas de muestreo es 7 μm y la distancia entre ellos es de 20 μm, dando como resultado al menos 20 zonas de muestreo dentro de la RETORNO DE LA INVERSIÓN). Pulse Calcular trama, entonces el software genera coordenadas de área de toma de muestras de manera aleatoria uniforme sistemática de posiciones de la micrografía en el Polígono (figura 1Biii).
Nota: Para mejor orientación, el polígono y las zonas de muestreo dentro del polígono pueden visualizarse por el software RPS (figura 1Biv).
- Almacenar los puntos de muestreo en la sección de referencia y consulta usando el software RPS y Sección serie TEM . Estas son las coordenadas de los montajes que se registran luego11.
- En el software RPS, pulse ir a la siguiente posición para mover la platina del microscopio a x / y coordenadas de cada área en la sección de referencia de muestreo. Vaya a la Ubicación e introducir estas coordenadas en el software en la sección de referencia de importación. Repetir este proceso para todas las coordenadas.
- Para reflejar las coordenadas de la sección de referencia en la sección de búsqueda, vaya a la sección y pulse ir a la sección. Introduzca el número de la sección de búsqueda (generalmente ' 2') en la ventana de diálogo.
- Para la grabación de los montajes (ver paso siguiente), cambiar entre la sección de referencia y consulta como se describe antes y cambiar la posición en la sección de referencia y vaya a número . Elegir la siguiente coordenada en la ventana de diálogo.
- Para los montajes de SerialEM en cada muestreo coordinar, ir a archivo y elija Nuevo montaje en el menú desplegable. Seleccione el número adecuado de azulejos y el porcentaje de superposición en la ventana de diálogo. Para el presente estudio, un aumento de 5000 X es suficiente para reconocer las características sinápticas bajo estudio, pero el limitado campo de visión de la cámara CCD requiere hacer montajes de imágenes de 2 x 2. Los montajes se realizan con el SerialEM.
- Antes de grabar cada montaje, vuelva a ajustar el enfoque (o, si es posible, activar la opción de enfoque automático en el software de grabación). Seleccione la carpeta para guardar el archivo de montaje e iniciar la grabación del montaje pulsando Start en el submenú de montaje a la izquierda en SerialEM.
6. analizar las imágenes TEM con ImageJ para documento características ultraestructurales.
Nota: Para esto, es importante crear una pila de imagen alineada de la sección de referencia y consulta.
- Los pares de imágenes con ImageJ imágenes a pila a convertir un archivo de pila y alinear las imágenes con StackReg (debe ser instalado de BIG-EPFL http://sites.imagej.net/BIG-EPFL/; en el presente caso, el algoritmo era afín utilizado). Para obtener la densidad numérica de características estructurales celulares, la medida macro ImageJ Disector genera un marco cuenta con un tamaño de 5.5 x 5.5 μm coloca aleatoriamente sobre la imagen con un ángulo al azar.
- Iniciar la macro Disector (ubicación en el menú de ImageJ depende del directorio donde se guarda) y definir los parámetros (tamaño de la estructura de la cuenta, número de segmentos) como sea necesario (figura 1Cii).
- Contar el número de sinapsis/μm2 utilizando el Disector. Contar cada sinapsis dentro del marco de la cuenta que está visible en la sección de referencia, pero no visibles en la sección de búsqueda. Omitir las sinapsis que se cruzan con los dos 'prohibido líneas' de disector; pero cuentan las sinapsis en las opuestas 'líneas de aceptación'. Para ello, utilice la Herramienta multipunto en Toolsbar en ImageJ (figura 2A,B, figura 2).
- Para la medición de parámetros de sinapsis, seleccione sólo las sinapsis con una hendidura sináptica en sección transversal (en la sección de referencia, dentro de los mismos marcos de imagen utilizados para el disector).
- Iniciar el plugin ObjectJ en ImageJ desde el menú desplegable (figura 2A) via Plugins | Analizar. Abra un nuevo proyecto desde el cuadro de diálogo de lista desplegable ObjectJ. Se abrirá una ventana que permite a los usuarios a las estructuras de contorno y marca con la Herramienta de marcador (figura 2B, círculo rojo). Los parámetros sinápticos utilizados para los experimentos aquí presentados se describen en los siguientes pasos.
- Medir la longitud de la membrana presináptica y postsináptica densidad longitud dibujando una línea a lo largo de la estructura utilizando la Herramienta de marcador (figura 2B, círculo rojo).
- Obtener la media anchura de la hendidura sináptica dibujando un polígono que abarca tanto la membrana pre y postsináptica, con lados rectos paralelos y una línea segmentada en la mitad, equidistante a ambas membranas.
- Para determinar el número de vesículas acopladas, contar todas las vesículas que tienen una distancia máxima de la membrana presináptica de un diámetro de vesícula o menos.
- Para determinar el número de vesículas desacoplados, cuenta esas vesículas con una distancia máxima de diámetro de una vesícula de vesículas desacopladas acopladas u otros en la misma sinapsis.
7. producir secciones semi-delgadas para microscopía de luz de características macroscópicas del documento (en este caso el número de células) dentro del mismo ROI como elegido para la investigación de TEM.
- Inmediatamente después de cortar las secciones ultra finas para el TEM, cortar dos secciones semi-delgadas, 0.5 μm de espesor e inmediatamente adyacente uno al otro. Coloque en un portaobjetos de vidrio y les mancha con solución de azul de toluidina 0.5%. Coloque un cubreobjetos sobre las secciones (con DPX medio de montaje, que consiste en distyrene, un plastificante (fosfato tricresyl) y xileno). Estas dos secciones se utilizan para contar el número de células.
- Fotografiar las secciones semi-delgadas Ampliación baja usando un microscopio de luz.
Nota: Las estructuras investigadas deben ser identificables en las imágenes. En el presente estudio, 20 aumentos se utilizan para identificar los cuerpos de la célula. Si es necesario, varias imágenes pueden cosidas junto con un software de procesamiento de imágenes. - Alinee los pares de dos secciones semi-delgadas consecutivas con un software de procesamiento de imágenes (por ej., ImageJ).
Nota: Las diferencias de rotación y tamaño (puede ocurrir debido a artefactos de la compresión introducidas por el proceso de seccionamiento) deberán ser ajustadas para una perfecta superposición de las dos secciones. - Marcan la frontera del retorno de la inversión en la imagen de microscopía de luz. El ROI debe corresponderse con el ROI que se utiliza para las imágenes TEM. Para ello, cargar las imágenes en ImageJ y elegir la selección de polígono Toolsbar (figura 2A).
- Generar una cuadrícula sobre la imagen entera con ImageJ abriendo analizar | Herramientas | Red y establezca los parámetros como sea necesario.
- Calcular el área y el volumen del polígono del número de puntos de la cuadrícula en el área de interés y sección de grosor (volumen = NCS * unGS * hST ; NCS = secciones contó Cruz; UnGS = tamaño de la cuadrícula; hST = espesor de la sección).
- Contar el número de núcleos de los cuerpos neuronales de la célula en el ROI si sólo están presentes en una sección. Elegir Herramienta de multipunto en ImageJ la Toolsbar y marcar las células. Después de contar las células en cada sección, calcular el número de células por volumen (
 ; Cdensidad = densidad celular; Ccuenta = cuenta de célula).
; Cdensidad = densidad celular; Ccuenta = cuenta de célula). - Registrar todas las mediciones en la ventana de Resultados de ObjectJ (figura 2C). Exportar y guardar para su uso posterior.
8. usando el SerialEM Script para optimizar el Análisis Elemental en muestras de cerebro en combinación con DigitalMicrograph (DM, provista de filtro de imagen).
- Ajuste de imagen (GIF) del filtro.
- Cargar la muestra en el TEM e ir a un agujero en la muestra para la afinación de GIF utilizando el trackball o joystick del microscopio.
- Cambiar a Energía filtrada TEM (EFTEM) en software de DM o DM y seleccione Cámara CCD en DM.
- Elegir el aumento para el análisis elemental (el aumento depende de la estructura/área de interés, en el presente caso, se establece el aumento de 76 k hasta 125 k). Establecer el tiempo de exposición al 0,001 s e inicio de vista.
- Enfoque el rayo cuidadosamente hasta que los bordes se aprecia y Centre el rayo en la imagen. Reducir la abertura C2/el objetivo hasta que los bordes de la abertura son visibles y centro de la viga con el trackball para la viga.
- Desenfoque de la viga (en C2 46.2%, tiempo de exposición para la adaptación debe ser alrededor de 0.05 s) y encontrar el cero pico de pérdida (ZPL) pulsando el botón de ZPL . Iniciar el procedimiento de sintonización pulsando el botón tune completo .
- Consigue puntos al azar de la adquisición.
- Volver al modo de la proyección de imagen de TEM y selecciona la cámara y compruebe el enfoque aumento 10 k (ajustar el eje z y desenfoque en cero).
- Seleccione LM 75 aumentos Y Compruebe si la cámara no se inserta (lo contrario no puede ser controlada por software SerialEM).
- Iniciar SerialEM y abra un nuevo proyecto.
- Abrir el navegador. Compruebe la configuración de la cámara en cámara y controles de Script (para vista y registro) y empezar a Ver (cámara se inserta automáticamente).
- Para hacer una esquina del mapa de la sección ultrafina, elegir añadir puntos en la ventana del navegador.
- Establecer los puntos de esquina en los bordes de una sección muy delgada. Mover el escenario a un punto de esquina manteniendo pulsada la tecla del ratón derecho. Cuando se llega a una esquina de la sección, agregue un punto de esquina con clic izquierdo del ratón. Repita el procedimiento para añadir 3 más puntos de esquina. Asegúrese de que en la ventana del navegador está marcada la casilla C puntos de esquina para los puntos almacenados.
- Para iniciar el montaje de esquina (preferible en aumento 75 LM), ir al navegador en la barra de menú SerialEM y elegir Montaging y rejillas y Montaje de esquina de configuración en el menú desplegable.
Nota: Se muestran los mejores instalación configuración de los parámetros de registro solicitados. Cambiarlos si es necesario. En el presente caso, sólo el porcentaje de superposición fue cambiado a un 20%.
- Esquema de la sección/ROI en la imagen de montaje. Elija Añadir polígono en la ventana del navegador y esbozar la sección con múltiples derecho clics de ratón. Elija Agregar malla de puntos en el menú desplegable del navegador y definir una distancia entre los puntos (la distancia depende de la pregunta experimental; e.g., 10 μm, figura 3).
- Siga los comandos de secuencia de comandos. Introduzca el número de puntos de la cuadrícula como se muestra en el navegador y escriba el número de puntos de adquisición (por ej., 20).
- Ajuste del umbral de iluminación para que el script puede evitar barras de la rejilla. Siga los comandos de script y mover el escenario manualmente para cubrir el campo de visión por un cuarto con una barra de rejilla. Según el valor, introduzca un valor de iluminación umbral (debe ser mayor que el valor mostrado).
- Espere hasta que se seleccionan los puntos de adquisición y se acaba la rutina de cocinar.
Nota: Esto lleva mucho tiempo y puede ser durante la noche; el script envía al microscopio en modo de espera después de terminar la rutina de cocinar; la rutina de cocinar es importante para estabilizar las secciones en el haz de electrones.
- Energía filtrada análisis elemental TEM (EFTEM)
- Elegir modo de EFTEM en TIA/DM y seleccione cámara CCD en DM.
- Centro de la viga y seguir los comandos de script que se moverán la etapa a cada coordenada de muestreo.
Nota: El usuario se pedirá si la etapa debe moverse a la siguiente coordenada. - Alinee el cero pico de pérdida (ZPL) y C2 a ~ 46.2%.
- Fijar la energía en eV 60 (en este caso, el valor se establece para la detección de la Fe M-edge), raja al tiempo 10 eV y la exposición a 0,4 s. Inserte la ranura y C2 en ~ 43,9%.
- Iniciar vista y enfocar la imagen.
- Defina C2 a 46.2%, alinear ZPL y C2 a 43,9%.
- Adquirir mapa elemental elementales ajustes específicos.
Nota: Por defecto se puede utilizar en el cuadro de diálogo de adquisición, pero se recomienda probar estos previamente, si es posible; en el ejemplo se filtran imágenes se muestran en la figura 4. - Conjunto C2 a 46.2% y adquirir el mapa de grosor.
- Repita para todos los puntos de adquisición determinado (paso 8.3.2-8.3.12).
- Siga las instrucciones de la secuencia de comandos y obtener el únicos micrografías o montajes de los puntos de adquisición. Elija la ampliación que todos la (ultra) estructural información es identificable/visible.
- Guardar archivo de registro, navigator y ventana de resultados y retire la raja.
- Cerrar la válvula, retire la muestra y apaga el TEM.
Resultados
Aquí, describimos un flujo de trabajo para seleccionar las áreas para TEM de forma automática y objetiva. El usuario selecciona el área de interés dentro de una sección ultra delgada el TEM y utiliza varias soluciones de software para el flujo de trabajo incluyendo nuestro software RPS que calcula automáticamente las coordenadas de 20 zonas de muestreo dentro del área de interés. Luego, la etapa TEM se traslada a cada área de muestreo para la fotografía. Esto es posible para el análisis de cada sección y para el análisis de pares de secciones, una distancia conocida, que permite la selección de áreas para la proyección de imagen sin el sesgo del investigador.
Este flujo de trabajo resultó valiosa al documentar las características ultraestructurales en cerebro de ratón secciones4,5. En estos estudios, la capa de células polimorfo del giro dentado (DGpl) se examinó como área de interés. Nuestro método resultó adecuado para examinar la dirección general, porque una sección coronal de la DG dorsal (Bregma −1.3) encaja en una sección ultrafina y sus contornos son fácilmente reconocibles en la ampliación baja. Si otras regiones cerebrales debían ser examinados, sería importante comprobar su tamaño y características particulares antes de planear los experimentos.
Aplicar el flujo de trabajo descrito aquí demostró que EE carcasa aumenta la anchura de la hendidura sináptica significativamente en la DGpl4, respecto a las condiciones de vivienda estándar. Por otra parte, el número de vesículas de núcleo denso disminuyó significativamente en los animales encuentra EE4, indicando los cambios en el hogar de los neuropéptidos. Cuando WT y NPY ratones knockout se mantuvieron bajo condiciones EE, el número de neuronas/µm³ en la DGpl aumentó mientras que disminuyó la densidad de DCV respecto a vivienda SE5. Por el contrario, nocaut NPY dio lugar a un aumento significativo de vesículas sinápticas en la piscina de reserva (vesículas sinápticas desacopladas) independiente de la vivienda las condiciones5. El efecto de EE en la anchura de la hendidura sináptica se invirtió en el grupo NPY KO dando por resultado una diferencia significativa entre EE encuentra WT y NPY KO ratones5. Junto con estudios de comportamiento de WT y NPY animales knockout celebró bajo ambos tipos de condiciones de vivienda, esto indica un papel crucial los efectos neurobiológicos de la EE5de NPY.
Para visualizar el hierro almacenado en el cerebro humano, una secuencia de comandos fue compilado para que el software de SerialEM elegir al azar los puntos de adquisición de dentro de una sección entera ultrafina, con el fin de obtener una energía filtraron micrográfo de electrón de cada uno de estos puntos . Después de cargar la sección en el microscopio electrónico, el script realiza la estabilización de la sección (es decir., la rutina de 'cocina de muestra') durante la noche. La escritura entonces seleccionó al azar un número de puntos predefinidos por el usuario de los marcados con una reja en la figura 3. Produciendo una micrografía de prueba y comprobación de sus niveles de gris, la secuencia de comandos comprueba si los puntos solicitados fueron situados en una parte visible de la sección, rechazar los puntos que aterrizaron en barras de la rejilla. La mayor parte del flujo de trabajo fue manejado por la secuencia de interacción mínima del usuario. Sin embargo, no fue posible registrar automáticamente energía filtrada micrografías (con esta configuración), ya que había muy poca luz para la rutina de enfoque automático de SerialEM. Por lo tanto, hemos cambiado a DM software tan pronto como la secuencia de comandos había traslada el escenario a cada punto, ajustar el foco con la mano y hecho una imagen EFTEM de hierro. En la figura 4se muestra un ejemplo de una imagen de hierro EFTEM de cerebro humano postmortem.
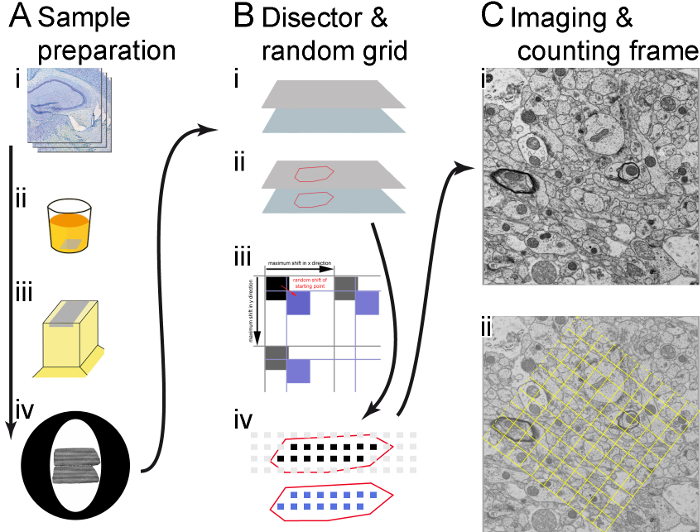
Figura 1. Ilustración del flujo de trabajo. (A) se muestran los pasos principales de la preparación de la muestra (en dirección de la flecha): vibratome secciones (i), embedding(ii), corte secciones semi-delgadas y ultrafina (iii) y captura de pares de secciones ultra delgadas sobre rejillas de cobre (iv). (B) el uso de software y software RPS por encargo del proveedor microscopio para crear coordenadas de área de toma de muestras que determinan los sitios de grabación. Los puntos de la esquina de las secciones se almacenan en el software de la microscopia y el ROI se describe (identificado con la ayuda de las secciones semi-delgadas) (i); una red de áreas de muestreo se genera sobre el retorno de la inversión, se introduce un cambio al azar (flecha roja) en x e y. El cambio es menor que la distancia entre las zonas de muestreo, (flechas negras), para que en vez de los cuadrados negros, que no hay cambio, los cuadrados azules, que se desplazan al azar, se utilizan para determinar los sitios de grabación (ii); sólo zonas de muestreo dentro de las fronteras de la ROI (dibujados como cuadrados negros y azules) se utilizan para la grabación. Las fotografías están hechas en la sección de referencia (cuadrados negros) y en los lugares correspondientes en la sección de búsqueda (cuadrados azules) (iii). (C) una micrografía se realiza en cada área de muestreo en una ampliación suficiente; se hace un montaje que consta de varias imágenes combinados si es necesario (en este caso, 2 x 2 imágenes combinaron juntos) (i); un marco de cuenta se genera y se muestra como una superposición de la imagen, se contará las estructuras dentro del marco y en las 'líneas de aceptación' (líneas discontinuas marco), pero no los de las 'líneas prohibidas' (líneas de marco sólido) (ii). Haga clic aquí para ver una versión más grande de esta figura.
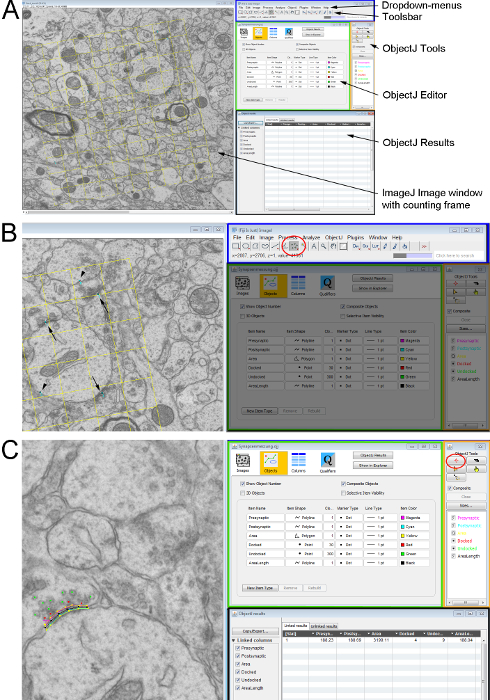
Figura 2 . Medición de parámetros ultraestructurales en un par de secciones ultra delgados con un marco de conteo imparcial. (A) Resumen de las ventanas de ImageJ utilizado para el conteo y análisis de las estructuras celulares. Lado izquierdo muestra la micrografía electrónica con el marco de la cuenta como una superposición. En el lado derecho: la interfaz de usuario de ImageJ (rectángulo azul) con el menú (arriba) y la barra de herramientas (abajo); el editor de objetos de ObjectJ (rectángulo verde); la ventana de Herramientas de ObjectJ (rectángulo naranja) donde se pueden seleccionar las herramientas para la medición y la ventana de resultados de ObjectJ (rectángulo negro) donde se documentan todas las mediciones. (B) detalle de mostrar las sinapsis marcadas en el micrográfo de electrón (sinapsis en ambas secciones - flechas; sinapsis sólo en la sección de búsqueda-puntas de flecha). Los marcados con la multipunto-herramienta (círculo rojo) desde la barra de herramientas en ImageJ. (C) los nombres y parámetros de medición de las funciones sinápticas se definen mediante las Herramientas de ObjectJ. Seleccionan la Herramienta de marcador y la característica de interés y el contorno dibujado en la imagen por clics de ratón de izquierda a lo largo de la estructura. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Selección de muestreo de áreas de mapeo elemental dentro de un retorno de la inversión energía filtrada microscopía electrónica de transmisión. SerialEM se utiliza para seleccionar una región de interés y sugieren un gran número de áreas de muestreo en un espaciado regular (Rosa Cruces en las imágenes A y B). Una secuencia de comandos a continuación al azar selecciona zonas de muestreo (a partir de estas coordenadas predefinidas) para la adquisición. Áreas de muestreo con mala iluminación son rechazadas para evitar barras de la rejilla y las paradas de escritura tan pronto como se han seleccionado 20 áreas de muestreo bien iluminada en el ROI. (A) Resumen de toda la zona de interés, delimitada por un polígono, con un alto número de áreas de muestreo posibles marcados con x. (B) detalle de A que muestra las áreas de muestreo antes de selección al azar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Ejemplo de adquisición elemental mapa (EFTEM). (A) micrografía TEM de campo brillante de área alrededor punto de adquisición. El área seleccionada al azar se utilizó para obtener un mapa elemental y se caracteriza por un rectángulo negro. (B) EFTEM borde la imagen de ventana en el área seleccionado al azar. (C) EFTEM borde posterior imagen de ventana en la misma zona. (D) mapa Elemental de hierro de la misma zona (M-edge). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El flujo de trabajo que presentamos permite al investigador obtener datos sobre las características ultraestructurales de una manera imparcial. Esto es mucho menos tiempo que las investigaciones volumen de secciones seriadas. Se utilizan varias aplicaciones diferentes para lograr este objetivo. Al principio, nuestro software RPS por encargo (para información sobre disponibilidad, póngase en contacto con el autor correspondiente) se utiliza para introducir un cambio de escenario aleatorio para seleccionar las coordenadas del área de muestreo. Esto permite un muestreo al azar uniforme sistemático del ROI. A continuación, para el conteo de estructuras específicas, adaptamos el método disector, donde se comparan 2 secciones consecutivas con distancia conocida, de una forma novedosa en comparación con anteriores estudios13,14,15 como nuestro software por encargo de RPS para sistemático muestreo aleatorio uniforme. Esto ahorra tiempo en comparación con los volúmenes todos reconstrucción 3D de secciones seriadas. El software a la medida de la RPS ha sido desarrollado específicamente para un tipo de microscopio que es un factor limitante para el flujo de trabajo de la reproducción. Una alternativa de este software específico sería una aplicación que permite secuencias de comandos y es compatible con otros modelos de microscopio.
Hemos utilizado con éxito este enfoque para nuestros estudios comparativos4,5. El ultra delgadas secciones de tejido neuronal, el área de interés fue esbozado e imágenes fueron tomadas por muestreo aleatorio uniforme sistemático dentro de esta área. Debe ser observado que el área de interés, la capa polimorfa del giro dentado, es un área más bien pequeña para investigar que podría ser beneficioso para nuestro enfoque. Dentro de un disector colocada al azar, se evaluó el número de DCV y varias características ultraestructurales de las sinapsis en la DGpl de ratones adultos en SE y EE como WT adultos ratones versus adultos ratones knockout NPY. Con nuestro enfoque, los datos obtenidos demostraron cambios en algunos de los parámetros investigados. Estos resultados confirman los de otros estudios similares en animales menores2.
Un inconveniente de la utilización experimental de este flujo de trabajo puede ser que este multi-uso-enfoque no es ideal en términos de facilidad de uso, los usuarios necesitan para sentirse cómodo con diferentes interfaces de usuario (en nuestro caso, la interfaz de usuario, sección serie TEM el software RPS y SerialEM). Aprender a manejar todas las aplicaciones de manera eficiente consume tiempo y debe tenerse en cuenta. Sin embargo, invertir tiempo en aprender a usar este flujo de trabajo sigue siendo claramente favorable sobre el tiempo necesario para analizar los volúmenes enteros con sección serie TEM. El método de usar un disector de sistemático muestreo aleatorio uniforme en el área de interés es suficiente para presentar datos fiables1 sin la necesidad de investigar una gran cantidad de secciones/volumen.
Para maximizar los resultados en nuestros estudios, es indispensable tomar buen cuidado durante la preparación de la muestra, como la preservación de los tejidos y las estructuras no sólo es crucial para la evaluación de características estructurales, sino también para identificar claramente el área de interés. Un factor fundamental y quizás otro inconveniente de este método, es que una alta calidad de los pares de secciones muy delgadas se requiere: no debe existir huecos ni arrugas que cubren el área de investigación en cualquiera de las secciones, y el espesor de la sección debe ser mantener homogéneo. El investigador tiene que estar bien entrenado en ultramicrotomía. Cuidado debe también ser cuando proyección de imagen las secciones en la TEM, como las secciones son sensibles a daño de viga del electrón y pueden desgarrar fácilmente. Además, es importante elegir el número adecuado de áreas de muestreo en el ROI. Dependiendo el objetivo experimental, el aumento de los micrográfos de electrón debe ajustarse cuidadosamente. Para nuestros experimentos específicamente, contando las sinapsis en el sistema nervioso central, 20 regiones de interés en una sección con la superficie de 30,25 μm2 son óptimas. Se aconseja capacitar al personal también en el reconocimiento de las características en cuestión (en nuestro caso sinapsis, sinápticas características y DCV) para obtener resultados fiables. Con el fin de identificar las sinapsis, las vesículas sinápticas deben ser identificables y esto requiere una resolución de al menos 10 nm. Para ello, un aumento de 5000 X era óptimo, pero debe tenerse en cuenta que la ampliación depende de parámetros del hardware tales como el tipo y la posición de las cámaras y tendría que ser adaptado para otros tipos de microscopio y cámara. También tiene que tenerse en cuenta que el protocolo utiliza aplicaciones específicas para un TEM y que los usuarios con otros modelos a tener en cuenta las diferencias en la configuración.
Creemos que nuestro flujo de trabajo puede ser adaptado para otras muchas aplicaciones no sólo en Neurociencias sino en un amplio campo de las ciencias biológicas y Ciencias de materiales (cuando es necesaria la alta resolución de un TEM) siempre que la pregunta de investigación exige una sistemática uniforme muestreo aleatorio y la cantidad de muestras a ser examinadas pide de una manera eficiente de tiempo de análisis. Por ejemplo, estamos actualmente interesados en localizar tiendas de hierro en el cerebro humano. Para ello, recientemente hemos adaptado nuestro flujo de trabajo, para permitir análisis elemental en ultra delgadas secciones de áreas seleccionadas al azar. Para reducir al mínimo el número de aplicaciones que son necesarias para el flujo de trabajo, se intentó aplicar usando el software SerialEM, porque puede ser programado para mover el escenario para establecer los puntos que pueden ser seleccionadas de manera aleatoria. Hemos creado scripts personalizados para controlar la temperatura, con el objetivo de automatizar el flujo de trabajo completamente. Esto resultó posible excepto el enfoque automático en modo imagen filtrado, que no dió resultados satisfactorios. Así utilizamos software de DM para enfocar y para la obtención de las imágenes filtradas de energía.
En Resumen, presentamos soluciones de software que ayudan en la obtención de micrografías electrónicas de una manera imparcial.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Financiado por el número de proyectos del fondo de Ciencias austríaca, FWF, P 29370 B27
Materiales
| Name | Company | Catalog Number | Comments |
| Pentobarbital | SigmaAldrich | P3761 | |
| Formaldehyde | Merck | 1040051000 | 1kg |
| Glutardialdehyde | Science Services | E 16210 | 25%; 100ml; EM grade |
| cacodylate buffer | Merck | C4945 | 250g; Dimethylarsinic acid sodium trihydrate |
| Thionine acetate/Ceristain | Merck | 861340 | |
| acetic acid | Merck | 1000631000 | 1 L |
| Sodium hydroxide | Merck | 1064951000 | 1 kg, pellets |
| osmium tetraoxide | Science Services | E 19110 | 10x1g |
| TAAB embedding resin | Science Services | TAT001 | 500g |
| DMP-30 | Science Services | TAD024 | 100g |
| DDSA | Science Services | TAD025 | 500g |
| Uranyl acetate dihydrate | Plano GmbH | 19481 | depleted, 25g |
| Ultrastain 2 | Leica | 16707235 | Lead citrate |
| Toluidine blue solution | Agar Scientific | AGR1727 | 10g |
| Pioloform | Plano GmbH | R1275 | 10g Powder |
| Proylenoxide | SigmaAldrich | 82320-1L | 1L |
| DPX embedding medium | Plano GmbH | R1320 | embedding medium for semi-thin sections on glass slide, 50 ml |
| Vibratome, Leica VT 1000 | Leica Microsystems, Vienna, Austria | ||
| Leica Ultracut UCT, ultramicrotom | Leica Microsystems, Wetzlar, Germany | ||
| Tecnai G2 20 | FEI,Eindhoven, Netherlands | ||
| Megaview wide angle camera | Olympus Soft Imaging Solution, Münster, Germany | ||
| US 1000 digital camera | Gatan, Pleasanton, USA | ||
| TEM Imaging Analysis Software | FEI,Eindhoven, Netherlands | ||
| FEI Serial Section Software | FEI,Eindhoven, Netherlands | ||
| Fiji, ImageJ 1.52e | National Institute of Health, USA | ||
| SPSS 20.0 | SPSS Inc., Chicago, IL, USA | ||
| SerialEM | Regents of the University of Colorado | ||
| RPS (random point sampling) software 0.9a | custom-made | ||
| Disector v1.0.2 (ImageJ macro) | custom-made | ||
| EFTEMSerialEM (SerialEM script) | custom-made |
Referencias
- Howard, V., Reed, M. . Unbiased Stereology: Three-Dimensional Measurement in Microscopy. , (1998).
- Nakamura, H., Kobayashi, S., Ohashi, Y., Ando, S. Age-changes of brain synapses and synaptic plasticity in response to an enriched environment. Journal of Neuroscience Research. 56 (3), 307-315 (1999).
- Landers, M. S., Knott, G. W., Lipp, H. P., Poletaeva, I., Welker, E. Synapse formation in adult barrel cortex following naturalistic environmental enrichment. Neuroscience. 199, 143-152 (2011).
- Reichmann, F., et al. A novel unbiased counting method for the quantification of synapses in the mouse brain. Journal of Neuroscience Methods. 240, 13-21 (2015).
- Reichmann, F., et al. Environmental enrichment induces behavioural disturbances in neuropeptide Y knockout mice. Scientific Report. 6, 28182 (2016).
- Mayhew, T. M. Taking Tissue Samples from the Placenta: An Illustration of Principles and Strategies. Placenta. 29, 1-14 (2008).
- Ferguson, S., Steyer, A. M., Mayhew, T. M., Schwab, Y., Lucocq, J. M. Quantifying Golgi structure using EM: combing volume-SEM and stereology for higher throughput. Histochemistry and Cell Biology. 147, 653-669 (2017).
- Sterio, D. C. The unbiased estimation of number and sizes of arbitrary particles using the disector. Journal of Microscopy. 134 (2), 127-136 (1984).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96 (10), 857-881 (1988).
- Franklin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Lewis, P. R., Knight, D. P. . Staining Methods for Sectioned Material. , (1988).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. J Struct Biol. 152 (1), 36-51 (2005).
- Rampon, C., Tang, Y. P., Goodhouse, J., Shimizu, E., Kyin, M., Tsien, J. Z. Enrichment induces structural changes and recovery from nonspatial memory deficits in CA1 NMDAR1-knockout mice. Nature Neuroscience. 3 (3), 238-244 (2000).
- Xu, X., Ye, L., Ruan, Q. Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats. Experimental Biology and Medicine. 234 (3), 296-305 (2009).
- Lonetti, G., et al. Early environmental enrichment moderates the behavioral and synaptic phenotype of MeCP2 null mice. Biological Psychiatry. 67 (7), 657-665 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados