Method Article
Un approccio imparziale di campionamento TEM sezioni in neuroscienze
In questo articolo
Riepilogo
Introduciamo un romanzo del flusso di lavoro per le indagini di microscopia elettronica del tessuto cerebrale. Il metodo consente all'utente di esaminare le caratteristiche di un neurone in modo imparziale. Per analisi elementare, presentiamo anche uno script che automatizza la maggior parte del flusso di lavoro per il campionamento randomizzato.
Abstract
Le indagini delle caratteristiche ultrastrutturali dei neuroni e le sinapsi sono possibili solo con microscopia elettronica. Soprattutto per gli studi comparativi dei cambiamenti nella densità e distribuzioni di tali caratteristiche, un protocollo di campionamento imparziale è fondamentale per ottenere risultati affidabili. Qui, presentiamo un flusso di lavoro per l'acquisizione di immagini di campioni del cervello. Il flusso di lavoro consente di sistematici di campionamento casuali uniformi all'interno di una regione definita del cervello, e le immagini possono essere analizzate usando un disector. Questa tecnica è molto più veloce di un esame approfondito delle sezioni di serie ma ancora presenta un approccio fattibile per stimare la densità e le distribuzioni delle caratteristiche ultrastruttura. Prima di incorporare, macchiato vibratome sezioni sono state usate come riferimento per identificare la regione del cervello sotto inchiesta, che ha contribuito a velocizzare la preparazione del campione globale di processo. Questo approccio è stato utilizzato per studi comparativi che studia l'effetto di un ambiente arricchito-alloggiamento su parecchi parametri ultrastrutturali nel cervello del topo. Basato sul riuscito uso del flusso di lavoro, abbiamo adattato ai fini dell'analisi elementare dei campioni del cervello. Abbiamo ottimizzato il protocollo in termini di tempo di interazione dell'utente. Automatizzare tutti i passaggi che richiede tempo di compilazione di uno script per il software open source SerialEM aiuta l'utente a concentrarsi sul lavoro principale di acquisire le mappe elementali. Come il flusso di lavoro originale, abbiamo prestato attenzione all'approccio imparziale campionamento per garantire risultati affidabili.
Introduzione
In microscopia elettronica, spesso risulta difficile a campione rappresentative regioni all'interno delle sezioni. Ci, come osservatore, sono spesso distorte a guardare la pagina di specifiche regioni disegnate alla nostra attenzione da cospicue caratteristiche del campione, impedendo un campionamento ben distribuito, imparziale. Bias di campionamento può essere evitato solo se ogni parte della regione di interesse ottiene la stessa probabilità di finire in un Micrografo elettronico1. È possibile evitare bias di campionamento senza una soluzione software, ad esempio, premendo la trackball del microscopio manualmente senza guardare l'immagine, in modo da selezionare le regioni di campionamento ovunque la fase si arresta. Ma non si tratta propriamente di una procedura casuale, perché, consciamente o inconsciamente, l'utente può avere un'influenza sul movimento del palco, e, inoltre, questo non è un modo sofisticato di selezionare le regioni di campionamento. Campionamento casuale diventa particolarmente importante se vengono utilizzate coppie di sezioni per valutare il numero di strutture in un certo volume, ad esempio, per stereology1, che richiede coppie di sezioni, una distanza nota apart. Sarebbe anche possibile guardare solo a una singola sezione e stimare il numero di strutture specifiche2, ma con questo approccio gli investigatori tendono a sovrastimare la densità numerica di strutture più grandi, a meno che le strutture sono molto piccole in confronto allo spessore della sezione. Approcci alternativi sono a ricostruire volumi di tessuto da sezioni di serie e quindi ottenere i dati desiderati3. Questo però richiede molto tempo e non un approccio fattibile per studi comparativi (più grandi).
Per superare questi problemi, abbiamo sviluppato un flusso di lavoro che consente al ricercatore di selezionare automaticamente i campioni per ottenere i micrografi elettronici a spaziatura regolare all'interno delle sezioni ultrasottili. La posizione dei micrografi elettronici è casuale, permettendo di campionamento imparziale. L'approccio è adatto sia per determinazione densità numerica di strutture (ad esempio, sinapsi all'interno di un certo neuropil volume4,5) e le dimensioni delle caratteristiche strutturali (ad esempio, la larghezza della fessura sinaptica, o il diametro delle densità postsinaptica4,5).
Il flusso di lavoro utilizza un punto casuale su misura (RPS) software (scritto in Java script utilizzando script software fornito con il nostro microscopio) che calcola automaticamente le posizioni in griglia all'interno di una zona predefinita di interesse in una sezione ultrasottile di campionamento. Il software RPS si muove la fase del microscopio elettronico questi punti predefiniti, affinché un Micrografo elettronico può essere fatta in ogni punto. In primo luogo, l'utente definisce un'area di interesse all'interno della sezione sottile. Successivamente, il software RPS calcola posizioni in griglia all'interno di questa regione. X / y coordinate della prima posizione vengono create in modo casuale, e le restanti posizioni sono collocate a intervalli regolari griglia rispetto alla prima posizione. Perché ogni parte della regione di interesse ha la stessa probabilità di essere esaminati, questo consente la raccolta minima dei dati. Questo approccio di campionamento viene anche chiamato sistematici di campionamento casuali uniformi (vedi riferimenti6,7 per maggiori dettagli).
Per determinare la densità numerica delle strutture, lavoriamo con coppie di sezioni che sono una distanza conosciuta. Dopo aver ottenuto un Micrografo elettronico della prima sezione in una delle posizioni predeterminate, TEM seriale sezione software (parte del pacchetto software fornito con il nostro microscopio elettronico) si muove il punto corrispondente nella seconda sezione, al fine di ottenere un Micrografo elettronico di posizione corrispondente. Questo si ripete per ogni posizione nella griglia predeterminata. Nel nostro approccio, un disector è usato per contare il numero di particelle in ogni coppia di micrografi elettronici8,9. Un disector è costituito da una coppia di conteggio frame, uno per ogni sezione8,9. La densità numerica degli oggetti è determinata contando solo gli oggetti visibili sulla prima sezione (o sezione di riferimento), ma non sulla seconda sezione (o sezione ricerca). Questo permette di valutare la densità numerica degli oggetti in un modo rapido ed efficiente8,9. Inoltre sulle singole sezioni, caratteristiche strutturali bidimensionale possono essere misurate.
Abbiamo applicato questo flusso di lavoro con successo per valutare le differenze nel numero di sinapsi nell'ippocampo di topi esposti ad ambiente arricchito (EE) rispetto al ambiente standard (SE) alloggiamento condizioni4,5, condizioni abitative e anche per valutare le differenze ultrastrutturali tra topi wild type (WT) e il neuropeptide Y (NPY) KO topi tenuti sotto SE ed EE5. Il nostro obiettivo era di guardare specificamente alle caratteristiche strutturali dei neuroni, come ad esempio la densità sinaptica numerica, le lunghezze della zona attiva in sezioni trasversali e di densità postsinaptica, la larghezza della fessura sinaptica e il numero di vescicole sinaptiche, al fine di valutare i cambiamenti nella connettività di un neurone e attivazione tra diverse condizioni sperimentali. Inoltre, eravamo interessati alla densità numerica delle vescicole denso-centro (DCV) nei neuroni per determinare la quantità di neuropeptidi stored in una certa area del cervello.
Sulla base del successo del nostro approccio per gli studi descritti sopra, nel nostro prossimo passo, abbiamo adattato il nostro flusso di lavoro per selezionare aree per imparziale analisi elementale all'interno di campioni di cervello umano. Questo è stato fatto a immagine di ferro, che viene memorizzato in molecole di ferritina in sia i neuroni e cellule gliali. Per questo, abbiamo compilato un script che ci ha permesso di automatizzare la maggior parte delle operazioni per un processo di selezione casuale delle sezioni di cervello in un'area definita.
Protocollo
Tutti gli esperimenti sono stati approvati da un comitato etico presso il Ministero federale della scienza e della ricerca della Repubblica d'Austria (BMWF-80.104/2-BrGT/2007 e BMWF-66.010/0037-II/3b/2013), o della Commissione di etica dell'Università medica di Graz, numero 28-549 ex 15/16 e condotte secondo la direttiva del Consiglio delle Comunità europee del 24 novembre 1986 (86/609/CEE) e della direttiva del Parlamento europeo e del Consiglio del 22 Settembre2010 (2010/63/UE). Esperimenti sugli animali sono stati progettati ed eseguiti in modo tale che il numero di animali utilizzati è stato ridotto al minimo.
1. la dissezione e la fissazione del tessuto
- Eutanasia di topi (21 settimane vecchio, femmina topi C57BL/6J e C57BL/6N topi; maschi topi WT e KO di NPY su un misto C57BL / 6:129 / SvJ (1:1) sfondo rispettivamente) iniettando pentobarbital 150 mg/kg per via intraperitoneale.
- Rimuovere il cervello dal cranio e immediatamente tagliarle a metà (che separa la sinistra dall'emisfero destro) - usando un bisturi.
- Posizionare immediatamente la metà in contenitori di vetro con 2% di formaldeide e glutaraldeide 2,5% in cacodilato 0.1 M tampone (CH3)2AsO2Na·3H2O, pH regolato a 7.4 con 1 M NaCl), pH 7,4 a 4 ° C.
Attenzione: I fissativi sono tossici e devono essere maneggiati con molta cura. Utilizzare solo con guanti protettivi e sotto la cappa. - Difficoltà la metà del cervello per 2 giorni a 4 ° C e risciacquo nello stesso tampone per almeno 24 ore, anche a 4 ° C. Il volume del buffer dovrebbe essere a circa dieci volte il volume di campione.
2. identificare l'area di interesse all'interno del cervello confrontando Vibratome sezioni con riferimento sezioni dal Mouse Brain Atlas10
- Posizionare il campione di cervello su un vibratomo. Assicurarsi che l'orientamento del cervello sia corretto (in questo caso, un orientamento della corona è stato scelto per l'ippocampo).
- Tagliare fino a quando viene raggiunta la regione di interesse (ROI) nel cervello. Tagliare le sezioni a un grande spessore (ad es., 100 µm) fino a quando la parte del cervello con la regione di interesse è raggiunto e buttare via ogni sezione.
- Iniziare a tagliare le sezioni del vibratome con 20 µm spessore all'inizio della parte del cervello con il ROI e posizionare le sezioni del vibratome su un vetrino. Macchia di loro (di Nissl) inserendo le sezioni in acetato di tionina 0.05% in tampone acetato di sodio, pH 4.2 per 1 min (Figura 1Ai).
- Confrontare le sezioni macchiate con l'Atlante del cervello del mouse utilizzando un microscopio a luce e continuare il taglio e colorazione finché non vengono raggiunte le coordinate di cervello desiderata.
3. ottenere un campione di regione per l'incorporamento
- Non appena viene identificata l'area a destra, è possibile iniziare una sezione di taglio a spessore di 150 µm con del vibratome.
- Microdissect questa sezione vibratome con una lama di rasoio sotto il microscopio stereo. Tagliare via le parti intorno il ROI. La sezione deve avere un formato adatto per le seguenti operazioni di preparazione per la microscopia elettronica a trasmissione (TEM) (non più grande di 1 x 1 mm2).
4. TEM preparazione - l'incorporamento, ultra-sottile taglio e colorazione
- L'incorporamento
- Post-fix per 2 h in tetrossido di osmio 2% a temperatura ambiente (TA). Utilizzare un volume per coprire il campione con almeno 10 volte il volume del campione, ma evitare l'uso di fissativo in eccesso per evitare inutili sprechi tossici.
Attenzione: il tetrossido di osmio è altamente tossico e deve essere maneggiato con molta cura. Utilizzare solo con guanti protettivi e sotto la cappa. - Disidratare utilizzando alcoli EM grado a passi di 20 min. uso un volume maggiore di quello nel passaggio precedente (50%, 70%, 80%, 96% e 100% etanolo).
- Posto in ossido di propilene per 40 min a RT. posto in una miscela di resina di ossido/incorporamento del propilene (1:2) per 2 ore a RT e pernottamento di 1:3 a 4 ° C.
Attenzione: L'ossido di propilene è altamente tossico e deve essere maneggiato con molta cura. Utilizzare solo con guanti protettivi e sotto la cappa. - Incorporare i campioni in resina 100% modificando la resina 2 volte dopo 60 min e una volta dopo 90 min (tutti a 45 ° C).
- Infine, posizionare i campioni negli stampi corretto e lasciare che la resina polimerizzare a 90 ° C per 3 giorni (Figura 1Aii).
- Post-fix per 2 h in tetrossido di osmio 2% a temperatura ambiente (TA). Utilizzare un volume per coprire il campione con almeno 10 volte il volume del campione, ma evitare l'uso di fissativo in eccesso per evitare inutili sprechi tossici.
- Rifilatura e sezionamento su un ultramicrotomo.
- Tagliare il blocco, garantendo che i lati sono più lisci possibile per le sezioni di aderire a vicenda (Figura 1Aiii).
- Prodotti 55 nm ultra-sottili sezioni di serie (dovrebbe essere argento grigio) utilizzando un ultramicrotomo. Utilizzare una griglia di slot (Larghezza cava 1 x 2 mm) rivestito con pioloform (Figura 1Aiv).
- Colorante di contrasto ultra-sottili sezioni sulle griglie di slot con acetato di uranile 2% per 30 min e citrato di piombo per 30 s a RT (questo è il metodo standard di microscopia elettronica11).
Attenzione: L'acetato di uranile è altamente tossico e deve essere evitato qualsiasi contatto diretto. Gestire solo con i guanti protettivi. Nitrato di piombo è tossico se ingerito o inalato e deve essere maneggiato con molta cura.
5. formazione immagine del corrispondente ROIs sul riferimento e sezioni di look-up su TEM con pacchetti Software
- Esaminare le sezioni sulla griglia di partenza con il TEM utilizzando un basso ingrandimento (a seconda delle dimensioni delle sezioni) per l'orientamento e per valutare la qualità delle sezioni.
- Avviare il software (un pacchetto di Software di analisi di immagine TEM o TIA, fornito con microscopio) per generare immagini virtuali delle sezioni memorizzando i punti d'angolo delle sezioni. Che consente al software di trovare le posizioni corrispondenti del ROI su ogni sezione.
- Vai alla sezione e scegliere Inserisci per aggiungere i punti d'angolo per la sezione di riferimento e look-up. Seguire le istruzioni della finestra popup. Iniziare con la sezione di riferimento e poi continuare con la sezione di ricerca. Assicurarsi che i bordi della sezione che sono paralleli alla sezione successiva come punti 1 e 2 (Figura 1Bi) siano state immesse.
- Visualizzare la sezione di riferimento sotto ingrandimento basso per identificare l'area di interesse e spostare il tavolino del microscopio usando TIA nella sezione di riferimento per più punti d'angolo del ROI per creare una struttura del ROI.
- Registrare le coordinate del poligono risultante utilizzando software RPS . Per farlo, premere Aggiungi Coordinate nella finestra di dialogo del software RPS in ogni punto del poligono che serve a delineare il ROI nella sezione (Figura 1Bii).
- Definire e immettere una dimensione adatta per le aree di campionamento e le distanze tra le zone in RPS software (nello studio presentato, la dimensione delle aree di campionamento è 7 µm e la distanza tra loro è 20 µm, con conseguente almeno 20 aree di campionamento all'interno del ROI). Stampa Raster calcolare, quindi il software genera coordinate dell'area di campionamento in modo casuale uniforme sistematico per le posizioni di microfotografia all'interno del poligono (Figura 1Biii).
Nota: Per un migliore orientamento, il poligono e le aree di campionamento all'interno del poligono possono essere visualizzate dal software RPS (Figura 1Biv).
- Memorizzare i punti di campionamento sulla sezione di riferimento e look-up utilizzando il software RPS e TEM seriale sezione software. Queste sono le coordinate dei montaggi che sono registrati in seguito11.
- Nel software RPS, premere Vai alla posizione successiva per spostare il tavolino del microscopio per x / y coordinate di ogni zona nella sezione di riferimento di campionamento. Andare alla posizione e inserire per importare queste coordinate nel software nella sezione di riferimento. Ripetere questa operazione per tutte le coordinate.
- Per specchiare le coordinate dalla sezione riferimento nella sezione ricerca, vai alla sezione e premere Vai alla sezione. Immettere il numero della sezione di look-up (solitamente ' 2') nella finestra di dialogo.
- Per la registrazione dei montaggi (Vedi punto successivo), passare alla sezione di riferimento e ricerca come descritto prima e cambiare la posizione sulla sezione di riferimento con la posizione e Vai al numero. Scegliere la coordinata successiva nella finestra di dialogo.
- Per i montaggi di SerialEM ogni campionamento a coordinare, andare su File e scegliere Nuovo Montage dal menu a discesa. Selezionare il giusto numero di piastrelle e la percentuale di sovrapposizione nella finestra di dialogo. Per il presente studio, un ingrandimento di 5000 X è sufficiente per riconoscere le funzioni sinaptiche sotto studio, ma il limitato campo visivo della telecamera CCD richiesto effettuare montaggi di immagini 2 x 2. I montaggi sono fatti con il SerialEM.
- Prima di registrare ogni montaggio, regolare nuovamente la messa a fuoco (o, se possibile, attivare l'opzione di messa a fuoco automatica del software di registrazione). Scegliere la cartella per salvare il file di montage e avviare la registrazione del montaggio premendo Start nel sottomenu montaggio a sinistra in SerialEM.
6. analizzare le immagini TEM con ImageJ per documento caratteristiche ultrastrutturali.
Nota: Per questo, è importante creare uno stack di immagine allineata dalla sezione riferimento e look-up.
- Convertire le coppie di immagini ImageJ quelle allo Stack in un file di stack e allineare le immagini con StackReg (deve essere installato da BIG-EPFL http://sites.imagej.net/BIG-EPFL/; nel caso di specie, l'algoritmo è stato Affine utilizzato). Per ottenere la densità numerica di cellulare caratteristiche strutturali, la macro su ordine di ImageJ Disector genera una cornice di conteggio con una dimensione di 5,5 x 5,5 µm disposte casualmente sopra l'immagine con un angolo casuale.
- Avviare la macro Disector (posizione nel menu ImageJ dipende dalla directory in cui si è salvato) e definire i parametri (dimensione del frame counting, numero di segmenti) come necessario (Figura 1Cii).
- Contare il numero di sinapsi/µm2 utilizzando il Disector. Contare ogni sinapsi all'interno del frame di conteggio che è visibile nella sezione di riferimento, ma non è visibile nella sezione ricerca. Omettere quelle sinapsi che si intersecano con i due 'vietato linee' di disector; ma contare sinapsi sull'opposto 'linee di accettazione'. Per questo, utilizzare lo Strumento Multipoint nella Toolsbar in ImageJ (Figura 2A, Figura 2B).
- Per la misura di parametri di sinapsi, è possibile selezionare solo le sinapsi con una fessura sinaptica orientata in cross-section (la sezione di riferimento, entro gli stessi fotogrammi immagine utilizzati per il disector).
- Avviare il plugin ObjectJ in ImageJ dal menu a discesa (Figura 2A) tramite plugin | Analizzare. Aprire un nuovo progetto nella finestra di dialogo a discesa ObjectJ. Si aprirà una finestra che consente all'utente di strutture di contorno e mark con Strumento indicatore (Figura 2B, cerchio rosso). I parametri sinaptici utilizzati per gli esperimenti presentati qui sono descritti di seguito.
- Misurare la lunghezza della membrana presinaptica e densità postsinaptica lunghezza tracciando una linea lungo la struttura utilizzando il Marcatore strumento (Figura 2B, cerchio rosso).
- Ottenere il medio dell'ampiezza della fessura sinaptica disegnando un poligono che copre sia la membrana pre- e postsinaptica, con i lati paralleli e una linea segmentata midway, equidistante da entrambe le membrane.
- Per determinare il numero di vescicole ancorate, contare tutte le vescicole che hanno una distanza massima dalla membrana presinaptica del diametro di una vescicola o meno.
- Per determinare il numero delle vescicole non ancorate, contare le vescicole con una distanza massima di diametro di una vescicola da ancorate o altre vescicole non ancorate alla stessa sinapsi.
7. produzione sezioni semi-sottile per microscopia luce per documento caratteristiche macroscopiche (nella fattispecie il numero di cellulare) all'interno della ROI stessa scelto per l'indagine di TEM.
- Immediatamente dopo il taglio delle sezioni ultrasottili per TEM, tagliare due sezioni semi-sottile, 0,5 µm spessore e immediatamente adiacente a vicenda. Posto su un vetrino e macchia li utilizzando soluzione di blu di toluidina 0,5%. Posizionare un coprioggetto sulle sezioni (con DPX mezzo di montaggio, costituito da distyrene, un plastificante (Tricresilfosfato) e xilene). Queste due sezioni vengono utilizzate per contare i numeri di cellulare.
- Fotografare le sezioni semi-sottile a basso ingrandimento utilizzando un microscopio ottico.
Nota: Le strutture in esame devono essere identificabili nelle immagini. Nello studio presente, 20 ingrandimenti era utilizzato per identificare i corpi delle cellule. Se necessario, immagini multiple possono essere cucite insieme a una software di elaborazione di immagini. - Allineare le coppie di due sezioni consecutive semi-sottile con una software di elaborazione di immagini (ad es., ImageJ).
Nota: Le differenze di rotazione e le dimensioni (può verificarsi a causa di artefatti di compressione introdotte dal processo di sezionamento) dovrebbero essere regolate per una perfetta sovrapposizione delle due sezioni. - Segnano il confine del ROI sull'immagine di microscopia chiara. Il ROI deve corrispondere al ROI utilizzato per le immagini TEM. Per questo scopo, caricare le immagini in ImageJ e scegliere la selezione poligono da Toolsbar (Figura 2A).
- Genera una griglia su tutta l'immagine usando ImageJ aprendo Analyze | Strumenti | Griglia e impostare i parametri secondo le necessità.
- Calcolare l'area e il volume del poligono dal numero di punti della griglia all'interno dell'area di interesse e sezione spessore (Volume = NCS * unGS * hST ; NCS = contato Cross sezioni; UnGS = dimensione della griglia; hST = spessore della sezione).
- Contare il numero di nuclei dai corpi delle cellule neuronali all'interno il ROI se sono presenti solo su una sezione. Scegliere il Toolsbar Multipoint strumento in ImageJ e contrassegnare le celle. Dopo il conteggio le cellule su ogni sezione, calcolare il numero di cellule per volume (
 ; Cdensità = densità cellulare; Cconteggio = conteggio delle cellule).
; Cdensità = densità cellulare; Cconteggio = conteggio delle cellule). - Registrare tutte le misurazioni nella finestra Risultati di ObjectJ (Figura 2C). Esportare e salvare per un uso ulteriore.
8. utilizzo dello SerialEM Script per ottimizzare analisi elementare in campioni di cervello in combinazione con DigitalMicrograph (DM, fornito con filtro immagine).
- Ottimizzazione di Imaging filtro (GIF).
- Caricare il campione nel TEM e andare ad un foro nel campione per la sintonizzazione del GIF utilizzando il trackball o il joystick del microscopio.
- Passare all' Energia filtrata TEM (EFTEM) in DM software/o DM e selezionare la telecamera CCD in DM.
- Scegliere l'ingrandimento per l'analisi elementare (l'ingrandimento dipende dalla struttura/zona di interesse; nel caso di specie, l'ingrandimento è impostato da 76 k fino a 125 k). Impostare il tempo di esposizione a 0,001 s e iniziare a vista.
- Focalizzazione del fascio con attenzione fino a quando i bordi possono essere visti e centrare il fascio nell'immagine. Ridurre apertura C2 / l'obiettivo fino a quando i bordi dell'apertura sono visibili e centrare il fascio con la trackball per il fascio.
- Il raggio di sfocatura (intorno C2 46,2%, tempo di esposizione per la sintonizzazione dovrebbe essere intorno 0.05 s) e trovare il zero picco di perdita (ZLP) premendo il pulsante ZLP . Avviare la procedura di sintonizzazione premendo il pulsante completa sintonia .
- Ottenere punti casuali di acquisizione.
- Tornare alla modalità di imaging di TEM e selezionare la telecamera e controllare lo stato attivo all'ingrandimento 10 k (regolare dell'asse z e impostare defocus a zero).
- Selezionare LM 75 X ingrandimento e verificare se la fotocamera non è inserita (in caso contrario non può essere controllato dal software SerialEM).
- Avviare SerialEM e aprire un nuovo progetto.
- Aprire il navigatore. Controllare le impostazioni per la fotocamera in fotocamera & controlli Script (per visualizzare e registrare) e avviare vista (fotocamera viene inserita automaticamente).
- Per rendere un angolo mappa della sezione ultrasottile, scegliere Aggiungi punti nella finestra del navigatore.
- Impostare i punti d'angolo ai bordi di una sezione di ultra-sottile. Spostare il palco in un punto angolo tenendo premuto il tasto di mouse di destra. Quando viene raggiunto un angolo della sezione, aggiungere un punto angolo con clic del mouse, sinistra. Ripetere la procedura per aggiungere 3 ulteriori punti d'angolo. Assicurarsi che nella finestra del navigatore è contrassegnare la casella C per punti d'angolo per i punti memorizzati.
- Per iniziare il montaggio di angolo (preferibile all'ingrandimento LM 75), passare all'applicazione Navigatore nella SerialEM-barra dei menu e scegliere Montaging & griglie e Montaggio di angolo di installazione dal menu a discesa.
Nota: Il miglior raccordo impostazioni per i parametri di registrazione selezionate vengono visualizzato. Modificarle se necessario. Nel caso di specie, solo la percentuale di sovrapposizione è stata cambiata al 20%.
- Delineare la sezione/ROI sull'immagine montage. Scegliere Aggiungi poligono nella finestra del navigatore e delineare la sezione con più diritto-clic del mouse. Scegliere Aggiungi griglia di punti nel menu a discesa navigator e definire una distanza tra i punti (la distanza dipende dalla domanda sperimentale; ad es., 10 µm, Figura 3).
- Seguire i comandi script. Immettere il numero di punti della griglia, come mostrato nel navigatore e immettere il numero di punti di acquisizione (ad es., 20).
- Impostare la soglia di illuminazione in modo che lo script può evitare le sbarre. Segui i comandi script e spostare il palco manualmente per coprire il campo visivo di un quarto con una barra di griglia. Secondo il valore visualizzato, immettere un valore di illuminazione di soglia (dovrebbe essere superiore al valore visualizzato).
- Attendere fino a quando vengono selezionati i punti per l'acquisizione e la routine di cottura è terminata.
Nota: Questo richiede molto tempo e può essere solo pernottamento; lo script Invia il microscopio in standby dopo aver terminato la cottura routine; la routine di cottura è importante per stabilizzare le sezioni a fascio di elettroni.
- Energia filtrata analisi elementare TEM (EFTEM)
- Scegliere modalità di EFTEM in TIA/DM e selezionare la telecamera CCD in DM.
- Centro del fascio e seguire i comandi di script che si muovono la fase per ogni coordinata di campionamento.
Nota: All'utente verrà chiesto se la fase deve essere spostata alla coordinata successiva. - Allineare il zero picco di perdita (ZLP) e impostare C2 ~ 46,2%.
- Impostare l'energia a 60 eV (in questo caso, il valore è impostato per il rilevamento del Fe M-bordo), fenditura a 10 eV e tempo di esposizione a 0,4 s. Insert la fessura e impostato C2 ~ 43,9%.
- Avviare Vista e mettere a fuoco l'immagine.
- Impostare C2 al 46,2%, allineare ZLP e C2 al 43,9%.
- Acquisire mappa elementale con impostazioni specifiche Elementale.
Nota: Le impostazioni predefinite possono essere utilizzate nella finestra di dialogo acquisizione, ma si raccomanda di testare questi in anticipo, se possibile; esempio filtrata immagini sono mostrati in Figura 4. - Impostare C2 al 46,2% e acquisire mappa di spessore.
- Ripetere per tutti i punti di acquisizione determinato (punto 8.3.2-8.3.12).
- Seguire le istruzioni dello script e ottenere i micrografi elettronici singoli o montaggi dei punti di acquisizione. Scegliere l'ingrandimento in modo che tutte le (ultra-) informazioni strutturali sono visibile e/o identificabili.
- Salvare il file LOG, navigatore e finestra risultati e rimuovere la fessura.
- Chiudere la valvola, rimuovere l'esempio e arrestare il TEM.
Risultati
Qui, descriviamo un flusso di lavoro per selezionare le aree per TEM in maniera automatica e imparziale. L'utente seleziona l'area di interesse all'interno di una sezione ultra-sottile sotto il TEM e utilizza diverse soluzioni software per il flusso di lavoro compreso il nostro software RPS che calcola automaticamente le coordinate di 20 aree di campionamento all'interno dell'area di interesse. Quindi, la fase TEM viene spostata per ogni area di campionamento per la fotografia. Questo è possibile sia per l'analisi di singole sezioni e per analizzare coppie di sezioni, una distanza nota a parte, che permette di selezionare aree per l'imaging senza pregiudizi dell'investigatore.
Questo flusso di lavoro si è rivelato prezioso quando documentare le caratteristiche ultrastrutturali in mouse cervello sezioni4,5. In questi studi, lo strato di cellule polimorfo della circonvoluzione dentata (DGpl) è stato esaminato come un'area di interesse. Il nostro metodo si è rivelato adatto per l'esame della DG, perché una sezione coronale della DG dorsale (Bregma −1.3) si inserisce in una sezione ultrasottile e i contorni sono riconosciuti prontamente a basso ingrandimento. Se altre regioni del cervello erano per essere esaminato, sarebbe importante verificare le loro dimensioni e caratteristiche distintive prima di pianificare gli esperimenti.
L'applicazione del flusso di lavoro descritto qui ha mostrato che EE custodia aumenta la larghezza della fessura sinaptica significativamente in DGpl4, rispetto alle condizioni standard di alloggio. Inoltre, il numero delle vescicole nucleo denso è stato diminuito significativamente in animali stabulati in EE4, che indica i cambiamenti nella famiglia dei neuropeptidi. Quando topi WT e NPY erano tenuti in condizioni di EE, il numero di neuroni/µm³ alla DGpl aumentato mentre la densità di DCV è diminuito rispetto al SE-alloggiamento5. Al contrario, knockout NPY ha provocato un aumento significativo delle vescicole sinaptiche nel pool di riserva (vescicole sinaptiche non ancorate) indipendente di alloggiamento condizioni5. L'effetto dell'EE sulla larghezza della fessura sinaptica è stato invertito nel gruppo NPY KO conseguente una differenza significativa tra EE-ospitato WT e NPY KO topi5. Preso insieme a studi comportamentali di WT e NPY knockout animali detenuti sotto entrambi i tipi di condizioni di alloggio, questo indica un ruolo cruciale di NPY per gli effetti neurobiologici della EE5.
Per visualizzare il ferro immagazzinato nel cervello umano, uno script è stato compilato per SerialEM software di scegliere in modo casuale i punti di acquisizione all'interno di una sezione tutta ultrasottile, con lo scopo di ottenere un'energia filtrata Micrografo elettronico in ciascuno di questi punti . Dopo aver caricato la sezione nel microscopio elettronico, eseguito lo script la stabilizzazione della sezione (i. e., la routine 'esemplare-cucina') durante la notte. Lo script quindi selezionato in modo casuale un numero di punti predefiniti dall'utente da quelli contrassegnati con una grata nella Figura 3. Di produrre una microfotografia di prova e controllare i suoi livelli di grigio, lo script controllato se nei punti prescelti sono stati situati su una parte visibile della sezione, respingendo i punti che sbarcati sulle sbarre. La maggior parte del flusso di lavoro è stato gestito dallo script con un'interazione minima dell'utente. Tuttavia, non era possibile registrare automaticamente energia filtrata micrografie (con questa configurazione), come c'era troppa poca luce per la routine di autofocus di SerialEM. Pertanto, siamo passati al DM software appena lo script aveva spostato la fase in ogni punto, regolato il fuoco a mano e fatto un immagine EFTEM di ferro. Nella Figura 4è riportato un esempio di un'immagine di ferro EFTEM da post mortem del cervello umano.
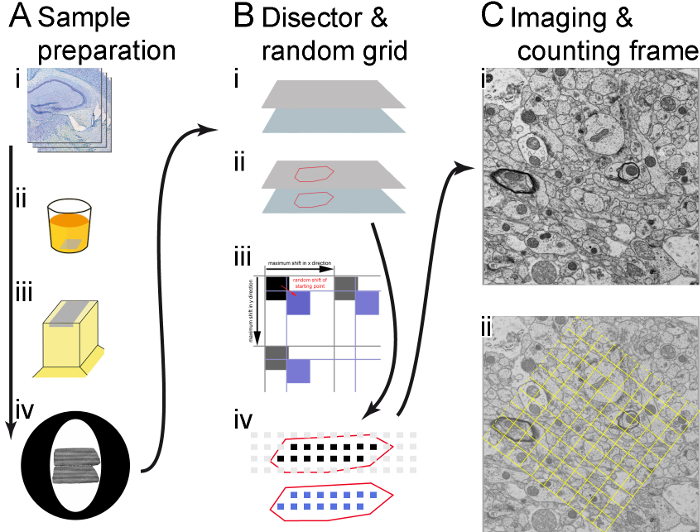
Figura 1. Illustrazione del flusso di lavoro. (A) le fasi principali della preparazione del campione sono mostrate (in direzione della freccia): sezioni del vibratome (i), embedding(ii), taglio di profili semi-sottile e ultra-sottile (iii) e coppie di sezioni ultrasottili su rame griglie (iv) la cattura. (B) l'utilizzo del software del fornitore microscopio e software su misura di RPS per creare le coordinate dell'area di campionamento che determinano i siti di registrazione. I punti d'angolo delle sezioni vengono memorizzati nel software microscopia e il ROI è delineato (identificato con l'aiuto delle sezioni semi-sottile) (i); una griglia di aree di campionamento viene generata sopra il ROI, uno spostamento casuale (freccia rossa) è stato introdotto in x e y. Lo spostamento è inferiore alla distanza tra le aree di campionamento, (frecce nere), in modo che anziché i quadrati neri, che non hanno nessuna svolta, i quadrati blu, che sono spostati casualmente, sono utilizzati per determinare i siti di registrazione (ii); solo aree di campionamento all'interno dei bordi del ROI (disegnata come un quadrato nero e blu) vengono utilizzate per la registrazione. Micrografie sono realizzati sia nella sezione di riferimento (quadrati neri) e nelle posizioni corrispondenti nella sezione ricerca (quadrati blu) (iii). (C) un Micrografo fatta presso ogni area di campionamento ad un ingrandimento sufficiente; un montaggio composto da diverse immagini unite fatta se necessario (in questo caso, 2 x 2 immagini sono state unite) (i); una cornice di conteggio è generata e mostrata come una sovrapposizione dell'immagine, strutture all'interno della cornice e sulle 'linee di accettazione' (cornice tratteggiata linee) verranno conteggiate, ma non quelli sulle 'linee' (linee solido telaio) (ii). Clicca qui per visualizzare una versione più grande di questa figura.
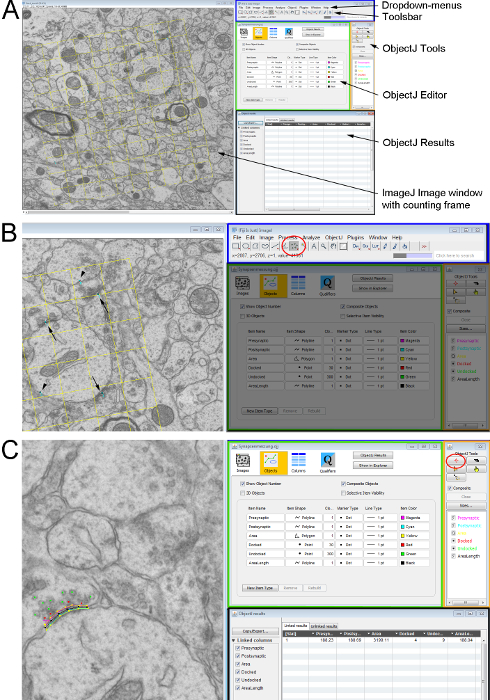
Figura 2 . Misurazione dei parametri ultrastrutturali su un paio di sezioni ultrasottili con un telaio di counting imparziale. (A) Panoramica delle finestre ImageJ utilizzato per il conteggio e l'analisi di strutture cellulari. Sul lato sinistro mostra il Micrografo elettronico con il telaio di conteggio come un overlay. Sul lato destro: l'interfaccia di utente di ImageJ (rettangolo blu) con il menu a discesa (in alto) e la barra degli strumenti (in basso); l' editor di oggetti ObjectJ (rettangolo verde); la finestra di Strumenti ObjectJ (rettangolo arancione) dove possono essere selezionati gli strumenti per la misurazione e la finestra di ObjectJ risultati (rettangolo nero) dove sono documentate tutte le misurazioni. (B) dettaglio da un mostrando le sinapsi contrassegnate sul Micrografo elettronico (sinapsi su entrambe le sezioni - frecce; sinapsi solo sulla ricerca sezione-punte di freccia). Quelli sono contrassegnati mediante lo strumento-Multipoint (cerchio rosso) dalla barra degli strumenti in ImageJ. (C) i nomi e i parametri di misurazione delle caratteristiche sinaptiche vengono definiti utilizzando gli Strumenti di ObjectJ. Il Marcatore-Tool e la funzione di interesse vengono selezionati e il contorno disegnato nell'immagine di sinistra-clic del mouse lungo la struttura. Clicca qui per visualizzare una versione più grande di questa figura.

Nella figura 3. Selezione aree per elemental mapping all'interno di un ROI per microscopia elettronica di trasmissione di energia filtrata di campionamento. SerialEM viene utilizzato per selezionare una regione di interesse e di suggerire un elevato numero di aree di campionamento ad una spaziatura regolare (rosa croci nelle immagini A e B). Uno script quindi seleziona casualmente aree di campionamento (da queste coordinate predefinite) per l'acquisizione. Aree di campionamento con scarsa illuminazione vengono rifiutati per evitare le sbarre e le fermate di script appena 20 aree di campionamento ben illuminati sono stati selezionati entro il ROI. (A) Panoramica di tutta l'area di interesse, delineato da un poligono, con un elevato numero di aree di campionamento possibile contrassegnato con x. (B) dettaglio di A che mostra le aree di campionamento prima selezione casuale. Clicca qui per visualizzare una versione più grande di questa figura.

Nella figura 4. Esempio di acquisizione di mappa Elementale (EFTEM). (A) Micrografo TEM campo luminoso della zona attorno al punto di acquisizione. Un'area selezionata in modo casuale utilizzata per ottenere una mappa Elementale ed è contrassegnata da un rettangolo nero. (B) EFTEM pre-bordo immagine finestra fatta nell'area selezionata in modo casuale. (C) EFTEM post-bordo immagine finestra fatta nella stessa zona. (D) mappa Elementale di ferro della stessa area (M-edge). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il flusso di lavoro qui presentato consente al ricercatore di ottenere dati sulle caratteristiche ultrastrutturali in modo imparziale. Questo è molto meno tempo rispetto a indagini di volume da sezioni di serie. Varie applicazioni vengono utilizzate per raggiungere questo obiettivo. In un primo momento, il nostro software su misura di RPS (per dettagli sulla disponibilità, contattare l'autore corrispondente) viene utilizzato per introdurre una fase casuale-MAIUSC per selezionare le coordinate dell'area di campionamento. Questo consente un campionamento casuale uniforme sistematico del ROI. Successivamente, per il conteggio delle strutture specifiche, abbiamo adattato il metodo di disector, dove vengono confrontati 2 sezioni consecutive con distanza nota, in modo inedito rispetto a precedenti studi13,14,15 , come abbiamo usato il nostro software su misura di RPS per campionamento casuale uniforme sistematico. Ciò consente di risparmiare tempo rispetto a 3D-ricostruire interi volumi da sezioni di serie. Il software su misura di RPS è progettato appositamente per un tipo di microscopio, che è un fattore limitante per la riproduzione del flusso di lavoro. Un'alternativa da questo software specifico sarebbe un'applicazione che permette la creazione di script ed è compatibile con altri modelli di microscopio.
Abbiamo utilizzato con successo questo approccio per i nostri studi comparativi4,5. Ultra-sottili sezioni di tessuto neuronale, l'area di interesse è stata delineata e immagini sono state scattate da sistematici di campionamento casuali uniformi all'interno dell'area. Deve essere notato che l'area di interesse, lo strato polimorfo della circonvoluzione dentata, è una zona piuttosto piccola per indagare che potrebbe essere utile per il nostro approccio. All'interno di un disector posizionati in modo casuale, abbiamo valutato il numero di DCV e diverse caratteristiche ultrastrutturali delle sinapsi in DGpl di topi adulti ospitato in SE ed EE nonché adulto WT topi contro adulti topi knockout NPY. Utilizzando il nostro approccio, i dati raccolti hanno mostrato i cambiamenti in alcuni dei parametri studiati. Questi risultati hanno confermato quelli di altri studi simili in animali giovani2.
Uno svantaggio dell'uso sperimentale di questo flusso di lavoro potrebbe essere che questo approccio multi-applicazione non è l'ideale in termini di facilità d'uso, come gli utenti hanno bisogno ottenere confortevole con diverse interfacce di utente (nel nostro caso, l'interfaccia utente, sezione seriale TEM il software RPS e SerialEM). Imparare a gestire tutte le applicazioni in modo efficiente richiede tempo e dovrebbero essere presi in considerazione. Tuttavia, investendo il tempo ad imparare a utilizzare questo flusso di lavoro è ancora chiaramente favorevole nel corso del tempo che è necessario analizzare interi volumi con sezione di serie TEM. Il metodo di usare un disector posizionato di campionamento casuale uniforme sistematico nella zona di interesse è sufficiente presentare dati affidabili1 senza la necessità di indagare una quantità elevata di sezioni/volume.
Per massimizzare il risultato nei nostri studi, era fondamentale prendersi cura durante la preparazione del campione, come la conservazione del tessuto e le strutture non è solo fondamentale per valutare le caratteristiche strutturali, ma anche per identificare la zona di interesse senza ambiguità. Un fattore fondamentale e forse un altro svantaggio di questo metodo, è che un'alta qualità delle coppie ultra-sottili sezioni è necessario: non ci deve essere nessun fori o rughe che coprono la zona sotto inchiesta in entrambe le parti, e lo spessore di sezione deve essere mantenuta omogenea. Il ricercatore deve essere ben addestrato in ultramicrotomia. Cura deve anche essere presa quando le sezioni in TEM, di imaging, come le sezioni sono sensibili ai danni del fascio di elettroni e possono lacerare facilmente. Inoltre, è importante scegliere il giusto numero di aree di campionamento nel ROI. A seconda l'obiettivo sperimentale, l'ingrandimento dei micrografi elettronici deve essere impostata accuratamente. Per i nostri esperimenti specificamente, contiamo le sinapsi nel sistema nervoso centrale, 20 aree di interesse su una sezione con l'area di 30.25 µm2 sono ottimali. Si consiglia di formare il personale anche nel riconoscere le caratteristiche in questione (nel nostro case sinapsi, funzionalità sinaptica e DCV) per ottenere risultati affidabili. Al fine di identificare le sinapsi, le vescicole sinaptiche devono essere identificabili e ciò richiede una risoluzione di almeno 10 nm. Per questo, un ingrandimento di 5000 X era ottimo, ma deve essere notato che l'ingrandimento dipende da parametri hardware quali il tipo e la posizione delle telecamere e avrebbe bisogno di essere adattato per altri tipi di microscopio e/o videocamera. Ha inoltre deve essere notato che il protocollo utilizza applicazioni specifiche per un TEM e che gli utenti con altri modelli dovranno considerare le differenze nell'impostazione.
Crediamo che il nostro flusso di lavoro può essere adattato per molte altre applicazioni non solo nell'ambito delle neuroscienze, ma in un ampio campo di scienza biologica e anche scienza dei materiali (quando è necessaria l'alta risoluzione di un TEM) ogni volta che la domanda di ricerca richiede una sistematica uniforme campionamento casuale e la quantità di campioni da esaminare chiede un modo efficiente di tempo di analisi. Ad esempio, siamo attualmente interessati nella localizzazione di depositi di ferro nel cervello umano. Per questo, recentemente abbiamo adattato il nostro flusso di lavoro, per consentire analisi elementare sulle sezioni ultrasottili in aree selezionate in modo casuale. Al fine di ridurre al minimo il numero di applicazioni che sono necessari per il flusso di lavoro, abbiamo mirato a applicare utilizzando il software di SerialEM solo, perché può essere programmato per spostare la fase di pre-impostare punti che possono essere selezionati in modo casuale. Abbiamo creato script personalizzati per controllare il TEM, con l'obiettivo di automatizzando il flusso di lavoro interamente. Ciò è risultato fattibile tranne che per la messa a fuoco automatica in modalità di imaging filtrata, che non ha dato risultati soddisfacenti. Abbiamo quindi utilizzato software di DM per messa a fuoco e per ottenere le immagini di energia-filtrata.
In sintesi, vi presentiamo soluzioni software che aiutano ad ottenere i micrografi elettronici in modo imparziale.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Finanziato per il numero di progetto fondo austriaco di scienza, FWF, P 29370 B27
Materiali
| Name | Company | Catalog Number | Comments |
| Pentobarbital | SigmaAldrich | P3761 | |
| Formaldehyde | Merck | 1040051000 | 1kg |
| Glutardialdehyde | Science Services | E 16210 | 25%; 100ml; EM grade |
| cacodylate buffer | Merck | C4945 | 250g; Dimethylarsinic acid sodium trihydrate |
| Thionine acetate/Ceristain | Merck | 861340 | |
| acetic acid | Merck | 1000631000 | 1 L |
| Sodium hydroxide | Merck | 1064951000 | 1 kg, pellets |
| osmium tetraoxide | Science Services | E 19110 | 10x1g |
| TAAB embedding resin | Science Services | TAT001 | 500g |
| DMP-30 | Science Services | TAD024 | 100g |
| DDSA | Science Services | TAD025 | 500g |
| Uranyl acetate dihydrate | Plano GmbH | 19481 | depleted, 25g |
| Ultrastain 2 | Leica | 16707235 | Lead citrate |
| Toluidine blue solution | Agar Scientific | AGR1727 | 10g |
| Pioloform | Plano GmbH | R1275 | 10g Powder |
| Proylenoxide | SigmaAldrich | 82320-1L | 1L |
| DPX embedding medium | Plano GmbH | R1320 | embedding medium for semi-thin sections on glass slide, 50 ml |
| Vibratome, Leica VT 1000 | Leica Microsystems, Vienna, Austria | ||
| Leica Ultracut UCT, ultramicrotom | Leica Microsystems, Wetzlar, Germany | ||
| Tecnai G2 20 | FEI,Eindhoven, Netherlands | ||
| Megaview wide angle camera | Olympus Soft Imaging Solution, Münster, Germany | ||
| US 1000 digital camera | Gatan, Pleasanton, USA | ||
| TEM Imaging Analysis Software | FEI,Eindhoven, Netherlands | ||
| FEI Serial Section Software | FEI,Eindhoven, Netherlands | ||
| Fiji, ImageJ 1.52e | National Institute of Health, USA | ||
| SPSS 20.0 | SPSS Inc., Chicago, IL, USA | ||
| SerialEM | Regents of the University of Colorado | ||
| RPS (random point sampling) software 0.9a | custom-made | ||
| Disector v1.0.2 (ImageJ macro) | custom-made | ||
| EFTEMSerialEM (SerialEM script) | custom-made |
Riferimenti
- Howard, V., Reed, M. . Unbiased Stereology: Three-Dimensional Measurement in Microscopy. , (1998).
- Nakamura, H., Kobayashi, S., Ohashi, Y., Ando, S. Age-changes of brain synapses and synaptic plasticity in response to an enriched environment. Journal of Neuroscience Research. 56 (3), 307-315 (1999).
- Landers, M. S., Knott, G. W., Lipp, H. P., Poletaeva, I., Welker, E. Synapse formation in adult barrel cortex following naturalistic environmental enrichment. Neuroscience. 199, 143-152 (2011).
- Reichmann, F., et al. A novel unbiased counting method for the quantification of synapses in the mouse brain. Journal of Neuroscience Methods. 240, 13-21 (2015).
- Reichmann, F., et al. Environmental enrichment induces behavioural disturbances in neuropeptide Y knockout mice. Scientific Report. 6, 28182 (2016).
- Mayhew, T. M. Taking Tissue Samples from the Placenta: An Illustration of Principles and Strategies. Placenta. 29, 1-14 (2008).
- Ferguson, S., Steyer, A. M., Mayhew, T. M., Schwab, Y., Lucocq, J. M. Quantifying Golgi structure using EM: combing volume-SEM and stereology for higher throughput. Histochemistry and Cell Biology. 147, 653-669 (2017).
- Sterio, D. C. The unbiased estimation of number and sizes of arbitrary particles using the disector. Journal of Microscopy. 134 (2), 127-136 (1984).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96 (10), 857-881 (1988).
- Franklin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Lewis, P. R., Knight, D. P. . Staining Methods for Sectioned Material. , (1988).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. J Struct Biol. 152 (1), 36-51 (2005).
- Rampon, C., Tang, Y. P., Goodhouse, J., Shimizu, E., Kyin, M., Tsien, J. Z. Enrichment induces structural changes and recovery from nonspatial memory deficits in CA1 NMDAR1-knockout mice. Nature Neuroscience. 3 (3), 238-244 (2000).
- Xu, X., Ye, L., Ruan, Q. Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats. Experimental Biology and Medicine. 234 (3), 296-305 (2009).
- Lonetti, G., et al. Early environmental enrichment moderates the behavioral and synaptic phenotype of MeCP2 null mice. Biological Psychiatry. 67 (7), 657-665 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon