Method Article
新生儿小鼠益生菌的研究
* 这些作者具有相同的贡献
摘要
本研究详细介绍了将精确数量的益生菌灌胃给新生小鼠的过程。实验设置进行了优化, 包括但不限于益生菌给药、给药方法和肠道细菌的量化。
摘要
成年小鼠模型已被广泛用于了解人类疾病进展的机制。在成年小鼠模型中所做的研究对新生儿疾病的适用性有限。为了更好地了解疾病进展、宿主反应和新生儿干预措施的长期影响, 新生儿小鼠模型可能更适合。新生儿小鼠模型的稀疏使用在一定程度上可归因于与这些小动物合作的技术困难。建立了一种新生小鼠模型, 以确定益生给药在早期生活中的作用, 并具体评估在新生的小鼠肠道中建立定植的能力。具体而言, 为了评估新生小鼠的益生菌定植, 植物乳杆菌(lp) 被直接输送到新生小鼠胃肠道。为此, lp 通过食管内 (ie) 灌胃喂养给小鼠。开发了一种高度可重复的方法, 以规范 ie 灌胃的过程, 从而准确地管理益生菌剂量, 同时最大限度地减少创伤, 鉴于新生小鼠的脆弱性, 这是一个特别重要的方面。这一过程的局限性包括食管刺激或损伤和吸入的可能性, 如果灌胃不正确。这种方法代表了对目前做法的改进, 因为 ie 入远端食道减少了吸气的机会。灌胃后, 利用 lp 特异性引物提取的肠道 dna 的定量聚合酶链反应 (qpcr), 追踪益生菌的定植特征。不同的垃圾环境和网箱管理技术被用来评估殖民蔓延的可能性。该协议详细介绍了 ie 新生儿小鼠灌胃的复杂性和随后的 lp 定植定量。
引言
在婴儿中, 早期益生菌接触与免疫调节效应有关, 导致坏死性小肠结肠炎、特应性皮炎和败血症 1, 2,3、4 个,5. 然而, 鉴于新生儿试验 (即顺序抽血和活检) 中取样的局限性, 这种免疫调节反应背后的机制难以探讨。新生儿小鼠模型可以帮助研究与益生菌使用和肠道微生物群变化有关的新生儿免疫调节的作用机制。不幸的是, 大多数小鼠模型的益生菌主要集中在成年小鼠;然而, 益生菌的影响可能是生命早期最高的, 这表明针对这个年龄段的模型将是有用的 3,6.此外, 新生儿小鼠模型更适合于研究用于人类婴儿早期生命的疾病和干预措施, 因为它们有望更密切地模仿发育中的免疫和微生物系统7,8 ,9,10。目的是研究新生小鼠益生菌定植的程度和模式, 重点是宿主与其微生物群之间的机械相互作用。文献中没有找到对新生儿模型的正确描述, 因此需要开发稳健和标准化的方法。
既定的向新生小鼠口服各种化合物的方法包括通过牛奶将所需化合物的母体转移, 方法是治疗怀孕大坝的水源 11或使用喂养针, 以促进对新生小鼠的使用。所需的化合物进入口咽12。这些方法是有用的实验, 没有精确的剂量要求, 并在那里治疗很容易被接收的小鼠。益生菌通常与益生菌等益生菌前生物 (如半乳糖和果糖) 一起使用, 作为益生菌的营养来源;这些添加剂化合物使溶液粘稠, 通过上述方法难以管理。从出生第一天 (dol) 开始, 就有必要设计一种方法, 对新生小鼠使用精确数量的益生菌和益生菌。在开发灌胃技术的过程中, 殖民传播的可能性 (如在治疗和对照武器13、14、15、16之间的其他益生菌研究中观察到的)对不同灌胃时间的幼崽肠道中的植物乳杆菌 (lp) 进行了试验研究, 并对其相对丰度进行了评估。实验中使用的益生菌制剂包括 109个lp 灌胃 (atcc-202195 株) 的菌落形成单元 (cfu), 与 fos (益生菌前) 和麦芽糊精 (辅料) 混合, 如最近的人类试验3所述。益生菌的交付是使用 ie 灌胃完成的, 这个过程在下面的协议中有详细说明。利用 lp 特异性引物对从全肠中提取的 dna 进行实时扩增, 评估了益生菌的定植剖面。
研究方案
所有程序都是根据不列颠哥伦比亚大学动物护理设施支助人员制定的准则进行的, 所有程序都得到了 ubc 动物护理委员会的批准。
1. 给药益生菌的定量
注: 建议采取此步骤来确定可在单剂量下给药的益生菌 cfu 的确切数量。益生菌和载体 (fos 和麦芽糊精) 的数量决定了溶液的饱和条件。根据经验, 在 dol 2 上, 液体的施用量不超过 30μl (~ 20 毫升/公斤), 因为任何较大的体积都会增加吸入的风险。
- 准备 6个 1.5 ml 微型离心管, 用于系列稀释, 每个管中含有180μl 的无菌5% 葡萄糖盐水。
- 称量一个0.2 克的益生菌前生物混合物, 并以无菌的方式将其溶解在1毫升的5% 葡萄糖盐水中。
- 涡流 30秒, 移液器打破团块。重复此操作, 直到没有观察到可见的团块。
注: 麦芽糊精使溶液粘稠, 并有助于溶液饱和。 - 使用步骤1.1 中准备的管道进行串行稀释。漩涡混合。
- 将每稀释40μl 的板材放入 mrs 琼脂板的标记象限上。板材每块稀释一式两份。
- 在厌氧 (或微氧) 条件下, 在37°c 条件下, 用气囊在真空罐中48小时进行孵化。
- 在每个象限20-70 个菌落的范围内计算每个板块。平均板计数与相同的稀释和计算回所需的单位。
2. 灌胃益生菌和益生菌的制备
注: 益生菌和益生菌前的适当溶解是必要的, 以确保液体顺利注射通过进料针在灌胃。
- 将所需数量的冻干益生菌与所需数量的益生菌和车辆混合在无菌微离心管中。
- 加入适量的溶剂 (5% 葡萄糖盐水) 溶解益生菌益生菌前混合物。
注: 溶解能力受到所使用的生物前期和车辆的限制。根据经验, 该组合 (与 fos 和麦芽糊精) 达到饱和约 0.3 g/ml, 而溶解在一个2毫升微离心管使用1毫升的溶剂。 - 漩涡混合, 直到所有固体溶解。使用移液器通过上下移液来分解溶剂中固体颗粒的球体。
- 在37°c 的水浴中沐浴溶液20分钟。
注: 如果益生菌益生菌前液是由活培养物创建的, 则可以跳过此步骤。 - 在灌胃之前, 在 mrs 琼脂板上进行5个系列的10倍稀释, 以准确量化给小狗的益生菌。如果不需要准确的 cfu 计数, 则可以跳过此步骤。
3. 生物安全内阁的筹备工作
- 使用益生菌时使用生物安全柜, 以保持无菌技术。将笼子与水坝和幼崽放在加热毯上 (设置为大约 38°c) 的一半上。在加热毯的另一半放置一个干净的、空的动物笼子。
- 在加热毯上放置消毒或无菌的吸水垫, 以便在灌胃时倾向于鼠标。
- 收集筑巢材料的幼崽从现有的, 阻尼创建的巢顶部, 并创建一个新的锥形筑巢杯使用戴手套的手, 消毒使用70% 的乙醇和干燥。把这个新巢放在干净的空荡荡的笼子里。这有利于将鸟巢的气味转移到戴手套的手, 从而最大限度地减少在小狗身上引入其他气味, 同时处理他们的程序, 减少切去的风险。
- 把小狗移到抱着笼子的圆锥形窝里, 把用大坝从柜子里取下笼子。这就通过防止大坝在手术过程中听到幼崽的声音, 减少了大坝的压力。
注: 如果益生菌是已知的小鼠肠道殖民者, 治疗条件必须由笼子甚至不同的生物安全柜分开, 以避免交叉定植的可能性。
4. 新生小鼠食管内灌胃
- 打开注射器包装, 以便于访问。以无菌的方式打开针头的包装, 并将其连接到注射器的头部。手术前用70% 的乙醇和高压灭菌器清洗针头。使用不同的针头进行处理和控制组, 以避免污染。
- 在注射器中加入比所需数量的益生菌染料溶液多一点的量。将注射器朝上。然后进一步拉下, 用手指轻拍, 以去除气泡, 并推动柱塞排出气泡和额外的液体体积, 直到达到所需的体积。这可确保针头中没有空气空间。对于 dol 2 小鼠, 灌胃体积不得超过30μl。
- 将小狗放在加热垫顶部的无菌吸收垫上。使用进料针 (24 量规, 1 "针长度, 1.25 毫米球直径), 通过将针头的球放置在小管过程 (胸骨的底部) 下方来测量食道的长度。将针头标记在鼻子的水平上, 以注意插入针头的限制 (图 1)。观察小狗的健康迹象, 包括正常呼吸和皮肤的粉红色着色。
- 将针头的尖端浸入浸渍溶剂 (5% 葡萄糖盐水或-用于溶解益生菌和益生菌前的介质), 以润滑喂养针的外部表面。这有利于针头顺利进入小鼠的食道。
- 通过擦洗或轻轻地握住拇指和食指之间的头部和身体, 提起小狗。确保头部、颈部和身体保持在一个直线的位置。不要把小狗抱在灌木丛上超过 60秒, 因为气管有可能堵塞, 导致窒息。确保小狗能呼吸。过于用力的迹象可能包括无法呼吸、明显的喘息和舌头伸出嘴。在整个过程中监控小狗的颜色和呼吸。
- 将针头的灯泡以45°角插入小狗口的中心, 直到它到达喉咙的后部。
- 轻轻改变针的角度, 通过旋转在针的灯泡上, 并将注射器从灌胃的人 (对小狗的背侧) 移开, 直到它与小狗的脊椎平面平行。擦洗小狗有助于保持针在喉咙后部的位置, 也防止老鼠蠕动。在角度变化过程中, 确保针头不前进或对喉咙后部施加任何压力。
- 如果鼠标试图吞下针头, 让它自然向下滑动, 并在针头上的标记与鼻子对齐时停止运动。注射器和针头通常足够重, 可以在重力的作用下滑落。在任何时候都要支持针头的重量, 这样针头就可以很容易地滑下食道, 而不会受到进行灌胃的人的向下压力。
- 如果针头在喉咙后部遇到阻力, 请稍微取出卡住针, 将针头取出, 然后将嘴内的针头慢慢向鼠标左侧 (处理者的右侧) 倾斜, 以小的1毫米增量缓慢。针头应该开始很容易地从食道上滑落。
- 如果针头在打孔到达口腔之前停止, 请不要注射溶液。
- 不要将针头插入超过20秒。如果发生这种情况, 请在将注射器与躯干保持平行的同时缓慢地缩回针头, 让小狗在纸巾上停留30秒至 1分钟, 在用溶剂润滑针头的外表面后, 再尝试灌胃。
注: 麻醉不用于手术, 因为老鼠的反应是必要的, 以衡量成功的灌胃。
- 当送针上的标记在鼻子上方并与鼻子尖端对齐时, 不要让针头移动或进一步前进。慢慢注入所需的液体体积。如果液体被吸气或观察到通过鼻子起泡, 立即停止注射, 慢慢地收回针头。
- 将小狗直立放在加热垫上的纸巾上, 以帮助其恢复。密切监测持续的呼吸问题或幼崽颜色的变化, 这表明了渴望。安乐死的幼崽, 立即吸气。
- 灌胃完成后, 轻轻取出以相同角度插入的进料针。将小狗放在纸巾上加热垫上。等待 10秒, 让小狗恢复正常活动和呼吸模式。一个健康的粉红色的色调应该出现在小狗的身体, 染料应该只在胃隔间可见。把它和其他的小狗一起搬回笼子里
注: 蓝色食品着色是一个很好的方式来练习上面概述的程序。如果灌胃成功, 老鼠的胃将被视为蓝色色调。如果在小狗的胃 (颈部、胸部或腋窝区域) 外发现蓝色染料, 则应人道地对动物进行安乐死 (按照动物护理规则), 因为这表明食道破裂或吸入。
5. 收集用于定植分析的意向样品
- 在随后的监测或灌胃过程中, 从幼崽身上收集粪便微生物群样本。
注: 小狗经常小便和排便时, 灌胃, 这一次可以作为一个机会, 收集粪便样本进行微生物群分析。 - 为了终止实验, 收集肠道从十二指肠到直肠后, 安乐死的小狗。将小狗去皮到手术板上, 用70% 的乙醇对皮肤进行消毒。使用70% 乙醇灭菌的工具和250°c 的热珠灭菌方法, 将皮肤切割成四个象限, 而不会损坏腹膜层。
- 使用一组不同的无菌工具将腹膜切割成四个象限, 并以内脏暴露的方式将其从中心移开。
- 定位胃, 用夹子夹紧幽门括约肌下方和直肠末端。用钝器或钳子操作肠道的长度, 以流线型肠道, 并将其从结缔组织和肠系膜组织中解救出来。一旦整个肠子被释放出结缔组织, 在夹紧的末端被割伤。
- 用肠道的方向标记铝箔, 以安全的方式包裹, 并在-80°c 下冷冻。
注: dna 提取过程可以在这一点上进行, 而不冻结。蓝色染料也被认为通过肠道超过 24小时, 收集样本进行殖民分析是最好的, 当肠道收集至少24小时后最后的灌胃。信号可能会被通过灌胃混合物瞬时的不粘附细菌在该时间点之前放大。
6. 从肠道中提取 dna 进行定植分析
注: dna 提取是使用商业试剂盒完成的, 并优化了对肠道 dna 提取协议的修改。确保加热设备设置到所需的温度, 并适当准备需要更改或预热的解决方案。
- 准备酶裂解缓冲器 (elb) 如下: 用 20 mm Tris-Cl、2 mm edta 钠和 1.2% triton x-100 来制备溶液。将 ph 值调整为8.0。在使用 elb 之前, 将溶菌酶加入到 20 mg/ml 的最终浓度中。
- 在去除瓶盖的情况下, 在分析天平上预称重石榴石珠管。
注: 这样做是为了在所需重量超标的情况下, 更容易删除肠道内容物。 - 使用无菌一次性手术刀将肠道切割成小块, 并将所需的部分铲入预先称重的石榴石珠管中。
注: 请确保在每个样本之间更换头皮, 因为 dna 无处不在, 并可能影响 pcr 结果。 - 在每个管中加入1毫升的 elb (从步骤 6.1) 到每个管中, 放置在涡旋的蜂打手上, 并在最大设置 (14) 下运行5分钟。
- 一旦组织被破坏, 将管道转移到37°C 的水浴中, 孵育 3 0分钟。
注: 这一步骤是为了激活溶菌酶, 并诱导革兰氏阳性菌细胞壁肽多糖的分解。 - 为每个样品准备具有20μl 蛋白酶 k 的管, 浓度为每毫升 600 mau。
- 以 400 x g离心管10分钟。裂解物看起来应该是清晰的, 珠子上有一些组织残留。
- 将180μl 的上清液 (上相) 转移到含有蛋白酶 k 的试管中, 然后在管中加入200μl 的 al 缓冲液。漩涡为15秒混合。
- 在56°c 的加热块上放置管道10分钟。
- 在试管中加入200μl 的100% 乙醇, 并通过涡旋混合15秒。
- 在自旋柱中加入约600μl 的裂解液 (从试剂盒)。
- 离心 1分钟, 8, 000 x g。丢弃流经。
- 重复步骤 6.12, 直到所有的裂解液都已通过列绘制完毕。
- 将列放入新的收集管中。在 8, 000 x g 的环境下添加500μl 的 aw1 缓冲液和离心机, 每次1分钟。
- 丢弃流经。在 8, 000 x g 处添加500μl 的 aw2 缓冲液和离心机, 时间为3分钟。
- 丢弃流经并在 8, 000 x g的空收集管中离心柱3分钟。
- 将色谱柱转移到 dna 洗脱管。将60μl 的 pcr 级超纯水直接添加到膜上, 在室温下孵育2分钟。
- 在37°c 时使用预热洗脱水进行洗脱。通过使用一半的最终洗脱量和重复6.15 两次步骤来提高产量, 可以完成两次洗脱。
- 以 8, 000 x克的速度离心 1分钟, 以提取 dna。
- 使用所需的定量方法测量洗脱的 dna 浓度。提取过程的产率在 10-40 ngμl dna 的范围内。
- 将洗脱的 dna 存放在-20°c。
7. qpcr 设置
- pcr 条件
- 打开机器并将表 1中的程序加载到实时 qpcr 机器中。
- 将表 1中的步骤3至5循环40循环, 并在反应结束时将样品保持在4°c。
- pcr 实验装置
- 使用表 2中的引物和温度。使用表 3中的浓度和反应条件。设置每个反应一式三份, 以控制程序的变化。
- 将 pcr 反应管板放入 qpcr 系统中, 并运行从步骤7.1 加载到系统中的程序。
- 在运行结束时取出管, 将其放置在 4°c, 并准备凝胶加载。
8. lp 殖民的量化
- 根据表 3为10μl 或20μl 反应准备 qpcr 混合物。
- lp 基因组 dna 标准曲线 10 7 至10 1 copiesμl
注: 由于每次稀释将镀布为 4μl, 因此起始库存中每μl 需要10份,每微米需要 2.5 x-6份。对曲线的其余部分使用相同的原则。- 准备 1: 4 稀释: 每μl在50μl 中每μl 10, 7份。
3.147 μl 的 lpdna + 46.85μl 的 dh2 o = 2.5 x 10 6 拷贝/ μl - 连续稀释 10倍: 将5μl 添加到 45μl dh 2 o, 为 1.25 x10 5 copiesμμμl。
- 每口井稀释板4μl。
- 准备 1: 4 稀释: 每μl在50μl 中每μl 10, 7份。
- lp 放大器的可视化
- 使用2% 琼脂糖凝胶, 以达到一个明确的分离 ~ 197 bp lp 扩增片段。
- 在凝胶中装入每个 pcr 产品的9μl。
- 在 120 v 处运行凝胶30分钟。
结果
这种方法的独特性在于它的灌胃技术适应了新生小鼠的大小和脆弱。上一节描述了在 dol 2 鼠标上成功进行灌胃过程的重要步骤。为了建立一个良好的量化量表, 使用具有三个技术复制的纯 lp dna 生成了一个标准曲线 (图 2)。标准曲线提供了利用引物检测 lp dna 的动态范围。动态范围在7至28个周期之间, 检测到 101至 107个 lp dna 副本的范围。标准曲线的稳定斜率代表了反应的效率和可扩展性。
ie 灌胃的程序已在成年小鼠中得到了相对简便的应用。然而, 新生小鼠的上消化道是脆弱的, 需要校准运动的灌胃针在过程中。反复的口角可能会增加由于处理而引起的食管内刺激、损伤、失败或排斥的机会。因此, 测试了两种不同的灌胃计划, 并利用全肠同质化的 dna 对肠道定植进行了定量。小鼠每天或每两天从 dol 2 到 dol 8 灌胃, 并每两天服用益生菌 (图 3)。每个样本都含有一个技术复制, 每个条件至少有两个生物复制。每天用7剂的幼崽有大约 103 个 lp拷贝, 而每两天用4次剂量灌胃的幼崽大约有 10, 5份.复制结果的一致性增加了技术精度的功劳。与每天被灌胃的幼崽相比, 每两天在被灌胃的幼崽肠道中检测到的 lp 更多。考虑到这一点, 随后的实验是用每隔一天的挖掘时间表进行的, 因为这也减轻了幼崽的压力。
与益生菌一起工作时, 避免垃圾内益生菌交叉污染是非常重要的。由于它们具有相同的母亲和筑巢环境, 预计它们的微生物群将是相似的。这证明了益生菌研究的一个问题, 如果处理和控制条件存在于与益生菌生物相同的垃圾中, 就有可能成为微生物群的一部分 ("殖民传播")。为了确定益生菌是否会污染和殖民未经处理的垃圾伙伴, 一半的垃圾被像上面一样灌满, 肠子被收集到 qpcr。对 dol 10只小鼠的肠道 qpcr 分析显示, 在灌胃小鼠体内, lp dna 的预期扩增, 但在较小程度上也显示在非灌胃小鼠中 (图 4)。同一 dol 小鼠在未处理的笼子里的肠道在大于32周的周期中没有表现出放大或最小的放大。这为在笼子里的垃圾中共同共享微生物群提供了证据。因此, 对于益生菌实验, 治疗组应该用网箱分离, 以通过交叉污染控制变异性。如果要在垃圾环境中进行实验, 可以考虑使用寄养水坝, 但应该评估和优化寄养大坝的减少和拒绝等混淆效果。当小鼠在 dol8 未被治疗6天之前, 并在 dol 14 对肠道 dna 进行分析时, 发现了大约 10个 lp 拷贝 (图 5)。因此, lp 的定植被发现是短暂的, 可探测的人口随着时间的推移而减少。
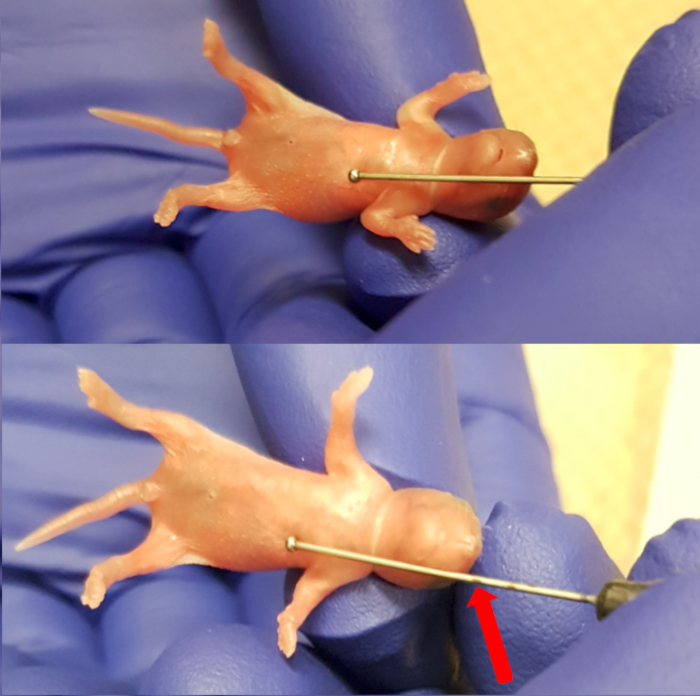
图 1.测量针状过程 (胸骨下端) 和鼻子之间的长度, 为针头做最大的插入标记.请点击这里查看此图的较大版本.
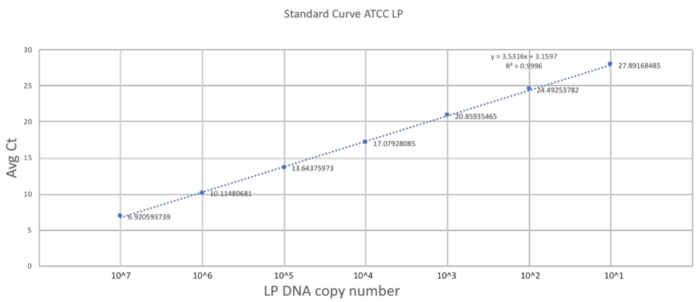
图 2.利用 lp 引物和 atcc lp dna 建立的标准曲线.对 atcc lp dna 进行了连续稀释, 建立了研究中使用的引物的动态检测范围。请点击这里查看此图的较大版本.
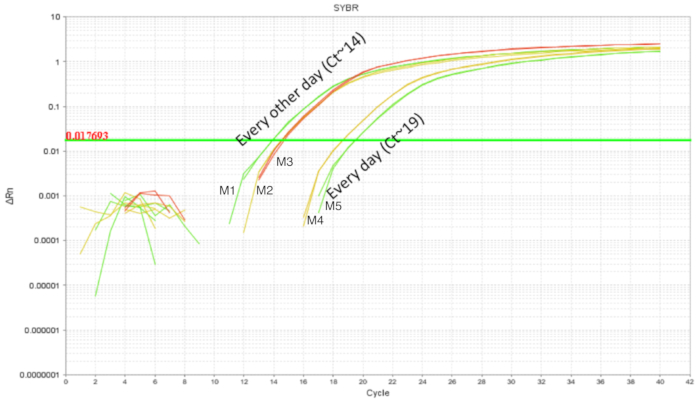
图 3.每日 (7 剂) 和每隔一天 (4 剂) 在 dol 2 和 dol 8 之间处理的 dol 10 幼崽肠道 dna 扩增.与每天的灌胃相比, 每隔一天的肠道 lp 显示出更高的水平。请点击这里查看此图的较大版本.
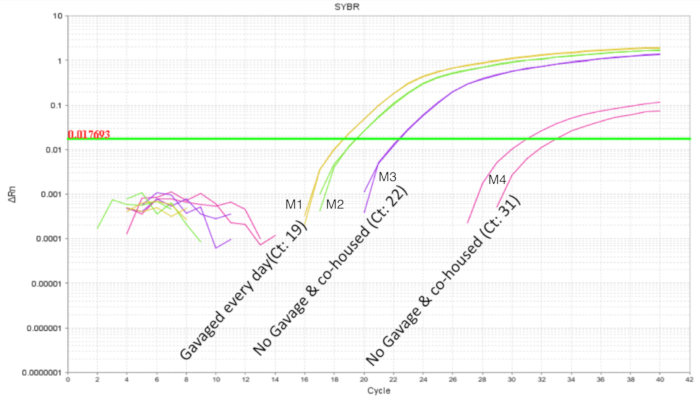
图 4.lp 扩增 dol 10 幼崽, 治疗2种, 未处理4头小狗2头。在每天预定的灌胃中, 灌胃在2和8分之间 (7 剂).这两只益生菌处理的小狗显示了预期的放大轮廓。未经处理的幼崽显示 lp 的可变放大, 表明在垃圾中共同分享益生菌。请点击这里查看此图的较大版本.
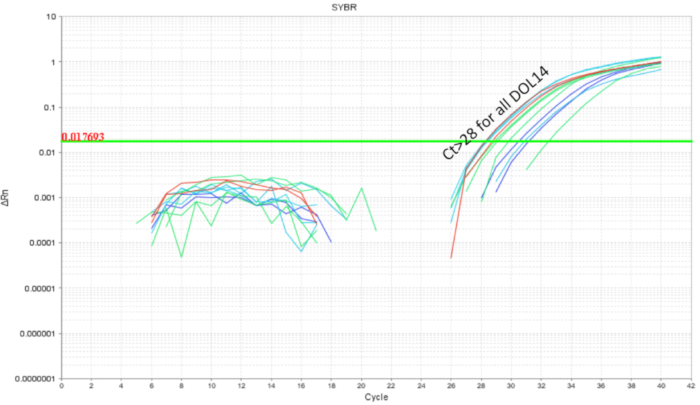
图 5.每日 (7 剂) 和每隔一天 (4 剂) 在 dol 2 和 dol 8 之间处理的 dol 14 幼崽肠道 dna 扩增.lp 负载低于周期 28, 表明 lp 在最后一次益生菌灌胃后的6天时间内的间隙。请点击这里查看此图的较大版本.
| 步 | 温度 | 时间 |
| 1 | 50°c | 2分钟 |
| 2 | 95°c | 3分钟 |
| 3个 | 95°c | 30秒 |
| 4个 | 58°c | 30秒 |
| 5 | 72°c | 30秒 |
表 1. qpcr 扩增条件.pcr 反应的温度和循环条件的数量。
| 目标 | 16s-23s 跨基因间隔区域 |
| 预期的片段大小 | 144 bp |
| 底漆 tm | 58°C |
| 正向底漆 (fp) | lp-1: tgg atc acc tcc ttt cta agg aat |
| 反向底漆 (rp) | lp-2: tgt tct cgg ttt cat tat gaa aaa ata |
表2。qpcr 反应成分的详细信息.在 pcr 反应中, 引物的细节、退火温度和预期的片段大小。
| 浓度 | 10μl 反应 | 20μl 反应 | |
| 模板 dna | 200 pg/μl | 1μl | 1μl |
| sybr master mix | - | 5μl | 10μl |
| Fp | 10μm | 0.3μl | 0.6μl |
| Rp | 10μm | 0.3μl | 0.6μl |
| dh2o | - | 3.4 微米 | 8.8 μl |
表3。按反应量和浓度计算.反应试剂的浓度和体积。
讨论
制定 ie 灌胃的程序, 以安全地给新生小鼠提供特定剂量的益生菌。少量的液体被送到上消化道使用喂养针, 以防止吸入, 同时确保在信心的剂量交付。收集小鼠的肠道进行定植分析, 在灌胃后2天和6天。对 dna 提取工艺进行了改进, 以确保益生菌革兰氏阳性生物的高产。对上一次灌胃后两天提取的 dna 进行 qpcr 分析, 表明每两天对坚持的小鼠 lp 的定植相对较高, 而在 dell 2-8 之间每天被灌胃的小鼠。在六天的时间里, lp 的数量也有所减少, 这表明这种益生菌是老鼠肠道中的一个短暂的生物。这些实验的结果为这一年龄组进行高度严谨的研究创造了条件。
为观察益生菌对新生小鼠的远期疗效, 在 dol 2 上对新生小鼠进行了应用;一个类似的开始时间点的人类试验。在文献中对新生小鼠的口咽部喂养进行了以前的描述, 并且是在 dol 5-812, 17 之后进行的, 当时由于吞咽力学的发展, 抽吸的风险较低。然而, 口咽喂养并不适合 dol 2 小鼠, 因为在试点研究中观察到较高的吸入率 (数据未显示)。益生菌和益生菌前溶液的黏性增加了吸入的风险。在 ie 灌胃程序后, 将 dol 2只小鼠的吸入风险降至最低, 同时将所需的体积直接传递到上消化道。该程序的成功首先是使用食品着色注入益生菌灌胃进行的。食物着色作为一个标记, 可以通过小狗的皮肤看到。在食物着色灌胃的小鼠中没有观察到任何负面影响, 建议在开始大规模实验之前, 以这种方式验证灌胃程序。快速解决后的喘息反射的灌胃也可以作为一个成功的灌胃的额外指标。一旦鼠标被放置在加热毯后, 喘息反射会消退, 呼吸频率会在 2 0秒内观察到增加。喘息反射持续超过30秒表示灌胃失败。成功的灌胃还取决于适当插入喂养针与灯泡坐在胃的心脏括约肌的开口上方。这可以通过确保针上的标记测量的长度之间的小管过程和鼻子的尖端, 不通过老鼠的鼻子在灌胃。这样可以最大限度地减少鼠标受伤的可能性。灌胃的频率会对实验结果产生重大影响。频繁的灌胃也会给幼崽和母牛造成更多的压力, 因为笼子和鸟巢不断受到干扰。最理想的灌胃计划是在灌胃频率最低且持续时间较短的情况下, 而不会在系统中失去预期效果。为了保证手术的安全性和无菌性, 灌针必须在使用之间进行清洗和高压灭菌。在高压灭菌前, 必须使用擦洗在外面严格清洗, 并在内部通过使用注射器强制通过针头, 因为在高压灭菌过程中, 任何剩余的颗粒都会在针头上结块, 并可能干扰灌胃过程。
与每天灌胃的幼崽相比, 每隔一天被灌胃的幼崽的 lp 定植率较高。这可能是由于每隔一天就会对被灌胃的幼崽造成压力, 并有可能通过这些幼崽摄入的相对较多的牛奶获得更多的营养。益生菌治疗的剂量依赖性在前几、19模型中已经研究过, 因此正确剂量的给药很重要。所制备的益生菌溶液在每次灌胃前都是电镀的, 以获得准确的 cfu 给药计数。如果益生菌是厌氧的, 重要的是要看看在培养有氧或无氧生物时, cfu 是否有差异。由于 lp 是一种兼性厌氧菌, 因此采用两种方法进行培养, 在 cfu 中没有差异。
利用 qpcr 和高质量的 dna 样本进行了灌胃后肠道 lp 负荷分析。为了最大限度地减少治疗和对照组之间的 lp dna 污染, 使用了不同的喂养针、生物安全柜和手术设备, 以确保最高质量的样品。准确测量肠道中的益生菌需要优化的 dna 提取方法。从大便中提取 dna 最有效的方法是多珠跳动步骤20,21,22。采用这种方法对肠细菌进行珠子殴打提取, 观察到 lp 在整个肠道 dna 提取中的表达减少 (lt;102个拷贝)。由于 lp 是细胞壁中含有大量肽多糖的革兰氏阳性生物, 因此使用溶菌酶23, 24 添加到酶裂解缓冲液中的肽多糖溶解步骤对该协议进行了优化。这增加了 lp 在同一肠道样本中的代表性超过两倍。溶菌酶处理可确保外层的溶解, 而珠子跳动的步骤有利于机体的裂解。优化组织数量、石榴石珠的类型和使用珠子破坏的持续时间是获得最佳 dna 产品进行 pcr 分析所必需的。
益生菌作为预防或治疗在早产儿和足月新生儿中的积极影响在最近的研究25、26、27、28 中得到证明。建立合适的益生菌新生儿小鼠模型是解开益生菌保护作用的保证。这里概述的这一协议为不熟悉使用益生菌的新生儿小鼠工作的研究人员提供了一个指南。尽管在研究人类健康和疾病的过程中存在啮齿类动物微生物群的问题, 但这种方法可以推广到研究, 重点是了解益生菌引起的微生物群的变化。该模型还为研究不同发育阶段的宿主-微生物相互作用和免疫反应提供了一个平台。
披露声明
没有利益冲突要披露。
致谢
感谢动物护理设施的工作人员和 ubc 兽医在不列颠哥伦比亚省儿童医院研究所对老鼠的工作进行培训和协助。感谢不列颠哥伦比亚大学和实验医学系为这项研究提供的资金。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
参考文献
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。