Method Article
Estudios de probióticos en ratones neonatales mediante sonda nasogástrica
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio detalla el proceso de cantidades precisas de gavaging de probióticos a los ratones neonatales. El montaje experimental se optimizó para incluir pero no se limita a probiótico, la dosis, métodos de administración y cuantificación de bacterias en los intestinos.
Resumen
Modelos de ratón adulto se han utilizado ampliamente para entender el mecanismo detrás de progresión de la enfermedad en los seres humanos. La aplicabilidad de los estudios realizados en modelos de ratón adulto a enfermedades neonatales es limitada. Para entender mejor la progresión de la enfermedad, las respuestas de los host y repercusiones a largo plazo de las intervenciones en recién nacidos, un modelo de ratón neonatal probable es un ajuste mejor. El escaso uso de modelos de ratón neonatal puede atribuirse en parte a las dificultades técnicas de trabajar con estos pequeños animales. Se desarrolló un modelo de ratón neonatal para determinar los efectos de la administración de probiótico en los primeros años de vida y evaluar específicamente la capacidad de establecer la colonización en el tracto intestinal del ratón recién nacido. En concreto, para evaluar la colonización del probiótico en el ratón neonatal, Lactobacillus plantarum (LP) fue entregado directamente en el aparato gastrointestinal del ratón neonatal. Con este fin, LP fue administrado a ratones por alimentación por gavage (IE) intra-del esófago. Se desarrolló un método altamente reproducible para estandarizar el proceso de alimentación forzada de IE que permite una administración exacta de dosis del probiótico minimizando el trauma, un aspecto particularmente importante dado la fragilidad de ratones recién nacidos. Limitaciones de este proceso incluyen posibilidades de daño o irritación del esófago y la aspiración si gavaged incorrectamente. Este enfoque representa una mejora en las prácticas actuales ya por sonda nasogástrica en la IE en el esófago distal reduce las posibilidades de aspiración. Siguiendo por sonda nasogástrica, se trazó el perfil de colonización de los probióticos usando la reacción en cadena de polimerasa cuantitativa (qPCR) del ADN extraído intestinal con iniciadores específicos de LP. Configuración de diferente camada y técnicas de gestión de la jaula fueron utilizadas para evaluar el potencial para la extensión de la colonización. El protocolo detalla los entresijos de la sonda nasogástrica de ratón neonatal de IE y cuantificación posterior colonización con LP.
Introducción
En niños, la exposición temprana de probióticos ha sido asociada con efectos inmunomoduladores a reducción en la incidencia de enfermedades como la enterocolitis necrotizante, dermatitis atópica y sepsis1,2,3, 4 , 5. sin embargo, el mecanismo detrás de esta respuesta inmunomoduladora es un reto explorar dada la limitación para la toma de muestras en recién nacidos humanos (es decir, sangre alternativamente atrae y biopsias). Modelos de ratón neonatal pueden ayudar a estudiar el mecanismo de acción involucrado en la regulación inmune neonatal asociada con el uso de probióticos y cambios en la microbiota intestinal. Desafortunadamente, la mayoría modelos de ratón para probióticos en gran parte se han centrado en ratones adultos; sin embargo, el impacto de los probióticos es probable ser más alto temprano en la vida, sugiriendo modelos específicos para este grupo de edad será útil3,6. Además, modelos de ratón neonatal son más apropiados para el estudio de las enfermedades y las intervenciones destinadas a aplicación en la vida temprana de los infantes como se espera que más de cerca imitar un desarrollo sistema inmunitario y microbiano7,8 ,9,10. El objetivo fue estudiar la magnitud y los patrones de colonización de probiótico de ratones neonatales con énfasis en la interacción mecanicista entre el host y su microbioma. Adecuadas descripciones de modelos recién nacidos no fueron encontradas en la literatura, y así se abordó la necesidad para el desarrollo del método robusto y estándar.
Métodos establecidos de la administración oral de diferentes compuestos a ratones recién nacidos incluyen a la transferencia de compuestos deseados a través de la leche por tratar la fuente de agua para presas embarazadas11 o utilizando una aguja de alimentación para facilitar la administración de compuestos deseados en la orofaringe12. Estos métodos son útiles para los experimentos que no tienen requisitos de dosificación exacta y donde el tratamiento es fácilmente ingerido por el ratón receptor. Los probióticos se administran a menudo en conjunción con un prebiótico como galactooligosaccharide y fructooligosaccharide (FOS) que sirven como fuente de nutrición para las bacterias probióticas; Estos compuestos aditivos hacen de la solución viscosa y difícil de administrar a través de las metodologías mencionadas. Idear un método para administrar cantidades precisas de los probióticos y prebióticos a ratones recién nacidos a partir tan pronto como el primer día de vida (DOL) era necesario. En el desarrollo de la técnica de sonda nasogástrica, la posibilidad de la extensión de la colonización (como se observa en otros estudios de probióticos entre el tratamiento y el control armas13,14,15,16) fue probado y se evaluó la abundancia relativa de colonizado Lactobacillus plantarum (LP) en los intestinos de los cachorros con horarios diferentes por sonda nasogástrica. La preparación de probióticos utilizada en los experimentos consistió en 109 unidades formadoras de colonias (UFC) por sonda nasogástrica de LP (cepa ATCC-202195), mezclado con FOS (prebiótico) y maltodextrina (excipiente) como se describe en el reciente ensayo humano3. El suministro de probióticos se realizó mediante sonda nasogástrica de la IE y el proceso se detalla en el protocolo a continuación. El perfil de colonización de los probióticos se evaluó utilizando en tiempo real la amplificación de ADN extraído de los intestinos todo usando las cartillas específicas LP.
Protocolo
Todos los procedimientos se llevaron a cabo referente a los lineamientos establecidos por el personal de apoyo en las instalaciones de cuidado Animal en la Universidad de British Columbia y todos los procedimientos fueron aprobados por el Comité de cuidado Animal de UBC.
1 cuantificación de probióticos administrados
Nota: Este paso se recomienda para determinar la cantidad exacta de probiótico CFU que se puede administrar en una dosis única. La cantidad de probióticos y vehículo (FOS y maltodextrina) determinar las condiciones de saturación de la solución. De la experiencia, no más de 30 μl (~ 20 mL por kg) del fluido puede ser administrada a ratones en DOL 2 como cualquier mayor volumen aumenta el riesgo de aspiración.
- Preparar seis tubos de microcentrífuga de 1,5 mL de diluciones en serie con cada tubo que contiene 180 μl de solución salina estéril de 5% de dextrosa.
- Pesar una alícuota de 0,2 g de una mezcla prebióticos probióticos y disuelva en 1 mL de solución salina dextrosa 5% en forma estéril.
- Vortex por 30 segundos y pipeta romper terrones. Repita hasta que no se observan grumos visibles.
Nota: Maltodextrina hace viscosa de la solución y contribuir a la saturación de la solución. - Realizar una dilución seriada usando los tubos preparados en el paso 1.1. Vortex para mezclar.
- Placa de 40 μl de cada dilución en un cuadrante con de la placa de agar MRS. La placa de cada dilución por duplicado.
- Incubar en anaerobiosis (o microaerofílicos) condiciones a 37 ° C durante 48 h en un tarro vacío usando un paquete de gas.
- Contar cada plato dentro de un rango de 20-70 colonias por cuadrante. Media placa cuenta con la misma dilución y calcular a las unidades deseadas.
2. preparación de probióticos y prebióticos para sonda nasogástrica
Nota: La correcta disolución de probiótico y prebiótico es necesaria para garantizar la inyección suave de líquido a través de la aguja de alimentación por sonda nasogástrica.
- Combinar la cantidad necesaria del organismo probiótico liofilizado con la cantidad deseada de prebióticos y el vehículo en un tubo de microcentrífuga estéril.
- Añadir cantidades apropiadas de solvente (solución salina dextrosa al 5%) para disolver la mezcla de probióticos prebióticos.
Nota: La capacidad de disolución está limitada por el prebiótico y vehículo utilizado. De la experiencia, la combinación de synbiotic (con FOS y maltodextrina) alcanzó saturación aproximadamente 0.3 g/ml mientras que disuelve en un tubo de microcentrífuga de 2 mL con 1 mL de disolvente. - Vortex para mezclar hasta que todos los sólidos se disuelvan. Utilice una pipeta para glóbulos de partículas en el solvente mediante pipeteo arriba y abajo.
- Incubar la solución en un baño de agua de 37 ° C por 20 min.
Nota: Este paso puede omitirse si la solución prebiótico probiótico se crea de una cultura viva. - Placa de una serie de cinco 10 veces dilución en placas de agar MRS antes por sonda nasogástrica para cuantificar con precisión el probiótico administrado para el cachorro. Este paso puede omitirse si no es necesario el conteo preciso de UFC.
3. preparación del gabinete de bioseguridad
- Utilizar un gabinete de bioseguridad cuando se trabaja con probióticos para mantener una técnica aséptica. Encuentra la jaula con las presas y los cachorros en una manta (conjunto a aproximadamente 38 ° C) en una mitad de la manta. Poner una jaula limpia y vacía en la otra mitad de la manta.
- Lugar un absorbente desinfectado o estéril, la almohadilla sobre la manta para tender al ratón durante la alimentación forzada.
- Recoger material de nidificación para los cachorros de la cima de la jerarquía existente, creado por la presa y crear una nueva Copa anidación cónica con manos enguantadas, desinfectado con etanol al 70% y se secó. Lugar este nuevo nido en la jaula limpia y vacía de la explotación. Esto facilita a la transferencia de olor de nido para las manos enguantadas y por lo tanto, reduce al mínimo la introducción de otros olores en el cachorro durante la manipulación para el procedimiento, reduciendo el riesgo de canibalización.
- Mover las crías en el nido cónico con jaula y sacar la jaula con la presa del gabinete. Esto disminuye la tensión de la presa impidiendo oir los cachorros durante el procedimiento.
Nota: Si el probiótico es un conocido colonizador de los intestinos murinos, las condiciones de tratamiento deben estar separadas por jaulas o bioseguridad incluso diferente gabinetes para evitar la posibilidad de cruzar la colonización.
4. sonda nasogástrica Intra-del esófago del ratón neonatal
- Abra el empaque de la jeringa para facilitar el acceso. Abra el embalaje de la aguja de manera estéril y fijarlo a la cabeza de la jeringa. Lavar la aguja con etanol al 70% y autoclave antes del procedimiento. Utilizar diferentes tipos de agujas para el tratamiento y el grupo de control para evitar la contaminación.
- Dibujar un poco más que la cantidad deseada de la solución de probiótico-tinte en la jeringa. Sostenga la jeringa hacia arriba. Luego baje otro y flick con el dedo para desalojar las burbujas y empuje el émbolo para expulsar las burbujas y el líquido extra volumen hasta alcanzar el volumen deseado. Esto asegura que no hay ningún espacio de aire en la aguja. Para ratón DOL 2, el volumen de la sonda no debe exceder 30 μl.
- Colocar el cachorro sobre la almohadilla absorbente estéril encima de la almohada. Utilizar la aguja de alimentación (calibre 24, 1" longitud de la aguja, diámetro de bola de 1.25 mm) desde el exterior para medir la longitud del esófago mediante la colocación de la bola de la aguja justo por debajo del proceso xifoides (extremo inferior del esternón). Marque la aguja a nivel del hocico para señalar el límite de inserción de la aguja (figura 1). Observar el cachorro para las muestras de la salud, que incluyen la respiración regular y la coloración rosada de la piel.
- Sumergir la punta de la aguja en inmersión solvente (solución salina al 5% dextrosa o el medio utilizado para disolver el probiótico y pre biótico) para lubricar la superficie externa de la aguja de alimentación. Esto facilita la entrada suave de la aguja hacia el esófago del ratón.
- Levante el cachorro por el pescuezo o manteniendo suavemente la cabeza y el cuerpo entre el pulgar y el dedo índice. Asegurar la cabeza, cuello y cuerpo se mantienen en una posición recta. No sostenga el cachorro por el pescuezo para más de 60 s como allí es un riesgo de obstrucción de la tráquea conduce a asfixia. Asegúrese de que el cachorro respira. Signos de scruffing demasiado pueden incluir la incapacidad para respirar, jadeo significativa y la lengua extendida hacia fuera de la boca. Monitor color de cachorro y la respiración durante todo el procedimiento.
- Inserte la bombilla de la aguja en el centro de la boca de la cría en un ángulo de 45° al plano del torso hasta llegar a la parte posterior de la garganta.
- Cambiar el ángulo de la aguja suavemente pivotando sobre el foco de la aguja y la jeringa en movimiento lejos de la persona de gavaging (hacia el lado dorsal de la pup) hasta que es paralelo al plano de la columna vertebral del cachorro. Scruffing el cachorro ayuda a mantener la aguja en su lugar en la parte posterior de la garganta y también evita que el ratón inquieto. Asegúrese de que la bola de la aguja no avance ni ejercer cualquier presión contra la parte posterior de la garganta durante el cambio de ángulo.
- Si el ratón intenta tragar la aguja, deje que se deslice hacia abajo y detener el movimiento cuando la marca de la aguja se alinea con el hocico de manera natural. La jeringa y la aguja son generalmente lo suficientemente pesados para deslizarse hacia abajo debido a la gravedad. Soporte el peso de la aguja en todo momento para que la aguja se desliza fácilmente hacia abajo del esófago con ninguna presión a la baja de la persona encargada de la sonda.
- Si la aguja cumple la resistencia en la parte posterior de la garganta, retire la aguja de la sonda un poco para sacar la bola de la aguja y volver a ángulo la aguja dentro de la boca hacia la izquierda del ratón (a la derecha del controlador) lentamente en incrementos pequeños, 1 mm. La aguja debe comenzar a deslizarse fácilmente por el esófago.
- Si la aguja se detiene antes de la marca de aguja llegue a la boca, no inyecte la solución.
- No mantenga la aguja insertada por más de 20 s. Si esto ocurre, retraiga lentamente la aguja manteniendo la jeringa paralela al torso y deje que el cachorro descanse sobre la toalla de papel para 30 s a 1 min Try gavaging otra vez después de lubricar la superficie externa de la aguja con el solvente.
Nota: La anestesia no se utiliza para el procedimiento como respuesta del ratón es necesario para medir el éxito de la sonda nasogástrica.
- Cuando la marca de la aguja de alimentación está por encima del hocico y alineado con la punta del hocico, no deje que la aguja moverse o avanzar cualquier aún más. Inyecte lentamente el volumen de líquido deseado. Si el líquido es aspirado u observa burbujas por la nariz, detener la inyección inmediatamente y retraiga lentamente la aguja.
- Colocar el cachorro en posición vertical sobre la toalla en la almohada para ayudar en su recuperación. Vigilar de cerca para los problemas de respiración continua o cambio de color del cachorro que indica aspiración. Eutanasia de cachorros que han aspirado inmediatamente.
- Una vez que la sonda nasogástrica, suavemente Retire la aguja de alimentación con el mismo ángulo que fue insertado. Colocar el cachorro sobre la toalla de papel sobre el cojín de calentamiento calentado. Espera 10 s para el cachorro a recuperar la actividad normal y el patrón de respiración. Un tono rosado saludable debe aparecer sobre el cuerpo del cachorro y el tinte debe verse sólo en el compartimiento del estómago. Volver a la jaula con los otros cachorros.
Nota: El colorante azul de Gavaging es una excelente manera de practicar el procedimiento descrito anteriormente. Si la sonda es correcta, el estómago del ratón será visible como un color azul. Si el tinte azul se encuentra fuera del estómago de la cría (cuello, pecho o región axilar), el animal debe ser humanamente sacrificado (de acuerdo con las normas de cuidado de los animales), como esto indica una ruptura del esófago o aspiración.
5. colección de muestras de intestional para el análisis de la colonización
- Durante la supervisión posterior o gavaging, recoger muestras de microbioma fecal de los cachorros.
Nota: El cachorro con frecuencia orina y defeca cuando gavaged y esta vez puede utilizarse como una oportunidad para recoger las muestras fecales para el análisis del microbioma. - Para la terminación de los experimentos, recoger los intestinos duodeno al recto después de la eutanasia de los cachorros. Prender el cachorro a un tablero quirúrgico y desinfectar la piel con etanol al 70%. Corte la piel en cuatro cuadrantes sin dañar la capa peritoneal utilizando herramientas esterilizadas con etanol al 70% y una esterilización del grano caliente a 250 ° C.
- Use un conjunto diferente de herramientas estériles para cortar el peritoneo en cuatro cuadrantes y mover lejos del centro de manera que están expuestos los órganos viscerales.
- Localizar el estómago y use una pinza para pellizcar debajo de la esfinge pilórica y en el extremo del recto. Ejecutar la longitud del intestino utilizando una herramienta sin punta o fórceps para agilizar el intestino y libres de tejido conectivo y tejido mesentérico. Una vez que toda la longitud del intestino ha sido liberada del tejido conectivo, corte en los extremos afianzada con abrazadera.
- Marque el aluminio con la orientación del intestino, envolver de manera segura y congelar a-80 ° C.
Nota: El procedimiento de extracción de ADN puede llevarse a cabo en este momento sin congelación. El tinte azul también fue visto pasar por el intestino más de 24 h y recogida de muestras para análisis de colonización es mejor cuando los intestinos se recogen al menos 24 horas post la última sonda. Señales pueden amplificarse antes de ese punto por las bacterias no adheridas transitoriamente pasando la mezcla por sonda nasogástrica.
6. extracción de ADN de los intestinos para el análisis de la colonización
Nota: La extracción de ADN se realiza utilizando un kit comercial con optimización de modificaciones en el protocolo para la extracción de ADN del intestino. Asegúrese de que el aparato de calefacción se encuentra a la temperatura deseada y las soluciones que necesitan modificaciones o precalentamiento están preparadas adecuadamente.
- Preparar el tampón de lisis enzimática (ELB) como sigue: hacer una solución con EDTA de sodio de 2 mM, 20 mM Tris-Cl y 1.2% Tritón X-100. Ajustar el pH a 8.0. Inmediatamente antes de usar el ELB, añadir lisozima a una concentración final de 20 mg/mL.
- Pre-pesar los tubos de granate de grano en balanza analítica con los tapones quitados.
Nota: Esto se hace para que si se sobrepasó el peso deseado, es más fácil eliminar el contenido intestinal. - Cortar los intestinos pequeños segmentos utilizando un bisturí estéril desechable y saquen los segmentos deseados en los tubos previamente pesado grano granate.
Nota: Asegúrese de cambiar bisturís entre cada muestra como DNA es ubicua y puede afectar los resultados del PCR. - Añada 1 mL de ELB con lisozima (en el paso 6.1) a cada tubo, poner en el batidor de grano Vortex y ejecutar al valor máximo (14) durante 5 minutos.
- Una vez que el tejido se interrumpe, transferir los tubos a 37 º C baño e incubar durante 30 minutos.
Nota: Este paso se hace para activar lisozima e inducir la ruptura de la pared celular de peptidoglicano de bacterias Gram positivas. - Preparar tubos con 20 μl de proteinasa K para cada muestra a una concentración de 600 mAU por mL.
- Centrifugar los tubos a 400 x g durante 10 minutos. El lisado debe verse claro con algún residuo de tejido en la parte superior los granos.
- Transferencia de 180 μl de sobrenadante (la fase superior) en un tubo que contiene proteinasa K y luego añadir 200 μL de tampón al tubo. Vortex por 15 s para mezclar.
- Colocar tubos en el bloque de calentamiento a 56 ° C durante 10 minutos.
- Añadir 200 μL de etanol al 100% en el tubo y mezclar con un vórtex durante 15 s.
- Añadir aproximadamente 600 μl de lisado a la columna de giro (del kit).
- Centrifugar durante 1 minuto a 8.000 x g. Deseche el flujo a través.
- Repita paso 6.12 hasta el lisado se ha dibujado a través de la columna.
- Coloque la columna en un tubo nuevo de colección. Añadir 500 μl de buffer AW1 y centrifugue a 8.000 x g durante 1 minuto.
- Deseche el flujo a través. Añadir 500 μl de buffer AW2 y centrifugue a 8.000 x g durante 3 minutos.
- Deseche el flujo a través y centrifugar la columna en un tubo de colección vacía en 8.000 x g durante 3 minutos.
- Transfiera la columna a tubo de elución de ADN. Añadir 60 μL de agua ultrapuro grado de polimerización en cadena directamente sobre la membrana e incubar 2 minutos a temperatura ambiente.
- Utilizar el agua de elución precalentada a 37 ° C para eluir. La elución puede hacerse dos veces por usar la mitad el volumen de elución final y repetir paso 6.15 dos veces para aumentar la producción.
- Centrifugar durante 1 minuto a 8.000 x g para eluir el ADN.
- Medir la concentración de la DNA eluida utilizando el método de cuantificación deseada. Los rendimientos del proceso de extracción están en el rango de 10-40 ng/μl de ADN.
- Almacenar el ADN eluído a-20 ° C.
7. qPCR configuración
- Condiciones PCR
- Encienda la máquina y cargar el programa en el cuadro 1 en una máquina de qPCR en tiempo real.
- Pasos 3 a 5 en la tabla 1 del lazo para 40 ciclos y mantener la muestra a 4 ° C al final de la reacción.
- Disposición experimental de PCR
- Utilizar las cartillas y temperatura encontrada en la tabla 2. Utilizar las concentraciones y condiciones de reacción encontradas la tabla 3. Configurar cada reacción por triplicado a control para la variación del procedimiento.
- Coloque la placa/tubos de reacción de PCR en el sistema qPCR y el funcionamiento del programa cargado en el sistema de paso 7.1.
- Retire el tubo en el extremo de la carrera, lugar en el 4 ° C y prepararse para gel de carga.
8. cuantificación de la colonización de LP
- Preparar mezclas de qPCR para μl 10 o 20 reacciones μl según tabla 3.
- LP genomic DNA curva estándar 107 a 101 copias/μl
Nota: Puesto que será plateado 4 μL de cada dilución, copias7 10 μl 4 o 2,5 x 106 copias por μl es necesaria en la población de partida. Utilice el mismo principio para el resto de la curva.- Preparar una dilución 1:4:107 copias por μL en 50 μl.
3.147 μl de LPDNA + 46.85 μl de dH2O = 2.5 x 106 copias por μl - En serie diluir 10 veces: Añadir 5 μl a 45 μl dH2O 1.25 x 105 copias/μl.
- 4 μL dilución por pocillo de la placa.
- Preparar una dilución 1:4:107 copias por μL en 50 μl.
- Visualización de amplicones de LP
- Utilizar un gel de agarosa al 2% para llegar a una separación clara entre el ~ fragmento amplificado de 197 bp LP.
- Carga 9 μl de cada producto PCR en el gel.
- Correr el gel a 120 V durante 30 minutos.
Resultados
La singularidad de este método se basa en su adaptación de la técnica de gavaging para el tamaño y la fragilidad de un ratón neonatal. La sección anterior describe los pasos importantes para llevar a cabo un procedimiento exitoso de la sonda en un ratón DOL 2. Para establecer una escala de cuantificación buenos, se generó una curva estándar utilizando el puro ADN de LP con tres repeticiones técnicas (figura 2). La curva estándar proporciona un rango dinámico de detección de la DNA de LP utilizando los cebadores. El rango dinámico fue entre 7 y 28 ciclos donde una gama de 101 a 107 copias del LP de ADN fue detectado. La constante pendiente de la curva estándar representa la eficiencia y la escalabilidad de la reacción.
El procedimiento de la sonda nasogástrica de IE se ha utilizado en ratones adultos con relativa facilidad. Sin embargo, el tracto gastrointestinal superior de un ratón neonatal es frágil y requiere movimientos calibrados de la sonda de aguja durante el procedimiento. Gavages repetidas podrían aumentar las posibilidades de irritación intra esofágico, lesiones y la falta o rechazo por la presa debido a la manipulación. Así, se probaron dos esquemas de diferentes gavaging y la colonización intestinal se cuantificó usando la DNA de homogenados entera del intestino. Ratones fueron gavaged de DOL 2 8 DOL con probiótico administrado cada día o cada dos días (figura 3). Cada muestra contiene una repetición técnica y cada estado tenía al menos dos réplicas biológicas. Los cachorros gavaged todos los días con dosis de 7 tenían alrededor de 103 copias del LP mientras que los cachorros gavaged cada dos días con 4 dosis tenían alrededor de 105 copias. La consistencia de resultados entre las repeticiones añadir crédito a la precisión de la técnica. Hubo más LP detectado en los intestinos de cachorros gavaged cada dos días en comparación con los cachorros que fueron gavaged todos los días. Dado esto, experimentos posteriores se establecieron con un horario de alimentación forzada de día ya que también reduce el estrés de las crías.
Es importante evitar intra camada probiótico contaminación cruzada cuando se trabaja con probióticos. Se esperaba que el microbioma de hermanos de camada son similares ya que comparten la misma madre y el ambiente de anidación. Esto resulta un problema para los estudios de probióticos si las condiciones de tratamiento y el control estaban presentes dentro de la misma camada como el organismo probiótico tiene el potencial para convertirse en una parte de la microbiota ("colonización extender '). Para determinar si un probiótico se contamine y colonizar hermanos de camada no tratados, la mitad de la camada fue gavaged como por encima y los intestinos se recolectaron para qPCR. Análisis de qPCR intestinal de ratones 10 DOL demostraron esperada amplificación de la DNA de LP en los ratones gavaged sino también, en menor grado en los hermanos de camada no gavaged (figura 4). Los intestinos de los ratones DOL mismo de una jaula no demostraron ninguna amplificación o mínima amplificación en ciclos mayor que 32. Esto proporcionó la evidencia para la participación comunitaria el microbioma dentro de una camada en una jaula. Así, para experimentos con probióticos los grupos de tratamiento deben estar separados por jaulas para control de variabilidad a través de la contaminación cruzada. El uso de presas foster puede considerarse si un experimento es que se creará dentro de un entorno de la camada, pero confundir efectos como atención disminuida de la presa de foster y rechazo debe ser evaluado y optimizado para. Cuando ratones gavaged hasta 8 DOL se dejaron sin tratan durante seis días y se analizó el ADN intestinal en DOL 14, aproximadamente 10 copias del LP fueron encontrados (figura 5). Así, la colonización del LP fue encontrada para ser transitoria y la población detectable disminuye con el tiempo.
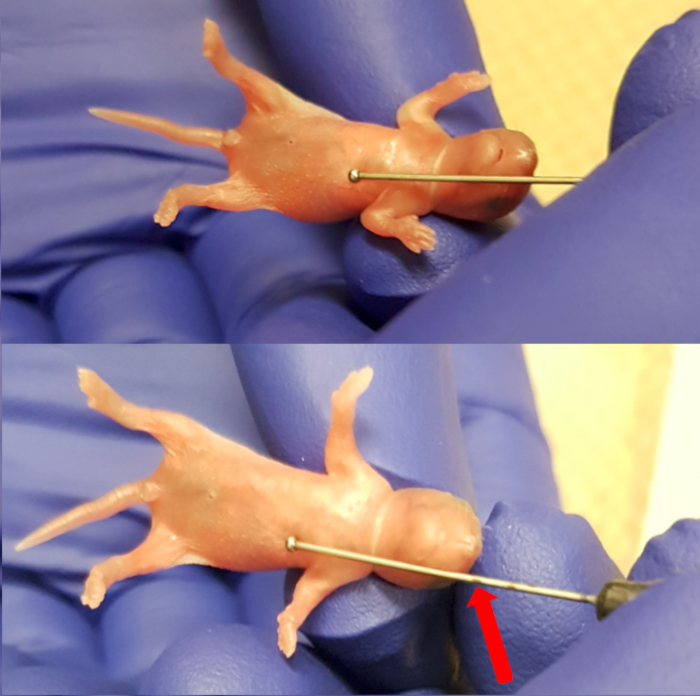
Figura 1 . Medición de la longitud entre el proceso xifoides (extremo inferior del esternón) y el hocico para hacer inserción máximo marcado por la aguja. Haga clic aquí para ver una versión más grande de esta figura.
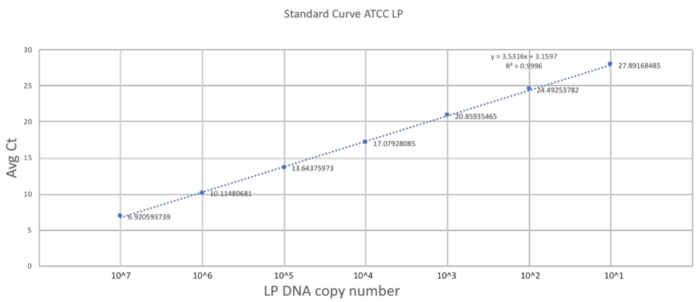
Figura 2 . Curva estándar establecida utilizando cebadores de LP y ATCC LP ADN. Una dilución seriada de la ATCC LP DNA se realizó para establecer el rango dinámico detectable para los primers utilizados en el estudio. Haga clic aquí para ver una versión más grande de esta figura.
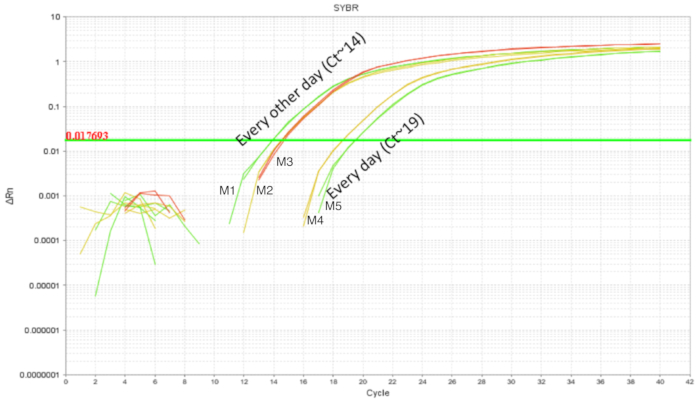
Figura 3 . La amplificación de ADN intestinal de cachorros 10 DOL la LP tratados entre DOL 2 y 8 DOL en gavages programadas todos los días (7 dosis) y cada dos días (4 dosis). Gavaging día demostró mayor LP intestinal en comparación con gavaging todos los días. Haga clic aquí para ver una versión más grande de esta figura.
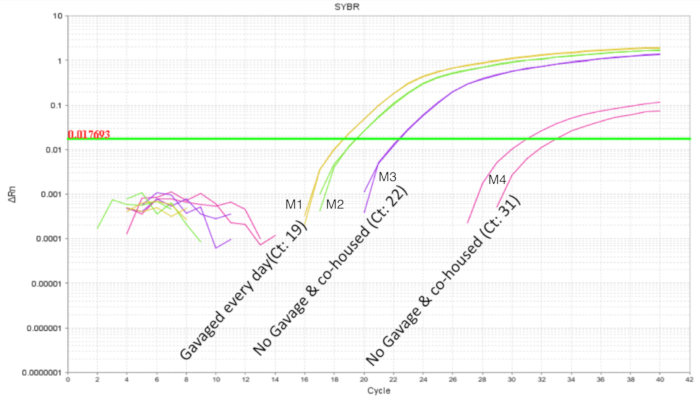
Figura 4 . La amplificación de ADN intestinal de cachorros 10 DOL con 2 tratados y 2 la LP no se trata de una camada de 4 cachorros. La sonda fue entre DOL 2 y 8 DOL en gavages programadas todos los días (7 dosis). El probiótico dos tratados cachorros mostrar el perfil de amplificación esperados. Los cachorros no tratados muestran amplificación variable de LP que indica compartir comunal del organismo probiótico dentro de una camada. Haga clic aquí para ver una versión más grande de esta figura.
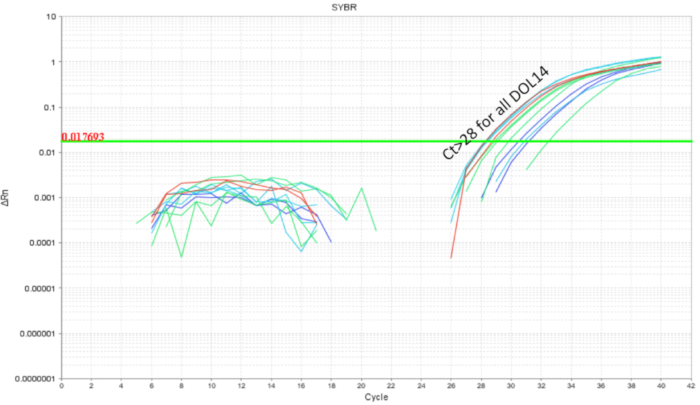
Figura 5 . La amplificación de ADN intestinal de cachorros 14 DOL la LP tratados entre DOL 2 y 8 DOL en gavages programadas todos los días (7 dosis) y cada dos días (4 dosis). Las gotas de la carga de LP a continuación ciclo 28 que indica separación de LP a lo largo de 6 días post pasado probiótico por sonda nasogástrica. Haga clic aquí para ver una versión más grande de esta figura.
| Paso | Temperatura | hora |
| 1 | 50 ° C | 2 minutos |
| 2 | 95 ° C | 3 minutos |
| 3 | 95 ° C | 30 segundos |
| 4 | 58 ° C | 30 segundos |
| 5 | 72 ° C | 30 segundos |
Tabla 1. condiciones de amplificación de qPCR. La temperatura y el número de condiciones del ciclo para la reacción de PCR.
| Blanco | Región de espaciador intergénico 16S-23S |
| Tamaño del fragmento esperado | 144 bp |
| Cartilla Tm | 58˚C |
| Primer avance (FP) | LPN-1: TGG ATC ACC TCC TTT CTA AGG AAT |
| Cartilla reversa (RP) | LPN-2: TCT TGT TTT CGG CAT TAT GAA AAA ATA |
Tabla 2. Detalles de los componentes de la reacción de qPCR. Los detalles de los iniciadores, su temperatura de recocido y el tamaño del fragmento esperado en la reacción de PCR.
| Concentración | Reacción de 10 μl | Reacción de 20 μl | |
| Plantilla de ADN | 200 pg/μl | 1 ΜL | 1 ΜL |
| Mezcla de maestra SYBR | - | 5 ΜL | 10 ΜL |
| PUNTO DE CONGELACIÓN | 10 ΜM | 0,3 ΜL | 0,6 ΜL |
| RP | 10 ΜM | 0,3 ΜL | 0,6 ΜL |
| dH2O | - | 3.4 ΜL | 8,8 ΜL |
Tabla 3. Por volúmenes de reacción y las concentraciones de. La concentración de los reactivos y los volúmenes para las reacciones.
Discusión
El procedimiento de la sonda nasogástrica de IE fue desarrollado para administrar con seguridad una dosis específica de un probiótico a ratones neonatales. Pequeñas cantidades de líquido se entregan en el tracto gastrointestinal superior usando una aguja de alimentación para prevenir la aspiración mientras se asegura la entrega de la dosis de confianza. Los intestinos de los ratones fueron recogidos para el análisis de la colonización dos y seis días después por sonda nasogástrica. El procedimiento para la extracción de ADN fue modificado para asegurar alto rendimiento del organismo probiótico Gram-positivas. El análisis de qPCR de la DNA extraen dos días post última sonda mostraron relativamente mayor colonización de LP en ratones gavaged cada dos días en comparación con ratones gavaged cada día entre DOL 2-8. También hubo una disminución en la cantidad de LP durante seis días, mostrando este probiótico que un organismo transitorio en el intestino del ratón. Los resultados de estos experimentos establecen las condiciones para llevar a cabo investigación con alto rigor en este grupo de edad.
Para observar los efectos a largo plazo de los probióticos en ratones neonatales, se administró a ratones neonatales en DOL 2; un tiempo partido similar señalan el juicio humano. Orofaríngeo de alimentación de ratones neonatales es descrita en la literatura y se ha realizado sólo después de12,DOL 5 817 cuando el riesgo de aspiración es bajo debido a una mecánica de deglución bien desarrollada. Sin embargo, alimentación orofaríngea no es idóneo para ratones 2 DOL como tasas más altas de aspiración se observaron en el estudio piloto (datos no mostrados). La naturaleza viscosa del probiótico y prebiótico solución agregado al riesgo de aspiración. Siguiendo el procedimiento de gavaging de IE reducen al mínimo el riesgo de aspiración en DOL 2 ratones mientras que entrega el volumen deseado directamente en el tracto gastrointestinal superior. El éxito del procedimiento primero se validó utilizando colorante infundido probiótico por sonda nasogástrica. El colorante de alimento actúa como un marcador que es visible a través de la piel del cachorro. No hay efectos negativos fueron observados en ratones gavaged con colorante, y se recomienda validar el procedimiento de gavaging de esta manera antes de comenzar los experimentos a gran escala. La rápida resolución de la sonda refleja post visto jadeando también puede utilizarse como un indicador adicional para una exitosa por sonda nasogástrica. Una vez que el ratón se coloca sobre la manta la sonda nasogástrica, reflejo del jadeo se desplomará y se observará un aumento en la frecuencia de la respiración dentro de 20 segundos. La continuación del reflejo del jadeo durante más de 30 segundos indica un fallido por sonda nasogástrica. Sonda nasogástrica éxito también depende de adecuada inserción de la aguja de alimentación con el bulbo sentado justo encima de la abertura del esfínter cardiaco del estómago. Esto puede facilitarse al asegurar que la marca de la aguja de medición de la longitud entre el proceso xiphoid y la punta del hocico, no pasar el hocico del ratón durante la alimentación forzada. Esto minimiza la posibilidad de lesiones al ratón. La frecuencia de la sonda nasogástrica puede tener un impacto significativo en los resultados experimentales. Gavaging frecuente también puede crear más estrés para los cachorros y la madre debido a la constante perturbación de la jaula y el nido. El horario más óptimo de sonda es cuando el gavages son las menos frecuentes y durante un tiempo más corto de tiempo sin perder el efecto esperado en el sistema. Para garantizar la seguridad y esterilidad del procedimiento de la sonda aguja debe ser esterilizada por autoclave entre uso y lavado. Lavar rigurosamente en el exterior utilizando un exfoliante el interior forzando el agua a través de la aguja con una jeringa antes de autoclave es necesario como las partículas de restos puede incrustar en la aguja durante la esterilización en autoclave y puede interferir con el procedimiento de gavaging.
Mayor colonización del LP fue observada en crías que fueron gavaged cada otro día en comparación con gavaged los cachorros todos los días. Esto puede ser debido a la tensión reducida en cachorros gavaged día y potencialmente probióticas obteniendo más nutrientes a través de la relativamente más leche ingerida por estos cachorros. La dependencia de la dosis del tratamiento con probióticos ha sido estudiada previamente en modelos de ratón18,19 y por lo tanto es importante la administración de la dosis correcta. La solución de probiótico elaborada es plateada antes de cada sonda nasogástrica para obtener un conteo preciso de UFC administrado. Si el organismo probiótico es anaeróbico, es importante ver si hay diferencia en la UFC cuando cultivan aeróbicamente o anaeróbicamente. LP es un anaerobio facultativo, fue cultivado usando ambos métodos y no se observó ninguna diferencia en la UFC.
Post por sonda nasogástrica intestinal LP carga análisis se realizó utilizando muestras de ADN de qPCR y de alta calidad. Para minimizar la contaminación del ADN de LP entre el tratamiento y los grupos de control, diferentes alimentación agujas, gabinetes de bioseguridad y equipos quirúrgicos fueron utilizados para muestras de calidad más altas. La medida exacta de los probióticos en el intestino requiere de un método optimizado de extracción de ADN. Métodos más eficientes para la extracción de ADN de heces implica múltiples grano superando pasos20,21,22. Este método fue adoptado para la extracción de bacterias intestinales con paliza de grano y observa representación disminuida (< 10 copias2 recuperados) de LP en la extracción de ADN completamente del intestino. LP es un Gram positivo organismo con una substancial cantidad de peptidoglicano en la pared celular, se optimizó el protocolo con un paso de la disolución de peptidoglicano usando lisozima23,24 añadido al buffer de lisis enzimática. Esto aumentó la representación de LP en la misma muestra intestinal por más de dos veces. El tratamiento de lisozima asegura la disolución de la capa externa, mientras que el grano a paso facilita la lisis del organismo. Optimización de la cantidad de tejido, el tipo de grano de granate y la duración de la interrupción con los granos es necesarios para la obtención de productos de DNA óptimo para llevar a cabo el análisis PCR.
Los efectos positivos de los probióticos administrados como profilaxis o tratamiento en los recién nacidos pre término y término se evidencia en recientes estudios25,26,27,28. El establecimiento de un modelo de ratón neonatal adecuada de probióticos está garantizado para desempaquetar el efecto protector de los probióticos. Este protocolo descrito aquí representa a una guía para los investigadores que no estén familiarizados con el trabajo de ratón neonatal con probióticos. No obstante lo dispuesto en el problemas con roedor microbiota mientras estudiaba la enfermedad y la salud humana, este método puede ampliarse a la investigación se centró en la comprensión de los cambios de la microbioma por probióticos. Este modelo también proporciona una plataforma para estudiar la interacción huésped-microbio y respuestas inmunes a lo largo de diferentes etapas de desarrollo.
Divulgaciones
No hay conflicto de intereses a revelar.
Agradecimientos
Gracias al personal del centro de cuidados de animales y los veterinarios UBC para entrenamiento y asistencia en el ratón funcionan en el Instituto de investigación del Hospital de niños BC. Gracias a la Universidad de British Columbia y el Departamento de Medicina Experimental para el estudio de la financiación.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
Referencias
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados