Method Article
Estudos de probiótico em camundongos neonatais usando Gavage
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo detalha o processo de quantidades precisas de gavaging de probióticos para camundongos neonatais. A montagem experimental foi otimizada para incluir, mas não está limitada ao probiótico dosagem, métodos de administração e quantificação de bactérias no intestino.
Resumo
Modelos do rato adulto foram amplamente utilizados para entender o mecanismo por trás da progressão da doença em seres humanos. A aplicabilidade de estudos realizados em modelos do rato adulto para neonatais é limitada. Para entender melhor a progressão da doença, acolhimento respostas e impacto a longo prazo das intervenções em neonatos, um modelo do rato neonatal provável é um melhor ajuste. O uso esparso de modelos do rato neonatal em parte pode ser atribuído às dificuldades técnicas de trabalhar com esses pequenos animais. Foi desenvolvido um modelo de rato neonatal para determinar os efeitos da administração de probióticos no início da vida e para avaliar especificamente a capacidade de estabelecer a colonização no tracto intestinal de rato recém-nascido. Especificamente, para avaliar a colonização de probiótico no mouse neonatal, Lactobacillus plantarum (LP) foi entregue diretamente no trato gastrointestinal neonatal do mouse. Para este fim, LP foi administrado a ratos alimentando através de intraesofágico gavagem (IE). Foi desenvolvido um método altamente reprodutível para padronizar o processo de gavage IE que permite uma administração precisa de probiótico dosagens, minimizando o trauma, um aspecto particularmente importante dado a fragilidade dos ratos recém-nascidos. As limitações deste processo incluem possibilidades de irritação esofágica ou danos e aspiração se gavaged incorretamente. Esta abordagem representa uma melhoria nas práticas actuais porque gavage de IE para o esôfago distal reduz as chances de aspiração. Após a intubação, o perfil de colonização do probiótico foi rastreado usando a reação em cadeia da polimerase quantitativa (qPCR) do DNA extraído intestinal com primers específicos de LP. Ninhada de diferentes configurações e técnicas de gestão de gaiola foram utilizadas para avaliar o potencial de propagação da colonização. O protocolo detalha os meandros da gavagem de rato neonatal do IE e quantificação de colonização subsequente com LP.
Introdução
Em crianças, a exposição precoce de probiótico tem sido associada com efeitos imunomoduladores, levando à redução da incidência de doenças como necrosante enterocolite, dermatite atópica e sepse1,2,3, 4 , 5. no entanto, o mecanismo por trás desta resposta imuno é um desafio para explorar dada a limitação de amostragem recém-nascido em ensaios em humanos (ou seja, sangue sequencial e biópsias). Modelos de rato neonatal podem ajudar a estudar o mecanismo de ação envolvido no Regulamento imune neonatal, associado com uso de probiótico e alterações da microbiota intestinal. Infelizmente, a maioria dos modelos de rato para probióticos têm focados em ratos adultos; no entanto, o impacto dos probióticos é susceptível de ser mais alto no início da vida, sugerindo modelos específicos para este grupo etário será útil3,6. Além disso, modelos de rato neonatal são mais adequados para estudar doenças e intervenções destinadas a aplicação no início da vida dos bebês humanos como eles são esperados para imitar mais de perto um desenvolvimento sistema imune e microbiana7,8 ,9,10. O objetivo foi estudar a extensão e os padrões de colonização de probiótico de ratos neonatais com foco na interação entre o host e seu microbiome mecanicista. Apropriado descrições dos modelos de recém-nascido não foram encontradas na literatura, e, portanto, uma necessidade para o desenvolvimento de um método robusto e padronizado foi abordada.
Estabelecidos métodos de administração oral de vários compostos de ratos recém-nascidos incluem transferência materna de compostos desejadas através do leite, tratando a fonte de água para barragens grávida11 ou usando agulhas alimentação para facilitar a administração de compostos desejados para a orofaringe12. Esses métodos são úteis para experiências que não têm requisitos de dosagem precisa e onde o tratamento é facilmente ingerido pelo destinatário mouse. Probióticos são frequentemente administrados em conjunto com um prebiótico como galactooligosaccharide e fructooligosaccharide (FOS) que servem como fonte de nutrição para as bactérias probióticas; Estes aditivos compostos tornam a solução viscosa e desafiador para administrar através das metodologias acima mencionadas. Conceber um método para administrar quantidades precisas de probióticos e prebióticos para ratos recém-nascidos começando tão cedo quanto o primeiro dia de vida (DOL) era necessário. No processo de desenvolvimento da técnica de gavagem, a possibilidade de propagação da colonização (como observado em outros estudos de probiótico entre o tratamento e o controle braços13,14,15,16) foi testado e a abundância relativa de colonizado Lactobacillus plantarum (LP) no intestino dos filhotes com horários diferentes gavagem foi avaliada. A preparação de probiótico utilizada nos experimentos consistiu de 10 unidades de formadoras9 (CFU) por gavagem de LP (cepa ATCC-202195), misturado com FOS (prebiótico) e maltodextrina (excipiente), conforme descrito no recente julgamento humano3. A entrega de probiótico foi realizada utilizando gavage IE e o processo é detalhado no protocolo abaixo. O perfil de colonização do probiótico foi avaliado usando o tempo real de amplificação do DNA extraído todo intestinos utilizando primers específicos de LP.
Protocolo
Todos os procedimentos foram realizados referentes às diretrizes estabelecidas pela equipe de suporte à instalação de cuidado Animal na Universidade de British Columbia e todos os procedimentos foram aprovados pelo Comité Cuidado Animal UBC.
1. quantificação dos probióticos administrados
Nota: Esta etapa é recomendada para determinar a quantidade exata de probiótico CFU que pode ser administrado em dose única. A quantidade de probióticos e veículo (FOS e maltodextrina) determinar as condições de saturação da solução. Por experiência própria, não mais que 30 µ l (~ 20 mL / kg) de fluido pode ser administrado aos ratos no DOL 2 como qualquer volume maior aumenta o risco de aspiração.
- Prepare-se seis tubos de 1,5 mL microcentrifuga de diluições em série com cada tubo contendo 180 µ l de solução salina estéril de dextrose 5%.
- Pesar uma alíquota de 0,2 g de uma mistura de probiótico-prebiótico e dissolvê-lo em 1 mL de solução salina de dextrose 5%, de forma estéril.
- Vórtex durante 30 segundos e pipeta quebrar aglomerados. Repita até não aglomerados visíveis são observados.
Nota: Maltodextrina torna a solução viscosa e contribuem para a saturação da solução. - Realize uma diluição serial usando tubos preparados no passo 1.1. Vórtice de misturar.
- Placa de 40 µ l de cada diluição em um quadrante rotulado da placa de ágar MRS. Placa de cada diluição em duplicado.
- Incube sob anaeróbio (facultativa) condições a 37 ° C por 48 h em um frasco de vácuo usando um pacote de gás.
- Conte cada placa dentro de um intervalo de 20-70 colónias por quadrante. Placa média conta com a mesma diluição e calcular para as unidades desejadas.
2. preparação de probióticos e prebióticos para gavage
Nota: A dissolução adequada de probiótico e prebiótico é necessária para garantir a injeção suave do líquido através da agulha de alimentação durante a intubação.
- Combine a quantidade necessária de organismo probiótico liofilizado com a quantidade desejada de prebióticos e veículo em um tubo estéril microcentrifuga.
- Adicione quantidades adequadas de solvente (soro fisiológico de dextrose a 5%) para dissolver a mistura prebiótico-probiótico.
Nota: A capacidade de dissolução é limitada pelo prebiótico e veículo utilizado. De experiência, a combinação de synbiotic (com FOS e maltodextrina) atingiu a saturação em cerca de 0,3 g/mL, enquanto a dissolução em um tubo de microcentrifugadora de 2 mL com 1 mL de solvente. - Vórtice de misturar até todos os sólidos são dissolvidos. Use uma pipeta para separar os glóbulos de partículas sólidas no solvente pipetando para cima e para baixo.
- Incube a solução em banho-maria 37 ° C por 20 min.
Nota: Este passo pode ser ignorado se a solução prebiótico-probiótico é criada a partir de uma cultura viva. - Placa de uma série de cinco 10 vezes diluição em placas de ágar MRS antes gavage de quantificar com precisão o probiótico administrado para o filhote. Esta etapa pode ser ignorada se a contagem exata do UFC não é necessária.
3. preparação do armário a biossegurança
- Use um armário de biossegurança ao trabalhar com probióticos para manter técnica asséptica. Defina a gaiola com as barragens e filhotes numa manta de aquecimento (conjunto de cerca de 38 ° C) em uma metade do cobertor. Coloque a outra metade no cobertor uma gaiola animal limpa, vazia.
- Lugar um absorvente desinfectado ou esterilizado, almofada sobre o cobertor que tendem para o mouse durante a intubação.
- Coletar material de nidificação para os filhotes da parte superior do ninho existente, represa-criado e criar uma xícara de aninhamento cónica nova usando as mãos enluvadas, desinfectado utilizando etanol a 70% e seco. Coloque este novo ninho na gaiola limpa e vazia de exploração. Isto facilita a transferência do perfume do ninho para as mãos com luvas e, portanto, minimiza a introdução de outras aromas sobre o filhote enquanto manuseá-los para o procedimento, reduzindo o risco de canibalização.
- Mover os filhotes no ninho cónico segurando a gaiola e remova a gaiola com a barragem do gabinete. Isso diminui o stress para a represa por impedindo-a de ouvir os filhotes durante o procedimento.
Nota: Se o probiótico é um conhecido colonizador dos intestinos murino, as condições de tratamento devem ser separadas por gaiolas ou mesmo diferente biossegurança armários para evitar a possibilidade de cruzar a colonização.
4. Intraesofágico gavage de rato neonatal
- Abra a embalagem da seringa para fácil acesso. Abra a embalagem da agulha de forma estéril e anexá-lo na cabeça da seringa. Lave a agulha com 70% de etanol e autoclave antes do procedimento. Uso de diferente conjuntos de agulhas para o tratamento e o grupo de controle para evitar contaminação.
- Desenhe um pouco mais do que a quantidade desejada de solução corante probiótico para a seringa. Segure a seringa virada para cima. Em seguida puxe para baixo mais e apertar com o dedo para retirar bolhas e empurre o êmbolo para expulsar as bolhas e o volume extra de líquido até atingir o volume desejado. Isso garante que não há nenhum espaço de ar na agulha. Para mouse DOL 2, o volume de gavage não deve exceder 30 µ l.
- Coloque o filhote para o absorvente estéril em cima da almofada de aquecimento. Use a agulha de alimentação (calibre 24, 1" agulha comprimento, diâmetro de esfera de 1,25 mm) externamente para medir o comprimento do esôfago, colocando a bola da agulha logo abaixo do processo xifoide (extremidade inferior do esterno). Marca da agulha no nível do focinho observar o limite de inserção da agulha (Figura 1). Observe o filhote para sinais de saúde, que incluem respiração regular e coloração rosa da pele.
- Mergulhe a ponta da agulha no solvente imersão (soro fisiológico de dextrose a 5% ou - o meio utilizado para dissolver o probiótico e pré-biótico) para lubrificar as superfícies externas da agulha alimentação. Isso facilita a entrada suave da agulha para o esôfago do mouse.
- Levante o filhote pela nuca ou segurando suavemente a cabeça e corpo entre o polegar e o dedo indicador. Certifique-se de cabeça, pescoço e corpo são mantidos em posição reta. Não segure o filhote pela nuca para mais de 60 s como lá é um risco de obstrução da traqueia levando a asfixia. Garantir que o filhote pode respirar. Sinais de agarrando demais podem incluir incapacidade para respirar, ofegante significativa e a língua estendida para fora da boca. Monitore do filhote cor e respiração durante todo o procedimento.
- Inserir a lâmpada da agulha para o centro da boca do filhote em um ângulo de 45° para o avião do torso até atingir o fundo da garganta.
- Delicadamente, mudar o ângulo da agulha inclinando na lâmpada da agulha e movendo-se a seringa da pessoa gavaging (para o lado dorsal do filhote) até que ele é paralelo ao plano da coluna vertebral do filhote. Agarrando o filhote ajuda a manter a agulha no lugar na parte de trás da garganta e também impede que o mouse se contorcendo. Certifica-se de que a bola da agulha não avance nem exercer pressão contra a parte de trás da garganta durante a mudança de ângulo.
- Se o rato tenta engolir a agulha, deixe-o deslizar para baixo e prender o movimento quando a marca na agulha coincida com o focinho naturalmente. A seringa e a agulha são geralmente pesadas o suficiente para deslizar para baixo o devido à gravidade. Suporte o peso da agulha em todos os momentos para que a agulha desliza facilmente para o esôfago sem pressão descendente do procede a gavagem.
- Se a agulha se encontra resistência na parte de trás da garganta, retire a agulha de gavagem ligeiramente para desalojar a bola da agulha e re-ângulo da agulha no interior da boca para a esquerda do mouse (direito do manipulador) lentamente em pequenos, incrementos de 1 mm. A agulha deve começar a deslizar facilmente para o esôfago.
- Se a agulha parar antes da marcação na agulha atinge a boca, não injete a solução.
- Não mantenha a agulha inserida por mais de 20 s. Se isso ocorrer, retire a agulha lentamente mantendo a seringa paralela ao tronco e deixe o filhote descansar sobre a toalha de papel por 30 s a 1 min. gavaging de tentar novamente após a lubrificação da superfície externa da agulha com o solvente.
Nota: Anestesia não é utilizada para o procedimento como resposta do mouse é necessária para medir o sucesso de gavage.
- Quando a marcação sobre a alimentação da agulha é acima do focinho e alinhado com a ponta do focinho, não deixe a agulha se mover ou avançar ainda mais. Injecte lentamente o volume desejado de líquido. Se o líquido é aspirado ou observado a bolha através do nariz, parar a injeção imediatamente e retire lentamente a agulha.
- Coloque o filhote na vertical sobre a toalha de papel sobre a almofada de aquecimento para ajudar na sua recuperação. Acompanhar de perto para problemas de respiração contínua ou mudança de cor do filhote que indica aspiração. Eutanásia em cachorros que tem aspirado imediatamente.
- Uma vez concluída a gavagem, delicadamente, retire a agulha alimentação no mesmo ângulo que foi inserido. Coloque o filhote sobre a papel toalha sobre a compressa aquecida. Espere 10 s para o filhote de cachorro retomar a actividade normal e o padrão de respiração. Uma tonalidade rosa saudável deve aparecer sobre o corpo do filhote e a tinta só deve ser visível no compartimento do estômago. Movê-lo de volta para a gaiola com os outros cachorrinhos.
Nota: O corante azul de Gavaging é uma excelente maneira de praticar o procedimento descrito acima. Se o gavage for bem-sucedida, o estômago do rato será visível como uma tonalidade de azul. Se o corante azul encontra-se fora o estômago do pup (pescoço, peito ou região axilar), o animal deve ser euthanized humanamente (de acordo com as regras de cuidados com animais), já que indica uma ruptura do esôfago ou aspiração.
5. colheita de amostras de intestional para análise de colonização
- Durante o acompanhamento posterior ou gavaging, colete amostras fecais microbiome dos filhotes.
Nota: O filhote frequentemente urina e defeca quando gavaged e desta vez pode ser usada como uma oportunidade para coletar as amostras fecais para análise microbiome. - Rescisão de experimentos, colete os intestinos do duodeno ao reto após eutanásia dos filhotes. Pin o filhote para um quadro de cirurgias e desinfectar a pele com álcool 70%. Cortar a pele em quatro quadrantes sem danificar a camada peritoneal usando ferramentas esterilizadas com 70% de etanol e uma esterilização de grânulo quente a 250 ° C.
- Use um conjunto diferente de ferramentas estéril para cortar o peritônio em quatro quadrantes e movê-lo longe do centro de forma a que estão expostos os órgãos viscerais.
- Localize o estômago e usar uma pinça para beliscar abaixo do esfíncter piloro e no final do reto. Execute o comprimento do intestino usando uma ferramenta contundente ou uma pinça para agilizar o intestino e liberá-la do tecido conjuntivo e tecido mesentérico. Uma vez que todo o comprimento do intestino foi liberado do tecido conjuntivo, corte nas extremidades preso.
- Marcar a folha de alumínio com a orientação do intestino, embrulhe em uma maneira segura e congelar a-80 ° C.
Nota: O procedimento de extração de DNA pode ser realizado neste momento sem congelamento. O corante azul também foi visto para passar através do intestino mais de 24h e coleta de amostras para análise de colonização é melhor quando os intestinos são coletados pelo menos 24 horas de postar a última gavagem. Os sinais podem ser amplificados antes que Commit pelas bactérias não-aderido transitoriamente passando através da mistura de gavage.
6. extração de DNA de intestinos para análise de colonização
Nota: A extração de DNA é feita usando um kit comercial com otimizando as modificações feitas no protocolo para a extração de DNA a intestino. Certifique-se o aparelho de aquecimento é definido como a temperatura desejada e as soluções que precisam de alterações ou pre-aquecimento são preparadas adequadamente.
- Preparar o tampão lise enzimática (ELB) da seguinte forma: faça uma solução com 20 mM de Tris-Cl, EDTA de sódio 2 mM e 1,2% Triton X-100. Ajuste o pH para 8,0. Imediatamente antes de usar o ELB, adicione lisozima para uma concentração final de 20 mg/mL.
- Pre-pese os tubos do grânulo granada na balança analítica com as tampas removidas.
Nota: Isto é feito para que se o peso exigido é ultrapassado, é mais fácil de remover o conteúdo intestinal. - Corte os intestinos em pequenos segmentos usando um bisturi descartável estéril e colher os segmentos desejados para os tubos de pré-pesados grânulo de Granada.
Nota: Certifique-se de alterar bisturis entre cada amostra como DNA é onipresente e pode afetar os resultados PCR. - Adicionar 1 mL de ELB com lisozima (da etapa 6.1) para cada tubo, coloque sobre o batedor de grânulo num Vortex e executar a configuração máxima (14) por 5 minutos.
- Uma vez que o tecido é interrompido, transferir os tubos para banho-maria a 37° C e incube por 30 minutos.
Nota: Este passo é feito para ativar lisozima e induzir a discriminação de peptidoglicanos da parede celular de bactérias gram-positivas. - Prepare os tubos com 20 µ l de Proteinase K para cada amostra em uma concentração de 600 mAU por mL.
- Centrifuga os tubos a 400 x g durante 10 minutos. O lisado deve olhar claro com algum resíduo de tecido em cima os grânulos.
- Transferência de 180 µ l do sobrenadante (fase superior) num tubo contendo Proteinase K e adicione 200 µ l de tampão de AL para o tubo. Vórtice por 15 s para misturar.
- Colocar os tubos no bloco de aquecimento a 56 ° C durante 10 minutos.
- Adicionar 200 µ l de etanol 100% para o tubo e misture vortexing por 15 s.
- Adicione aproximadamente 600 µ l de lisado para a coluna de rotação (do kit).
- Centrifugue a 8.000 x gde 1 minuto. Descarte a fluir.
- Repita a etapa 6.12 até o lisado foi elaborado através da coluna.
- Coloque a coluna em um novo tubo de coleta. Adicione 500 µ l de buffer AW1 e centrifugar a 8.000 x g por 1 minuto.
- Descarte a fluir. Adicione 500 µ l de buffer AW2 e centrifugar a 8.000 x g durante 3 min.
- Descartar o fluxo através de e centrifugar a coluna em um tubo vazio coleção a 8.000 x g durante 3 min.
- Transferi a coluna para tubo de eluição do DNA. Acrescente 60 µ l de água ultrapura de PCR grau directamente sobre a membrana e incube por 2 minutos à temperatura ambiente.
- Use a água de eluição previamente aquecido a 37 ° C para eluir. A eluição pode ser feita por duas vezes usando metade do volume de eluição final e repetir passo 6.15 duas vezes para aumentar o rendimento.
- Centrifugar por 1 minuto a 8.000 x g para Eluir o DNA.
- Medir a concentração do DNA eluído utilizando o método de quantificação desejado. O rendimento do processo de extração está na faixa de 10 a 40 ng / µ l de DNA.
- Armazenar o DNA eluted a-20 ° C.
7. qPCR instalação
- Condições do PCR
- Ligar a máquina e carregar o programa no quadro 1 em uma máquina do tempo real qPCR.
- As etapas 3 a 5 na tabela 1 de loop para 40 ciclos e segurar a amostra a 4 ° C, no final da reação.
- Instalação experimental de PCR
- Use os primers e temperatura encontrados na tabela 2. Use as concentrações e condições de reação encontradas na tabela 3. Configure cada reação em triplicado para controle de variação processual.
- Coloque a tubos/placa do PCR reação no sistema qPCR e a executar o programa carregado no sistema da etapa 7.1.
- Remover o tubo no final da corrida, colocá-lo em 4 ° C e prepare-se para o carregamento de gel.
8. quantificação da colonização de LP
- Prepare misturas de qPCR para 10 µ l ou 20 µ l reações, de acordo com a tabela 3.
- LP genomic DNA curva padrão 107 a1 10 cópias / µ l
Nota: Desde ser banhado a 4 µ l de cada diluição, 107 cópias em 4 µ l ou 2,5 x 106 cópias por µ l é necessário o estoque inicial. Use o mesmo princípio para o resto da curva.- Preparar uma diluição de 1:4:107 cópias por µ l em 50 µ l.
3.147 µ l de LPDNA + 46.85 µ l de dH2O = 2,5 x 106 cópias por µ l - Serialmente diluir 10-fold: Adicione 5 µ l de 45 µ l dH2O para 1,25 x 105 cópias / µ l.
- Placa 4 µ l por diluição por bem.
- Preparar uma diluição de 1:4:107 cópias por µ l em 50 µ l.
- Visualização dos amplicons LP
- Use um gel de agarose 2% para chegar a uma clara separação entre o ~ 197 fragmento amplificado LP de bp.
- Carrega 9 µ l de cada produto PCR no gel.
- Funcione o gel durante 30 minutos a 120 V.
Resultados
A singularidade deste método baseia-se na sua adaptação da técnica gavaging para o tamanho e a fragilidade de um rato neonatal. A seção anterior descreveu os passos importantes na realização de um procedimento bem sucedido gavage em um mouse de 2 DOL. Para estabelecer uma escala de quantificação de boa, uma curva padrão foi gerada usando o DNA de LP puro com três repetições de técnicas (Figura 2). A curva padrão fornecido uma gama dinâmica de detecção de DNA do LP usando as primeiras demão. A gama dinâmica estava entre 7 e 28 ciclos onde um intervalo de 101 107 cópias de DNA LP foi detectado. O declive constante da curva padrão representado a eficiência e a escalabilidade da reação.
O procedimento de gavage IE tem sido utilizado em ratos adultos, com relativa facilidade. No entanto, o trato gastrointestinal superior de um rato neonatal é frágil e necessários movimentos calibrados do gavage agulha durante o procedimento. Gavages repetidas poderiam aumentar as chances de irritação intraesofágica, lesão e falha ou rejeição pela barragem devido a manipulação. Assim, foram testadas duas agendas diferentes gavaging e a colonização intestinal foi quantificada utilizando DNA de todo intestino homogenates. Os ratos foram gavaged de DOL 2 a 8 DOL com probiótico administrado diariamente ou a cada dois dias (Figura 3). Cada amostra continha uma técnica replicar e cada Estado tinha pelo menos duas réplicas biológicas. Os filhotes gavaged todos os dias com 7 doses tinham cerca de 103 cópias do LP enquanto os filhotes gavaged com 4 doses a cada dois dias tinham cerca de 105 cópias. A consistência dos resultados entre as repetições adicionar crédito à precisão da técnica. Havia mais LP detectado nos intestinos dos filhotes gavaged em dois dias, em comparação com filhotes que foram gavaged todos os dias. Dada esta, experimentos posteriores foram criados com uma cronograma de gavage de todos os outros dias como também reduz o estresse para os filhotes.
É importante evitar intraninhada probiótico contaminação cruzada quando se trabalha com probióticos. A microbiome de littermates era esperado para ser semelhante como partilham a mesma mãe e ambiente de aninhamento. Isto prova que um problema para estudos de probiótico se as condições de tratamento e controle estiveram presentes dentro da mesma ninhada, como o organismo probiótico tem o potencial para se tornar parte da microbiota ("colonização espalhar '). Para determinar se um probiótico vai contaminar e colonizar littermates sem tratamento, metade de uma ninhada foi gavaged como acima e os intestinos foram coletados para qPCR. QPCR intestinal análise de DOL 10 ratos mostrou esperada de amplificação de DNA de LP nos ratos gavaged, mas também, em menor grau nos littermates não-gavaged (Figura 4). Os intestinos dos ratos DOL mesmos de uma gaiola não tratada não mostraram amplificação ou amplificação mínima em ciclos maiores que 32. Isto forneceu a evidência para a partilha comum do microbiome dentro de uma ninhada numa jaula. Assim, para experiências com probióticos os grupos de tratamento devem ser separados por gaiolas de controle para variabilidade através de contaminação cruzada. A utilização de barragens adotivas pode considerar-se um experimento vai ser criado dentro de um cenário de maca, mas confundindo efeitos como cuidados diminuído da barragem de acolhimento e rejeição deve ser avaliada e otimizada para. Quando os ratos gavaged até 8 DOL foram deixados sem tratamento durante seis dias e o DNA intestinal foi analisado no DOL 14, cerca de 10 cópias do LP foram encontradas (Figura 5). Assim, a colonização do LP foi encontrada para ser transitória e detectável população diminuiu ao longo do tempo.
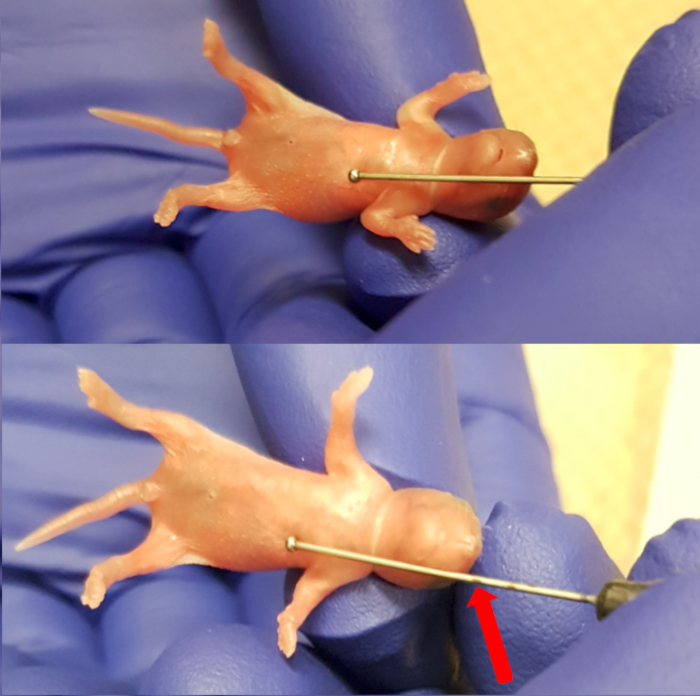
Figura 1 . Medir o comprimento entre o processo xifoide (extremidade inferior do esterno) e o focinho tornar máxima inserção da agulha de marcação. Clique aqui para ver uma versão maior desta figura.
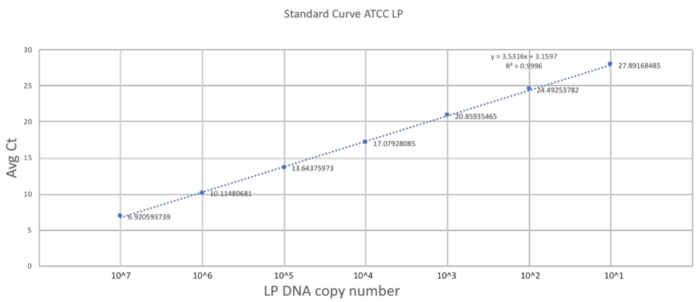
Figura 2 . Curva padrão estabelecida usando LP primers e ATCC LP DNA. Uma diluição serial do ATCC LP DNA foi feita para estabelecer o alcance dinâmico detectável para os primers utilizados no estudo. Clique aqui para ver uma versão maior desta figura.
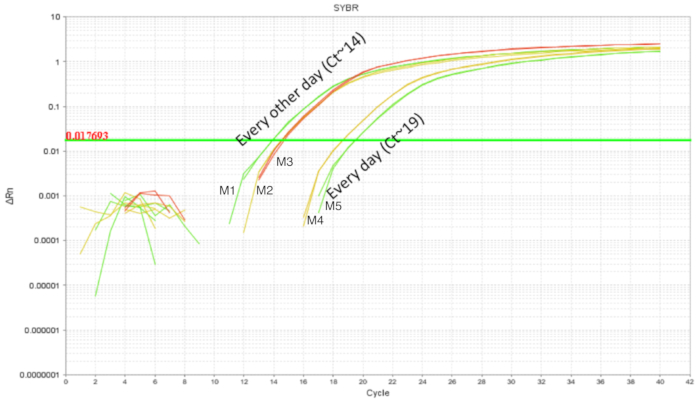
Figura 3 . Amplificação de LP do DNA intestinal de DOL 10 filhotes tratados entre DOL 2 e 8 DOL em gavages regulares todos os dias (7 doses) e todos os outros dias (4 doses). Gavaging todos os outros dias mostrou maior LP intestinal em comparação com gavaging todos os dias. Clique aqui para ver uma versão maior desta figura.
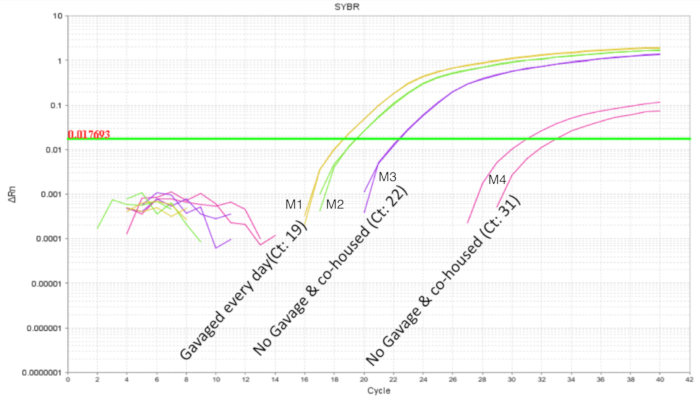
Figura 4 . Amplificação de LP do DNA intestinal de DOL 10 filhotes com 2 tratados e 2 não for tratada em uma ninhada de 4 filhotes. A gavagem foi entre DOL 2 e 8 DOL em gavages programadas todos os dias (7 doses). O probiótico dois tratados filhotes mostrar o perfil de amplificação esperado. Os filhotes não tratados mostram amplificação variável de LP indicando a partilha comum do organismo probiótico dentro de uma ninhada. Clique aqui para ver uma versão maior desta figura.
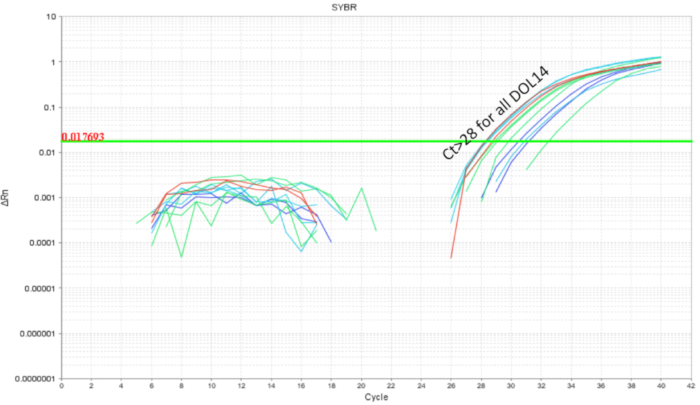
Figura 5 . Amplificação de LP do DNA intestinal de DOL 14 filhotes tratados entre DOL 2 e 8 DOL em gavages regulares todos os dias (7 doses) e todos os outros dias (4 doses). As LP gotas de carga abaixo de apuramento indicando ciclo 28 de LP ao longo de 6 dias post última gavagem de probiótico. Clique aqui para ver uma versão maior desta figura.
| Passo | Temperatura | Tempo |
| 1 | 50 ° C | 2 minutos |
| 2 | 95 ° C | 3 minutos |
| 3 | 95 ° C | 30 segundos |
| 4 | 58 ° C | 30 segundos |
| 5 | 72 ° C | 30 segundos |
Tabela 1. condições de amplificação qPCR. A temperatura e o número de condições de ciclo para a reação de PCR.
| Alvo | Região intergênica espaçador de 16s-23S |
| Tamanho do fragmento esperado | 144 bp |
| Primeira demão Tm | 58˚C |
| Cartilha para a frente (FP) | LPN-1: ATC TGG ACC TCC TTT CTA AGG AAT |
| Primeira demão reversa (RP) | LPN-2: TGT TCT CGG TTT CAT TAT GAA AAA ATA |
Tabela 2. Detalhes dos componentes da reação qPCR. Os detalhes sobre os primers, sua temperatura do recozimento e o tamanho do fragmento esperado na reação de PCR.
| Concentração | Reação de 10 µ l | Reação de 20 µ l | |
| Modelo de DNA | 200 pg / µ l | 1 Μ l | 1 Μ l |
| SYBR Master Mix | - | 5 Μ l | 10 Μ l |
| FP | 10 ΜM | 0,3 Μ l | 0,6 Μ l |
| RP | 10 ΜM | 0,3 Μ l | 0,6 Μ l |
| O dH2 | - | 3.4 Μ l | Μ l 8.8 |
Tabela 3. Por reação volumes e concentrações. A concentração dos reagentes e volumes para reações.
Discussão
O procedimento de gavage IE foi desenvolvido para administrar com segurança uma dose específica de um probiótico para camundongos neonatais. Pequenas quantidades de líquido são entregues ao tracto gastrointestinal superior usando uma agulha de alimentação para evitar a aspiração, garantindo a entrega da dose de confiança. Os intestinos dos ratos foram coletados para análise de colonização dois e seis dias post gavage. O procedimento para extração de DNA foi modificado para garantir alto rendimento do organismo Gram-positivas de probiótico. A qPCR análise do DNA extraído dois dias post último gavagem mostrou relativamente maior colonização de LP em camundongos gavaged em dois dias, em comparação com os ratos gavaged todos os dias entre DOL 2-8. Houve também uma diminuição na quantidade de LP durante seis dias, mostrando este probiótico para ser um organismo transiente no intestino do rato. Os resultados destes experimentos estabelecem as condições para realizar pesquisas com elevado rigor neste grupo etário.
Para observar os efeitos a longo prazo dos probióticos em camundongos neonatais, foi administrado a ratos neonatais em DOL 2; um tempo de partida semelhante, aponte para o julgamento humano. Alimentação da orofaringe dos ratos neonatais é descrito anteriormente na literatura e foi realizada somente após DOL 5-812,17 quando o risco de aspiração é menor devido a uma mecânica de deglutição bem desenvolvida. No entanto, alimentação da orofaringe não é adequado para DOL 2 ratos como taxas mais elevadas de aspiração foram observadas no estudo piloto (dados não mostrados). A natureza viscosa do probiótico e prebiótica solução adicionado ao risco de aspiração. Seguir o procedimento de gavaging IE minimizado o risco de aspiração em DOL 2 ratos ao entregar o volume desejado diretamente para o trato gastrointestinal superior. O sucesso do procedimento foi primeiro validado usando corante alimentício infundido gavage probiótico. A coloração de alimento atua como um marcador que é visível através da pele do filhote. Sem efeitos negativos foram observados em ratos gavaged com corante alimentar, e é recomendável para validar o procedimento de gavaging desta forma antes de iniciar as experiências em larga escala. A resolução rápida do ofegante gavage reflexo visto post também pode ser usada como um indicador adicional para uma bem sucedida gavage. Uma vez que o mouse é colocado sobre o cobertor térmico pós-gavage, o reflexo ofegante vai diminuir e um aumento da frequência de respiração será observado dentro de 20 segundos. A continuação do reflexo ofegante durante mais de 30 segundos indica uma falha gavage. Gavage sucesso também depende de adequada inserção da agulha alimentação com o bulbo sentado bem em cima da abertura do esfíncter cardíaco do estômago. Isto pode ser facilitado, garantindo que a marcação na agulha medindo o comprimento entre o processo xifoide e a ponta do focinho, não passar o focinho do rato durante a intubação. Isso minimiza a chance de lesão para o mouse. A frequência de gavage pode ter um impacto significativo sobre os resultados experimentais. Gavaging frequente também pode criar mais stress para os filhotes e a mãe devido a constante perturbação da gaiola e do ninho. O cronograma de gavage mais ideal é quando os gavages são as menos frequentes e em uma duração mais curta de tempo sem perder o efeito esperado no sistema. Para garantir a segurança e a esterilidade do procedimento o gavage agulha deve ser esterilizada por lavagem e uso nas entrelinhas de autoclavagem. Lavagem com rigor sobre o exterior usando um esfoliante e dentro, forçando a água através da agulha, utilizando uma seringa antes da autoclavagem é necessária como qualquer sobras partículas podem encrust na agulha durante a autoclavagem e podem interferir com o processo de gavaging.
Maior colonização LP foi observada em filhotes que estavam gavaged cada outro dia, quando comparado aos filhotes gavaged todos os dias. Isto pode ser devido o esforço reduzidos em filhotes gavaged todos os dias e, potencialmente, o probiótico ficando mais nutrientes através do leite relativamente mais ingerido por esses filhotes. A dependência da dose de tratamento probiótico foi estudada anteriormente no rato modelos18,19 , e, portanto, a administração da dose correta é importante. Probiótico solução preparada é chapeada antes cada gavagem para obter uma contagem exata de UFC administrado. Se o organismo probiótico é anaeróbico, é importante ver se há diferença na UFC quando cultivadas por via aeróbia ou anaeróbia. Desde que o LP é um anaerobe facultative, ele foi cultivado usando ambos os métodos e não no UFC foi observada diferença.
A análise de carga do post gavage intestinal LP foi feita usando amostras de DNA de qPCR e alta qualidade. Para minimizar a contaminação de DNA LP entre o tratamento e os grupos de controle, diferente de alimentação agulhas, armários de segurança biológica e equipamentos cirúrgicos foram usados para assegurar amostras de qualidade mais alta. A medida exata do probiótico no intestino necessário um método de extração de DNA otimizado. Métodos mais eficientes para a extração de DNA de fezes envolve múltiplos do grânulo batendo passos20,21,22. Esse método foi adotado para a extração de bactérias intestinais usando o espancamento do grânulo e observado a representação diminuída (< 10 cópias de2 recuperadas) de LP na extração de DNA a todo o intestino. Como LP é um organismo de Gram positivo com uma quantidade substancial de peptidoglicano na parede celular, o protocolo foi otimizado com uma etapa de dissolução de peptidoglicano usando lisozima23,24 adicionado para a Lise enzimática. Isto aumentou a representação da LP na mesma amostra intestinal maior que duas vezes. O tratamento de lisozima garante a dissolução da camada externa enquanto o grânulo batendo passo facilita a lise do organismo. Otimização da quantidade de tecido, o tipo de grânulo de Granada e a duração das interrupções usando os grânulos são necessários para a obtenção de produtos de DNA ideais para realizar a análise PCR.
O impacto positivo dos probióticos administrados como profilaxia ou tratamento nos recém-nascidos pré-termo e termo é evidenciado em recentes estudos25,26,,27,28. O estabelecimento de um modelo de mouse neonatal adequado para probióticos é garantido para descompactar o efeito protetor de probióticos. Este protocolo descrito aqui representa um guia para os investigadores não familiarizados com o trabalho de rato neonatal usando probióticos. Não obstante os problemas com roedor microbiota enquanto estudava a doença e a saúde humana, esse método pode ser estendido para pesquisa focada em entender as mudanças da microbiome devido probióticos. Este modelo também fornece uma plataforma para estudar a interação do anfitrião-micróbio e respostas imunes ao longo dos diferentes estádios de desenvolvimento.
Divulgações
Não há conflito de interesses para divulgar.
Agradecimentos
Obrigado ao pessoal da facilidade de cuidado Animal e os veterinários UBC para treinamento e auxiliando o mouse funcionam no Instituto de pesquisa do Hospital infantil de BC. Graças a Universidade da Colúmbia Britânica e o departamento de Medicina Experimental para o estudo de financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
Referências
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados