Method Article
Studi di probiotici in topi neonatali tramite sonda gastrica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio dettaglia il processo di quantità precisa di gavaging di probiotici per topi neonatali. Il set-up sperimentale è stato ottimizzato per includere ma non è limitato ai probiotici di dosaggio, metodi di somministrazione e la quantificazione dei batteri nell'intestino.
Abstract
Modelli di topo adulto sono stati ampiamente utilizzati per comprendere il meccanismo dietro la progressione della malattia in esseri umani. L'applicabilità di studi condotti in modelli di topo adulto per malattie neonatali è limitato. Per comprendere meglio la progressione della malattia, le risposte ospite e impatto a lungo termine degli interventi in neonati, un modello di topo neonatale probabile è una migliore vestibilità. L'uso di tipo sparsa di modelli murini neonatale può essere attribuito in parte per le difficoltà tecniche di lavorare con questi piccoli animali. Un modello del topo neonatale è stato sviluppato per determinare gli effetti della somministrazione di probiotici nella vita in anticipo e per valutare in particolare la capacità di stabilire la colonizzazione del tratto intestinale neonato mouse. In particolare, per valutare la colonizzazione di probiotici nel topo neonatale, Lactobacillus plantarum (LP) è stato consegnato direttamente nel tratto gastrointestinale del mouse neonatale. A tal fine, LP è stato amministrato ai topi di alimentazione mediante sonda gastrica (IE) intra-esofageo. Un metodo altamente riproducibile è stato sviluppato per standardizzare il processo di "gavage" IE che permette un'accurata somministrazione di probiotici dosaggi riducendo al minimo il trauma, un aspetto particolarmente importante dato la fragilità di topi neonati. Limitazioni di questo processo includono la possibilità di irritazione esofagea o di danni e di aspirazione se gavaged in modo non corretto. Questo approccio rappresenta un miglioramento sulle attuali pratiche perché "gavage" IE nell'esofago distale riduce le possibilità di aspirazione. In seguito "gavage", il profilo di colonizzazione del probiotico è stato tracciato usando reazione a catena della polimerasi quantitativa (qPCR) del DNA Estratto intestinale con primers specifici LP. Cucciolata di diverse impostazioni e tecniche di gestione della gabbia sono state utilizzate per valutare il potenziale per colonizzazione-diffusione. Il protocollo dettaglia la complessità della sonda gastrica del mouse neonatale di IE e la successiva colonizzazione quantificazione con LP.
Introduzione
In infanti, esposizione precoce di probiotici è stata associata con effetti immunomodulatori che conduce alla ridotta incidenza di malattie come necrotizzarsi enterocolite, dermatite atopica e sepsi1,2,3, 4 , 5. Tuttavia, il meccanismo dietro questa risposta immunomodulatoria è una sfida per esplorare data la limitazione di campionamento nelle prove umane neonate (cioè, estrazioni sequenziali sangue e biopsie). Modelli murini neonatale possono aiutare a studiare il meccanismo di azione coinvolti nella regolazione immunitaria neonatale connessa con uso probiotico e cambiamenti nel microbiota intestinale. Purtroppo, la maggior parte dei modelli del mouse per i probiotici hanno principalmente focalizzato su topi adulti; Tuttavia, l'impatto dei probiotici è probabile essere più presto nella vita, suggerendo modelli specifici per questo gruppo di età sarà utile3,6. Inoltre, i modelli murini neonatale sono più adatte per studiare malattie e interventi destinati all'applicazione nei primi anni di vita i neonati umani come dovrebbero imitare più molto attentamente un'in via di sviluppo di sistema immunitario e microbica7,8 ,9,10. Lo scopo era di studiare gli schemi di probiotici colonizzazione di topi neonatali con un focus sull'interazione tra l'host e sua microbiome meccanicistico e misura. Adatte descrizioni dei modelli neonati non sono state trovate nella letteratura, e così è stata indirizzata una necessità per lo sviluppo del metodo robusto e standardizzato.
Metodi consolidati della somministrazione orale di vari composti a topi neonati includono il trasferimento materno di composti desiderate attraverso il latte trattare la fonte di acqua per dighe incinta11 o utilizzando aghi d'alimentazione per facilitare la somministrazione di composti desiderate nella orofaringe12. Questi metodi sono utili per gli esperimenti che non hanno requisiti di dosaggio preciso e dove il trattamento è prontamente ingerito dal destinatario mouse. I probiotici sono spesso somministrati in combinazione con un prebiotico come galactooligosaccharide e fructooligosaccharide (FOS) che servono come una fonte di nutrimento per i batteri probiotici; questi composti additivi rendono la soluzione viscoso e difficile da amministrare tramite le metodologie di cui sopra. Elaborazione di una metodologia per amministrare la precisa quantità di probiotici e prebiotici per topi neonati a partire fin dal primo giorno di vita (DOL) era necessario. Nel processo di sviluppo la tecnica sonda gastrica, la possibilità di colonizzazione-diffusione (come osservato in altri studi di probiotici fra il trattamento ed il controllo armi13,14,15,16) è stato testato e l'abbondanza relativa di colonizzate Lactobacillus plantarum (LP) nell'intestino dei cuccioli con orari diversi sonda gastrica è stata valutata. La preparazione di probiotici utilizzata negli esperimenti consisteva di9 in 10 unità formanti colonie (CFU) per sonda gastrica del LP (ceppo ATCC-202195), mescolato con FOS (prebiotico) e maltodestrine (eccipiente), come descritto nella recente prova umana3. La consegna di probiotici è stata compiuta tramite sonda gastrica IE e il processo è descritto nel protocollo sottostante. Il profilo di colonizzazione del probiotico è stato valutato usando tempo reale amplificazione del DNA Estratto da intero intestino utilizzando primers specifici LP.
Protocollo
Tutte le procedure sono state effettuate riguardanti le linee guida stabilite dal personale di supporto presso l'Animal Care Facility presso la University of British Columbia e tutte le procedure sono state approvate dal Comitato cura animale UBC.
1. quantificazione dei probiotici amministrati
Nota: Questo passaggio è consigliato per determinare l'esatta quantità di probiotici CFU che può essere somministrato in dose singola. La quantità di probiotici e veicolo (FOS e maltodestrina) determinare le condizioni di saturazione della soluzione. Dall'esperienza, non più di 30 µ l (~ 20 mL / kg) del fluido può essere somministrato a topi su DOL 2 qualsiasi volume maggiore aumenta il rischio di aspirazione.
- Preparare sei provette per microcentrifuga da 1,5 mL per diluizioni seriali con ogni provetta contenente 180 µ l di soluzione fisiologica sterile destrosio 5%.
- Pesare un'aliquota di 0,2 g di una miscela di probiotico-prebiotico e scioglierla in 1 mL di soluzione fisiologica destrosio 5% in maniera sterile.
- Vortex per 30 secondi e pipetta rompere i grumi. Ripetere fino a quando non visibili grumi sono osservati.
Nota: Maltodestrina rende la soluzione viscoso e contribuire alla saturazione della soluzione. - Eseguire una diluizione seriale utilizzando tubi preparate al punto 1.1. Vortice di mescolare.
- Piastra 40 µ l di ogni diluizione su un quadrante coniugato della piastra di agar di MRS. Piastra di ciascuna diluizione.
- Incubare sotto anaerobico (o microaerofili) Condizioni a 37 ° C per 48 h in un barattolo vuoto utilizzando una confezione di gas.
- Contare ogni piatto in un raggio di 20-70 colonie per quadrante. Piatto medio conta con la stessa diluizione e calcolare Torna alle unità desiderate.
2. preparazione di probiotici e prebiotici per sonda gastrica
Nota: La corretta dissoluzione di probiotici e prebiotici è necessaria garantire liscio iniezione di liquido attraverso l'ago di alimentazione durante l'alimentazione mediante sonda gastrica.
- Combinare la quantità necessaria di probiotici liofilizzati organismo con i valori desiderati di prebiotici e veicolo in una microcentrifuga sterile.
- Aggiungere la quantità appropriata di solvente (soluzione salina destrosio di 5%) per sciogliere la miscela probiotico-prebiotico.
Nota: La capacità di dissoluzione è limitata dal prebiotico e veicolo usato. Dall'esperienza, la combinazione di synbiotic (con FOS e maltodestrina) raggiunto la saturazione a circa 0,3 g/mL durante la dissoluzione in un tubo del microcentrifuge da 2 mL con 1 mL di solvente. - Vortice di mescolare fino a quando tutti i solidi disciolti. Utilizzare una pipetta per rompere i globuli di particelle solide nel solvente pipettando su e giù.
- Incubare la soluzione in bagnomaria a 37 ° C per 20 min.
Nota: Questo passaggio può essere ignorato se la soluzione probiotico-prebiotico è creata da una cultura dal vivo. - Piastra una serie di cinque diluizione 10 volte su piastre di agar di MRS prima sonda gastrica per quantificare con precisione il probiotico somministrato per il cucciolo. Questo passaggio può essere ignorato se il conteggio accurato dei CFU non è necessario.
3. preparazione della di biosicurezza
- Utilizzare un armadio di sicurezza biologica quando si lavora con i probiotici per mantenere una tecnica asettica. Impostare la gabbia con le dighe e i cuccioli su una coperta di riscaldamento (insieme a circa 38 ° C) su una metà della coperta. Posizionare una gabbia animale pulita, vuota sull'altra metà della termocoperta.
- Posto un assorbente disinfettato o sterile, tampografia sulla termocoperta per tendono al mouse durante l'alimentazione mediante sonda gastrica.
- Raccogliere il materiale di nidificazione per i cuccioli dalla parte superiore del nido esistente, diga-creato e creare una nuova Coppa conica nidificazione utilizzando le mani guantate, disinfettati con etanolo al 70% e secchi. Posto questo nuovo nido nella gabbia che tiene pulito, vuoto. Questo facilita il trasferimento del profumo del nido per le mani guantate e quindi riduce al minimo l'introduzione di altri profumi sul cucciolo durante la loro manipolazione per la procedura, riducendo il rischio di cannibalizzazione.
- Spostare i cuccioli nel nido conico holding gabbia e rimuovere la gabbia con la diga dal cabinet. Questo riduce lo stress per la diga, impedendo di sentire i cuccioli durante la procedura.
Nota: Se il probiotico è un noto colonizzatore dell'intestino murino, le condizioni di trattamento devono essere separate da gabbie o biosicurezza anche diversa armadi per evitare la possibilità di attraversare la colonizzazione.
4. Intra-esofageo gastrica del mouse neonatale
- Aprire la confezione della siringa per un facile accesso. Aprire l'imballaggio dell'ago in modo sterile e allegarlo alla testa della siringa. Lavare l'ago con etanolo al 70% ed autoclave prima della procedura. Utilizzare diversi set di aghi per il trattamento e il gruppo di controllo per evitare la contaminazione.
- Disegnare un po' più che la quantità desiderata di probiotici-colorante soluzione nella siringa. Tenere la siringa rivolta verso l'alto. Quindi tirare verso il basso ulteriore e scorri con il dito per sloggiare le bolle e spingere lo stantuffo per espellere le bolle e il volume extra liquido finché non viene raggiunto il volume desiderato. Questo assicura che non c'è spazio di aria nell'ago. Per mouse DOL 2, il volume di alimentazione mediante sonda gastrica non deve superare 30 µ l.
- Posto il cucciolo sul tampone assorbente sterile sopra il dissipatore di calore. Utilizzare l'ago d'alimentazione (24 Gauge, 1" lunghezza dell'ago, 1,25 mm di diametro di sfera) esternamente per misurare la lunghezza dell'esofago mettendo la palla dell'ago appena sotto il processo xifoideo (estremità inferiore dello sterno). Contrassegnare l'ago a livello del muso notare il limite di inserimento dell'ago (Figura 1). Osservare il cucciolo per segni di salute, che comprendono respiro regolare e colorazione rosa della pelle.
- Immergere la punta dell'ago nel tuffantesi solvente (soluzione salina di destrosio 5% o - il mezzo usato per sciogliere il probiotico e pre-biotico) per lubrificare le superfici esterne dell'ago d'alimentazione. Questo facilita l'entrata liscia dell'ago nell'esofago del mouse.
- Sollevare il cucciolo per la collottola o tenendo delicatamente la testa e il corpo tra il pollice e il dito indice. Garantire la testa, collo e corpo sono tenuti in una posizione diritta. Non tenere il cucciolo per la collottola per più di 60 s come c'è un rischio di ostruzione della trachea che conduce al soffocamento. Assicurarsi che il cucciolo può respirare. Segni di scruffing troppo duro possono includere incapacità di respirare, ansimante significativa e la linguetta estesa dalla bocca. Monitorare il pup colore e respirazione durante l'intera procedura.
- Inserire la lampadina dell'ago al centro della bocca del cucciolo verso l'aereo del torso con un'angolazione di 45°, fino a quando raggiunge la parte posteriore della gola.
- Delicatamente cambiare l'angolo dell'ago facendo perno sul bulbo dell'ago e la siringa in movimento lontano dalla persona gavaging (verso il lato dorsale del cucciolo) fino a quando è parallelo al piano della colonna vertebrale del pup. Scruffing il cucciolo aiuta a mantenere l'ago in posto nella parte posteriore della gola e inoltre impedisce che il mouse si dimenava. Assicurarsi che la palla dell'ago non avanzare o esercitare qualsiasi pressione contro la parte posteriore della gola durante il cambiamento di angolo.
- Se il mouse tenta di ingoiare l'ago, lasciarla naturalmente far scorrere verso il basso e arrestare il movimento quando la marcatura sull'ago si allinea con il muso. La siringa e l'ago sono solitamente abbastanza pesante per scivolare giù la dovuta alla gravità. Supporto il peso dell'ago in ogni momento così l'ago scivola facilmente giù l'esofago con nessuna pressione verso il basso dalla persona che effettua l'alimentazione mediante sonda gastrica.
- Se l'ago incontra resistenza nella parte posteriore della gola, ritirare l'ago sonda gastrica leggermente per sloggiare la palla dell'ago e ri-angolo l'ago all'interno della bocca verso sinistra del mouse (destra del gestore) lentamente in piccoli, incrementi di 1 mm. L'ago dovrebbe iniziare a far scorrere facilmente giù l'esofago.
- Se l'ago si ferma prima della marcatura sul ferro raggiunga la bocca, non iniettare la soluzione.
- Non tenere l'ago inserito per più di 20 s. In questo caso, ritirare l'ago lentamente, mantenendo la siringa parallelo al torso e lasciare che il cucciolo riposare su carta assorbente per 30 s a 1 min gavaging di provare nuovamente dopo aver lubrificato la superficie esterna dell'ago con il solvente.
Nota: L'anestesia non viene utilizzato per la procedura come risposta del mouse è necessario misurare il successo di "gavage".
- Quando la marcatura sull'ago d'alimentazione è sopra il muso e allineato con la punta del muso, non lasciare l'ago spostare o avanzare ulteriormente. Iniettare lentamente il volume del liquido. Se il liquido viene aspirato o osservato a bolla attraverso il naso, interrompere immediatamente l'iniezione e ritirare lentamente l'ago.
- Collocare il cucciolo in posizione verticale sul tovagliolo di carta sul pad di riscaldamento per facilitare il suo recupero. Monitorare attentamente per problemi di respirazione continua o variazioni nel colore del cucciolo che indica l'aspirazione. Eutanasia cuccioli che hanno aspirato immediatamente.
- Una volta completata la sonda gastrica, ritirare delicatamente l'ago d'alimentazione allo stesso angolo che è stato inserito. Posto il cucciolo sul tovagliolo di carta il termocuscino riscaldato. Aspetta 10 s per il cucciolo a riacquistare la normale attività e tipo di respirazione. Una tonalità rosa sana dovrebbe apparire sopra il corpo del cucciolo e la tintura deve essere visibile solo nel vano di stomaco. Riportarlo alla gabbia con gli altri cuccioli.
Nota: Il colorante blu di Gavaging è un ottimo modo per praticare la procedura sopra descritta. Se la sonda gastrica ha esito positivo, lo stomaco del mouse sarà visibile come una tonalità blu. Se il colorante blu si trova di fuori dello stomaco del cucciolo (collo, torace o regione ascellare), l'animale deve essere umanamente eutanasia (in conformità con le regole di cura degli animali), come questo indica una rottura dell'esofago o aspirazione.
5. raccolta dei campioni di intestional per l'analisi di colonizzazione
- Durante il successivo monitoraggio o gavaging, è possibile raccogliere campioni microbioma fecale da cuccioli.
Nota: Il pup frequentemente urina e defeca quando gavaged e questo tempo può essere utilizzato come un'opportunità per raccogliere i campioni fecali per analisi microbiome. - Per la terminazione degli esperimenti, raccogliere gli intestini dal duodeno al retto dopo l'eutanasia dei cuccioli. Appuntare il cucciolo ad una scheda chirurgica e disinfettare la pelle con etanolo al 70%. Tagliare via la pelle in quattro quadranti senza danneggiare lo strato peritoneale utilizzando strumenti sterilizzati con etanolo al 70% e una sterilizzazione tallone caldo a 250 ° C.
- Utilizzare un diverso insieme di strumenti sterili per tagliare il peritoneo in quattro quadranti e spostarlo lontano dal centro in modo che gli organi viscerali sono esposti.
- Individuare lo stomaco e utilizzare una pinza per pizzicare sotto lo sfintere pilorico e alla fine del retto. Eseguire la lunghezza dell'intestino con uno strumento smussato o il forcipe per snellire l'intestino e liberarla dal tessuto connettivo e tessuto mesenterico. Una volta che l'intera lunghezza dell'intestino è stata liberata del tessuto connettivo, tagliato all'estremità fissata.
- Contrassegnare il foglio di alluminio con l'orientamento dell'intestino, avvolgere in modo sicuro e congelare a-80 ° C.
Nota: La procedura di estrazione del DNA può essere effettuata a questo punto senza congelamento. La tintura blu è stato visto anche di passare attraverso l'intestino oltre 24 h e raccolta di campioni per analisi di colonizzazione sono migliore quando gli intestini sono raccolti almeno 24 ore post l'ultima sonda gastrica. Segnali potrebbero essere amplificati prima che timepoint dai batteri non aderito transitoriamente passando attraverso la miscela di alimentazione mediante sonda gastrica.
6. estrazione di DNA da intestini per analisi di colonizzazione
Nota: L'estrazione di DNA viene eseguita utilizzando un kit commerciale con ottimizzazione delle modifiche apportate al protocollo per l'estrazione di DNA dell'intestino. Assicurare l'apparecchio di riscaldamento è impostata la temperatura desiderata e le soluzioni che necessitano di modifiche o pre-riscaldamento sono preparate in modo appropriato.
- Preparare il tampone di lisi enzimatica (ELB) come segue: fare una soluzione con 20 mM Tris-Cl, 2 mM EDTA di sodio e 1,2% Triton X-100. Regolare il pH a 8.0. Immediatamente prima di utilizzare ELB, aggiungere lisozima ad una concentrazione finale di 20 mg/mL.
- Pre-pesare i tubi di granato perlina bilancia analitica con i tappi rimossi.
Nota: Questo è fatto in modo che se il peso richiesto viene oltrepassato, è più facile rimuovere il contenuto intestinale. - Tagliare l'intestino in piccoli segmenti usando un bisturi monouso sterile e scoop i segmenti desiderati nelle provette pre-pesati perlina granato.
Nota: Assicurarsi di modificare il bisturi tra ogni campione come il DNA è onnipresente e possa influire sui risultati PCR. - Aggiungere 1 mL di ELB con lisozima (dal punto 6.1) in ogni provetta, appoggiate il battitore di perlina su vortex e funzionare al massimo (14) per 5 minuti.
- Una volta che il tessuto è interrotto, trasferire le provette nel bagnomaria a 37° C ed incubare per 30 minuti.
Nota: Questo passaggio viene fatto per attivare lisozima e indurre la rottura del peptidoglicano della parete cellulare dei batteri Gram-positivi. - Preparare le provette con 20 µ l di proteinasi K per ogni campione a una concentrazione di 600 mAU / mL.
- Centrifugare le provette a 400 x g per 10 minuti. Il lisato dovrebbe apparire chiaro con alcuni residui di tessuto sopra le perline.
- Trasferire 180 µ l del surnatante (la fase superiore) in una provetta contenente proteinasi K e quindi aggiungere 200 µ l di tampone di al tubo. Vortex per 15 s a mescolare.
- Inserire le provette sul blocco riscaldamento a 56 ° C per 10 minuti.
- Aggiungere 200 µ l di etanolo al 100% nella provetta e mescolare nel Vortex per 15 s.
- Aggiungere circa 600 µ l di lisato nella colonna di spin (dal kit).
- Centrifugare per 1 minuto a 8.000 x g. Scartare il flusso attraverso.
- Ripetere il passaggio 6.12 per tutti il lisato è stato disegnato attraverso la colonna.
- Posizionare la colonna in un nuovo tubo di raccolta. Aggiungere 500 µ l di buffer AW1 e centrifugare a 8.000 x g per 1 minuto.
- Scartare il flusso attraverso. Aggiungere 500 µ l di buffer AW2 e centrifugare a 8.000 x g per 3 min.
- Scartare il flusso attraverso e centrifugare la colonna in un tubo di raccolta vuota a 8.000 x g per 3 min.
- Trasferire la colonna in provetta di eluizione DNA. Aggiungere 60 µ l di acqua ultrapura grado PCR direttamente sulla membrana e incubare per 2 minuti a temperatura ambiente.
- Utilizzare l'acqua di eluizione pre-riscaldato a 37 ° C per eluire. L'eluizione può avvenire due volte da utilizzando la metà del volume di eluizione finale e ripetendo passo 6,15 due volte per aumentare il rendimento.
- Centrifugare per 1 minuto a 8.000 x g per eluire il DNA.
- Misurare la concentrazione del DNA eluito utilizzando il metodo di quantificazione desiderata. I rendimenti del processo di estrazione sono nella gamma di 10-40 ng / µ l DNA.
- Conservare il DNA eluito a-20 ° C.
7. qPCR installazione
- Condizioni di PCR
- Accendere la macchina e caricare il programma nella tabella 1 in una macchina di qPCR di tempo reale.
- Ciclo i passaggi da 3 a 5 nella tabella 1 per 40 cicli e tenere il campione a 4 ° C alla fine della reazione.
- Setup sperimentale PCR
- Utilizzare il primer e la temperatura trovato nella tabella 2. Utilizzare le concentrazioni e le condizioni di reazione trovate nella tabella 3. Impostare ogni reazione in triplice copia al controllo per variazione procedurale.
- Posizionare i tubi/piastra di reazione di PCR nel sistema qPCR ed Esegui il programma caricato nel sistema dal punto 7.1.
- Rimuovere il tubo all'estremità della corsa, posto su 4 ° C e preparare per caricamento del gel.
8. quantificazione della colonizzazione LP
- Preparare miscele di qPCR per µ l 10 o 20 µ l reazioni secondo tabella 3.
- LP genomic DNA curva standard 107 a 101 copie / µ l
Nota: Poiché saranno piastrate 4 µ l di ciascuna diluizione, 107 copie in 4 µ l o 2.5 x 106 copie per µ l è necessaria in stock iniziale. Utilizzare lo stesso principio per il resto della curva.- Preparare una diluizione di 1:4:107 copie per µ l in 50 µ l.
3.147 µ l di LPDNA + 46.85 µ l di dH2O = 2,5 x 106 copie per µ l - In serie diluire 10 volte: aggiungere 5 µ l di 45 µ l dH2O per 1,25 x 105 copie / µ l.
- 4 µ l per diluizione ogni pozzetto della piastra.
- Preparare una diluizione di 1:4:107 copie per µ l in 50 µ l.
- Visualizzazione di ampliconi LP
- Utilizzare un gel di agarosio al 2% per raggiungere una chiara separazione del ~ 197 frammento amplificato LP di bp.
- Caricare 9 µ l di ciascun prodotto PCR nel gel.
- Esegua il gel per 30 minuti a 120 V.
Risultati
L'unicità di questo metodo si riposa nel suo adattamento della tecnica gavaging per la dimensione e la fragilità di un mouse neonatale. La sezione precedente ha descritto i passi importanti nello svolgimento di una procedura di successo "gavage" DOL 2 del mouse. Per stabilire una scala di buona quantificazione, una curva standard è stata generata utilizzando il DNA puro LP con tre replicati tecnici (Figura 2). La curva standard fornito una gamma dinamica di rilevamento del DNA LP utilizzando i primers. La gamma dinamica è tra 7 e 28 cicli dove una serie di 101 107 copie di DNA LP è stato rilevato. La costante pendenza della curva standard rappresentato l'efficienza e la scalabilità della reazione.
La procedura di "gavage" IE è stata utilizzata in topi adulti con relativa facilità. Tuttavia, tratto gastrointestinale del mouse neonatale è fragile e movimenti richiesti calibrati della sonda gastrica dell'ago durante la procedura. Ripetute alimentazioni mediante sonda gastrica potrebbe aumentare la probabilità di irritazione intra-esofageo, lesioni e guasti o rifiuto dalla diga a causa della gestione. Così, due orari diversi gavaging sono stati testati e la colonizzazione intestinale è stata quantificata utilizzando il DNA da omogeneati dell'intero intestino. Topi gavaged da DOL 2 a DOL 8 con probiotico somministrato ogni giorno o ogni due giorni (Figura 3). Ogni campione conteneva un tecnico replicare e ogni condizione aveva almeno due repliche biologiche. I cuccioli gavaged ogni giorno con 7 dosi avevano circa 103 copie del LP, mentre i cuccioli gavaged ogni due giorni con 4 dosi ha avuto circa 105 copie. La consistenza dei risultati tra la replica di aggiungere credito la precisione della tecnica. Non c'era più LP rilevato negli intestini dei cuccioli gavaged ogni due giorni rispetto ai cuccioli che gavaged ogni giorno. Dato questo, esperimenti successivi sono stati istituiti con un programma di alimentazione mediante sonda gastrica di ogni altro giorno come si riduce anche lo stress per i cuccioli.
È importante evitare intra-cucciolata probiotico contaminazione incrociata quando si lavora con i probiotici. Il microbioma di littermates doveva essere simile come condividono la stessa madre e l'ambiente di nidificazione. Questo dimostra un problema per gli studi di probiotici, se le condizioni di trattamento e controllo erano presenti all'interno della stessa cucciolata come organismo probiotico ha il potenziale per diventare una parte del microbiota ("colonizzazione diffondere '). Per determinare se un probiotico sarà contaminare e colonizzare littermates non trattata, la metà di una cucciolata era gavaged come sopra e gli intestini sono stati raccolti per qPCR. Analisi qPCR intestinale di DOL 10 topi ha mostrato previsto l'amplificazione del DNA di LP nei topi gavaged ma anche, in misura minore nei littermates non-gavaged (Figura 4). L'intestino dei topi DOL stessi da una gabbia non trattato non ha mostrato l'amplificazione o amplificazione minima a cicli maggiore di 32. Questo fornito la prova per la condivisione comune del microbioma all'interno di una cucciolata in una gabbia. Così, per gli esperimenti con i probiotici, i gruppi di trattamento devono essere separati da gabbie a controllo per variabilità attraverso contaminazione incrociata. L'uso di dighe adottivi può essere considerato se un esperimento deve essere impostato all'interno di un'impostazione di lettiera, ma effetti di confusione come cura diminuita dalla diga di foster e rifiuto dovrebbe essere valutato e ottimizzato per. Quando i topi gavaged fino a DOL 8 sono stati lasciati non trattati per sei giorni e il DNA intestinale è stato analizzato a DOL 14, circa 10 copie del LP sono state trovate (Figura 5). Così, la colonizzazione del LP è stata trovata per essere transitoria e la popolazione rilevabile diminuita nel tempo.
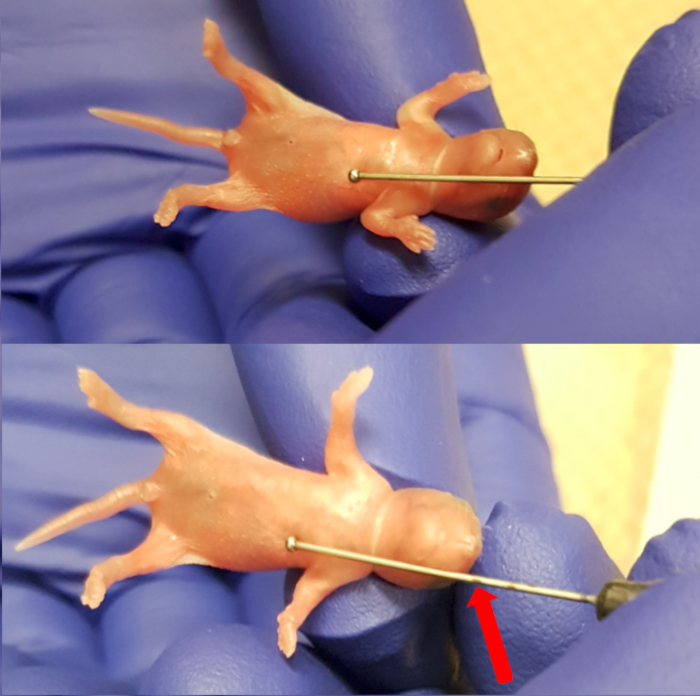
Figura 1 . Misurando la lunghezza tra il processo xifoideo (estremità inferiore dello sterno) e il muso per rendere massimo inserimento di marcatura per l'ago. Clicca qui per visualizzare una versione più grande di questa figura.
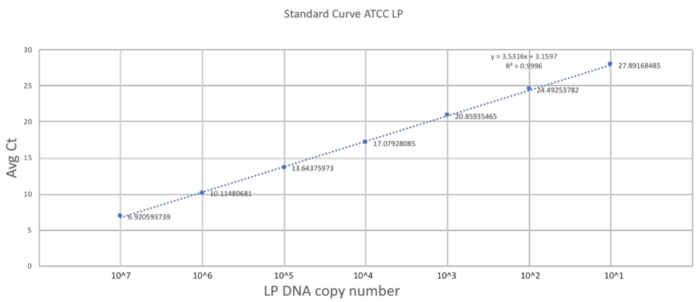
Figura 2 . Curva standard stabilita utilizzando primer LP e ATCC LP DNA. Una diluizione seriale del ATCC LP DNA è stata effettuata per stabilire la dinamica rilevabile per i primers utilizzati nello studio. Clicca qui per visualizzare una versione più grande di questa figura.
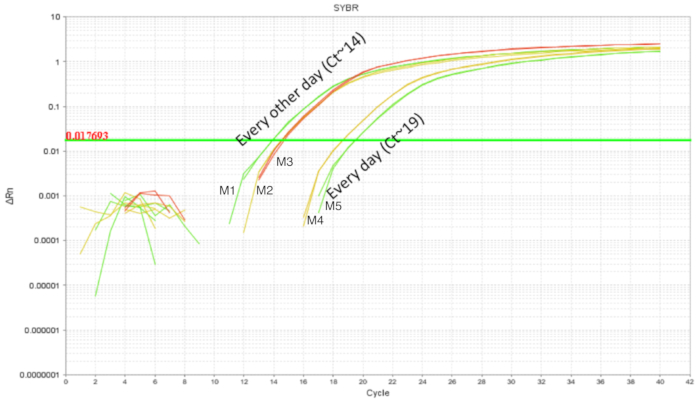
Figura 3 . Amplificazione di LP di DNA intestinale da DOL 10 cuccioli trattati fra DOL 2 e DOL 8 in alimentazioni mediante sonda gastrica pianificata ogni giorno (7 dosi) e ogni altro giorno (4 dosi). Gavaging ogni altro giorno ha mostrato LP intestinale superiore rispetto al gavaging ogni giorno. Clicca qui per visualizzare una versione più grande di questa figura.
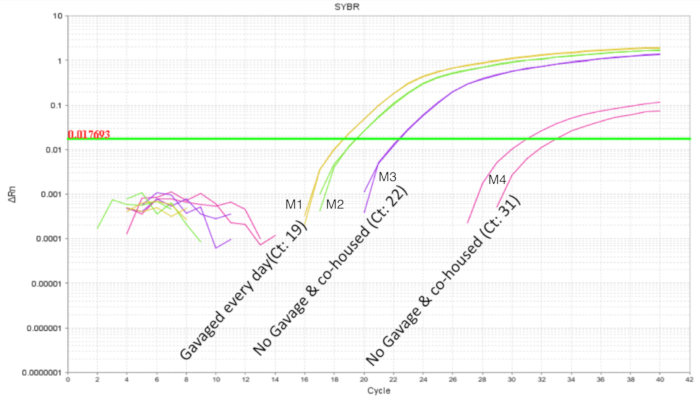
Figura 4 . Amplificazione di LP di DNA intestinale da DOL 10 cuccioli con 2 trattati e 2 non trattata in una cucciolata di 4 cuccioli. La sonda gastrica era tra 2 DOL e DOL 8 in alimentazioni mediante sonda gastrica pianificata ogni giorno (7 dosi). Il probiotico due trattati cuccioli Vedi il profilo di amplificazione previsto. I cuccioli non trattati mostrano variabile amplificazione del LP che indica la condivisione comune dell'organismo probiotico all'interno di una cucciolata. Clicca qui per visualizzare una versione più grande di questa figura.
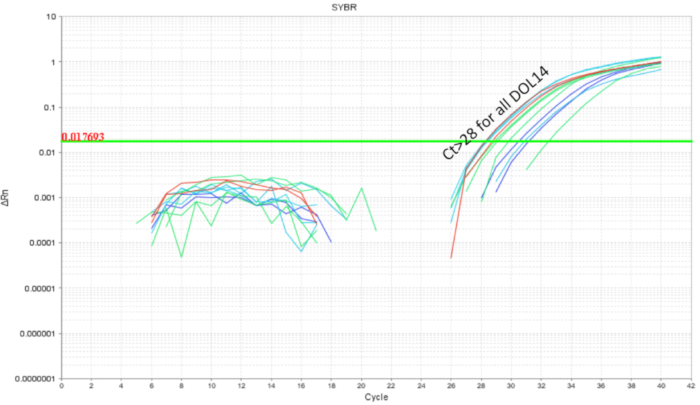
Figura 5 . Amplificazione di LP di DNA intestinale da DOL 14 cuccioli trattati fra DOL 2 e DOL 8 in alimentazioni mediante sonda gastrica pianificata ogni giorno (7 dosi) e ogni altro giorno (4 dosi). Le gocce di carico LP sotto ciclo 28 liquidazione indicando di LP nel corso di 6 giorni post ultimo probiotico sonda gastrica. Clicca qui per visualizzare una versione più grande di questa figura.
| Passo | Temperatura | Tempo |
| 1 | 50 ° C | 2 minuti |
| 2 | 95 ° C | 3 minuti |
| 3 | 95 ° C | 30 secondi |
| 4 | 58 ° C | 30 secondi |
| 5 | 72 ° C | 30 secondi |
Tabella 1. condizioni di amplificazione qPCR. La temperatura e il numero delle condizioni di ciclo per la reazione di PCR.
| Destinazione | Regione intergenica spacer 16S-23S |
| Dimensione del frammento previsto | 144 bp |
| Primer Tm | 58˚C |
| Forward primer (FP) | LPN-1: TGG ATC ACC TCC TTT CTA AGG AAT |
| Reverse primer (RP) | LPN-2: TGT TCT CGG TTT CAT TAT GAA AAA ATA |
Tabella 2. Dettagli dei componenti della reazione qPCR. I dettagli sui primers, loro temperatura di ricottura e la dimensione del frammento previsto nella reazione di PCR.
| Concentrazione | Reazione di 10 µ l | Reazione di 20 µ l | |
| Modello del DNA | 200 pg / µ l | 1 Μ l | 1 Μ l |
| SYBR Master Mix | - | 5 Μ l | 10 Μ l |
| FP | 10 ΜM | 0,3 Μ l | 0,6 Μ l |
| RP | 10 ΜM | 0,3 Μ l | 0,6 Μ l |
| dH,2O | - | 3,4 Μ l | 8.8 Μ l |
Tabella 3. Per volumi di reazione e concentrazioni. La concentrazione dei reagenti e dei volumi per le reazioni.
Discussione
La procedura di "gavage" IE è stata sviluppata per amministrare in modo sicuro una dose specifica di un probiotico per topi neonatali. Piccole quantità di liquido vengono consegnati al tratto gastrointestinale superiore utilizzando un ago di alimentazione per impedire l'aspirazione, garantendo nel contempo la consegna del dosaggio in confidenza. L'intestino dei topi sono stati raccolti per l'analisi di colonizzazione due e sei giorni dopo la sonda gastrica. La procedura di estrazione del DNA è stata modificata per garantire alto rendimento dell'organismo probiotici Gram-positivi. La qPCR l'analisi del DNA estratti due giorni post ultima sonda gastrica ha mostrato relativamente maggiore colonizzazione del LP in topi gavaged ogni due giorni rispetto ai topi gavaged ogni giorno tra DOL 2-8. C'era anche una diminuzione della quantità di LP per sei giorni, mostrando questo probiotico per essere un organismo transitorio nell'intestino del mouse. I risultati di questi esperimenti stabiliscono le condizioni per condurre una ricerca con alto rigore in questo gruppo di età.
Per osservare gli effetti a lungo termine dei probiotici in topi neonatali, esso è stato somministrato a topi neonatali in DOL 2; punto di un orario di partenza simile alla sperimentazione umana. Orofaringea alimentazione dei topi neonatali precedentemente è stato descritto nella letteratura ed è stata effettuata solo dopo DOL 5-812,17 quando il rischio di aspirazione è inferiore a causa di una meccanica deglutizione ben sviluppata. Tuttavia, alimentazione orofaringea non è adatto per DOL 2 topi più alti tassi di aspirazione sono stati osservati nello studio pilota (dati non mostrati). La natura viscosa del probiotico e prebiotico soluzione aggiunta al rischio di aspirazione. Seguendo la procedura di gavaging IE ridotto al minimo il rischio di aspirazione in DOL 2 topi mentre trasporta il volume desiderato direttamente al tratto gastrointestinale superiore. Il successo della procedura in primo luogo è stato convalidato utilizzando coloranti alimentari infuso "gavage" probiotici. Il colorante alimentare agisce come un indicatore che è visibile attraverso la pelle del cucciolo. Nessun effetto negativo sono stato osservato in topi gavaged con colorante alimentare, e si consiglia di validare la procedura di gavaging in questo modo prima di iniziare gli esperimenti su larga scala. La risoluzione veloce dell'alimentazione mediante sonda gastrica post visto riflesso boccheggianti utilizzabile anche come indicatore supplementare per un successo "gavage". Una volta che il mouse è posizionato sulla termocoperta post-sonda gastrica, il riflesso ansimante si abbasserà e sarà osservato un aumento della frequenza di respirazione entro 20 secondi. La continuazione del riflesso ansimante per più di 30 secondi indica una sonda gastrica non riuscita. Sonda gastrica di successo dipende anche appropriato inserimento dell'ago d'alimentazione con il bulbo seduto proprio sopra l'apertura dello sfintere cardiaco dello stomaco. Questo può essere facilitato facendo in modo che la marcatura sull'ago misura la lunghezza tra il processo xifoideo e la punta del muso, non andare oltre il muso del mouse durante l'alimentazione mediante sonda gastrica. Questo minimizza la possibilità di lesioni al mouse. La frequenza della sonda gastrica può avere un impatto significativo sui risultati sperimentali. Gavaging frequente anche possibile creare più stress per i cuccioli e la madre a causa della perturbazione costante della gabbia e il nido. Il programma di alimentazione mediante sonda gastrica più ottimo è quando le alimentazioni mediante sonda gastrica è meno frequenti e sopra una durata più breve di tempo senza perdere l'effetto previsto nel sistema. Per garantire la sicurezza e la sterilità della procedura la sonda gastrica dell'ago dovrà essere sterilizzato in lavaggio e sterilizzazione in autoclave-tra uso. Lavaggio rigorosamente sull'esterno utilizzando uno scrub e l'interno forzando acqua attraverso l'ago usando una siringa prima di sterilizzazione in autoclave è necessario come le particelle rimanenti possono incrostare sull'ago durante la sterilizzazione in autoclave e possono interferire con la procedura di gavaging.
Più alto LP colonizzazione è stata osservata nei cuccioli che gavaged ogni altro giorno, quando rispetto a cuccioli gavaged ogni giorno. Questo può essere dovuto allo stress ridotto su cuccioli gavaged ogni altro giorno e potenzialmente il probiotico sempre più sostanze nutritive attraverso il latte relativamente più ingerito da questi cuccioli. La dipendenza della dose di trattamento probiotico è stato precedentemente studiata in mouse modelli18,19 e pertanto la somministrazione di dosaggio corretto è importante. La soluzione di probiotici preparata è placcata prima di ogni sonda gastrica per ottenere un conteggio accurato dei CFU amministrato. Se l'organismo probiotico è anaerobico, è importante vedere se c'è differenza in CFU quando coltivate aerobica o anaerobica. Poiché LP è un anaerobio facoltativo, esso è stato coltivato utilizzando entrambi i metodi ed è stata osservata alcuna differenza in CFU.
L'analisi di carico post sonda gastrica intestinale LP è stato fatto usando i campioni di DNA di qPCR e di alta qualità. Per minimizzare la contaminazione del DNA LP fra il trattamento ed i gruppi di controllo, diversi alimentazione aghi, biosicurezza e apparecchiature chirurgiche sono stati utilizzati per assicurare i campioni di qualità più alti. La misura esatta del probiotico nell'intestino richiesto un metodo di estrazione del DNA ottimizzato. Metodi più efficienti per l'estrazione del DNA da sgabello coinvolge più perlina battendo passi20,21,22. Questo metodo è stato adottato per l'estrazione dei batteri intestinali mediante battitura perlina e osservato rappresentazione diminuita (< 102 copie recuperate) del LP nell'estrazione del DNA dell'intero intestino. Come LP è un organismo di Gram positivo con una notevole quantità di peptidoglicano nella parete delle cellule, il protocollo è stato ottimizzato con un passo di dissoluzione di peptidoglicano utilizzando lisozima23,24 aggiunto al buffer di lisi enzimatica. Ciò ha aumentato la rappresentazione del LP nello stesso campione intestinale da maggiore di due volte. Il trattamento di lisozima garantisce la dissoluzione dello strato esterno, mentre il tallone battendo passaggio facilita la lisi dell'organismo. Ottimizzazione della quantità di tessuto, il tipo di cordone di granato e la durata della perturbazione utilizzando le perle è necessarie per l'ottenimento di ottimi prodotti di DNA per l'analisi di PCR.
L'impatto positivo dei probiotici somministrati come profilassi o trattamento in neonati pre-termine e termine è testimoniata in recenti studi25,26,27,28. L'istituzione di un modello del mouse neonatale corretto per i probiotici è autorizzata a disfare l'effetto protettivo dei probiotici. Questo protocollo descritto qui rappresenta una guida per i ricercatori non familiari con il lavoro del mouse neonatale usando i probiotici. Nonostante le questioni con roditore microbiota mentre studiava la malattia e la salute umana, questo metodo può essere esteso alla ricerca focalizzata sulla comprensione dei cambiamenti del microbioma a causa di probiotici. Questo modello fornisce anche una piattaforma per studiare le risposte immunitarie e interazione del ospite-microbo nel corso delle diverse fasi di sviluppo.
Divulgazioni
Nessun conflitto di interessi di divulgare.
Riconoscimenti
Grazie per il personale di Animal Care Facility e i veterinari UBC per assistere nel topo e formazione lavoro Hospital Research Institute di BC Children. Grazie per la University of British Columbia e del dipartimento di medicina sperimentale per lo studio di finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
Riferimenti
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon