Method Article
強制経口投与を用いた新生児マウスにおけるプロバイオティクス研究
* これらの著者は同等に貢献しました
要約
本研究では、gavaging マウス新生仔にプロバイオティクスの正確な量のプロセスを詳しく説明します。実験の設定を含むように最適化されたが、プロバイオティクスの投与、管理の方法、腸内細菌の定量化に限定されていません。
要約
成体マウスのモデルは、人間の病気の進行の背後にあるメカニズムを理解する広く使用されています。新生児疾患に成体マウス モデルで行われた研究の適用は、限られています。病気の進行、宿主反応と新生児における介入の長期的な影響を理解し、可能性が高い新生児マウス モデルはより良いフィットです。新生児マウス モデルのスパースの使用は、これらの小動物での作業の技術的な問題の一部に原因があります。新生児マウス モデルは、初期の生活のプロバイオティクス投与の効果を決定するため、特に新生児マウス腸管内で植民地を確立する能力を評価するために開発されました。具体的には、新生児マウスでプロバイオティクスの植民地化を評価するために乳酸菌(LP) は新生児マウス消化管に直接配信されました。このため、LP は強制経口投与 (IE) 内食道を介して供給することによりマウスに投与しました。外傷、新生仔マウスのもろさを与えられた特に重要な側面を最小限に抑えながらプロバイオティクス投与量の正確な管理を可能にする IE 強制経口投与のプロセスを標準化する再現性の高い方法を開発しました。このプロセスの制限は、場合 gavaged 食道炎症または損傷や誤嚥の可能性を含める誤って。遠位食道に IE を強制経口投与は誤嚥の可能性を低減するため、このアプローチは現在の慣行の改善を表します。次の強制経口投与、プロバイオティクスの植民地化のプロファイルは、LP 特異的プライマーと DNA を抽出し腸の量的なポリメラーゼの連鎖反応 (qPCR) を使用してトレースされました。別の猫の設定とケージ管理技術は、植民地化普及の可能性を評価するために使用されました。プロトコルの詳細 IE 新生児マウス経口と LP とそれに続く植民地化定量の複雑さ。
概要
乳児で早期プロバイオティクスが関連付けられている壊死性腸炎、アトピー性皮膚炎、敗血症1,2,3,のような病気の減少率につながる免疫調節効果4,5します。 ただし、この免疫調節応答の後ろのメカニズムは新生児の臨床試験 (すなわち、連続血液を描画および生検) でサンプリングに制限を与えられた探検に挑戦するです。新生児マウス モデルは、プロバイオティクスと腸内細菌叢の変化に関連付けられている新生児の免疫調節に関与する作用機序の研究を助けることができます。残念ながら、プロバイオティクスのほとんどのマウス モデルが大人のマウスの中心します。しかし、プロバイオティクスの影響は最初期の生活、この年齢別グループのために特定のモデルになります便利な3,6を示唆する可能性があります。また、新生仔マウス モデル、病気と人間の幼児の初期の人生のアプリケーション向けの開発微生物・免疫システム7,8 をもっと密接に模倣するどおり、介入研究に適しています ,9,10。目的は、範囲とホストとそのマイクロバイ間力学的相互作用にフォーカスを持つ新生児マウスのプロバイオティクスを植民地化のパターンを勉強することでした。新生児モデルの適切な説明は文献で見つけられなかったし、堅牢で標準化された方法の開発の必要性がこのように対処されました。
新生マウスにさまざまな化合物の経口投与の確立された方法には妊娠ダム11の水の源を扱うかの管理を容易にする餌針を使用して、牛乳を通じて必要な化合物の母体搬送が含まれます中咽頭の12に必要な化合物です。これらのメソッドは、正確な投与量の要件がないし、治療が受信者のマウスによって摂取されますすぐに実験に便利です。プロバイオティクス、プレバイオティクス ガラクトオリゴなどのプロバイオティクス細菌の栄養源としてフラクトオリゴ糖 (FOS) と組み合わせて投与されしばしばこれらの付加物は、粘性と上記の方法論による管理への挑戦に、ソリューションを行います。(DOL) の人生の最初の日が必要だったが早くも始まって新生児マウスにプロバイオティクスとプレバイオティクスの正確な量を管理するためのメソッドを考案します。(治療とコントロール アーム13,14,15,16の他のプロバイオティクス研究で観察)、強制経口投与法、植民地化普及の可能性を開発する過程でテストされたし、植民地化した乳酸菌(LP) 異なる強制経口投与スケジュールと子犬の腸内の相対的な豊かさが評価されました。実験で使用するプロバイオティクス製剤は、最近人間裁判3で説明した FOS (プレバイオティクス) とマルトデキストリン (賦形剤) 混合 LP (ATCC 202195 ひずみ) の強制経口投与あたり 109コロニー形成単位 (CFU) から成っていた。プロバイオティクス配信は IE 強制経口投与を使用して達成され、プロセスは、以下のプロトコルで説明します。プロバイオティクスの植民地化のプロファイルは、リアルタイムに LP 特異的プライマーを使用して全体の腸から抽出した DNA の増幅を使用して評価しました。
プロトコル
動物介護老人施設ブリティッシュ ・ コロンビア大学でのサポート スタッフによって確立されたガイドラインに係るをすべての手順を実施し、すべてのプロシージャは、UBC 動物ケア委員会によって承認されました。
1. プロバイオティクス投与の定量化
注: プロバイオティクス単回投与で管理できる CFU の正確な量を決定するには、この手順の使用をお勧めします。プロバイオティクスと車両 (FOS とマルトデキストリン) の量は、溶液の飽和条件を決定します。経験から大きいボリュームが誤嚥のリスクを高めると DOL 2 にマウスに流体の以上 30 μ L (1 kg あたり 〜 20 mL) を管理できます。
- シリアル希釈滅菌 5% ブドウ糖食塩液 180 μ L を含む各管 6 1.5 mL 容マイクロ チューブを準備します。
- 重量 0.2 g 因数プロバイオティクス ・ プレバイオティクスの混合物の滅菌方法で 5% ブドウ糖生理食塩水 1 mL に溶解します。
- 30 秒とピペットの群生を分割するための渦。目に見える塊が観察されるまで繰り返します。
注: マルトデキストリン粘性ソリューションとなって、ソリューション彩度に貢献。 - 1.1 準備したチューブを使用してシリアル希釈を実行します。ミックスする渦。
- MRS 寒天プレートのラベル領域にすべての希釈の 40 μ L をプレートします。重複してそれぞれの希釈をプレートします。
- 嫌気性下で孵化させなさい (または微好気) 37 ° C でガスのパックを使用して真空の瓶に 48 h のための条件。
- クアドラントあたり 20 70 植民地の範囲内で各板をカウントします。平均プレートは同じ希釈でカウントし、任意の単位に計算します。
2. プロバイオティクス、プレバイオティクスの強制経口投与のための準備
注: プロバイオティクスとプレバイオティクス適切な溶解は強制経口投与中に餌針を通して液体のスムーズな注入を確保するため必要です。
- プレバイオティクスと滅菌遠心管内の車両の希望金額と凍結乾燥プロバイオティクス生物の必要量を兼ね備えてください。
- プロバイオティクス ・ プレバイオティクスの混合物を溶解する溶媒 (5% ブドウ糖塩水) の適切な量を追加します。
注: 分解の容量は、プレバイオティクスによって制限され、使用される車両です。経験から (FOS とマルトデキストリン) とシンバイオティクスの組み合わせは溶媒 1 ml、2 mL 遠心チューブに溶解しながら約 0.3 g/mL に飽和に達し。 - すべての固体が溶解するまで混合する渦。上下にピペッティングによる溶媒中における固体粒子の球を分割するため、ピペットを使用します。
- 20 分の 37 ° C の水浴のソリューションを孵化させなさい。
メモ: ライブ文化からプロバイオティクス ・ プレバイオティクスのソリューションを作成する場合は、この手順をスキップできます。 - 5 つのシリーズのプレート子犬にプロバイオティクスを正確に定量化する強制経口投与前に MRS 寒天の 10 倍希釈を投与します。正確な CFU の数が必要ない場合、この手順をスキップできます。
3. バイオ セーフティ キャビネットの準備
- 無菌技術を維持するためにプロバイオティクスを使用するとき安全キャビネットを使用します。1 つのダムと毛布を (およそ 38 ° C に設定) の子犬ケージをセット、毛布の半分。暖房毛布の他の半分にきれいで、空の動物ケージを配置します。
- 強制経口投与でマウスにがち暖房ブランケット上の消毒や滅菌は、吸収パッドの場所。
- 既存のダム作成巣の上から子犬のネスト材料を収集し、手袋をはめた手、70% エタノールを使って消毒し、乾燥を使用して新しい円錐入れ子のカップを作成します。きれいで、空の保有物のおりにこの新しい巣を配置します。これは手袋をはめた手に巣の香りの転送を容易に、共食いのリスクの低減の手順のためそれらを処理しながら子犬の他の香りの導入を最小限に抑えます。
- ケージを保持している円錐形の巣に子犬を移動し、ダムとケージをキャビネットから取り出します。これはプロシージャの間に子犬を聞いてからそれを防止することにより、ダムのストレスを軽減します。
注: プロバイオティクスがマウスの腸の知られている植民の場合治療条件区切る必要がありますケージまたは異なるバイオ セーフティによって十字の植民地化の可能性を避けるためにキャビネット。
4 新生仔マウスの内食道強制経口投与
- 簡単にアクセスできるシリンジ包装を開きます。滅菌方法で針の梱包を開き、注射器の頭にアタッチします。70% のエタノールと手続きの前にオートクレーブ針を洗います。針治療とコントロール グループの異なるセットを使用して、汚染を避けます。
- 注射器にプロバイオティクス色素溶液の希望の金額よりももう少し多くを描画します。上向きシリンジを保持します。さらにプルダウンし、泡を取り除くし、希望の音量に達するまで泡や余分な液体の体積を追放するプランジャーを押し下げて指でフリックします。これにより、針に空気のスペースがありません。DOL 2 マウス、強制経口投与量は 30 μ L のを超えてはなりません。
- 加熱パッドの上に無菌の吸収パッドに子犬を配置します。剣状突起 (胸骨の下端) のすぐ下の針のボールを配置することによって、食道の長さを測定するのに外部給餌針 (24 のゲージ、1「針の長さ、ボール直径 1.25 mm) を使用します。(図 1) の針の挿入の制限に注意してください鼻のレベルで針をマークします。通常呼吸と皮膚のピンクの着色を含む健康兆候の子犬を観察します。
- 浸漬溶媒 (5% ブドウ糖塩水または - プロバイオティクスを溶解するために使用される、事前ミディアム) で針の先端を浸し餌針の外部表面を潤滑します。これはマウスの食道に針のスムーズなエントリを容易します。
- 首筋や頭と親指と人差し指の間に体を優しく押して子犬を持ち上げます。頭、首を確保し、体がまっすぐの位置で行われます。持っていない子犬の首筋に 60 を超えると s は窒息につながる気管の閉塞の危険性。子犬が呼吸することができますを確認します。スクラッフィングもハードの兆候は、息をすることができない、重要なあえぎと舌口を拡張を含めることができます。子犬の色、全体の手順中に呼吸を監視します。
- 喉の奥に到達するまで、胴体の面に 45 ° の角度で子犬の口の中心に針の電球を挿入します。
- そっと針の電球にはめ込んで、針の角度を変更、注射器を移動 (子犬の背側) に向かってそれまでの gavaging 人から離れた子犬の脊柱の平面に平行です。スクラッフィング子犬は、喉の奥に場所に針を維持するのに役立ち、マウスが蠢動するを防ぎます。針のボールを進めるしないか、または角度変更時に咽喉の背部に対して任意の圧力を発揮していることを確認します。
- マウスが針を飲み込むしようとすると、もし自然下方にスライドし、鼻と針のマーキングが揃うとき動きを逮捕できます。注射器と針は通常十分な期限をすべる重い重力に。針の重みですべての回で針からスライドを簡単に下方圧力がないと食道を押し、強制経口投与を行う者をサポートします。
- 針が喉の奥に抵抗を満たしている場合は、わずかに針と再角度のボールを取り除く強制経口投与針小さい、1 ミリ単位でゆっくりとマウス (ハンドラーの右) の左の方の口の中に針を撤回します。針は簡単に食道を押しスライド始めるべきであります。
- 針は、針のマーキングが口に達する前に停止した場合は、ソリューションを挿入しません。
- 20 以上の挿入針を守らない s。この場合、注射器を胴体と平行に保ちながらゆっくりと針を撤回し、子犬 30 紙タオルの上に残りの部分を聞かせて溶剤による針の外表面を潤滑した後、再び 1 分みてください gavaging に s。
注: マウスの応答強制経口投与の成功を測定する必要があると、麻酔は、プロシージャの使用されません。
- 餌針のマーキングは、鼻の上と鼻の先端を揃えて移動またはいずれかを進める針がさせない。液体の適切な量をゆっくり注入します。液体が吸引や鼻から泡が観察された場合、は、すぐに注入を停止、針をゆっくりと上げます。
- 加熱パッドでその回復を支援するためにペーパー タオルの上に直立した子犬を配置します。継続的な呼吸の問題は、密接に監視または吸引を示す子犬の色に変更します。すぐに吸気が子犬を安楽死させます。
- 強制経口投与が完了する、優しく挿入された同じ角度で餌針を撤回します。温め加熱パッド上に紙タオルで子犬を配置します。通常の活動と呼吸のパターンを取り戻すために子犬のため待機 10 s。子犬の体を健康的なピンクの色合いが表示され、染料は、胃のコンパートメントでのみ表示されます。その他の子犬をケージにそれを戻します。
注: Gavaging 青食品着色料は、上記の手順を練習する優れた方法です。強制経口投与に成功した場合、マウスの胃は青の色相として表示されます。(首、胸部や腋窩部) 子犬の胃外青い色素がある場合動物が人道的に安楽死させた (動物) の規則に従って、これは食道や吸引の破裂を示す。
5 植民地化分析のための intestional サンプルのコレクション
- それ以降の監視または gavaging の間に子犬から糞便マイクロバイ サンプルを収集します。
注: 子犬よく小便し、場合 gavaged の defecates、マイクロバイ分析のため糞便のサンプルを収集する機会としてこの時間を使えます。 - 実験が終了したため子犬の安楽死後直腸、十二指腸から腸を収集します。手術用ボードに子犬をピン留めし、70% アルコールで皮膚を消毒します。70% のエタノールと 250 ° C の高温ビーズ滅菌滅菌ツールを使用して腹膜の層を損なうことがなく 4 つの象限に皮膚を切り取る
- 滅菌ツールの別のセットを使用して、4 つの象限に腹膜をカットし、内臓器官が公開されていること方法で中心から移動します。
- 胃を見つけて下幽門括約筋と直腸の端をピンチにクランプを使用します。腸を合理化し、結合組織や腸間膜組織から無愛想なツールまたは鉗子を使用して腸の長さを実行します。腸の全体の長さは、結合組織の解放されている、一度両端固定でカットします。
- 腸の向きでアルミ箔をマーク、安全な方法でラップし、-80 ° C で凍結
注: この時点で凍結もなくうち DNA 抽出プロシージャを実行できます。ブルーの染料は、24 h 以上の腸管を通過するも見られ、植民地化の解析は、腸は、少なくとも 24 時間を収集が最高ポストの最後の強制経口投与のサンプルのコレクション。一過性強制経口投与混合物を通る非付着細菌によって、timepoint の前に増幅があります。
6 植民地化の分析のための腸から DNA 抽出法
注: DNA の抽出を行うと腸の DNA の抽出のプロトコルに対して行われた変更の最適化に市販のキットを使用しています。暖房器具が所望の温度に設定されて変更または事前の温暖化を必要とするソリューションを適切に準備を確認します。
- 酵素換散バッファー (エルプ) を次のように準備: トリス Cl 20 mM、2 mM ナトリウム EDTA 1.2% と解決をするトリトン X-100。8.0 pH を調整します。エルプを使用する直前に最終濃度 20 mg/mL にリゾチームを追加します。
- 削除キャップを持つ分析的なバランスで重さガーネット ビーズ チューブ。
注: これは、必要な重量はオーバー シュートした場合それが腸の内容物を取り出しやすいです。 - 滅菌使い捨てメスを使用して小さなセグメントに腸を切り、あらかじめ重量を量られたガーネット ビーズ チューブに必要なセグメントをスクープします。
注: DNA ユビキタスは PCR の結果に影響を与えることができると、各サンプル間のメスを変更するを確認します。 - 各管に (ステップ 6.1) からリゾチームとエルプの 1 mL を追加、ボルテックス ・ ビード ・ ビーターに置き、5 分間最大設定 (14) で実行します。
- 組織を破壊すると、一度 37 ° C の水浴にチューブを転送し、30 分間インキュベートします。
注: この手順を行うリゾチームをアクティブにし、グラム陽性細菌の細胞壁ペプチドグリカンの故障を誘発します。 - 1 mL あたり 600 マウの濃度ですべてのサンプルのプロティナーゼ K の 20 μ L でチューブを準備します。
- 10 分間 400 x gでチューブを遠心します。ライセートがビーズの上にいくつかの組織の残渣と明確になります。
- プロティナーゼ K を含むチューブに上清 (上部の段階) の 180 μ L を転送し、チューブに AL バッファーの 200 μ L を追加します。15 の渦を混在させる s。
- 10 分間 56 ° C で加熱ブロックにチューブを置きます。
- チューブに 100% エタノール 200 μ L を追加し、15 のボルテックスによってミックス s。
- キット () からスピン列に lysate の約 600 μ L を追加します。
- 8,000 × gで 1 分間遠心します。流れを破棄します。
- 手順 6.12 を繰り返してすべてのライセート列を通して描かれています。
- 新しいコレクションの管に列を配置します。8,000 × gで 1 分 AW1 バッファーおよび遠心分離機の 500 μ L を追加します。
- 流れを破棄します。3 分間 8,000 x gで AW2 バッファーおよび遠心分離機の 500 μ L を追加します。
- 流れを破棄し、遠心分離機の 3 分間 8,000 x gで空のコレクション チューブ内の列。
- DNA 溶出チューブに列を転送します。膜の上に直接 PCR グレード純水 60 μ L を追加し、室温で 2 分間インキュベートします。
- 溶出が 37 ° C で予め温めておいた溶出水を使用します。溶出によって 2 回行うことができます最終的な溶出の半分のボリュームを使用して、収率を高めるために 2 回 6.15 のステップを繰り返します。
- DNA を溶出する 8,000 × gで 1 分間遠心します。
- 必要な数量を用いた溶出 DNA の濃度を測定します。抽出プロセスの収率は、10-40 の ng/μ L の DNA の範囲にあります。
- -20 ° C で溶離された DNA を格納します。
7. qPCR セットアップ
- PCR の状態
- マシンをオンにし、表 1のプログラムを読み込むリアルタイム qPCR マシン。
- 40 サイクルの表 1の手順 3 から 5 をループ、4 ° C、反応の終点でサンプルを持ちます。
- PCR 実験装置
- プライマーと表 2の温度を使用します。濃度と反応条件の表3 を使用します。手続き型の変動に対する制御に 3 通の各反応を設定します。
- QPCR システムと手順 7.1 のシステムに読み込まれるプログラム実行に PCR 反応チューブ/プレートを配置します。
- 実行の終わりにチューブを削除、4 ° C の上に置きます、ゲルの準備します。
8. LP 植民地化の定量化
- QPCR ミックスを 10 μ L または表 3によると 20 μ L 反応に備えます。
- LP ゲノム DNA 標準曲線 107 101コピー/μ L に
注: 各希釈の 4 μ L はメッキが、以来 4 μ L の 10 の7のコピーまたは μ L あたり 10 の6枚 × 2.5 が必要開始入荷です。曲線の残りの部分と同じ原理を使用します。- 1:4 希釈を準備: 50 μ L 中の μ L あたり 10 の7枚。
LPDNA + dH2O 46.85 μ 3.147 μ = μ L あたり 10 の6枚 × 2.5 - 連続 10 倍希釈: 45 μ L dH2O 105コピー/μ L × 1.25 の 5 μ L を追加。
- 4 μ L/ウェルあたり希釈をプレートします。
- 1:4 希釈を準備: 50 μ L 中の μ L あたり 10 の7枚。
- LP amplicons の可視化
- 2% の agarose のゲルを使用しての明確な分離を到達する、~ 197 bp LP 増幅されたフラグメント。
- ゲルの PCR 製品ごとの 9 μ L をロードします。
- 120 V で 30 分間のゲルを実行します。
結果
このメソッドの一意性は、サイズ gavaging 手法の適応と新生仔マウスのもろさにかかっています。前のセクションでは、DOL 2 マウスで成功した強制経口投与の手順を遂行する上で重要なステップを説明します。よい定量化スケールを確立するには、標準曲線は 3 つの技術的なレプリケートします (図 2) と純粋な LP の DNA を使用して生成されました。標準曲線は、プライマーを使用して LP DNA の検出のダイナミック レンジを提供しました。ダイナミック レンジは 7/28 サイクル間 10 の範囲1 107枚 LP DNA が検出されました。標準曲線の安定した斜面は、効率性と反応のスケーラビリティに表されます。
IE 強制経口投与の手順は、成体マウスの相対的な容易さと使用されています。しかし、新生仔マウスの上部消化管は壊れやすいものと、強制経口投与の必要な校正運動針のプロシージャの間に。繰り返される gavages によって処理するためダム内食道の炎症、怪我、障害または拒絶の可能性が高くなります。したがって、2 つの異なる gavaging スケジュールされたテスト、腸管のホモジュネートから DNA を用いて定量化腸の植民地化。マウスは、プロバイオティクス投与、毎日または 2 日おきに (図 3) DOL 2 DOL 8 ~ gavaged。各サンプルは、1 つの技術的な複製を含まれている、すべての条件には、少なくとも 2 つの生物学的複製。Gavaged の子犬子犬 gavaged 4 回投与によるすべての 2 日間は約 10 の5枚、7 の用量で毎日は LP の約 10 の3コピーを持っていた。結果複製間の一貫性は、技術の精度にクレジットを追加します。検出 gavaged の子犬の腸内 2 日にされた gavaged、毎日の子犬と比較してより多くの LP があった。このため、その後の実験一日おきの強制経口投与スケジュールを設定したようにそれはまた子犬のストレスを軽減します。
内ごみプロバイオティクスを避けることが重要ですクロスコンタミネーション プロバイオティクスを使用するとき。同腹子のマイクロバイは同じ母と営巣場所を共有するように期待されていた。プロバイオティクス微生物細菌叢の一部になる可能性があり、治療と制御条件が同じトイレ内で存在する場合、これはプロバイオティクス研究のための問題を証明する (「植民地化広がる ').かどうかプロバイオティクスは汚染され、未処理の同腹子を植民地化し、ごみの半分は上記として gavaged と qPCR 用腸に収集されました。DOL 10 マウスの腸 qPCR 解析 gavaged マウスではなく、非 gavaged の同腹子 (図 4) の程度は低いに LP DNA の増幅を期待を示した。未処理のケージから同じ DOL マウスの腸を示さなかった増幅または最小限の増幅サイクルで 32 を超える。これはケージのトイレ内マイクロバイの共同分配の証拠を提供しました。したがって、交差汚染による変動の制御するためにケージで、プロバイオティクス実験治療グループを区切る必要があります。実験を設定する場合ゴミ設定が効果のように里親のダムから減少したケアと拒絶反応を評価し、ため最適化する必要があります、フォスターのダムの使用を考慮することができます。マウス gavaged DOL 8 が残っていたまでは 6 日間放置すると DOL 14 で腸の DNA 分析、LP 約 10 冊 (図 5) が見つかりました。したがって、LP の植民地化は一時的なことが判明しました、時間をかけて検出人口減少します。
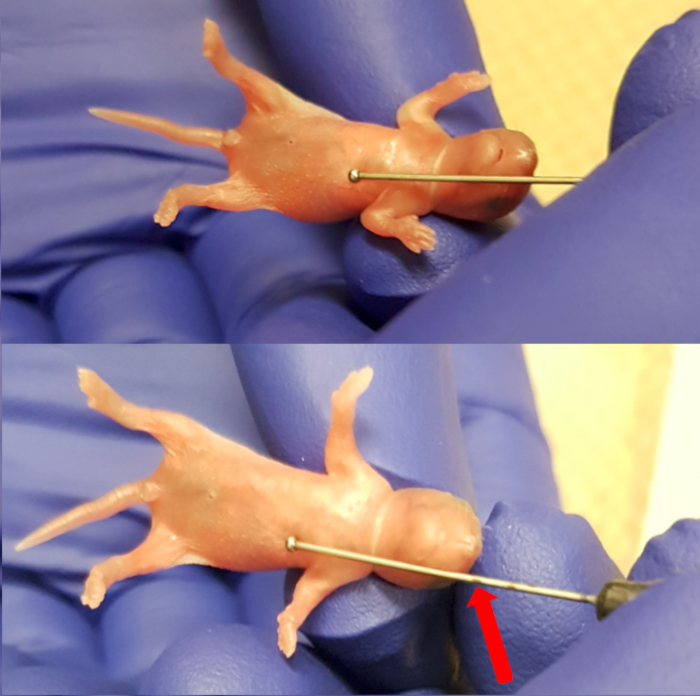
図 1.剣状のプロセス (胸骨の下端) と最大挿入針のマーキングをする鼻の間の長さを測定します。この図の拡大版を表示するのにはここをクリックしてください。
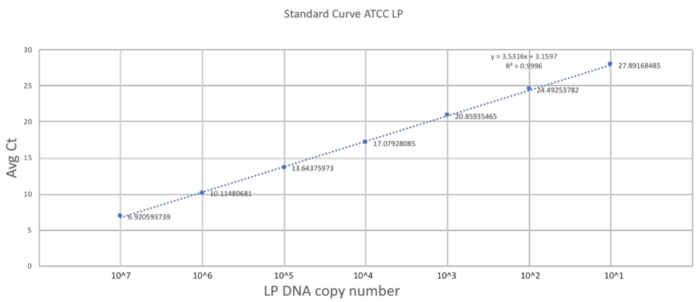
図 2.標準曲線 LP プライマーと ATCC LP DNA を使用して確立します。研究で使用されるプライマーの動的検出範囲を確立 ATCC LP DNA のシリアル希釈しました。この図の拡大版を表示するのにはここをクリックしてください。
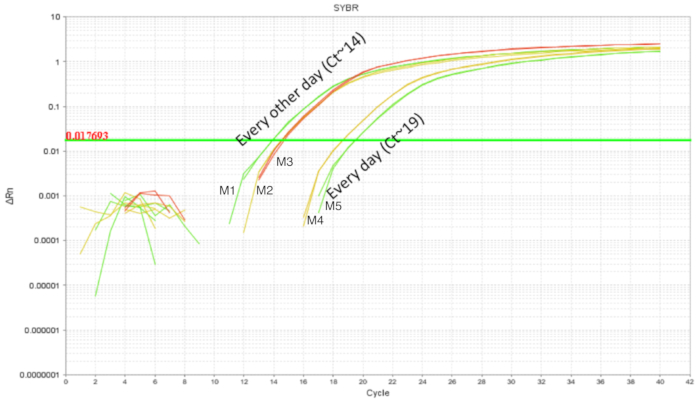
図 3.LP DOL 10 子犬から腸内の DNA の増幅処理スケジュールされた gavages で DOL 2 と DOL 8 の毎日 (7 回分) と、その他の毎日 (4 回投与).Gavaging その他の毎日は毎日 gavaging と比較してより高い腸 LP を示した。この図の拡大版を表示するのにはここをクリックしてください。
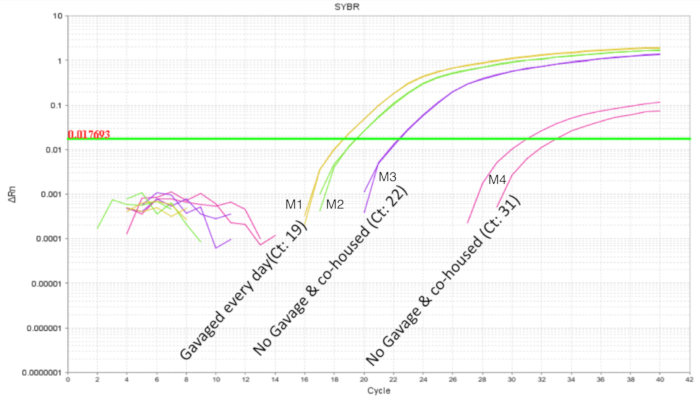
図 4.4 子犬のくずで LP 2 扱われ、2 で DOL 10 子犬から腸内の DNA の増幅は放置。強制経口投与スケジュールされた gavages で DOL 2 と DOL 8 間であった毎日 (7 用量).2 つのプロバイオティクスは、子犬を予想される増幅プロファイルを扱われます。未処理の子犬は、くず内プロバイオティクス生物の共同分配を示す LP の可変増幅を表示します。この図の拡大版を表示するのにはここをクリックしてください。
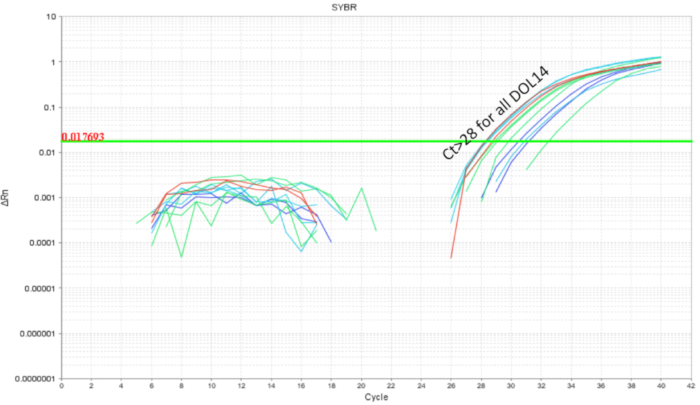
図 5.LP DOL 14 子犬から腸内の DNA の増幅処理スケジュールされた gavages で DOL 2 と DOL 8 の毎日 (7 回分) と、その他の毎日 (4 回投与).LP 負荷サイクル 28 6 日間のコース上の LP を示すクリアランス下回った投稿最後プロバイオティクス強制経口投与してください。この図の拡大版を表示するのにはここをクリックしてください。
| ステップ | 温度 | 時間 |
| 1 | 50 ° C | 2 分 |
| 2 | 95 ° C | 3 分 |
| 3 | 95 ° C | 30 秒 |
| 4 | 58 ° C | 30 秒 |
| 5 | 72 ° C | 30 秒 |
テーブル 1 qPCR 増幅条件。 。温度、PCR 反応のサイクル条件の数。
| ターゲット | 16S 23S 間スペーサー領域 |
| 予想されるフラグメント サイズ | 144 bp |
| プライマーの Tm | 58˚C |
| 前方プライマー (FP) | Lpn-1: TGG ATC ACC TCC TTT CTA AGG AAT |
| 逆プライマー (RP) | Lpn-2: TGT TCT CGG TTT 猫 TAT GAA AAA ATA |
表 2。QPCR 反応のコンポーネントの詳細情報。プライマーをアニール温度、PCR 反応の予想されるフラグメント サイズの詳細については。
| 濃度 | 10 μ L 反応 | 20 μ L 反応 | |
| テンプレート DNA | 200 pg/μ l | 1 Μ L | 1 Μ L |
| サイバー マスター ミックス | - | 5 Μ L | 10 Μ L |
| FP | 10 Μ M | 0.3 Μ L | 0.6 Μ L |
| RP | 10 Μ M | 0.3 Μ L | 0.6 Μ L |
| dH2O | - | 3.4 Μ L | 8.8 Μ L |
表 3。反応ボリュームと濃度あたり。試薬と反応するボリュームの濃度。
ディスカッション
IE 強制経口投与の手順は、マウス新生仔にプロバイオティクスの特定の投与量を安全に管理するために開発されました。液体の少量は、自信で投与量の配達を確保しながらの吸引を防ぐために餌針を使用して上部消化管に配信されます。マウスの腸を植民地化解析 2 の採取、6 日後に強制経口投与。DNA の抽出のプロシージャは、プロバイオティクスのグラム陽性の有機体の高収量を確保するため変更されました。QPCR の DNA の分析抽出 2 日間ポスト最後強制経口投与を示した比較的高い植民地化 LP の gavaged マウスの gavaged マウスと比較してすべての 2 日間毎日 DOL 2-8 の間。またあった LP の量の減少 6 日間マウスの腸内の一時的な生物にこのプロバイオティクスを示します。これらの実験結果は、この年齢層の高い厳しさで研究を行うための条件を確立します。
DOL 2; マウス新生仔に投与された新生児マウスにおけるプロバイオティクスの長期効果を観察するには同様の開始時間は、ひと試験をポイントします。新生仔マウスの咽頭餌と、以前の文献に記載されて、行われている DOL 5 812,17後誤嚥のリスクがよく発達した嚥下力学に起因する低。ただし、咽頭の餌は適していません DOL 2 マウスの吸引率が高いパイロット研究 (データは示されていない) で認められました。プロバイオティクスとプレバイオティクスのソリューションが誤嚥のリスクに追加の粘性の性質。IE gavaging 手順に従うと、DOL 2 マウスの上部消化管に直接音量を提供しながら誤嚥のリスクが最小化されます。プロシージャの成功は、プロバイオティクスの経口注入食品着色料を使用してまず検証されました。食品着色料は、子犬の皮膚を通して見えるマーカーとして機能します。否定的な影響は認められなかったマウスの gavaged 食品着色料と、大規模実験を開始する前にこの方法で gavaging の手順を検証する勧めします。あえぎ反射見たポスト強制経口投与の迅速な解決は、成功した強制経口投与の追加のインジケーターとして使用できます。暖房毛布の上にマウスが配置される後強制経口投与、あえぎの反射が治まるし、呼吸の頻度の増加は 20 秒以内厳守します。30 秒より長くあえぎ反射の継続では、失敗した強制経口投与を示します。成功した強制経口投与は、胃の噴門括約筋の開口部の真上に座っている電球と餌針の適切な挿入によっても異なります。強制経口投与中に過去のマウスの鼻、剣状突起と、鼻の先端の間の長さを測定針のマーキングは行っていないことを確保することによって、これを促進することができます。これは、マウスへの損傷のチャンスを最小化します。強制経口投与の頻度は、実験結果の重大な影響を持つことができます。頻繁に gavaging も子犬とケージと巣の一定の摂動のため母親のためのより多くのストレスを作成できます。最適な強制経口投与スケジュールは、システムで期待される効果を失うことがなく、gavages、少なくとも頻繁に、時間の短い期間にわたってします。安全性とプロシージャの不妊、強制経口投与を確保するには、針は洗濯とオートクレーブ間使用で滅菌する必要があります。スクラブとオートクレーブが必要前に注射器を使用して針を通して水を強制的に任意の残りの粒子によって内部のオートクレーブ滅菌中に針に付着することができます gavaging プロシージャを妨げることができますを使用して、外部の徹底洗浄。
高い LP 植民地化は他のすべての gavaged された子犬で観察された日毎日子犬 gavaged と比較した場合。一日おきにし可能性のあるこれらの子犬が摂取すると比較的より多くのミルクをより多くの栄養素を得ることプロバイオティクス子犬 gavaged に減らされた圧力によりできます。プロバイオティクス治療の線量依存性は、以前マウス モデル18,19の研究されている、したがって適切な投与量の管理が重要です。準備プロバイオティクス ソリューションは、すべて強制経口投与 CFU の正確なカウントを取得する前にメッキです。プロバイオティクス有機体が嫌気性の場合 CFU 好気的または嫌気培養した場合で違いがあるかを参照してくださいすることが重要です。LP は、通性嫌気性菌は、それを両方の方法を使用して培養した、CFU で差は認められなかった。
ポスト強制経口投与腸 LP 負荷分析を行った qPCR で高品質の DNA サンプルを使用して。最小限の治療とコントロール グループの間 LP DNA 汚染餌針、異なるバイオ セーフティ キャビネット ・手術機器使用された最高品質のサンプルを確保するため。腸内のプロバイオティクスの正確な測定には、最適化された DNA 抽出法が必要な。便からの DNA の抽出のための最も効率的な方法は、手順20,21,22を破って複数のビードを含まれます。このメソッドはビーズの打撃を使用して腸内細菌の抽出のため採用し、減少した表現を観察 (< 102枚回復) 腸管の DNA の抽出の LP の。LP は細胞壁のペプチドグリカンの相当な量のグラムの肯定的な生物、リゾチーム23,24酵素換散バッファーに追加を使用して、ペプチドグリカン分解ステップ プロトコルを最適化しました。これは 2 つ以上同じ腸内サンプルの LP の表現を増加しました。リゾチーム処理は、有機物の溶解を容易にステップを破ってビード際に外側の層の溶解を確保します。組織の量の最適化、ガーネット ビーズの種類とビーズを使用して中断の期間、PCR 分析を実施する最適な DNA の製品を得るために必要なです。
プロバイオティクスとして予防や治療前の用語と用語の新生児管理の肯定的な影響は、最近研究25,26,27,28証明されます。プロバイオティクスの適切な新生児マウス モデルの確立は、プロバイオティクスの予防効果をアンパックする保証されます。ここで説明したこのプロトコルは、プロバイオティクスを用いた新生児マウス作業でなじみのない研究者のためのガイドを表します。人間の健康と病気を勉強しながら齧歯動物の腸に問題があるにもかかわらずこのメソッドはプロバイオティクスによるマイクロバイの変化を理解することに焦点を当てた研究を拡張できます。このモデルは、異なる発達段階にわたってホスト微生物間相互作用と免疫反応を研究するためのプラットフォームを提供します。
開示事項
明らかに利害の衝突はないです。
謝辞
動物介護老人施設スタッフにありがとうと訓練し、マウスの支援の UBC 獣医師仕事紀元前こども病院研究所。ブリティッシュ ・ コロンビアの大学と研究資金の実験医学に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
参考文献
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved