Method Article
一种在裂变酵母中的深度固序辅助自发抑制屏
摘要
我们提出了一个简单的抑制屏幕协议在裂变酵母。这种方法是有效的, 无突变, 并选择性的突变, 经常发生在一个单一的基因组位点。 该协议适用于分离抑制剂, 以减轻由突变或药物引起的液体培养中的生长缺陷。
摘要
抑制突变引起的表型缺陷的突变等位基因的基因筛选是识别属于密切相关的生化途径的基因的有力方法。以前的方法, 如合成遗传阵列 (sga) 分析, 以及使用紫外线 (uv) 或类似甲基磺酸盐 (ems) 或 n-乙基-n-硝基脲 (enu) 等化学品的随机诱变技术, 已被广泛使用, 但往往成本很高, 而且成本也很高。辛苦。此外, 这些基于突变的筛选方法经常与对生物体的严重副作用相关, 从而导致多种突变, 从而增加分离抑制剂的复杂性。在这里, 我们提出了一个简单而有效的方案, 以确定抑制突变体, 这赋予了生长缺陷的血吸虫。在标准富液介质或合成液体介质中存在生长缺陷的细胞的适应性可以使用自动96孔板读取器在较长时间内进行恢复监测。一旦细胞在培养中获得抑制突变, 其后代就会超过亲本细胞。与亲本细胞相比, 恢复的细胞具有竞争增长优势, 然后可以与亲本细胞隔离和反交叉。然后使用全基因组测序来识别抑制突变。利用这种方法, 我们成功地分离出了多个抑制剂, 以减轻 elf1 (aaa + 家族 atpase) 的丢失所造成的严重生长缺陷, 该产品是核 mrna 运输和维持基因组稳定性的重要组成部分。目前有超过400个基因在 s .石榴与突变体授予生长缺陷。由于这些基因中的许多没有特征, 我们建议我们的方法将加快识别新的功能相互作用与这种用户友好, 高通量的方法。
引言
理解基因之间的功能联系的基础依赖于识别复杂遗传特征分化以产生不同表型的分子机制的能力1。在裂变酵母中, 大多数蛋白质编码基因是活性2 的可有可无的.这个结果并不说明这些基因的不重要性, 而是说明了这些基因所属的生化途径背后复杂的补偿机制。解剖这些补偿机制产生了认知化图, 揭示了全面的遗传相互作用, 拓宽了我们对功能生化途径3,4的理解。
高通量方法 (如合成遗传阵列分析 (sga)) 已经开发出来, 以识别萌发酵母中的全基因组遗传相互作用, 并已扩大到用于裂变酵母5,6。这种方法通常依赖于包含所有可行的单一蛋白质编码基因缺失的菌株库 (约3300个单倍体缺失突变体, 覆盖超过92% 的裂变酵母基因组), 并需要一个机器人手臂来执行之间的基因交叉兴趣的应变和所有可能的应变在图书馆6。此外, sga 技术依赖于图书馆菌株有适当和有效的交配能力, 这种表型是异常的444个目前有特征的基因 s. pombe 2。
尽管基因相互作用很复杂, 但将携带两个基因突变的菌株的表型与携带每个基因单个突变的两个菌株的表型进行比较, 可以有两个显著的结果之一: 1) 双突变表型是比预期的乘法父母表型更糟糕, 其形式是疾病, 在最极端的情况下, 是杀伤力。这被称为负遗传相互作用, 通常是这两个基因在平行生物路径中作用的信号。2) 双突变表型优于父母表型的预期组合, 也称为正遗传相互作用。积极的基因相互作用特别有趣, 因为它表明这些基因在同一过程中发挥作用。两个正相互作用的基因有三个潜在的关系: 突变基因可能会在平行的路径中向上调节另一个基因的表达, 这两个基因可能在彼此下游的同一路径内协同作用, 或者两个基因编码蛋白质, 直接相互作用。因此, 阳性遗传相互作用可用于绘制基因调控节点图, 并在生化途径7、8 中对无特征基因进行分类。
抑制是一种突变, 可以减轻另一个基因突变的疾病表型, 通常代表两个基因之间的积极遗传相互作用 9,10.与它们抑制的突变不同的位点上的抑制突变被称为外生抑制。它们在综合抢救致命表型 (也称为拉扎鲁斯效应)的同时, 在研究不可行的基因突变方面特别有价值。它们在治疗遗传病 12, 13 方面也有潜在的治疗应用。
由于所有这些原因, 在各种模型生物中的抑制突变的识别已被广泛使用, 以促进我们了解各种生化途径14,15,16。筛选抑制剂通常是基于有关突变的表型, 需要进行随机诱变, 以分离突变, 从而缓解表型。几乎所有的模型生物都建立了随机诱变方法。例如, n-乙基-n-硝基磺酸盐 (enu) 和乙基甲磺酸盐 (ems) 是两个能够诱导 dna 中的点突变的突变体, 广泛应用于从细菌到小鼠17,18、19的各种模型中。.此外, 氯化锰长期以来一直被用于酵母中, 用于锰阳离子抑制 dna 修复途径的能力 20--.另一种常见的方法是 uv 诱导的诱变, 它产生全基因组的诱变吡啶二聚体 21,22。
虽然利用化学诱变来识别抑制突变已经很流行, 但这种方法有很多缺点, 包括使用危险化学品、高可变成功率和引入额外的混淆变量由突变体对多个细胞过程23,24的负面副作用表现出来。此外, 化学诱变通常会在基因组中诱发多个突变, 这增加了使用遗传和测序技术来识别赋予抑制因子表型的确切突变25的复杂性。
为了解决目前诱变方法的缺点, 我们提出了一种方法来筛选自发抑制突变在裂变酵母不依赖任何诱变或删除库。该方法通过阳性选择法分离抑制剂。该方法的原理是基于液培养中突变抑制子群的生长优势, 可由自动板式读取器进行监测。只有当人们想在全基因组测序之前清理遗传背景或确认是否存在单基因等位基因时, 才会使用匹配和减数分裂。如果抑制表型是由单个突变引起的, 则抑制表型将在与亲本菌株回交后分离2:2。然后可以使用全基因组测序来识别抑制突变。我们提出该方法适用于液体培养中可生长到大量人群的所有微生物中的抑制剂筛选。
研究方案
1. 应变的构造和制备
- 如前面所述, 使用标准的站点定向诱变 (sdm)生成基因突变或缺失 (yfm, 你最喜欢的突变)。
- 在开始屏幕之前, (最佳的) 反交叉突变菌株与野生类型菌株, 以清洁遗传背景, 并产生新生突变细胞作为亲本菌株。在标准的富媒体板上将父母的压力流到单个菌落上。随机选择8到16个独立的殖民地 (生物复制) 与所需的突变为板材读取器分析 (参见 3.1)。
注: 只有当亲本菌株在液体介质 (最小或丰富, 有或没有药物, 或温度变化导致生长缺陷) 有生长缺陷时, 该协议才有效。所有亲本菌株都应该是单倍体, 因此能够在基因上与其他具有互补交配类型的单倍体菌株杂交。
2. 板材读取器检测
- 使用无菌施药器, 取少量步骤1.1 中准备的每个菌落 (无需确切的剂量来接种起始培养培养物), 并将其放置在96孔聚苯乙烯微板中。将每个菌落悬浮在适当的液体介质中 200μl (丰富或最小, 有或不含药物)。在包含相同介质 (无单元格) 的200μl 的板材上的每一行中都包括一个空白井。
- 在连接到自动微板读取器的板式读取器检测软件上运行以下协议: 将动态程序设置为 24小时, 温度为 30°c, 具有连续快速轨道晃动 (425 cpm, 3 mm 振幅)。将光学读数设置为测量波长为600nm 的光散射的光学密度, 并将从平板下方读取的光设置为2分钟的读数频率 (每口井在24小时内总共读取 721)。
- 24小时后, 记录最后的空白光学密度读数 (空白 od600), 并使用以下公式确定将每个样品稀释到 ob = 0.1 所需的体积:
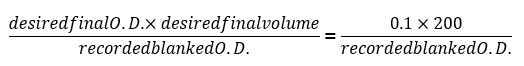
注: 从板式读取器软件导出数据, 并使用电子表格软件插入上述公式作为批处理每个试验井使用的稀释量的函数。 - 每 24小时, 使用与第0至 o. d. = 0.1 (约 1.5 x10 6 cellss/ml) 相同的介质, 使用步骤2.3 中所示的公式稀释每个样品。保存每天生成的所有生长曲线, 并注意任何显示增长率增加的单个群体, 以最终的 od 来判断, 该结果明显高于遗传背景相同的其他群体或类似于野生类型的殖民地。
注: 此检测通常需要大约7-14。在无菌条件下执行所有步骤。
3. 抑制菌落的选择和表型的确认。
- 从平板读取器检测的最后一天 (步骤 2.4), 保存有明显恢复的增长率的液体培养物, 大概是通过获得抑制突变, 可以减轻父母突变的表型。将250μl 液体培养物转移和混合到含有 250μl 50% 甘油的低温管中。闪存在液氮中的细胞冷冻, 并将菌株无限期地保存在-80oc 中。
- 为了确认抑制因子突变是一种遗传遗传元素, 请使用标准的遗传交叉方法将 yfm p (对于亲本, 在板式读取器分析开始时使用的菌株) 与yfm s (对于抑制剂, 在末端保存的菌株板读取器分析)。如果抑制因子突变确实是遗传可遗传的元素,则 yfm pxyfm s应产生四元数, 其中两个菌落具有亲本菌株的疾病表型, 两个菌落具有抑制因子的恢复生长速率应变。
- 从步骤3.2 的交叉中, 从同一遗传交叉 (每个3个生物复制体) 中选取三个具有抑制表型 (s 株) 的菌落和3个具有亲本表型 (p 株) 的菌落, 然后进行基因组 dna 提取, 然后进行基因组 dna 提取,下面的排序步骤。
注: 强烈建议执行步骤3.2 和 3.3, 但不是必需的。或者, 可以将从富含培养基3.1 收集到的回收液体培养传播到单个菌落中, 然后在没有进一步基因确认的情况下, 随机抽取三个菌落作为用于全基因组测序的生物三联体。在这种情况下, 父母菌株的三个生物三胞胎应该用于基因组测序比较。
4. 基因组 dna 提取、文库生产和测序。
- 对于 dna 提取、库制备和测序, 随机选取每yfm p 菌株的三个生物复制, 以及从基因杂交 (步骤 3.2) 或从基因杂交中单独出现的每个 yfm s 菌株的三个生物复制。已扩散以获得 s 菌株的单个菌落的板 (步骤3.3 注)。
- 在丰富的培养基中生长10毫升培养物中的菌株, 直到中对数阶段 (o. d. = 0.5-0.8, 约 0.75-1.2 x10 7 cellss/ml), 并使用晃动孵化器在30°c 下生长液体培养物, 在 250 rpm 下连续晃动。在4°c 下离心5分钟收集细胞, 在 1000 x克。
- 悬浮在400μl 的 dna 萃取缓冲液中的颗粒细胞 (2% triton x-100, 1% sds, 100 mm 氯化钠, 10 mm tris-cl (ph 8.0), 1mm na 2-edta), 然后加入400μl 的玻璃珠和400μl 的25:24:1 苯酚: 氯仿: 异戊醇。在4°c 下大力涡旋2分钟。
- 添加额外的200μl 的 dna 提取缓冲液, 并通过反转几次混合。在4°c 下离心 5分钟, 在 20, 000 x g下离心。
- 将水相转移到干净的管中, 加入20μg 的 rnase ace/t1 混合物, 在37°c 孵育15分钟。
- 加入 25: 24x-1 酚的等量: 氯仿: 异戊醇, 在4°c 时在 20, 000 x g 下旋转 5分钟, 然后将水相转移到干净的管中。
- 加入相同体积的氯仿, 通过倒置几次混合, 然后在4°c 下在 20, 000 x g 旋转 5分钟, 然后将水相转移到干净的管中。
- 在-20°c 下, 用100% 乙醇的两卷加 3 m naoac (ph 4.3) 的10% 体积沉淀 dna 至少 2小时, 然后在4°c 下在 20, 000 x g下旋转 5分钟, 并收集颗粒。
- 用冷冻70% 乙醇清洗颗粒 (沉淀 dna) 两次 (离心时为 20, 000xg , 5分钟, 4°c), 并将颗粒悬浮在50微米的 tris 缓冲器 (ph 7.4) 中。
- 根据制造商的建议, 使用库准备工具包 (见材料表) 准备整个基因组测序库。
注: 我们推荐材料表中列出的试剂盒, 因为它允许在不进行 pcr 扩增的情况下构建基因组库, 从而最大限度地减少 pcr 扩增过程中产生的错误突变。此外, 在基因组库准备过程中, 不要让珠子完全干燥, 将珠子干燥时间缩短到1-2分钟。 - 对于库准备过程中的剪切参数, 请使用有重点的声纳器 (见材料表), 并将占空系数设置为 20%, 将峰值功率设置为 175 w, 每次爆裂有200个周期, 在5.5 °c 至6°c 时的频率扫模为45度。dna 和查玛汀剪切系统 (见材料表) 具有以下设置: 脉冲模式4°c 时振幅为 50%, 脉冲模式为 15秒, 10分钟关闭 15秒, 总处理时间为20分钟。
- 必须小心处理这一步中使用的危险材料。有关处理 naoac、乙醇、25: 24x:氯仿: 异戊醇和氯仿的材料安全表和机构的环境健康和安全办公室。
- 对生成的基因组库进行排序。整个测序读数应至少覆盖整个基因组的三倍, 分辨率应在一个单一的核苷酸范围内进行。建议使用红道 (或最新技术)。
5. 用于识别抑制突变的生物信息学分析
- 进行生物信息学分析, 重点研究在所有生物复制中, 亲本菌株和被抑制的yfm菌株之间的基因组变化。
注: 下面介绍了完整的管道过程, 但是, 另外, 两个纯文本 bash-脚本文件, fastq _ 到 _ vcf. sh 和 vcfprocess. sh, 作为补充材料, 以显示从读取到 vcf 变体的工作流示例文件, 并分别处理和交集 vcf 文件。 - 使用命令行后面的 shear (https://github.com/jbpease/shear) 修剪短读 (所有其他选项默认):
剪切--fq1 $FASTQ 1-fq1 $FASTQ 2--超过 1 $OUTFQ 1-出 2 $OUTFQ 2\
--条形码 1 $BARCODE--平台 truseq--修剪 20:20
--装饰在 0--三大--滤膜长度 50--过滤器未配对 - 利用 bwa v0.7.1527从 pombe (ftp://ftp.ebi.ac.uk/pub/databases/pombase/pombe/Chromosome_Dumps/fasta/) 获得的s. pombe参考基因组的地图读取。使用以下命令行 (所有其他选项默认):
bwa mem-t 8 $GENOME $OUTFQ 1 $OUTFQ 2 > $SAM 1 - 使用 gatk v3.6 29、picardtools v2.5.0 (http://broadinstitute.github.io/picard)和 samtools v1.3.1 30, 通过 gatk 最佳实践管道28对齐sam 文件进行不同的调用。使用以下命令行和参数 (所有其他选项默认):
java-xmx30g-jar picard. jar adorre占读写组输入 = $SAM 1\
输出 = $BAMMARKED rgid脱脱1 rglb\ lib01 rgpl = luminn\
RGPU = $BARCODE RGSM = $SAMPLENUMBER
采样器固定器-o bam $BAMMARKED $BAMFIXED
samtools 排序-o bam-o $BAMSORTED-t/houne/hupe/anjb/mp $BAMFIXED
采样器索引 $BAMSORTED
java-xmx30 g-jar genomeanalysistk. jar-t haplotypepaer\
-r $GENOME-我 $BAMSORTED--基因分型模式发现 \
-立场 _ 发射 _ conf 10-stand _ call _ conf _ o $VCFRAW - 使用选项卡压缩和索引 vcf 文件:
bgzip $VCFRAW. vcf
制板 $VCFRAW - 比较亲本和抑制菌株之间的 vcf 文件, 使用 bcftools v1.3.127对复制进行排序。使用以下命令行和参数 (所有其他选项保留默认值):
bcftools isec-n+1 1. gz $VCFPARENTAL 2. gz $VCFPARENTAL 3. gz\
$VCFMUTANT 1. gz $VCFMUTANT 2. gz $VCFMUTANT 3. gz > 通用 _ varants. list
注: 此命令生成了一个用二进制模式编码的文件, 其中仅出现在第一个突变体中的序列变体将被二进制编码为 "000100", 第二个突变体仅编码为 "000010", 所有三个突变体都为 "000100" 等。这些文件是为每组父文件和突变复制 vcf 文件生成的。 - 使用 unix grep 命令将变量交集列表文件与附加到每行的文件名一起编译:
grep "." *. list > 所有. list - 使用自定义 python 脚本 (变体 _ 特性. py) 将完整的变体列表与当前 gff3 注释文件 (ftp://ftp.ebi.ac.uk/pub/databases/pombase/pombe/Chromosome_Dumps/gff3/schizosacchar omyces_pombe.chr.gff3) 进行交叉引用识别蛋白质编码区域 (同义和非同义)、5 ' 和 3 ' ucr 以及 ncrna 中一致的 snp 位点。
python3 变体 _ 特性. py--------------------------------------------------
--gff schizosaccharomyces_pombe.chr.gff3 \
--------------------------------------------ASM294v2.30.dna.genome.fa
--模式千 100--出 all.list.filter.000100
重复此脚本, 使用二进制文件修改-模式和输出文件 (-out) 的后缀
模式: 0010、000010、000 110、000010、000110和000110 - 将所有这些脚本的输出合并到一个选项卡分隔的文件中, 以便作为电子表格查看。带注释的变体表包括相对于背景的一个或两个突变菌株中出现的变体应变。二进制标志场表示单个突变株 (000100, 000010, 000010)、两个突变菌株 (000010、000100、000100) 或所有三个突变菌株 (000100) 中的外观。
- 分析在亲本样本中没有发现的、但在一个、两个或三个突变体样本中发现的带有注释的变体列表。注释表示基因组位置和变体类 (编码区域中的同义词/同义词、3 '/5 ' utr、非编码等)。从这个候选突变列表中, 一个与之密切相关的候选项的示例可能是在所有三个菌株中一致出现的非同义词编码变体。另一种类型的强候选体是在出现在同一基因内的突变株中积累各种非同义或假定的调控突变。
结果
缓慢生长的突变体在液体培养中表现出表型恢复
我们选择了三个突变体参与各种生物途径与生病, 生长缓慢, 表型: aaa 家庭 atpase elf1, 组蛋白脱乙酰酶 clr6, 和 exon 结复合物 fal1。一种野生类型菌株和携带这三个基因突变的菌株, 与野生类型菌株进行了背过处理, 并被随机选择16个单一的菌落, 在丰富的液体培养基中使用96孔板进行培养。上述。通过使用板式读取器进行连续监测, 记录了单个菌落在初始时间点 (第0天) 和6天的生长曲线。不出所料, 野生型菌落在整个实验31 (图 1) 中的生长曲线没有明显变化。值得注意的是, 有 4个具有背景和 1个假1的群体的生长正在发生巨大的转变, 从缓慢增长到与野生群体相似或接近的不同水平的增长。在戏剧性的情况下, 所有的 clr6-1突变体都表现出一致的表型恢复, 到检测结束时, 将以更快的速度增长 31 (图 1)。为了描述不同的表型, 我们指的是作为 "p 菌株" (或亲本菌株) 生长缓慢的原始菌株, 以及显示表型恢复为 "s 菌株" (或抑制菌株) 的菌株。请注意,图 1是一轮筛选实验的示例, 并不代表在以下代表性结果中确定和排序的总非互补抑制剂。
表型恢复是遗传性状引起的
在丰富的培养基中, 可以作为单倍体生长, 但在氮饥饿的情况下, 两个具有互补交配类型的单倍体株交配。裂变酵母中的减数分裂需要一轮重复, 然后是两轮细胞分裂。性循环导致四个单倍体孢子的形成携带父母菌株的遗传物质与2:2 分离的遗传特征遵循经典孟德尔遗传学的规则 (图 2a)。当在同一板块上生长相同的时间, 我们确认2:2 分离时, 反交叉所有抑制菌株 (s 菌株) 与他们的亲本菌株 (p 菌株), 这导致2个小 (生长缺陷) 和2个大 (抑制表型)殖民地。图 2b显示了抑制 elf1、 clr6-1和fal1 细胞的个别例子。我们已经证实, 所有分离的 s 菌株携带一个单基因遗传元素, 抑制其 p 菌株生长缓慢的表型 (数据未显示)。
全基因组测序成功地识别抑制突变
例如, 我们使用配对端全基因组测序来识别导致 elf1 s菌株表型恢复的遗传元素。更完整的数据分析说明可在网上查阅。简单地说, 我们使用了两个独立生成的 elf1 p菌株的生物样体和五种不同的 elf1 elf1 s 菌株的生物副本, 每个菌株都含有不同的抑制剂. 在我们从生物信息学分析 (6.1-10) 中获得注释变体的列表后, 我们确定了与我们的分析相关的某些变体类别的优先级。我们的重点是确定在单个elf1 s菌株的所有生物复制中与亲本 p 菌株相比, 一致的基因组变化(图 3和补充表 1-4)。).我们在所有五个不同的 elf1 s菌株中确定了 cds 区域的五个非同义变化, 包括rli1 +、 spbj466402、 cue2+和rli1+ +.s-a1 和 s-a2 都含有突变的 spbj6644.02, 尽管突变发生在不同的氨基酸中。由于spbpj464.02是一个具有数百次重复的长基因 (11, 916个核苷酸), 因此无法通过 pcr 结果来确认这些突变, 然后进行测序。s-a3 在rli1中包含一个删除突变体, 该突变体在两个生物重复项中都是一致的。然而, 突变体并没有与elf1背景中的 s 表型分离。我们在 s-b1 中发现了一个cue2 突变体 (cue2), 其中氨基酸396-400 缺失。s-b2 含有一个 rpl2702突变体 (rpl2702-1), 它改变了45位置的氨基酸从甘氨酸到天冬氨酸31。cue2-1和rpl2702-1均被确认为elf1 抑制剂, 如下所示。
已确定的抑制突变的遗传确认验证恢复表型的遗传性
利用现场定向诱变的标准协议, 在实验室中重建了两个被识别的非同义变化,即 cue2-1 和 rpl2702-1.双突变菌株cue2-1 elf1 p 和rpl2702-1 elf1 p 与补充elf1 p 菌株31 (图 4) 交叉。如果通过这个屏幕识别的非同义突变足以抑制elf1 p, 那么所产生的四元数将显示一个2:2 的比例, 在菌落中产生的4个孢子, 在每个四分体中产生的小到大的比率。事实上, 遗传杂交表明, 已鉴定的抑制突变成功地抑制了 p 缓慢生长的表型, 并且是可遗传的。

图 1: 通过在板式读取器中记录生长曲线, 可以监测表型恢复情况.16个单一的野生类型 (wt)、 elf1、 clr6-1和fal1 "的菌落被放置在一个96孔的盘子里。生长曲线记录在24小时内, 菌落每天在丰富的培养基中被重新稀释。生长缺陷是显而易见的低吸收率 (o. d.) 在24小时期间结束在第0天。表型回收菌株是指在第6天的24小时内, 在野生类型期间显示类似或接近野生类型生长曲线的菌株。4个菌落1、1个假1 菌落和所有氯6-1 菌落在6天后表现出不同程度的表型恢复。请点击这里查看此图的较大版本.
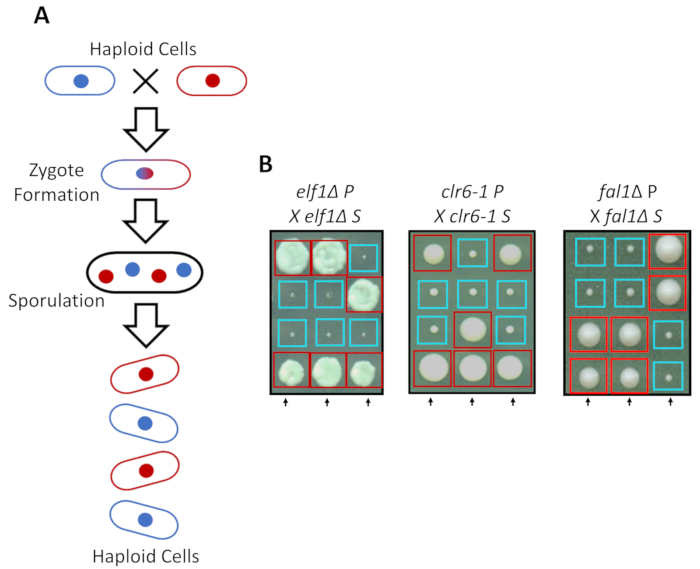
图 2: 遗传交叉可以证实表型恢复归因于单个可遗传等位基因.(a) 当裂变酵母细胞遭受氮饥饿时, 两个具有互补交配类型的单倍体细胞可以产生一个受囊, 其孢子会产生4个孢子的四体。父母遗传物质将在减数分裂过程中按照孟德尔遗传学的规则进行分离。(b) 表型恢复的菌落 (标记为 s, 为抑制) 与表明的父母基因型被反交叉与他们的补充父母菌落 (这显示没有表型恢复, 标记为 p, 为父母)。基因交叉显示 2: 2 小 (不良的健身) 大 (恢复的健身) 殖民地表明, 表型恢复是遗传性的, 可以归因于单一的遗传因素。红色盒子是携带抑制等位基因的菌落, 蓝色盒子是携带亲本等位基因的菌落。这一数字已从 marayati 等人, 2018年31修改。请点击这里查看此图的较大版本.
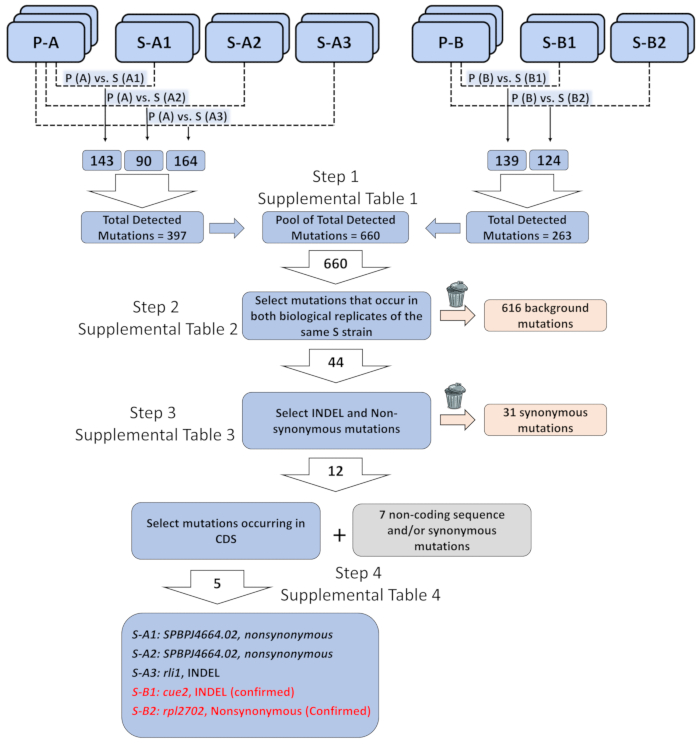
图 3: 分析全基因组测序数据, 以确定导致表型恢复的遗传因素.2个亲本 "p" 菌株 (p-a 和 p-b) 的3个生物复制, 5个表型回收的交换 "s" 菌株 (s-a1、s-a2 和 s-a3 从 p-a 中回收的2个生物复制;对 p-b 的 s-b1 和 s-b2) 进行了测序, 并将突变组织为恢复菌株中与亲本菌株基因组相比的每个突变的列表 (例如, p-a 对 s-a1 等)。在所有这些对等比较中, 整个基因组中检测到的突变总数为660。当只选择同一 "s" 菌株的两个生物复制中发生的突变时, 共发现了44个突变。在44个突变中, 12个突变为插入-缺失 (index) 或非同义突变。在 12个 index 或非同义突变中, 有5个发生在蛋白质编码序列中。这五个突变可能与造成表型恢复菌株的单个遗传元素相关: 在 s-a1 和 s-a2 中发现的spbpj464.02中的非同义突变, 在 s-a3 中发现的 index 1 中发现的 index, 在 cue2 中发现的 index 在 s-b1 中发现, 在 s-b2中发现的 rpl2702中的非同义突变。有关突变和过滤背景的详细序列信息包含在补充表 1-4中。请点击这里查看此图的较大版本.
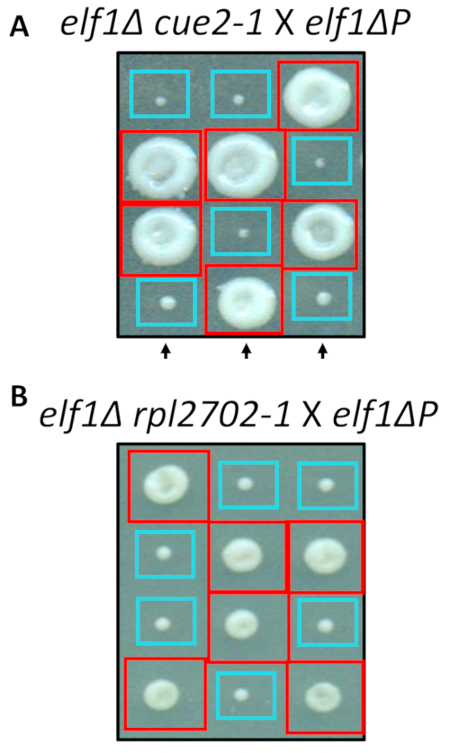
图 4: 通过全基因组测序确定的抑制剂的确认.通过独立生成突变和进行遗传杂交来证实全基因组测序的结果, 以确认表型恢复, 方法是通过将elf1 2-1 菌株与elf1 p 菌株和elf1 杂交, 确定表型恢复rpl2702-1 与 elf1 p 应变。显示了三个具有代表性的垂直四分。红盒为双突变菌落 (elf1 cue2-1, 或 elf1 rpl2702-1);蓝色的盒子是这一数字已从 marayati 等人, 2018年31修改。请点击这里查看此图的较大版本.
补充表 1. 请点击此处下载此表格.
补充表 2. 请点击此处下载此表格.
补充表 3. 请点击此处下载此表格.
补充表 4. 请点击此处下载此表格.
补充编码文件. 请点击此处下载文件.
讨论
这里描述的协议代表了一个新的和简单的筛选自发抑制突变检测到的表型恢复的突变导致缓慢增长的裂变酵母, 表型特征的400多个基因在 s. pombe,其中许多功能仍然是未知的2,32。以前的方法已经采取了其他方法来筛选微生物中的抑制突变, 包括使用突变体21, 或应用温度敏感突变背景33的温度转移。相反, 该协议表明, 表型恢复是在没有额外环境-化学干扰的情况下进行的, 并突出了抑制突变的上升最终取代液体中的可用资源的健康优势文化。此屏幕允许隔离旁路抑制剂或相互作用抑制剂, 因为它对功能损失突变 (如 elf1、或 fal1 )和点突变 (如 clr6-1) 都有效, 只要突变体在液体培养中显示适宜性缺陷。
到目前为止, 我们所调查的所有恢复的 s 菌株都已显示出不同程度的表型恢复。通过遗传交叉检测到, 回收的表型可归因于单一的遗传元素, 是可遗传的 (如图 2所示)。与通常针对多个基因组位点的基于化学或 uv 的抑制屏幕相比, 这是该方法最显著的优势之一。通常观察到在16个殖民地株中发现的一个或两个殖民地 (约 10%)在一个星期内。然而, 我们确实注意到, 某些突变体, 如 rrp6 (核特异性外显子群) 的功能损失, 从未恢复到elf1细胞31中观察到的几乎野生类型的生长速度。rrp6 的功能很可能只能通过抑制剂来部分补偿, 这与其他被测试的突变体的功能不同, 包括假,它通过其在调节方面的重要功能而被证明会造成严重的减数分裂缺陷拼接34。我们相信, 当yfg在细胞生长中具有独特的、不可替代的作用时, 替代抑制筛查方法也会受到同样的问题的影响。
在进行基因组测序之前, 最好是对从读板机中发现的表型恢复的菌落进行反式处理, 并使用亲本菌株清除遗传背景并获得生物复制。此外, 深度全基因组测序可识别数百种单核苷酸变化, 其中大部分与对筛选兴趣不大的生物复制物之间并不相同。例如, 我们发现在两个elf1 p 和五个不同的 s 菌株之间的所有三条染色体上总共有660种基因组改变 (图 3)。我们通常没有观察到每个菌株的测序生物复制之间的相同突变, 这表明在基因组库构建之前, 在培养elf1 细胞的过程中可能会出现新的突变, 或者随机错误可能是随机错误。介绍在库的建设和排序。因此, 在生物复制过程中分离一致的突变是使用全基因组测序成功识别抑制剂的一个重要方面。
我们在五株 s 系中发现并确认了 cds 地区的两种抑制剂。虽然在 s-a1 和 s-a2 菌株中都检测到spbpj464.02中的突变, 但spbpj466402不可能是有效的抑制因子, 因为 s-a1 和 s-a2 不包含同一基因上的抑制器, 因为它们之间不是互补的 (数据)。我们也没有证实 s-a3 中的 rli1 , 它在与elf1反交叉时没有与 s 表型分离。或者, 我们在 s-a1、s-a2 和 s-a3 中的非编码区域中发现了特定的突变。这些改变后的非编码基因组区域有可能缓解elf1 表型, 这将在我们未来的研究中得到解决。与传统的方法 (如连锁分析) 相比, 在确认单基因元素导致 s 表型后, 我们在两个月内确定了两种抑制剂, 这种方法可能需要数年时间来绘制基因突变图。随着全基因组测序技术的快速发展, 我们乐观地认为, 在可预见的未来, 这种方法将更有效地识别一致的基因突变。
总之, 该协议提供了逐步的指导, 以成功地识别抑制突变的任何感兴趣的基因与缓慢增长的缺陷, 在液体培养。这种检测的简单性允许大规模筛选感兴趣的多个遗传背景, 几乎没有实践培训。通过使用液体处理机器人进行日常稀释, 有进一步自动化这一过程的空间。由于实验室对微生物的操纵不可避免地需要液体培养的生长, 这个过程对健身具有内在的选择性, 我们建议该协议可以广泛地应用于其他大种群模型生物, 如细菌和其他酵母种。
披露声明
提交人声明, 制造商没有认可这种方法中使用的工具, 也没有相互竞争的金融利益。
致谢
这项工作得到了国家普通医学研究所的支持, 向 k. z 提供了1R15GM119105-01。我们感谢所有评审人员提出的有见地的意见。我们还感谢詹姆斯·塔克、艾丽西亚·安德森、伊丽莎白·布莱克和格伦·马尔斯对这份手稿的讨论和评论。
材料
| Name | Company | Catalog Number | Comments |
| Adenine, Powder | Acros Organics | 147441000 | Use at 75 mg/L to make liquid and solid rich media (YEA) |
| Bacteriology Petri Dish | Corning, Falcon | C351029 | 100 ×15 mm, use to grow strains to single colonies on solid rich media |
| D-Glucose Anhydrous, Powder | Fisher Chemical | D16-1 | Use at 30 g/L to make liquid and solid rich media (YEA) |
| Difco Agar, Granuated | Becton, Dickinson and Co. | 214530 | Use at 20 g/L to make solid rich media (YEA) |
| DNA extraction buffer | 2% Triton X-100, 1% SDS, 100 mM NaCl, 10 mM Tris-Cl (pH 8.0), 1mM Na2-EDTA | ||
| Focused-ultrasonicator | Covaris Inc. | S220 | Alternatively, use QSonica Q800R sonicator/DNA and chromatin shearing system |
| Gen5 Data Collection and Analysis Software | Biotek, Inc. | GEN5SECURE | Or equivalent, must be compatible with the micro-plate reader, use to export data readings from the micro-plate reader |
| Hydrochloric Acid 1N, Liquid | Fisher Chemical | SA48-4 | Use to adjust pH to 5.5 in liquid and solid rich media |
| Liquid Rich Media (liquid YEA) | 30 g/L D-Glucose, 5 g/L Yeast Extract, 75 mg/L Adenine, pH adjusted to 5.5 with 1 M HCl | ||
| Microplate Reader, Synergy H1 Hybrid Multi-Mode Reader | Biotek, Inc. | BTH1MG | Or equivalent, must read visible light at 600 nm wavelength range |
| Rich Media agar plates (YEA plates) | 30 g/L D-Glucose, 5 g/L Yeast Extract, 75 mg/L Adenine, 20 g/L Agar, pH adjusted to 5.5 with 1 M HCl. | ||
| RNase A/T1 mix | Thermo Fisher Scientific | EN0551 | Use according to manufacturer recommendation |
| Sterile Polystyrene Inoculating Loop | Corning, Inc. | OS101 | Or equivalent, use to transfer colonies from agar plates to 96-well plate |
| Sterile workspace and burners | |||
| Tissue Culture Plate, 96-well Optical Flat Bottom with Low Evaporation Lid | Corning, Falcon | C353072 | Or equivalent, must have optical flat bottom for micro-plate ready |
| TruSeq DNA PCR-Free LT/HT Library Prep Kit | Illumina, Inc. | 20015962 | Use to prepare the whole-genome sequencing library |
| Yeast Extract, Powder | Fisher Chemical | BP1422-500 | Use at 5 g/L to make liquid and solid rich media (YEA) |
参考文献
- McKay, J. K., Latta, R. G. Adaptive population divergence: Markers, QTL and traits. Trends in Ecology and Evolution. 17 (6), 285-291 (2002).
- Wood, V., Harris, M. A., et al. PomBase: A comprehensive online resource for fission yeast. Nucleic Acids Research. 40 (D1), (2012).
- de Visser, J. A. G. M., Cooper, T. F., Elena, S. F. The causes of epistasis. Proceedings of the Royal Society B: Biological Sciences. 278 (1725), 3617-3624 (2011).
- Sailer, Z. R., Harms, M. J. Detecting high-order epistasis in nonlinear genotype-phenotype maps. Genetics. 205 (3), 107911088(2017).
- Kuzmin, E., Costanzo, M., Andrews, B., Boone, C. Synthetic genetic arrays: Automation of yeast genetics. Cold Spring Harbor Protocols. 2016 (4), 326-332 (2016).
- Tong, A. H. Y., Boone, C. Synthetic genetic array analysis in Saccharomyces cerevisiae. Methods in Molecular Biology. 313 (1), 171-192 (2006).
- Dixon, S. J., Costanzo, M., Baryshnikova, A., Andrews, B., Boone, C. Systematic Mapping of Genetic Interaction Networks. Annual Review of Genetics. 43 (1), 601-625 (2009).
- Boone, C., Bussey, H., Andrews, B. J. Exploring genetic interactions and networks with yeast. Nature Reviews Genetics. 8 (6), 437-449 (2007).
- Bai, X., Yang, Z., Jiang, H., Lin, S., Zon, L. I. Genetic suppressor screens in haploids. Methods in Cell Biology. , 129-136 (2011).
- Manson, M. D. Allele-specific suppression as a tool to study protein-protein interactions in bacteria. Methods. 20 (1), 18-34 (2000).
- Motter, A. E., Gulbahce, N., Almaas, E., Barabási, A. L. Predicting synthetic rescues in metabolic networks. Molecular Systems Biology. 4, 168(2008).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nature Biotechnology. 22 (5), 595-599 (2004).
- Giorgini, F., Guidetti, P., Nguyen, Q., Bennett, S. C., Muchowski, P. J. A genomic screen in yeast implicates kynurenine 3-monooxygenase as a therapeutic target for Huntington disease. Nature Genetics. 37 (5), 526-531 (2005).
- Forsburg, S. L., Patton, E., et al. The art and design of genetic screens. Nature reviews. Genetics. 2 (9), 659-668 (2001).
- Johnston, D. S. The art and design of genetic screens. Genetics. 3 (March), 176-188 (2002).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: Caenorhabditis elegans. Nature Reviews Genetics. 3 (5), 356-369 (2002).
- Gocke, E., Müller, L. In vivo studies in the mouse to define a threshold for the genotoxicity of EMS and ENU. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 678 (2), 101-107 (2009).
- Suzuki, T., Hayashi, M., et al. A comparison of the genotoxicity of ethylnitrosourea and ethyl methanesulfonate in lacZ transgenic mice (Muta(TM)Mouse). Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 395 (1), 75-82 (1997).
- Uttam, J., Alberico, C., De Stasio, E. ENU Mutagenesis. International C. elegans Meeting. , (1995).
- Putrament, A., Baranowska, H., Ejchart, A., Prazmo, W. Manganese Mutagenesis in Yeast. Methods in Cell Biology. 20, 25-34 (1978).
- Bose, J. L. Chemical and UV mutagenesis. Methods in Molecular Biology. 1373, 111-115 (2016).
- Ikehata, H., Ono, T. The Mechanisms of UV Mutagenesis. Journal of Radiation Research. 52 (2), 115-125 (2011).
- Shrivastav, N., Li, D., Essigmann, J. M. Chemical biology of mutagenesis and DNA repair: cellular responses to DNA alkylation. Carcinogenesis. 31 (1), 59-70 (2010).
- De Stasio, E. A., Dorman, S. Optimization of ENU mutagenesis of Caenorhabditis elegans. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 495 (1-2), 81-88 (2001).
- Probst, F. J., Justice, M. J. Mouse mutagenesis with the chemical supermutagen ENU. Methods in Enzymology. 477 (C), 297-312 (2010).
- Bähler, J., Wu, J. Q., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows – Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Van der Auwera, G. A., Carneiro, M. O., et al. From fastQ data to high-confidence variant calls: The genome analysis toolkit best practices pipeline. Current Protocols in Bioinformatics. 43, 11.10.1-11.10.33 (2013).
- Mckenna, A., Hanna, M., et al. The Genome Analysis Toolkit: A MapReduce framework for analyzing next-generation DNA sequencing data. Genome Research. 20, 1297-1303 (2010).
- Li, H., Handsaker, B., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Marayati, B. F., Drayton, A. L., et al. Loss of Elongation-Like Factor 1 Spontaneously Induces Diverse, RNase H-Related Suppressor Mutations in Schizosaccharomyces pombe. Genetics. 209 (4), 967-981 (2018).
- Harris, M. A., Lock, A., Bähler, J., Oliver, S. G., Wood, V. FYPO: The fission yeast phenotype ontology. Bioinformatics. 29 (13), 1671-1678 (2013).
- Xu, X., Wang, L., Yanagida, M. Whole-Genome Sequencing of Suppressor DNA Mixtures Identifies Pathways That Compensate for Chromosome Segregation Defects in Schizosaccharomyces pombe. G3: Genes|Genomes|Genetics. 8 (3), 1031-1038 (2018).
- Marayati, B. F., Hoskins, V., et al. The fission yeast MTREC and EJC orthologs ensure the maturation of meiotic transcripts during meiosis. RNA. 22 (9), 1349-1359 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。