需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
兔子模型中的跨胸超声心动图检查
摘要
在这里,我们一步一步地描述在兔子模型中执行超声心动图的详细协议。我们展示了如何正确获取不同的超声心动图视图和成像平面,以及人类和兽医患者常用的临床超声心动图系统中可用的不同成像模式。
摘要
大型动物模型,如兔子,对临床前转化研究很有价值。与人类和其他大型动物模型(如狗和猪)相比,兔子的心脏电生理学相似。然而,与其他大型动物模型相比,兔子模型具有较低的维护成本的额外优势。使用超声心动图对心脏功能进行纵向评估,如果实施得当,是临床前评估心力衰竭新疗法的有用方法,减少喷射分数(例如心脏再生)。正确使用这种非侵入性工具需要按照国际准则实施标准化检查协议。在这里,我们一步一步地描述由兽医心脏病学家监督在兔子模型中进行超声心动图的详细方案,并演示如何正确获取不同的超声心动图视图和成像平面,以及临床超声心动图系统中常用的临床成像模式,用于人类和兽医患者。
引言
大型动物模型中心脏功能的纵向评估是一种强有力的研究方法,通常用于评估治疗缺血性和非缺血性心肌病的新疗法的效果。在可用于临床前研究的几种心血管成像技术中,超声心动图因其非侵入性和可移植性特性而得到广泛应用。在有经验的手,超声心动图也是一个非常可重复的成像技术,研究心脏解剖学以及收缩和舒张功能的心脏。
大型临床前动物模型,如猪、狗和兔子,对于临床前转化研究1、2、3至关重要。事实上,新疗法(如心脏再生医学)在心肌病设置中的潜在益处需要在大型临床前模型中进行广泛的假说测试,然后才能考虑供人类使用2、4.与其他大型临床前模型相比,兔子模型具有一些优点,包括维护成本低,与小鼠和大鼠相媲美。然而,与小鼠和大鼠相比,Ca+2运输系统和心脏电生理学在兔子中与人类相似,其他大型动物模型(如狗和猪)相似,从而增加了兔子的转化潜力。型号1,5.因此,兔子作为一种大型的实验前临床模型,在临床前转化研究中具有独特的成本平衡和可重复性。
兔子在使用人类和兽医患者常用的临床超声装置进行超声成像的可维护性方面,具有额外的优势,从而充分利用了谐波成像和最先进的技术。技术。为此,首选频率相对较高(高达 12 MHz)的扇区传感器(也称为相位阵列),例如新生儿/儿科心脏病学中使用的传感器。在兔子临床前模型中的超声心动图检查允许使用现代超声心动图单元(例如连续波多普勒(CWD)中的多种视图和不同模式,对收缩和舒张功能进行完整评估,脉冲波多普勒(PWD)和组织多普勒成像(TDI)。
回声心动图是一种依赖于操作员的技术,因此需要根据国际准则对该技术进行广泛的培训和核心知识。通过视频的可视化,可以促进此培训的一部分,并详细解释如何获得不同的超声心动图视图。实现高超声心动图成像能力,以及开发标准化协议和正确技术,对于尽量减少操作员的影响和生成可靠的定量数据至关重要,因为需要严格科研。
对于兔子和其他大型动物模型用于超声心动图的系统和实验室设置,有必要考虑一些注意事项。对于心脏功能的标准跨胸超声心动图评估,超声系统必须包括以下模式:二维模式(B模式或2D)、运动模式(M模式)、彩色多普勒以及CWD、PWD和TDI。此外,该机器应安装完整的心脏分析和测量软件,以及足够的内部硬盘空间,以存储足够的高质量数字静止图像和视频循环,以便离线分析。有些系统使用线性阵列传感器;然而,为了获得最佳心脏成像效果,具有小扫描头直径的相控阵扇区传感器是首选,因为这些传感器允许超声波更容易通过狭窄的闭周空间。对于兔子,我们使用相对较高的频率传感器(高达12 MHz)。动物的成像位置对于获得高质量的图像至关重要。因此,建议在超声心动图检查期间获得所有标准成像平面的左右侧侧卧位。为此,建议使用与胸部心脏区域重合的切口的桌子(图1A)。此凹槽表便于传感器进入将扫描的胸部区域,因此允许操作员手保持动物最佳扫描位置的自由流动。将动物置于横向卧位位置会导致心脏向传感器下降和肺升高,并通过体间空间拓宽超声波光束的进入窗口,从而改善整体成像质量 (图 1A)超声心动图检查应以盲视方式进行,并遵循美国兽医内科学院心电图委员会和美国回声心电图学会/欧洲心血管成像协会6,7,8。
我们的科学团队的一部分与兽医教学医院的心脏病服务有关,该医院每天为兽医患者(如狗和猫)提供服务,并为此接受兽医心脏病学和超声心动图,及其不同的成像模式,以及在成像不同尺寸的动物患者和胸腔符合这种技术的丰富经验。此外,我们通常使用超声心动图在兔子模型引起的心肌病9心脏功能的纵向评估。在这里,我们描述了一个逐步的超声心动图方案,用于在大型临床前模型(如兔子)中使用临床超声单元评估心脏功能。该协议适用于当前的国际准则8,并包括基于我们在临床和实验环境中的经验的实用建议。
研究方案
此处所述的实验由西班牙穆尔西亚大学伦理研究委员会批准,并根据欧盟委员会指令 2010/63/EU 进行。所述步骤是在标准操作协议下执行的,这些规程是工作计划的一部分,并非完全为了拍摄本文附带的视频而执行。
1. 准备兔子
- 在继续之前,首先在同一注射器中注射氯胺酮(10毫克/千克)与麦地胺(200微克/千克)的均质组合,对动物进行麻醉,这将减轻兔子手术的压力。
注:使用麻醉还可以以可预测的方式降低心率,从而减少个体间变异性,并具有提高整体成像质量的额外好处。如视频所示,用手术毯盖住头部,以帮助在麻醉注射过程中保持动物的镇定。- 通过确认存在肌肉松弛、无苍白反射、皮面运动和嗅探,验证动物在10-20分钟内是否完全麻醉。后两个体征(下颌运动和嗅觉)的存在,反过来又是麻醉深度降低的最早迹象。即使很少需要,如果预期需要长时间的延迟才能完成程序,也应考虑重新剂量(例如,初始麻醉剂量组合的一半)。
注意:虽然动物在注射后的第一个+5分钟内会迅速入睡,但建议在尝试操纵动物之前,允许麻醉的深层。这种延迟将避免困扰兔子,否则可能会产生心动过速,并在超声心动图检查(例如线心检查)期间对某些参数的成像准确性和可重现性产生不利影响。 - 一旦动物被麻醉,使用剪发器从胸部的皮肤去除头发。从颈线下方开始,继续到左右忧郁症区域的水平,以及中间线的亚西波地区(图1B)。
- 右前肢内脸的1-3厘米2,以及左右后肢的中庭区域(图1B)。
- 通过确认存在肌肉松弛、无苍白反射、皮面运动和嗅探,验证动物在10-20分钟内是否完全麻醉。后两个体征(下颌运动和嗅觉)的存在,反过来又是麻醉深度降低的最早迹象。即使很少需要,如果预期需要长时间的延迟才能完成程序,也应考虑重新剂量(例如,初始麻醉剂量组合的一半)。
- 将兔子放在热毯或加热垫上以避免手术过程中体温过低,在电极上涂上合适的导电凝胶,并将其放置在四肢的被扫描区域。用胶带固定电极。
- 验证系统屏幕上是否显示正确的心电图信号;通常同时进行1引线心电图追踪,足以在整个超声心动图研究中同步监测心律(图1A和图1C)。
注:除了心率外,还监测呼吸速率和温度。呼吸速率可以通过超声心动图像中胸腔运动的发生率进行目视监测,而温度应通过直肠探头进行监测。这些参数应在开始时、然后每 10 分钟和过程结束时进行监控。兔子在麻醉过程中不会呕吐10,11;因此,在超声心动图检查之前,不经常建议禁食兔子。
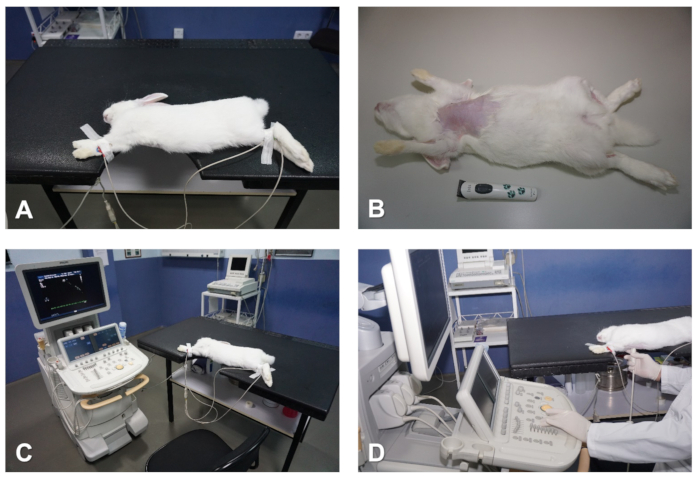
图 1.准备和定位兔子的超声心动图。(A) 具有切口的表,与要成像的心脏区域重合。(B) 从胸部取下头发。(C) 连接心电图电极以监测心脏.(D) 在进行超前超声心动图检查时,操作人员的定位。请点击此处查看此图的较大版本。
2. 心脏的截面长轴(护身符)视图
- 要获得心脏的腰形长轴 (PSLAX) 视图,将兔子置于右侧侧卧位位置,用手术胶带将前肢伸出远离胸腔(图 1A和图 1C)。
- 为了达到最佳的成像质量,保持胸腔区域的皮肤尽可能平坦,以增加穿透力,提高整体成像质量,同时对动物进行成像非常重要。为此,用一只手握住前肢远离胸腔,同时使用自由手识别任何皮肤褶皱和口袋,从上到下将这些褶皱平平,并将任何皮肤折叠从胸部移向兔子的侧和背部。这对年长和较大的兔子尤其重要,因为兔子的皮肤过多和皮下脂肪组织会降低图像质量。
注:胸部的心脏区域应位于表格的切口部分。然而,请记住,在这个位置,腹部有一个自然倾向,向切口移动,并产生一个积极的压力,取代心脏颅骨,然后干扰良好的超声心动图成像。为了防止这种情况,腹部完全放在桌子上是很重要的,为了达到这个目的,通过温和的按摩将腹部器官轻轻地移向动物的胆小区域(图1A和图1C)是很有用的。
- 为了达到最佳的成像质量,保持胸腔区域的皮肤尽可能平坦,以增加穿透力,提高整体成像质量,同时对动物进行成像非常重要。为此,用一只手握住前肢远离胸腔,同时使用自由手识别任何皮肤褶皱和口袋,从上到下将这些褶皱平平,并将任何皮肤折叠从胸部移向兔子的侧和背部。这对年长和较大的兔子尤其重要,因为兔子的皮肤过多和皮下脂肪组织会降低图像质量。
- 对于超声心动图成像,用右手握住传感器,同时用左手操作超声心动图系统的控制,如图1D所示。
- 为了保持良好的皮肤接触,将未稀释的乙醇涂到皮肤上,然后将足够的超声波传输凝胶涂抹到传感器的头部。
- 接下来,将传感器与右半截面的皮肤紧密定位,在第二至第三个间质空间的水平上,距离右半截线约 1-3 厘米,传感器方向标记指向动物的右肩,相对于中线大约 30° 的角度 (图2A)。这应该产生心脏正确 PSLAX 的图像(请参阅代表性结果)。
- 在屏幕上显示 2D 心脏图像后,下一步是调整超声波单元控制以获得最佳图像。主要有:
- 深度和缩放控件:使用这些控件优化感兴趣区域。图像的深度必须足够,以便在每个图像上可以看到心脏结构。使用缩放工具更好地评估感兴趣的结构,例如阀门和传单的完整性。
- 总增益和时间增益补偿(即,实时获得不同深度的增益设置):控制灰度和手动增益,以尽量减少背景噪声并最大化心脏结构的划定。这些参数在兔子中尤其重要,因为心室心肌的回波性较差。
- 动态范围或压缩:使用此控件可调整图像显示的灰色阴影数。设置动态范围,使血库变暗,组织明亮。这将导致更好的心内边界定义,这对获得左心室体积非常重要。
- 扇区宽度:从宽扇区(90°)开始检查,并在心脏概述后,如果特定区域需要更好地成像,请减小扇区宽度。减小扇区大小通过提高帧速率来提高时间分辨率。当使用 2D 超声心动图指导多普勒检查时,这一点尤其重要。
- 为了在成像兔子的同时保持传感器的位置,并减轻操作者疲劳,使用食指将手固定在动物的桌子或胸部,而其他手指则握住传感器(图2A)。
- 在正确的 PSLAX 视图中获取心脏的两个主要成像平面。
- 找到一个成像平面,它纵向分割心脏,并可以识别心脏的所有四个腔室(两个心室和两个心室);此外,当使用宽视野时,心的顶点也应出现在图像左侧(请参阅"代表结果"部分)。
- 相对于成本空间以及超声束的颅角和多索文拉角执行传感器的细微运动,如扫描、摇动和旋转,以获得半截面长轴视图的其他成像平面(图 2A,B。在其他成像平面中,可以识别左心室流出轨迹 (LVOT) 和主动脉(参见代表性结果)。
- 图像方向:请注意,心底将位于扇区图像的右侧。
- 获得适当的成像平面后,使用 B 模式评估心脏的整体功能,并使用彩色多普勒评估所有瓣膜的血流以及中间隔膜 (IVS) 的完整性。
注: 始终保存不同视图和平面的图像,以便进行离线分析。
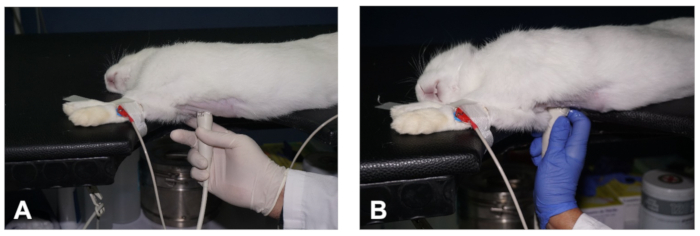
图 2.如何获得PSLAX的心脏视图。(A- B)定位传感器以获取心脏 PSLAX 视图的两个不同平面(请参阅文本中的说明)。请点击此处查看此图的较大版本。
3. 心脏的半轴短轴视图
- 传感器在胸部的同一位置,同时显示一个对齐良好的PSLAX,对传感器进行约90°(图3A)的逆时针旋转,以获得右半身短轴(PSSAX)视图。这一次,传感器方向标记应指向兔子的左肩。
注:为帮助在旋转传感器时将传感器保持在胸部的相同位置,请使用左手从传感器的电源线执行旋转,如图3B所示。 - 在半轴短轴视图中,通过沿心脏轴扫描传感器获得三个成像平面:中心室、斜面阀和高基,肺动脉 (PA) 和主动脉瓣 (AoV) 在视图中。
- 在心室中成像平面中,在心形肌肉和弦肌腱水平(图 3C)处分割心脏,在图像底部显示右心室 (RV) 和左心室 (LV)(参见代表性结果)。
- 使用 B 模式评估 LV 的径向和圆周收缩和松弛,并检查区域壁运动异常。
- 使用 M 模式,在轨迹球的帮助下,将光标实时移动在 2D 图像上,然后将光标放置在 LV 的中间,在两个毛骨肌肉之间,垂直于 IVS 和左心室自由壁 (FW) (图 3C)。在屏幕上显示 M 模式图像后,存储图像以进行离线分析。在心率较高的兔子中,使用较高的扫描速度在心脏周期(例如,150 mm/sec)更好地分离心脏事件。
- 通过将传感器扫向头方区域(图3D),获得斜面阀(MV)平面。使用 B 模式和 M 模式评估 MV 传单的完整性和动性。将光标沿LV中间放置,垂直于IVS(图3E),以获取有关MV相对于IVS的偏移的详细信息。
- 进一步扫描传感器,在高基级(也称为 AoV 平面)处产生成像平面;图 3F - H),其中可以识别 AoV 及其传单、右心室流出轨迹 (RVOT)、PA 和左右耳塞 (LA)(参见代表性结果)。
- 图像方向:请注意,PA 将位于扇区图像的右侧。
- 要完全可视化 PA 及其分叉,请使用更大的血管,有时,传感器的颅位位(一个闭周空间)。
- 使用 B 模式评估这些结构的大小和形状(例如,充血性心力衰竭时左心房大小增加),并使用彩色多普勒和 PWD 在 PV 级别记录血流(流出)的速度,将样本体积置于略低于打开光伏传单(图3G)。最后,使用 M 模式,将光标沿 AoV 和 LA 放置 (图 3H)。
- 使用以下主要控件和调整来获得足够的颜色流多普勒图像:
- 由于颜色扇区位于感兴趣区域,请尽可能减小色段和血流方向之间的角度。
- 色扇宽度:调整这个阀区,以提高帧速率,改善色流信息。
- 基线和脉冲重复频率 (PRF):调整色条和 PRF 上的基线,以允许显示更高的速度。颜色条顶部和底部的数字表示颜色混叠发生之前的最大可检测速度。
注: 与光谱脉冲多普勒相比,混叠在颜色流处理中更为频繁,因为分配了一部分脉冲来获取横截面图像,从而损害了色流多普勒信息。 - 颜色增益:首先,将其增加到刚刚开始创建背景杂色的程度,然后降低到优化颜色流成像的级别。
- 使用以下主要控件获得足够的光谱多普勒图像:
- 光标位置:使这个平行于血流方向;至少,保持在一个角度 < 30°。
- 门位置:它是光标行中与采样站点对应的标记。将其放在主动脉和肺瓣膜之后,放在耳欲使瓣膜瓣膜的传单提示处。
- 浇口大小:使用最小设置,但获取小回流流除外。
- 基线:根据血流的方向选择基线。当血液流向传感器(例如肺和主动脉流动)时,或当血液流向传感器时(例如,眼膜瓣流),将其放在顶部。
- 比例:根据血流速度选择这个,通常比获得的速度高25%。
- 多普勒增益:用它来增强多普勒信号。增加增益,直到显示颜色。
- 多普勒信号的着色:当多普勒光谱较弱时使用洋红色,因为它使速度更锐利。
- 壁滤波器:用它来减少心脏壁产生的低频噪声量。
- 扫描速度:使用更高的扫描速度,以方便时间测量。
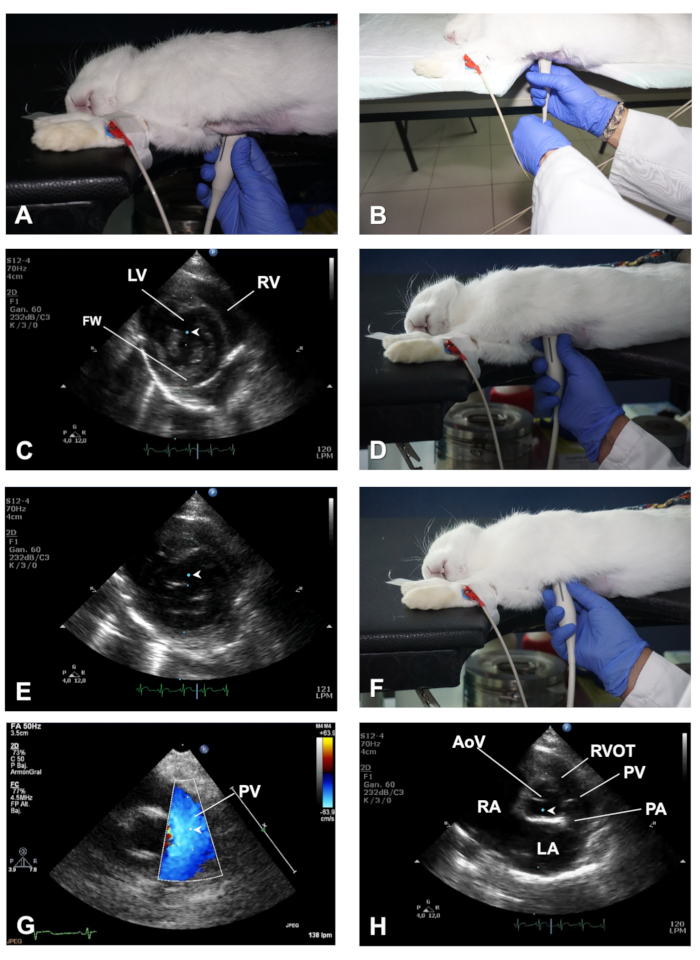
图 3.如何获取 PSSAX 视图及其不同的成像平面。(A) 传感器的位置,以获得在毛细管肌肉水平上的 PSSAX 视图。(B) 演示从 PSLAX 视图切换到 PSSAX 视图时,左手的作用有助于旋转传感器。(C) M 模式光标在 PSSAX 视图的毛细管肌肉平面中的位置。(D) 传感器的位置,以获得线瓣阀平面上心脏的PSSAX视图。(E) M 模式光标在 PSSAX 视图的 MV 平面中的位置。(F) 传感器的位置,以获得在PSSAX视图中的AV平面。(G) 显示彩色多普勒和 PWD 样本体积的定位,以评估 PV 的流出。(H) M 模式光标在 PSSAX 视图的 AoV 平面中的位置。LV = 左心室;RV = 右心室;FW = LV 自由壁;AoV = 主动脉阀;RVOT = 右心室流出轨道;PV = 肺瓣膜;PA = 肺动脉;洛杉矶 = 左中庭;RA = 右中庭。请点击此处查看此图的较大版本。
4. 心形四室视图
- 要获得 Apical 4 腔 (AP4C) 视图,将兔子置于左侧侧卧位位置,通过手术胶带将前肢伸离胸腔区域(图 4A)。以与上述类似方式保持胸部皮肤扁平(步骤 2.1.1)。胸部的心脏区域应位于桌子的切口部分。同样,通过温和的按摩,腹部在移动腹部器官后,应在桌子上得到很好的支撑。
- 将超声波凝胶涂到传感器上,然后通过表中的切口进入心脏,并将其与左半目肌的皮肤紧密地放置,在具有中胸线的4-5个间质空间的水平上,传感器方向标记指向兔子的背部(在左肩骨的方向) (图 4B)。这样,传感器与心脏顶点正交,超声波束定向到心脏底部。
- 如有必要,如有必要,将传感器向上移动一个成本空间,直到第 4 个成本间空间(通常称为"窗口购物")。
- 到达适当的间质空间(可能因兔子的大小和/或年龄而异),观察心脏从顶点到心脏底部的图像,这是典型的心脏形状,可以看到所有四个腔室,左侧和右侧图像顶部和脑后室的分心室(参见图4C、D和代表性结果)。
- 图像方向:请注意,LV 将位于扇区图像的右侧。
- 避免在此视图中提前缩短顶点,以便心脏的典型 AP4C 视图应给出具有 IVS 中间的 LV 的子弹形图像(图 4CD )。如果顶点为圆角,则 LV 可能会缩短;因此,向下移动传感器一个成本空间和/或传感器的倾斜。
- 使用 B 模式检查区域壁运动异常,并具有 LV 函数的全局视图。使用彩色多普勒评估三角阀的流量,并使用 PWD 并将样本体积定位在 MV 传单提示的水平上,以获得 MV 流入光谱的图像(图 4C)。
- 使用 TDI 模式并将样品体积放置在斜面阀环的隔膜和侧边(图 4D)。
- 使用 M 模式并将光标与横向 MV 环形对齐,以获得斜面环形平面收缩偏移 (MAPSE)。将图像存储在每种模式下,以便离线分析心脏功能。
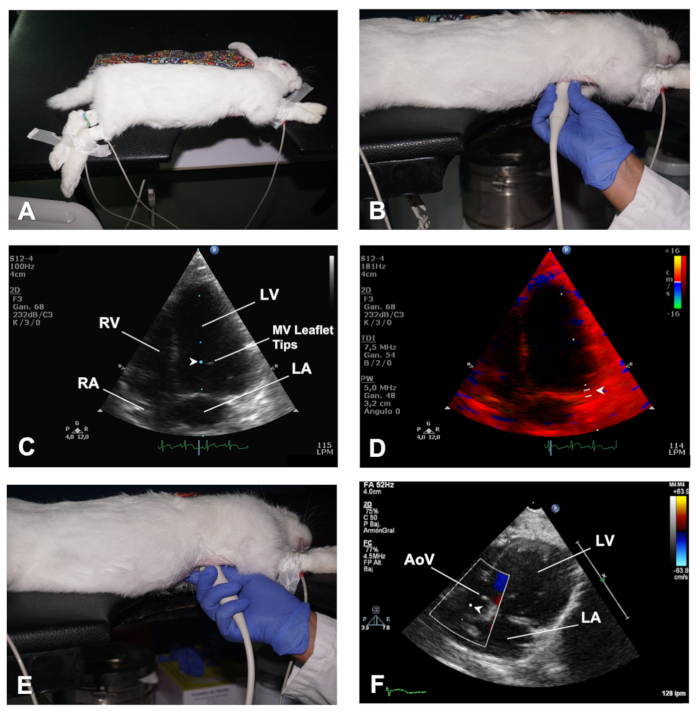
图 4.如何获取心脏的 AP4C 和 AP5C 视图。(A) 兔子在左侧侧侧下放置,以观察心脏的 AP4C 视图。(B) 传感器的位置,以获得心脏的 AP4C 视图。(C) 在 MV 传单提示处定位样本量,以评估 MV 流入。(D) 用于 TDI 分析 MV 环形侧心肌速度的样本体积的位置。(E) 传感器的位置,以获得心脏的 AP5C 视图。(F) 用于 PWD 分析整个 AoV 流出的样本体积的位置。LV = 左心室;RV = 右心室;MV = 斜面阀;洛杉矶 = 左中庭;RA = 右中庭;AoV® 主动脉阀。请点击此处查看此图的较大版本。
5. 心形5室视图
- 从传感器在与 AP4C 视图中相同的位置开始,执行柔和的倾斜(图 4E),直到 LVOT 和 AoV 进入视野,这是心脏的 apical 5 室视图 (AP5C)(参见代表性结果)。
- 使用 B 模式评估 LVOT、AoV 传单的移动以及 LV 型腔大小和功能。
- 使用彩色多普勒模式评估整个AoV的流出,并使用PWD通过将样品量定位在AoV的正后面来评估该阀的流量(图4F)。
结果
心脏的半轴长轴视图
图 5A显示了右侧 PSLAX 视图的成像平面,其中心脏的 4 个腔室清晰区分。在此视图中,您可以识别右心室 (RV)、三头气门 (TV)、IVS、LV、FW 以及斜面阀 (MV)。当顶点在此视图中图像左侧清晰可见且 LV 未缩短时,可以使用磁盘的双平面方法(修改辛普森的规则)准确估计 LV 体积,如图<...
讨论
我们描述了一个在兔子的心脏功能参数的超声心动图检查协议,代表一个大型临床前模型1,2,3。本文所述的逐步方法应视为指导,通过对超声心动图基本原则的补充研究和超声成像的基本知识,将帮助研究人员通过实践和互补和专家指导,在相对较短的时间内提供高质量的数据。
使用此处描述的超声心动图协议,...
披露声明
作者没有什么可透露的。
致谢
这项工作部分得到了以下国家的支持:塞内卡基金会、西班牙穆尔西亚大学(JT)和联合王国雷丁大学(中央供资)。资助者在研究设计、数据收集和分析、决定出版或编写手稿方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| Bluesensor | Medicotest | 13BY1062 | Disposable adhesive ECG lectrodes |
| Domtor (Medetomidine) | Esteve | CN 570686.3 | Veterinary prescription is necessary |
| HD11 XE Ultrasound System | Philips | 10670267 | Echocardiography system. |
| Heating Pad | Solac | CT8632 | |
| Imalgene (Ketamine) | Merial | RN 9767 | Veterinary prescription is necessary |
| Omnifix-F 1 ml syringe | Braun | 9161406V | |
| S12-4 | Philips | B01YgG | 4-12 MHz phase array transducer |
| Ultrasound Transmision Gel (Aquasone) | Parker laboratories Inc. | N 01-08 |
参考文献
- Pogwizd, S. M., Bers, D. M. Rabbit models of heart disease. Drug Discovery Today Disease Models. 5, 185-193 (2008).
- Gandolfi, F., et al. Large animal models for cardiac stem cell therapies. Theriogenology. 75, 1416-1425 (2011).
- Harding, J., Roberts, R. M., Mirochnitchenko, O. Large animal models for stem cell therapy. Stem Cell Research & Therapy. 4, 23 (2013).
- Chong, J. J., Murry, C. E. Cardiac regeneration using pluripotent stem cells--progression to large animal models. Stem Cell Research. 13, 654-665 (2014).
- Del, M. F., Mynett, J. R., Sugden, P. H., Poole-Wilson, P. A., Harding, S. E. Subcellular mechanism of the species difference in the contractile response of ventricular myocytes to endothelin-1. Cardioscience. 4, 185-191 (1993).
- Sahn, D. J., DeMaria, A., Kisslo, J., Weyman, A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation. 58, 1072-1083 (1978).
- Thomas, W. P., et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 7, 247-252 (1993).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16, 233-270 (2015).
- Talavera, J., et al. An Upgrade on the Rabbit Model of Anthracycline-Induced Cardiomyopathy: Shorter Protocol, Reduced Mortality, and Higher Incidence of Overt Dilated Cardiomyopathy. BioMed Research International. 2015, 465342 (2015).
- Borkowski, R., Karas, A. Z. Sedation and anesthesia of pet rabbits. Clinical Techniques in Small Animal Practice. 14, 44-49 (1999).
- Cantwell, S. L. Ferret, rabbit and rodent anesthesia. The Veterinary Clinics of North America. Exotic Animal Practice. 4, 169-191 (2001).
- Giraldo, A., et al. Percutaneous intramyocardial injection of amniotic membrane-derived mesenchymal stem cells improves ventricular function and survival in non-ischaemic cardiomyopathy in rabbits. European Heart Journal. 36, 149 (2015).
- Giraldo, A., et al. Allogeneic amniotic membrane-derived mesenchymal stem cell therapy is cardioprotective, restores myocardial function, and improves survival in a model of anthracycline-induced cardiomyopathy. European Journal of Heart Failure. 19, 594 (2017).
- Bellenger, N. G., et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable?. European Heart Journal. 21, 1387-1396 (2000).
- Flachskampf, F. A., et al. Cardiac Imaging to Evaluate Left Ventricular Diastolic Function. Journal of the American College of Cardiology Cardiovascular Imaging. 8, 1071-1093 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。