Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Examen Ecocardiográfico Transtorácico en el Modelo Conejo
En este artículo
Resumen
Aquí describimos, paso a paso, un protocolo detallado para realizar ecocardiografía en el modelo de conejo. Mostramos cómo obtener correctamente las diferentes vistas ecocardiográficas y planos de imagen, así como los diferentes modos de imagen disponibles en un sistema de ecocardiografía clínica utilizado rutinariamente en pacientes humanos y veterinarios.
Resumen
Los grandes modelos animales como el conejo son valiosos para la investigación preclínica traslacional. Los conejos tienen una electrofisiología cardíaca similar en comparación con la de los seres humanos y la de otros grandes modelos animales como perros y cerdos. Sin embargo, el modelo de conejo tiene la ventaja adicional de menores costos de mantenimiento en comparación con otros modelos animales grandes. La evaluación longitudinal de la función cardíaca mediante ecocardiografía, cuando se implementa adecuadamente, es una metodología útil para la evaluación preclínica de nuevas terapias para la insuficiencia cardíaca con fracción de eyección reducida (por ejemplo, regeneración cardíaca). El uso correcto de esta herramienta no invasiva requiere la aplicación de un protocolo de examen estandarizado siguiendo las directrices internacionales. Aquí describimos, paso a paso, un protocolo detallado supervisado por cardiólogos veterinarios para realizar ecocardiografía en el modelo de conejo, y demostramos cómo obtener correctamente las diferentes vistas ecocardiográficas y planos de imagen, así como el diferentes modos de imagen disponibles en un sistema de ecocardiografía clínica utilizado rutinariamente en pacientes humanos y veterinarios.
Introducción
La evaluación longitudinal de la función cardíaca en grandes modelos animales es una metodología de investigación robusta comúnmente utilizada para la evaluación de los efectos de las terapias novedosas para el tratamiento de la miocardiopatía isquémica y no isquémica. Entre las diversas técnicas de imagen cardiovascular disponibles para la investigación preclínica, la ecocardiografía se ha utilizado ampliamente debido a sus características no invasivas y portátiles. En manos experimentadas, la ecocardiografía es también una técnica de imagen muy reproducible para estudiar la anatomía cardíaca, así como la función sistólica y diastólica del corazón.
Grandes modelos animales preclínicos como cerdos, perros y conejos, son primordiales para la investigación traslacional preclínica1,2,3. De hecho, el beneficio potencial de nuevas terapias como la medicina regenerativa cardíaca en el entorno de la cardiomiopatía requiere extensas pruebas de hipótesis en grandes modelos preclínicos antes de que puedan ser consideradas para uso humano2,4 . En comparación con otros grandes modelos preclínicos, el modelo de conejo ofrece algunas ventajas, incluyendo su bajo costo de mantenimiento, que es comparable al de ratones y ratas. Sin embargo, a diferencia de ratones y ratas, el sistema de transporte Ca+2 y la electrofisiología cardiaca son similares en conejos que los humanos, y los de otros grandes modelos animales como perros y cerdos, aumentando así el potencial traslacional del conejo modelo1,5. Por lo tanto, el conejo, como un gran modelo experimental preclínico, tiene un equilibrio excepcional de costo y reproducibilidad para la investigación traslacional preclínica.
El conejo tiene el beneficio adicional de su amenabilidad para la imagen ecocardiográfica utilizando unidades de ultrasonido clínico utilizadas rutinariamente en pacientes humanos y veterinarios, aprovechando así la superioridad de la imagen armónica y el estado de la técnica Tecnología. Para ello, se prefieren los transductores sectoriales (también conocidos como matriz de fase) de frecuencia relativamente alta (hasta 12 MHz), como los utilizados en cardiología neonatal/pediátrica. El examen ecocardiográfico en el modelo preclínico de conejo permite la evaluación completa de la función sistólica y diastólica utilizando múltiples vistas y diferentes modos disponibles en unidades ecocardiográficas modernas (por ejemplo, Doppler de ondas continuas (CWD), Doppler de onda pulsada (PWD) e imágenes Doppler de tejido (TDI)).
La ecocardiografía es una técnica dependiente del operador y, por lo tanto, requiere una amplia formación y conocimiento sin núcleo de la técnica de acuerdo con las directrices internacionales. Parte de esta formación se puede facilitar con la visualización de vídeos explicando en detalle cómo se pueden obtener diferentes vistas ecocardiográficas. El logro de una alta competencia en imágenes ecocardiográficas, así como el desarrollo de un protocolo estandarizado y una técnica correcta, son esenciales para minimizar la influencia del operador y generar datos cuantitativos fiables, como se requiere en rigurosos investigación científica.
Algunas consideraciones son necesarias con respecto al sistema y la configuración de laboratorio utilizado para la ecocardiografía en conejos y otros modelos animales grandes. Para una evaluación ecocardiográfica transtorácica estándar de la función cardíaca, el sistema de ultrasonido debe incluir las siguientes modalidades: modo bidimensional (modo B o 2D), modo de movimiento (modo M), Color Doppler, así como CWD, PWD y TDI. Además, la máquina debe tener instalado un software completo de medición y análisis cardíaco, así como suficiente espacio en el disco duro interno para almacenar suficientes imágenes fijas digitales de alta calidad y bucles de vídeo para el análisis fuera de línea. Algunos sistemas utilizan transductores de matriz lineal; sin embargo, para la mejor imagen del corazón, se prefieren transductores sectoriales de matriz por fases con un pequeño diámetro de cabeza de escaneo, ya que permiten un paso más fácil de las ondas de ultrasonido a través de los espacios intercostales estrechos. Para conejos, utilizamos transductores de frecuencia relativamente alta (hasta 12 MHz). La posición del animal para la toma de imágenes es de suma importancia para adquirir imágenes de buena calidad. Por lo tanto, se recomiendan las posiciones de reclinación laterales derecha e izquierda para obtener todos los planos de imagen estándar durante un examen ecocardiográfico. Para ello, se recomienda una mesa con una muesca que coincida con la zona cardiaca del tórax (Figura1A). Esta mesa con muescas facilita el acceso con el transductor a la zona del pecho que será escaneada, y por lo tanto permite la libre movilidad de la mano del operador sin tener la mejor posición de escaneo del animal. Colocar al animal en una posición lateral reclinada da como resultado una caída del corazón hacia el transductor y la elevación de los pulmones, así como enlachar la ventana de acceso del haz de ultrasonido a través de los espacios intercostales, mejorando así la imagen general calidad(Figura 1A). El examen ecocardiográfico debe realizarse de manera ciega y siguiendo las directrices del Comité de Ecocardiografía del Colegio Americano de Medicina Interna Veterinaria y la Sociedad Americana de Ecocardiografía/Europa Asociación para las Imágenes Cardiovasculares6,7,8.
Parte de nuestro equipo científico está asociado con el Servicio de Cardiología de un Hospital De Enseñanza Veterinaria que atiende diariamente a pacientes veterinarios (por ejemplo, perros y gatos), para lo cual cuenta con la formación y acreditación pertinente según la ecocardiografía, y sus diferentes modalidades de imagen, así como una amplia experiencia en la toma de imágenes de diferentes tamaños de pacientes animales y conformaciones torácicas con esta técnica. Además, utilizamos comúnmente ecocardiografía para la evaluación longitudinal de la función cardiaca enun modelo de conejo de cardiomiopatía inducida por antraciclinas 9. Aquí, describimos un protocolo de ecocardiografía paso a paso para la evaluación de la función cardíaca utilizando una unidad de ultrasonido clínico en un modelo preclínico grande como el conejo. Este protocolo está adaptadopara las directrices internacionales actuales 8, e incluye recomendaciones prácticas basadas en nuestras propias experiencias en entornos clínicos y experimentales.
Protocolo
Los experimentos descritos en el presente documento fueron aprobados por el Comité de Investigación Etica de la Universidad de Murcia, España, y se realizaron de conformidad con la Directiva 2010/63/UE de la Comisión Europea. Los pasos descritos se realizaron en virtud de protocolos operativos estándar que formaban parte del plan de trabajo y no se han realizado únicamente con el propósito de filmar el vídeo que acompaña a este documento.
1. Preparación del conejo
- Antes de proceder, comience inyectando una combinación de ketamina (10 mg/kg) homogeneizada en la misma jeringa con medetomidina (200 g/kg) para anestesiar al animal, lo que reducirá el estrés del procedimiento para el conejo.
NOTA: El uso de anestesia también reduce la frecuencia cardíaca de una manera predecible, reduciendo así la variabilidad interindividual, y tiene el beneficio adicional de mejorar la calidad general de la imagen. Como se muestra en el video, cubra la cabeza con una manta quirúrgica para ayudar a mantener al animal tranquilo durante la inyección de anestesia.- Verificar que el animal está completamente anestesiado en 10-20 min, confirmando la presencia de flacidez muscular, ausencia de reflejo palpebral, movimientos mandibulares y olfateo. La presencia de estos dos últimos signos (movimientos mandibulares y olfateo), son a su vez los primeros signos de reducción de la profundidad anestésica. Aunque rara vez se necesita, se debe considerar la redosificación (por ejemplo, la mitad de la combinación de dosis anestésica inicial), si se prevé un retraso prolongado para completar el procedimiento.
NOTA: Si bien el animal se dormirá rápidamente en los primeros 5 minutos después de la inyección, se recomienda permitir un plano más profundo de la anestesia antes de intentar manipular al animal. Este retraso evitará angustiar al conejo, que de otro modo probablemente producirá taquicardia y afectará negativamente la precisión de la imagen y la reproducibilidad de ciertos parámetros durante el examen ecocardiográfico (por ejemplo, análisis de entrada de la válvula mitral). - Una vez anestesiado al animal, usa una cortapelos para eliminar el cabello de la piel del tórax. Comience por debajo de la línea del cuello y continúe hasta el nivel de las regiones hipocondríaca derecha e izquierda, así como de la región subxifobide en la línea media (Figura1B).
- Afeitar 1-3 cm2 de la cara interna de la extremidad delantera derecha, así como las regiones mediotibiales de las extremidades posteriores derecha e izquierda (Figura1B).
- Verificar que el animal está completamente anestesiado en 10-20 min, confirmando la presencia de flacidez muscular, ausencia de reflejo palpebral, movimientos mandibulares y olfateo. La presencia de estos dos últimos signos (movimientos mandibulares y olfateo), son a su vez los primeros signos de reducción de la profundidad anestésica. Aunque rara vez se necesita, se debe considerar la redosificación (por ejemplo, la mitad de la combinación de dosis anestésica inicial), si se prevé un retraso prolongado para completar el procedimiento.
- Después de colocar el conejo en una manta térmica o almohadilla de calentamiento para evitar la hipotermia durante el procedimiento, aplicar un gel conductor adecuado a los electrodos y colocarlos en las regiones arasda de las extremidades. Fije los electrodos con cinta quirúrgica.
- Verifique que se muestre una señal ECG correcta en la pantalla del sistema; por lo general, un rastreo electrocardiográfico simultáneo de 1 plomo es suficiente para monitorear sincrónicamente el ritmo cardíaco durante todo el estudio ecocardiográfico (Figura1A y Figura 1C).
NOTA: Además de la frecuencia cardíaca, monitoree la frecuencia respiratoria, así como la temperatura. La frecuencia respiratoria puede controlarse visualmente o a través de la incidencia de movimientos torácicos en la imagen ecocardiográfica, mientras que la temperatura debe controlarse a través de una sonda rectal. Estos parámetros deben ser monitoreados al principio, luego cada 10 min y al final del procedimiento. Los conejos no tienden a vomitar durante la anestesia10,11; por lo tanto, el ayuno de los conejos no se recomienda rutinariamente antes de un examen ecocardiográfico.
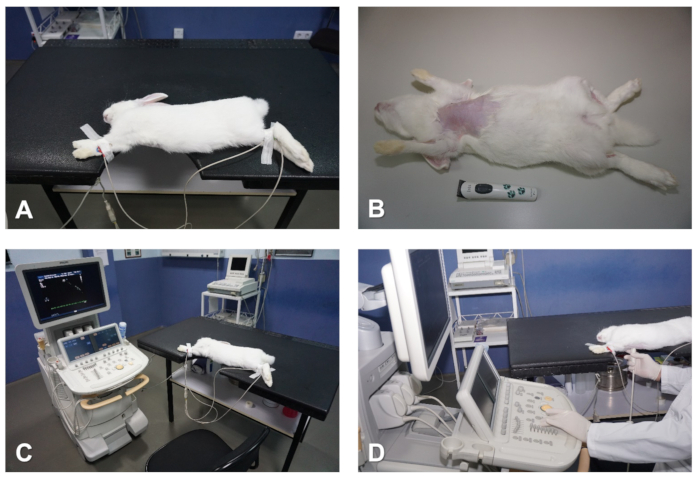
Figura 1 . Preparación y posicionamiento del conejo para ecocardiografía. (A) Tabla con muesca que coincide con el área cardiaca a tomar imágenes. (B) Retire el vello del pecho. (C) Conecte los electrodos ECG para controlar el corazón. (D) Posicionamiento del operador durante el preformación del examen ecocardiográfico. Haga clic aquí para ver una versión más grande de esta figura.
2. Vista parasternal del eje largo (sagital) del corazón
- Para obtener una vista parsternal del eje largo (PSLAX) del corazón, coloque el conejo en la posición lateral derecha reclinada, con las extremidades delanteras extendidas lejos del tórax, con cinta quirúrgica (Figura1A y Figura 1C).
- Para lograr la mejor calidad de imagen posible, es importante mantener la piel de la región torácica lo más plana posible para aumentar la penetración y mejorar la calidad general de la imagen mientras se toma imágenes del animal. Para ello, mantenga las extremidades delanteras lejos del tórax con una mano, mientras usa la mano libre para identificar los pliegues de la piel y los bolsillos, aplanarlos de arriba a abajo, y mover cualquier piel que se pliegue lejos del pecho hacia el lado lateral y la parte posterior del conejo. Esto es particularmente importante para los conejos mayores y más grandes cuya piel excesiva y tejido graso subcutáneo podrían reducir la calidad de la imagen.
NOTA: El área cardíaca del tórax debe colocarse sobre la sección de recorte de la tabla. Sin embargo, tenga en cuenta que, en esta posición, el abdomen tiene una tendencia natural a moverse hacia la muesca, y crea una presión positiva que desplaza el corazón cranealmente, que luego interfiere con una buena imagen ecocardiográfica. Para evitar esto, es importante que el abdomen se apoye completamente sobre la mesa y, para lograrlo, es útil mover suavemente los órganos abdominales hacia la región caudal del animal a través de un masaje suave (Figura1A y Figura 1C).
- Para lograr la mejor calidad de imagen posible, es importante mantener la piel de la región torácica lo más plana posible para aumentar la penetración y mejorar la calidad general de la imagen mientras se toma imágenes del animal. Para ello, mantenga las extremidades delanteras lejos del tórax con una mano, mientras usa la mano libre para identificar los pliegues de la piel y los bolsillos, aplanarlos de arriba a abajo, y mover cualquier piel que se pliegue lejos del pecho hacia el lado lateral y la parte posterior del conejo. Esto es particularmente importante para los conejos mayores y más grandes cuya piel excesiva y tejido graso subcutáneo podrían reducir la calidad de la imagen.
- Para las imágenes ecocardiográficas, sostenga el transductor con la mano derecha, mientras utiliza la mano izquierda para operar los controles del sistema de ecocardiografía como se muestra en la Figura 1D.
- Para mantener un buen contacto con la piel, aplique etanol sin diluir en la piel y luego suficiente gel de transmisión por ultrasonido en la cabeza del transductor.
- A continuación, coloque el transductor estrechamente en la piel del hemitrastóx derecho, a nivel del segundo al tercer espacio intercostal y a unos 1-3 cm de distancia de la línea parasternal derecha, con la marca de orientación del transductor apuntando al hombro derecho del animal y en un ángulo de aproximadamente 30o en relación con la línea media (Figura2A). Esto debería producir una imagen del PSLAX adecuado del corazón (ver Resultados Representativos).
- Una vez que las imágenes cardíacas 2D se muestran en la pantalla, el siguiente paso es ajustar los controles de la unidad de ultrasonido para obtener imágenes óptimas. Los principales son:
- Controles de profundidad y zoom: Utilice estos controles para optimizar el área de interés. La profundidad de la imagen debe ser adecuada para que las estructuras cardíacas puedan verse en cada imagen. Utilice la herramienta de zoom para una mejor evaluación de las estructuras de interés, por ejemplo, la integridad de las válvulas y los folletos.
- Ganancia total y compensación de ganancia de tiempo (es decir, ajustes de ganancia a diferentes profundidades en tiempo real): Controle las escalas de grises y las ganancias manualmente para minimizar el ruido de fondo y maximizar la delineación de las estructuras cardíacas. Estos parámetros son especialmente importantes en conejos debido a la mala ecogenicidad del miocardio ventricular.
- Rango dinámico o compresión: utilice este control para ajustar el número de tonos de gris que muestra la imagen. Establezca el rango dinámico para que el charco de sangre esté oscuro y el tejido sea brillante. Esto resultará en una mejor definición del borde endocardial, que es importante para obtener volúmenes ventriculares izquierdos.
- Anchura del sector: Comience el examen con un sector amplio (90o) y después de una visión general del corazón, reduzca el ancho del sector si es necesario obtener una mejor imagen de áreas específicas. La reducción del tamaño del sector mejora la resolución temporal al aumentar la velocidad de fotogramas. Esto es especialmente importante cuando la ecocardiografía 2D se utiliza para guiar el examen Doppler.
- Para mantener la posición del transductor mientras se toma imágenes del conejo, y para reducir la fatiga del operador, utilice el dedo índice para anclar la mano a la mesa o al pecho del animal, mientras que los demás dedos sostienen el transductor (Figura2A).
- Obtenga dos planos de imagen principales del corazón en la vista PSLAX correcta.
- Encontrar un plano de imagen que seccione el corazón longitudinalmente y donde se pueden identificar las cuatro cámaras del corazón (dos aurículas y dos ventrículos); también, cuando se utiliza un amplio campo de visión, el ápice del corazón también debe salir a la vista en el lado izquierdo de la imagen (ver sección Resultados Representativos).
- Realizar movimientos sutiles del transductor, como barrido, balanceo y rotación, en relación con el espacio intercostal, así como el ángulo craneocaudal y dorsoventral del haz de ultrasonido para obtener el otro plano de imagen de la vista del eje largo parasternal ( Figura 2A,B). En el otro plano de imagen, se puede identificar la pista de salida ventricular izquierda (LVOT) y la aorta (ver Resultados Representativos).
- Orientación de la imagen: Tenga en cuenta que la base del corazón estará en el lado derecho de la imagen del sector.
- Después de obtener los planos de diagnóstico por imágenes adecuados, utilice el modo B para evaluar la función general del corazón y utilice Doppler de color para evaluar el flujo sanguíneo a través de todas las válvulas, así como la integridad del tabique interventricular (IVS).
NOTA: Guarde siempre imágenes de las diferentes vistas y planos para el análisis sin conexión.
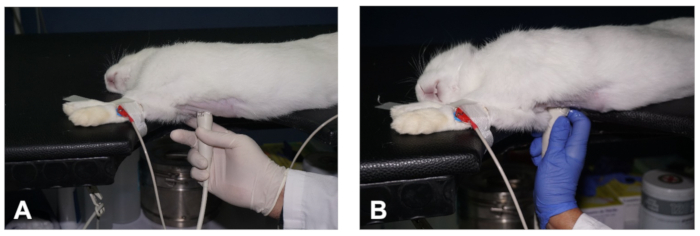
Figura 2 . Cómo obtener una vista PSLAX del corazón. (A- B) Posicionamiento del transductor para obtener los dos planos diferentes de la vista PSLAX del corazón (ver descripción en el texto). Haga clic aquí para ver una versión más grande de esta figura.
3. Parasternal vista de eje corto del corazón
- Con el transductor en la misma ubicación en el pecho mientras muestra un PSLAX bien alineado, realice una rotación en sentido contrario a las agujas del reloj del transductor de aproximadamente 90o (Figura3A)para obtener una vista de eje corto parasternal derecho (PSSAX). Esta vez, la marca de orientación del transductor debe apuntar hacia el hombro izquierdo del conejo.
NOTA: Para ayudar a mantener el transductor en la misma ubicación del pecho mientras gira el transductor, utilice la mano izquierda para realizar la rotación desde el cable del transductor como se muestra en la Figura 3B. - En la vista parasternal del eje corto, obtenga tres planos de imagen barriendo el transductor a lo largo del eje del corazón: la mitad del ventoral, la válvula mitral y la base alta con la arteria pulmonar (PA) y la válvula aórtica (AoV) a la vista.
- En el plano de imagen de medio ventricular, que seccione el corazón en los músculos papilares y el nivel de las tendineas de acordio (Figuras 3C), visualizaeles el ventrículo derecho (RV) en la parte superior y el ventrículo izquierdo (LV) en la parte inferior de la imagen (ver Resultados Representativos).
- Utilice el modo B para evaluar la contracción radial y circunferencial y la relajación del LV, y compruebe si hay anomalías en el movimiento de la pared regional.
- Utilice el modo M y con la ayuda de la bola de pista mueva el cursor en tiempo real sobre la imagen 2D, y luego coloque el cursor en el centro del LV, entre ambos músculos papilares, perpendicular al IVS y la pared libre ventricular izquierda (FW) (Figura3C). Una vez que las imágenes en modo M se muestren en pantalla, almacene las imágenes para su análisis sin conexión. En conejos con frecuencias cardíacas altas, utilice velocidades de barrido más altas para separar mejor los eventos cardíacos durante el ciclo cardíaco (por ejemplo, 150 mm/seg).
- Al barrer el transductor hacia la región cefálica (Figura3D),obtener un plano de válvula mitral (MV). Utilice el modo B y el modo M para evaluar la integridad y la motilidad de los prospectos MV. Coloque el cursor a lo largo de la mitad del LV, perpendicular al IVS (Figura3E),para obtener información detallada sobre la excursión de la MV en relación con el IVS.
- Barrer el transductor más cranealmente para dar lugar a un plano de imagen a nivel de la base alta (también conocido como plano AoV; Figura 3F - H), donde se pueden identificar el AoV y sus foliolos, la pista de salida ventricular derecha (RVOT), el PA y las árilos derecha e izquierda (LA) (ver Resultados Representativos).
- Orientación de la imagen: Tenga en cuenta que el PA estará en el lado derecho de la imagen del sector.
- Para visualizar completamente el PA y su bifurcación, utilice una mayor angulación y, a veces, un desplazamiento craneal del transductor (un espacio intercostal).
- Utilice el modo B para evaluar el tamaño y la forma de estas estructuras (por ejemplo, el tamaño auricular izquierdo aumenta en insuficiencia cardíaca congestiva), y utilice el color Doppler y PWD para registrar la velocidad del flujo sanguíneo (salida) a nivel fotovoltaico, colocando el volumen de la muestra justo debajo del apertura de los folletos fotovoltaicos (Figura3G). Por último, utilice el modo M y coloque el cursor a lo largo del AoV y la LA (Figura3H).
- Utilice los siguientes controles principales y ajustes para obtener imágenes Doppler de flujo de color adecuado:
- Con el sector del color posicionado en el área de interés, reduzca el ángulo entre el sector y la dirección del flujo sanguíneo tanto como sea posible.
- Anchura del sector del color: Ajuste esto al área de la válvula, con el fin de aumentar la velocidad de fotogramas y mejorar la información de flujo de color.
- Línea base y frecuencia de repetición de pulsos (PRF): Ajuste la línea base en la barra de color y el PRF, para permitir que se muestren velocidades más altas. Un número en la parte superior e inferior de la barra de color representa la velocidad máxima detectable antes de que se produzca el alias de color.
NOTA: El alias es más frecuente en el procesamiento de flujo de color que el Doppler pulsado espectral, porque una parte de los pulsos se asigna para obtener imágenes transversales seccionales en detrimento de la información Doppler de flujo de color. - Ganancia de color: En primer lugar, aumente esto hasta el punto de que simplemente comienza a crear ruido de fondo y, a continuación, disminuya a un nivel que optimice las imágenes de flujo de color.
- Utilice los siguientes controles principales para obtener imágenes Doppler espectrales adecuadas:
- Posición del cursor: Haga esto paralelo a la dirección del flujo sanguíneo; al menos, manténgase en un ángulo de 30o.
- Posición de la puerta: Es un marcador en la línea del cursor correspondiente al sitio de muestreo. Colóquelo después de las válvulas aórticas e pulmonares y en las puntas del prospecto de las válvulas auriculoventriculares.
- Tamaño de la puerta: Utilice la configuración mínima excepto para obtener pequeños flujos regurgitantes.
- Línea de base: Seleccione la línea base dependiendo de la dirección del flujo sanguíneo. Colóquelo en la parte superior cuando la sangre fluye contra el transductor (por ejemplo, flujos pulmonares y aórticos), o en la parte inferior cuando la sangre fluye hacia el transductor (por ejemplo, flujos de válvulas auriculoventriculares).
- Escala: Seleccione esto de acuerdo con la velocidad del flujo sanguíneo, por lo general, 25% mayor que la velocidad obtenida.
- Ganancia Doppler: Utilice esto para intensificar las señales Doppler. Aumente la ganancia hasta que se muestre el color.
- Coloración de la señal Doppler: Utilice el color magenta cuando el espectro Doppler es débil porque hace que la velocidad sea más nítida.
- Filtro de pared: Utilícelo para disminuir la cantidad de ruido de baja frecuencia que producen las paredes cardíacas.
- Velocidad de barrido: Utilice velocidades de barrido más altas para facilitar las mediciones de tiempo.
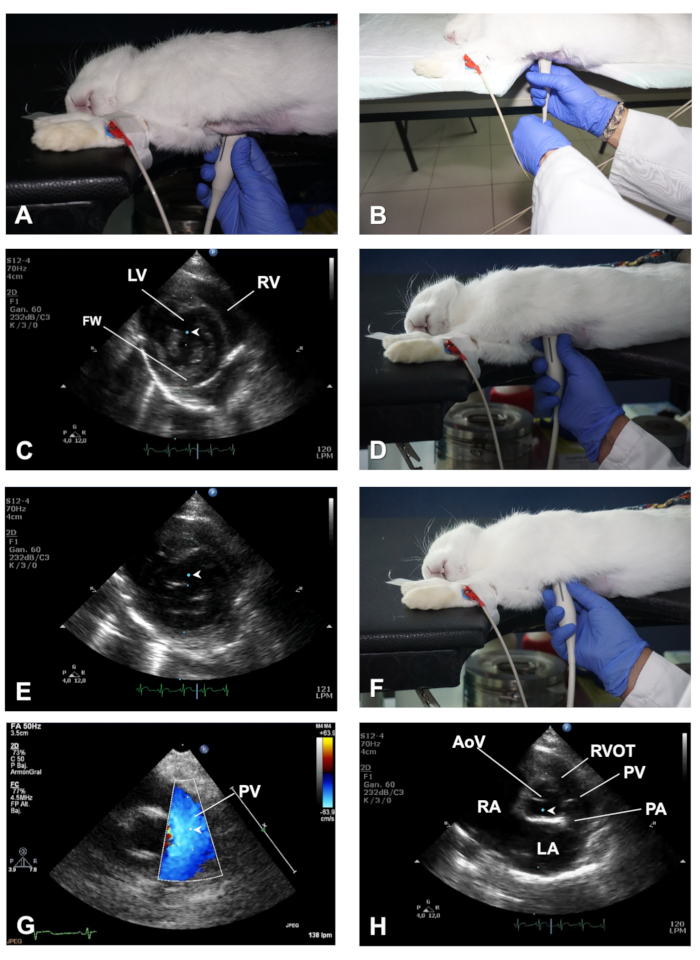
Figura 3 . Cómo obtener una vista PSSAX y sus diferentes planos de imagen. (A) Posición del transductor para obtener una vista PSSAX a nivel de los músculos papilares. (B) Demostración del papel de la mano izquierda para ayudar a girar el transductor al cambiar de una PSLAX a una vista PSSAX. (C) Ubicación del cursor del modo M en el plano de los músculos papilares de la vista PSSAX. (D) Posición del transductor para obtener una vista PSSAX del corazón en el plano de la válvula mitral. (E) Ubicación del cursor del modo M en el plano MV de la vista PSSAX. (F) Posición del transductor para obtener el plano AV en la vista PSSAX. (G) Demostración del color Doppler y posicionamiento del volumen de muestra PWD para evaluar la salida del PV. (H) Ubicación del cursor del modo M en el plano AoV de la vista PSSAX. LV - Ventrículo izquierdo; RV - ventrículo derecho; FW - Pared libre de LV; AoV - válvula aórtica; RVOT - pista de salida ventricular derecha; PV - Válvula pulmonar; PA - arteria pulmonar; LA - Atrio izquierdo; RA - aurícula derecha. Haga clic aquí para ver una versión más grande de esta figura.
4. Apical 4 cámaras vista del corazón
- Para obtener una vista Apical 4 cámaras (AP4C), coloque el conejo en la posición lateral izquierda reclinada con las extremidades delanteras extendidas lejos de la región torácica por medio de cinta quirúrgica (Figura 4A). Mantener la piel del tórax plana de una manera similar a como se describió anteriormente (Paso 2.1.1). El área cardíaca del tórax debe colocarse sobre la sección de recorte de la mesa. Del mismo modo, el abdomen debe estar bien apoyado en la mesa después de mover caudalmente los órganos abdominales a través de un masaje suave.
- Aplicar gel de ultrasonido al transductor, y luego acceder al corazón a través de la muesca en la mesa y colocarlo cerca de la piel del hemitórax izquierdo, en el nivel del espacio intercostal 4-5con la línea midclavicular, con el Marca de orientación del transductor que apunta hacia la parte posterior del conejo (en la dirección de la escápula izquierda) (Figura4B). De esta manera, el transductor es ortogonal con el ápice del corazón y el haz de ultrasonido se dirige hacia la base del corazón.
- Desde esta posición, si es necesario, mueva el transductor hacia arriba un espacio intercostal a la vez hasta el espacio intercostal n.o 4 (una maniobra a menudo llamada "compra de ventanas").
- Al llegar al espacio intercostal apropiado (que puede variar según el tamaño y/o la edad del conejo), observe una imagen del corazón desde el ápice hasta la base del corazón, la forma típica del corazón donde se pueden ver las cuatro cámaras, con la izquierda y la derecha ventrículos en la parte superior y ambas aurículas en la parte inferior de la imagen (ver Figura 4C,D y Resultados Representativos).
- Orientación de la imagen: Tenga en cuenta que el LV estará en el lado derecho de la imagen del sector.
- Evite acortar el ápice en esta vista, de modo que la vista AP4C típica del corazón debe dar unaimagen de forma de bala del LV con el IVS en el medio (Figura4C,D). Si el ápice es redondeado, es probable que el LV se escore; por lo tanto, mueva el transductor hacia abajo un espacio intercostal y/o inclinación del transductor.
- Utilice el modo B para comprobar si hay anomalías en el movimiento de pared regional y tener una vista global de la función LV. Utilice doppler de color para evaluar el flujo a través de las válvulas auriculoventriculares, y utilice PWD y coloque el volumen de la muestra a nivel de las puntas del prospecto MV para obtener imágenes del espectro de entrada de MV (Figura4C).
- Utilice el modo TDI y coloque el volumen de la muestra en los lados septal y lateral del anillo de la válvula mitral (Figura4D).
- Utilice el modo M y coloque el cursor alineado con el anular lateral MV para obtener la excursión sistólica del plano anular mitral (MAPSE). Almacenar imágenes en cada uno de estos modos para el análisis fuera de línea de la función cardíaca.
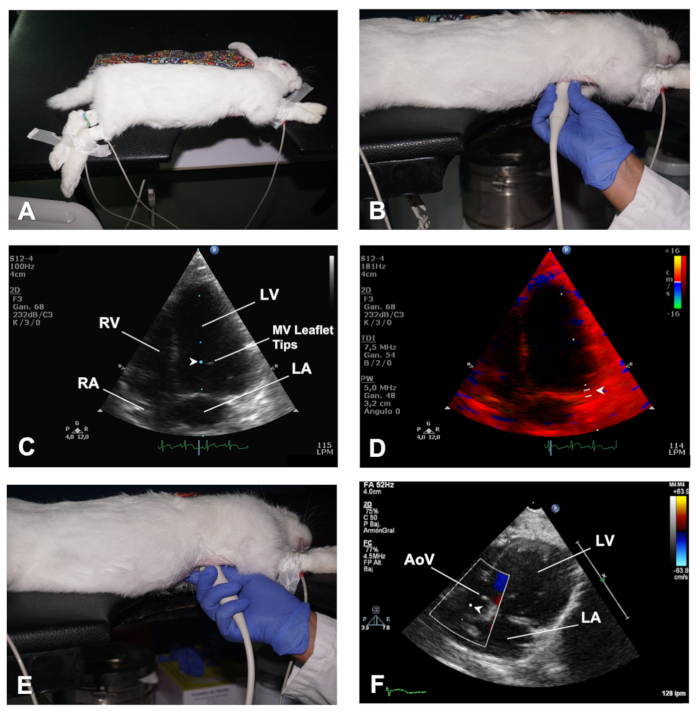
Figura 4 . Cómo obtener las vistas AP4C y AP5C del corazón. (A) Colocación del conejo en decútrito lateral izquierdo para una vista AP4C del corazón. (B) Posición del transductor para obtener una vista AP4C del corazón. (C) Ubicación del volumen de la muestra en las puntas del prospecto MV para evaluar la entrada de MV. (D) Ubicación del volumen de muestra para el análisis TDI de las velocidades miocárdicas en el lado lateral del anular MV. (E) Posición del transductor para obtener una vista AP5C del corazón. (F) Ubicación del volumen de muestra para el análisis PWD de la salida a través del AoV. LV - Ventrículo izquierdo; RV - ventrículo derecho; MV - Válvula mitral; LA - Aurícula izquierda; RA - aurícula derecha; Válvula aórtica AoV. Haga clic aquí para ver una versión más grande de esta figura.
5. Apical 5 cámaras vista del corazón
- Comenzando con el transductor en la misma ubicación que en la vista AP4C, realice una inclinación suave caudal (Figura4E)hasta que el LVOT y el AoV entren en la vista, esta es la vista apical de 5 cámaras (AP5C) del corazón (ver Resultados Representativos).
- Utilice el modo B para evaluar el LVOT, el movimiento de los folletos de AoV, así como el tamaño y la función de la cavidad LV.
- Utilice el modo Doppler de color para evaluar la salida a través del AoV y utilice PWD para evaluar la velocidad de flujo a través de esta válvula colocando el volumen de la muestra justo detrás del AoV (Figura4F).
Resultados
Vista parasternal del eje largo del corazón
La Figura 5A muestra un plano de imagen de la vista PSLAX derecha donde las 4 cámaras del corazón están claramente distinguidas. Puede identificar en esta vista el ventrículo derecho (RV), la válvula tricúspide (TV), IVS, LV, FW, así como la válvula mitral (MV). Cuando el ápice es claramente visible en el lado izquierdo de la ima...
Discusión
Hemos descrito un protocolo para el examen ecocardiográfico de los parámetrosde la función cardiaca en el conejo, que representa un gran modelo preclínico 1,2,3. La metodología paso a paso descrita en este documento debe considerarse orientación, que con un estudio complementario de los principios básicos de ecocardiografía, y un conocimiento básico de la imagen por ultrasonido, ayudará al investigador a obtener, a tra...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta obra fue apoyada en parte por: Fundación Séneca, Agencia de Ciencia y Tecnología, Región de Murcia, España (JT) (Número de subvención: 11935/PI/09) y la Universidad de Reading, Reino Unido (AG, GB) (Central Funding). Los fórhechos no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Bluesensor | Medicotest | 13BY1062 | Disposable adhesive ECG lectrodes |
| Domtor (Medetomidine) | Esteve | CN 570686.3 | Veterinary prescription is necessary |
| HD11 XE Ultrasound System | Philips | 10670267 | Echocardiography system. |
| Heating Pad | Solac | CT8632 | |
| Imalgene (Ketamine) | Merial | RN 9767 | Veterinary prescription is necessary |
| Omnifix-F 1 ml syringe | Braun | 9161406V | |
| S12-4 | Philips | B01YgG | 4-12 MHz phase array transducer |
| Ultrasound Transmision Gel (Aquasone) | Parker laboratories Inc. | N 01-08 |
Referencias
- Pogwizd, S. M., Bers, D. M. Rabbit models of heart disease. Drug Discovery Today Disease Models. 5, 185-193 (2008).
- Gandolfi, F., et al. Large animal models for cardiac stem cell therapies. Theriogenology. 75, 1416-1425 (2011).
- Harding, J., Roberts, R. M., Mirochnitchenko, O. Large animal models for stem cell therapy. Stem Cell Research & Therapy. 4, 23 (2013).
- Chong, J. J., Murry, C. E. Cardiac regeneration using pluripotent stem cells--progression to large animal models. Stem Cell Research. 13, 654-665 (2014).
- Del, M. F., Mynett, J. R., Sugden, P. H., Poole-Wilson, P. A., Harding, S. E. Subcellular mechanism of the species difference in the contractile response of ventricular myocytes to endothelin-1. Cardioscience. 4, 185-191 (1993).
- Sahn, D. J., DeMaria, A., Kisslo, J., Weyman, A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation. 58, 1072-1083 (1978).
- Thomas, W. P., et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 7, 247-252 (1993).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16, 233-270 (2015).
- Talavera, J., et al. An Upgrade on the Rabbit Model of Anthracycline-Induced Cardiomyopathy: Shorter Protocol, Reduced Mortality, and Higher Incidence of Overt Dilated Cardiomyopathy. BioMed Research International. 2015, 465342 (2015).
- Borkowski, R., Karas, A. Z. Sedation and anesthesia of pet rabbits. Clinical Techniques in Small Animal Practice. 14, 44-49 (1999).
- Cantwell, S. L. Ferret, rabbit and rodent anesthesia. The Veterinary Clinics of North America. Exotic Animal Practice. 4, 169-191 (2001).
- Giraldo, A., et al. Percutaneous intramyocardial injection of amniotic membrane-derived mesenchymal stem cells improves ventricular function and survival in non-ischaemic cardiomyopathy in rabbits. European Heart Journal. 36, 149 (2015).
- Giraldo, A., et al. Allogeneic amniotic membrane-derived mesenchymal stem cell therapy is cardioprotective, restores myocardial function, and improves survival in a model of anthracycline-induced cardiomyopathy. European Journal of Heart Failure. 19, 594 (2017).
- Bellenger, N. G., et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable?. European Heart Journal. 21, 1387-1396 (2000).
- Flachskampf, F. A., et al. Cardiac Imaging to Evaluate Left Ventricular Diastolic Function. Journal of the American College of Cardiology Cardiovascular Imaging. 8, 1071-1093 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados