A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בחינת החזה הקרדיוגרפית במודל הארנב
In This Article
Summary
כאן אנו מתארים, צעד אחר צעד, פרוטוקול מפורט לביצוע האקו במודל הארנב. אנו מראים כיצד להשיג בצורה נכונה את התצוגות ומטוסי ההדמיה השונים, כמו גם מצבי דימות שונים הזמינים במערכת אקו קלינית המשמשת באופן שגרתי בחולים אנושיים וטרינריים.
Abstract
מודלים גדולים של בעלי חיים כגון הארנב הם בעלי ערך למחקר טרום-קליני. הארנבים הם בעלי הפיזיולוגיה הקרדיולוגית הדומה לזו של בני האדם ושל מודלים גדולים של בעלי חיים כגון כלבים וחזירים. עם זאת, מודל הארנב יש יתרון נוסף של עלויות תחזוקה נמוכות בהשוואה לדגמים גדולים אחרים של בעלי חיים. הערכה האורך של תפקוד הלב באמצעות האקו, כאשר מיושם כראוי, היא מתודולוגיה שימושית להערכת טרום קליני של טיפולים חדשניים עבור אי ספיקת לב עם שבר הוצאה מופחתת (כגון התחדשות לב). השימוש הנכון בכלי שאינו פולשני זה דורש יישום של פרוטוקול בדיקה מתוקננת העוקב אחר ההנחיות הבינלאומיות. כאן אנו מתארים, צעד אחר צעד, פרוטוקול מפורט בפיקוח על ידי קרדיולוגים וטרינריים לביצוע התהודה במודל הארנב, ולהדגים כיצד להשיג בצורה נכונה את השקפות האקו-קרדיוגרפיות השונות ואת מטוסי ההדמיה, כמו גם את ה מצבי דימות שונים הזמינים במערכת אקו-קרדיוגרפיה קלינית המשמשת באופן שגרתי בחולים אנושיים וטרינריים.
Introduction
הערכה האורך של תפקוד הלב במודלים בעלי חיים גדולים היא מתודולוגיה מחקר חזקה נפוץ להערכת ההשפעות של טיפולים חדשניים לטיפול במחלת האיסכמי שריר הלב והאי. בין מספר טכניקות הדמיה לב וכלי דם זמין עבור מחקר טרום קליני, אקו קרדיוגרפיה כבר נעשה שימוש נרחב בשל מאפיינים שאינם פולשנית וניידים. בידיים מנוסה, האקו הוא גם טכניקת הדמיה מאוד מאוד מאוד לחקר האנטומיה הלב, כמו גם הסיסטולית פונקציה של הלב.
מודלים גדולים של בעלי חיים פרה-קליניים כגון חזירים, כלבים וארנבים, הינם בעלי חשיבות עליונה למחקר מעבר-קליני1,2,3. אכן, היתרון הפוטנציאלי של טיפולים חדשניים כגון רפואה רגנרטיבית לב בקביעת שריר הלב דורש בדיקות השערות נרחבות במודלים קדם קליניים גדולים לפני שהם יכולים להיחשב לשימוש אנושי2,4 . לעומת מודלים גדולים אחרים טרום קלינית, המודל ארנב מציע כמה יתרונות, כולל עלות אחזקה נמוכה שלה, אשר דומה לזה של עכברים וחולדות. עם זאת, בניגוד עכברים וחולדות, מערכת התחבורה Ca+ 2 ו אלקטרופיזיולוגיה הלב הם דומים בארנבים כמו אלה של בני אדם, ואלה של דגמים גדולים אחרים של בעלי חיים כגון כלבים וחזירים, ובכך להגדיל את הפוטנציאל הטרנסללוגי של הארנב דגם1,5. לכן, הארנב, כמו המודל הקליני הקדם ניסיוני גדול, יש איזון יוצא דופן של עלות והגנה עבור מחקר טרנסלפורמציה טרום קלינית.
הארנב יש יתרון נוסף של היכולת העצמית שלה עבור הדמיה אקו קרדיוגרפית באמצעות יחידות אולטרסאונד קליני בשימוש שגרתי אצל האדם וטרינרי חולים, ובכך לנצל את העליונות של הדמיה הרמונית והמדינה-of-the-art טכנולוגיה. לשם כך, מערכת הצירים (הידועה גם כמערך פאזה) של תדר גבוה יחסית (עד 12 מגה-הרץ), כגון אלה המשמשים בקרדיולוגיה/רפואת ילדים, מעדיפים. בדיקת האקו-קרדיגרפית במודל הפרה-קליני מאפשרת הערכה מלאה של התפקוד הסיסטולי והדיאסטולי באמצעות תצוגות מרובות ומצבים שונים הזמינים ביחידות האקו-קרדיוגרפיות המודרניות (למשל, גל מתמשך דופלר (CWD), פעמו גל דופלר (PWD), ו הדמיה דופלר רקמה (TDI)).
אקו-קרדיוגרפיה היא טכניקה תלוית-מפעיל ולכן דורשת הכשרה נרחבת וידע ליבה של הטכניקה בהסכמה עם הנחיות בינלאומיות. חלק מאימון זה ניתן להקל עם הדמיה של קטעי וידאו המסביר בפרוטרוט כיצד ניתן להשיג תצוגות שונות של האקו. השגת היכולות הגבוהות בהדמיה האקוקרדיוגרפית, כמו גם פיתוח פרוטוקול מתוקננת וטכניקה נכונה, חיוניים להפחתת ההשפעה של המפעיל ולהפקת נתונים כמותיים אמינים, כנדרש בתהליך קפדני מחקר מדעי.
כמה שיקולים נחוצים בנוגע למערכת ולהתקנת מעבדה המשמשת לשימוש לצורך הד בארנבים ובדגמים גדולים אחרים של בעלי חיים. עבור הערכה סטנדרטית בבית החזה, המערכת אולטרסאונד חייב לכלול את האופנים הבאים: מצב bi-מימדי (B-מצב או 2D), במצב תנועה (M-mode), צבע דופלר, כמו גם CWD, PWD ו TDI. יתר על כן, המכונה צריכה להיות ניתוח לב מלא ותוכנה מדידה מותקן, כמו גם מספיק שטח כונן קשיח פנימי לאחסן מספיק באיכות גבוהה דיגיטלי תמונות סטילס ולולאות וידאו לניתוח לא מקוון. מערכות מסוימות משתמשות במערכות הקצעה במערך ליניארי; עם זאת, עבור הדמיה הטובה ביותר של הלב, השלבים מהדרגה מערכת מתתמרים עם קוטר הראש הקטן לסרוק הם העדיפו, כי אלה מאפשרים מעבר קל יותר של גלי אולטרסאונד דרך החללים הבין מפרידים צרים. לארנבים, אנו משתמשים במתמרים בתדר גבוה יחסית (עד 12 מגה-הרץ). מיקומו של בעל החיים להדמיה הוא בעל חשיבות עליונה לרכישת תמונות באיכות טובה. לכן, עמדות שכיבה מימין ומשמאל מומלץ להשיג את כל מטוסי ההדמיה הסטנדרטיים במהלך בחינת האקו-קרדיוגרפית. בשביל זה, שולחן עם חריץ שעולה בקנה אחד עם אזור הלב של החזה מומלץ (איור 1A). טבלה זו מקלה על הגישה עם מתמר לאזור החזה כי ייסרקו, ולכן מאפשר ניידות חופשית של היד של המפעיל ולשמור על מיקום הסריקה הטובה ביותר של החיה. מיקום החיה בתנוחה שכיבה לרוחב תוצאות נפילה של הלב לעבר מתמר והעלאת הריאות, כמו גם הרחבת חלון הגישה של הקרן אולטרסאונד דרך החללים האינטרקוסטל, ובכך שיפור ההדמיה הכוללת איכות (איור 1A). יש לבצע את בדיקת האקו-קרדיוגרפית בצורה עיוורת ולעקוב אחר ההנחיות של ועדת האקו של המכללה האמריקנית לרפואה פנימית וטרינרית והחברה האמריקנית של אקו-קרדיוגרפיה/אירופה האגודה לדימות לב וכלי דם6,7,8.
חלק מהצוות המדעי שלנו משויך לשירות הקרדיולוגי של בית החולים להוראה וטרינרית המשתתף מדי יום למטופלים וטרינריים (כגון כלבים וחתולים), שעבורם יש לו את ההכשרה הרלוונטית וההסמכה בקרדיולוגיה וטרינרית האקו, ושיטות ההדמיה השונות שלה, כמו גם ניסיון רב בהדמיה בגדלים שונים של מטופלים בעלי חיים וקונמציות החזה עם טכניקה זו. בנוסף, אנו משתמשים בדרך כלל באמצעות אקו להערכת האורך של תפקוד הלב במודל של ארנבת של שריר הלב הנגרמת על ידי פחם9. כאן, אנו מתארים צעד אחר צעד פרוטוקול להערכת תפקוד הלב באמצעות יחידת אולטרסאונד קליני במודל קדם קליני גדול כגון הארנב. פרוטוקול זה מותאם להנחיות הבינלאומיות הנוכחיות8, וכולל המלצות מעשיות המבוססות על ההתנסויות שלנו בהגדרות הקליניות והנסיוניות.
Protocol
הניסויים שתוארו במסמך זה אושרו על ידי ועדת המחקר האתית של אוניברסיטת מורסיה, ספרד, ובוצעו בהתאם להנחיה 2010/63/האיחוד האירופי של הנציבות האירופית. הצעדים שתוארו בוצעו תחת פרוטוקולי הפעלה סטנדרטיים שהיו חלק מתוכנית העבודה ולא בוצעו רק למטרת צילום הווידאו הנלווה לנייר זה.
1. הכנת הארנב
- לפני שתמשיך, להתחיל על ידי הזרקת שילוב של קטמין (10 מ"ג/ק"ג) הומוגניים במזרק אותו עם medetomidine (200 μg/ק"ג) כדי להרדים את בעל החיים, אשר תפחית את הלחץ של ההליך עבור הארנב.
הערה: השימוש בהרדמה מפחית גם את קצב הלב באופן צפוי, ובכך מקטין שינויים בין-אישיים, והוא מוסיף תועלת לשיפור איכות ההדמיה הכוללת. כפי שמוצג בסרטון, לכסות את הראש עם שמיכה כירורגית כדי לעזור לשמור על החיה רגוע בזריקת הרדמה.- ודאו כי בעל החיים מורדם לחלוטין בתוך 10-20 דקות, על ידי אישור נוכחות של שרירים, היעדר palpebral רפלקס, תנועות הלסת והרחרוח. נוכחותם של שני הסימנים האחרונים (תנועות הלסת והרחרוח), הם בתורו את הסימנים המוקדמים ביותר של עומק הרדמה מופחתת. למרות שלעיתים רחוקות יש צורך, מינון מחדש צריך להיחשב (למשל, חצי שילוב המינון הראשוני), אם עיכוב ארוך צפוי על מנת להשלים את ההליך.
הערה: בזמן שהחיה תירדם במהירות ב-5 דקות הראשונות לאחר ההזרקה, מומלץ לאפשר מישור הרדמה עמוק לפני שמנסים לתמרן את החיה. עיכוב זה ימנע מצער את הארנב, אשר בדרך כלל עלול לייצר טכיקרדיה ולהשפיע לרעה על הדיוק הדמיה והתמחסות של פרמטרים מסוימים במהלך בדיקת האקו-קרדיוגרפית (למשל צניפי שסתום נכנס ניתוח). - ברגע שהחיה מרדימים, השתמשו בקוצץ שיער כדי להסיר את השיער מהעור של בית החזה. התחל מתחת לקו הצוואר והמשך לרמה של אזורי היפוכונזה ימינה ושמאלה, כמו גם באזור התת-שיופואיד בשורה האמצעית (איור 1B).
- לגלח 1-3 ס מ2 של הפנים הפנימיים של הזכות forelimb, כמו גם את האזורים המדיטיתים של הגפיים הימנית והשמאלית (איור 1b).
- ודאו כי בעל החיים מורדם לחלוטין בתוך 10-20 דקות, על ידי אישור נוכחות של שרירים, היעדר palpebral רפלקס, תנועות הלסת והרחרוח. נוכחותם של שני הסימנים האחרונים (תנועות הלסת והרחרוח), הם בתורו את הסימנים המוקדמים ביותר של עומק הרדמה מופחתת. למרות שלעיתים רחוקות יש צורך, מינון מחדש צריך להיחשב (למשל, חצי שילוב המינון הראשוני), אם עיכוב ארוך צפוי על מנת להשלים את ההליך.
- לאחר הנחת הארנב על שמיכה תרמית או משטח חימום כדי למנוע היפותרמיה במהלך ההליך, להחיל ג'ל מוליך מתאים לאלקטרודות ולמקם אותם באזורים מגולח של הגפיים. . תקן את האלקטרודות בנייר כירורגי
- ודא שאות א. א. הנכון מוצג על מסך המערכת; בדרך כלל המעקב האלקטרו-קרדיוגרפי בו זמנית, הוא מספיק כדי לנטר את קצב הלב במהלך כל מחקר האקו-כללי (איור 1A ואיור 1a).
הערה: בנוסף לקצב הלב, לניטור קצב הנשימה, כמו גם טמפרטורה. שיעור הנשימה יכול להיות מנוטר חזותית או באמצעות שכיחות של תנועות החזה בתמונה אקו קרדיוגרפית, בעוד הטמפרטורה צריך להיות מפוקח באמצעות לווין רקטלי. פרמטרים אלה יש לפקח בהתחלה, אז כל 10 דקות ובסוף ההליך. ארנבים אינם נוטים להקיא במהלך ההרדמה10,11; לפיכך, הצום של הארנבים אינו מומלץ באופן שגרתי לפני בחינת אקו-קרדיוגרפית.
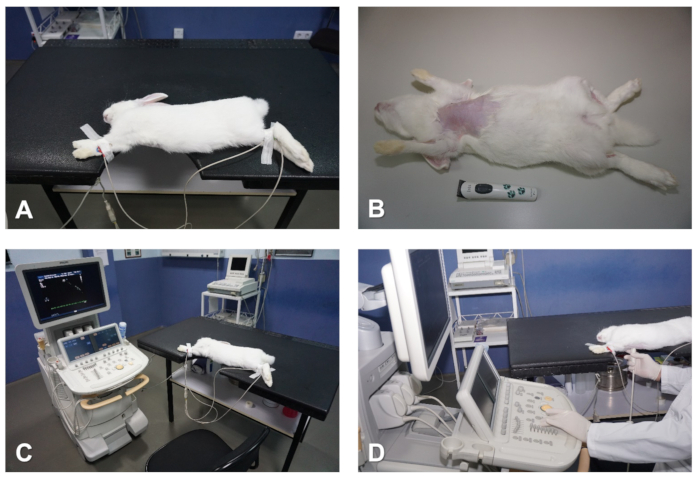
איור 1 . הכנה ומיקום הארנב להאקו. (א) טבלה עם חריץ שעולה בקנה אחד עם אזור הלב כדי להיות בתמונה. (ב) להסיר שיער מהחזה. (ג) להצמיד אלקטרודות לפיקוח על הלב. (ד) מיקום המפעיל בזמן בדיקת האקו-קרדיוגרפית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. ציר ארוך פראסטרילי (משונן) של הלב
- כדי להשיג את הציר הארוך (PSLAX) השקפה של הלב, למקם את הארנב בתנוחה הימנית שכיבה לרוחב, עם forelimbs הרחק מן החזה, עם קלטת כירורגית (איור 1A ואיור 1a).
- כדי להשיג את איכות ההדמיה הטובה ביותר האפשרית, חשוב לשמור על העור של אזור החזה שטוח ככל האפשר כדי להגביר את החדירה ולשפר את איכות ההדמיה הכוללת תוך הדמיה של החיה. בשביל זה, להחזיק את forelimbs הרחק מן החזה ביד אחת, תוך שימוש ביד חופשית כדי לזהות קפלי העור וכיסים, לשטח את אלה מלמעלה למטה, ולהעביר כל העור מתקפל הרחק החזה לכיוון הצד הצדדי והאחורי של הארנב. זה חשוב במיוחד עבור ארנבים מבוגרים וגדולים אשר עור מופרז ורקמת שומן תת עורית יכול להפחית את איכות התמונה.
הערה: אזור הלב של החזה צריך להיות ממוקם מעל סעיף החיתוך בטבלה. עם זאת, זכור כי, בתנוחה זו, הבטן יש נטייה טבעית לנוע לכיוון החריץ, ויוצר לחץ חיובי המפריע בגולגולת הלב, אשר לאחר מכן מפריעה עם הדמיה אקו-קרדיוגרפית טובה. כדי למנוע זאת, חשוב כי הבטן נשענת לגמרי על השולחן, כדי להשיג את זה, זה שימושי בעדינות להעביר את איברי הבטן לעבר אזור caudal של החיה באמצעות עיסוי עדין (איור 1A ואיור 1a).
- כדי להשיג את איכות ההדמיה הטובה ביותר האפשרית, חשוב לשמור על העור של אזור החזה שטוח ככל האפשר כדי להגביר את החדירה ולשפר את איכות ההדמיה הכוללת תוך הדמיה של החיה. בשביל זה, להחזיק את forelimbs הרחק מן החזה ביד אחת, תוך שימוש ביד חופשית כדי לזהות קפלי העור וכיסים, לשטח את אלה מלמעלה למטה, ולהעביר כל העור מתקפל הרחק החזה לכיוון הצד הצדדי והאחורי של הארנב. זה חשוב במיוחד עבור ארנבים מבוגרים וגדולים אשר עור מופרז ורקמת שומן תת עורית יכול להפחית את איכות התמונה.
- לדימות האקו-קרדיוגרפי, החזיקו את התמר בידו הימנית, תוך שימוש ביד שמאל כדי להפעיל את הבקרות של מערכת האקו-הד כפי שמוצג באיור 1D.
- כדי לשמור על מגע העור טוב, להחיל אתנול מדולל על העור ולאחר מכן מספיק ג'ל שידור אולטרסאונד לראש המתמר.
- הבא, למקם את מתמר בצמוד לעור של הבית הימני, ברמה של השני לחלל הבינקוסטל השלישי וכ1-3 ס מ הרחק קו parasternal ימינה, עם סימן אוריינטציה מתמר הצבעה על הכתף הימנית של בעל החיים ו בזווית של כ -30 ° ביחס לקו האמצע (איור 2A). זה אמור להפיק תמונה של הימין PSLAX של הלב (ראה תוצאות מייצגים).
- לאחר תמונות לב 2D מוצגים על המסך, השלב הבא הוא להתאים את הפקדים יחידת אולטרסאונד כדי להשיג תמונות אופטימליות. העיקריים הם:
- שולט עומק ומרחק מתצוגה: השתמש בפקדים אלה כדי למטב את תחום הריבית. העומק של התמונה חייב להיות הולם, כך שמבני הלב ניתן לראות על כל תמונה. השתמש בכלי זום להערכה טובה יותר של מבנים של עניין, למשל, שלמות של שסתומים ועלונים.
- רווח כולל ופיצוי מרווח זמן (כלומר, לצבור הגדרות בעומקים שונים בזמן אמת): שלוט בסולמות אפורים ורווחי באופן ידני כדי למזער את רעשי הרקע וכלה למקסם את התיחום של מבני הלב. פרמטרים אלה חשובים במיוחד בארנבים בגלל הד הדגניות המסכן של שריר הלב החדרית.
- טווח דינמי או דחיסה: השתמש בפקד זה כדי לכוונן את מספר גווני האפור המוצגים על-ידי התמונה. הגדר את הטווח הדינמי כך שבריכת הדם כהה והרקמה בהירה. זה יגרום להגדרה טובה יותר של גבול אנדוקרחיוג, אשר חשוב להשיג כרכים שמאל חדרית.
- רוחב סקטור: התחל את הבדיקה עם סקטור רחב (90 °) ולאחר מבט כולל על הלב, הפחת את רוחב הסקטור אם אזורים מסוימים צריכים להיות בעלי תמונה טובה יותר. הקטנת גודל הסקטור משפרת את הרזולוציה הטמפורלית על-ידי הגדלת קצב המסגרות. זה חשוב במיוחד כאשר האקו 2D משמש להנחות את בדיקת דופלר.
- כדי לשמור על מיקומו של מתמר תוך הדמיה הארנב, כדי להפחית את העייפות של המפעיל, להשתמש באצבע המפתח כדי לעגן את היד על השולחן או החזה של החיה, בעוד האצבעות האחרות להחזיק את מתמר (איור 2A).
- השג שני מטוסי הדמיה עיקריים של הלב בתצוגת PSLAX ימינה.
- מצא מישור הדמיה אשר מחלקים את הלב longitudinally והיכן כל ארבעת התאים של הלב (שתי האטריה ושני חללי המקום) ניתן לזהות; כמו כן, כאשר נעשה שימוש בשדה רחב של השקפה, יש להציג את קודקוד הלב גם בצידו השמאלי של התמונה (עיין בסעיף תוצאות מייצגים).
- לבצע תנועות עדינות של מתמר, כגון גורף, נדנדה וסיבוב, ביחס לחלל האינטרקוסטל, כמו גם הגולגולת הקראודל ו dorsoventral של קרן אולטרסאונד כדי להשיג את מישור ההדמיה האחר של תצוגת ציר ארוך parasternal ( איור 2 א,ב). במישור ההדמיה האחר, ניתן לזהות את מסלול הזרימה הבין-חדרית השמאלי (LVOT) ואת העורקים (ראה תוצאות מייצגות).
- כיוון תמונה: שים לב שבסיס הלב יהיה בצד הימני של תמונת המגזר.
- לאחר קבלת מטוסי ההדמיה המתאים, השתמש ב-mode כדי להעריך את התפקוד הכללי של הלב, ולהשתמש בצבע דופלר כדי להעריך את זרימת הדם בכל השסתומים, כמו גם את השלמות של המחיצה הבין-חדרית (IVS).
הערה: שמור תמיד תמונות של התצוגות והמטוסים השונים לניתוח לא מקוון.
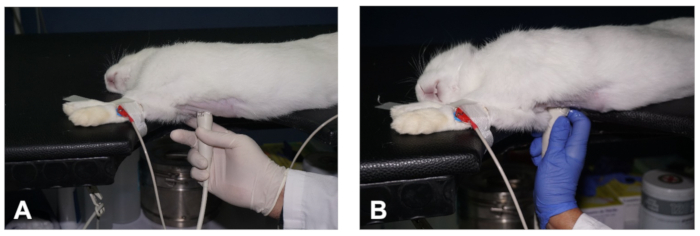
איור 2 . כיצד לקבל תצוגה PSLAX של הלב. (א-ב) מיקום מתמר כדי להשיג את שני מישורים שונים של תצוגת PSLAX של הלב (ראה תיאור בטקסט). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. תצוגת ציר קצר של הלב
- עם מתמר באותו מיקום בחזה תוך כדי הצגת PSLAX מיושר היטב, לבצע סיבוב נגד כיוון השעון של מתמר של כ 90 ° (איור 3A) כדי לקבל ציר ימין parasternal קצר (pssax) השקפה. הפעם, סימן הכיוון מתמר צריך להצביע לכיוון הכתף השמאלית של הארנב.
הערה: כדי לסייע לשמור על מתמר באותו מיקום של החזה תוך כדי סיבוב מתמר, השתמש ביד שמאל כדי לבצע את הסיבוב מן החוט של מתמר כפי שמוצג באיור 3B. - בתצוגת ציר קצר parasternal, להשיג שלושה מטוסי הדמיה על ידי ניקוי מתמר לאורך ציר הלב: אמצע המוח, השסתום צניפי, ואת בסיס גבוה עם עורק הריאתי (PA) ואת שסתום אבי העורקים (AoV) לראות.
- במישור הדמיה באמצע המוח, אשר מחלקים את הלב על שרירי הלסת העליונה וכורסיים ברמה הטריים (דמויות 3C), להמחיש את החדר הימני (RV) בחלק העליון ואת החדר השמאלי (LV) בחלק התחתון של התמונה (לראות תוצאות מייצגים).
- השתמש ב-mode כדי להעריך מוקדי התכווצות והרפיה של ה-LV, ולבדוק חריגות תנועה בקיר האזורי.
- השתמש במצב M ובעזרתו של הכדור מסלול להעביר את הסמן בזמן אמת על התמונה 2D, ולאחר מכן למקם את הסמן באמצע LV, בין שתי שרירי הלסת, בניצב אל IVS ו-הקיר השמאלי החדרית הקירות השמאליים (לאיור 3C). לאחר שהתמונות במצב M מוצגות על המסך, מאחסנים תמונות לניתוח לא מקוון. בארנבים עם קצב לב גבוה, השתמש במהירויות לטאטא גבוה יותר כדי להפריד את אירועי הלב במהלך מחזור הלב (g., 150 מ"מ/שניה).
- על ידי ניקוי מתמר לכיוון האזור הספלי (איור 3D), להשיג שסתום צניפי (MV) מטוס. השתמש במצב B ובמצב M כדי להעריך את התקינות והתנועתיות של העלונים של MV. מניחים את הסמן לאורך האמצע של LV, בניצב IVS (איור 3E), כדי לקבל מידע מפורט לגבי הטיול של ה-MV ביחס ivs.
- לטאטא את מתמר עוד ברית לגרום למטוס הדמיה ברמה של בסיס גבוה (ידוע גם בשם מטוס AoV; איור 3F - H), היכן שניתן לזהות את ה-aov ואת העלונים שלה, את המסלול הימני-השלישי (RVOT), הרשות והימנית והשמאלית (LA) (ראה תוצאות מייצגות).
- כיוון תמונה: שים לב שהרשות הפלסטינית תהיה בצד הימני של תמונת הסקטור.
- כדי להמחיש לחלוטין את הרשות הפלסטינית ואת הביקטיון שלה, השתמשו ביותר בעזרת שאיפה ולעיתים, בעקירה גולגולתית של התמר (מרחב אינטרקוסטל).
- השתמש ב-מצב B עבור הערכה של גודל וצורה של מבנים אלה (למשל, שמאל גודל פרפור הוא גדל אי ספיקת לב הגדשתית), ולהשתמש בצבע דופלר ו pwd כדי להקליט את המהירות של זרימת הדם (זרימה) ברמת PV, על ידי הצבת נפח המדגם ממש מתחת ל פתיחה של העלונים PV (איור 3G). לבסוף, להשתמש במצב M ולמקם את הסמן לאורך AoV ו-LA (איור 3H).
- השתמש בפקדים העיקריים הבאים והתאמות כדי לקבל את זרימת הצבע המתאים תמונות דופלר:
- עם מגזר הצבע הממוקם בתחום העניין, הפחת את הזווית בין הסקטור לכיוון זרימת הדם ככל האפשר.
- רוחב סקטור צבע: התאם זאת לאזור השסתום, כדי להגדיל את קצב המסגרות ולשפר את מידע זרימת הצבע.
- תדירות בסיסית וחזרה על הדופק (PRF): כוונן את קו הבסיס בסרגל הצבעים ואת ה-PRF, כדי לאפשר הצגת מהירויות גבוהות יותר. מספר בחלק העליון והתחתון של סרגל הצבע מייצג את המהירות המרבית היכולה לזיהוי לפני התרחשות הפחתת הצבע.
הערה: ההחלקה היא בתדירות גבוהה יותר מעבד זרימת צבע יותר מאשר דופלר פעמו, כי חלק מהפולסים מוקצה כדי לקבל תמונות לחצות החתך לרעת הצבע זרימת מידע דופלר. - רווח צבע: ראשית, להגדיל את זה עד כדי כך שזה רק מתחיל ליצור רעשי רקע, ולאחר מכן להקטין לרמה האופטימיזציה של זרימת צבע הדמיה.
- השתמש בפקדים העיקריים הבאים כדי לקבל הולם תמונות דופלר ספקטרלי:
- מיקום הסמן: להפוך את זה מקביל לכיוון זרימת הדם; לפחות, לשמור בזווית < 30 °.
- מיקום השער: זה סמן בקו הסמן המתאים לאתר הדגימה. הניחו אותו אחרי השסתומים של אבי העורקים והריאות ובקצות העלעל של השסתומים המאובריות.
- גודל שער: השתמש בהגדרה המינימלית למעט כדי להשיג זרימות regurgitant קטנות.
- תוכנית בסיסית: בחר את התוכנית הבסיסית בהתאם לכיוון זרימת הדם. מניחים אותו בראש כאשר הדם זורם נגד מתמר (למשל זורם ריאתי והאבי העורקים), או בתחתית כאשר הדם זורם לכיוון מתמר (למשל שסתומים מלוח זורם).
- קנה מידה: בחר את זה על פי מהירות זרימת הדם, בדרך כלל, 25% גבוה יותר מאשר המהירות המתקבלת.
- לצבור דופלר: להשתמש בזה כדי להעצים את האותות דופלר. הגדל את הרווח עד להצגת הצבע.
- לצבוע את האות דופלר: להשתמש בצבע מגנטה כאשר ספקטרום דופלר הוא חלש כי זה עושה את המהירות חדה יותר.
- מסנן קיר: השתמש באפשרות זו כדי להקטין את כמות הרעש בתדר נמוך המיוצר על ידי קירות הלב.
- מהירות מטאטא: להשתמש במהירויות לטאטא גבוה כדי להקל על מדידות זמן.
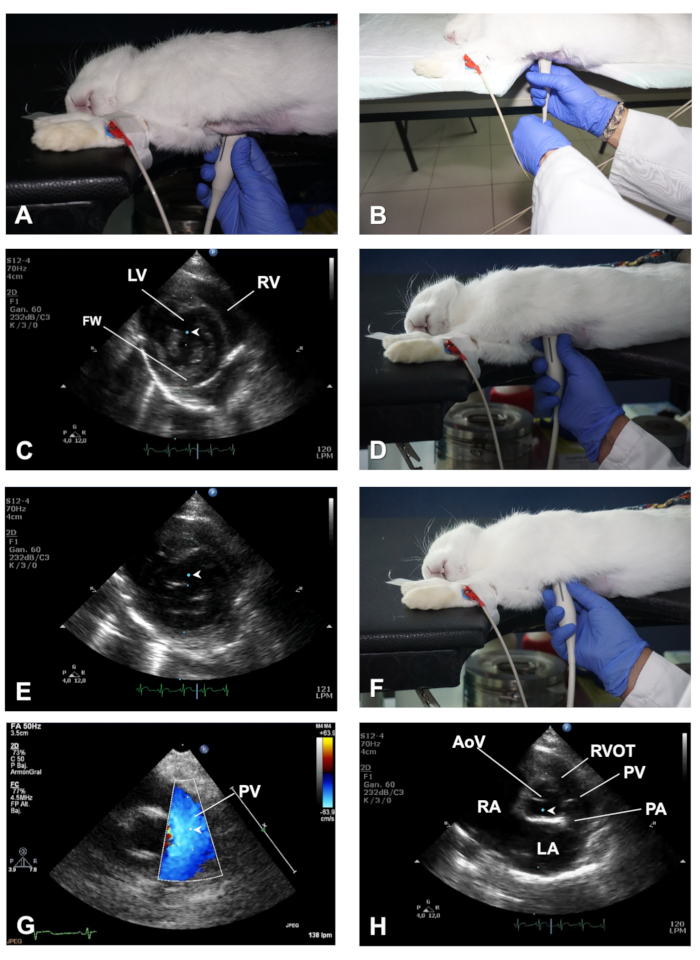
איור 3 . כיצד להשיג תצוגה PSSAX ומטוסי הדמיה שונים שלה. (א) מיקום של מתמר לקבל תצוגה pssax ברמה של השרירים הלסת. (ב) הפגנה של התפקיד יד שמאל כדי לסייע בסיבוב מתמר בעת המעבר מ PSLAX לתצוגה pssax. (ג) מיקום הסמן של מצב M במישור השרירים הלסת של התצוגה pssax. (ד) מיקום של מתמר לקבל מבט pssax של הלב במטוס צניפי שסתום. (E) מיקום הסמן של מצב M במישור ה-MV של התצוגה pssax. (ו) מיקום התמר כדי להשיג את המטוס AV בתצוגה pssax. (G) הפגנה של צבע דופלר ומיצוב של נפח pwd לדוגמה כדי להעריך את היצוא של PV. (ח) מיקום הסמן של מצב M במישור aov של התצוגה pssax. LV = חדר שמאלי; RV = החדר הימני; FW = LV חינם הקיר; AoV = שסתום אבי העורקים; RVOT = מסלול זרימה בין-חדרית ימני; PV = שסתום ריאתי; הרשות הפלסטינית = עורק הריאות; LA = אטריום שמאל; RA = הפרוזדור הימני. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. נוף של הלב 4 חדרי שינו
- כדי להשיג השקפה Apical 4 (AP4C), מניחים את הארנב בתנוחת שכיבה לרוחב שמאל עם forelimbs הרחק מן האזור בית החזה באמצעות קלטת כירורגית ( איור 4A). שמרו על עורו של בית החזה באופן דומה כפי שמתואר לעיל (Step 2.1.1). יש למקם את אזור הלב של החזה מעל למקטע החיתוך של השולחן. באופן דומה, את הבטן צריך להיות נתמך היטב על השולחן לאחר העברת מקבל את איברי הבטן באמצעות עיסוי עדין.
- החלת ג'ל אולטרסאונד על מתמר, ולאחר מכן לגשת ללב דרך החריץ בשולחן ולמקם אותו היטב את העור של האונה השמאלית, ברמה של החלל האינטרקוסטל 4ה-5 עם קו midclavicular, עם ה מתמר כיוון סימן הצבעה לעבר האחורי של הארנב (לכיוון השכם השמאלית) (איור 4B). בדרך זו, המתמר הוא אורתוגונלי עם קודקוד הלב וקרן האולטרסאונד מכוונת לכיוון בסיס הלב.
- מעמדה זו, במידת הצורך, להעביר את התמר מעלה אחד החלל הבין-משני בכל פעם עד החלל הבינקוסטל ~ 4 (התמרון מכונה לעתים קרובות "הקניות החלון").
- לאחר שהגיעו לחלל הבין-תאי המתאים (שעשוי להשתנות בהתאם לגודל ו/או גיל הארנב), יש להתבונן בדימוי הלב מהפיסגה אל בסיס הלב, בצורת הלב הטיפוסית שבה ניתן לראות את כל ארבעת התאים, עם שמאל וימין חללי הבית בחלק העליון ובשתי האטריה בתחתית התמונה (ראו איור 4C,D ותוצאות מייצגות).
- כיוון תמונה: שים לב ש-LV יהיה בצד הימני של תמונת הסקטור.
- הימנע מראש את הפיסגה בתצוגה זו, כך השקפה AP4C אופייני של הלב צריך לתת את התמונה הצורה כדור של LV עם IVS באמצע (איור 4C,D). אם הפיסגה מעוגלת, העירוי צפוי לקוצר; לכן, להעביר את מתמר כלפי מטה אחד החלל הפנימי ו/או להטות של מתמר.
- השתמש ב-mode כדי לבדוק חריגות תנועה בקיר האזורי יש תצוגה כללית של הפונקציה LV. השתמש בצבע דופלר כדי להעריך את הזרימה על פני שסתומים מלוח, ולהשתמש PWD ולמקם את נפח המדגם ברמה של עצות העלעל MV כדי להשיג תמונות של ספקטרום הזרימה של MV (איור 4C).
- השתמש במצב TDI ולמקם את הנפח לדוגמה במחיצה ואת הצדדים לרוחב של שסתום צניפי lus (איור 4D).
- להשתמש במצב M ולמקם את הסמן מיושר עם השנתית MV לרוחב כדי להשיג את צניפי טבעתי המטוס לסיור סיסטולי (MAPSE). לאחסן תמונות בכל אחד ממצבים אלה עבור ניתוח לא מקוון של תפקוד הלב.
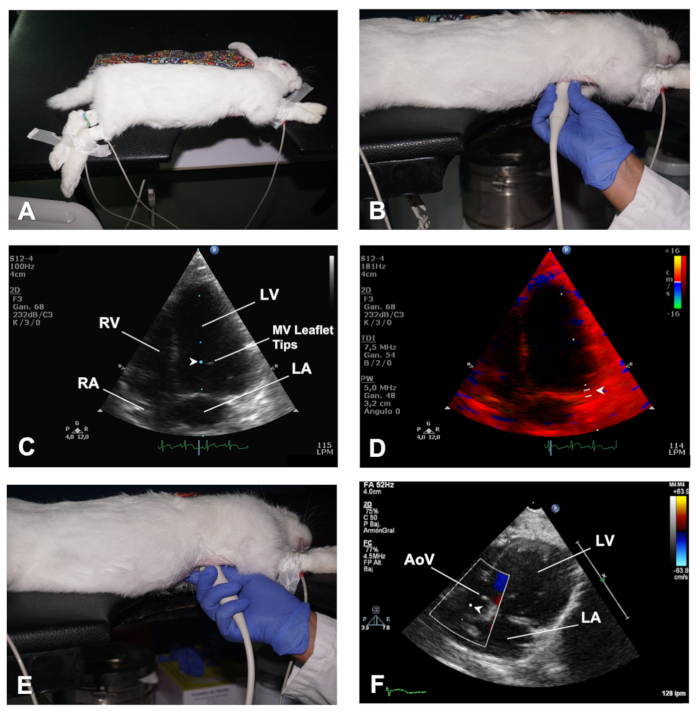
איור 4 . כיצד להשיג את AP4C ו AP5C צפיות של הלב. (א) מיצוב הארנב בAP4C לרוחב שמאל למראה הלב. (ב) מיקום של מתמר כדי לקבל מבט AP4C של הלב. (ג) מיקום הנפח לדוגמה בתיאורי העלעל של mv כדי להעריך את הזרימה הנכנס של mv. (ד) מיקום נפח המדגם לניתוח TDI של מהירויות שריר הלב בצדו הצדדי של ה-MV. (ה) מיקום של מתמר כדי לקבל מבט AP5C של הלב. (ו) מיקום אמצעי האחסון לדוגמה עבור ניתוח pwd של היצוא לאורך aov. LV = חדר שמאלי; RV = החדר הימני; MV = צניפי שסתום; LA = אטריום שמאל; רע = פרוזדור ימני; AoV = שסתום אבי העורקים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. נוף של הלב 5 חדרים
- החל עם מתמר באותו מיקום כמו בתצוגת AP4C, לבצע הטיית הטיה עדין (איור 4e) עד lvot ו aov לבוא לראות, זה השקפה פסגה 5 צ'יימברס (AP5C) של הלב (לראות תוצאות מייצגים).
- השתמש ב-מצב B כדי להעריך את LVOT התנועה של העלונים AoV, כמו גם את גודל החלל LV ותפקוד.
- השתמש במצב דופלר צבע עבור הערכה של זרימה ברחבי AoV, ולהשתמש PWD כדי להעריך את מהירות הזרימה על פני שסתום זה על ידי מיקום נפח לדוגמה ממש מאחורי AoV (איור 4F).
תוצאות
השקפה ארוכה של ציר ארוך של הלב
איור 5A מראה מישור הדמיה של התצוגה הימנית PSLAX שבו 4 חדרי הלב ברורים בבירור. ניתן לזהות בתצוגה זו את החדר הימני (RV), תלת-צניפי שסתום (טלוויזיה), IVS, LV, FW, כמו גם שסתום צניפי (MV). כאשר הפיסגה נר?...
Discussion
התחלנו לתאר פרוטוקול לבדיקת אקו-קרדיוגרפית של פרמטרים של תפקוד הלב בארנב, המייצג מודל קדם-קליני גדול1,2,3. מתודולוגיה לשלב אחר שלב המתואר בזאת צריכה להיחשב הדרכה, אשר עם מחקר משלים של העקרונות הבסיסיים של האקו, וידע בסיסי של הדמיה אולטרסאונ...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
העבודה הזאת היתה נתמכת בחלקו על ידי: הפונדה Séneca, אגנסיה דה Ciencia y Tecnología, מורסיה, ספרד (JT) (מספר גרנט: 11935/PI/09) ואוניברסיטת רידינג, בריטניה (AG, GB) (מימון מרכזי). לתורמים לא היה כל תפקיד בעיצוב הלמידה, איסוף נתונים וניתוח, החלטה לפרסם או הכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| Bluesensor | Medicotest | 13BY1062 | Disposable adhesive ECG lectrodes |
| Domtor (Medetomidine) | Esteve | CN 570686.3 | Veterinary prescription is necessary |
| HD11 XE Ultrasound System | Philips | 10670267 | Echocardiography system. |
| Heating Pad | Solac | CT8632 | |
| Imalgene (Ketamine) | Merial | RN 9767 | Veterinary prescription is necessary |
| Omnifix-F 1 ml syringe | Braun | 9161406V | |
| S12-4 | Philips | B01YgG | 4-12 MHz phase array transducer |
| Ultrasound Transmision Gel (Aquasone) | Parker laboratories Inc. | N 01-08 |
References
- Pogwizd, S. M., Bers, D. M. Rabbit models of heart disease. Drug Discovery Today Disease Models. 5, 185-193 (2008).
- Gandolfi, F., et al. Large animal models for cardiac stem cell therapies. Theriogenology. 75, 1416-1425 (2011).
- Harding, J., Roberts, R. M., Mirochnitchenko, O. Large animal models for stem cell therapy. Stem Cell Research & Therapy. 4, 23 (2013).
- Chong, J. J., Murry, C. E. Cardiac regeneration using pluripotent stem cells--progression to large animal models. Stem Cell Research. 13, 654-665 (2014).
- Del, M. F., Mynett, J. R., Sugden, P. H., Poole-Wilson, P. A., Harding, S. E. Subcellular mechanism of the species difference in the contractile response of ventricular myocytes to endothelin-1. Cardioscience. 4, 185-191 (1993).
- Sahn, D. J., DeMaria, A., Kisslo, J., Weyman, A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation. 58, 1072-1083 (1978).
- Thomas, W. P., et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 7, 247-252 (1993).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16, 233-270 (2015).
- Talavera, J., et al. An Upgrade on the Rabbit Model of Anthracycline-Induced Cardiomyopathy: Shorter Protocol, Reduced Mortality, and Higher Incidence of Overt Dilated Cardiomyopathy. BioMed Research International. 2015, 465342 (2015).
- Borkowski, R., Karas, A. Z. Sedation and anesthesia of pet rabbits. Clinical Techniques in Small Animal Practice. 14, 44-49 (1999).
- Cantwell, S. L. Ferret, rabbit and rodent anesthesia. The Veterinary Clinics of North America. Exotic Animal Practice. 4, 169-191 (2001).
- Giraldo, A., et al. Percutaneous intramyocardial injection of amniotic membrane-derived mesenchymal stem cells improves ventricular function and survival in non-ischaemic cardiomyopathy in rabbits. European Heart Journal. 36, 149 (2015).
- Giraldo, A., et al. Allogeneic amniotic membrane-derived mesenchymal stem cell therapy is cardioprotective, restores myocardial function, and improves survival in a model of anthracycline-induced cardiomyopathy. European Journal of Heart Failure. 19, 594 (2017).
- Bellenger, N. G., et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable?. European Heart Journal. 21, 1387-1396 (2000).
- Flachskampf, F. A., et al. Cardiac Imaging to Evaluate Left Ventricular Diastolic Function. Journal of the American College of Cardiology Cardiovascular Imaging. 8, 1071-1093 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved