このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ウサギモデルにおける経胸部心エコー検査
要約
ここでは、ウサギモデルにおける心エコー検査を行うための詳細なプロトコルを段階的に説明する。我々は、異なる心エコービューとイメージングプレーンを正しく取得する方法、ならびにヒトおよび獣医の患者で日常的に使用される臨床心エコー検査システムで利用できる異なったイメージングモードを示す。
要約
ウサギのような大型動物モデルは、翻訳前臨床研究に価値があります。ウサギは、人間や犬やブタなどの他の大型動物モデルと比較して、同様の心臓電気生理学を持っています。しかし、ウサギモデルは他の大型動物モデルと比較して低い維持費の付加的な利点がある。心エコー検査を用いた心機能の縦方向評価は、適切に実施された場合、排出率の低下(例えば心臓再生)を伴う心不全に対する新規療法の前臨床評価に有用な方法論である。この非侵襲的なツールを正しく使用するには、国際ガイドラインに従って標準化された検査プロトコルを実装する必要があります。ここでは、ウサギモデルで心エコー検査を行うための獣医学心理学者によって監督された詳細なプロトコルを段階的に説明し、異なる心エコービューとイメージングプレーンを正しく取得する方法を示します。人間および獣医の患者で日常的に使用される臨床心エコー検査システムで利用できる異なったイメージ投射モード。
概要
大型動物モデルにおける心臓機能の縦方向評価は、虚血性および非虚血性心筋症を治療するための新規療法の効果の評価に一般的に用いられる堅牢な研究方法論である。前臨床研究に利用可能ないくつかの心血管イメージング技術の中で、心エコー検査は、その非侵襲的でポータブルな特性のために広く使用されています。経験豊富な手では、心エコー検査はまた、心臓の解剖学だけでなく、心臓の収縮期および拡張期機能を研究するための非常に再現可能なイメージング技術です。
豚、犬、ウサギなどの大型前臨床動物モデルは、前臨床翻訳研究1、2、3にとって最も重要である。確かに、心筋症の設定における心臓再生医療のような新しい治療法の潜在的な利点は、それらが人間の使用のために考慮することができる前に、大規模な前臨床モデルで広範な仮説試験を必要とします 2,4.他の大きい前臨床モデルと比較して、ウサギモデルはマウスおよびラットのそれに匹敵する低い維持費を含むいくつかの利点を提供する。しかし、マウスやラットとは対照的に、Ca+2輸送システムと心臓電気生理学は、ウサギとヒトのそれと同様であり、犬やブタなどの他の大型動物モデルのものと同様であり、ウサギの翻訳可能性を高める。モデル1,5.したがって、ウサギは、大規模な実験的前臨床モデルとして、前臨床翻訳研究のためのコストと再現性の例外的なバランスを有する。
ウサギは、ヒトおよび獣医の患者で日常的に使用される臨床超音波単位を使用して心エコーイメージ投射のための付加的な利点を有し、こうして高調波イメージ投射および最先端の優位性を利用する。技術。このために、新生児/小児心臓学で使用されるものなど、比較的高周波(最大12MHz)のセクタートランスデューサ(相アレイとも呼ばれる)が好ましい。ウサギ前臨床モデルにおける心エコー検査は、現代の心エコーユニット(例えば連続波ドップラー(CWD))で利用可能な複数のビューと異なるモードを使用して収縮期および拡張期機能の完全な評価を可能にします。パルス波ドップラー(PWD)、およびティッシュドップラーイメージング(TDI)。
心エコー検査はオペレータに依存する技術であるため、国際的なガイドラインに従って技術の広範な訓練とコア知識が必要です。このトレーニングの一部は、異なる心エコービューを得ることができる方法を詳細に説明するビデオの視覚化を容易にすることができます。心エコーイメージングにおける高いコンピテンシーの達成、標準化されたプロトコルと正しい技術の開発は、オペレータの影響を最小限に抑え、厳格に要求される信頼性の高い定量データを生成するために不可欠です。科学的研究。
ウサギやその他の大型動物モデルの心エコー検査に使用されるシステムと実験室のセットアップに関して、いくつかの考慮事項が必要です。心臓機能の標準的な経胸部心エコー評価のために、超音波システムは次のモダリティを含む必要があります:二次元モード(Bモードまたは2D)、モーションモード(Mモード)、カラードップラー、ならびにCWD、PWDおよびTDI。さらに、マシンは完全な心臓分析および測定ソフトウェアをインストールするだけでなく、オフライン分析のための十分な高品質のデジタル静止画とビデオループを格納するのに十分な内部ハードドライブスペースを持っている必要があります。一部のシステムでは、線形アレイトランスデューサを使用しています。しかし、心臓の最高のイメージングのために、これらは狭い肋間空間を通して超音波の容易な通過を可能にするので、小さいスキャンヘッド直径を持つ段階的アレイセクタートランスデューサが好ましい。ウサギの場合、比較的高周波トランスデューサ(最大12MHz)を使用しています。イメージングのための動物の位置は、良質の画像を取得するために最も重要です。したがって、心エコー検査中にすべての標準的なイメージングプレーンを得るために、右および左の両方のリカンベント位置が推奨される。このために、胸部の心臓領域と一致するノッチを持つテーブルが推奨される(図1A)。このノッチ付きテーブルはスキャンされる胸部の区域へのトランスデューサとのアクセスを促進し、従って動物の最もよいスキャン位置を維持するオペレータの口笛の手の自由な移動を可能にする。動物を横方向のリカンベント位置に配置すると、トランスデューサに向かって心臓が落下し、肺の標高が上昇し、肋間空間を通して超音波ビームのアクセスウィンドウが広がり、全体的なイメージングが向上します。品質(図1A)。心エコー検査は、目が見えない方法で行われるべきであり、米国獣医学部内科および米国心エコー検査学会/ヨーロッパ学会の心エコー検査委員会のガイドラインに従って行われるべきである。心臓血管イメージング協会6,7,8.
私たちの科学チームの一部は、獣医の患者(例えば、犬や猫)に毎日出席する獣医教育病院の心臓サービスに関連付けられており、獣医の心臓学における関連するトレーニングと認定を受けています。心エコー検査、およびその異なるイメージングモダリティ、ならびにこの技術で動物患者および胸部適合の異なるサイズのイメージングの広範な経験。また、アントラシクリン9によって誘導される心筋症のウサギモデルにおいて、心臓機能の縦方向評価に心エコー検査を一般的に用いる。ここでは、ウサギ等の大型前臨床モデルにおける臨床超音波ユニットを用いて心臓機能を評価するための心エコー検査プロトコルを段階的に説明する。このプロトコルは、現在の国際的なガイドライン8に適合し、臨床および実験の設定で私たち自身の経験に基づいて実用的な推奨事項が含まれています。
プロトコル
ここに記載されている実験は、スペインのムルシア大学の倫理研究委員会によって承認され、欧州委員会の指令2010/63/EUに従って行われました。記載された手順は、作業計画の一部であり、本論文に添付のビデオを撮影する目的でのみ行われていない標準的な動作プロトコルの下で行われました。
1. ウサギの準備
- 先に進む前に、メデトミジン(200μg/kg)と同じ注射器で均質化されたケタミン(10mg/kg)の組み合わせを注入して動物を麻酔し、ウサギの処置のストレスを軽減します。
注:麻酔の使用はまた、予測可能な方法で心拍数を減少させ、したがって、個々の変動を減少させ、全体的なイメージング品質を向上させる付加的な利点を有する。ビデオに示すように、麻酔の注射中に動物を落ち着かせるのに役立つ外科毛布で頭を覆います。- 筋肉の弛緩、触覚反射の欠如、顎の動きおよび嗅覚の存在を確認することによって、動物が10〜20分以内に完全に麻酔されていることを確認してください。後者の2つの徴候(顎の動きおよび嗅覚)の存在は、今度は麻酔深度の低下の最も初期の徴候である。それはめったに必要とされないが、再投与を考慮する必要があります(例えば、最初の麻酔用量の組み合わせの半分)、手順を完了するために長い遅延が予想される場合。
注:動物は注射後最初の〜5分以内にすぐに眠りに落ちるが、動物を操作しようとする前に麻酔のより深い平面を許可することをお勧めします。この遅延は、そうでなければ頻脈を生じる可能性が高いウサギを苦しめ、心エコー検査中に特定のパラメータの画像化精度と再現性に悪影響を及ぼすことを回避します(僧帽弁流入解析など)。 - 動物が麻酔されたら、毛バリカンを使用して胸郭の皮膚から毛を取り除きます。ネックラインの下から開始し、左右の低血圧領域と中央線のサブxiphoid領域のレベルに進みます(図1B)。
- 右前肢の内面の1〜3cm2を剃るだけでなく、右後肢と左後肢の平行領域(図1B)。
- 筋肉の弛緩、触覚反射の欠如、顎の動きおよび嗅覚の存在を確認することによって、動物が10〜20分以内に完全に麻酔されていることを確認してください。後者の2つの徴候(顎の動きおよび嗅覚)の存在は、今度は麻酔深度の低下の最も初期の徴候である。それはめったに必要とされないが、再投与を考慮する必要があります(例えば、最初の麻酔用量の組み合わせの半分)、手順を完了するために長い遅延が予想される場合。
- 手順中に低体温症を避けるために熱毛布または加熱パッドにウサギを置かれた後、電極に適切な導電ゲルを適用し、手足の剃った領域にこれらを配置します。外科テープで電極を固定します。
- 正しいECG信号がシステムの画面に表示されていることを確認します。通常、同時1リード心電図トレースは、心エコー研究全体の間に心臓のリズムを同期的に監視するのに十分である(図1Aおよび図1C)。
注:心拍数に加えて、呼吸数と温度を監視します。呼吸数は、心エコー画像の胸部運動の発生率を視覚的に監視することができ、一方、温度は直腸プローブを介して監視する必要があります。これらのパラメータは、最初に、次に10分ごとに、プロシージャの最後に監視する必要があります。ウサギは麻酔中に嘔吐する傾向がない10,11;したがって、ウサギの断食は、心エコー検査の前に日常的に推奨されていません。
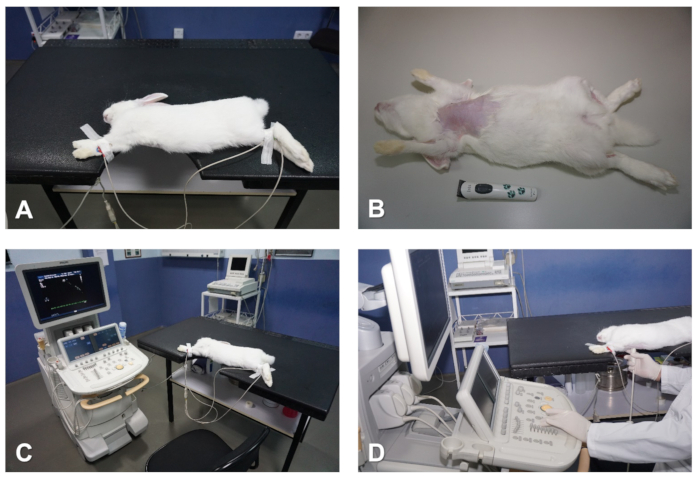
図 1.心エコー検査のためのウサギの準備と位置決め。(A) 画像化する心臓領域と一致するノッチを持つテーブル。(B) 胸から毛を取り除く。(C) 心電図を取り付けて心臓を監視します。(D) 心エコー検査を前にしながら、オペレータの位置決め。この図のより大きなバージョンを表示するには、ここをクリックしてください。
2. 心臓のパラステナル長軸(矢状)ビュー
- 心臓のパースターン長軸(PSLAX)ビューを得るには、ウサギを右横方向のリカンベント位置に置き、前肢を胸部から伸ばし、外科テープ(図1Aおよび図1C)を使用します。
- 可能な限り最高のイメージング品質を達成するためには、胸部領域の皮膚を可能な限り平坦に保ち、動物をイメージングしながら、浸透性を高め、全体的なイメージング品質を向上させることが重要です。このために、前肢を片手で胸部から離し、自由な手を使って皮膚の折り目やポケットを識別し、上から下に平らにし、胸から横側と背中に向かって折りたたむ皮膚を動かします。これは、過剰な皮膚および皮下脂肪組織が画質を低下させる可能性がある古くて大きなウサギにとって特に重要です。
注:胸部の心臓領域は、テーブルのカットアウトセクションの上に配置する必要があります。しかし、この位置では、腹部はノッチに向かって移動する自然な傾向があり、心臓を頭蓋に置き換える正の圧力を作成し、良好な心エコーイメージングを妨げることに留意してください。これを防ぐためには、腹部がテーブルの上に完全に置かれておき、これを達成するためには、穏やかなマッサージを通じて動物の方に腹部器官を穏やかに動かすのに有用である(図1Aおよび図1C)。
- 可能な限り最高のイメージング品質を達成するためには、胸部領域の皮膚を可能な限り平坦に保ち、動物をイメージングしながら、浸透性を高め、全体的なイメージング品質を向上させることが重要です。このために、前肢を片手で胸部から離し、自由な手を使って皮膚の折り目やポケットを識別し、上から下に平らにし、胸から横側と背中に向かって折りたたむ皮膚を動かします。これは、過剰な皮膚および皮下脂肪組織が画質を低下させる可能性がある古くて大きなウサギにとって特に重要です。
- 心エコーイメージングの場合、トランスデューサを右手で保持し、左手を使用して心エコー検査システムの制御を操作します。
- 良好な皮膚接触を維持するために、皮膚に希釈されていないエタノールを適用し、その後、トランスデューサの頭部に十分な超音波ゲルを適用します。
- 次に、トランスデューサを右片胸の皮膚に密接に配置し、2~3番目の肋間空間のレベルで、右パラスターンラインから約1〜3cm離れた位置に、トランスデューサの向きマークを動物の右肩を指し、および中線に対して約30°の角度で(図2A)。これは、心臓の右のPSLAXの画像を生成する必要があります(代表的な結果を参照してください)。
- 2D心臓画像が画面に表示されたら、次のステップは、最適な画像を得るために超音波ユニットコントロールを調整することです。主なものは次のとおりです。
- 深度コントロールとズーム コントロール: これらのコントロールを使用して、対象領域を最適化します。各画像に心臓構造を見ることができるように、画像の深さは十分でなければなりません。ズームツールを使用して、バルブやリーフレットの完全性など、対象の構造をより良く評価できます。
- 合計ゲインとタイムゲイン補正(つまり、リアルタイムで異なる深さでのゲイン設定):グレースケールとゲインを手動で制御して、バックグラウンドノイズを最小限に抑え、心臓構造の線引きを最大化します。これらのパラメータは、心室心筋のエコー原性が悪いため、ウサギにおいて特に重要である。
- ダイナミックレンジまたは圧縮: このコントロールを使用して、イメージに表示されるグレーの色合いの数を調整します。血液プールが暗く、組織が明るいようにダイナミックレンジを設定します。これは、左心室体積を得るために重要である心内境界定義が改善されます。
- セクター幅:広いセクター(90°)で試験を開始し、心臓の概要の後、特定の領域をより良い画像化する必要がある場合は、セクター幅を縮小します。セクタ サイズを小さくすると、フレーム レートを上げることで時間的な解像度が向上します。これは、2D心エコー検査を使用してドップラー検査を導く場合に特に重要です。
- ウサギをイメージングしながらトランスデューサの位置を維持し、オペレータの疲労を軽減するために、人差し指を使用して動物のテーブルまたは胸部に手を固定し、他の指はトランスデューサを保持する(図2A)。
- 右のPSLAXビューで心臓の2つの主要なイメージングプレーンを取得します。
- 心臓を縦方向に切り取り、心臓の4つの部屋(2つの心房と2つの心室)を識別できるイメージングプレーンを見つけます。また、広い視野を使用する場合は、画像の左側にも心臓の頂点が見えるはずです(代表的な結果セクションを参照)。
- トランスデューサの微妙な動きを行う(例えば、スイープ、ロッキング、回転など)、肋間空間に対して、超音波ビームの頭蓋骨と背房角を基準にして、パラスターナル長軸ビューの他の撮像面((図 2A,B)他の撮像面では、左心室流出トラック(LVOT)と大動脈を同定することができる(代表的な結果を参照)。
- 画像の向き: ハートの基部がセクタ イメージの右側にあることに注意してください。
- 適切なイメージングプレーンを得た後、Bモードを使用して心臓の全体的な機能を評価し、色のドップラーを使用してすべての弁全体の血流と心室中隔(IVS)の完全性を評価する。
注:オフライン分析のために常に異なるビューや平面の画像を保存します。
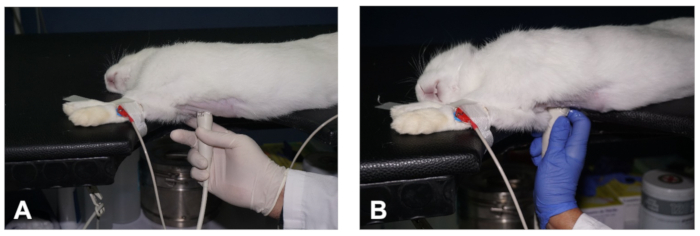
図 2.心臓のPSLAXビューを取得する方法。(A- B)心臓のPSLAXビューの2つの異なる平面を得るためにトランスデューサの位置決め(本文中の説明を参照)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
3. 心臓のパラステナル短軸ビュー
- 十分に整列したPSLAXを表示しながら、胸部内の同じ位置にトランスデューサを使用して、約90°(図3A)のトランスデューサの反時計回りの回転を行い、右パラステナル短軸(PSSAX)ビューを得る。今回は、トランスデューサの向きマークがウサギの左肩を指しているはずです。
注:トランスデューサを回転させながら、トランスデューサを胸部の同じ位置に維持するために、左手を使用して、図3Bに示すように、トランスデューサのコードからの回転を実行します。 - パラスタール短軸ビューでは、心臓の軸に沿ってトランスデューサを掃引することにより、3つのイメージングプレーンを得る:中心室、僧帽弁、および肺動脈(PA)と大動脈弁(AoV)を視野に入れた高い基盤。
- 乳頭筋と弦楽体のテディネアレベルで心臓を切り離す中室イメージング平面(図3C)では、画像の下部にある右心室(RV)と左心室(LV)を可視化する(代表的な結果を参照)。
- Bモードを使用して、LVの放射状および周回収縮および緩和を評価し、地域の壁運動異常をチェックする。
- Mモードを使用し、トラックボールの助けを借りて、2D画像上でリアルタイムにカーソルを移動し、LVの中央にカーソルを置き、両方の乳頭筋の間に、IVSと左心室自由壁(FW)に垂直です(図3C)。Mモード画像が画面に表示されたら、オフライン分析用の画像を保存します。心拍数の高いウサギでは、より高いスイープ速度を使用して、心臓周期中の心臓イベント(例えば、150 mm/秒)をより良く分離します。
- トランスデューサを頭蓋領域(図3D)に向かって掃引することにより、僧帽弁(MV)面を得る。B モードと M モードを使用して、MV リーフレットの整合性と運動性を評価します。IVS (図 3E)に垂直な LV の中央にカーソルを置き、IVS に関連する MV のエクスカーションに関する詳細情報を取得します。
- トランスデューサをさらに頭蓋にスイープして、高い基地のレベルでイメージングプレーンを得る(AoV平面とも呼ばれます)図3F-Hは、AoVおよびそのリーフレット、右心室流出トラック(RVOT)、PA、および左右の心房(LA)を同定することができる(代表的な結果を参照)。
- 画像の向き: PA はセクタ イメージの右側に置かれることに注意してください。
- PAとその分岐を完全に視覚化するには、より大きな角度を使用し、時にはトランスデューサ(肋間空間)の頭蓋変位を使用します。
- これらの構造の大きさと形状の評価にBモードを使用し(例えば、左心房サイズがうっ血性心不全で増加する)、および色ドップラーおよびPWDを使用して、PVレベルで血流(流出)の速度を記録し、サンプル体積をちょうど下に置くことによって、PVリーフレットのオープニング(図3G)。最後に、M モードを使用し、AoV と LA (図 3H)に沿ってカーソルを置きます。
- 適切なカラー フロー Doppler イメージを取得するには、次の主なコントロールと調整を使用します。
- 対象領域に位置するカラーセクタを使用して、セクターと血流方向の間の角度を可能な限り減らします。
- カラーセクタ幅: フレームレートを上げ、カラーフロー情報を改善するために、バルブ領域に合わせて調整します。
- ベースラインとパルスの繰り返し頻度(PRF):カラーバーとPRFのベースラインを調整して、より高い速度を表示できるようにします。カラー バーの上部と下部の数値は、カラー エイリアシングが発生する前の最大検出可能な速度を表します。
注:アリアシングは、パルスの一部がカラーフロードップラー情報に不利益を与える断面画像を得るために割り当てられているため、スペクトルパルスドップラーよりもカラーフロー処理においてより頻繁です。 - カラーゲイン: まず、バックグラウンド ノイズの作成を開始した時点までこの値を増やし、カラー フロー イメージングを最適化するレベルまで下げます。
- 適切なスペクトルドップラー イメージを取得するには、次のメイン コントロールを使用します。
- カーソル位置: この方向を血流方向に平行にします。少なくとも、角度<30°で維持します。
- ゲート位置:サンプリングサイトに対応するカーソルライン内のマーカーです。大動脈弁および肺弁の後と房室弁のリーフレット先端に置く。
- ゲートサイズ: 小さな逆流流を得る場合を除き、最小設定を使用します。
- ベースライン: 血流の方向に応じてベースラインを選択します。トランスデューサに対して血液が流れるとき(例えば、肺および大動脈の流れ)、または血液がトランスデューサに向かって流れるときに下部に置く(例えば、房室弁が流れる)。
- スケール:血流の速度に応じてこれを選択し、通常、得られた速度よりも25%高い。
- ドップラーゲイン: ドップラー信号を強化するためにこれを使用します。色が表示されるまでゲインを増やします。
- ドップラー信号の着色:ドップラースペクトルが弱い場合は、速度がシャープになるため、マゼンタ色を使用します。
- ウォール フィルタ: 心臓壁によって発生する低周波ノイズの量を減らす場合に使用します。
- スイープ速度: より高いスイープ速度を使用して、時間の測定を容易にします。
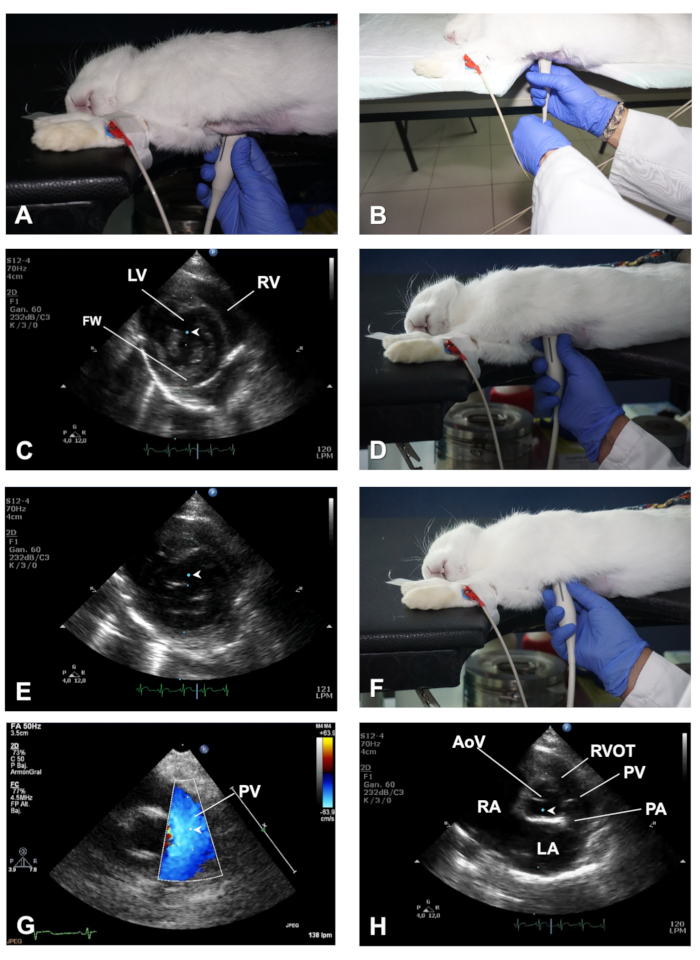
図 3.PSSAX ビューとその異なるイメージング プレーンを取得する方法。(A)乳頭筋のレベルでPSSAXビューを得るためにトランスデューサの位置。(B) PSLAXからPSSAXビューに切り替える際のトランスデューサの回転に役立つ左手の役割のデモンストレーション。(C) PSSAXビューの乳頭筋面におけるMモードのカーソルの位置。(D)ミトラル弁面における心臓のPSSAXビューを得るためにトランスデューサの位置。(E) PSSAX ビューの MV 平面内の M モードのカーソルの位置。(F) PSSAXビューでAV面を取得するトランスデューサの位置。(G) PVの流出を評価するために、PWDサンプル体積のカラードップラーと位置決めのデモンストレーション。(H) PSSAX ビューの AoV 平面における M モードのカーソルの位置。LV = 左心室;RV = 右心室;FW = LVフリーウォール;AoV = 大動脈弁;RVOT = 右心室流出トラック;PV = 肺弁;PA = 肺動脈;LA = 左アトリウム;RA = 右アトリウム。この図のより大きなバージョンを表示するには、ここをクリックしてください。
4.心臓のアピカル4室ビュー
- Apical 4チャンバー(AP4C)ビューを得るには、外科テープを使用して前肢を胸部領域から伸ばした左横リカンベント位置にウサギを配置する(図4A)。前述の通り、胸郭の皮膚を平らに保ちます(ステップ2.1.1)。胸部の心臓領域は、テーブルの切り抜きセクションの上に配置する必要があります。同様に、腹部は、穏やかなマッサージを通じて腹部の器官を動かす後、テーブルの上でよく支えられるべきである。
- トランスデューサに超音波ゲルを適用し、テーブルのノッチを通して心臓にアクセスし、左片胸の皮膚に密接に位置し、中鎖骨線との第4-5番目の肋間空間のレベルで、ウサギの背面を指すトランスデューサの向きマーク(左肩甲骨の方向)(図4B)。このようにして、トランスデューサは心臓の頂点と直交し、超音波ビームは心臓の基部に向けられる。
- この位置から、必要に応じて、トランスデューサを一度に1つの肋間空間を上に移動し、〜4番目の肋間空間(しばしば「ウィンドウショッピング」と呼ばれる操縦)まで移動します。
- 適切な肋間空間(ウサギの大きさや年齢によって異なる場合があります)に到達すると、頂点から心臓の基部までの心臓の画像を観察し、4つの部屋すべてが左右に見える典型的な心臓の形状を観察します。画像の下部にある上部の心室と両方の心房の心室(図4C、Dおよび代表的な結果を参照)。
- イメージの向き: LV はセクタ イメージの右側に置かれることに注意してください。
- 心臓の典型的な AP4C ビューは、中央に IVS を持つ LV の弾丸形状のイメージを与える必要があります(図 4C、D)。頂点が丸みを帯びた場合、LV は短縮される可能性が高くなります。したがって、トランスデューサを1つの肋間空間および/またはトランスデューサの傾きを下に移動します。
- B モードを使用して、地域の壁の動きの異常をチェックし、LV 関数のグローバル ビューを持ちます。色のドップラーを使用して房室弁を横切る流れを評価し、PWDを使用し、MVリーフレットの先端のレベルでサンプル体積を配置して、MV流入スペクトルの画像を得ます(図4C)。
- TDI モードを使用し、僧帽弁環状の中隔側と横側にサンプルボリュームを配置します (図 4D)。
- M モードを使用し、横 MV 環状に位置合わせされたカーソルを配置して、僧帽弁環状平面収縮期 (MAPSE) を取得します。心臓機能のオフライン分析のために、これらの各モードに画像を保存します。
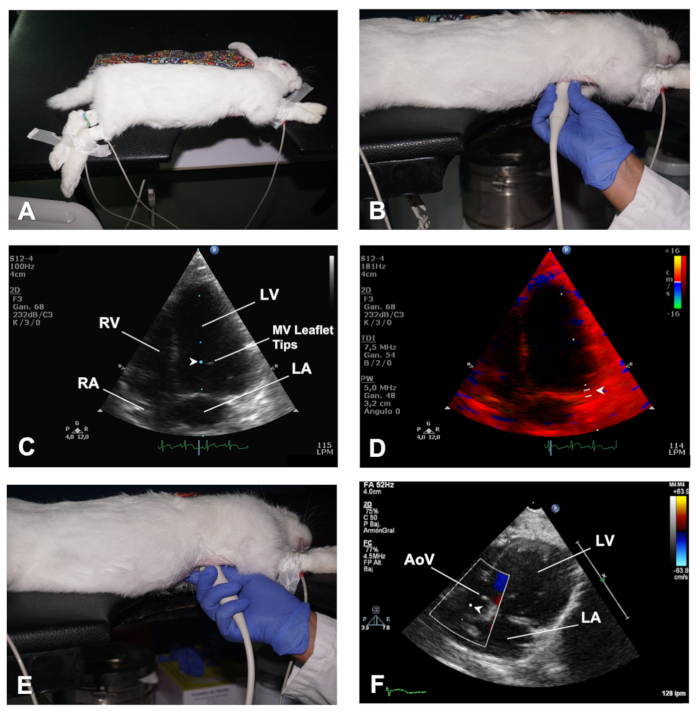
図 4.心臓の AP4C ビューと AP5C ビューを取得する方法。(A) 心臓のAP4Cビューのための左横デキュビタスにおけるウサギの位置決め。(B)心臓のAP4Cビューを得るためにトランスデューサの位置。(C) MV流入を評価するためのMVリーフレットのサンプルボリュームの位置(D) MV環状の横側における心筋速度のTDI分析のためのサンプル体積の位置。(E)心臓のAP5Cビューを得るためにトランスデューサの位置。(F) AoVを横断する流出のPWD分析のためのサンプル体積の位置。LV = 左心室;RV = 右心室;MV = 僧帽弁;LA = 左アトリウム;RA = 右アトリウム;AoV= 大動脈弁。この図のより大きなバージョンを表示するには、ここをクリックしてください。
5.心臓の頂点5室の眺め
- AP4Cビューと同じ位置にあるトランスデューサから始めて、LVOTおよびAoVが見えてくるまで穏やかな傾斜(図4E)を行い、これは心臓の頂点5チャンバービュー(AP5C)である(代表的な結果を参照)。
- Bモードを使用して、LVOT、AoVリーフレットの動き、およびLVキャビティのサイズと機能を評価します。
- AoV を横切る流出の評価にはカラー ドップラー モードを使用し、PWD を使用して、AoV (図 4F)のすぐ後ろにサンプルボリュームを配置して、このバルブ全体の流速を評価します。
結果
心臓のパラステナル長軸図
図5Aは、心臓の4つのチャンバーが明確に区別される右のPSLAXビューの撮像面を示す。このビューでは、右心室(RV)、三尖弁(テレビ)、IVS、LV、FW、ならびに僧帽弁(MV)を識別することができます。このビューで画像の左側に頂点がはっきりと見え、LVが短縮されてい...
ディスカッション
ウサギにおける心電図パラメータの心エコー検査のためのプロトコルを説明し、大きな前臨床モデル1、2、3を表す。本明細書に記載されるステップバイステップの方法論は、心エコー検査の基本原理の補完的な研究と超音波画像の基礎知識を補完的に検討し、研究者が実践を通じて、および補完的で専門的なガイダンス、...
開示事項
著者は何も開示していない。
謝辞
この研究は、フンダシオン・セネカ、アジェンシア・デ・シエンシア・イ・テクノロジア、レジオン・デ・ムルシア、スペイン(JT)(助成番号:11935/PI/09)、英国レディング大学(AG、GB)(セントラル・ファンディング)によって部分的にサポートされました。資金提供者は、研究の設計、データ収集と分析、出版の決定、または原稿の準備に何の役割も持ちはありませんでした。
資料
| Name | Company | Catalog Number | Comments |
| Bluesensor | Medicotest | 13BY1062 | Disposable adhesive ECG lectrodes |
| Domtor (Medetomidine) | Esteve | CN 570686.3 | Veterinary prescription is necessary |
| HD11 XE Ultrasound System | Philips | 10670267 | Echocardiography system. |
| Heating Pad | Solac | CT8632 | |
| Imalgene (Ketamine) | Merial | RN 9767 | Veterinary prescription is necessary |
| Omnifix-F 1 ml syringe | Braun | 9161406V | |
| S12-4 | Philips | B01YgG | 4-12 MHz phase array transducer |
| Ultrasound Transmision Gel (Aquasone) | Parker laboratories Inc. | N 01-08 |
参考文献
- Pogwizd, S. M., Bers, D. M. Rabbit models of heart disease. Drug Discovery Today Disease Models. 5, 185-193 (2008).
- Gandolfi, F., et al. Large animal models for cardiac stem cell therapies. Theriogenology. 75, 1416-1425 (2011).
- Harding, J., Roberts, R. M., Mirochnitchenko, O. Large animal models for stem cell therapy. Stem Cell Research & Therapy. 4, 23 (2013).
- Chong, J. J., Murry, C. E. Cardiac regeneration using pluripotent stem cells--progression to large animal models. Stem Cell Research. 13, 654-665 (2014).
- Del, M. F., Mynett, J. R., Sugden, P. H., Poole-Wilson, P. A., Harding, S. E. Subcellular mechanism of the species difference in the contractile response of ventricular myocytes to endothelin-1. Cardioscience. 4, 185-191 (1993).
- Sahn, D. J., DeMaria, A., Kisslo, J., Weyman, A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation. 58, 1072-1083 (1978).
- Thomas, W. P., et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 7, 247-252 (1993).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16, 233-270 (2015).
- Talavera, J., et al. An Upgrade on the Rabbit Model of Anthracycline-Induced Cardiomyopathy: Shorter Protocol, Reduced Mortality, and Higher Incidence of Overt Dilated Cardiomyopathy. BioMed Research International. 2015, 465342 (2015).
- Borkowski, R., Karas, A. Z. Sedation and anesthesia of pet rabbits. Clinical Techniques in Small Animal Practice. 14, 44-49 (1999).
- Cantwell, S. L. Ferret, rabbit and rodent anesthesia. The Veterinary Clinics of North America. Exotic Animal Practice. 4, 169-191 (2001).
- Giraldo, A., et al. Percutaneous intramyocardial injection of amniotic membrane-derived mesenchymal stem cells improves ventricular function and survival in non-ischaemic cardiomyopathy in rabbits. European Heart Journal. 36, 149 (2015).
- Giraldo, A., et al. Allogeneic amniotic membrane-derived mesenchymal stem cell therapy is cardioprotective, restores myocardial function, and improves survival in a model of anthracycline-induced cardiomyopathy. European Journal of Heart Failure. 19, 594 (2017).
- Bellenger, N. G., et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable?. European Heart Journal. 21, 1387-1396 (2000).
- Flachskampf, F. A., et al. Cardiac Imaging to Evaluate Left Ventricular Diastolic Function. Journal of the American College of Cardiology Cardiovascular Imaging. 8, 1071-1093 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved