È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Esame ecocardiografico transtoracico nel modello del coniglio
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui descriviamo, passo dopo passo, un protocollo dettagliato per l'esecuzione di ecocardiografia nel modello del coniglio. Mostriamo come ottenere correttamente le diverse viste ecocardiografiche e i piani di imaging, così come le diverse modalità di imaging disponibili in un sistema di ecocardiografia clinica abitualmente utilizzato nei pazienti umani e veterinari.
Abstract
Modelli animali di grandi dimensioni come il coniglio sono preziosi per la ricerca preclinica traslazionale. I conigli hanno un'elettrofisiologia cardiaca simile a quella degli esseri umani e di altri modelli animali di grandi dimensioni come cani e maiali. Tuttavia, il modello di coniglio ha il vantaggio aggiuntivo di ridurre i costi di manutenzione rispetto ad altri modelli animali di grandi dimensioni. La valutazione longitudinale della funzione cardiaca utilizzando l'ecocardiografia, se opportunamente implementata, è una metodologia utile per la valutazione preclinica di nuove terapie per l'insufficienza cardiaca con riduzione della frazione di espulsione (ad esempio rigenerazione cardiaca). L'uso corretto di questo strumento non invasivo richiede l'attuazione di un protocollo di esame standardizzato che segue le linee guida internazionali. Qui descriviamo, passo dopo passo, un protocollo dettagliato supervisionato da cardiologi veterinari per l'esecuzione di ecocardiografia nel modello del coniglio, e dimostriamo come ottenere correttamente le diverse viste ecocardiografiche e piani di imaging, così come il diverse modalità di imaging disponibili in un sistema di ecocardiografia clinica regolarmente utilizzato in pazienti umani e veterinari.
Introduzione
La valutazione longitudinale della funzione cardiaca nei modelli animali di grandi dimensioni è una solida metodologia di ricerca comunemente utilizzata per la valutazione degli effetti di nuove terapie per il trattamento della cardiomiopatia ischemica e non ischemica. Tra le diverse tecniche di imaging cardiovascolare disponibili per la ricerca preclinica, l'ecocardiografia è stata ampiamente utilizzata a causa delle sue caratteristiche non invasive e portatili. Nelle mani esperte, l'ecocardiografia è anche una tecnica di imaging molto riproducibile per studiare l'anatomia cardiaca e la funzione sistolica e diastolica del cuore.
Grandi modelli animali preclinici come maiali, cani e conigli, sono fondamentali per la ricerca traslazionale preclinica1,2,3. Infatti, il potenziale beneficio di nuove terapie come la medicina rigenerativa cardiaca in impostazione di cardiomiopatia richiede un'ampia ipotesi di test in grandi modelli preclinici prima che possano essere considerati per uso umano2,4 . Rispetto ad altri grandi modelli preclinici, il modello di coniglio offre alcuni vantaggi, tra cui il suo basso costo di manutenzione, che è paragonabile a quello di topi e ratti. Tuttavia, a differenza di topi e ratti, il sistema di trasporto Ca2 e l'elettrofisiologia cardiaca sono simili nei conigli a quelli degli esseri umani, e quelli di altri modelli animali di grandi dimensioni come cani e maiali, aumentando così il potenziale traslazionale del coniglio modello1,5. Pertanto, il coniglio, come un grande modello preclinico sperimentale, ha un eccezionale equilibrio di costi e riproducibilità per la ricerca traslazionale preclinica.
Il coniglio ha il vantaggio aggiuntivo della sua amenabilità per l'imaging ecocardiografico utilizzando unità ecografiche cliniche abitualmente utilizzate in pazienti umani e veterinari, sfruttando così la superiorità dell'imaging armonico e dello stato dell'arte tecnologia. Per questo, sono preferiti i trasduttori di settore (noti anche come phase array) di frequenza relativamente elevata (fino a 12 MHz), come quelli utilizzati nella cardiologia neonatale/pediatrica. L'esame cardiografico nel modello preclinico del coniglio consente la valutazione completa della funzione sistolica e diastolica utilizzando più viste e diverse modalità disponibili nelle moderne unità ecocardiografiche (ad es. Doppler a onda continua (CWD), Doppler a onde pulsate (PWD) e Tissue Doppler imaging (TDI)).
L'ecocardiografia è una tecnica dipendente dall'operatore e richiede pertanto un'ampia formazione e una conoscenza di base della tecnica in accordo con le linee guida internazionali. Parte di questa formazione può essere facilitata con la visualizzazione di video che spiegano in dettaglio come è possibile ottenere diverse visualizzazioni ecocardiografiche. Il raggiungimento di un'elevata competenza nell'imaging ecocardiografico, nonché lo sviluppo di un protocollo standardizzato e una tecnica corretta, sono essenziali per ridurre al minimo l'influenza dell'operatore e per generare dati quantitativi affidabili, come richiesto in rigoroso ricerca scientifica.
Alcune considerazioni sono necessarie per quanto riguarda il sistema e la configurazione di laboratorio utilizzati per l'ecocardiografia nei conigli e in altri modelli animali di grandi dimensioni. Per una valutazione ecocardiografica transtocica standard della funzione cardiaca, il sistema a ultrasuoni deve includere le seguenti modalità: modalità bidimensionale (B-mode o 2D), modalità di movimento (M-mode), colore Doppler, così come CWD, PWD e TDI. Inoltre, la macchina dovrebbe avere installato un software completo di analisi e misurazione cardiaco, nonché spazio sufficiente sul disco rigido interno per memorizzare abbastanza immagini fisse digitali di alta qualità e loop video per l'analisi offline. Alcuni sistemi utilizzano trasduttori di array lineari; tuttavia, per la migliore imaging del cuore, sono preferiti trasduttori phased array settore con un piccolo diametro della testa di scansione, perché questi consentono un passaggio più facile delle onde ultrasoniche attraverso gli spazi intercostali stretti. Per i conigli, usiamo trasduttori a frequenza relativamente alta (fino a 12 MHz). La posizione dell'animale per l'imaging è della massima importanza per acquisire immagini di buona qualità. Pertanto, si raccomandano entrambe le posizioni di recumbent laterali destra e sinistra per ottenere tutti i piani di imaging standard durante un esame ecocardiografico. Per questo, è consigliabile un tavolo con una tacca che coincide con l'area cardiaca del torace (Figura 1A). Questo tavolo dentellato facilita l'accesso con il trasduttore all'area del torace che verrà scansionata, e quindi consente la libera mobilità della mano del whist operatore mantenendo la migliore posizione di scansione dell'animale. Posizionare l'animale in una posizione reclinata laterale si traduce in una caduta del cuore verso il trasduttore e l'elevazione dei polmoni, oltre ad allargare la finestra di accesso del fascio ad ultrasuoni attraverso gli spazi intercostali, migliorando così l'imaging complessivo qualità (Figura 1A). L'esame ecocardiografico deve essere eseguito in modo cieco e seguendo le linee guida del Comitato ecocardiografia dell'American College of Veterinary Internal Medicine e della Società Americana di Ecocardio/Europea Associazione per l'imaging cardiovascolare6,7,8.
Parte del nostro team scientifico è associato al Servizio di Cardiologia di un Ospedale di Insegnamento Veterinario che si occupa quotidianamente di pazienti veterinari (ad es. cani e gatti), per i quali ha la formazione e l'accreditamento pertinenti in cardiologia veterinaria e l'ecocardiografia, e le sue diverse modalità di imaging, così come una vasta esperienza nell'imaging di diverse dimensioni di pazienti animali e conformazioni toraciche con questa tecnica. Inoltre, usiamo comunemente l'ecocardiografia per la valutazione longitudinale della funzione cardiaca in un modello di coniglio di cardiomiopatia indotta da antracicline9. Qui, descriviamo un protocollo di ecocardiografia passo dopo passo per la valutazione della funzione cardiaca utilizzando un'unità ecografica clinica in un grande modello preclinico come il coniglio. Questo protocollo è adattato alle attuali linee guida internazionali8e include raccomandazioni pratiche basate sulle nostre esperienze in ambienti clinici e sperimentali.
Protocollo
Gli esperimenti qui descritti sono stati approvati dal Comitato di ricerca etica dell'Università di Murcia, in Spagna, e sono stati eseguiti in conformità con la direttiva 2010/63/EU della Commissione europea. I passaggi descritti sono stati eseguiti in base a protocolli operativi standard che facevano parte del piano di lavoro e non sono stati eseguiti esclusivamente allo scopo di filmare il video di accompagnamento a questo documento.
1. Preparazione del coniglio
- Prima di procedere, iniziare iniettando una combinazione di ketamina (10 mg/kg) omogeneizzata nella stessa siringa con medetomidina (200 g/kg) per anesthetizzare l'animale, riducendo lo stress della procedura per il coniglio.
NOTA: L'uso dell'anestesia riduce anche la frequenza cardiaca in modo prevedibile, riducendo così la variabilità inter-individuale e ha l'ulteriore vantaggio di migliorare la qualità complessiva dell'imaging. Come mostrato nel video, coprire la testa con una coperta chirurgica per aiutare a mantenere l'animale calma durante l'iniezione di anestesia.- Verificare che l'animale sia completamente anetizzato entro 10-20 min, confermando la presenza di flaccidità muscolare, assenza di riflesso palpebrale, movimenti mandibolari e sniffing. La presenza di questi ultimi due segni (movimenti mandibolici e sniffing), sono a sua volta i primi segni di ridotta profondità anestetica. Anche se è raramente necessario, si dovrebbe considerare il ri-dosaggio (ad esempio la metà della combinazione di dosi anestetiche iniziali), se si prevede un lungo ritardo per completare la procedura.
NOTA: Mentre l'animale si addormenterà rapidamente entro i primi 5 minuti dopo l'iniezione, si raccomanda di consentire un piano più profondo di anestesia prima di tentare di manipolare l'animale. Questo ritardo eviterà di angosciare il coniglio, che altrimenti probabilmente produrrà tachicardia e influirà negativamente sulla precisione dell'imaging e sulla riproducibilità di alcuni parametri durante l'esame ecocardiografico (ad esempio analisi dell'afflusso della valvola mitrale). - Una volta che l'animale è anestesizzato, utilizzare un tagliacapelli per rimuovere i capelli dalla pelle del torace. Iniziare sotto la linea del collo e continuare fino al livello delle regioni ipocondriache destra e sinistra, così come la regione sub-xifoide nella linea mediana (Figura 1B).
- Rasare 1-3 cm2 della faccia interna dell'anteriore destro, così come le regioni mediotibiche degli arti posteriori destro e sinistro (Figura 1B).
- Verificare che l'animale sia completamente anetizzato entro 10-20 min, confermando la presenza di flaccidità muscolare, assenza di riflesso palpebrale, movimenti mandibolari e sniffing. La presenza di questi ultimi due segni (movimenti mandibolici e sniffing), sono a sua volta i primi segni di ridotta profondità anestetica. Anche se è raramente necessario, si dovrebbe considerare il ri-dosaggio (ad esempio la metà della combinazione di dosi anestetiche iniziali), se si prevede un lungo ritardo per completare la procedura.
- Dopo aver posizionato il coniglio su una coperta termica o un pad riscaldante per evitare l'ipotermia durante la procedura, applicare un gel conduttore adatto agli elettrodi e posizionarli nelle regioni rasate degli arti. Fissare gli elettrodi con nastro chirurgico.
- Verificare che sullo schermo del sistema venga visualizzato un segnale ECG corretto; di solito una traccia elettrocardiografica simultanea a 1 piombo è sufficiente per monitorare in modo sincrono il ritmo cardiaco durante l'intero studio cardiocardiografico (Figura 1A e Figura 1C).
NOTA: Oltre alla frequenza cardiaca, monitorare la frequenza respiratoria e la temperatura. La velocità respiratoria può essere monitorata visivamente o attraverso l'incidenza di movimenti toracici nell'immagine ecocardiografica, mentre la temperatura deve essere monitorata tramite sonda rettale. Questi parametri devono essere monitorati all'inizio, quindi ogni 10 min e alla fine della procedura. I conigli non tendono a vomitare durante l'anestesia10,11; pertanto, il digiuno dei conigli non è regolarmente raccomandato prima di un esame ecocardiografico.
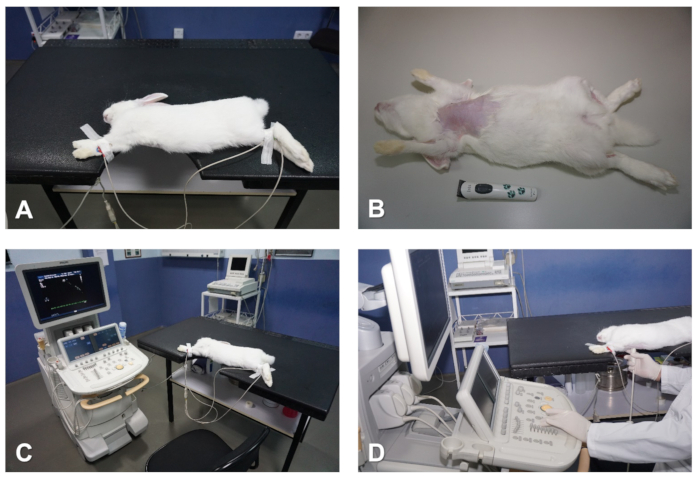
Figura 1 . Preparazione e posizionamento del coniglio per l'ecocardiografia. (A) Tabella con tacca che coincide con l'area cardiaca da immaginare. (B) Rimuovere i capelli dal petto. (C) Attaccare gli elettrodi ECG per monitorare il cuore. (D) Posizionamento dell'operatore durante la preformazione dell'esame ecocardiografico. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Vista parasternale lungo asse (sagittale) del cuore
- Per ottenere una vista parsternal long axis (PSLAX) del cuore, posizionare il coniglio nella giusta posizione laterale reclinata, con gli arti anteriori distesi lontano dal torace, con nastro chirurgico (Figura 1A e Figura 1C).
- Per ottenere la migliore qualità di imaging possibile, è importante mantenere la pelle della regione toracica il più piatta possibile per aumentare la penetrazione e migliorare la qualità complessiva dell'imaging durante l'imaging dell'animale. Per questo, tenere gli arti anteriori lontano dal torace con una mano, mentre utilizzando la mano libera per identificare eventuali pieghe e tasche della pelle, appiattire questi dall'alto verso il basso, e spostare qualsiasi pelle pieghevole lontano dal petto verso il lato laterale e posteriore del coniglio. Ciò è particolarmente importante per i conigli più vecchi e più grandi la cui pelle eccessiva e il tessuto adiposo sottocutaneo potrebbero ridurre la qualità dell'immagine.
NOTA: L'area cardiaca del torace deve essere posizionata sopra la sezione di ritaglio nella tabella. Tuttavia, tenere a mente che, in questa posizione, l'addome ha una tendenza naturale a muoversi verso la tacca, e crea una pressione positiva che sposta il cuore cranicamente, che poi interferisce con una buona imaging ecocardiografico. Per evitare questo, è importante che l'addome poggia completamente sul tavolo e, per raggiungere questo obiettivo, è utile spostare delicatamente gli organi addominali verso la regione caudale dell'animale attraverso massaggi delicati (Figura 1A e Figura 1C).
- Per ottenere la migliore qualità di imaging possibile, è importante mantenere la pelle della regione toracica il più piatta possibile per aumentare la penetrazione e migliorare la qualità complessiva dell'imaging durante l'imaging dell'animale. Per questo, tenere gli arti anteriori lontano dal torace con una mano, mentre utilizzando la mano libera per identificare eventuali pieghe e tasche della pelle, appiattire questi dall'alto verso il basso, e spostare qualsiasi pelle pieghevole lontano dal petto verso il lato laterale e posteriore del coniglio. Ciò è particolarmente importante per i conigli più vecchi e più grandi la cui pelle eccessiva e il tessuto adiposo sottocutaneo potrebbero ridurre la qualità dell'immagine.
- Per l'imaging ecocardiografico, tenere il trasduttore con la mano destra, mentre si utilizza la mano sinistra per azionare i controlli del sistema echocardiografico come illustrato nella Figura 1D.
- Per mantenere un buon contatto con la pelle, applicare l'etanolo non diluito sulla pelle e quindi un gel di trasmissione ad ultrasuoni sufficiente alla testa del trasduttore.
- Successivamente, posizionare il trasduttore vicino alla pelle dell'emitorace destro, al livello del secondo-terzo spazio intercostale e a circa 1-3 cm di distanza dalla linea del parasterna destra, con il segno di orientamento del trasduttore che punta alla spalla destra dell'animale e con un angolo di circa 30 gradi rispetto alla linea mediana (Figura2A). Questo dovrebbe produrre un'immagine del giusto PSLAX del cuore (vedi Risultati rappresentativi).
- Una volta visualizzate le immagini cardiache 2D sullo schermo, il passo successivo è quello di regolare i controlli dell'unità a ultrasuoni per ottenere immagini ottimali. I principali sono:
- Controlli di profondità e zoom: utilizzare questi controlli per ottimizzare l'area di interesse. La profondità dell'immagine deve essere adeguata in modo che le strutture cardiache possano essere viste su ogni immagine. Utilizzare lo strumento zoom per una migliore valutazione delle strutture di interesse, ad esempio l'integrità delle valvole e dei volantini.
- Guadagno totale e compensazione guadagno di tempo (cioè, impostazioni di guadagno a diverse profondità in tempo reale): Controllare le scale di grigi e guadagni manualmente per ridurre al minimo il rumore di fondo e per massimizzare la delineazione delle strutture cardiache. Questi parametri sono particolarmente importanti nei conigli a causa della scarsa ecogenicità del miocardio ventricolare.
- Intervallo dinamico o compressione: utilizzare questo controllo per regolare il numero di sfumature di grigio visualizzate dall'immagine. Impostare la gamma dinamica in modo che la riserva di sangue è scura e il tessuto è luminoso. Ciò si tradurrà in una migliore definizione del confine endocardico, che è importante per ottenere volumi ventricolari lasciati.
- Larghezza del settore: Iniziare l'esame con un ampio settore (90 o più) e dopo una panoramica del cuore, ridurre la larghezza del settore se aree specifiche devono essere meglio immagine. La riduzione delle dimensioni del settore migliora la risoluzione temporale aumentando la frequenza fotogrammi. Ciò è particolarmente importante quando l'ecocardiografia 2D viene utilizzata per guidare l'esame Doppler.
- Per mantenere la posizione del trasduttore durante l'imaging del coniglio, e per ridurre l'affaticamento dell'operatore, utilizzare l'indice per ancorare la mano al tavolo o al torace dell'animale, mentre le altre dita tengono il trasduttore (Figura 2A).
- Ottieni due piani di imaging principali del cuore nella giusta vista PSLAX.
- Trovare un piano di imaging che sezioni lungo il cuore e dove tutte e quattro le camere del cuore (due atri e due ventricoli) possono essere identificate; inoltre, quando si utilizza un ampio campo visivo, l'apice del cuore dovrebbe anche venire in vista sul lato sinistro dell'immagine (vedi sezione Risultati rappresentativi).
- Eseguire movimenti sottili del trasduttore, come spazzare, dondolo e rotazione, rispetto allo spazio intercostale, nonché l'angolo craniocaudale e dorsoventrale del fascio ultragrafico per ottenere l'altro piano di imaging della vista dell'asse lungo parasternale ( Figura 2A,B). Nell'altro piano di imaging, è possibile identificare la traccia di deflusso ventricolare sinistro (LVOT) e l'aorta (vedere Risultati rappresentativi).
- Orientamento immagine: si noti che la base del cuore sarà sul lato destro dell'immagine del settore.
- Dopo aver ottenuto i piani di imaging appropriati, utilizzare la modalità B per valutare la funzione complessiva del cuore e utilizzare Doppler di colore per valutare il flusso sanguigno su tutte le valvole, nonché l'integrità del setto interventricolare (IVS).
NOTA: salva sempre le immagini delle diverse viste e piani per l'analisi offline.
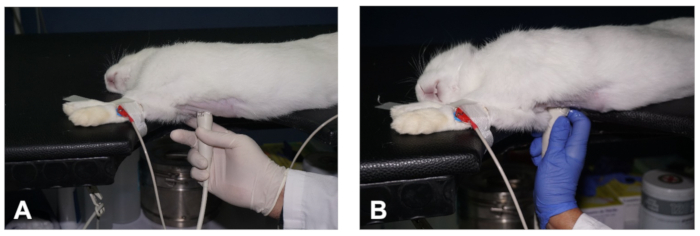
Figura 2 . Come ottenere una vista PSLAX del cuore. (A- B) Posizionamento del trasduttore per ottenere i due diversi piani della vista PSLAX del cuore (vedere la descrizione nel testo). Fare clic qui per visualizzare una versione più grande di questa figura.
3. Vista parasternale dell'asse corto del cuore
- Con il trasduttore nella stessa posizione nel torace mentre si visualizza una PSLAX ben allineata, eseguire una rotazione in senso antiorario del trasduttore di circa 90 gradi (Figura3A) per ottenere una vista dell'asse corto parasternale destro (PSSAX). Questa volta, il segno di orientamento del trasduttore dovrebbe essere rivolto verso la spalla sinistra del coniglio.
NOTA: Per mantenere il trasduttore nella stessa posizione del torace durante la rotazione del trasduttore, utilizzare la mano sinistra per eseguire la rotazione dal cavo del trasduttore come mostrato nella Figura 3B. - Nella vista parasternale dell'asse corto, ottenere tre piani di imaging spazzando il trasduttore lungo l'asse del cuore: il mid-ventricolare, la valvola mitrale e la base alta con l'arteria polmonare (PA) e la valvola aortica (AoV) in vista.
- Nel piano di imaging medio-ventricolare, che taglia il cuore ai muscoli papillari e il livello delle corde tendine (Figure 3C), visualizza il ventricolo destro (RV) in alto e il ventricolo sinistro (LV) nella parte inferiore dell'immagine (vedi Risultati rappresentativi).
- Utilizzare la modalità B per valutare la contrazione radiale e circonferenziale e il rilassamento del VL e verificare la presenza di anomalie di movimento della parete regionale.
- Utilizzare la modalità M e con l'aiuto della palla da pista spostare il cursore in tempo reale sull'immagine 2D, quindi posizionare il cursore al centro dell'LV, tra entrambi i muscoli papillari, perpendicolarmente all'IVS e alla parete libera ventricolare sinistra (FW) (Figura3C). Una volta visualizzate le immagini in modalità M sullo schermo, memorizzare le immagini per l'analisi offline. Nei conigli con frequenza cardiaca elevata, utilizzare velocità di sweep più elevate per separare meglio gli eventi cardiaci durante il ciclo cardiaco (ad esempio, 150 mm/sec).
- Spazzando il trasduttore verso la regione cefalica (Figura 3D), ottenere un piano della valvola mitrale (MV). Utilizzare la modalità B e la modalità M per valutare l'integrità e la motilità dei volantini MV. Posizionare il cursore lungo il centro della LV, perpendicolare all'IVS (Figura 3E), per ottenere informazioni dettagliate sull'escursione del MV in relazione all'IVS.
- Spazzare ulteriormente il trasduttore grossolanamente per provocare un piano di imaging a livello della base alta (noto anche come piano AoV; Figura 3F - H), in cui è possibile identificare l'AoV e i suoi volantini, la traccia di deflusso ventricolare destra (RVOT), l'AP e l'atria destra e sinistra (LA) (vedere Risultati rappresentativi).
- Orientamento immagine: si noti che l'AP sarà sul lato destro dell'immagine del settore.
- Per visualizzare completamente l'AP e la sua biforcazione, utilizzare una maggiore angolazione e, a volte, uno spostamento cranico del trasduttore (uno spazio intercostale).
- Utilizzare la modalità B per la valutazione delle dimensioni e della forma di queste strutture (ad esempio, la dimensione atriale sinistra viene aumentata in insufficienza cardiaca congestizia) e utilizzare Doppler e PWD di colore per registrare la velocità del flusso sanguigno (deflusso) a livello di PV, posizionando il volume del campione appena al di sotto del l'apertura dei volantini fotovoltaici (Figura 3G). Infine, utilizzare la modalità M e posizionare il cursore lungo l'AoV e la (Figura 3H).
- Utilizzare i seguenti controlli principali e regolazioni per ottenere immagini Doppler flusso di colore adeguate:
- Con il settore del colore posizionato nell'area di interesse, ridurre il più possibile l'angolo tra il settore e la direzione del flusso sanguigno.
- Larghezza del settore del colore: regolare questo all'area della valvola, al fine di aumentare la frequenza del fotogramma e migliorare le informazioni sul flusso di colore.
- Frequenza di ripetizione della linea di base e dell'impulso (PRF): regolare la linea di base sulla barra dei colori e sul PRF, per consentire la visualizzazione di velocità più elevate. Un numero nella parte superiore e inferiore della barra dei colori rappresenta la velocità massima rilevabile prima dell'aliasing dei colori.
NOTA: l'aliasing è più frequente nell'elaborazione del flusso di colorerispetto al Doppler spettrale a impulsi, perché una parte degli impulsi viene assegnata per ottenere immagini sezionali trasversali in modo dannoso per le informazioni sul doppler del flusso di colore. - Guadagno di colore: in primo luogo, aumentare questo al punto che inizia a creare rumore di fondo, e quindi diminuire a un livello che ottimizza l'imaging del flusso di colore.
- Utilizzare i seguenti controlli principali per ottenere immagini Doppler spettrali adeguate:
- Posizione del cursore: rendere questo parallelo alla direzione del flusso sanguigno; almeno, mantenere ad angolo < 30.
- Posizione cancello: è un indicatore nella riga del cursore corrispondente al sito di campionamento. Posizionarlo dopo le valvole aortiche e polmonari e sulle punte dei volantini delle valvole atrioventricolari.
- Dimensioni cancello: utilizzare l'impostazione minima tranne per ottenere piccoli flussi di rigurgito.
- Linea di base: selezionare la linea di base a seconda della direzione del flusso sanguigno. Posizionarlo in alto quando il sangue scorre contro il trasduttore (ad esempio flussi polmonari e aortici), o in basso quando il sangue scorre verso il trasduttore (ad esempio le valvole atrioventuracolari.
- Scala: selezionare questo in base alla velocità del flusso sanguigno, di solito, 25% superiore alla velocità ottenuta.
- Doppler guadagno: Utilizzare questo per intensificare i segnali Doppler. Aumentare il guadagno fino a quando non viene visualizzato il colore.
- Colorazione del segnale Doppler: Utilizzare il colore magenta quando lo spettro Doppler è debole perché rende la velocità più nitida.
- Filtro a parete: utilizzare questa opzione per ridurre la quantità di rumore a bassa frequenza prodotta dalle pareti cardiache.
- Velocità di sweep: utilizzare velocità di sweep più elevate per facilitare le misurazioni del tempo.
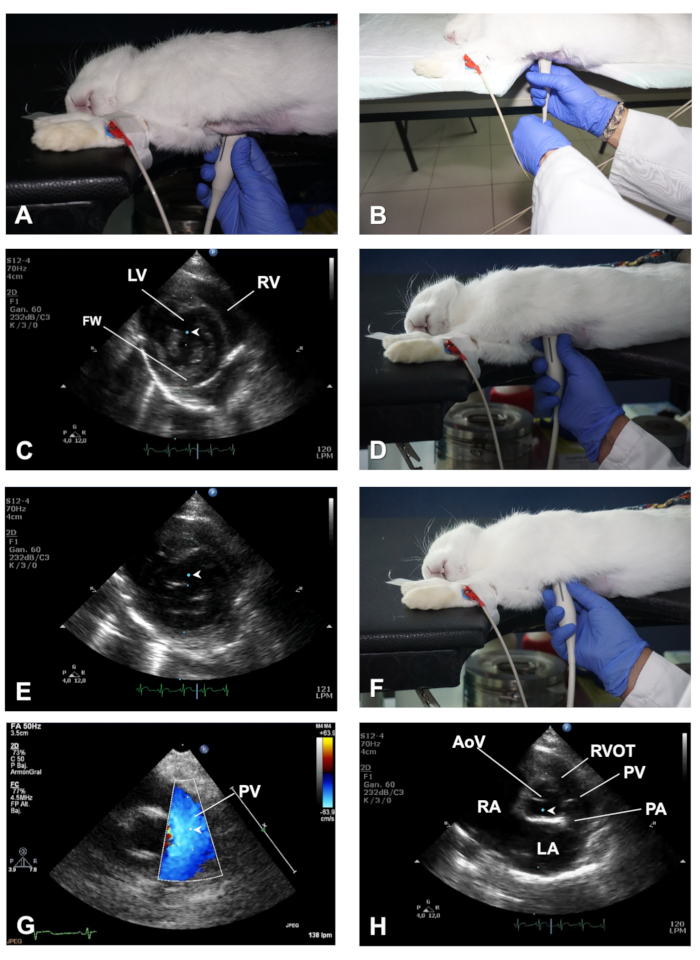
Figura 3 . Come ottenere una vista PSSAX e i suoi diversi piani di imaging. (A) Posizione del trasduttore per ottenere una vista PSSAX a livello dei muscoli papillari. (B) Dimostrazione del ruolo della mano sinistra per aiutare a ruotare il trasduttore quando si passa da una vista PSLAX a una vista PSSAX. (C) Posizione del cursore della modalità M nel piano dei muscoli papillari della vista PSSAX. (D) Posizione del trasduttore per ottenere una vista PSSAX del cuore sul piano della valvola mitrale. (E) Posizione del cursore della modalità M nel piano MV della vista PSSAX. (F) Posizione del trasduttore per ottenere il piano AV nella vista PSSAX. (G) Dimostrazione del Colore Doppler e posizionamento del volume del campione PWD per valutare il deflusso del PV. (H) Posizione del cursore della m-Mode nel piano AoV della vista PSSAX. LV - ventricolo sinistro; RV - ventricolo destro; FW - parete libera LV; AoV - valvola aortica; RVOT - traccia di deflusso ventricolare destra; PV - valvola polmonare; PA - arteria polmonare; LA - Atrio sinistro; RA - Atrio destro. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Apical 4 camere vista del cuore
- Per ottenere una vista Apical 4 camere (AP4C), posizionare il coniglio nella posizione reclinata laterale sinistra con gli arti anteriori distesi lontano dalla regione toracica per mezzo di nastro chirurgico ( Figura 4A). Mantenere la pelle del torace piatta in modo simile a quanto descritto sopra (Passaggio 2.1.1). L'area cardiaca del torace deve essere posizionata sopra la sezione di ritaglio del tavolo. Allo stesso modo, l'addome dovrebbe essere ben supportato sul tavolo dopo aver spostato caudalmente gli organi addominali attraverso un massaggio delicato.
- Applicare il gel ad ultrasuoni al trasduttore, quindi accedere al cuore attraverso la tacca del tavolo e posizionarlo da vicino alla pelle dell'emitorace sinistro, a livello dello spazio thcostale 4 th-5 con la linea midclavicular, con la segno di orientamento del trasduttore rivolto verso la parte posteriore del coniglio (nella direzione della scapola sinistra) (Figura 4B). In questo modo, il trasduttore è ortogonale con l'apice del cuore e il fascio ultragrafico è diretto verso la base del cuore.
- Da questa posizione, se necessario, spostare il trasduttore verso l'alto di uno spazio intercostale alla volta fino al quarto spazio intercostale (una manovra spesso chiamata "finestra shopping").
- Una volta raggiunto lo spazio intercostale appropriato (che può variare in base alle dimensioni e/o all'età del coniglio), osservare un'immagine del cuore dall'apice alla base del cuore, la tipica forma del cuore in cui tutte e quattro le camere possono essere viste, con la sinistra e la destra ventricoli nella parte superiore ed entrambi gli atri nella parte inferiore dell'immagine (vedere Figura 4C,D e Risultati rappresentativi).
- Orientamento immagine: si noti che l'LV sarà sul lato destro dell'immagine del settore.
- Evitare di scorciare l'apice in questa vista, in modo che la tipica vista AP4C del cuore dovrebbe dare un'immagine a forma di proiettile del LV con lo SVS al centro (Figura 4C,D). Se l'apice è arrotondato, l'LV è probabilmente accorciato; quindi, spostare il trasduttore verso il basso di uno spazio intercostale e/o inclinazione del trasduttore.
- Utilizzare la modalità B per verificare la presenza di anomalie di movimento della parete regionale e avere una visione globale della funzione LV. Utilizzare Doppler di colore per valutare il flusso attraverso le valvole atrioventricolari e utilizzare PWD e posizionare il volume campione al livello delle punte del foglio illustrativo MV per ottenere immagini dello spettro di afflusso MV (Figura 4C).
- Utilizzare la modalità TDI e posizionare il volume del campione ai lati settale e laterale dell'annulo della valvola mitrale (Figura 4D).
- Utilizzare la modalità M e posizionare il cursore allineato con l'annulo MV laterale per ottenere l'escursione sistolica del piano anulare mitrale (MAPSE). Archiviare le immagini in ognuna di queste modalità per l'analisi offline della funzione cardiaca.
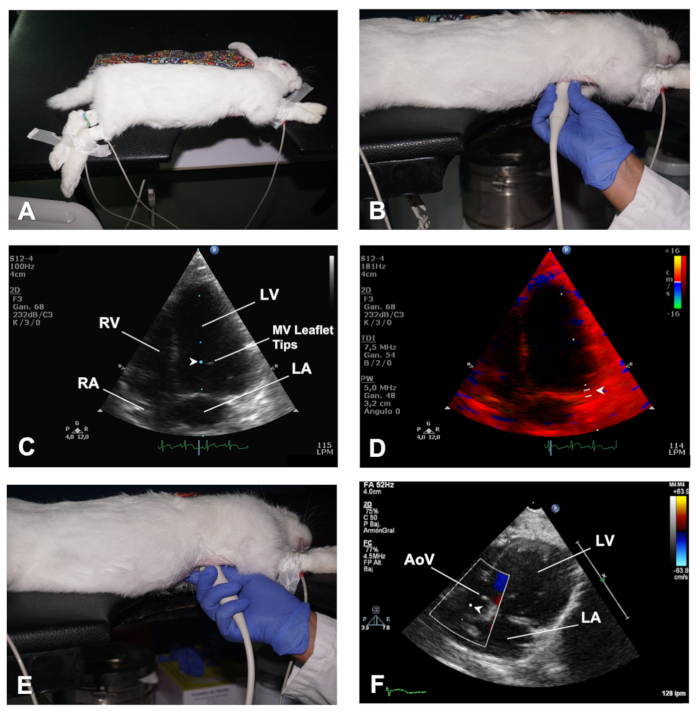
Figura 4 . Come ottenere le opinioni AP4C e AP5C del cuore. (A) Posizionamento del coniglio in decubito laterale sinistro per una vista AP4C del cuore. (B) Posizione del trasduttore per ottenere una vista AP4C del cuore. (C) Posizione del volume campione all'opuscolo MV punte per valutare l'afflusso di MV. (D) Posizione del volume del campione per l'analisi TDI delle velocità miocardiche sul lato laterale dell'annulo MV. (E) Posizione del trasduttore per ottenere una vista AP5C del cuore. (F) Posizione del volume campione per l'analisi PWD del deflusso attraverso l'AoV. LV - ventricolo sinistro; RV - ventricolo destro; MV - valvola mitrale; LA - atrio sinistro; RA - atrio destro; Valvola aortica AoV. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Apical 5 camere vista del cuore
- Partendo dal trasduttore nella stessa posizione della vista AP4C, eseguire un'inclinazione delicata caudally (Figura 4E) fino a quando il LVOT e AoV entrano in vista, questa è la vista apicale 5 camere (AP5C) del cuore (vedi Risultati rappresentativi).
- Utilizzare la modalità B per valutare il LVOT, il movimento dei volantini AoV, nonché la dimensione e la funzione della cavità LV.
- Utilizzare la modalità Doppler a colori per la valutazione del deflusso attraverso l'AoV e PWD per valutare la velocità del flusso attraverso questa valvola posizionando il volume del campione appena dietro l'AoV (Figura 4F).
Risultati
Parasternal lungo asse vista del cuore
La figura 5A mostra un piano di imaging della vista PSLAX di destra in cui le 4 camere del cuore si distinguono chiaramente. È possibile identificare in questa vista il ventricolo destro (RV), valvola tricuspid (TV), IVS, LV, FW, così come la valvola mitrale (MV). Quando l'apice è chiaramente visibile sul lato sinistro dell'immagine in quest...
Discussione
Abbiamo descritto un protocollo per l'esame ecocardiografico dei parametri di funzione cardiaca nel coniglio, che rappresenta un grande modello preclinico1,2,3. La metodologia passo dopo passo descritta qui dovrebbe essere considerata una guida, che con uno studio complementare dei principi di base dell'ecocardiografia, e una conoscenza di base dell'imaging ad ultrasuoni, aiuterà il ricercatore a ottenere, attraverso la pratica...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da: Fundaciàn Séneca, Agencia de Ciencia y Tecnolog, Regiàn de Murcia, Spagna (JT) (numero di sovvenzione: 11935/PI/09) e l'Università di Reading, Regno Unito (AG, GB) (Finanziamento centrale). I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Bluesensor | Medicotest | 13BY1062 | Disposable adhesive ECG lectrodes |
| Domtor (Medetomidine) | Esteve | CN 570686.3 | Veterinary prescription is necessary |
| HD11 XE Ultrasound System | Philips | 10670267 | Echocardiography system. |
| Heating Pad | Solac | CT8632 | |
| Imalgene (Ketamine) | Merial | RN 9767 | Veterinary prescription is necessary |
| Omnifix-F 1 ml syringe | Braun | 9161406V | |
| S12-4 | Philips | B01YgG | 4-12 MHz phase array transducer |
| Ultrasound Transmision Gel (Aquasone) | Parker laboratories Inc. | N 01-08 |
Riferimenti
- Pogwizd, S. M., Bers, D. M. Rabbit models of heart disease. Drug Discovery Today Disease Models. 5, 185-193 (2008).
- Gandolfi, F., et al. Large animal models for cardiac stem cell therapies. Theriogenology. 75, 1416-1425 (2011).
- Harding, J., Roberts, R. M., Mirochnitchenko, O. Large animal models for stem cell therapy. Stem Cell Research & Therapy. 4, 23 (2013).
- Chong, J. J., Murry, C. E. Cardiac regeneration using pluripotent stem cells--progression to large animal models. Stem Cell Research. 13, 654-665 (2014).
- Del, M. F., Mynett, J. R., Sugden, P. H., Poole-Wilson, P. A., Harding, S. E. Subcellular mechanism of the species difference in the contractile response of ventricular myocytes to endothelin-1. Cardioscience. 4, 185-191 (1993).
- Sahn, D. J., DeMaria, A., Kisslo, J., Weyman, A. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation. 58, 1072-1083 (1978).
- Thomas, W. P., et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 7, 247-252 (1993).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16, 233-270 (2015).
- Talavera, J., et al. An Upgrade on the Rabbit Model of Anthracycline-Induced Cardiomyopathy: Shorter Protocol, Reduced Mortality, and Higher Incidence of Overt Dilated Cardiomyopathy. BioMed Research International. 2015, 465342 (2015).
- Borkowski, R., Karas, A. Z. Sedation and anesthesia of pet rabbits. Clinical Techniques in Small Animal Practice. 14, 44-49 (1999).
- Cantwell, S. L. Ferret, rabbit and rodent anesthesia. The Veterinary Clinics of North America. Exotic Animal Practice. 4, 169-191 (2001).
- Giraldo, A., et al. Percutaneous intramyocardial injection of amniotic membrane-derived mesenchymal stem cells improves ventricular function and survival in non-ischaemic cardiomyopathy in rabbits. European Heart Journal. 36, 149 (2015).
- Giraldo, A., et al. Allogeneic amniotic membrane-derived mesenchymal stem cell therapy is cardioprotective, restores myocardial function, and improves survival in a model of anthracycline-induced cardiomyopathy. European Journal of Heart Failure. 19, 594 (2017).
- Bellenger, N. G., et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable?. European Heart Journal. 21, 1387-1396 (2000).
- Flachskampf, F. A., et al. Cardiac Imaging to Evaluate Left Ventricular Diastolic Function. Journal of the American College of Cardiology Cardiovascular Imaging. 8, 1071-1093 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon