Method Article
丝状真菌曲霉菌的单步富集蛋白脱乙酰化酶的酶活性测定
摘要
像 RpdA 这样的1级组蛋白去乙酰化酶 (Hdac) 作为治疗真菌感染的潜在靶点变得越来越重要。在这里, 我们提出了一个协议的特普标签 RpdA 结合 HDAC 活性检测, 允许体外疗效测试组蛋白去乙酰化酶抑制剂的方案.
摘要
第1类组蛋白去乙酰化酶 (Hdac), 如 RpdA 已成为治疗真菌感染和真菌次生代谢物基因组挖掘的潜在靶点。然而, 抑制剂筛选需要纯化酶活性。由于第1类去乙酰化酶发挥其作为多蛋白复合物的功能, 当它们在细菌中作为单个多肽表达时, 通常是不活跃的。因此, 内源性复合物需要隔离, 当应用传统技术, 如离子交换和大小排除色谱, 是费力和耗时。串联亲和力纯化已被开发为一种工具, 以丰富多蛋白复合物从细胞, 因此被证明是理想的分离内源性酶。在这里, 我们提供了一个详细的协议, 通过第一步纯化的 c 端 tap 标记 RpdA 从曲霉菌硝斯的 RpdA 的活性 RpdA 复合物的单步浓缩. 纯化后的配合物可用于随后应用去乙酰化酶法进行抑制剂筛选。蛋白质富集与酶活性测定可在两天内完成。
引言
组蛋白去乙酰化酶 (Hdac) 是锌2 +依赖水解酶, 能够从组蛋白和其他蛋白质的赖氨酸残留物中去除乙酰基。基于序列相似性, Hdac 被分组为几个类 1。最近, 真菌类 1 HDAC RpdA, 面包师酵母 (酿酒酵母) rpd3p 的正畸, 被证明是必不可少的机会真菌病原体熏蒸菌2。因此, RpdA 作为治疗真菌感染的潜在靶点已经变得越来越重要。体外对去乙酰化酶活性的评估对于酶特性的表征很重要, 可以确定新物质对抑制剂开发的有效性。尽管最近3种信息在大肠杆菌中重组了人类 hdac1 的代码优化版本, 但在这个宿主中表达全长rpda 的尝试失败了4。此外, 由于真菌1类 Hdac, 如 RpdA 和 HosA 发挥其功能作为多蛋白复合物, 它是有利的使用本地内源性复合物的酶抑制剂研究。然而, 由于抑制因素和真菌裂解物中存在不同的 Hdac, 在整个蛋白质提取物中测量的催化活性相对较低, 不能分配给单个酶。此外, 以前的研究中的丝状真菌a. nidulans 确定了2类 Hdac, HdaA, 主要去乙酰化酶的色谱组分的真菌提取物。因此, 需要多个常规色谱纯化步骤来分离非 hdaa 活性和真菌菌株4。在 a. nidulans5 中引入串联亲和力纯化 (tap) 策略, 显著缓解了特异性去乙酰化酶活性的富集。原来的 TAP 标记由两个蛋白质 A 域和一个钙调素结合肽 (CBP) 组成, 由烟草蚀刻病毒蛋白酶 (TEV) 裂解位点 6分离。这允许本地纯化和洗脱标记的蛋白质, 包括他们的相互作用伙伴 7。当使用浓缩蛋白进行活性检测时, 蛋白酶裂解在本地条件下的轻度洗脱是 TAP 标签纯化的一个重要特征。例如, gfp 标记的蛋白质也可以通过固定化抗体来丰富, 然而, 在本地条件下也不能洗脱。
在这里, 我们提供了一个详细的协议, 通过第一步纯化的活性 rpda 复合物从a. nidulans (igg 分离和 tev 裂解) 的第一个纯化步骤, 用于随后的抑制剂筛选应用组蛋白去乙酰化酶检测。正如证明的那样, 亲和力富集仅限于一个纯化步骤, 这也是因为与单独的 IgG 纯化相比, 两步 tap 纯化后的酶活性显著降低。
然而, 所介绍的协议也应适用于其他标记酶的浓缩参与染色质调节, 如乙酰转移酶, 甲基转移酶, 和去己基酶。通过附加 TAP 协议的第二个纯化步骤, 与标记诱饵共纯化的蛋白质可以被认为是 (新的) 酶复合物的复合物。
研究方案
1. a. nidulans的栽培
- 伊诺库鲁姆制剂
注: 除孵化外的所有步骤都应在层流柜下执行。- 流出 TAP 应变 (例如: TIB32.12) 从甘油库存 (-80°c) 到葡萄糖/木糖最小介质 (gxmm; 每公升: 10.0 克葡萄糖, 0.5 克木糖, 10 毫升 1 m 二铵酒石酸盐溶液, 20 毫升 50 x 盐溶液 [每升: 26.0 gKCl, 26.0 g MgSO4 ·7h2o, 76.0 g kh 2Po4, 1 ml 氯仿], 1 毫升1毫升1毫升 1, 000xhhrner 的微量元素8), 包括 1.5% (w/v) 琼脂和 todd等人所述的所需补充剂, 2007年9。在37°c 下孵化2-3天。
注: TIB32.1 包含rpda:: 由 xyloe 诱导启动子 xyl p (p) 10控制的 tap 融合。这就是为什么木糖被包括在上述配方中。当生长的菌株表达不受木质 p(p) 控制的结构时, 忽略木糖。 - 制备无菌 1.5 mL 离心管, 其中含有 1.5 mL 的无菌综合悬浮液 (CSS; 0.9% (w/v)、0.01% (v/v) 聚山梨酸酯 80)。
- 湿一次性接种循环在 CSS, 刮掉圆锥1.1.1 从板和悬浮在管从步骤1.1.2。
- 将每根锥形悬浮液的150Μl 转移到 10 25 厘米2细胞培养瓶, 通风口盖含有 GXMM 琼脂, 包括补充剂和200ΜL 的 css。
- 使用无菌接种回路将锥形悬浮液分散在烧瓶内, 并在37°c 孵育烧瓶2-3天。
- 要收获圆锥, 每个烧瓶使用10毫升的 CSS。将溶液倒进烧瓶中, 用提供的螺帽紧紧地合住烧瓶, 大力摇晃烧瓶。
- 在润湿真菌表面后, 用无菌接种循环完全刮掉剩余的圆锥花序。
- 通过放置在无菌50毫升离心管上的40μm 细胞过滤器, 并在一个管中收集5个烧瓶的悬浮液。
- 以 1, 000xg 离心管 10分钟。
- 在每管10毫升的 CSS 中分解上清液并重新悬浮颗粒。
- 收集两个悬浮液在一个管, 冲洗空管与40毫升的 CSS, 添加到悬浮液, 和离心机如步骤1.1.9 所述。
- 在 CSS 的4毫升中分解上清液并重新悬浮锥形颗粒。
- 准备两个连续的 1:50 稀释的锥形悬浮液, 并确定在产生的 1:2, 500-diluted 稀释悬浮液与计数室的圆锥数的数量, 如所述的第11。
- 流出 TAP 应变 (例如: TIB32.12) 从甘油库存 (-80°c) 到葡萄糖/木糖最小介质 (gxmm; 每公升: 10.0 克葡萄糖, 0.5 克木糖, 10 毫升 1 m 二铵酒石酸盐溶液, 20 毫升 50 x 盐溶液 [每升: 26.0 gKCl, 26.0 g MgSO4 ·7h2o, 76.0 g kh 2Po4, 1 ml 氯仿], 1 毫升1毫升1毫升 1, 000xhhrner 的微量元素8), 包括 1.5% (w/v) 琼脂和 todd等人所述的所需补充剂, 2007年9。在37°c 下孵化2-3天。
- 菌丝体的生长和收获
- 在层流柜下工作时, 接种4-6 个一升锥形烧瓶, 每个烧瓶中含有250毫升的 GXMM, 包括密度为 5x10 6 的适当补充剂 , 并在37°c 时以180转/分的温度孵育14-16h。
- 将奶酪布放入烧瓶上的漏斗中, 并通过该布过滤菌丝体。用去离子水短暂清洗。
- 通过挤压被困在奶酪布中的菌丝体, 首先在双手之间, 然后是纸巾, 去除尽可能多的水分。
- 将干燥的菌丝体作为平板将转移到带螺丝盖的塑料烧杯上, 并用液氮冷冻闪光。这确保了以下冷冻干燥过程的高面积体积比。
- 在冻干前将冷冻菌丝体存放在-80°c。
注: 协议可以在此处暂停。 - 菌丝体在一夜之间的再冷冻化。
- 当菌丝体温度保持不变 (18–24小时) 时, 停止冷冻干燥过程。取下烧杯, 并立即用提供的螺帽密封。
注: 当紧密密封时, 冻干菌丝体可以在 RT 储存数周。
2. 单步浓缩贴有 tap 标签的 HDAC (改编自 Bayram等人, 2012年)12
- 缓冲区和解决方案的准备
注: 使用前直接在缓冲液中添加 2-硫醇 (EtSH) 和蛋白酶抑制剂。通过0.22μm 硝化纤维素膜过滤用于色谱的所有缓冲液, 以避免在色谱树脂中引入污染物。以下步骤中的说明指的是每个缓冲区的 1 L 的准备。将缓冲区存储在4°C。- 萃取缓冲液 (B250): 250 mM 氯化钠, 100 mM Tris-HCl pH 7.5 (RT), 0.1% (v/v) TX-100, 5 mM etsh。
- 在800毫升去离子水中溶解12.35 克 Tris-HCl, 2.62 克 Tris (自由碱) 和13.2 克氯化钠, 并加入 10% (v/v) tx-100 溶液的10毫升。
- 如有必要, 使用 NaOH 或 HCl [5 M] 检查 rt 的 pH 值, 并调整到 pH 值7.5。
- 通过0.22 微米的硝化纤维素膜制成高达1升并过滤。
- 在使用前, 直接在每100毫升的缓冲液 (5 mM 最终浓度) 中加入 35μl EtSH。
- 洗涤缓冲液 250 (WB250): 250 mM Ncl, 40 mM Tris-HCl ph 值 8.0 (RT), tx-100, 5 mM etsh 0.1%。
- 按照 B250 (2.1.1) 的描述准备 WB250, 但使用3.59 克的 Tris-HCl 和2.08 克的 Tris (免费基地)。
- 洗涤缓冲液 150 (WB150): 150 mM 氯化钠, 40 mM Tris-HCl ph 值 8.0 (RT), tx-100, 5 mM etsh 0.1%。
- 按照 B250 (2.1.1) 的描述准备 WB150, 但有3.59 克的 Tris-HCl, 2.08 克的 Tris (免费基地) 和8.77 克的氯化钠。
- TEV 平衡缓冲液 (TEB): 150 mM Ncl, 40 mM Tris-HCl ph 值 8.0 (RT), 0.5 mM EDTA, 0.1% (v/v) TX-100, 5 mM EtSH。
- 与 WB150 相同, 但在 0.5 mM 最终浓度中添加 EDTA。
- TEV 裂解缓冲液 (TCB): 150 mM 氯化钠, 40 mM Tris-HCl ph 值 8.0 (RT), 0.5 mM EDTA, 0.1% (v/v) TX-100, 10% (v/v) 甘油, 5 mM EtSH。
- 准备与3.59 克的 Tris-HCl, 2.08 克的 Tris (自由碱) 和8.77 克的氯化钠, 并添加100毫升的甘油, 然后调整体积到1升2.1.1。
- 50x 蛋白酶抑制剂鸡尾酒: 将市售的蛋白酶抑制剂混合物1片溶解在1毫升的水中, 并储存在-20°c。
- TBS-T:50 mM Tris-HCl pH 7.6 (RT), 0.9% (w/v) 氯化碳, 0.1% (v/v) 聚山梨酸酯20。
- 按照步骤2.1.1 中的说明进行准备。使用6.06 克 Tris-HCl、1.40 克 tris (游离碱)、9克氯化碳和1毫升聚山梨酸盐20。
- 5XLSB (Laemmli 样品缓冲液): 315 mM Tris-HCl ph 6.8 (RT), 25% (v/v) etsh, 50% (v/v) 甘油, 10% (w/v) SDS, 0.05% (w/v) 溴酚蓝。
- 萃取缓冲液 (B250): 250 mM 氯化钠, 100 mM Tris-HCl pH 7.5 (RT), 0.1% (v/v) TX-100, 5 mM etsh。
- 蛋白质提取物的制备
- 在球磨机的磨罐中加入1.5 克冻干菌丝体和磨球。
注: 也可以使用新鲜的菌丝体。这样做的时候, 在冷冻前尽可能彻底地干燥菌丝体, 并确保将磨罐用液氮预置, 以研磨新鲜的菌丝体. - 将菌丝体磨成25赫兹的粉末, 30s。
注: 在没有磨床的情况下, 使用砂浆和磨刀将菌丝体磨成粉末, 如 Bayram等人所述.12岁 - 将菌丝粉转移到15毫升离心管中。
- 倾斜离心管, 包括地面菌丝体, 以便随后将菌丝体与缓冲液混合。
- 加入6毫升冰凉 B250, 包括1xx 蛋白酶抑制剂鸡尾酒每克菌丝体粉, 并与小铲子混合, 直到实现粗提取物的完全均匀化。使用新鲜菌丝体时, 请参阅 Bayram等人.12. 达到正确的生物质提取缓冲比。
- 将管子放在冰上5分钟。
- 将试管和平衡管放入离心机中, 在4°c 下以 40, 000xg旋转≥20分钟。在离心过程中对 IgG 树脂进行平衡 (步骤 2.3)。
- 离心后, 去除10Μl 上清液, 进行 SDS-PAGE 分析。将样品放入含有40μl 的水和125μl 的5XLSB 的 1.5 mL 管中;图 1中称为 "ex"。
- 使用血清学移液器小心去除上清液 (清除裂解液), 转移到包含平衡 IgG 珠 (2.3 步) 的列上, 并使用所提供的端盖紧紧关闭。
- 在球磨机的磨罐中加入1.5 克冻干菌丝体和磨球。
- IgG 树脂的平衡 (在步骤2.2.7 中进行)
- 准备一个10毫升的一次性色谱柱和管道300μl 的良好再悬浮 Igg 树脂 (50% 浆料) 到该柱。用 B250 将柱填充到10毫升, 让缓冲液通过重力流动。
- 加入1毫升的 B250, 包括1x·蛋白酶抑制剂鸡尾酒, 让流动通过。插入列的底部。
- 带 tab 标记的 HDAC 的批量纯化
- 在旋转搅拌机上, 在10°c 时, 在10°c 时, 在旋转搅拌机上, 以2-4小时的速度, 将含有平衡珠子和清除裂解物的色谱柱2.2.9 中清除。
- 批处理绑定后, 取下盖板, 打开底部的列, 以收集流经。
- 如步骤2.2.8 所述, 进行 SDS-PAGE 分析的样本;图 1中称为 "ft"。
- 用10毫升 WB250 清洗珠子。首先, 使用1毫升的缓冲液, 使用移液器从柱盖中取出被困的珠子, 并将该悬浮液在一次冲洗中转移到固定的树脂上, 以允许珠子重新悬浮。然后将柱填充到顶部, 使用堆栈盖关闭, 并连接到蠕动泵。调整流量约为 1-5 mL/min, 防止树脂干燥。
- 重复步骤2.4.4 三次, 使用 WB250 共洗四次。
- 如步骤2.4.4 所述, 用10毫升的 TEB 清洗珠子三次。
- 关闭底部的色谱柱, 在 TCB 的1毫升中重新悬浮 IgG 珠, 并加入50xu 蛋白酶抑制剂鸡尾酒20μl 以及10μl 的 TEV (~ 1 mgml 库存, 内部生产的 S219V 突变体变体).
- 在4°C 的晚上 10点, 在旋转搅拌机上封盖柱, 并在旋转混合器上孵育, 通过贴有标签的 HDAC 将蛋白质复合物洗脱。
注: 或者在高温 (16–25°c) 下进行 TEV 消化, 这减少了反应时间, 但增加了蛋白质降解的风险。 - 第二天打开柱, 并收集在一个2毫升离心管的洗脱液。使用0.7 毫升的 TCB 从瓶盖上取下珠子, 并冲洗柱壁。
- 将柱放置在上一步打开的2毫升管上, 该管本身被放置在50毫升的离心管内。
- 将该组件转移到桌面离心机中, 以 300xg旋转2分钟。这是 TEV 洗脱。
注: 执行串联亲和力纯化时, 使用 TEV 洗脱液作为钙调位亲和力步骤的输入。您也可以拆分 TEV 洗脱液, 并使用一个部分进行 HDAC 活性测定, 第二部分用于完成 TAP 纯化。 - 从 TEV 洗脱液中取出 50μl, 并为 SDS-PAGE 添加12.5μl 的 5XLSB (图1 和 2中称为 "te"), 并将剩余的洗脱液保持在冰上。
- 为了评估蛋白酶洗脱的效果, 加入2毫升的5% 乙酸, 并在 RT 孵育5分钟。再次, 使用第一个 mL 重新悬浮树脂。
- 收集酸洗脱液, 再次取50Μl 样品, 加入12.5Μl 的 5XLSB (如图 1所示为 "ae")。当添加到酸性溶液中时, LSB 会变成黄色。要中和酸, 在1μl 的步骤中加入 10m NaOH, 并充分混合, 直到颜色再次变为蓝色。
- 用 TBS-T 重新平衡 IgG 树脂, 使其中和酸。将树脂储存在 TBS-T20% (v/v) 乙醇中, 在4°c 下, 与相同的标记蛋白重复使用。
- 洗脱分数的存储
- 将洗脱液倾斜到 ~ 100μl 组分中, 以避免多个冻融循环。
- 将脂肪冻结在液氮中, 并保持在-80°c。
注: 以这种方式存储的样品将在几个月内保持稳定, 而不会失去酶活性。
3. SDS-PAGE 和西方印迹的纯化分析
- 使用标准协议铸造 sds-聚丙烯酰胺凝胶或使用预制凝胶13。在95°c 下, 上一段的变性凝胶样品 5分钟, 离心机在≥15, 000 x g下 5分钟, 并加载到12% 的凝胶上。图 1的图例中给出了建议的加载卷。电泳样品在 1xtris-甘辛 SDS-PAGE 运行缓冲液 180 v 常数60–70分钟, 直到 SDS-PAGE 加载缓冲液的溴酚蓝色标记开始迁移出凝胶。
- 使用标准协议对凝胶进行银染色。例如, 使用 Blum 等人的协议.1987 14 这也与 ms 分析兼容。
- 使用标准的西方印迹15。对于下面具有代表性的结果的产生, 使用了一个商业上可获得的印迹系统。
- 在4°C 的 TBS-T 中, 用市售的抗钙调蛋白结合蛋白 (抗 cbp) 抗体在 TBS-T 中的 5% (w/v) 进行探针印迹。
注: 抗 cbp 抗体针对的是在 TEV 裂解后仍然存在的 TAP 标签部分。 - 使用标准协议检测和开发印迹。例如, 使用抗兔 igg 碱性磷酸酶共轭和 BCIP/NBT 颜色开发基板生成以下具有代表性的结果。
4. 体外 [3h] 醋酸标记鸡网状细胞组蛋白的去乙酰化酶检测 (改编自 Trojer 等人, 2003年)4
- 有关 [3h] 醋酸标记的鸡网状组蛋白的制备, 请参阅 kölle 等人1998年第16款的协议。
- 根据检测条件, 将三个 1.5 mL 的离心管放置在冰上, 以便在三重奏中进行测量。也准备三个管只适用于缓冲区的背景控制。
- 将25μl 的 WB150 放入每个管中, 从步骤2.4.11 添加25Μl 的 TEV 洗脱液, 并保持在冰上。
- 将管式孵化器预热至25°c。
- 使用15秒的间隔 (秒表) 在每个管中添加10μl 的标记组蛋白 [1.5 mg/mL]。
- 在开始检测之前, 取10Μl 的 [3h] 醋酸标记鸡组蛋白, 并开始停止手表。
- 开始后 5秒, 添加标记的组蛋白, 将管子紧密地关闭, 涡旋, 并将其放入孵化器。
- 使用15秒的间隔添加10Μl 的标记组蛋白, 然后按照上一步中的说明继续操作。
- 60分钟孵育后, 每隔15秒在每个管中加入50μl 的停止溶液 (1m Hcl/2 0.4 m 乙酸);涡流立即。添加酸性溶液后, 检测组合是稳定的, 可以保持在 RT, 直到下一步。
- 在每个试管中加入800μl 乙酸乙酯, 提取释放的 [3h] 乙酸。
- 紧紧地关闭管, 并旋涡每个管5秒。
- 将管子放入微型离心机中, 在 rt以10, 000xg 旋转10分钟。
- 同时, 为每个检测样品准备一个闪烁小瓶, 并为疏水样品添加3毫升闪烁鸡尾酒。
- 离心后 (步骤 2.12), 小心地将上有机相的600μl 转移到制备的闪烁管中, 并将管紧紧地关闭。
- 测量液体闪烁计数器中与 HDAC 活性相对应的放射性。
结果
图 1 (称为 "igg") 显示了所提出的 rpda 单步浓缩的典型结果。为了完整起见, 我们还包括了流经和洗脱分数 ("CFT" 和 "CE"), 说明了 12所述的钙调素树脂 ("cam") 的第二个纯化步骤。显示的银染凝胶 (a) 清楚地说明了第一个亲和力步骤的有效性, 在执行串联纯化时, 这种步骤甚至会进一步增加。然而, 蛋白质提取物和流经中存在的最突出的蛋白质在 TEV 洗脱液 (TE) 中已经耗尽。重要的是要注意到, 与萃取和流经相比, TEV 洗脱分数是 gt;100 x 浓缩的。星号标记为 RpdA (比较面板b)。计算出的包括 CBP (RpdA:: Cbp) 在内的 RpdA Mw 为 82 kDa, 但蛋白质的迁移表观分子量要高得多, 约为 120 kDa。这种现象以前已经观察到, 可以分配给其 c-终端4、17的具体特性。免疫印迹 (b) 显示在大约 120 kda 处迁移的强信号, 与 tev 洗脱液 ("te")、钙调蛋白 ("cft") 和洗脱 ("ce") 分数中的 cbp 标记的全长 RpdA (RPDA:: CBP) 相对应。在酸洗脱 ("AE") 第二个信号以稍微更大兆瓦是可看见的。这表示 tap 标记的 RpdA 与 IgG 树脂结合的比例, 而这并不是由 TEV 裂解释放的。大小的差异对应于蛋白质 A 的 16 kDa 重复的未切割 RpdA:: tap。正如预期的那样, 在野生类型控制分数 ( b 组,"野生类型") 中, 抗 cbp 抗体无法检测到波段。
图 2显示了具有代表性的去乙酰化酶活性测定结果, 并与特定的 HDAC 抑制剂三菌素 a (tsa) 进行了分析。该方法最初是为植物18开发的, 也被用于对哺乳动物去乙酰化酶19,20的抑制剂筛选。用于检测的组蛋白按所述16进行了标记和制备。研究表明了 TSA 浓度的增加对富集 RpdA 复合物 ("TET±TSA") 催化活性的影响。该活动的敏感性证实, 测量的 cpm 值确实是由于 RpdA, 而不是由非特定的蛋白酶活性引起的。这是一个重要的观察, 因为它表明, 在相当高的浓度, tev, 不干扰 HDAC 活性分析。为了将测量到的 HDAC 活动分配给 RpdA, 使用了一种野生类型应变作为负控制 ("Co")。如预期的那样, 在野生类型的 TEV 洗脱液中只检测到边际 HDAC 活性 (约占 rpda 富集分数的 5-10)。有趣的是, 与 TEV 洗脱液相比, 在第二次亲和力纯化步骤 ("CE") 之后, HDAC 的活性显著降低。
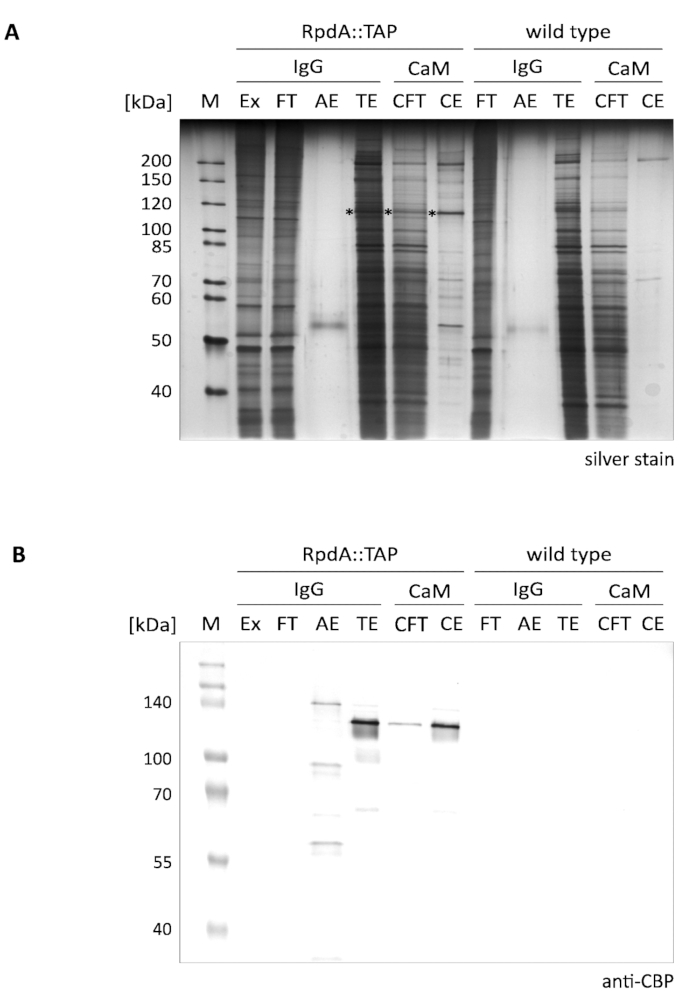
图1。带 tab 标记的 RpdA 的串联亲和力纯化.本文介绍了用抗 cbp 抗体 (b) 检测的银染 10% sds-聚丙烯酰胺凝胶 (a) 和西方印迹。车道标记和装载量如下: "M": 2μl 的 1 :10 稀释未染色蛋白标记物 (银染色), 3.5μl 的预染色蛋白标记 (西方印迹); "Ex": 步骤2.2.8 中制备的蛋白质提取物样品 ( 1:10 稀释的 2μl, 5μl);"FT": 步骤2.4.3 制备的 IgG 树脂流动样品 ( 1:10 稀释的 2μl, 5μl);"AE": 2.4.14 的酸洗脱 (10μl, 10μl); "TE": 通过 TEV 裂解、步骤 2.4.12 (10μl, 10μl) 洗脱隔夜洗脱术; "CFT": 钙调素流通 (20μl, 20μl);"CE": 钙调素洗脱 (10μl, 10μl)。所选标记蛋白的大小显示在面板的左侧。括号中给出的体积分别对应于银染色和西方印迹的样品载荷。银染凝胶中的星号表示 RpdA 融合蛋白。用 BCIP/NBT 显色系统检测碱性磷酸酶免疫印迹 (b)。请点击这里查看此图的较大版本.
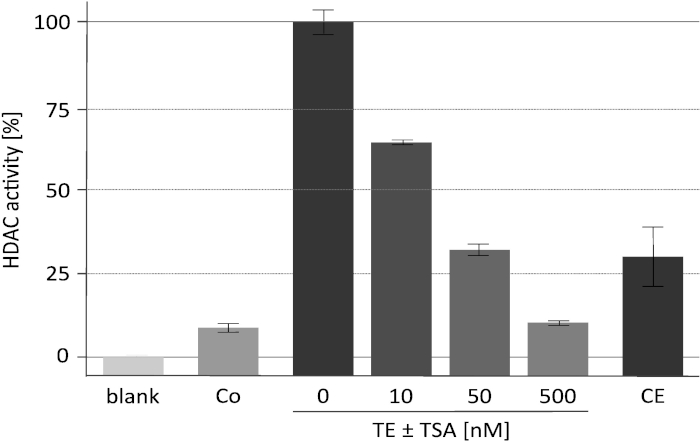
图2。HDAC 活性分析在三打素 A 浓度增加的情况下.用25μl 的亲和力纯化重组 RpdA ("TE") 和25μl 的 HDAC 抑制剂 Tsa 在 RPMI-1640 培养基中稀释, 测试了 RpdA 抑制的有效性。RPMI 用于评估背景活动 ("空白")。显示第二个钙调素亲和力步骤 ("CE") 后的最终洗脱液和第一个亲和力纯化步骤 ("阴性控制") 后的未标记应变的活动。活动显示为没有 TSA 的浓缩 RpdA 的百分比 (100%, "TE")。误差线表示三个副本的标准偏差。这一数字已从 Bauer等人的 2016年 2中修改。请点击这里查看此图的较大版本.
讨论
该协议描述了单步浓缩的 tap 标记类 1 HDAC 从丝状真菌a. 尼杜兰体外脱乙酰化酶活性的评估。TAP 标签最初是在面包师酵母中引入的, 用于鉴定标记蛋白6的蛋白质-蛋白质相互作用伙伴。随后, 该标签被编码优化, 以便在a. nidulans5中使用.在这里, 我们提供了一个直接的分步协议, 用于应用 tap 策略的第一个亲和力纯化步骤, 用于第1类 HDAC RpdA 的单步浓缩。第二亲和力纯化步骤清楚地增加了纯化的水平, 这对于识别诱饵相互作用的蛋白质尤为重要。然而, 仅仅第一步建议后续的活性测试, 因为第一步后没有明显的污染是通过使用野生类型菌株的控制实验得到证实的。此外, 与完整的 tap 相比, 单步浓缩后的洗脱活性要高得多。除 RpdA2外, 该协议还成功地用于净化第二类 1 Hdac hosa 21 的 a. nidulans 配合物。
由于我们的观察, 真菌类 1 Hdac 建立稳定的复合物4, 我们已经成功地修改了协议由 bayram等 2012 12代表了这种方法的基础。然而, 必须提到一些关键步骤。制备高浓度蛋白质提取物以确保近生理条件对于复杂的稳定性至关重要。因此, 重要的是要注意给定的建议有关生物物质提取缓冲比。在这方面, 使用井底细菌丝体粉体以确保适当的提取也是至关重要的。在这里, 使用磨床显然是有利的。正如协议部分所提到的, 为了加快净化速度, 在室温下尝试1-2小时的 tev 裂解步骤是值得的。这在 RpdA 测试中没有观察到对稳定的任何有害影响 (未发表的观测结果, Bauer i, 2018)。此外, 用 TX-100 替换 NP40 (在原始协议中使用) 可能不适合其他蛋白质复合物。当使用这种方法纯化其他 tap 标记的蛋白质时, 还应该参考 Bayram 协议, 其中包含一些有价值的提示, 可能有助于充分纯化其他蛋白质复合物12。
除了这里描述的 tap 方法, 其他亲和力标记和技术是常用的单步富集蛋白的丝状真菌, 包括他和 gfp 标签。然而, 由于第1类 Hdac 通常作为高分子量复合物发挥作用, 本机洗脱条件是催化活性 Hdac 富集的先决条件。重要的是, 许多其他亲和力纯化是在不利的条件下进行的。例如, 由于酸性洗脱条件干扰了 hdac 配合物与树脂结合的蛋白质-蛋白质相互作用, 因此通过基于抗原-抗体相互作用的 GFP-疏水阀浓缩 hdac 是不合适的。此外, 试图通过金属螯合亲和层析22纯化他标记的 RpdA, 在净化过程中导致催化活性的显著损失, 尽管使用咪唑而不是低 ph 值条件进行洗脱 (未公布的数据, 鲍尔, I, 2010)。
所述酶分析协议的一个局限性是放射性基板的使用。然而, 在荧光的基础上进行的检测也开发了23,24 , 并可在商业上获得。这些检测是在良好的板材中进行的, 因此也适用于 HDAC 抑制剂的高通量筛选。在这种情况下, 需要采用所提出的程序的高档。
该协议的潜在应用包括浓缩第1类 Hdac 的特定子配合物, 以评估其特定的生理作用和/或它们对 HDAC 抑制剂的敏感性差异。在为其他酶建立所述方法时, 强烈建议对无标记菌株进行负控制实验。这确保了被测酶活性的特异性, 并将揭示不具体结合的酶的污染。
此处描述的纯化和活性测定可在两天内进行, 富集酶在-80°c 时储存在脂肪中至少几个月内稳定。总之, 该协议为实现第1类 HDAC 配合物的活性测量和抑制剂疗效测定提供了一种相对简单且具有成本效益的方法。
披露声明
作者没有什么可透露的。
致谢
我们要感谢分子生物学系 (因斯布鲁克医科大学生物分校) 的 Petra Merschak 对这份手稿的帮助和支持。此外, 我们还要感谢评审人员的宝贵意见。
这项工作由奥地利科学基金 (P24803 至 SG 和 P21087 至 GB) 和校内资金 (MUI Start, ST2014031交给 IB) 提供资金。
材料
| Name | Company | Catalog Number | Comments |
| 10 x SDS-PAGE running buffer | Novex | ||
| 2-mercaptoethanol (EtSH) | Roth | 4227 | |
| 25 cm2 cell culture flasks with vent cap | Sarstedt | 833910002 | For spore production |
| 47 mm vacuum filtration unit | Roth | EYA7.1 | |
| AccuFLEX LSC-8000 | HITACHI | – | Scintillation counter |
| Acetic acid | Roth | 7332 | |
| Anti-Calmodulin Binding Protein Epitope Tag Antibody | Millipore | 07-482 | Used at 1:1333 dilution |
| Anti-Rabbit IgG (whole molecule)–Alkaline Phosphatase (AP) antibody | Sigma-Aldrich | A3687 | |
| Ball mill | Retsch | 207450001 | Mixer Mill MM 400 |
| BCIP/NBT | Promega | S3771 | Color development substrate for AP |
| Cell strainer | Greiner | 542040 | |
| Cheese cloth for harvesting mycelia | BioRen | H0028 | Topfentuch |
| Dimethylsulfoxid (DMSO) | Roth | 4720 | |
| EDTA | Prolabo | 20309.296 | |
| Ethyl acetate | Scharlau | Ac0155 | |
| Freeze Dryer | LABCONCO | 7400030 | FreeZone Triad |
| Glycerol | Roth | 3783 | |
| HCl | Roth | 4625 | |
| IgG resin | GE Healthcare | 17-0969-01 | IgG Sepharose 6 Fast Flow |
| Inoculation loops | VWR | 612-2498 | |
| KOH | Merck | 5033 | |
| Laminar flow cabinet | Thermo Scientific | – | Hera Safe KS |
| Mixed Cellulose Esters Membrane Filters | Millipore | GSWP04700 | |
| NaCl | Roth | 3957 | |
| NaOH | Roth | 6771 | |
| Neubauer counting chamber improved | Roth | T728 | |
| Novex gel system | Thermo Scientific | For SDS-PAGE | |
| Novex Tris-glycine SDS running buffer (10X) | Thermo Scientific | LC2675 | Running buffer for SDS-PAGE |
| peqGold protein-marker II | VWR | 27-2010P | Protein ladder used for silver stain |
| Peristaltic Pump P-1 | GE Healthcare | 18111091 | |
| Pipette controller | Brand | 26302 | accu-jet pro |
| Poly-Prep chromatography columns | Bio-Rad | 731-1550 | |
| ProSieve QuadColor protein marker | Biozym | 193837 | Prestained protein ladder used for western blot |
| Protease inhibitor cocktail tablets | Sigma-Aldrich | 11873580001 | cOmplete, EDTA-free |
| Rotary mixer | ELMI | – | Intelli-Mixer RM-2 S |
| Rotiszint eco plus | Roth | 0016 | |
| RPMI-1640 | Sigma-Aldrich | R6504 | |
| Scintillation vials | Greiner | 619080 | |
| Sorvall Lynx 4000 | Thermo Scientific | ||
| Thermomixer comfort | Eppendorf | ||
| TIB32.1 | A. nidulans rpdA::TAP strain. Genotype: alcA(p)::rpdA; veA1; argB2; yA2; pIB32::argB; ArgB+; PyrG+ | ||
| Trans-Blot Turbo RTA Midi Nitrocellulose Transfer Kit | Bio-Rad | 1704271 | |
| Trans-Blot Turbo Transfer System | Bio-Rad | 1704150 | |
| Trichostatin A (TSA) | Sigma-Aldrich | T8552 | 5 mM stock in DMSO |
| Tris (free base) | Serva | 37190 | |
| Tris-HCl | Roth | 9090 | |
| Polysorbate 20 | Roth | 9127 | Tween 20 |
| Polysorbate 80 | Sigma-Aldrich | P1754 | Tween 80 |
| TX-100 | Acros Organics | 215682500 | Triton X-100, Octoxynol-9 detergent |
参考文献
- Gregoretti, I. V., Lee, Y. -. M., Goodson, H. V. Molecular evolution of the histone deacetylase family: functional implications of phylogenetic analysis. Journal of Molecular Biology. 338 (1), 17-31 (2004).
- Bauer, I., et al. A Class 1 Histone Deacetylase with Potential as an Antifungal Target. mBio. 7 (6), (2016).
- Stefan, A., et al. Purification of active recombinant human histone deacetylase 1 (HDAC1) overexpressed in Escherichia coli. Biotechnology Letters. 40 (9-10), 1355-1363 (2018).
- Trojer, P., et al. Histone deacetylases in fungi: novel members, new facts. Nucleic Acids Research. 31 (14), 3971-3981 (2003).
- Bayram, &. #. 2. 1. 4. ;., et al. VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism. Science. 320 (5882), 1504-1506 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hill, T. W., Kafer, E. Improved protocols for Aspergillus minimal medium: trace element and minimal medium salt stock solutions. Fungal Genetics Reports. 48, (2001).
- Todd, R. B., Davis, M. A., Hynes, M. J. Genetic manipulation of Aspergillus nidulans: meiotic progeny for genetic analysis and strain construction. Nature Protocols. 2 (4), 811-821 (2007).
- Zadra, I., Abt, B., Parson, W., Haas, H. xylP promoter-based expression system and its use for antisense downregulation of the Penicillium chrysogenum nitrogen regulator NRE. Applied and Environmental Microbiology. 66 (11), 4810-4816 (2000).
- Stolz, D. J., et al. Histological Quantification to Determine Lung Fungal Burden in Experimental Aspergillosis. Journal of Visualized Experiments. (133), (2018).
- Bayram, &. #. 2. 1. 4. ;., et al. Identification of protein complexes from filamentous fungi with tandem affinity purification. Methods in Molecular Biology. 944, 191-205 (2012).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Blum, H., Beier, H., Gross, H. J. Improved silver staining of plant proteins, RNA and DNA in polyacrylamide gels. Electrophoresis. 8 (2), 93-99 (1987).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 24, 145-149 (1992).
- Kölle, D., et al. Biochemical methods for analysis of histone deacetylases. Methods. 15 (4), 323-331 (1998).
- Tribus, M., et al. A novel motif in fungal class 1 histone deacetylases is essential for growth and development of Aspergillus. Molecular Biology of the Cell. 21 (2), 345-353 (2010).
- Sendra, R., Rodrigo, I., Salvador, M. L., Franco, L. Characterization of pea histone deacetylases. Plant Molecular Biology. 11 (6), 857-866 (1988).
- Valente, S., et al. 1,3,4-Oxadiazole-containing histone deacetylase inhibitors: anticancer activities in cancer cells. Journal of Medicinal Chemistry. 57 (14), 6259-6265 (2014).
- Mai, A., et al. Synthesis and biological properties of novel, uracil-containing histone deacetylase inhibitors. Journal of Medicinal Chemistry. 49 (20), 6046-6056 (2006).
- Pidroni, A., et al. A Class 1 Histone Deacetylase as Major Regulator of Secondary Metabolite Production in Aspergillus nidulans. Frontiers in Microbiology. 9, 2212 (2018).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Wegener, D., Wirsching, F., Riester, D., Schwienhorst, A. A fluorogenic histone deacetylase assay well suited for high-throughput activity screening. Chemistry & Biology. 10 (1), 61-68 (2003).
- Peng, L., Yuan, Z., Seto, E. Histone deacetylase activity assay. Methods in Molecular Biology. 1288, 95-108 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。