Method Article
糸状菌のタップタグ付きヒストンデアセチラーゼのシングルステップエンリッチメント酵素活性アッセイのためのカビnidulans
要約
クラス1のヒストンデアセチラーゼ (HDACs) RpdA のような真菌感染症を治療する潜在的なターゲットとして重要性を得ています。.ここでは、ヒストンデアセチラーゼ阻害剤のインビトロ薬効試験を可能にする HDAC 活性アッセイと組み合わせた、TAP タグ付き RpdA の特異的な濃縮のためのプロトコルを提示する。
要約
RpdA のような1級ヒストンデアセチラーゼ (HDACs) は、真菌感染症の治療や真菌二次代謝物のゲノムマイニングの標的として重要性を増している。しかし、阻害剤のスクリーニングには、精製酵素活性が必要である。クラス1デアセチラーゼは multiprotein 複合体としての機能を発揮するので、細菌において単一ポリペプチドとして表される場合には通常活性ではない。したがって、内因性複合体は単離される必要があり、これは、イオン交換およびサイズ排除クロマトグラフィーのような従来の技術が適用される場合に、手間と時間がかかる。タンデム親和性精製は、細胞から multiprotein 錯体を濃縮するツールとして開発されており、内因性酵素の単離に理想的であることが判明しました。ここでは、アスペルギルス nidulansからの C-終末タップタグ RpdA の最初の精製ステップを介して、活性 RpdA 複合体の一段階濃縮のための詳細なプロトコルを提供する。精製された複合体を、次いで、デアセチラーゼアッセイを適用するその後の阻害剤スクリーニングに使用することができる。酵素活性アッセイとともにタンパク質の濃縮を2日以内に完了させることができます。
概要
ヒストンデアセチラーゼ (HDACs) は、ヒストンおよび他のタンパク質のリジン残基からアセチル基を除去することができる Zn2 +依存性加水分解酵素である。シーケンスの類似性に基づいて、HDACs はいくつかのクラス1にグループ化されます。最近、真菌クラス 1 HDAC RpdA は、パン酵母 (サッカロミセスセレビシエ) Rpd3p のオルソログであり、日和見真菌性病原体であるアスペルギルスフミガーツス2にとって必須であることが示された。したがって、RpdA は、真菌感染症2を治療する潜在的な標的として重要性を得ている。インビトロでのデアセチラーゼ活性の評価は、酵素特性の特徴付けのために重要であり、阻害剤開発のための新規物質の有効性を決定することを可能にする。コドン最適化されたヒト HDAC1 の遺伝子組み換え型の発現は、最近3回報告しているが、この宿主では全長 RpdA を発現する試みは4に失敗した。さらに、RpdA および HosA のような真菌クラス 1 HDACs は multiprotein 複合体としての機能を発揮するので、酵素阻害剤の研究には天然の内因性複合体を使用することが好ましい。しかしながら、真菌性溶解物における阻害因子および異なる HDACs の存在に起因して、タンパク質抽出全体で測定された触媒活性は比較的低く、個々の酵素に割り当てることができない。さらに、糸状菌の nidulans における以前の研究では、真菌抽出物のクロマトグラフ画分において優勢なデアセチラーゼとして、クラス 2 HDAC、HdaA が同定された。従って、複数の従来のクロマトグラフ精製ステップは、真菌株4から非 HdaA 活性を分離するために必要とされる。Nidulans5 のタンデムアフィニティー精製 (TAP) 戦略の導入により、特定のデアセチラーゼ活動の充実が大幅に緩和されました。元のタップタグは、タバコエッチウイルスプロテアーゼ (TEV) 切断部位6によって分離された2つのプロテイン A ドメインとカルモジュリン結合ペプチド (CBP) とからなる。これにより、相互作用パートナー7を含むタグ付きタンパク質のネイティブな精製および溶出が可能になる。活性アッセイのために富化タンパク質を使用する場合、プロテアーゼ切断による天然条件下での軽度の溶出は、TAP タグ精製の重要な特徴である。例えば、GFP タグ付きタンパク質は、固定化された抗体によっても濃縮することができますが、天然の条件下で溶出することはできません。
ここでは、その後の阻害剤スクリーニングのために nidulans (IgG 分離と TEV 切断) からの C-終末タップタグ付き RpdA の最初の精製ステップを介して、アクティブ RpdA 複合体の一段階濃縮のための詳細なプロトコルを提供しますヒストンデアセチラーゼアッセイ。十分であることが証明されたように、親和性エンリッチメントは、IgG 精製単独と比較した場合の2段階タップ精製後にも酵素活性が有意に減少したことからも1つの精製ステップだけに限定した。
それにもかかわらず、導入されたプロトコルは、acetyltransferases、メチルトランスフェラーゼ、および demethylases などのクロマチン調節に関与する他のタグ付き酵素の濃縮にも適用可能であるべきである。TAP プロトコルの第2の精製ステップを付加することによって、タグ付けされた餌と共精製されたタンパク質は、(新規) 酵素複合体の複合パートナーとみなすことができる。
プロトコル
1. nidulansの栽培
- 接種準備
注: インキュベーションから離れたすべてのステップは、層流キャビネットの下で実行する必要があります。- (例: tib 32.12)、グリセロールストック (-80 ° c) からグルコース/キシロースの最小培地 (1 リットル当たりの GXMM) へのひずみ (1 リッターあたり、10.0 g のグルコース、0.5 g のキシロース、20ml の1ml の溶液、20 ml の50×塩溶液 (リットル当たり 26.0 g)KCl, 26.0 g MgSO4 ·7 H2O, 76.0 g KH2PO4, 1 mL のクロロホルム], 1 ml の1000× Hutner の微量元素8) 1.5%(w/v) 寒天およびトッドet al. 20079によって記述されている必要なサプリメントを含む。37° c で 2 ~ 3 日間インキュベートします。
注: TIB 32.1 は、キシロース誘導性プロモーター、 xylP(p)10によって制御されるrpdA:: TAP fusion を含んでいます。これが、キシロースが上記のレシピに含まれている理由です。XylP(p) 制御下にないコンストラクトを発現する菌株を増殖させる場合にはキシロースを省略する。 - 滅菌 conidial 懸濁液 (CSS; 0.9%(w/v) NaCl、0.01% (v/v) ポリソルベート 80) の無菌 1.5 ml 遠心1.5 チューブを準備してください。
- CSS で使い捨て接種ループを濡らし、ステップ1.1.1 から分生子をプレートから削り出し、ステップ1.1.2 からチューブに懸濁させる。
- 150μ l をそれぞれ conidial 懸濁液を含む GXMM 寒天を含有するベントキャップを 10 25 cm2 の細胞培養フラスコに移し、その中には CSS のサプリメントおよび200μ l を転写する。
- 無菌接種ループを使用して conidial 懸濁液をフラスコ内に広げ、37° c で 2 ~ 3 日間フラスコをインキュベートします。
- 分生子を収穫するには、フラスコあたり 10 mL の CSS を使用してください。溶液をフラスコに注ぎ、付属のスクリューキャップでフラスコをしっかりと閉じ、フラスコを激しく振ってください。
- 真菌表面を湿潤させると、残留した分生子を無菌の接種ループで完全に掻き取る。
- 40μ m の細胞こし器を通して生殖不能の 50 mL の遠心管の上に置き、1つの管の5つのフラスコの懸濁液を集めなさい。
- チューブを1000× gで10分間遠心します。
- 上清をデカントし、チューブあたり 10 mL の CSS でペレットを再懸濁します。
- 1つのチューブで両方の懸濁液を収集し、40 mL の CSS で空のチューブをすすぎ、懸濁液に追加し、ステップ1.1.9 で説明したように遠心分離します。
- 上清をデカントし、CSS の 4 mL で conidial ペレットを再懸濁します。
- Conidial 懸濁液の2つの連続1:50 希釈液を調製し、得られた 1: 2, 500-希釈懸濁物中の分生子の数を11記載の計数室とともに決定する。
- (例: tib 32.12)、グリセロールストック (-80 ° c) からグルコース/キシロースの最小培地 (1 リットル当たりの GXMM) へのひずみ (1 リッターあたり、10.0 g のグルコース、0.5 g のキシロース、20ml の1ml の溶液、20 ml の50×塩溶液 (リットル当たり 26.0 g)KCl, 26.0 g MgSO4 ·7 H2O, 76.0 g KH2PO4, 1 mL のクロロホルム], 1 ml の1000× Hutner の微量元素8) 1.5%(w/v) 寒天およびトッドet al. 20079によって記述されている必要なサプリメントを含む。37° c で 2 ~ 3 日間インキュベートします。
- 菌糸体の成長と収穫
- 層流キャビネットの下で作業しながら、それぞれ5×106分生子/ml の濃度で適切なサプリメントを含む GXMM の 250 mL を含む 4-6 1 リットルの円錐フラスコを接種し、37° c で 14-16 h で180インキュベートします。
- チーズクロスをフラスコの上の漏斗に置き、布を通して菌糸体をろ過します。脱イオン水で簡単に洗ってください。
- 最初の手とペーパータオルの間にチーズクロスに閉じ込められた菌糸体を絞ることによって、できるだけ多くの水分を除去します。
- 乾燥した菌糸体を平らなシートとして、ネジ蓋とフラッシュ凍結を液体窒素でプラスチックビーカーに移します。これは次の凍結乾燥プロセスのための高い面積/容積の比率を保障する。
- 冷凍菌糸体は、凍結乾燥の前に-80 ° c で保管してください。
注: プロトコルはここで一時停止することができます。 - 菌糸体を一晩 Lyophilize。
- 菌糸体の温度が一定 (18 – 24 h) のままである場合、凍結乾燥プロセスを停止します。ビーカーを取り外し、直ちに付属のスクリューキャップで密封します。
注: 堅く密封されたとき、凍結乾燥した菌糸体は RT で数週間貯えることができる。
2. タップタグが付いた HDAC のシングルステップエンリッチメント (ラムet al. 2012 から適合)12
- バッファーとソリューションの準備
注: 使用する前に直接バッファーに 2-メルカプトエタノール (EtSH) およびプロテアーゼ阻害剤を追加してください。0.22 μ m ニトロセルロース膜のクロマトグラフィーに使用されるすべてのバッファーを濾過して、クロマトグラフィー樹脂への不純物/汚染の導入を回避します。以下の手順では、各バッファの 1 L の準備について説明します。バッファを4° c で保存します。- 抽出バッファー (B250): 250 mM NaCl、100 mM トリス-HCl pH 7.5 (RT)、0.1%(v/v) TX-100、5 mM EtSH。
- 12.35 g のトリス-HCl、2.62 g のトリス (遊離塩基)、および 13.2 g の NaCl を脱イオン水の 800 mL とし、10 mL の 10%(v/v) TX-100 溶液を加えます。
- RT で pH をチェックし、必要に応じて、NaOH または HCl [5 M] で pH 7.5 に調整します。
- 1 L まで作り、0.22 μ m のニトロセルロース膜を通してろ過する。
- 使用する前に、100 mL のバッファー (5 mM の最終濃度) に35μ l の EtSH を加えます。
- 洗浄緩衝液 250 (WB250): 250 mM NaCl、40 mM トリス-HCl pH 8.0 (RT)、0.1%(v/v) TX-100、5 mM EtSH。
- B250 (2.1.1) について説明したように WB250 を準備しますが、3.59 g のトリス・ HCl、2.08 g のトリス (フリーベース) を使用してください。
- 洗浄緩衝液 150 (WB150): 150 mM NaCl、40 mM トリス-HCl pH 8.0 (RT)、0.1%(v/v) TX-100、5 mM EtSH。
- B250 (2.1.1) について説明したように WB150 を調製しますが、3.59 g のトリス-HCl、2.08 g のトリス (遊離塩基)、および NaCl の 8.77 g を用いた。
- TEV 平衡バッファー (TEB): 150 mM NaCl、40 mM トリス-HCl pH 8.0 (RT)、0.5 mM EDTA、0.1%(v/v) TX-100、5 mM EtSH。
- WB150 と同じですが、0.5 mM の最終濃度に EDTA を追加します。
- TEV 切断バッファー (TCB): 150 mM NaCl、40 mM トリス-HCl pH 8.0 (RT)、0.5 mM EDTA、0.1%(v/v) TX-100、10%(v/v) グリセロール、5 mM EtSH。
- ステップ2.1.1 で説明されているように、3.59 g のトリス HCl、2.08 g のトリス (遊離塩基)、8.77 g の NaCl を使用し、容積を 1 L に調整する前にグリセロールを 100 mL 追加します。
- 50×プロテアーゼ阻害剤カクテル: 水 1 mL でのプロテアーゼ阻害剤の市販カクテル1錠を溶解し、-20 ° c で保存します。
- TBS-T:50 mM トリス-HCl pH 7.6 (RT), 0.9%(w/v) NaCl, 0.1% (v/v) ポリソルベート 20.
- 手順2.1.1 で説明したように準備します。6.06 g のトリス-HCl、1.40 g のトリス (遊離塩基)、NaCl の 9 g、およびポリソルベート20の1Ml を使用してください。
- 5× LSB (Laemmli サンプルバッファ): 315 mM トリス HCl pH 6.8 (RT)、25%(v/v) EtSH、50%(v/v) グリセロール、10%(w/v) SDS、0.05% (w/v) ブロモフェノールブルー。
- 抽出バッファー (B250): 250 mM NaCl、100 mM トリス-HCl pH 7.5 (RT)、0.1%(v/v) TX-100、5 mM EtSH。
- タンパク質抽出物の調製
- 1.5 g の凍結乾燥した菌糸体と粉砕ボールをボールミルの研削瓶に加える。
注: フレッシュ菌糸体を使用することもできます。これを行うときは、凍結する前にできるだけ徹底的に菌糸体を乾燥させ、新鮮な菌糸体を研削するために液体窒素で粉砕瓶を precool ことを確認してください。 - 菌糸体を 25 Hz で30秒間粉砕します。
注: 研削機が使用できない場合は、ラムet al.に記載されているように、モルタルと乳棒を使用して菌糸体を粉末に粉砕します。12です。 - 菌糸粉末を 15 mL の遠心管に移します。
- 地下菌糸体を含む遠心管を傾けて、バッファーとの菌糸体の混合を可能にする。
- 菌糸粉末1グラム当たりの B250 を含む氷冷の混合物 6 mL を加え、粗抽出物の完全な均質化が達成されるまで小さなスパチュラでブレンドする。新鮮な菌糸体を使用する場合は、ラムet alを参照してください。12は、抽出バッファー比に適切なバイオマスを達成する。
- チューブを氷上に5分間保管してください。
- チューブとバランスチューブを遠心分離機に入れ、4° c で20分以上4万× gで回転させる。遠心分離の際に IgG 樹脂 (ステップ 2.3) の平衡を行う。
- 遠心分離後、SDS − PAGE 分析のために10μ l の上清を除去する。40μ l の水と12.5 μ l の5× LSB を含む 1.5 mL チューブにサンプルを入れます。図 1の「Ex」と称される。
- 血清中のピペットを使用して上清 (クリアされた溶解液) を慎重に取り出し、平衡化した IgG ビーズを含むカラムに移します (ステップ 2.3)、提供されたエンドキャップを使用してしっかりと閉じます。
- 1.5 g の凍結乾燥した菌糸体と粉砕ボールをボールミルの研削瓶に加える。
- IgG 樹脂の平衡化 (ステップ2.2.7 中に行われる)
- 10 mL 使い捨てクロマトグラフィーカラムと pipet 300 μ l の十分に再懸濁された IgG 樹脂 (50% スラリー) をカラムに調製します。B250 でカラムを 10 mL まで充填し、バッファーが重力によって流れるようにします。
- 1×プロテアーゼ阻害剤カクテルをはじめとする B250 を 1 mL 添加して流す。列の下部を差し込みます。
- タップタグ HDAC のバッチ精製
- 平衡化したビーズを含むクロマトグラフィーカラムおよびステップ2.2.9 からのクリアされたライセートを4° c で 10 rpm で 2 ~ 4 時間インキュベートします。
- バッチバインディングの後、キャップを外し、下部の列を開いてフロースルーを収集します。
- ステップ2.2.8 で説明されているように、SDS-PAGE 分析のサンプルを取得します。図 1の "FT" と呼ばれます。
- 10 mL の WB250 でビーズを洗ってください。まず、バッファー 1 mL を使用して、pipettor を使用してカラムキャップからトラップされたビーズを除去し、この懸濁液を1つのフラッシュに移して沈殿物の再懸濁を可能にします。その後、スタックキャップを使用して閉じて、上部に列を記入し、蠕動ポンプに接続します。流量を約 1 ~ 5 mL/min に調整します。レジンの乾燥を防ぎます。
- WB250 で4回の洗浄を合計してステップ2.4.4 を3度繰り返します。
- ステップ2.4.4 で説明されているように10ml の TEB でビーズを3回洗浄する。
- 下部にあるクロマトグラフィーカラムを閉じ、再懸濁の TCB で IgG ビーズを挿入し、50×プロテアーゼ阻害剤カクテルの 20 μl および TEV (~ 1Mg/mL の株) を加え、S219V 変異型を社内で製造しました。
- カラムをキャップし、4° c で 10 rpm で回転ミキサーにインキュベートして、タグ付き HDAC を介して結合されたタンパク質複合体を溶出します。
注: 一方、高温 (16 ~ 25 ° c) で TEV ダイジェストを行うと、反応時間が短縮されますが、タンパク質分解のリスクが高まります。 - 次の日に列を開いて、2ml の遠心管で溶出液を集めます。0.7 mL の TCB を使用して、キャップからビーズを取り出し、柱の壁をすすいでください。
- それ自体が 50 mL の遠心管の中に置かれる前のステップからの開いた2つの mL の管にコラムを置きなさい。
- このアセンブリをテーブルトップの遠心分離機に移し、300× gで2分間回転させる。これが TEV 溶出液です。
注: タンデムアフィニティー精製を実行する場合は、カルモジュリンアフィニティー・ステップの入力として TEV 溶出液を使用してください。また、TEV 溶出液を分割し、HDAC 活性判定および第2の部分をタップ精製を完了するために1つの部分を使用することができます。 - TEV 溶出液から50μ l を取り出し、SDS-PAGE (図1および 2では「TE」と呼ぶ) の12.5 μ l を加えて、残りの溶出液を氷上に保持します。
- プロテアーゼの溶出効果を評価するには、5%(v/v) 酢酸 2 mL を添加し、RT で5分間インキュベートします。再び、最初の mL を使用して樹脂を再懸濁します。
- 酸溶出液を回収し、再度50μ l のサンプルをとり、12.5 μ l の5× LSB (図 1の「AE」と称する) を加える。酸性溶液に添加すると、LSB は黄色に変わります。酸を中和するには、10 M NaOH を1μ l のステップで加え、色が再び青色に変わるまでよく混ぜる。
- 酸を中和するために平衡化で IgG 樹脂を再合成します。この樹脂を TBS-T/20%(v/v) エタノールで4° c で保存し、同じタグ付きタンパク質で再利用します。
- 溶出画分の保存
- アリコートは、複数の凍結融解サイクルを回避するために、溶出液を〜100μ l 分画に分解する。
- 液体窒素でアリコートを凍結し、-80 ° c で維持してください。
注: この方法で保存されたサンプルは、酵素活性を失うことなく、数ヶ月間安定しています。
3. SDS-PAGE およびウェスタンブロッティングによる精製分析
- SDS-ポリアクリルアミドゲルの鋳造またはプレキャストゲル13の使用には、標準のプロトコルを使用します。前のセクションのゲルサンプルを95° c で5分間変性させると、≥15000× gで5分間遠心分離し、12% ゲルに負荷をかけます。推奨積載量は、図 1の凡例に記載されています。Electrophorese は、sds-PAGE ローディングバッファーのブロモフェノールブルーマーカーがゲルからの移行を開始するまでの1×トリス-グリシン SDS-ページの実行中のバッファーで、60 ~ 70 分の 180 V 定数でサンプルを使用します。
- ゲルの銀染色には標準プロトコルを使用します。たとえば、ブルーム et al のプロトコルを使用します。198714 MS 分析にも対応しています。
- ウェスタンブロッティング15には標準プロトコルを使用してください。下記の代表的な結果の生成のために、市販のブロッティングシステムが使用されました。
- 市販の抗カルモジュリン結合タンパク質 (抗 CBP) 抗体を、4° c の TBS-T で 5%(w/v) 粉乳で一晩でプローブします。
注: 抗 CBP 抗体は、TEV 切断後も依然として存在するタップタグの部分に対して向けられている。 - ブロットの検出および開発には、標準プロトコルを使用します。例えば、抗ウサギ IgG-アルカリホスファターゼコンジュゲートおよび BCIP/NBT カラー現像基質は、以下の代表的な結果の生成のために使用された。
4. インビトロ [3h] 酢酸標識されたニワトリ網状赤血球ヒストンを用いたデアセチラーゼアッセイ (Trojer et al. 2003 から適合)4
- [3h] 酢酸標識鶏肉網状赤血球ヒストンの調製については、Kölle et al. 199816のプロトコルを参照してください。
- アッセイ条件ごとに、triplicates で測定するために3つの 1.5 mL 遠心管を氷上に設置します。また、バッファ専用のバックグラウンドコントロール用に3本のチューブを用意します。
- 各チューブに25μ l の WB150 を入れ、ステップ2.4.11 から TEV 溶出液の25μ l を加えて氷上で維持する。
- チューブインキュベーターを25° c に予熱します。
- 10μ l の標識されたヒストン [1.5 mg/mL] を各チューブに添加する場合は、15 s インターバル (ストップウォッチ) を使用します。
- アッセイを開始する前に、[3h] 酢酸標識チキンヒストンの10μ l を取り、ストップウォッチを開始します。
- 開始から5秒後に、標識されたヒストンを追加し、チューブをしっかりと閉じ、渦をし、インキュベーター内に入れます。
- 標識されたヒストン10μ l の添加には15秒間隔を使用し、前のステップで説明したように進みます。
- 60分のインキュベーションの後、15秒間隔で各チューブに50μ l のストップ溶液 (1 M HCl/0.4 M 酢酸) を加えます。すぐに渦。酸性溶液を添加した後、アッセイミックスは安定しており、次のステップまで RT で保持することができます。
- 各チューブに800μ l の酢酸エチルを加えて、放出された [3h] 酢酸を抽出する。
- しっかりとチューブを閉じ、5 s のために各チューブを渦。
- チューブをマイクロ遠心に入れ、RT で10分間1万× gでスピンします。
- その間、アッセイサンプルごとに1つのシンチレーションバイアルを調製し、疎水性サンプルのためのシンチレーションカクテルを 3 mL 追加します。
- 遠心分離 (ステップ 2.12) 後、上部有機相の600μ l を慎重に調製したシンチレーションチューブに移し、チューブをしっかりと閉じます。
- 液体シンチレーションカウンターで HDAC 活性に対応する放射能を測定する。
結果
RpdA の提示された一段上の濃縮の典型的な結果は、図 1に示される (「IgG」と称される)。完全性のために、我々はまた、カルモジュリン樹脂 (「CaM」) によって第2の精製ステップを説明するフロースルーおよび溶出フラクション (「CFT」および「CE」) に記載されている12.表示された銀染色ゲル (A) は、タンデム精製を行う際にさらに増加する第1の親和性ステップの有効性を明確に示している。タンパク質抽出物およびフロースルーに存在する最も顕著なタンパク質は、しかしながら、すでに TEV 溶出液 (TE) で枯渇している。TEV 溶出画分は、抽出液とフロースルーに比べて100倍集中して > ことに注意してください。アスタリスクマークが付いて RpdA (パネルBを比較)。CBP (RpdA:: CBP) を含む RpdA の計算された MW は、82 kDa であるが、タンパク質は約 120 kDa のはるかに高い見かけの分子量で移行する。この現象は、以前に観察されており、その C 末端4,17の特定の特性に割り当てることができる。イムノブロット (B) は、TEV 溶出液 (「TE」)、カルモジュリンフロースルー (「CFT」)、および溶出液 (「CE」) フラクションにおいて、CBP タグ付き全長 RpdA (RpdA:: cbp) に対応した、約 120 kDa のところに移行する強い信号を示しています。酸溶出液 (「AE」) では、わずかに大きい MW を有する第2の信号が可視である。これは、TEV 切断によって放出されなかった IgG 樹脂に結合したタップタグ付き RpdA の割合を表す。サイズの違いは、タンパク質の 16 kDa に相当し、切断 RpdA:: TAP の繰り返し。予想通り、野生型制御画分 (パネルB、「野生型」) の抗 CBP 抗体では、バンドは検出されなかった。
特定の HDAC 阻害剤トリコスタチン (TSA) を用いた代表的なデアセチラーゼ活性アッセイの結果を図 2に表示する。このアッセイは、元々植物18に対して開発されたものであり、哺乳動物デアセチラーゼ19,20に対する阻害剤スクリーニングにも使用されている。アッセイに用いたヒストンを標識し、16記載のように調製した。濃縮された RpdA 複合体の触媒活性に対する TSA の濃度上昇の効果 (「TE ± TSA」) が示される。活動の感度は、測定された cpm 値が実際に RpdA によるものであり、非特異的プロテアーゼ活性によるものではないことを裏付けています。これは、かなり高い濃度で存在する TEV が、HDAC 活性アッセイを妨害しないことを示しているので重要な観察である。測定された HDAC 活性を RpdA に割り当てるために、野生型株をネガティブコントロール (「Co」) として使用した。予想されたように、野生型の TEV 溶出液においては、限界がある HDAC 活性 (約 5-10% の RpdA 富化分) のみが検出される。興味深いことに、HDAC 活性は、TEV 溶出液と比較した場合に第2の親和性精製工程 (「CE」) の後に有意に減少する。
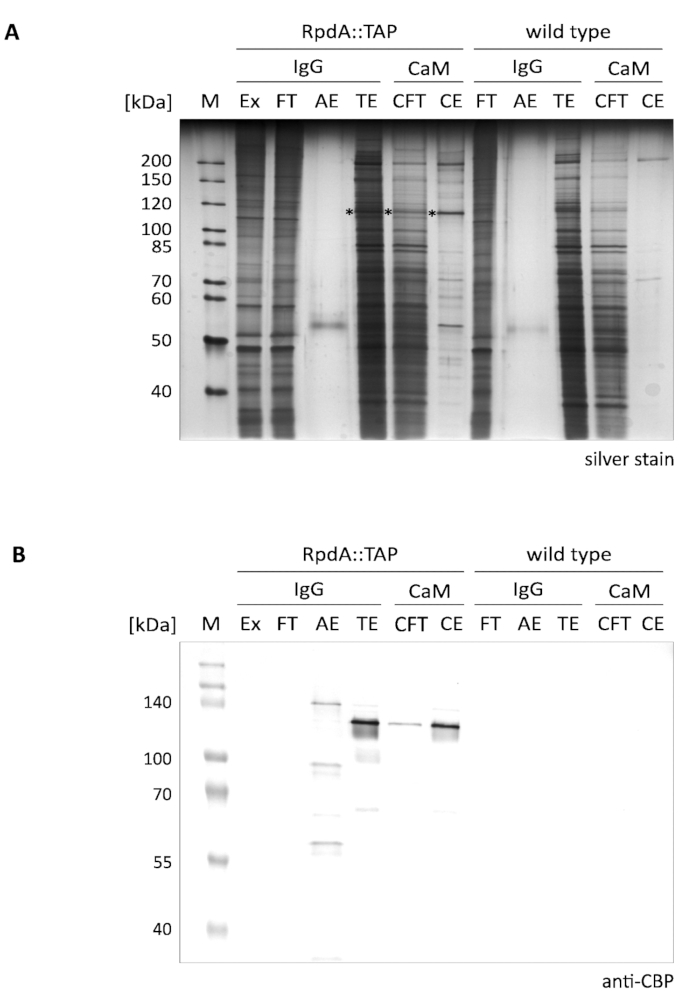
図 1.タンデムアフィニティ purificationof タップタグ付き RpdA。銀染色の 10% SDS-ポリアクリルアミドゲル (A) と、抗 CBP 抗体 (B) でプローブしたウェスタンブロットを表示しています。レーンラベリングとロードされたボリュームは次のようになります: "M": 2 μl の1:10 希釈未染色タンパク質マーカー (銀染色)、3.5 μl のスタンダードバリュータンパク質マーカー (ウェスタンブロット);「Ex」: ステップ 2.2.8 (1:10 希釈の 2 μl、5 μl) で調製したタンパク質抽出サンプル。"FT": ステップ 2.4.3 (1:10 希釈の 2 μl、5 μl) で調製した IgG 樹脂フロースルーサンプル。「AE」: ステップ2.4.14 の酸溶出液 (10 μl、10 μl);「TE」: TEV 切断による一晩溶出の TEV 溶出液、ステップ 2.4.12 (10 μl、10 μl);「CFT」: カルモジュリンフロースルー (20 μ l、20μ l);「CE」: カルモジュリン溶出液 (10 μ l、10μ l)。選択されたマーカータンパク質のサイズは、パネルの左側に示される。括弧で示された体積は、それぞれ銀染色およびウェスタンブロットのサンプル負荷量に対応しています。銀染色ゲル中のアスタリスクは、RpdA 融合タンパク質を示す。イムノブロット (B) は、BCIP/NBT カラー開発システムを用いてアルカリホスファターゼで検出された。この図の大規模なバージョンを表示するには、ここをクリックしてください。
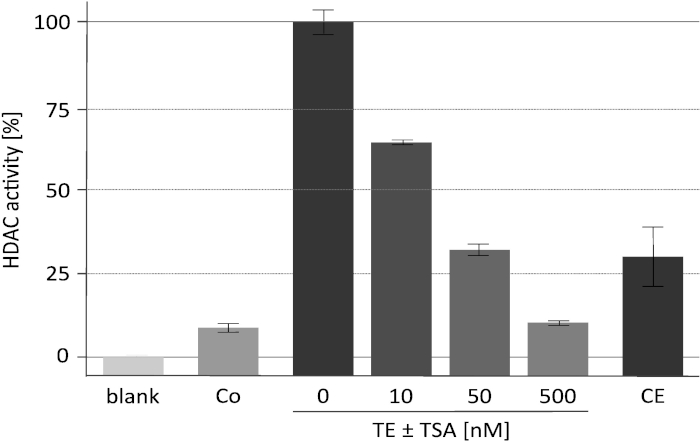
図 2.トリコスタチンの濃度の増加の下で HDAC 活性アッセイ。RpdA 阻害の効能は、親和性精製された組換え RpdA の25μ l (「TE」) と25μ l の 0, 10, 50, および 500 nM の HDAC 阻害剤を RPMI −1640培地中で希釈して試験した。RPMI を使用してバックグラウンド活動 (「ブランク」) を評価した。第1のアフィニティー精製ステップ (ネガティブ・コントロール、「Co」) の後で、2番目のカルモジュリンアフィニティー・ステップ (「CE」) およびタグなしひずみの後の最終溶出液の活動が表示されます。活動は、TSA (100%、「TE」) なしで濃縮された RpdA のパーセントとして示される。誤差バーは、3つの反復の標準偏差を示します。この図は、バウアー et al. 20162から修正されています。この図の大規模なバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、インビトロデアセチラーゼ活性の評価のためのnidulansの真菌からのタップタグ付きクラス 1 HDAC のシングルステップエンリッチメントについて説明する。TAP タグは元々、タグ付きタンパク質6のタンパク質相互作用パートナーの同定のためにパン酵母に導入されました。続いて、タグは、 nidulans5での使用のためにコドン最適化された。ここでは、クラス 1 HDAC RpdA のシングルステップエンリッチメントのためのタップ戦略の最初のアフィニティ精製ステップを適用するための、簡単なステップバイステップのプロトコルを提供します。第2の親和性精製ステップは、明確に精製のレベルを増加させ、これは特に餌相互作用タンパク質の同定にとって重要である。それにもかかわらず、最初のステップは、その後の活性試験のために推奨され、最初のステップの後に有意な汚染の欠如は、野生型株を用いた対照実験によって確かめられたからである。さらに、溶出活性は、フルタップのものと比較した場合の単一段濃縮後にはかなり高い。RpdA2に加えて、このプロトコルは、第2クラス 1 HDAC HosA21のnidulans複合体の精製にも首尾よく使用された。
真菌クラス 1 HDACs が安定した複合体4を構築するという我々の観察により、この方法の基礎を表すラムet al. 201212によってプロトコルを修正することに成功しました。それにもかかわらず、いくつかの重要な手順を言及する必要があります。高度に濃縮されたタンパク質抽出物を調製して、生理的に近い状態を確保することは、複雑な安定性にとって重要です。したがって、バイオマス/抽出バッファ比に関する所定の推奨事項を念頭におくことが重要です。この点で、適切な抽出を確実にするためによくグランドファイン菌糸粉末を使用することも重要です。ここで、研削機の使用は明らかに有利である。プロトコルセクションで述べたように、浄化をスピードアップするために、室温で 1-2 h の TEV 切断ステップを試してみる価値があります。これは、安定性に有害な影響を観察することなく RpdA のためにテストされました (未発表の観察, バウアー I, 2018).さらに、TX-100 との NP40 (元の議定書で使用される) の取り替えは他の蛋白質の複合体のために適していないかもしれない。他のタップタグ付きタンパク質の精製にこの方法を使用する場合、他のタンパク質錯体12の十分な精製に役立つ可能性のある多数の貴重なヒントが含まれているラムプロトコルも参照する必要があります。
ここに記載されている TAP-方法に加えて、他の親和性タグおよび技法は、His および GFP タグを含む糸状菌のタンパク質の単一段的な濃縮のために一般的に使用される。しかしながら、クラス 1 HDACs は一般に高分子量複合体として機能するので、天然の溶出条件は、触媒的に活性な HDACs を濃縮するための前提条件である。重要なことに、他の多くのアフィニティー精製は好ましくない条件下で実行されます。例えば、抗原抗体相互作用に基づいた GFP トラップによる HDACs の濃縮は、樹脂に結合した HDAC 複合体のタンパク質-タンパク質相互作用を妨害する酸性溶出条件のためには適していません。さらに、金属キレート親和性クロマトグラフィー22によって彼のタグ付き RpdA を浄化しようとすると、低 pH 条件の代わりにイミダゾールが溶出のために使用されたが、精製手順の間に触媒活性の著しい損失をもたらした (未発行のデータ、バウアー、I、2010)。
記載された酵素アッセイプロトコールの1つの制限は、放射性基質の使用である。しかし、蛍光ベースでのアッセイは23、24と同様に開発されており、市販されている。これらのアッセイは、ウェルプレートで行われ、したがって HDAC 阻害剤のハイスループットスクリーニングにも適している。その場合は、提示された手続きの高級感が必要になります。
このプロトコルの潜在的な今後のアプリケーションには、その特定の生理的役割および/または HDAC 阻害剤への感受性における差異を評価するためのクラス 1 HDACs の特定のサブ複合体の濃縮が含まれる。他の酵素について記載された方法を確立する場合、タグなしひずみを用いて陰性対照実験を行うことが強く推奨される。これは、測定された酵素活性の特異性を保証し、unspecifically 結合酵素による汚染を明らかにします。
ここに記載されている精製および活性アッセイは、2日以内に行うことができ、濃縮された酵素は、−80° c でアリコートに保存したときに少なくとも数ヶ月間安定である。結論として、このプロトコルは、活性測定および阻害剤有効性の決定のためのクラス 1 HDAC 複合体を達成するための比較的単純で費用対効果の高い方法を提供する。
開示事項
作者は何も開示することはありません。
謝辞
私たちは、この原稿についての彼女の助けとサポートのために、分子生物学 (Biocenter、インスブルックの医科大学) の Merschak、ペトラ・ラケイ、に感謝したいと思います。さらに、私たちは彼らの貴重なコメントのための査読者に感謝したいと思います。
この作業は、オーストリア科学基金 (P24803 から SG、P21087) によって資金提供を受け、学内 (MUI Start、ST201405031 IB) が出資しました。
資料
| Name | Company | Catalog Number | Comments |
| 10 x SDS-PAGE running buffer | Novex | ||
| 2-mercaptoethanol (EtSH) | Roth | 4227 | |
| 25 cm2 cell culture flasks with vent cap | Sarstedt | 833910002 | For spore production |
| 47 mm vacuum filtration unit | Roth | EYA7.1 | |
| AccuFLEX LSC-8000 | HITACHI | – | Scintillation counter |
| Acetic acid | Roth | 7332 | |
| Anti-Calmodulin Binding Protein Epitope Tag Antibody | Millipore | 07-482 | Used at 1:1333 dilution |
| Anti-Rabbit IgG (whole molecule)–Alkaline Phosphatase (AP) antibody | Sigma-Aldrich | A3687 | |
| Ball mill | Retsch | 207450001 | Mixer Mill MM 400 |
| BCIP/NBT | Promega | S3771 | Color development substrate for AP |
| Cell strainer | Greiner | 542040 | |
| Cheese cloth for harvesting mycelia | BioRen | H0028 | Topfentuch |
| Dimethylsulfoxid (DMSO) | Roth | 4720 | |
| EDTA | Prolabo | 20309.296 | |
| Ethyl acetate | Scharlau | Ac0155 | |
| Freeze Dryer | LABCONCO | 7400030 | FreeZone Triad |
| Glycerol | Roth | 3783 | |
| HCl | Roth | 4625 | |
| IgG resin | GE Healthcare | 17-0969-01 | IgG Sepharose 6 Fast Flow |
| Inoculation loops | VWR | 612-2498 | |
| KOH | Merck | 5033 | |
| Laminar flow cabinet | Thermo Scientific | – | Hera Safe KS |
| Mixed Cellulose Esters Membrane Filters | Millipore | GSWP04700 | |
| NaCl | Roth | 3957 | |
| NaOH | Roth | 6771 | |
| Neubauer counting chamber improved | Roth | T728 | |
| Novex gel system | Thermo Scientific | For SDS-PAGE | |
| Novex Tris-glycine SDS running buffer (10X) | Thermo Scientific | LC2675 | Running buffer for SDS-PAGE |
| peqGold protein-marker II | VWR | 27-2010P | Protein ladder used for silver stain |
| Peristaltic Pump P-1 | GE Healthcare | 18111091 | |
| Pipette controller | Brand | 26302 | accu-jet pro |
| Poly-Prep chromatography columns | Bio-Rad | 731-1550 | |
| ProSieve QuadColor protein marker | Biozym | 193837 | Prestained protein ladder used for western blot |
| Protease inhibitor cocktail tablets | Sigma-Aldrich | 11873580001 | cOmplete, EDTA-free |
| Rotary mixer | ELMI | – | Intelli-Mixer RM-2 S |
| Rotiszint eco plus | Roth | 0016 | |
| RPMI-1640 | Sigma-Aldrich | R6504 | |
| Scintillation vials | Greiner | 619080 | |
| Sorvall Lynx 4000 | Thermo Scientific | ||
| Thermomixer comfort | Eppendorf | ||
| TIB32.1 | A. nidulans rpdA::TAP strain. Genotype: alcA(p)::rpdA; veA1; argB2; yA2; pIB32::argB; ArgB+; PyrG+ | ||
| Trans-Blot Turbo RTA Midi Nitrocellulose Transfer Kit | Bio-Rad | 1704271 | |
| Trans-Blot Turbo Transfer System | Bio-Rad | 1704150 | |
| Trichostatin A (TSA) | Sigma-Aldrich | T8552 | 5 mM stock in DMSO |
| Tris (free base) | Serva | 37190 | |
| Tris-HCl | Roth | 9090 | |
| Polysorbate 20 | Roth | 9127 | Tween 20 |
| Polysorbate 80 | Sigma-Aldrich | P1754 | Tween 80 |
| TX-100 | Acros Organics | 215682500 | Triton X-100, Octoxynol-9 detergent |
参考文献
- Gregoretti, I. V., Lee, Y. -. M., Goodson, H. V. Molecular evolution of the histone deacetylase family: functional implications of phylogenetic analysis. Journal of Molecular Biology. 338 (1), 17-31 (2004).
- Bauer, I., et al. A Class 1 Histone Deacetylase with Potential as an Antifungal Target. mBio. 7 (6), (2016).
- Stefan, A., et al. Purification of active recombinant human histone deacetylase 1 (HDAC1) overexpressed in Escherichia coli. Biotechnology Letters. 40 (9-10), 1355-1363 (2018).
- Trojer, P., et al. Histone deacetylases in fungi: novel members, new facts. Nucleic Acids Research. 31 (14), 3971-3981 (2003).
- Bayram, &. #. 2. 1. 4. ;., et al. VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism. Science. 320 (5882), 1504-1506 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hill, T. W., Kafer, E. Improved protocols for Aspergillus minimal medium: trace element and minimal medium salt stock solutions. Fungal Genetics Reports. 48, (2001).
- Todd, R. B., Davis, M. A., Hynes, M. J. Genetic manipulation of Aspergillus nidulans: meiotic progeny for genetic analysis and strain construction. Nature Protocols. 2 (4), 811-821 (2007).
- Zadra, I., Abt, B., Parson, W., Haas, H. xylP promoter-based expression system and its use for antisense downregulation of the Penicillium chrysogenum nitrogen regulator NRE. Applied and Environmental Microbiology. 66 (11), 4810-4816 (2000).
- Stolz, D. J., et al. Histological Quantification to Determine Lung Fungal Burden in Experimental Aspergillosis. Journal of Visualized Experiments. (133), (2018).
- Bayram, &. #. 2. 1. 4. ;., et al. Identification of protein complexes from filamentous fungi with tandem affinity purification. Methods in Molecular Biology. 944, 191-205 (2012).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Blum, H., Beier, H., Gross, H. J. Improved silver staining of plant proteins, RNA and DNA in polyacrylamide gels. Electrophoresis. 8 (2), 93-99 (1987).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 24, 145-149 (1992).
- Kölle, D., et al. Biochemical methods for analysis of histone deacetylases. Methods. 15 (4), 323-331 (1998).
- Tribus, M., et al. A novel motif in fungal class 1 histone deacetylases is essential for growth and development of Aspergillus. Molecular Biology of the Cell. 21 (2), 345-353 (2010).
- Sendra, R., Rodrigo, I., Salvador, M. L., Franco, L. Characterization of pea histone deacetylases. Plant Molecular Biology. 11 (6), 857-866 (1988).
- Valente, S., et al. 1,3,4-Oxadiazole-containing histone deacetylase inhibitors: anticancer activities in cancer cells. Journal of Medicinal Chemistry. 57 (14), 6259-6265 (2014).
- Mai, A., et al. Synthesis and biological properties of novel, uracil-containing histone deacetylase inhibitors. Journal of Medicinal Chemistry. 49 (20), 6046-6056 (2006).
- Pidroni, A., et al. A Class 1 Histone Deacetylase as Major Regulator of Secondary Metabolite Production in Aspergillus nidulans. Frontiers in Microbiology. 9, 2212 (2018).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Wegener, D., Wirsching, F., Riester, D., Schwienhorst, A. A fluorogenic histone deacetylase assay well suited for high-throughput activity screening. Chemistry & Biology. 10 (1), 61-68 (2003).
- Peng, L., Yuan, Z., Seto, E. Histone deacetylase activity assay. Methods in Molecular Biology. 1288, 95-108 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved