Method Article
Arricchimento in un solo passaggio di un istone deacetilasi con tag TAP del fungo filamentoso Aspergillus nidulans per il saggio di attività enzimatica
In questo articolo
Riepilogo
Gli istoni di classe 1 (HDACs) come gli RpdA hanno acquisito importanza come potenziali bersagli per il trattamento delle infezioni fungine. Qui presentiamo un protocollo per l'arricchimento specifico di RpdA con tag TAP, combinato con un test di attività HDAC che consente test di efficacia in vitro degli inibitori dell'istone deacetilasi.
Abstract
Gli istoni di classe 1 (HDACs) come gli RpdA hanno acquisito importanza come potenziali bersagli per il trattamento delle infezioni fungine e per l'estrazione del genoma di metaboliti secondari fungini. Lo screening degli inibitori, tuttavia, richiede attività enzimatiche depurata. Dal momento che la classe 1 deacetilasi esercitano la loro funzione come complessi multiproteici, di solito non sono attivi quando espressi come singoli polipeptidi nei batteri. Pertanto, i complessi endogeni devono essere isolati, che, quando vengono applicate tecniche convenzionali come lo scambio ionico e la cromatografia di esclusione dimensionale, è laborioso e richiede molto tempo. La purificazione di affinità tandem è stata sviluppata come uno strumento per arricchire complessi multiproteici dalle cellule e quindi si è rivelato ideale per l'isolamento degli enzimi endogeni. Qui forniamo un protocollo dettagliato per l'arricchimento in singolo passaggio di complessi RpdA attivi attraverso il primo passo di purificazione di RpdA con tag C-Terminally da Aspergillus nidulans. I complessi purificati possono quindi essere utilizzati per il successivo screening degli inibitori applicando un saggio di deacetilasi. L'arricchimento proteico insieme al saggio di attività enzimatica può essere completato entro due giorni.
Introduzione
Gli istoni deacetilici (HDACs) sono enzimi idrolitici a base di Zn2 +in grado di rimuovere i gruppi acetile dai residui di lisina di istone e altre proteine. In base alla somiglianza di sequenza, i dischi rigidi sono raggruppati in diverse classi1. Recentemente, la classe fungina 1 HDAC RpdA, un ortogeno di lievito del panettiere (Saccharomyces cerevisiae) Rpd3p, è stato indicato per essere essenziale per il patogeno fungino opportunistico Aspergillus fumigatus2. Pertanto, RpdA ha acquisito importanza come un potenziale bersaglio per trattare le infezioni fungine2. La valutazione dell'attività della deacetilasi in vitro è importante per la caratterizzazione delle proprietà enzimatiche e consente di determinare l'efficacia di nuove sostanze per lo sviluppo di inibitori. Anche se l'espressione ricombinante di una versione ottimizzata di codone di HDAC1 umano in Escherichia coli è stato riportato di recente3, tentativi di esprimere RPDA a lunghezza intera in questo host fallito4. Inoltre, poiché gli HDAC di classe 1 fungine come RpdA e HosA esercitano la loro funzione come complessi multiproteici, è favorevole l'uso di complessi endogeni nativi per studi di inibitori enzimatici. Tuttavia, a causa dei fattori inibitori e della presenza di diversi HDAC nei lisati fungini, l'attività catalitica misurata in estratti proteici interi è relativamente bassa e non può essere assegnata a singoli enzimi. Inoltre, studi precedenti nel fungo filamentoso a. nidulans identificato una classe 2 HDAC, hdaa, come predominante deacetilasi in frazioni cromatografiche di estratti fungini. Pertanto, sono necessarie più fasi convenzionali di purificazione cromatografica per separare l'attività non HdaA dai ceppi fungini4. L'introduzione della strategia di purificazione dell'affinità tandem (TAP) in a. nidulans5 ha significativamente facilitato l'arricchimento di attività specifiche della deacetilasi. Il tag TAP originale è composto da due domini di proteina A e un peptide di legame calmodulina (CBP) separato da un sito di scissione del tabacco etch virus proteasi (TEV)6. Ciò consente la purificazione nativa e l'eluizione delle proteine etichettate, inclusi i loro partner di interazione7. Quando si utilizzano le proteine arricchite per i saggi di attività, la lieve eluizione in condizioni native da scissione della proteasi è una caratteristica importante della purificazione del tag TAP. Una proteina con tag GFP, ad esempio, può essere arricchita anche da anticorpi immobilizzati, ma non può essere eluita in condizioni native.
Qui forniamo un protocollo dettagliato per l'arricchimento in singolo passaggio di complessi RpdA attivi attraverso il primo passo di purificazione di RpdA con tag C-Terminally da a. nidulans (separazione IgG e scissione TEV) per il successivo screening degli inibitori applicando un saggio di istone deacetilasi. Come si è rivelato sufficiente, l'arricchimento dell'affinità è stato limitato a un solo passaggio di purificazione, anche perché l'attività enzimatica è stata significativamente ridotta dopo la purificazione del rubinetto in due fasi rispetto alla sola purificazione delle IgG.
Tuttavia, il protocollo introdotto dovrebbe anche essere applicabile per l'arricchimento di altri enzimi contrassegnati coinvolti nella regolamentazione della cromatina, quali acetiltransferasi, metiltransferasi e demethylases. Aggiungendo la seconda fase di purificazione del protocollo TAP, le proteine co-purificate con le esche etichettate possono essere considerate come partner complessi di (romanzo) complessi enzimatici.
Protocollo
1. coltivazione di A. nidulans
- Preparazione dell'inoculo
Nota: tutti i passaggi a parte l'incubazione devono essere eseguiti sotto un armadio a flusso laminare.- Striscia fuori ceppo TAP (ad es. TIB 32.12) dal brodo di glicerolo (-80 ° c) su glucosio/xylosa Medium minimo (gxmm; per litro: 10,0 g di glucosio, 0,5 g di Xillosa, 10 ml di soluzione di tartrato di 1 M di ammonio, 20 ml di 50 × soluzione salina [per litro: 26,0 g KCl, 26,0 g MgSO4 · 7 H2O, 76,0 g KH2po4, 1 ml di cloroformio], 1 ml di 1.000 × oligoelementi Hutner8) compreso l'agar 1,5% (w/v) e gli integratori richiesti come descritto da Todd et al. 20079. Incubare per 2 – 3 giorni a 37 ° c.
Nota: TIB 32.1 contiene una fusione RPDA:: Tap controllata da un promotore Xylose-inducible, xylp(p)10. Questo è il motivo per cui Xylose è incluso nella ricetta di cui sopra. Omettere Xylose quando crescono ceppi che esprimono costrutti che non sono sotto controllo Xylp(p). - Preparare una provetta sterile da centrifuga da 1,5 mL con 1,5 mL di soluzione sterile di sospensione conidiale (CSS; 0,9% (w/v) NaCl, 0,01% (v/v) polisorbato 80).
- Bagnare un ciclo di inoculo monouso in CSS, rasare i conidia dalla piastra dal passo 1.1.1 e sospendere nel tubo dal passo 1.1.2.
- Trasferire 150 μL di ogni sospensione conidiale a 10 25 cm2 palloni di coltura cellulare con tappo di sfiato contenente agar GXMM inclusi supplementi e 200 ΜL di CSS.
- Stendere la sospensione conidiale all'interno delle palloni utilizzando un ciclo sterile di inoculo e incubare i palloni a 37 ° c per 2 – 3 giorni.
- Per raccogliere la conidia, utilizzare 10 mL di CSS per pallone. Versare la soluzione in un pallone, chiudere saldamente il pallone con il tappo a vite fornito e scuotere vigorosamente il pallone.
- Dopo aver bagnato la superficie fungina, rasare completamente i restanti conidia con un ciclo di inoculo sterile.
- Passare conidia attraverso i filtri a cellule 40 μm posizionati su una provetta sterile da 50 mL e raccogliere la sospensione di cinque palloni in un tubo.
- Centrifugare il tubo a 1.000 × g per 10 min.
- Decant il surnatante e risospendi il pellet in 10 mL di CSS per tubo.
- Raccogliere entrambe le sospensioni in un tubo, sciacquare il tubo vuoto con 40 mL di CSS, aggiungere alla sospensione, e centrifugare come descritto nel passo 1.1.9.
- Decant il surnatante e risospendi il pellet conidiale in 4 mL di CSS.
- Preparare due diluizioni seriali 1:50 della sospensione conidiale e determinare il numero di conidia nella risultante sospensione diluita 1:2, 500 con una camera di conteggio come descritto11.
- Striscia fuori ceppo TAP (ad es. TIB 32.12) dal brodo di glicerolo (-80 ° c) su glucosio/xylosa Medium minimo (gxmm; per litro: 10,0 g di glucosio, 0,5 g di Xillosa, 10 ml di soluzione di tartrato di 1 M di ammonio, 20 ml di 50 × soluzione salina [per litro: 26,0 g KCl, 26,0 g MgSO4 · 7 H2O, 76,0 g KH2po4, 1 ml di cloroformio], 1 ml di 1.000 × oligoelementi Hutner8) compreso l'agar 1,5% (w/v) e gli integratori richiesti come descritto da Todd et al. 20079. Incubare per 2 – 3 giorni a 37 ° c.
- Crescita e raccolta di miceli
- Mentre si lavora sotto un armadio a flusso laminare, inoculare 4 – 6 palloni conici da un litro ciascuno contenente 250 mL di GXMM compresi i supplementi appropriati ad una densità di 5 × 106 conidia/ml e incubare a 180 rpm a 37 ° c per 14 – 16 h.
- Mettere il panno di formaggio in un imbuto sulla sommità di un pallone e filtrare il micelio attraverso il panno. Lavare brevemente con acqua deionizzata.
- Rimuovere quanta più umidità possibile, spremendo il micelio intrappolato nel panno di formaggio tra prima le mani e poi gli asciugamani di carta.
- Trasferire il micelio essiccato come fogli piatti a un bicchiere di plastica con un coperchio a vite e un blocco del flash con azoto liquido. Questo assicura un elevato rapporto area/volume per il seguente processo di liofilizzazione.
- Conservare la micelio congelata a-80 ° c prima della liofilizzazione.
Nota: il protocollo può essere messo in pausa qui. - Lyophilize il Miceli durante la notte.
- Arrestare il processo di liofilizzazione quando la temperatura di micelio rimane costante (18 – 24 h). Rimuovere i becher e sigillare immediatamente con i tappi a vite forniti.
Nota: quando è ermeticamente sigillato, Miceli liofilizzata può essere conservato per diverse settimane a RT.
2. arricchimento in un solo passaggio di HDAC con tag TAP (adattato da Bayram et al. 2012)12
- Preparazione di tamponi e soluzioni
Nota: aggiungere 2-mercaptoetanolo (EtSH) e inibitori della proteasi ai buffer direttamente prima dell'uso. Filtrare tutti i tamponi utilizzati per la cromatografia attraverso membrane di nitrocellulosa 0,22 μm per evitare l'introduzione di impurità/contaminazioni alla resina cromatografica. Le istruzioni nei passaggi seguenti si riferiscono alla preparazione di 1 L di ogni tampone. Conservare i tamponi a 4 ° c.- Tampone di estrazione (B250): 250 mM NaCl, 100 mM Tris-HCl pH 7,5 (RT), 0,1% (v/v) TX-100, 5 mM EtSH.
- Sciogliere 12,35 g di Tris-HCl, 2,62 g di tris (base libera) e 13,2 g di NaCl in 800 mL di acqua deionizzata e aggiungere 10 mL di una soluzione TX-100 al 10% (v/v).
- Controllare il pH a RT e regolare a pH 7,5 con NaOH o HCl [5 M], se necessario.
- Fare fino a 1 L e filtrare attraverso una membrana di nitrocellulosa 0,22 μm.
- Aggiungere 35 μL di EtSH per 100 mL di tampone (concentrazione finale di 5 mM) direttamente prima dell'uso.
- Tampone di lavaggio 250 (WB250): 250 mM NaCl, 40 mM Tris-HCl pH 8,0 (RT), 0,1% (v/v) TX-100, 5 mM EtSH.
- Preparare WB250 come descritto per B250 (2.1.1) ma con 3,59 g di Tris-HCl e 2,08 g di tris (base libera).
- Tampone di lavaggio 150 (WB150): 150 mM NaCl, 40 mM Tris-HCl pH 8,0 (RT), 0,1% (v/v) TX-100, 5 mM EtSH.
- Preparare WB150 come descritto per B250 (2.1.1) ma con 3,59 g di Tris-HCl, 2,08 g di tris (base libera) e 8,77 g di NaCl.
- Tampone di equilibratura TEV (TEB): 150 mM NaCl, 40 mM Tris-HCl pH 8,0 (RT), 0,5 mM EDTA, 0,1% (v/v) TX-100, 5 mM EtSH.
- Come WB150 ma aggiungere EDTA a 0,5 mM di concentrazione finale.
- TEV tampone di scissione (TCB): 150 mM NaCl, 40 mM Tris-HCl pH 8,0 (RT), 0,5 mM EDTA, 0,1% (v/v) TX-100, 10% (v/v) glicerolo, 5 mM EtSH.
- Prepararsi come descritto al punto 2.1.1 con 3,59 g di Tris-HCl, 2,08 g di tris (base libera) e 8,77 g di NaCl e aggiungere 100 mL di glicerolo prima di regolare il volume a 1 L.
- 50 di un cocktail di inibitore della proteasi: sciogliere 1 compressa di un cocktail di inibitori della proteasi disponibili in commercio in 1 mL di acqua e conservare a-20 ° c.
- TBS-T: 50 mM Tris-HCl pH 7,6 (RT), 0,9% (p/v) NaCl, 0,1% (v/v) polisorbato 20.
- Prepararsi come descritto al punto 2.1.1. Usare 6,06 g di Tris-HCl, 1,40 g di tris (base libera), 9 g di NaCl e 1 mL di polisorbato 20.
- 5 × LSB (tampone di campionamento Laemmli): 315 mm Tris-HCl pH 6,8 (RT), 25% (v/v) ETSH, 50% (v/v) glicerolo, 10% (w/v) SDS, 0,05% (p/v) blu bromofenolo Blue.
- Tampone di estrazione (B250): 250 mM NaCl, 100 mM Tris-HCl pH 7,5 (RT), 0,1% (v/v) TX-100, 5 mM EtSH.
- Preparazione dell'estratto proteico
- Aggiungere 1,5 g di micelio liofilizzato e una pallina di macinazione nel barattolo di macinazione di un mulino a sfere.
Nota: Miceli fresco potrebbe essere utilizzato pure. Quando si fa così, asciugare il Miceli il più accuratamente possibile prima di congelare e assicurarsi di preraffreddare i vasi di macinazione in azoto liquido per macinazione Miceli fresca. - Macinare Miceli in polvere a 25 Hz per 30 s.
Nota: nei casi in cui non è disponibile alcuna rettificatrice, macinare Miceli a una polvere utilizzando un mortaio e pestello, come descritto da Bayram et al. 12. per la - Trasferire la polvere myceliale in una provetta da centrifuga da 15 mL.
- Inclinare il tubo della centrifuga, compreso il micelio macinato, per consentire la successiva miscelazione di micelio con tampone.
- Aggiungere 6 mL di ghiaccio-freddo B250 compreso 1 × cocktail inibitore della proteasi per grammo di polvere micelio e frullare con una piccola spatola fino a completa omogeneizzazione dell'estratto grezzo è raggiunto. Quando usi Mycelia fresche, fai riferimento a Bayram et al. 12 per ottenere il giusto rapporto tra biomassa e tampone di estrazione.
- Tenere il tubo sul ghiaccio per 5 min.
- Posizionare il tubo e il tubo di bilanciamento in una centrifuga e girare a 40.000 × g per ≥ 20 min a 4 ° c. Eseguire l'equilibratura della resina IgG (fase 2,3) durante la centrifugazione.
- Dopo la centrifugazione, rimuovere 10 μL del supernatante per l'analisi SDS-PAGE. Collocare il campione in un tubo da 1,5 mL contenente 40 μL di acqua e 12,5 μL di 5 × LSB; indicato come "ex" nella Figura 1.
- Rimuovere con cautela il surnatante (liofilato) utilizzando una pipetta sierologica e trasferirlo sulla colonna contenente le perline di IgG equilibriate (fase 2.3) e chiudere strettamente utilizzando il tappo di chiusura fornito.
- Aggiungere 1,5 g di micelio liofilizzato e una pallina di macinazione nel barattolo di macinazione di un mulino a sfere.
- Equilibrazione di resina IgG (eseguita durante la fase 2.2.7)
- Preparare una colonna di cromatografia monouso da 10 mL e Pipet 300 μL di resina IgG ben risospesa (50% di liquami) nella colonna. Riempire la colonna a 10 mL con B250 e lasciare che il buffer scorre attraverso per gravità.
- Aggiungere 1 mL di B250 compreso 1 × cocktail inibitore della proteasi e lasciare scorrere attraverso. Inserire la parte inferiore della colonna.
- Purificazione batch di HDAC con tag TAP
- Incubare la colonna cromatografica contenente le perle equilibriate e il lisato eliminato da Step 2.2.9 su un mixer rotativo a 10 rpm a 4 ° c per 2 – 4 h.
- Dopo l'associazione batch, rimuovere il tappo e aprire la colonna in basso per raccogliere il flusso.
- Prendere un campione per l'analisi SDS-PAGE come descritto nel passaggio 2.2.8; denominata "FT" nella Figura 1.
- Lavare le perle con 10 mL di WB250. In primo luogo, utilizzare 1 mL di tampone per rimuovere le perle intrappolate dal tappo della colonna utilizzando un pipettaggio e trasferire questa sospensione in un filo sulla resina regolata per consentire la risospensione delle perle. Quindi riempire la colonna in alto, chiudere utilizzando un tappo dello stack e connettersi a una pompa peristaltica. Regolare una portata di circa 1 – 5 mL/min. evitare che la resina si asciughi.
- Ripetere il passaggio 2.4.4 tre volte per un totale di quattro Lavini con WB250.
- Lavare le perle tre volte con 10 mL di TEB come descritto al punto 2.4.4.
- Chiudere la colonna cromatografica nella parte inferiore, risospendere le perle IgG in 1 mL di TCB e aggiungere 20 μL di 50 × cocktail di inibitore della proteasi e 10 ΜL di TEV (~ 1 mg/ml di brodo, S219V variante mutante prodotta internamente).
- Tappare la colonna e incubare su un mixer rotativo a 10 rpm a 4 ° c durante la notte per eluire i complessi proteici legati tramite l'HDAC taggato.
Nota: in alternativa, eseguire il digest TEV a temperatura elevata (16 – 25 ° c), che riduce il tempo di reazione, tuttavia, sta aumentando il rischio di degradazione delle proteine. - Il giorno successivo aprire la colonna e raccogliere l'eluato in una provetta da centrifuga da 2 mL. Utilizzare 0,7 mL di TCB per rimuovere le perle dal tappo e sciacquare la parete della colonna.
- Collocare la colonna sul tubo aperto da 2 mL dal passaggio precedente che si trova all'interno di una provetta da centrifuga da 50 mL.
- Trasferire questo assemblaggio in una centrifuga da tavolo e girare a 300 × g per 2 min. Questo è il TEV eluato.
Nota: quando si esegue la purificazione di affinità tandem, utilizzare l'eluato TEV come input per la fase di affinità di calmodulina. È anche possibile dividere l'eluato TEV e utilizzare una parte per la determinazione dell'attività HDAC e la seconda parte per completare la purificazione TAP. - Rimuovere 50 μL dal TEV eluato e aggiungere 12,5 μL di 5 × LSB per SDS-PAGE (indicato come "TE" nelle figure 1 e 2) e mantenere l'eluato rimanente sul ghiaccio.
- Per valutare l'efficacia dell'eluizione della proteasi, aggiungere 2 mL di acido acetico al 5% (v/v) e incubare a RT per 5 min. Ancora una volta, utilizzare il primo mL per risospendere la resina.
- Raccogliere l'eluato acido e di nuovo prendere 50 μL di campione e aggiungere 12,5 μL di 5 × LSB (indicato come "AE" in Figura 1). LSB diventerà giallo quando aggiunto alla soluzione acida. Per neutralizzare l'acido, aggiungere 10 M di NaOH in incrementi di 1 μL e mescolare bene fino a quando il colore diventa di nuovo blu.
- Riequilibrare la resina IgG con TBS-T per neutralizzare l'acido. Conservare la resina in TBS-T/20% (v/v) etanolo a 4 ° c per il riutilizzo con la stessa proteina contrassegnata.
- Conservazione delle frazioni di eluizione
- Aliquota l'eluato in ~ 100 μL frazioni, per evitare più cicli di congelamento-scongelamento.
- Congelare le aliquote in azoto liquido e mantenere a-80 ° c.
Nota: i campioni immagazzinati in questo modo saranno stabili per mesi senza perdere l'attività enzimatica.
3. analisi della purificazione tramite SDS-PAGE e Western blotting
- Utilizzare protocolli standard per la colata di gel di SDS-Polyacrylamide o utilizzare gel prefabbricati13. Denaturare campioni di gel dalla sezione precedente a 95 ° c per 5 min, centrifugare a ≥ 15.000 × g per 5 min, e caricare su 12% gel. I volumi di caricamento consigliati sono indicati nella legenda della Figura 1. Electrophorese i campioni in 1 × tris-Glycine SDS-page in esecuzione buffer a 180 V costante per 60 – 70 min, fino a quando il marcatore blu di blu bromofenolo del buffer di caricamento SDS-PAGE inizia a migrare fuori dal gel.
- Utilizzare protocolli standard per la colorazione argentata dei gel. Ad esempio, utilizzare il protocollo di Blum et al. 1987 e14 che è anche compatibile con l'analisi di MS.
- Utilizzare protocolli standard per Western blotting15. Per la generazione dei risultati rappresentativi di seguito è stato utilizzato un sistema di blotting disponibile in commercio.
- Blot di sonda con anticorpo di proteina legante anti-calmodulina (anti-CBP) disponibile in commercio nel 5% (p/v) di latte in polvere in TBS-T a 4 ° c durante la notte.
Nota: l'anticorpo anti-CBP è diretto contro la parte del tag TAP ancora presente dopo la scissione di TEV. - Utilizzare protocolli standard per il rilevamento e lo sviluppo di blots. Per la generazione dei risultati rappresentativi di seguito sono stati utilizzati, ad esempio, il coniugato anti-coniglio IgG-alcalino-fosfatasi e un substrato di sviluppo del colore BCIP/NBT.
4. saggio di deacetilasi in vitro [3H] istoni di reticulociti di pollo etichettati con acetato (adattato da Trojer et al. 2003)4
- Fare riferimento al protocollo di Kölle et al. 199816 per la preparazione di [3H] istoni di reticulociti di pollo etichettati con acetato.
- Per ogni condizione di saggio posizionare tre provette centrifughe da 1,5 mL su ghiaccio per misurazioni in triplicati. Preparare anche tre tubi per il controllo di sfondo solo buffer.
- Mettere 25 μL di WB150 in ogni tubo e aggiungere 25 μL di TEV eluato dal passo 2.4.11 e mantenere il ghiaccio.
- Preriscaldare un incubatore di tubi a 25 ° c.
- Utilizzare intervalli di 15 s (orologio di arresto) per l'aggiunta di 10 μL di istoni etichettati [1,5 mg/mL] a ciascun tubo.
- Prima di iniziare il saggio, assumere 10 μL degli istoni di pollo etichettati con acetato [3H] e avviare l'orologio di arresto.
- Cinque secondi dopo l'inizio, aggiungere gli istoni etichettati, chiudere il tubo saldamente, vortice, e metterlo nell'incubatrice.
- Utilizzare intervalli di 15 s per l'aggiunta di 10 μL di istoni etichettati e procedere come descritto nel passaggio precedente.
- Dopo 60 min incubazione aggiungere 50 μL di soluzione di arresto (1 M HCl/0,4 M di acido acetico) a ciascun tubo in intervalli di 15 s; immediatamente il vortice. Dopo l'aggiunta della soluzione acida, la miscela di dosaggio è stabile e può essere mantenuta a RT fino al passaggio successivo.
- Aggiungere 800 μL di acetato di etile a ciascun tubo per estrarre l'acido acetico rilasciato [3H].
- Chiudere ermeticamente i tubi e agitare ogni tubo per 5 s.
- Mettere il tubo in una microcentrifuga e girare a 10.000 × g per 10 minuti a RT.
- Nel frattempo, prepara un flaconcino di scintillazione per campione di saggio e Aggiungi 3 mL di cocktail a scintillazione per campioni idrofobici.
- Dopo la centrifugazione (fase 2,12), trasferire accuratamente 600 μL della fase organica superiore ai tubi di scintillazione preparati e chiudere saldamente i tubi.
- Misurare la radioattività corrispondente all'attività dell'HDAC in un contatore liquido a scintillazione.
Risultati
Un risultato tipico dell'arricchimento di RpdA presentato in un singolo passaggio è mostrato nella Figura 1 (denominata "IgG"). Per completezza, abbiamo anche incluso frazioni di flusso e di eluizione ("CFT" e "CE") che illustrano la seconda fase di purificazione da una resina calmodulina ("CaM") come descritto12. Il gel macchiato d'argento visualizzato (A) illustra chiaramente l'efficacia del primo passo di affinità che è ancora ulteriormente aumentato quando si esegue la purificazione tandem. Le proteine più prominenti presenti nell'estratto proteico e nel flusso passante, tuttavia, sono già esaurite nell'eluato TEV (TE). È importante notare che le frazioni di eluizione del TEV sono > 100 × concentrate rispetto all'estratto e al flusso passante. Gli asterischi contrassegnare RpdA contrassegnati (confrontare il pannello B). La MW calcolata di RpdA compreso il CBP (RpdA:: CBP) è 82 kDa, tuttavia, la proteina migra ad un peso molecolare apparente molto più alto di circa 120 kDa. Questo fenomeno è stato osservato in precedenza e può essere assegnato alle proprietà specifiche del suo C-Terminus4,17. L'immunoblot (B) mostra segnali forti che migrano a circa 120 kDa corrispondenti a RPDA a lunghezza intera con tag CBP (RPDA:: CBP) nell'eluato TEV ("te"), nelle frazioni di calmodulina Flow-through ("CFT") e eluato ("CE"). Nell'eluato acido ("AE") è visibile un secondo segnale con una MW leggermente più grande. Questo rappresenta la proporzione di RpdA con tag TAP legato alla resina IgG che non è stato rilasciato dalla scissione TEV. La differenza di dimensione corrisponde a 16 kDa della proteina una ripetizione di RpdA uncleaved:: TAP. Come previsto, nessuna banda potrebbe essere rilevata dall'anticorpo anti-CBP nelle frazioni di controllo Wild-Type (pannello B, "tipo selvaggio").
I risultati di un saggio di attività rappresentativa della deacetilasi con lo specifico inibitore dell'HDAC tricostatina A (TSA) sono mostrati nella Figura 2. Questo saggio è stato originariamente sviluppato per le piante18 ed è stato utilizzato anche per lo screening degli inibitori contro i deacetioplasmi dei mammiferi19,20. Gli istoni utilizzati per il saggio sono stati etichettati e preparati come descritto16. Viene mostrato l'effetto di aumentare le concentrazioni di TSA sull'attività catalitica del complesso RpdA arricchito ("TE ± TSA"). La sensibilità dell'attività conferma che i valori di CPM misurati sono effettivamente dovuti a RpdA e non causati da attività proteasi non specifica. Si tratta di un'osservazione importante in quanto indica che TEV, che è presente ad una concentrazione piuttosto elevata, non interferisce con il test di attività HDAC. Al fine di assegnare l'attività HDAC misurata a RpdA, è stato utilizzato un ceppo Wild-Type come controllo negativo ("co"). Come previsto, nell'eluato TEV del tipo selvaggio è stata rilevata solo l'attività marginale dell'HDAC (circa 5-10% delle frazioni arricchite da RpdA). È interessante notare che, l'attività HDAC è significativamente ridotta dopo la seconda fase di purificazione di affinità ("CE") rispetto al TEV eluato.
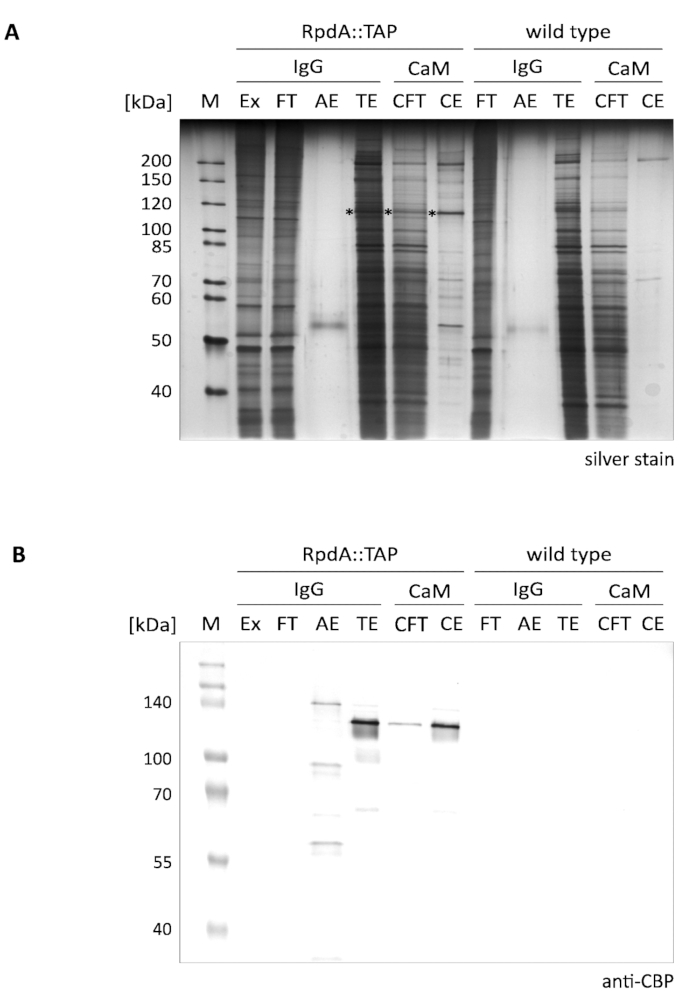
Figura 1. Purificazione tandem affinità di RpdA con tag TAP. Vengono visualizzati un gel 10% SDS-Polyacrylamide (A) e un Western blot con l'anticorpo anti-CBP (B) macchiato d'argento. Le etichette di corsia e i volumi caricati sono i seguenti: "M": 2 μl di 1:10 marcatore proteico non macchiato diluito (macchia d'argento), 3,5 μl di marcatore proteico precolorato (Western blot); "Ex": campione di estratto proteico preparato in fase 2.2.8 (2 μl di diluizione 1:10, 5 μl); "FT": campione di flusso di resina IgG come preparato al punto 2.4.3 (2 μl di diluizione 1:10, 5 μl); "AE": eluato acido del passo 2.4.14 (10 μl, 10 μl); "TE": TEV eluato di eluzione durante la notte da scissione TEV, passo 2.4.12 (10 μl, 10 μl); "CFT": flusso di calmodulina (20 μL, 20 μL); "CE": eluato di calmodulina (10 μL, 10 μL). La dimensione delle proteine marker selezionate è indicata sul lato sinistro dei pannelli. I volumi indicati in parentesi corrispondono rispettivamente ai caricamenti campione per macchia d'argento e Western blot. Gli asterischi nel gel macchiato d'argento indicano la proteina di fusione RpdA. L'immunoblot (B) è stato rilevato con fosfatasi alcalina utilizzando il sistema di sviluppo del colore BCIP/NBT. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
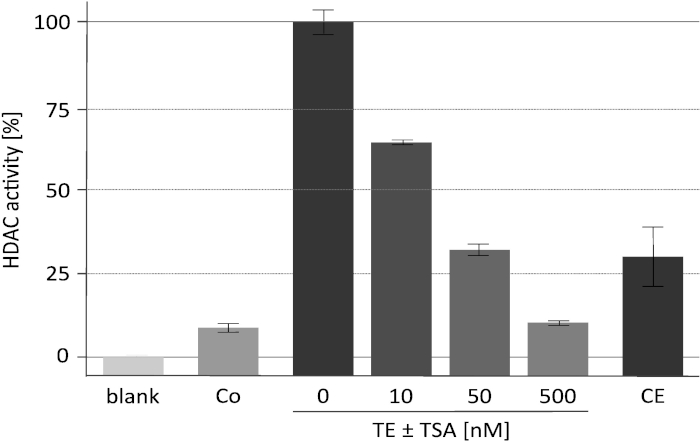
Figura 2. Test di attività HDAC in concentrazioni crescenti di tricostatina A. L'efficacia dell'inibizione di RpdA è stata testata con 25 μL di RpdA ricombinante purificato per affinità ("TE") e 25 μL di 0, 10, 50 e 500 nM dell'inibitore HDAC TSA diluito in RPMI-1640 medium. RPMI è stato utilizzato per valutare l'attività in background ("blank"). Vengono visualizzate le attività dell'eluato finale dopo la seconda fase di affinità di calmodulina ("CE") e di un ceppo senza tag dopo la prima fase di purificazione dell'affinità (controllo negativo, "co"). Le attività sono mostrate come percentuale di RpdA arricchiti senza TSA (100%, "TE"). Le barre di errore indicano la deviazione standard di tre repliche. Questa cifra è stata modificata da Bauer et al. 20162. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
Discussione
Questo protocollo descrive un arricchimento in un solo passaggio di un HDAC di classe 1 con tag TAP dal fungo filamentoso a. nidulans per la valutazione dell'attività in vitro della deacetilasi. Il tag TAP è stato originariamente introdotto nel lievito del panettiere per l'identificazione dei partner di interazione proteina-proteina della proteina contrassegnata6. Successivamente, il tag era codone-ottimizzato per il suo utilizzo in a. nidulans5. Qui forniamo un protocollo passo-passo dritto in avanti per l'applicazione del primo passo di purificazione di affinità della strategia TAP per l'arricchimento in singolo passaggio della classe 1 HDAC RpdA. Il secondo passo di purificazione di affinità aumenta chiaramente il livello di purificazione, che è particolarmente importante per l'identificazione delle proteine che interagiscono con le esche. Tuttavia, solo il primo passo è raccomandato per i successivi test di attività, poiché la mancanza di contaminazione significativa dopo il primo passaggio è stata confermata da un esperimento di controllo utilizzando un ceppo di tipo selvaggio. Inoltre, l'attività eluita è considerevolmente più alta dopo l'arricchimento in un solo passaggio rispetto a quella del rubinetto completo. Oltre a RpdA2, questo protocollo è stato anche utilizzato con successo per purificare i complessi A. nidulans della seconda classe 1 HDAC Hosa21.
A causa delle nostre osservazioni che i HDAC di classe 1 fungine costruiscono complessi stabili4, siamo riusciti a modificare il protocollo di Bayram et al. 201212 che rappresenta la base di questo metodo. Tuttavia, occorre menzionare alcuni passi critici. La preparazione di estratti proteici altamente concentrati per garantire condizioni quasi fisiologiche è fondamentale per una stabilità complessa. Pertanto, è importante tenere presente le raccomandazioni fornite per quanto riguarda il coefficiente di accumulo di biomassa/estrazione. A questo proposito, è anche fondamentale utilizzare polveri micelio fine ben macinato per garantire una corretta estrazione. Qui, l'uso di una rettificatrice è chiaramente vantaggioso. Come accennato nella sezione protocollo, vale la pena di provare il passo TEV-Cleavage per 1-2 h a temperatura ambiente al fine di accelerare la purificazione. Questo è stato testato per RpdA senza osservare eventuali effetti deleteri sulla stabilità (osservazione non pubblicata, Bauer I, 2018). Inoltre, la sostituzione di NP40 (utilizzata nel protocollo originale) con TX-100 potrebbe non essere adatta ad altri complessi proteici. Quando si utilizza questo metodo per la purificazione di altre proteine con tag TAP, si dovrebbe anche fare riferimento al protocollo Bayram, che contiene una serie di preziosi suggerimenti che potrebbero essere utili per una sufficiente purificazione di altri complessi proteici12.
Oltre al metodo di tocco qui descritto, altri tag e tecniche di affinità sono comunemente utilizzati per l'arricchimento in singolo passaggio di proteine di funghi filamentosi, inclusi i suoi-e i tag GFP. Tuttavia, poiché i HDAC di classe 1 sono generalmente funzionali come complessi ad alto peso molecolare, le condizioni di eluizione nativa sono un prerequisito per l'arricchimento di HDAC catticamente attivi. È importante sottolineare che molte altre purificazioni di affinità vengono eseguite in condizioni sfavorevoli. Ad esempio, l'arricchimento di HDACs tramite GFP-trap, che si basa sull'interazione antigene-anticorpo, non è adatto a causa delle condizioni acide di eluizione che interferiscono con l'interazione proteina-proteina dei complessi HDAC legati alle resine. Inoltre, i tentativi di purificare il suo RpdA con la cromatografia di affinità di metallo chelato22, ha provocato una significativa perdita di attività catalitica durante la procedura di purificazione, anche se l'imidazolo invece di condizioni a basso pH è stato utilizzato per l'eluizione ( dati non pubblicati, Bauer, I, 2010).
Una limitazione del protocollo di saggio enzimatico descritto è l'uso del substrato radioattivo. Tuttavia, i saggi su base fluorescente sono stati sviluppati così23,24 e sono disponibili in commercio. Questi saggi sono eseguiti in piastre ben e quindi sono adatti anche per lo screening ad alto rendimento degli inibitori HDAC. In tal caso, sarebbe necessario un alto livello della procedura presentata.
Le potenziali applicazioni imminenti di questo protocollo includono l'arricchimento di specifici sub-complessi di HDACs di classe 1 per valutare i loro specifici ruoli fisiologici e/o le differenze nella loro suscettibilità agli inibitori dell'HDAC. Quando si stabilisce il metodo descritto per altri enzimi, si consiglia vivamente di eseguire un esperimento di controllo negativo con un ceppo senza tag. Ciò garantisce la specificità delle attività enzimatiche misurate e rivelerebbe la contaminazione da enzimi non specificamente legati.
Il saggio di purificazione e di attività descritto qui può essere eseguito entro due giorni e gli enzimi arricchiti sono stabili per almeno diversi mesi, se conservati in aliquote a-80 ° c. In conclusione, questo protocollo fornisce un modo relativamente semplice ed economico per raggiungere i complessi HDAC di classe 1 per la misurazione dell'attività e la determinazione dell'efficacia dell'inibitore.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare Petra Merschak, divisione di biologia molecolare (Biocenter, Università di medicina di Innsbruck), per il suo aiuto e supporto per quanto riguarda questo manoscritto. Inoltre, vorremmo ringraziare i recensori per i loro preziosi commenti.
Questo lavoro è stato finanziato dal Fondo scientifico austriaco (P24803 a SG e P21087 a GB) e da finanziamenti intramurali (MUI Start, ST201405031 a IB).
Materiali
| Name | Company | Catalog Number | Comments |
| 10 x SDS-PAGE running buffer | Novex | ||
| 2-mercaptoethanol (EtSH) | Roth | 4227 | |
| 25 cm2 cell culture flasks with vent cap | Sarstedt | 833910002 | For spore production |
| 47 mm vacuum filtration unit | Roth | EYA7.1 | |
| AccuFLEX LSC-8000 | HITACHI | – | Scintillation counter |
| Acetic acid | Roth | 7332 | |
| Anti-Calmodulin Binding Protein Epitope Tag Antibody | Millipore | 07-482 | Used at 1:1333 dilution |
| Anti-Rabbit IgG (whole molecule)–Alkaline Phosphatase (AP) antibody | Sigma-Aldrich | A3687 | |
| Ball mill | Retsch | 207450001 | Mixer Mill MM 400 |
| BCIP/NBT | Promega | S3771 | Color development substrate for AP |
| Cell strainer | Greiner | 542040 | |
| Cheese cloth for harvesting mycelia | BioRen | H0028 | Topfentuch |
| Dimethylsulfoxid (DMSO) | Roth | 4720 | |
| EDTA | Prolabo | 20309.296 | |
| Ethyl acetate | Scharlau | Ac0155 | |
| Freeze Dryer | LABCONCO | 7400030 | FreeZone Triad |
| Glycerol | Roth | 3783 | |
| HCl | Roth | 4625 | |
| IgG resin | GE Healthcare | 17-0969-01 | IgG Sepharose 6 Fast Flow |
| Inoculation loops | VWR | 612-2498 | |
| KOH | Merck | 5033 | |
| Laminar flow cabinet | Thermo Scientific | – | Hera Safe KS |
| Mixed Cellulose Esters Membrane Filters | Millipore | GSWP04700 | |
| NaCl | Roth | 3957 | |
| NaOH | Roth | 6771 | |
| Neubauer counting chamber improved | Roth | T728 | |
| Novex gel system | Thermo Scientific | For SDS-PAGE | |
| Novex Tris-glycine SDS running buffer (10X) | Thermo Scientific | LC2675 | Running buffer for SDS-PAGE |
| peqGold protein-marker II | VWR | 27-2010P | Protein ladder used for silver stain |
| Peristaltic Pump P-1 | GE Healthcare | 18111091 | |
| Pipette controller | Brand | 26302 | accu-jet pro |
| Poly-Prep chromatography columns | Bio-Rad | 731-1550 | |
| ProSieve QuadColor protein marker | Biozym | 193837 | Prestained protein ladder used for western blot |
| Protease inhibitor cocktail tablets | Sigma-Aldrich | 11873580001 | cOmplete, EDTA-free |
| Rotary mixer | ELMI | – | Intelli-Mixer RM-2 S |
| Rotiszint eco plus | Roth | 0016 | |
| RPMI-1640 | Sigma-Aldrich | R6504 | |
| Scintillation vials | Greiner | 619080 | |
| Sorvall Lynx 4000 | Thermo Scientific | ||
| Thermomixer comfort | Eppendorf | ||
| TIB32.1 | A. nidulans rpdA::TAP strain. Genotype: alcA(p)::rpdA; veA1; argB2; yA2; pIB32::argB; ArgB+; PyrG+ | ||
| Trans-Blot Turbo RTA Midi Nitrocellulose Transfer Kit | Bio-Rad | 1704271 | |
| Trans-Blot Turbo Transfer System | Bio-Rad | 1704150 | |
| Trichostatin A (TSA) | Sigma-Aldrich | T8552 | 5 mM stock in DMSO |
| Tris (free base) | Serva | 37190 | |
| Tris-HCl | Roth | 9090 | |
| Polysorbate 20 | Roth | 9127 | Tween 20 |
| Polysorbate 80 | Sigma-Aldrich | P1754 | Tween 80 |
| TX-100 | Acros Organics | 215682500 | Triton X-100, Octoxynol-9 detergent |
Riferimenti
- Gregoretti, I. V., Lee, Y. -. M., Goodson, H. V. Molecular evolution of the histone deacetylase family: functional implications of phylogenetic analysis. Journal of Molecular Biology. 338 (1), 17-31 (2004).
- Bauer, I., et al. A Class 1 Histone Deacetylase with Potential as an Antifungal Target. mBio. 7 (6), (2016).
- Stefan, A., et al. Purification of active recombinant human histone deacetylase 1 (HDAC1) overexpressed in Escherichia coli. Biotechnology Letters. 40 (9-10), 1355-1363 (2018).
- Trojer, P., et al. Histone deacetylases in fungi: novel members, new facts. Nucleic Acids Research. 31 (14), 3971-3981 (2003).
- Bayram, &. #. 2. 1. 4. ;., et al. VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism. Science. 320 (5882), 1504-1506 (2008).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hill, T. W., Kafer, E. Improved protocols for Aspergillus minimal medium: trace element and minimal medium salt stock solutions. Fungal Genetics Reports. 48, (2001).
- Todd, R. B., Davis, M. A., Hynes, M. J. Genetic manipulation of Aspergillus nidulans: meiotic progeny for genetic analysis and strain construction. Nature Protocols. 2 (4), 811-821 (2007).
- Zadra, I., Abt, B., Parson, W., Haas, H. xylP promoter-based expression system and its use for antisense downregulation of the Penicillium chrysogenum nitrogen regulator NRE. Applied and Environmental Microbiology. 66 (11), 4810-4816 (2000).
- Stolz, D. J., et al. Histological Quantification to Determine Lung Fungal Burden in Experimental Aspergillosis. Journal of Visualized Experiments. (133), (2018).
- Bayram, &. #. 2. 1. 4. ;., et al. Identification of protein complexes from filamentous fungi with tandem affinity purification. Methods in Molecular Biology. 944, 191-205 (2012).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Blum, H., Beier, H., Gross, H. J. Improved silver staining of plant proteins, RNA and DNA in polyacrylamide gels. Electrophoresis. 8 (2), 93-99 (1987).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 24, 145-149 (1992).
- Kölle, D., et al. Biochemical methods for analysis of histone deacetylases. Methods. 15 (4), 323-331 (1998).
- Tribus, M., et al. A novel motif in fungal class 1 histone deacetylases is essential for growth and development of Aspergillus. Molecular Biology of the Cell. 21 (2), 345-353 (2010).
- Sendra, R., Rodrigo, I., Salvador, M. L., Franco, L. Characterization of pea histone deacetylases. Plant Molecular Biology. 11 (6), 857-866 (1988).
- Valente, S., et al. 1,3,4-Oxadiazole-containing histone deacetylase inhibitors: anticancer activities in cancer cells. Journal of Medicinal Chemistry. 57 (14), 6259-6265 (2014).
- Mai, A., et al. Synthesis and biological properties of novel, uracil-containing histone deacetylase inhibitors. Journal of Medicinal Chemistry. 49 (20), 6046-6056 (2006).
- Pidroni, A., et al. A Class 1 Histone Deacetylase as Major Regulator of Secondary Metabolite Production in Aspergillus nidulans. Frontiers in Microbiology. 9, 2212 (2018).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Wegener, D., Wirsching, F., Riester, D., Schwienhorst, A. A fluorogenic histone deacetylase assay well suited for high-throughput activity screening. Chemistry & Biology. 10 (1), 61-68 (2003).
- Peng, L., Yuan, Z., Seto, E. Histone deacetylase activity assay. Methods in Molecular Biology. 1288, 95-108 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon