需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
创伤性脑损伤的神经炎症和血流动力学反应的系统分析
* 这些作者具有相同的贡献
摘要
该协议提出了表征神经炎症和血流动力学对轻度创伤性脑损伤的反应的方法,并将这些数据整合为使用偏最小二乘回归的多变量系统分析的一部分。
摘要
轻度创伤性脑损伤(mTBI)是一个重大的公共卫生问题。反复暴露于 mTBI 可导致累积的、持久的功能缺陷。我们小组和其他人的大量研究表明,mTBI刺激细胞因子表达并激活小胶质细胞,减少脑血流量和新陈代谢,并损害脑血管反应性。此外,一些作品报告了这些神经炎症和血液动力学标志物中的紊乱与认知障碍之间的关联。在本文中,我们详细介绍了表征小鼠神经炎症和血流动力学组织对mTBI的反应的方法。具体而言,我们描述了如何执行mTBI的重量下降模型,如何使用称为弥漫相关光谱的非侵入性光学技术纵向测量脑血流量,以及如何对脑组织样品进行Luminex多重免疫测定以量化细胞因子和免疫调节磷酸化蛋白(例如,在MAPK和NFκB途径内),这些蛋白响应并调节小胶质细胞和其他神经免疫细胞的活性。最后,我们详细介绍了如何使用多变量系统分析方法集成这些数据,以了解所有这些变量之间的关系。了解这些生理和分子变量之间的关系最终将使我们能够确定导致mTBI的机制。
引言
概述
轻度创伤性脑损伤(mTBIs)每年影响约160-380万运动员1.这些损伤,包括亚脑震荡和脑震荡损伤,可使患者出现短暂的躯体、情绪、心理和认知症状2.此外,在"脆弱性窗口"内持续的 重复 性mTBI(rmTBI)可能导致认知后果的累积严重程度和持续时间,其持续时间比单个mTBI单独3的影响更长,最终甚至导致功能永久丧失4,5,6。虽然许多患者在相对较短的时间范围内(<1周)恢复,但10-40%的患者在1个月内遭受>mTBI的更持久影响,有些持续长达1年3,7,8,9。尽管这些损伤的患病率很高且后果持久,但对损伤机制知之甚少,并且没有有效的治疗策略。
鉴于mTBI/rmTBI后结局的高度变异性,在确定在终末mTBI/rmTBI研究中获得的组织的早期分子触发因素的一个挑战是缺乏纵向数据证明这些分子触发因素与长期结局的明确"急性分子联系"。为了克服这一挑战,我们小组发现,使用称为弥漫相关光谱(DCS)的光学工具急性测量的急性脑血流量减少与rmTBI10小鼠模型中的长期认知结果密切相关。使用这种血流动力学生物标志物,我们表明脑血流量急性降低(并且通过扩展,预测的长期结果更差)的小鼠在MAPK和NFκB通路内同时具有神经元磷酸信号传导的急性增加,促炎细胞因子的神经元表达增加,吞噬细胞/小胶质细胞标志物的表达增加111.这些数据表明,神经元磷酸化信号传导、细胞因子表达和小胶质细胞活化在损伤后脑血流的急性调节以及触发导致神经元功能障碍和更差认知结果的信号级联反应中可能起作用。在本文中,我们详细介绍了在rmTBI之后同时探测血流动力学和神经炎症环境的方法,以及如何整合这些复杂的数据集。具体而言,我们概述了这种综合方法的四个关键步骤的程序:(1)轻度创伤性脑损伤的重量下降模型,(2)使用弥漫相关光谱评估脑血流,(3)神经炎症环境的定量,以及(4)数据整合(图1)。下面,我们简要介绍了这些关键步骤中的每一个,以帮助指导读者了解我们方法背后的基本原理。手稿的其余部分为每个关键步骤提供了详细的协议。
轻度创伤性脑损伤的降重模型
虽然存在许多重复性轻度TBI的优秀临床前模型12,13,14,15,16,17,18,但我们采用了一个完善且临床相关的重量下降闭合性头部损伤模型。该模型的主要特征包括(1)完整颅骨/头皮的钝性影响,然后头部围绕颈部的无限制旋转,(2)没有明显的结构性脑损伤,水肿,血脑屏障损伤,急性细胞死亡或慢性脑组织丢失,以及(3)持续(长达1年)仅在多次命中后出现认知缺陷19 (图2))。
弥漫相关光谱评估脑血流
弥漫相关光谱(DCS)是一种非侵入性光学技术,可测量血流量5,20,21。在DCS中,近红外光源放置在组织表面上。将检测器放置在与组织表面上的光源固定的距离处,以检测通过组织倍增散射的光(图3)。散射移动的红细胞会导致检测到的光强度随时间波动。一种称为相关扩散理论的简单分析模型用于将这些强度波动与血流指数相关联(CBFi, 图4)。虽然CBFi (cm2 / s)的单位不是传统的流量单位(mL / min / 100 g),但先前对小鼠的研究表明,CBFi 与通过标记为MRI21的动脉旋转测量的脑血流量密切相关。
作为参考,这里使用的DCS仪器是内部构建的,由852 nm长相干长度激光器,4个光子计数雪崩光电二极管阵列和硬件自相关器板(单tau,8通道,100 ns最小采样时间)21,22组成。数据是使用LabView编写的自制软件获取的。该器件的动物接口由 400 μm 多模源光纤(400-2200 nm 波长范围、纯硅芯、TECS 硬包层)和 780 nm 单模检测器光纤(780-970 nm 波长范围、纯硅芯、TECS 硬包层、730 ± 30 nm 秒模式截止)组成,间隔 6 mm 并嵌入黑色 3D 打印传感器 (4 mm x 8 mm, 图 3)。
神经炎症环境的量化
虽然神经炎症受多种细胞过程的调节,但两个关键的相关机制是细胞因子/趋化因子的细胞外信号传导和磷酸化蛋白的细胞内信号传导。为了研究损伤后大脑的神经炎症环境,从小鼠中提取大脑,进行微解剖,并使用Luminex量化细胞因子/趋化因子和磷酸化蛋白(图5, 图6, 图7)。Luminex多重免疫分析通过将酶联免疫吸附测定(ELISA)与荧光标记的磁珠偶联,能够同时对这些蛋白质的各种集合进行定量。对每种感兴趣的蛋白质使用不同的荧光标签,并且每个标签的磁珠都用针对该特定蛋白质的捕获抗体进行功能化。将数百个用于捕获每种蛋白质的磁珠混合在一起,置于96孔板中,并与样品一起孵育。样品孵育后,使用磁铁将磁珠捕获在孔中,同时将样品洗出。接下来,生物素化的检测抗体与感兴趣的分析物结合,形成类似于传统ELISA的抗体 - 抗原三明治,但每种蛋白质的ELISA发生在不同的荧光标记珠上。加入藻红素偶联链霉亲和素(SAPE)完成每个反应。然后,Luminex仪器读取磁珠并根据每个荧光标签/蛋白质分离信号。
数据集成
由于在Luminex测定中测量了大量的分析物(例如细胞因子),如果单独分析每个定量的蛋白质,则数据分析可能难以解释。为了简化分析并捕获分析物中观察到的趋势,我们使用一种称为偏最小二乘回归的多元分析方法(PLSR, 图8)23。PLSR的工作原理是识别对应于每个被测蛋白质(即细胞因子或磷酸化蛋白,称为"预测变量")的权重轴,这些权重轴与反应变量(例如,脑血流量)一起最优地解释了被测蛋白质的协方差。权重被称为"载荷",并被组装成一个称为潜在变量(LV)的向量。通过在两个LV中的每一个上投影(称为"评分")测量的蛋白质数据,可以根据这些LV重新绘制数据。计算 PLSR 后,我们使用 varimax 旋转来识别新的 LV,该 LV 使样本投影到 LV 和预测变量24 之间的协方差最大化。这种方法允许我们将LV1定义为响应变量方差得到最好解释的轴。LV2最大化了响应变量和LV1残留数据之间的协方差,这可能与样品之间的生物或技术变异性有关。最后,我们进行一劳永逸的交叉验证(LOOCV),以确保PLSR模型不会严重依赖于任何一个样本23。
在该协议中,我们详细介绍了表征神经炎症和血流动力学组织对mTBI反应的方法。一般工作流程如图 1 所示。在该协议中,小鼠使用重量下降闭合性头部损伤模型进行一个或多个mTBI。脑血流量在损伤前和损伤后的多个时间点纵向测量。在询问神经炎症变化的兴趣点,动物被安乐死,大脑被提取出来。通过显微切割分离感兴趣的大脑区域,然后裂解以提取蛋白质。然后,裂解物用于细胞因子和磷酸化蛋白表达的Luminex多重免疫测定以及蛋白质印迹。最后,使用偏最小二乘回归分析集成该整体数据集。
研究方案
所有动物程序均由埃默里大学机构动物护理和使用委员会(IACUC)批准,并遵循NIH实验室动物护理和使用指南。
1. 轻度创伤性脑损伤的降重模型
- 准备举重设置。将虎钳安装在平坦的表面上,并垂直对齐1米的导流管(内径2.54厘米)(使用水平仪检查)。使用54克螺栓(基本体径0.95厘米,头部直径2厘米,长度10.2厘米)进行冲击。
- 短暂麻醉小鼠。用4.5%异氟醚在100%氧气中诱导小鼠45秒。通过缺乏脚趾捏合反应来确认足够的麻醉深度。
- 诱导损伤。
- 迅速将小鼠从麻醉中取出,并将小鼠俯卧在薄膜(11.2 cm x 21.3 cm组织)的中心。
- 用双手绷紧组织,将鼠标俯卧在中心。将鼠标的尾巴固定在拇指下。将鼠标头放在导管下方(图2)。
- 将螺栓从导管的顶部放到鼠标头部的背侧,目的是在眼睛后部和耳朵前部之间产生冲击力。撞击时,小鼠将穿透组织,允许头部围绕颈部的快速加速(图2)。
- 恢复
- 撞击后,将小鼠仰卧在室内空气中37°C的加热垫上。监测损伤后1小时的恢复情况。在1小时内,小鼠应该能够正常行走,找到食物和水,并且不会表现出粗大的运动缺陷。
注意:根据机构动物护理和使用委员会的批准,不使用镇痛,这是合理的,因为镇痛对感兴趣的参数(即脑血流量,炎症标志物)的混杂影响。意识丧失,定义为从麻醉中移除到恢复矫正反射的时间,预计持续20秒至3分钟(补充表1)。可观察到短暂的(<30 秒)呼吸暂停和/或癫痫发作样活动,特别是在重复性颅脑外伤后,间隔每日一次。
- 撞击后,将小鼠仰卧在室内空气中37°C的加热垫上。监测损伤后1小时的恢复情况。在1小时内,小鼠应该能够正常行走,找到食物和水,并且不会表现出粗大的运动缺陷。
- 根据需要重复上述步骤。这种损伤可以重复一次-每日、每周或每月一次。损伤的数量和间距取决于所需的损伤严重程度。通常,我们采用间隔五次的命中,每天一次,以诱导空间学习和记忆的严重缺陷。
注意:先前的研究表明,每天间隔一次的五次命中足以诱导损伤后持续1年以上的空间学习和记忆缺陷,而不会对大脑造成水肿,出血或明显的结构性损伤19。每天称量小鼠的体重,并密切监测脱水,运动缺陷和食欲不振的迹象。如果脱水,给予小鼠湿胆和皮下注射1mL盐水,每日一次。为了防止不必要的痛苦并确保人道的终点,小鼠被安乐死:脱水持续或恶化>皮下盐水治疗后24小时,体重比损伤前基线减少20%以上,运动缺陷如盘旋或爪子拖曳出现,并在受伤后持续>1小时。
2. 弥漫相关光谱评估脑血流
- 数据采集
- 去除头皮上的毛发。由于DCS在没有头发的情况下效果最好,因此有必要在实验开始之前去除头部的毛皮。通常,脱毛在研究开始前1-3天进行。
- 用4.5%异氟醚在100%氧气中诱导小鼠45秒,并在100%氧气中用1-2%异氟醚维持。
- 剃掉眼睛和耳朵之间的头部。然后,使用脱毛膏去除头上的毛皮,如图 3所示。
- 让动物在温暖的垫上从麻醉中恢复过来,然后回到笼子里。
- 使用DCS测量脑血流量。为了最大限度地减少测量过程中的运动伪影,在短暂的异氟醚麻醉下研究小鼠。
注意:在整个测量过程中目视监测呼吸和脚趾夹紧反应,并根据需要调整异氟醚浓度,以确保麻醉深度的一致性。鉴于异氟醚25的已知血管舒缩作用,麻醉深度的显着变化可能会改变血流。- 用4.5%异氟醚在100%氧气中诱导45秒,然后在100%氧气中用1.0-1.75%异氟醚维持。通过无脚趾捏合反应和正常呼吸(每分钟约60-80次呼吸)来确认足够的麻醉深度。
- 稳定2分钟后,将DCS传感器轻轻放在右半球上,使光学传感器的顶部边缘与眼睛后部对齐,传感器的侧面沿着中线对齐(图3)。用杯子放在传感器上,以避开室内光线。采集 5 秒数据(1 Hz 采集)。
- 将传感器重新定位在左半球,并获取 5 秒的数据。
- 每个半球重复3次,以考虑组织表面下的局部异质性。
- 恢复
- 将鼠标从麻醉中取出并放在保暖垫上。
- 在小鼠恢复其矫正反射后,将其返回到笼子中。
- 去除头皮上的毛发。由于DCS在没有头发的情况下效果最好,因此有必要在实验开始之前去除头部的毛皮。通常,脱毛在研究开始前1-3天进行。
- 数据分析
- 执行初始质量控制。每帧DCS数据由测得的归一化强度自相关函数
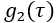 (图4A)和光子计数率(kHz)组成。
(图4A)和光子计数率(kHz)组成。- 要移除具有显著运动伪影的数据帧,请丢弃曲线尾部
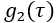 平均值(即
平均值(即 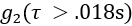 )> 1.005 的数据帧。
)> 1.005 的数据帧。 - 要删除信噪比较差的数据帧,如果检测到的光子计数率< 20 kHz,请丢弃数据帧。
- 要移除具有显著运动伪影的数据帧,请丢弃曲线尾部
- 提取脑血流量指数。在 Matlab 中使用 fminsearch,拟合 CBFi(i)的每个测量数据帧
 。将拟合限制为
。将拟合限制为 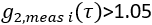 ,并找到 CBFi 的值,该值可最小化以下成本函数:
,并找到 CBFi 的值,该值可最小化以下成本函数: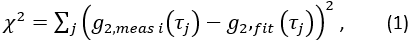
其中总和是所有测量的延迟时间,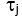 并且是
并且是 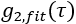 相关扩散方程的半无限均匀解(图4B):
相关扩散方程的半无限均匀解(图4B):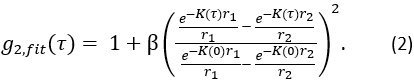
这里β是由实验设置确定的相干因子,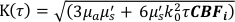
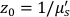
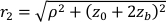
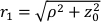
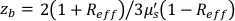 ,Reff = 0.493,假设组织折射率为1.4,ρ为6 mm,μa和μ是组织的吸收和降低的散射系数(假设分别为0.25和9.4 / cm,分别为10,26,27)。
,Reff = 0.493,假设组织折射率为1.4,ρ为6 mm,μa和μ是组织的吸收和降低的散射系数(假设分别为0.25和9.4 / cm,分别为10,26,27)。
注意:由于β随时间变化约 10%,因此请同时拟合每个数据帧的 β 和 CBFi 。 - 执行二次质量控制。在每个重复(由 5 个数据帧组成)中,丢弃异常值。异常值定义为那些落在该重复的平均 CBFi 的 1.5 标准差之外的 CBFi 值。如果将 1 个以上的数据点标识为异常值,请丢弃整个重复项。
- 估计平均脑血流量指数:通过对所有重复的所有数据帧取平均值来估计每个半球的平均CBFi (图4C)。如果未观察到明显的半球差异,则对不同半球的平均值进行平均,以获得全球平均CBF i的估计值。
- 执行初始质量控制。每帧DCS数据由测得的归一化强度自相关函数
3. 使用荧光测定对细胞因子和磷酸化蛋白进行多重定量
- 组织提取
注意:使用Luminex定量脑细胞因子和磷酸信号蛋白需要组织提取。- 使用4.5%异氟醚在100%氧气中麻醉小鼠1-2分钟。通过缺乏脚趾捏合反应来检查麻醉的深平面。通过斩首实施安乐死。
- 收获组织。
- 切除大脑。通常,固定左半球进行组织学检查,并在皮层和海马体内从右半球微切除几个区域(图5)。
- 将解剖的样品置于微量离心管中,在液氮中快速冷冻。对于冷冻敏感蛋白的分析,最好在快速冷冻之前对组织切片进行细分,以避免以后的冻融。
注意:方案可以暂停,组织样品可以储存在-80°C,直到准备裂解样品。或者,可以裂解样品,然后在-80°C下储存。
- 裂解体样品。
- 通过在裂解缓冲液中加入蛋白酶抑制剂和2mM苯基甲基磺酰氟来制备裂解缓冲液。
- 每约3μg动物组织加入150μL混合裂解缓冲液。作为参考,小鼠视觉皮层组织样品约为3μg。
- 为了使组织均质化,使用1000μL移液器上下移液约15-20次,机械地对组织进行研磨。为了获得最佳的样品研磨效果,可以使用杵浆机。
- 将样品管在4°C下在旋转器上放置30分钟。
- 将样品在4°C下以约15,000× g离心10分钟,并收集上清液。样品可以立即处理或储存在-80°C下以进行进一步分析。
注意:使用该方案制备的样品裂解物与蛋白质印迹相容,可以从中分析吞噬细胞/小胶质细胞标记物Iba1和/或星形胶质细胞活化标志物GFAP,以补充用于神经炎症研究的细胞因子和磷酸化蛋白分析11。
- 细胞因子和磷酸化蛋白的多重免疫检测方案
注意:虽然总体上相似,但细胞因子和磷酸化蛋白试剂盒的方案存在一些细微差异。每个步骤都记录了差异。下面概述了为Luminex测定制备样品的步骤。- 试剂的制备(第1天,细胞因子和磷酸化蛋白相同)
- 让试剂升温至室温(约30分钟)。
- 超声处理多路磁珠瓶30秒,然后涡旋1分钟。确保使用铝箔保护多路复用磁珠免受光线照射,或使用提供的光保护瓶。
- 通过将0.1%吐温20混合在1xPBS中来制备洗涤缓冲液,或者使用试剂盒中提供的洗涤缓冲液。
- 裂解组织样品的制备(第1天,细胞因子和磷酸化蛋白相同)
- 如果先前冷冻,从冰箱中取出裂解组织样品,并在冰上解冻(约20分钟)。将样品以9,167× g 离心10分钟以除去沉淀物。
- 以线性范围分析确定的最佳蛋白质浓度制备25μL样品(见第3.3节)。要归一化所有样品的总体积,请在试剂盒中提供的测定缓冲液中稀释样品。
- 制备96孔板(第1天,细胞因子和磷酸化蛋白相同)
- 使用试剂盒中包含的 96 孔板或底部较薄的孔板(例如,Brand Tech)。
- 向每个孔中加入200μL洗涤缓冲液(或1x PBS,0.1%吐温),并在平板振荡器上以750rpm混合10分钟。
- 卧螺洗涤缓冲液,将盘子拍打在纸巾上以去除残留物。
- 细胞因子的免疫测定程序(第1天)
- 按顺序将以下内容添加到每个孔中。
- 向所有孔中加入25μL测定缓冲液。
- 仅向背景孔中加入25μL额外的测定缓冲液。对于每个实验运行,至少有两个背景孔。背景孔没有上样,并定义了仪器在没有样品的情况下读取的荧光强度。
- 将每个稀释样品的25μL加入相应的样品孔中。
- 向所有孔中加入25μL1x多重磁珠(图6)。在加入孔之前,一定要涡旋珠子1分钟。
- 向所有孔中加入25μL测定缓冲液。
- 用板封口机密封板,并用铝箔盖住板。在2-8°C下孵育过夜(12-16小时)。
- 按顺序将以下内容添加到每个孔中。
- 细胞因子的免疫测定程序(第2天)
- 将96孔板放在磁选机上,确保孔与磁铁对齐。静置 2 分钟。当板仍然附着在磁选机上时,倾析孔内容物。
- 使用以下步骤清洗板2次。
- 向每个孔中加入200μL洗涤缓冲液,并在室温下置于振荡器上2分钟。
- 将孔板放在磁选机上,在室温下2分钟。
- 在孔板仍然附着在磁选机上时倾析孔内容物。
- 每孔加入25μL检测抗体(图6)。用铝箔覆盖。在室温下在平板振荡器(750rpm)上孵育1小时。
- 将检测抗体留在其中,并向每个孔中加入25μL链霉亲和素 - 藻红素(SAPE)(图6)。用铝箔覆盖。在室温下在平板振荡器(750rpm)上孵育30分钟。
- 将孔板放在磁选机上,静置2分钟。倾析井内容物并从磁选机上分离。
- 将孔板洗涤两次(见步骤3.2.5.2)。
- 向每个孔或测定缓冲液(如果使用200或FlexMap 3D仪器)中加入75μLLuminex驱动液(如果使用MAGPIX仪器)。在室温下将珠子重新悬浮在平板振荡器上5分钟。
- 阅读Luminex仪器(MAGPIX,200或FlexMap 3D),参考用户手册进行正确操作(图6)。
- 磷酸化蛋白的免疫测定程序(第1天)
- 按顺序将以下内容添加到每个孔中。
- 向所有孔中加入25μL测定缓冲液。
- 仅向背景孔中加入25μL额外的测定缓冲液。对于每次实验运行,建议至少有两个背景孔。背景孔没有上样,并定义了仪器在没有样品的情况下读取的荧光强度。
- 向每个样品孔中加入25μL每个稀释的样品。
- 向所有孔中加入25μL1x多重磁珠(图6)。
注:Luminex 检测试剂盒在 20 倍储备溶液中提供多重磁珠。确保涡旋20x储备多重磁珠溶液2分钟,然后在测定缓冲液中将其稀释至1x溶液。涡旋1x多重磁珠悬浮液1分钟,然后加入孔中。
- 用板封口机密封板,并用铝箔盖住板。在2-8°C下孵育过夜(12-16小时)。
- 向所有孔中加入25μL测定缓冲液。
- 按顺序将以下内容添加到每个孔中。
- 磷酸化蛋白的免疫测定程序(第2天)
- 将孔板放在磁选机上,确保孔板与磁选机完全对齐。静置 2 分钟。当孔板仍然附着在磁选机上时,倾析孔内容物。
- 洗涤平板2次(参见细胞因子免疫测定程序第2天的步骤b)。
- 将20x储备检测抗体稀释至测定缓冲液中的1x溶液。每孔加入25μL1x检测抗体(图6)。用铝箔覆盖。在室温下在平板振荡器(750rpm)上孵育1小时。
- 将96孔板放在磁选机上,静置2分钟。倾析井内容物,从磁选机上分离。
- 将测定缓冲液中的25x储备SAPE稀释至1x缓冲液。加入25μL的1x SAPE(图6)。用铝箔盖上盖子,在室温下在平板振荡器(750rpm)上孵育15分钟。
- 将SAPE留在孔中,并向每个孔中加入25μL扩增缓冲液。用铝箔覆盖。
- 在室温下在平板振荡器(750rpm)上孵育15分钟。
- 将孔板放在磁选机上2分钟。倾析孔内容物并从磁选机上分离。
- 加入75μLLuminex驱动液(如果使用MAGPIX仪器)或测定缓冲液(如果使用200或FlexMap 3D仪器)。在室温下将珠子重新悬浮在平板振荡器上5分钟。
- 阅读Luminex仪器(MAGPIX,200或FlexMap 3D),参考用户手册进行正确操作(图6)。
- 试剂的制备(第1天,细胞因子和磷酸化蛋白相同)
- 样品稀释曲线的线性度
- 样品制备:连续稀释不同浓度总蛋白的测试样品。对于散装脑组织,加载0-25μg细胞因子和0-12μg磷酸化蛋白的连续稀释液。总蛋白质浓度可以使用双辛胆酸(BCA)测定法测量。
- 多重免疫测定:对选定的样品进行Luminex测定(见第3.2节)。
- 数据分析
- 绘制每种蛋白质的荧光强度与上样蛋白质量的关系(图7)。
- 对于每种分析物,确定总蛋白负载范围,其中总蛋白和荧光强度读数之间的关系是线性的(图7)。
- 为了确定整个测定运行中应上样的总蛋白量,确定每种分析物曲线的线性部分,然后选择落在大多数分析物线性范围内的蛋白质浓度。
注意:尽管大多数蛋白质共享相似的线性范围,但所有蛋白质的线性范围可能不重叠。如果是这种情况,可能需要使用不同量的总蛋白加载来多次运行每个样品。或者,非线性样本可能被排除在分析之外。此外,一些蛋白质可能没有任何线性范围。
4. 偏最小二乘回归
注意:提供了示例 R 代码和示例数据电子表格来执行偏最小二乘分析。
- 数据准备:按照提供的示例数据电子表格"MyData"中所示设置数据格式。在第 1 行中包括变量名称,在列 A 中包括示例名称,在 B 列中包括响应变量,并在列 C+ 中包括所有预测变量。用背景数据填充最后两行,并将两个示例名称都设置为"背景"。
- RStudio 中的偏最小二乘回归
- 从 www.r-project.org 安装R(免费,开源)。
- 从 www.rstudio.com 安装RStudio Desktop(免费开源许可证)。
- 下载随此发布提供的示例 R 代码"PLSR_Sample_Code.R",并将其保存到包含数据电子表格的同一文件夹中。在 RStudio 中打开代码文件。
- 在 "用户输入 "部分中,将"dataFileName"更改为数据电子表格的名称。
- 通过突出显示要运行的代码部分并单击脚本右上角的" 运行 "来执行以下步骤。
- 在 RStudio 中加载必要的 R 包、函数、工作目录地址和用户输入值(小节"初步信息")。
- 将数据加载到RStudio中,并通过从所有测量中减去平均背景信号并z评分每个分析物来准备原始数据进行处理(小节"读取数据并减去背景")(图8A)。
- 使用综合 R 存档网络 (CRAN) 上提供的 plsRglm 包 v1.2.528 在 RStudio 中执行偏最小二乘回归。在LV1-LV2平面中执行varimax旋转(统计包v3.6.2)23 ,以识别一个新的水平轴,该轴最好地通过响应变量分隔样本(小节"PLS")(图8B)。
- 执行"留一个出格"交叉验证 (LOOCV),其中一个样本以迭代方式从数据中剔除,并重新计算 PLSR 模型。计算所有 LOOCV 运行中分析物负载的标准偏差(小节"LOOCV")。
- 创建代表性图:按照上面详述运行提供的示例代码以创建代表性图,这些图自动以pdf文件导出到工作目录(包含数据和代码文件的文件夹)。
- 创建已处理数据的热图,如图 8A (小节"PLS")所示。按照 z 得分定义的光谱为每个条目着色。按感兴趣的潜在变量中计算的顺序对分析物进行排序。
- 创建一个分数图,其中沿水平轴绘制LV1分数,沿垂直轴绘制LV2分数,如图 8B 所示(子节"PLS")。根据其响应变量测量值对每个数据点进行着色,以可视化每个潜在变量与响应变量之间的关系。
- 创建一个条形图,显示每个预测变量的载荷,以可视化每个分析物对潜在变量的贡献,如图 8C 所示(小节"LOOCV")。
- 根据响应变量创建回归LV1分数的图,以可视化PLSR模型分离样本的程度,如图 8D 所示(子部分"PLS")。
结果
先前收集的数据取自先前的工作,其中一组8只C57BL / 6小鼠遭受三次闭合头部损伤(图2),间隔一次,每日11。在这项工作中,在最后一次损伤后4 h用弥漫相关光谱测量脑血流量(图3, 图4)。在损伤后CBF评估后,对动物进行安乐死,并通过免疫测定提取脑组织以定量细胞因子和磷酸化蛋白(图5
讨论
在这里,我们详细介绍了评估对重复性轻度创伤性脑损伤的血流动力学和神经炎症反应的方法。此外,我们已经展示了如何使用偏最小二乘回归将这些数据作为多元系统分析的一部分进行积分。在下面的文本中,我们将讨论与协议相关的一些关键步骤和限制,以及这些方法相对于现有方法的优缺点。
轻度创伤性脑损伤的降重模型。 这种创伤性脑损伤诱导方法是?...
披露声明
没有。
致谢
该项目得到了美国国立卫生研究院R21 NS104801(EMB)和R01 NS115994(LBW / EB)以及亚特兰大儿童保健初级教师重点奖(EMB)的支持。这项工作还得到了美国国防部通过国会指导的医学研究计划的支持,奖励号为。W81XWH-18-1-0669 (LBW/EMB).意见,解释,结论和建议是作者的意见,解释,结论和建议不一定得到国防部的认可。本材料基于美国国家科学基金会研究生研究奖学金计划支持的工作,授予编号1937971。本材料中表达的任何意见,发现,结论或建议均为作者的观点,并不一定反映美国国家科学基金会的观点。
材料
| Name | Company | Catalog Number | Comments |
| Adjustable pipettes | any adjustable pipette | ||
| Aluminum foil | VWR | 89107-726 | |
| Bio-Plex cell lysis kit | C Bio-Rad | 171304012 | |
| BRAND BRANDplates pureGrade Microplates, Nonsterile | BrandTech | 781602 96 | |
| Complete mini protease inhibitor tablet | Sigma-Aldrich | 11836153001 | |
| Depilatory cream | Amazon | Nair | |
| DiH2O | VWR | VWRL0200-1000 | |
| Handheld magnetic separator block for 96 well flat bottom plates | Millipore Sigma Catalogue | 40-285 | |
| Hardware Autocorrelator Board | www.correlator.com | Flex05-8ch | |
| Isoflurane 250 mL | MED-VET INTERNATIONAL | RXISO-250 | |
| Kimwipe (11.2 x 21.3 cm) | VWR | 21905-026 | |
| Laboratory vortex mixer | VWR | 10153-838 | |
| LabView | National Instruments | LabVIEW | |
| Luminex 200, HTS, FLEXMAP 3D, or MAGPIX with xPONENT software | Luminex Corporation | ||
| Luminex Drive Fluid | Luminex | MPXDF-4PK | |
| Luminex sheath fluid | EMD Millipore | SHEATHFLUID | |
| MILLIPLEX MAP Mouse Cytokine/Chemokine Magnetic Bead Panel - Premixed 32 Plex - Immunology Multiplex Assay | Millipore Sigma | MCYTMAG-70K-PX32 | |
| MILLIPLEX MAPK/SAPK Signaling 10-Plex Kit-Cell Signaling Multiplex Assay | Millipore Sigma | 48-660MAG | |
| Mini LabRoller rotator | VWR | 10136-084 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626-1G | |
| Phosphate-buffered Saline (PBS) | VWR | 97064-158 | |
| Plate Sealer | VWR | 82050-992 | |
| Polypropylene microfuge tubes | VWR | 20901-547 | |
| Mini LabRoller | Millipore Sigma | Z674591 | |
| Reagent Reservoirs | VWR | 89094-668 | |
| R Programming Language | |||
| RStudio | www.rstudio.com | ||
| Sonicator | |||
| Titer plate shaker | VWR | 12620-926 | |
| Tween20 | Sigma-Aldrich | P9416-50ML | |
| 1 m acrylic guide tube | McMaster-Carr | 49035K85 | |
| 4 photon counting avalanche photodiode | Perkin-Elmer | SPCM-AQ4C-IO | |
| 400 um multimode source fiber | Thorlabs Inc. | FT-400-EMT | |
| 54 g bolt | Ace Hardware | 0.95 cm basic body diameter, 2 cm head diameter, 10.2 cm length | |
| 780 nm single mode detector fiber | Thorlabs Inc. | 780HP | |
| 852 nm long-coherence length laser | TOPTICA Photonics | iBeam smart |
参考文献
- Langlois, J. A., Rutland-Brown, W., Wald, M. M. The epidemiology and impact of traumatic brain injury: a brief overview. Journal of Head Trauma Rehabilitation. 21 (5), 375-378 (2006).
- Iraji, A., et al. Resting State Functional Connectivity in Mild Traumatic Brain Injury at the Acute Stage: Independent Component and Seed-Based Analyses. Journal of Neurotrauma. 32 (14), 1031-1045 (2015).
- Guskiewicz, K. M., et al. Cumulative effects associated with recurrent concussion in collegiate football players: the NCAA Concussion Study. Journal of the American Medical Association. 290 (19), 2549-2555 (2003).
- Longhi, L., et al. Temporal window of vulnerability to repetitive experimental concussive brain injury. Neurosurgery. 56 (2), 364-374 (2005).
- Committee on Sports-Related Concussions in Youth, Board on Children, Youth, and Families, Institute of Medicine, National Research Council. . Sports-Related Concussions in Youth: Improving the Science, Changing the Culture. , (2014).
- Barkhoudarian, G., Hovda, D. A., Giza, C. C. The Molecular Pathophysiology of Concussive Brain Injury - an Update. Physical Medicine and Rehabilitation Clinics of North America. 27 (2), 373-393 (2016).
- McCrory, P., et al. Consensus statement on concussion in sport--the 4th International Conference on Concussion in Sport held in Zurich, November 2012. Clinical Journal of Sport Medicine. 23 (2), 89-117 (2012).
- Belanger, H. G., Vanderploeg, R. D., Curtiss, G., Warden, D. L. Recent neuroimaging techniques in mild traumatic brain injury. Journal of Neuropsychiatry and Clinical Neurosciences. 19 (1), 5-20 (2007).
- Sours, C., Zhuo, J., Roys, S., Shanmuganathan, K., Gullapalli, R. P. Disruptions in Resting State Functional Connectivity and Cerebral Blood Flow in Mild Traumatic Brain Injury Patients. PLoS ONE. 10 (8), 0134019 (2015).
- Buckley, E. M., et al. Decreased Microvascular Cerebral Blood Flow Assessed by Diffuse Correlation Spectroscopy after Repetitive Concussions in Mice. Journal of Cerebral Blood Flow & Metabolism. 35 (12), 1995-2000 (2015).
- Sankar, S. B., et al. Low cerebral blood flow is a non-invasive biomarker of neuroinflammation after repetitive mild traumatic brain injury. Neurobiology of Disease. 124, 544-554 (2019).
- Vagnozzi, R., et al. Temporal window of metabolic brain vulnerability to concussions: mitochondrial-related impairment--part I. Neurosurgery. 61, 379-388 (2007).
- Longhi, L., et al. Temporal window of vulnerability to repetitive experimental concussive brain injury. Neurosurgery. 56, 364-374 (2005).
- Fujita, M., Wei, E. P., Povlishock, J. T. Intensity- and interval-specific repetitive traumatic brain injury can evoke both axonal and microvascular damage. Journal of Neurotrauma. 29, 2172-2180 (2012).
- Angoa-Perez, M., et al. Animal models of sports-related head injury: bridging the gap between preclinical research and clinical reality. Journal of Neurochemistry. 129, 916-931 (2014).
- Prins, M. L., Hales, A., Reger, M., Giza, C. C., Hovda, D. A. Repeat traumatic brain injury in the juvenile rat is associated with increased axonal injury and cognitive impairments. Developmental Neuroscience. 32, 510-518 (2010).
- Viano, D. C., Hamberger, A., Bolouri, H., Saljo, A. Concussion in professional football: animal model of brain injury--part 15. Neurosurgery. 64, 1162-1173 (2009).
- Kane, M. J., et al. A mouse model of human repetitive mild traumatic brain injury. Journal of Neuroscience Methods. 203, 41-49 (2012).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing Recovery Time Between Injuries Improves Cognitive Outcome After Repetitive Mild Concussive Brain Injuries in Mice. Neurosurgery. 71 (4), 885-892 (2012).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. NeuroImage. 85, 51-63 (2014).
- Sathialingam, E., et al. Small separation diffuse correlation spectroscopy for measurement of cerebral blood flow in rodents. Biomedical Optics Express. 9 (11), 5719 (2018).
- Lee, S. Y., et al. Noninvasive optical assessment of resting-state cerebral blood flow in children with sickle cell disease. Neurophotonics. 6 (03), 1 (2019).
- Wang, H., Liu, Q., Tu, Y. Interpretation of partial least-squares regression models with VARIMAX rotation. Partial Least Squares. 48 (1), 207-219 (2005).
- Eriksson, L., Byrne, T., Johansson, E., Trygg, J., Vikström, C. Multi- and Megavariate Data Analysis Basic Principles and Applications. Umetrics Academy. , (2013).
- Conzen, P. F., et al. Systemic and regional hemodynamics of isoflurane and sevoflurane in rats. Anesthesia and Analgesia. 74 (1), 79-88 (1992).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Lee, S. Y., et al. Small separation frequency-domain near-infrared spectroscopy for the recovery of tissue optical properties at millimeter depths. Biomedical Optics Express. 10 (10), 5362-5377 (2019).
- . plsRglm: Partial Least Squares Regression for Generalized Linear Models Available from: https://CRAN.R-project.org/package=pplsRglm (2019)
- White, B. R., Bauer, A. Q., Snyder, A. Z., Schlaggar, B. L., Lee, J. M., Culver, J. P. Imaging of functional connectivity in the mouse brain. PLoS One. 6, 16322 (2011).
- Buckley, E. M., Parthasarathy, A. B., Grant, P. E., Yodh, A. G., Franceschini, M. A. Diffuse correlation spectroscopy for measurement of cerebral blood flow: future prospects. Neurophotonics. 1 (1), 011009 (2014).
- Rowan, O., et al. Cerebrovascular reactivity measured in awake mice using diffuse correlation spectroscopy. Neurophotonics. 8 (1), (2021).
- Tate, J., Ward, G. Interferences in immunoassay. The Clinical Biochemist. Reviews. 25 (2), 105-120 (2004).
- Staples, E., Ingram, R. J. M., Atherton, J. C., Robinson, K. Optimising the quantification of cytokines present at low concentrations in small human mucosal tissue samples using Luminex assays. Journal of Immunological Methods. 394 (1-2), 1-9 (2013).
- Gierut, J. J., et al. Network-level effects of kinase inhibitors modulate TNF-α-induced apoptosis in the intestinal epithelium. Science Signaling. 8 (407), 129 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。