Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Системный анализ нейровоспалительного и гемодинамического ответа на черепно-мозговую травму
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе представлены методы характеристики нейровоспалительного и гемодинамического ответа на легкую черепно-мозговую травму и интеграции этих данных в рамках многомерного системного анализа с использованием частичной регрессии наименьших квадратов.
Аннотация
Легкие черепно-мозговые травмы (mTBI) являются серьезной проблемой общественного здравоохранения. Повторное воздействие МТМТ может привести к кумулятивному, длительному функциональному дефициту. Многочисленные исследования, проведенные нашей группой и другими, показали, что mTBI стимулирует экспрессию цитокинов и активирует микроглию, уменьшает мозговой кровоток и обмен веществ, а также ухудшает цереброваскулярную реактивность. Кроме того, в нескольких работах сообщалось о связи между расстройствами в этих нейровоспалительных и гемодинамических маркерах и когнитивными нарушениями. Здесь мы подробно описываем методы характеристики нейровоспалительного и гемодинамического тканевого ответа на МТМТ у мышей. В частности, мы описываем, как выполнить модель снижения веса mTBI, как продольно измерять мозговой кровоток с использованием неинвазивного оптического метода, называемого диффузной корреляционной спектроскопией, и как выполнить мультиплексированный иммуноанализ Luminex на образцах тканей мозга для количественной оценки цитокинов и иммуномодулирующих фосфо-белков (например, в пределах путей MAPK и NFκB), которые реагируют и регулируют активность микроглии и других нервных иммунных клеток. Наконец, мы подробно расскажем, как интегрировать эти данные с использованием подхода к многомерному системному анализу, чтобы понять взаимосвязи между всеми этими переменными. Понимание взаимосвязей между этими физиологическими и молекулярными переменными в конечном итоге позволит нам определить механизмы, ответственные за mTBI.
Введение
Обзор
Легкие черепно-мозговые травмы (мТБИ) затрагивают ~ 1,6-3,8 миллиона спортсменов ежегодно1. Эти травмы, включая субконтузивные и сотрясающие травмы, могут оставить пациентов с преходящими физическими, эмоциональными, психологическими и когнитивными симптомами2. Более того, повторяющиеся mTBI (rmTBI), поддерживаемые в «окне уязвимости», могут привести к кумулятивной серьезности и продолжительности когнитивных последствий, которые длятся дольше, чем эффекты одной МЧТв одиночку 3, и в конечном итоге даже к постоянной потере функции 4,5,6. Хотя многие пациенты выздоравливают в течение относительно короткого периода времени (<1 неделя), 10-40% пациентов страдают от более длительных последствий МТМТ в течение > 1 месяца, причем некоторые из них длятся до 1 года 3,7,8,9. Несмотря на высокую распространенность и длительные последствия этих травм, механизмы травм плохо изучены, и не существует эффективных стратегий лечения.
Учитывая высокую вариабельность исходов после mTBI/rmTBI, одной из проблем при выявлении молекулярных триггеров на ранней стадии из ткани, полученных в исследованиях терминальной mTBI/rmTBI, является отсутствие продольных данных, демонстрирующих окончательные «острые молекулярные связи» этих молекулярных триггеров с долгосрочными исходами. Чтобы преодолеть эту проблему, наша группа обнаружила, что остро сниженный мозговой кровоток, измеренный остро с использованием оптического инструмента, называемого диффузной корреляционной спектроскопией (DCS), сильно коррелирует с долгосрочным когнитивным результатом в мышиной модели rmTBI10. Используя этот гемодинамический биомаркер, мы показали, что у мышей с остро низким мозговым кровотоком (и, как следствие, худшим прогнозируемым долгосрочным исходом) наблюдается сопутствующее острое увеличение нейрональной фосфо-сигнализации в путях MAPK и NFκB, увеличение нейронной экспрессии провоспалительных цитокинов и увеличение экспрессии фагоцитарного / микроглиального маркера Iba111 . Эти данные свидетельствуют о возможной роли нейрональной фосфо-сигнализации, экспрессии цитокинов и активации микроглии как в острой регуляции мозгового кровотока после травмы, так и в запуске сигнального каскада, который приводит к дисфункции нейронов и худшему когнитивному результату. Здесь мы подробно описываем наш подход к одновременному исследованию гемодинамической и нейровоспалительной среды после rmTBI и как интегрировать эти сложные наборы данных. В частности, мы описываем процедуры для четырех ключевых шагов к этому комплексному подходу: (1) модель снижения веса легкой черепно-мозговой травмы, (2) оценка мозгового кровотока с помощью диффузной корреляционной спектроскопии, (3) количественная оценка нейровоспалительной среды и (4) интеграция данных (рисунок 1). Ниже мы предоставляем краткое введение в каждый из этих ключевых шагов, чтобы помочь читателям понять обоснование наших методов. Остальная часть рукописи содержит подробный протокол для каждого из этих ключевых шагов.
Модель снижения веса легкой черепно-мозговой травмы
Хотя существует много отличных доклинических моделей повторяющейся легкой ЧМТ 12,13,14,15,16,17,18, мы используем хорошо зарекомендовавшую себя и клинически значимую модель закрытой черепно-мозговой травмы. Ключевые особенности этой модели включают (1) тупое воздействие неповрежденного черепа / кожи головы с последующим неограниченным вращением головы вокруг шеи, (2) отсутствие явной структурной черепно-мозговой травмы, отека, повреждения гематоэнцефалического барьера, острой гибели клеток или хронической потери мозговой ткани и (3) стойкого (до 1 года) когнитивного дефицита, который возникает только после многократных ударов19 (Рисунок 2).
Оценка мозгового кровотока с помощью диффузной корреляционной спектроскопии
Диффузная корреляционная спектроскопия (DCS) является неинвазивным оптическим методом, который измеряет кровоток 5,20,21. В DCS источник света ближнего инфракрасного диапазона помещается на поверхность ткани. Детектор размещается на фиксированном расстоянии от источника на поверхности ткани для обнаружения света, который многократно рассеян через ткань (рисунок 3). Рассеяние движущихся красных кровяных клеток приводит к тому, что обнаруженная интенсивность света колеблется со временем. Простая аналитическая модель, известная как теория корреляционной диффузии, используется для связи этих колебаний интенсивности с индексом кровотока (CBFi, рисунок 4). Хотя единицы CBFi (см2 /с) не являются традиционными единицами потока (мл / мин / 100 г), предыдущее исследование на мышах показало, что CBFi сильно коррелирует с мозговым кровотоком, измеренным артериальным спином, меченым МРТ21.
Для справки, используемый здесь прибор DCS был построен собственными силами и состоит из лазера когерентной длиной 852 нм, массива из 4 фотонных лавинных фотодиодов и аппаратной платы автокоррелятора (один тау, 8 каналов, минимальное время выборки 100 нс)21,22. Данные собираются с помощью самодельного программного обеспечения, написанного в LabView. Животный интерфейс для устройства состоит из многомодового исходного волокна 400 мкм (диапазон длин волн 400-2200 нм, чистый кремнеземный сердечник, жесткая оболочка TECS) и одномодового детекторного волокна 780 нм (диапазон длин волн 780-970 нм, чистый кремнеземный сердечник, жесткая оболочка TECS, отсечка режима 730 ± 30 нм секундного режима), расположенных на расстоянии 6 мм друг от друга и встроенных в черный 3D-печатный датчик (4 мм x 8 мм, Рисунок 3).
Количественная оценка нейровоспалительной среды
Хотя нейровоспаление регулируется различными клеточными процессами, двумя ключевыми соответствующими механизмами являются внеклеточная сигнализация цитокинами / хемокинами и внутриклеточная сигнализация фосфо-белками. Чтобы исследовать нейровоспалительную среду головного мозга после травмы, мозг извлекают из мышей, микрорассекают, а цитокины / хемокины и фосфо-белки количественно оцениваются с использованием Luminex (рисунок 5, рисунок 6, рисунок 7). Мультиплексированные иммуноанализы Luminex позволяют одновременно количественно оценивать разнообразную коллекцию этих белков путем соединения иммуноферментных анализов (ИФА) с флуоресцентно помеченными магнитными шариками. Для каждого интересующего белка используются различные флуоресцентные метки, а шарики каждой метки функционализируются антителом захвата против этого конкретного белка. Сотни шариков для захвата каждого белка смешиваются вместе, помещаются в пластину из 96 лунок и инкубируются с образцом. После инкубации образца магнит используется для улавливания шариков в скважине, в то время как образец вымывается. Затем биотинилированное детектирующее антитело связывается с анализируемым веществом, представляющим интерес, чтобы сформировать сэндвич антитело-антиген, похожий на традиционный ИФА, но с ИФА для каждого белка, встречающегося на другой флуоресцентно помеченной бусине. Добавление фикоэритрин-конъюгированного стрептавидина (SAPE) завершает каждую реакцию. Затем прибор Luminex считывает шарики и разделяет сигнал в соответствии с каждой флуоресцентной меткой / белком.
Интеграция данных
Из-за большого количества аналитов (например, цитокинов), измеренных в анализе Luminex, анализ данных может быть трудно интерпретировать, если каждый количественный белок анализируется индивидуально. Для упрощения анализа и фиксации тенденций, наблюдаемых среди аналитов, мы используем метод многомерного анализа, называемый частичной регрессией наименьших квадратов (PLSR, рисунок 8)23. PLSR работает, идентифицируя ось весов, соответствующих каждому измеренному белку (т. Е. Цитокины или фосфо-белки, называемые «предикторными переменными»), которые вместе оптимально объясняют кодисперсию измеренных белков с переменной ответа (например, мозговой кровоток). Веса называются «нагрузками» и собираются в вектор, известный как латентная переменная (LV). Проецируя (называемое «скорингом») измеренные белковые данные на каждом из двух LN, данные могут быть повторно построены в терминах этих LV. После вычисления PLSR мы используем вариамационное вращение для идентификации нового РН, который максимизирует ковариацию между проекциями выборки на LV и предикторной переменной24. Такой подход позволяет определить LV1 как ось, для которой лучше всего объяснить дисперсию переменной ответа. LV2 максимизирует кодисперсию между переменной отклика и остаточными данными LV1, которые могут быть связаны с биологической или технической изменчивостью между образцами. Наконец, мы проводим перекрестную проверку Leave One Out (LOOCV), чтобы убедиться, что модель PLSR не сильно зависит от какой-либо одной выборки23.
В этом протоколе мы подробно описываем методы характеристики нейровоспалительного и гемодинамического ответа тканей на mTBI. Общий рабочий процесс описан на рисунке 1. В этом протоколе мыши подвергаются воздействию одного или нескольких мТБИ с использованием модели закрытой травмы головы с пониженным падением веса. Мозговой кровоток измеряется продольно до и в несколько временных точек после травмы. В момент, представляющий интерес для опроса о нейровоспалительных изменениях, животное усыпляется, а мозг извлекается. Области мозга, представляющие интерес, выделяются с помощью микродиссекции, а затем лизируются для извлечения белка. Лизаты затем используются как для мультиплексированных иммуноанализов Luminex цитокиновой и фосфо-белковой экспрессии, так и для вестерн-блоттинга. Наконец, этот целостный набор данных интегрируется с использованием частичного регрессионного анализа наименьших квадратов.
протокол
Все процедуры для животных одобрены Институциональным комитетом по уходу за животными и их использованию Университета Эмори (IACUC) и соответствуют Руководящим принципам NIH по уходу и использованию лабораторных животных.
1. Модель снижения веса легкой черепно-мозговой травмы
- Подготовьте настройку снижения веса. Установите тиски на плоскую поверхность с помощью направляющей трубки длиной 1 м (внутренний диаметр 2,54 см), выровненной по вертикали (проверьте с помощью уровня). Используйте болт 54 г (основной диаметр корпуса 0,95 см, диаметр головки 2 см, длина 10,2 см).
- Кратко обезболивайте мышь. Индуцировать мышь 4,5% изофлурана в 100% кислороде в течение 45 секунд. Подтверждают достаточную глубину анестезии отсутствием реакции на защемление пальца ноги.
- Вызвать травму.
- Быстро выведите мышь из наркоза и поместите мышь лежа на центр тонкой мембраны (ткань 11,2 см х 21,3 см).
- Используйте обе руки, чтобы держать ткань подтянутой мышью, лежащей по центру. Закрепите хвост мыши под большим пальцем. Расположите головку мыши под направляющей трубкой (рисунок 2).
- Опустите болт с верхней части направляющей трубки на спинной аспект головы мыши, стремясь к удару между задней частью глаз и передней частью ушей. При ударе мышь проникнет в ткань, что позволит быстро ускорить движение головы вокруг шеи (рисунок 2).
- Выздоровление
- После удара поместите мышь лежа на согревательной подушке при температуре 37 °C в воздухе комнаты. Следите за восстановлением в течение 1 ч после травмы. В течение 1 ч мыши должны быть в состоянии нормально амбулировать, находить пищу и воду и не проявлять грубого двигательного дефицита.
ПРИМЕЧАНИЕ: Анальгезия не используется по одобрению Институционального комитета по уходу за животными и их использованию, что оправдано из-за смешанного влияния анальгезии на интересующие параметры (т.е. мозговой кровоток, маркеры воспаления). Потеря сознания, определяемая как время от снятия с анестезии до времени восстановления рефлекса, ожидается и обычно длится от 20 с до 3 минут (дополнительная таблица 1). Могут наблюдаться короткие (<30 с) эпизоды апноэ и / или судорожной активности, особенно после повторяющихся травм головы, расположенных один раз в день.
- После удара поместите мышь лежа на согревательной подушке при температуре 37 °C в воздухе комнаты. Следите за восстановлением в течение 1 ч после травмы. В течение 1 ч мыши должны быть в состоянии нормально амбулировать, находить пищу и воду и не проявлять грубого двигательного дефицита.
- Повторите по мере необходимости. Эта травма может повторяться один раз в день, еженедельно или ежемесячно. Количество и расстояние между травмами зависят от желаемой тяжести травмы. Как правило, мы используем пять ударов с интервалом один раз в день, чтобы вызвать устойчивый дефицит пространственного обучения и памяти.
ПРИМЕЧАНИЕ: Предыдущие исследования показали, что пяти ударов, расположенных один раз в день, достаточно, чтобы вызвать дефицит пространственного обучения и памяти, длящийся более 1 года после травмы, без отека, кровоизлияния или открытой структурной травмы головного мозга19. Мышей ежедневно взвешивают и тщательно контролируют на наличие признаков обезвоживания, двигательного дефицита и потери аппетита. При обезвоживании мышам дают влажный чау-чау и подкожную инъекцию 1 мл физиологического раствора один раз в день. Чтобы предотвратить ненужные страдания и обеспечить гуманную конечную точку, мышей усыпляют, если: обезвоживание сохраняется или ухудшается >24 ч после подкожного физиологического лечения, масса тела снижается более чем на 20% от исходного уровня до травмы, двигательные дефициты, такие как кружение или перетаскивание лап, появляются и сохраняются >1 ч после травмы.
2. Оценка мозгового кровотока с помощью диффузной корреляционной спектроскопии
- Сбор данных DCS
- Удалить волосы на коже головы. Поскольку DCS лучше всего работает при отсутствии волос, необходимо удалить мех на голове до начала экспериментов. Как правило, эпиляцию делают за 1-3 дня до начала исследования.
- Индуцировать у мышей 4,5% изофлурана в 100% кислороде в течение 45 секунд и поддерживать 1-2% изофлураном в 100% кислороде.
- Побрить голову между глазами и ушами. Затем используйте крем для депиляции, чтобы удалить мех на голове, как показано на рисунке 3.
- Дайте животному восстановиться после анестезии на согревающей подушке, а затем вернитесь в клетку.
- Измерьте мозговой кровоток с помощью DCS. Чтобы свести к минимуму артефакты движения во время измерения, исследуйте мышей под кратковременной изофлурановой анестезией.
ПРИМЕЧАНИЕ: Визуально контролируйте дыхание и реакцию на защемление пальцев ног на протяжении всех измерений и регулируйте концентрацию изофлурана по мере необходимости для обеспечения постоянной глубины анестезии. Значительные изменения глубины анестезии могут изменить кровоток, учитывая известные вазомодулирующие эффекты изофлурана25.- Индуцировать 4,5% изофлурана в 100% кислороде в течение 45 секунд, а затем поддерживать 1,0-1,75% изофлурана в 100% кислороде. Подтвердите достаточную глубину анестезии отсутствием реакции на защемление пальца ноги и нормальным дыханием (между ~60-80 вдохами в минуту).
- После 2-минутного периода стабилизации осторожно уложите датчик DCS на правое полушарие таким образом, чтобы верхний край оптического датчика выровнялся с задней частью глаза, а сторона датчика выровнялась вдоль средней линии (рисунок 3). Поднимите руку на датчик, чтобы защититься от комнатного света. Получение данных за 5 секунд (1 Гц).
- Переместите датчик над левым полушарием и получите 5 секунд данных.
- Повторите 3 раза / полушарие, чтобы учесть локальные неоднородности под поверхностью ткани.
- Выздоровление
- Выньте мышь из наркоза и поместите на согревающую прокладку.
- После того, как мышь восстановит свой правый рефлекс, верните ее в клетку.
- Удалить волосы на коже головы. Поскольку DCS лучше всего работает при отсутствии волос, необходимо удалить мех на голове до начала экспериментов. Как правило, эпиляцию делают за 1-3 дня до начала исследования.
- Анализ данных DCS
- Выполните первоначальный контроль качества. Каждый кадр данных DCS состоит из измеренной нормированной функции
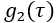 автокорреляции интенсивности (рисунок 4A) и скорости подсчета фотонов (кГц).
автокорреляции интенсивности (рисунок 4A) и скорости подсчета фотонов (кГц).- Чтобы удалить кадры данных со значительным артефактом движения, отбросьте кадры данных,
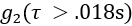 для которых среднее значение хвоста кривой
для которых среднее значение хвоста кривой 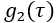 (т.е. ) составляет > 1,005.
(т.е. ) составляет > 1,005. - Чтобы удалить кадры данных с плохим отношением сигнал/шум, откажитесь от кадров данных, если скорость обнаружения фотонов составляет < 20 кГц.
- Чтобы удалить кадры данных со значительным артефактом движения, отбросьте кадры данных,
- Экстракт индекса мозгового кровотока. Используя fminsearch в Matlab, поместите каждыйi-й измеренный кадр
 данных для CBFi(i). Ограничьте соответствия
данных для CBFi(i). Ограничьте соответствия 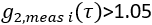 , и найдите значение CBFi , которое минимизирует следующую функцию затрат:
, и найдите значение CBFi , которое минимизирует следующую функцию затрат: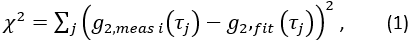
Где сумма находится над всеми измеренными временами задержки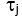 и
и 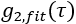 является полубесконечным однородным решением уравнения корреляционной диффузии (рисунок 4B):
является полубесконечным однородным решением уравнения корреляционной диффузии (рисунок 4B):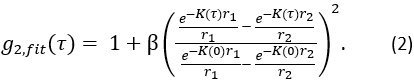
Здесь β — фактор когерентности, определяемый экспериментальной установкой,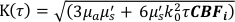 ,
, 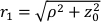 ,
, 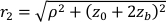
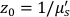 ,
, 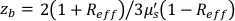 Reff = 0,493 для предполагаемого тканевого показателя преломления 1,4, ρ составляет 6 мм, а μa и μ — коэффициент поглощения и пониженного рассеяния ткани (предполагается, что он равен 0,25 и 9,4/см соответственно 10,26,27).
Reff = 0,493 для предполагаемого тканевого показателя преломления 1,4, ρ составляет 6 мм, а μa и μ — коэффициент поглощения и пониженного рассеяния ткани (предполагается, что он равен 0,25 и 9,4/см соответственно 10,26,27).
ПРИМЕЧАНИЕ: Поскольку β может варьироваться ~ 10% с течением времени, установите каждый кадр данных для β и CBFi одновременно. - Выполняйте вторичный контроль качества. В каждом повторении (которое состоит из 5 фреймов данных) отбрасывайте выбросы. Выбросы определяются как те значения CBFi , которые выходят за пределы 1,5 стандартных отклонений среднего CBFi для этого повторения. Если более 1 точки данных идентифицировано как выброс, отбросьте все повторение.
- Оценка среднего индекса мозгового кровотока: Оцените средний CBFi на полушарие, взяв среднее значение по всем кадрам данных для всех повторений (рисунок 4C). Если существенных различий в масштабах полушария не наблюдается, усредните по полушариям, чтобы получить оценку среднего глобального CBFi.
- Выполните первоначальный контроль качества. Каждый кадр данных DCS состоит из измеренной нормированной функции
3. Мультиплексированная количественная оценка цитокинов и фосфопротеинов с использованием анализов luminex
- Извлечение тканей
ПРИМЕЧАНИЕ: Количественная оценка цитокинов мозга и фосфо-сигнальных белков с использованием Luminex требует экстракции ткани.- Обезболить мышь с использованием 4,5% изофлурана в 100% кислороде в течение 1-2 мин. Проверьте наличие глубокой плоскости анестезии из-за отсутствия реакции на защемление пальца ноги. Усыпление путем обезглавливания.
- Заготовьте ткань.
- Удалите мозг. Как правило, фиксируют левое полушарие для гистологии и микрорассекают несколько областей от правого полушария в пределах коры и гиппокампа (рисунок 5).
- Поместите рассеченные образцы в микроцентрифужные трубки, мгновенно заморозьте в жидком азоте. Для анализа чувствительных к замораживанию белков оптимально подразделять участки ткани перед мгновенным замораживанием, чтобы избежать последующего замораживания-оттаивания.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен, и образцы тканей могут храниться при -80 °C до тех пор, пока они не будут готовы к лизированию образцов. Альтернативно, образцы могут быть лизированы, а затем сохранены при -80 °C.
- Образцы лиза.
- Готовят буфер лизиса, добавляя ингибитор протеазы и 2 мМ фенилметилсульфонилфторида в буфер лизиса.
- Добавьте 150 мкл смешанного буфера лизиса примерно на 3 мкг ткани животных. Для справки, образцы ткани зрительной коры головного мозга мыши составляют примерно 3 мкг.
- Чтобы гомогенизировать ткань, механически тритурируйте ткань путем пипетирования вверх и вниз ~ 15-20 раз с использованием пипетки 1000 мкл. Для оптимальной тритурации образцов может быть использован гомогенизатор пестика.
- Поместите пробирки на ротатор на 30 мин при 4°C.
- Центрифугируйте образцы при 4°C в течение 10 мин при приблизительно 15 000 х г и соберите супернатант. Образцы могут быть немедленно обработаны или сохранены при -80°C для дальнейшего анализа.
ПРИМЕЧАНИЕ: Образцы лизатов, приготовленные с использованием этого протокола, совместимы с вестерн-блоттингом, из которого фагоцитарный/микроглиальный маркер Iba1 и/или маркер активации астроцитов GFAP могут быть проанализированы для дополнения анализа цитокинов и фосфобелков для исследований нейровоспаления11.
- Протокол мультиплексного иммуноанализа на цитокины и фосфобенины
ПРИМЕЧАНИЕ: Несмотря на сходство в целом, существуют некоторые незначительные различия в протоколах для наборов цитокинов и фосфобелков. Различия отмечаются на каждом этапе. Этапы подготовки образцов для анализа Luminex описаны ниже.- Приготовление реагентов (день 1, то же самое для цитокинов и фосфопротеинов)
- Дайте реагентам нагреться до комнатной температуры (~30 мин).
- Ультразвуковые мультиплексные магнитные шарики бутылки в течение 30 секунд с последующим 1 минутой вихря. Убедитесь, что мультиплексные магнитные шарики защищены от света алюминиевой фольгой или используйте предоставленные легкие защитные бутылки.
- Подготовьте буфер для стирки, перемешав 0,1% Tween20 в 1xPBS или в качестве альтернативы используйте буфер для стирки, поставляемый в комплекте.
- Подготовка лизированных образцов тканей (день 1, то же самое для цитокинов и фосфо-белков)
- При предварительной заморозке извлеките образцы лизированных тканей из морозильной камеры и дайте оттаять на льду (~20 мин). Центрифужные образцы в течение 10 мин при 9,167 х г для удаления осадка.
- Готовят 25 мкл образца при оптимальной концентрации белка, определяемой линейным диапазонным анализом (см. раздел 3.3). Чтобы нормализовать общий объем для всех образцов, разбавьте образцы в буфере анализа, предусмотренном в комплекте.
- Приготовление 96 луночной пластины (день 1, то же самое для цитокинов и фосфо-белков)
- Используйте пластину из 96 скважин, входящую в комплект, или пластину с тонким дном (например, Brand Tech).
- Добавьте 200 мкл промывочного буфера (или 1x PBS, 0,1% анимации) в каждую лунку и перемешайте на шейкере в течение 10 минут при 750 об/мин.
- Декант промыть буфер и постучать пластиной по бумажному полотенцу, чтобы удалить остатки.
- Процедура иммуноанализа на цитокины (день 1)
- Добавьте следующее к каждой скважине по порядку.
- Добавьте 25 мкл пробирного буфера во все скважины.
- Добавьте 25 мкл дополнительного буфера анализа ТОЛЬКО в фоновые скважины. Для каждого экспериментального запуска есть по крайней мере две фоновые скважины. Фоновые скважины не имеют загруженного образца и определяют интенсивность флуоресценции, считываемую прибором без образца.
- Добавьте 25 мкл каждого разбавленного образца в соответствующие пробоотборные скважины.
- Добавьте 25 мкл 1x мультиплексных магнитных шариков ко всем скважинам (рисунок 6). Обязательно вихревые шарики в течение 1 мин перед добавлением в лунки.
- Добавьте 25 мкл пробирного буфера во все скважины.
- Уплотните пластину с помощью пластинчатого герметика и покройте пластину алюминиевой фольгой. Инкубировать в течение ночи (12-16 ч) при 2-8 °C.
- Добавьте следующее к каждой скважине по порядку.
- Процедура иммуноанализа на цитокины (2 день)
- Поместите пластину 96 скважин на магнитный сепаратор, убедившись, что скважины выровнены с магнитами. Дать постоять 2 мин. Декантируйте содержимое скважины, пока пластина еще прикреплена к магнитному сепаратору.
- Помойте тарелку 2 раза, выполнив следующие действия.
- Добавьте 200 мкл промывочного буфера в каждую лунку и поместите на шейкер на 2 мин при комнатной температуре.
- Поместите пластину скважины на магнитный сепаратор на 2 мин при комнатной температуре.
- Декантируйте содержимое скважины, в то время как пластина скважины все еще прикреплена к магнитному сепаратору.
- Добавьте 25 мкл детектирующего антитела на лунку (рисунок 6). Накрыть фольгой. Инкубировать в течение 1 часа на пластинчатом шейкере (750 об/мин) при комнатной температуре.
- Оставьте антитело для обнаружения и добавьте 25 мкл стрептавидина-фикоэритрина (SAPE) в каждую лунку (рисунок 6). Накрыть фольгой. Инкубировать в течение 30 мин на пластинчатом шейкере (750 об/мин) при комнатной температуре.
- Поместите пластину колодца на магнитный сепаратор и оставьте на 2 мин. Декантировать содержимое скважины и отсоединять от магнитного сепаратора.
- Промыть плиту колодца два раза (см. шаг 3.2.5.2).
- Добавьте 75 мкл приводной жидкости Luminex (при использовании прибора MAGPIX) в каждую скважину или буфер анализа (если используется прибор 200 или FlexMap 3D). Повторно суспендировать шарики на шейкере пластин в течение 5 мин при комнатной температуре.
- Читайте на Luminex Instrument (MAGPIX, 200 или FlexMap 3D), ссылаясь на руководство пользователя для правильной работы (рисунок 6).
- Процедура иммуноанализа на фосфопротеины (день 1)
- Добавьте следующее к каждой скважине по порядку.
- Добавьте 25 мкл пробирного буфера во все скважины.
- Добавьте 25 мкл дополнительного буфера анализа ТОЛЬКО в фоновые скважины. Для каждого экспериментального запуска рекомендуется иметь не менее двух фоновых скважин. Фоновые скважины не имеют загруженного образца и определяют интенсивность флуоресценции, считываемую прибором без образца.
- Добавьте 25 мкл каждого разбавленного образца в каждую пробную скважину.
- Добавьте 25 мкл 1x мультиплексных магнитных шариков ко всем скважинам (рисунок 6).
ПРИМЕЧАНИЕ: Набор для анализа Luminex обеспечивает мультиплексную магнитную бусину в 20-кратном стоковом растворе. Обязательно вихрево 20x запас мультиплексного магнитного шарика раствора в течение 2 мин, а затем разбавьте его в буфере анализа до 1x раствора. Вихревая 1x мультиплексная магнитная шариковая суспензия в течение 1 мин перед добавлением в скважины.
- Уплотните пластину с помощью пластинчатого герметика и покройте пластину алюминиевой фольгой. Инкубировать на ночь (12-16 часов) при 2-8 °C.
- Добавьте 25 мкл пробирного буфера во все скважины.
- Добавьте следующее к каждой скважине по порядку.
- Процедура иммуноанализа на фосфопротеины (день 2)
- Поместите пластину скважины на магнитный сепаратор, убедившись, что пластина скважины полностью выровнена с магнитным сепаратором. Дать постоять 2 мин. Декантируйте содержимое скважины, в то время как пластина скважины все еще прикреплена к магнитному сепаратору.
- Промойте пластину 2 раза (см. шаг b в процедуре иммуноанализа цитокинов на 2-й день).
- Разбавьте 20-кратное антитело для обнаружения запасов до 1x раствора в буфере анализа. Добавьте 25 мкл 1x антитела обнаружения на лунку (рисунок 6). Накрыть фольгой. Инкубировать в течение 1 ч на пластинчатом шейкере (750 об/мин) при комнатной температуре.
- Поместите пластину из 96 лунок на магнитный сепаратор и оставьте на 2 мин. Декантировать содержимое скважины, отсоединить от магнитного сепаратора.
- Разбавьте 25-кратный запас SAPE в буфере анализа до 1x буфера. Добавьте 25 мкл 1x SAPE (рисунок 6). Накрыть фольгой и инкубировать в течение 15 мин на пластинчатом шейкере (750 об/мин) при комнатной температуре.
- Оставьте SAPE в скважинах и добавьте 25 мкл буфера амплификации в каждую скважину. Накрыть фольгой.
- Инкубировать в течение 15 мин на пластинчатом шейкере (750 об/мин) при комнатной температуре.
- Поместите пластину скважины на магнитный сепаратор на 2 мин. Декантировать содержимое скважины и отсоединять от магнитного сепаратора.
- Добавьте 75 мкл приводной жидкости Luminex (при использовании прибора MAGPIX) или буфер анализа (при использовании прибора 200 или FlexMap 3D). Повторно суспендируйте бусины на шейкере пластин в течение 5 мин при комнатной температуре.
- Читайте на приборе Luminex (MAGPIX, 200 или FlexMap 3D), ссылаясь на руководство пользователя для правильной работы (рисунок 6).
- Приготовление реагентов (день 1, то же самое для цитокинов и фосфопротеинов)
- Кривая линейности разбавления пробы
- Подготовка образцов: Серийно разбавляйте тестовые образцы с различной концентрацией общего белка. Для объемных тканей головного мозга нагрузите последовательные разведения от 0-25 мкг для цитокинов и 0-12 мкг для фосфо-белков. Общая концентрация белка может быть измерена с помощью анализа бицинхониновой кислоты (BCA).
- Мультиплексный иммуноанализ: Выполните анализ Luminex (см. раздел 3.2) на выбранных образцах.
- Анализ данных
- График флуоресцентной интенсивности для каждого белка по сравнению с количеством загруженного белка (рисунок 7).
- Для каждого анализируемого вещества определите диапазон общего загруженного белка, для которого соотношение между общим белком и считыванием интенсивности флуоресцентности является линейным (рисунок 7).
- Чтобы определить количество общего белка, которое должно быть загружено для полного прогона анализа, определите линейную часть кривой для каждого анализируемого вещества, а затем выберите концентрацию белка, которая попадает в линейный диапазон для большинства аналитов.
ПРИМЕЧАНИЕ: Хотя большинство белков имеют сходный линейный диапазон, линейные диапазоны могут не перекрываться для всех белков. Если это так, может потребоваться запустить каждый образец несколько раз с различным количеством загруженного общего белка. В качестве альтернативы, нелинейные образцы могут быть исключены из анализа. Кроме того, некоторые белки могут вообще не иметь линейного диапазона.
4. Частичная регрессия наименьших квадратов
ПРИМЕЧАНИЕ: Пример кода R и образец электронной таблицы данных предоставляются для проведения частичного анализа наименьших квадратов.
- Подготовка данных: отформатируйте данные, как показано в предоставленном образце электронной таблицы данных "MyData". Включите имена переменных в строку 1, имена образцов в столбце A, переменную ответа в столбце B и все переменные предиктора в столбцы C+. Заполните последние две строки фоновыми данными и задайте для обоих образцов имя "Фон".
- Частичная регрессия наименьших квадратов в RStudio
- Установите R с www.r-project.org (бесплатно, с открытым исходным кодом).
- Установите RStudio Desktop с www.rstudio.com (бесплатная лицензия с открытым исходным кодом).
- Загрузите образец кода R, поставляемый с этой публикацией, "PLSR_Sample_Code.R", и сохраните его в той же папке, которая содержит электронную таблицу данных. Откройте файл кода в RStudio.
- В разделе Пользовательский ввод измените "dataFileName" на имя электронной таблицы данных.
- Выполните следующие действия, выделив раздел выполняемого кода и щелкнув Выполнить в правом верхнем углу сценария.
- Загрузите необходимые R-пакеты, функции, адрес рабочего каталога и значения пользовательского ввода в RStudio (подраздел "Предварительные настройки").
- Загрузите данные в RStudio и подготовьте необработанные данные для обработки, вычитая средний фоновый сигнал из всех измерений и z-оценки каждого анализируемого (подраздел «Чтение данных и вычитание фона») (рисунок 8A).
- Выполните частичную регрессию наименьших квадратов в RStudio с помощью пакета plsRglm v1.2.528 , доступного в Comprehensive R Archive Network (CRAN). Выполните вариамационное вращение (пакет статистики v3.6.2)23 в плоскости LV1-LV2, чтобы определить новую горизонтальную ось, которая лучше всего разделяет образцы по переменной отклика (подраздел "PLS") (рисунок 8B).
- Проведите перекрестную проверку (LOOCV), в которой один образец итеративно исключается из данных, а модель PLSR пересчитывается. Вычисление стандартного отклонения для загрузки анализируемого вещества во всех прогонах LOOCV (подраздел "LOOCV").
- Создание репрезентативных участков: Запустите предоставленный пример кода, как описано выше, чтобы создать репрезентативные графики, которые автоматически экспортируются в виде pdf-файлов в рабочий каталог (папку, содержащую файлы данных и кода).
- Создайте тепловую карту обработанных данных, как показано на рисунке 8A (подраздел "PLS"). Окрасьте каждую запись по спектру, определяемому z-оценкой. Сортируйте аналиты по порядку, вычисленному в латентной переменной интереса.
- Создайте график оценок с оценками LV1, построенными вдоль горизонтальной оси, и оценками LV2, построенными вдоль вертикальной оси, как показано на рисунке 8B (подраздел "PLS"). Раскрасьте каждую точку данных в соответствии с ее измерением переменной отклика, чтобы визуализировать связь между каждой скрытой переменной и переменной ответа.
- Создайте гистограмму, отображающую нагрузки для каждой из ваших предикторных переменных, чтобы визуализировать, как каждый анализируемый вносит вклад в латентные переменные, как показано на рисунке 8C (подраздел «LOOCV»).
- Создайте график, регрессирующий оценки LV1 по отношению к переменной ответа, чтобы визуализировать, насколько хорошо модель PLSR разделяет выборки, как показано на рисунке 8D (подраздел "PLS").
Результаты
Ранее собранные данные были взяты из предыдущей работы, в которой группа из восьми мышей C57BL/6 подвергалась трем закрытым травмам головы (рисунок 2), расположенным один раз в день11. В этой работе мозговой кровоток измеряли с помощью диффузной корреляционной с...
Обсуждение
Здесь мы подробно описываем методы оценки гемодинамической и нейровоспалительной реакции на повторяющуюся легкую черепно-мозговую травму. Кроме того, мы показали, как интегрировать эти данные в рамках многомерного системного анализа с использованием частичной регрессии наименьших ?...
Раскрытие информации
Никакой.
Благодарности
Этот проект был поддержан Национальными институтами здравоохранения R21 NS104801 (EMB) и R01 NS115994 (LBW / EB) и детской медицинской премией Атланты Junior Faculty Focused Award (EMB). Эта работа также была поддержана Министерством обороны США через программы медицинских исследований, направляемые Конгрессом под номером премии. W81XWH-18-1-0669 (LBW/EMB). Мнения, интерпретации, выводы и рекомендации принадлежат автору и не обязательно одобряются Министерством обороны. Этот материал основан на работе, поддерживаемой Программой стипендий для аспирантов Национального научного фонда в рамках гранта No 1937971. Любые мнения, выводы, выводы или рекомендации, выраженные в этом материале, принадлежат авторам и не обязательно отражают взгляды Национального научного фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| Adjustable pipettes | any adjustable pipette | ||
| Aluminum foil | VWR | 89107-726 | |
| Bio-Plex cell lysis kit | C Bio-Rad | 171304012 | |
| BRAND BRANDplates pureGrade Microplates, Nonsterile | BrandTech | 781602 96 | |
| Complete mini protease inhibitor tablet | Sigma-Aldrich | 11836153001 | |
| Depilatory cream | Amazon | Nair | |
| DiH2O | VWR | VWRL0200-1000 | |
| Handheld magnetic separator block for 96 well flat bottom plates | Millipore Sigma Catalogue | 40-285 | |
| Hardware Autocorrelator Board | www.correlator.com | Flex05-8ch | |
| Isoflurane 250 mL | MED-VET INTERNATIONAL | RXISO-250 | |
| Kimwipe (11.2 x 21.3 cm) | VWR | 21905-026 | |
| Laboratory vortex mixer | VWR | 10153-838 | |
| LabView | National Instruments | LabVIEW | |
| Luminex 200, HTS, FLEXMAP 3D, or MAGPIX with xPONENT software | Luminex Corporation | ||
| Luminex Drive Fluid | Luminex | MPXDF-4PK | |
| Luminex sheath fluid | EMD Millipore | SHEATHFLUID | |
| MILLIPLEX MAP Mouse Cytokine/Chemokine Magnetic Bead Panel - Premixed 32 Plex - Immunology Multiplex Assay | Millipore Sigma | MCYTMAG-70K-PX32 | |
| MILLIPLEX MAPK/SAPK Signaling 10-Plex Kit-Cell Signaling Multiplex Assay | Millipore Sigma | 48-660MAG | |
| Mini LabRoller rotator | VWR | 10136-084 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626-1G | |
| Phosphate-buffered Saline (PBS) | VWR | 97064-158 | |
| Plate Sealer | VWR | 82050-992 | |
| Polypropylene microfuge tubes | VWR | 20901-547 | |
| Mini LabRoller | Millipore Sigma | Z674591 | |
| Reagent Reservoirs | VWR | 89094-668 | |
| R Programming Language | |||
| RStudio | www.rstudio.com | ||
| Sonicator | |||
| Titer plate shaker | VWR | 12620-926 | |
| Tween20 | Sigma-Aldrich | P9416-50ML | |
| 1 m acrylic guide tube | McMaster-Carr | 49035K85 | |
| 4 photon counting avalanche photodiode | Perkin-Elmer | SPCM-AQ4C-IO | |
| 400 um multimode source fiber | Thorlabs Inc. | FT-400-EMT | |
| 54 g bolt | Ace Hardware | 0.95 cm basic body diameter, 2 cm head diameter, 10.2 cm length | |
| 780 nm single mode detector fiber | Thorlabs Inc. | 780HP | |
| 852 nm long-coherence length laser | TOPTICA Photonics | iBeam smart |
Ссылки
- Langlois, J. A., Rutland-Brown, W., Wald, M. M. The epidemiology and impact of traumatic brain injury: a brief overview. Journal of Head Trauma Rehabilitation. 21 (5), 375-378 (2006).
- Iraji, A., et al. Resting State Functional Connectivity in Mild Traumatic Brain Injury at the Acute Stage: Independent Component and Seed-Based Analyses. Journal of Neurotrauma. 32 (14), 1031-1045 (2015).
- Guskiewicz, K. M., et al. Cumulative effects associated with recurrent concussion in collegiate football players: the NCAA Concussion Study. Journal of the American Medical Association. 290 (19), 2549-2555 (2003).
- Longhi, L., et al. Temporal window of vulnerability to repetitive experimental concussive brain injury. Neurosurgery. 56 (2), 364-374 (2005).
- Committee on Sports-Related Concussions in Youth, Board on Children, Youth, and Families, Institute of Medicine, National Research Council. . Sports-Related Concussions in Youth: Improving the Science, Changing the Culture. , (2014).
- Barkhoudarian, G., Hovda, D. A., Giza, C. C. The Molecular Pathophysiology of Concussive Brain Injury - an Update. Physical Medicine and Rehabilitation Clinics of North America. 27 (2), 373-393 (2016).
- McCrory, P., et al. Consensus statement on concussion in sport--the 4th International Conference on Concussion in Sport held in Zurich, November 2012. Clinical Journal of Sport Medicine. 23 (2), 89-117 (2012).
- Belanger, H. G., Vanderploeg, R. D., Curtiss, G., Warden, D. L. Recent neuroimaging techniques in mild traumatic brain injury. Journal of Neuropsychiatry and Clinical Neurosciences. 19 (1), 5-20 (2007).
- Sours, C., Zhuo, J., Roys, S., Shanmuganathan, K., Gullapalli, R. P. Disruptions in Resting State Functional Connectivity and Cerebral Blood Flow in Mild Traumatic Brain Injury Patients. PLoS ONE. 10 (8), 0134019 (2015).
- Buckley, E. M., et al. Decreased Microvascular Cerebral Blood Flow Assessed by Diffuse Correlation Spectroscopy after Repetitive Concussions in Mice. Journal of Cerebral Blood Flow & Metabolism. 35 (12), 1995-2000 (2015).
- Sankar, S. B., et al. Low cerebral blood flow is a non-invasive biomarker of neuroinflammation after repetitive mild traumatic brain injury. Neurobiology of Disease. 124, 544-554 (2019).
- Vagnozzi, R., et al. Temporal window of metabolic brain vulnerability to concussions: mitochondrial-related impairment--part I. Neurosurgery. 61, 379-388 (2007).
- Longhi, L., et al. Temporal window of vulnerability to repetitive experimental concussive brain injury. Neurosurgery. 56, 364-374 (2005).
- Fujita, M., Wei, E. P., Povlishock, J. T. Intensity- and interval-specific repetitive traumatic brain injury can evoke both axonal and microvascular damage. Journal of Neurotrauma. 29, 2172-2180 (2012).
- Angoa-Perez, M., et al. Animal models of sports-related head injury: bridging the gap between preclinical research and clinical reality. Journal of Neurochemistry. 129, 916-931 (2014).
- Prins, M. L., Hales, A., Reger, M., Giza, C. C., Hovda, D. A. Repeat traumatic brain injury in the juvenile rat is associated with increased axonal injury and cognitive impairments. Developmental Neuroscience. 32, 510-518 (2010).
- Viano, D. C., Hamberger, A., Bolouri, H., Saljo, A. Concussion in professional football: animal model of brain injury--part 15. Neurosurgery. 64, 1162-1173 (2009).
- Kane, M. J., et al. A mouse model of human repetitive mild traumatic brain injury. Journal of Neuroscience Methods. 203, 41-49 (2012).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing Recovery Time Between Injuries Improves Cognitive Outcome After Repetitive Mild Concussive Brain Injuries in Mice. Neurosurgery. 71 (4), 885-892 (2012).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. NeuroImage. 85, 51-63 (2014).
- Sathialingam, E., et al. Small separation diffuse correlation spectroscopy for measurement of cerebral blood flow in rodents. Biomedical Optics Express. 9 (11), 5719 (2018).
- Lee, S. Y., et al. Noninvasive optical assessment of resting-state cerebral blood flow in children with sickle cell disease. Neurophotonics. 6 (03), 1 (2019).
- Wang, H., Liu, Q., Tu, Y. Interpretation of partial least-squares regression models with VARIMAX rotation. Partial Least Squares. 48 (1), 207-219 (2005).
- Eriksson, L., Byrne, T., Johansson, E., Trygg, J., Vikström, C. Multi- and Megavariate Data Analysis Basic Principles and Applications. Umetrics Academy. , (2013).
- Conzen, P. F., et al. Systemic and regional hemodynamics of isoflurane and sevoflurane in rats. Anesthesia and Analgesia. 74 (1), 79-88 (1992).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Lee, S. Y., et al. Small separation frequency-domain near-infrared spectroscopy for the recovery of tissue optical properties at millimeter depths. Biomedical Optics Express. 10 (10), 5362-5377 (2019).
- . plsRglm: Partial Least Squares Regression for Generalized Linear Models Available from: https://CRAN.R-project.org/package=pplsRglm (2019)
- White, B. R., Bauer, A. Q., Snyder, A. Z., Schlaggar, B. L., Lee, J. M., Culver, J. P. Imaging of functional connectivity in the mouse brain. PLoS One. 6, 16322 (2011).
- Buckley, E. M., Parthasarathy, A. B., Grant, P. E., Yodh, A. G., Franceschini, M. A. Diffuse correlation spectroscopy for measurement of cerebral blood flow: future prospects. Neurophotonics. 1 (1), 011009 (2014).
- Rowan, O., et al. Cerebrovascular reactivity measured in awake mice using diffuse correlation spectroscopy. Neurophotonics. 8 (1), (2021).
- Tate, J., Ward, G. Interferences in immunoassay. The Clinical Biochemist. Reviews. 25 (2), 105-120 (2004).
- Staples, E., Ingram, R. J. M., Atherton, J. C., Robinson, K. Optimising the quantification of cytokines present at low concentrations in small human mucosal tissue samples using Luminex assays. Journal of Immunological Methods. 394 (1-2), 1-9 (2013).
- Gierut, J. J., et al. Network-level effects of kinase inhibitors modulate TNF-α-induced apoptosis in the intestinal epithelium. Science Signaling. 8 (407), 129 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены