Method Article
点变异荧光相关光谱用于分析活细胞质膜上的分子扩散
* 这些作者具有相同的贡献
摘要
本文旨在提出一种关于如何构建点变异荧光相关光谱(svFCS)显微镜以测量活细胞质膜处分子扩散的协议。
摘要
活细胞中的动态生物过程,包括与质膜组织相关的过程,分别发生在各种空间和时间尺度上,从纳米到微米,从微秒到几分钟。如此广泛的生物过程对传统的显微镜方法提出了挑战。在这里,我们详细介绍了使用定制的经典荧光显微镜实施点变异荧光相关光谱(svFCS)测量的过程。该协议包括svFCS设置的特定性能检查以及svFCS在生理条件下对活细胞质膜进行分子扩散测量的指南。此外,我们还提供了通过胆固醇氧化酶处理破坏质膜筏纳米结构域的程序,并演示了质膜横向组织的这些变化如何通过svFCS分析揭示。总之,这种基于荧光的方法能够以适当的空间和时间分辨率提供有关质膜横向组织的前所未有的细节。
引言
质膜组织的复杂性
目前对细胞膜组织的理解必须考虑几个方面1。首先,复杂的脂质组成不仅在细胞类型之间变化,而且在单个细胞(膜细胞器/质膜)内也不同。此外,相关或内在膜蛋白大多组织在动态多聚体复合物中,大结构域延伸到膜外,比单独的跨膜结构域的面积大得多。此外,膜相关蛋白表现出特定的脂质结合或脂质相互作用能力,在调节蛋白质功能中起作用。这些直接取决于脂质的局部组成和可及性2。
最后,由于膜蛋白的固有不对称结构和脂质的分布,在两个膜小叶之间观察到显着的不对称水平。事实上,合成和水解之间的脂质代谢平衡,结合小叶之间的脂质翻转,产生诸如不对称分布。由于穿过双层的任何传输都受到通过膜的疏水性内部移动极性头基团所需的自由能的约束,因此通常由选择性转运蛋白辅助。对于每种细胞类型,不对称性往往得到牢固的维持。总之,这些因素促成质膜3,4的横向不均匀性或区室化。
我们通过考虑双层内部和整个双层的固有分子扩散来丰富质膜的这种表示,这有助于在十分之一到数百纳米和微秒到秒的范围内动态横向非均质性。例如,脂质依赖性膜纳米域 - 所谓的脂质筏,定义为胆固醇和富含鞘脂的信号平台 - 有助于质膜的区室化5,6。然而,目前关于膜组织的观点并不仅限于脂筏。膜纳米结构域在组成,起源和功能上更加复杂和异质。尽管如此,它们在质膜上的存在必须紧密协调,蛋白质和脂质之间的动态相互作用似乎在膜纳米域1,3,7,8的空间分布和化学修饰中很重要。
svFCS原理及其在探测质膜组织的应用
尽管主要通过生物物理技术在膜结构域分析方面取得了很大进展,但需要用适当的空间和时间分辨率来细化决定质膜局部组织的决定因素。基于跟踪单个分子的行列式提供了出色的空间精度,并允许表征不同的运动模式9,10,11,12,但具有有限的时间分辨率和经典的低相机帧速率,并且需要更多的实验工作来记录大量轨迹。或者,膜组分的扩散系数可以通过光漂白后的荧光恢复(FRAP)13 或荧光相关光谱(FCS)14来评估。后者受到更多的关注,主要是因为其灵敏度和选择性高,显微检测体积大,侵入性低,动态范围宽15。
FCS的概念基础是由Magde及其同事在大约50年前16,17年引入的。它基于以高时间分辨率(从μs到s)记录荧光发射的波动18。在其现代版本中,活细胞的测量是通过位于感兴趣区域(例如,在质膜处)内的小共聚焦激发体积(〜0.3飞升)进行的;通过扩散进出观察体积的荧光分子产生的荧光信号以非常高的时间分辨率(即每个光子到达探测器的时间)收集。然后,计算信号以生成自相关函数(ACF),从中提取分子停留在焦点体积内的平均时间td (扩散时间),以及观察体积中存在的粒子的平均数量(N),这与ACF的振幅成反比。最后一个参数可能是关于观察体积内分子浓度的有用信息。
从那时起,由于生物光子学仪器的快速发展,越来越多的食品接触物质模式已经实施,从而可以描述生命系统中发生的动态现象。尽管如此,分子物种将经历扩散系数值的更重叠分布,这通常反映在异常扩散特征中,其中分子在时间19中以非线性关系扩散,并且难以识别这种异常子扩散的生物学意义。过去,通过记录FRAP从各种大小的区域(而不仅仅是一个区域)的分子扩散,从而提供了额外的空间信息,在某种程度上克服了这一困难。例如,这使得膜微域20,21,22的概念化成为可能。
通过改变观察焦点体积的大小,建立了将该策略转换为FCS测量(即所谓的点变异荧光相关光谱(svFCS)),从而允许在不同的空间尺度上记录荧光的波动23。因此,svFCS方法提供了间接的空间信息,允许识别和确定所研究分子的分子扩散模式和膜分区类型(孤立与连续域24)。通过将扩散时间td 绘制为腰部(ω)值定义的各种空间尺度的函数,在这种情况下对应于检测光束半径大小23,25,可以表征给定分子在给定生理条件下的扩散规律。因此,svFCS是时域26中单粒子跟踪的完美模拟。在布朗扩散约束下,人们应该期望扩散时间td 和腰部ω之间存在严格的线性关系(图1)23,25。扩散定律偏离该方案的起源可归因于非排他性原因,例如细胞骨架网格,分子拥挤,纳米域中的动态分割,或这些和其他效应的任意组合(图1),并且需要通过实验进行测试25。
在这里,我们为从头开始构建的定制svFCS光学系统的日常使用提供了所有必要的控制检查点,这补充了我们之前关于该实验方法的协议审查27,28 。此外,作为概念的证明,我们提供了有关设置校准,细胞制备,数据采集和分析的指南,以建立Thy1-GFP的svFCS扩散定律(DL),Thy1-GFP是一种质膜糖基磷脂酰肌醇锚定蛋白,已知其定位于脂筏纳米域29。最后,我们证明了胆固醇氧化酶处理对脂筏纳米结构域的部分不稳定如何影响Thy1-GFP的扩散特性。此外, 补充材料中还提供了从头开始构建 svFCS 设置的详细说明。
研究方案
1. 设置用于组装定制 svFCS 设置的规范
注意:建议的svFCS设置简单,可以低成本地轻松安装,操作和维护,同时确保光子恢复的效率。有关更多详细信息,请参阅 补充材料。
- 实验室和安全
- 将系统安装在稳定在21°C左右的房间中。
- 避免被动(或主动)光学工作台上的直接气流,并遵循激光安全规则进行光学对准。
- 硬件和软件
注: 补充材料 详细介绍了 图 2 中描述的安装步骤。- 使用 状态 机 和 事件 结构 架构 在 LabVIEW 中 编写 主要 采集 和 控制 软件, 其中 多功能 采集 板 驱动 了 大部分 控制器。
注:相关器、激光器和功率计由其自己的软件控制或监控。 - 根据所使用的硬件调整硬件和软件安装过程。
- 使用 状态 机 和 事件 结构 架构 在 LabVIEW 中 编写 主要 采集 和 控制 软件, 其中 多功能 采集 板 驱动 了 大部分 控制器。
- 光学设置
注: 图3 显示了以下各节中用于控制光学对准质量的光学工作台模块。所有光学元件规格均列于 材料表中。构建设置的过程在 补充材料中进行了广泛详细介绍。该系统包括连续波激光器、配备浸水物镜的电动倒置显微镜、耦合到单个光子计数模块的雪崩光电二极管探测器以及硬件相关器。带有无振动加热器的显微镜培养室专门设计用于控制活细胞实验的温度。按照惯例,XY 轴对应于光路的垂直平面,Z 轴对应于光路。
2. 运行实验前的每日检查点
- 控制激励路径(图3、
 &)
&)  。
。- 打开所有虹膜隔膜。
- 使用功率计测量激光功率,使第一个光圈保持完全打开。
- 转动半波板(HWP)以找到最大功率。
- 如果激光功率低于平时,请使用光圈检查对准,并在必要时交替移动L1和M1。
- 记下实验实验室笔记本中的功率值。
- 控制检测路径(图3、
 &)
&)  。
。- 将水、盖玻片和2 nM罗丹明6G(Rh6G)溶液液滴放在物镜上。
- 如果荧光信号(APD上的计数数字,用LabVIEW软件记录)低于平时,请重新制作Rh6G溶液,检查物镜上的定位和盖玻片数量,或消除气泡(如果有)。
- 如果荧光信号仍然低于平时,请将功率计放在光路内以阻挡光束。
- 关闭 APD(以下 APD 是指 APD 和单光子计数模块)。
- 删除示例。
- 清洁物镜并用反射目标替换物镜。
- 通过从光路中取下功率计来检查反射目标上的激光束。确保目标光束居中,并且背反射到达线上
 的第一个光圈(图3)。
的第一个光圈(图3)。 - 如果没有,请使用M2调整中心位置或使用二向色镜调整背面反射。
- 如果显微镜耦合正确,请将物镜向后推,加入一滴水,一个盖玻片和一滴更浓缩的Rh6G溶液(即200 nM),并设置比经典测量更低的激光功率(很少μW)。
- 打开 APD 并 优化 APD 和 针孔对准, 或者 使用 其 自身 的 XYZ 调节 螺钉 同时 监测 强度 信号 (LabVIEW 软件) 。
- 更换盖玻片并加入较低浓度的Rh6G(2 nM)。沿Z轴移动针孔,找到分子亮度比增加的位置,腰围最小。
- 关闭光圈直到信号下降:激光束尺寸达到物镜的背孔径尺寸(即最小腰部尺寸,参见 补充材料)。
- 启动相关器软件并记录数据(有关数据记录,请参见第 7 节)。
- 检查ACF,它应该显示低噪音,提供小腰围,以及每秒每个分子的高计数率(有关数据分析和腰围尺寸评估,请参阅第7节)。
3. svFCS数据记录和分析的一般注意事项
- 按照以下一般方案记录和分析荧光数据(参见第7、8和9节):(1)荧光记录和ACF生成(相关器软件),(2)意外丢弃数据,平均保留数据,与适当的模型拟合(使用自制的Igor Pro软件),(3)扩散规律图(自制MATLAB软件1),以及(4)可选的扩散规律比较(自制MATLAB软件2)。可根据要求提供不同的软件程序。
注:硬件相关器的最短采样时间为 12.5 ns(即采样频率为 80 MHz)。它提供的时间分辨率至少比溶液中自由扩散的小分子的典型常驻时间低1,000,比共聚焦观察体积内膜蛋白的扩散时间小106 。
4. 细胞培养和转染
- 使用完整的Dulbecco改性鹰培养基(DMEM),补充5%胎牛血清,青霉素(100 U / mL),链霉素(100 U / mL)和L-谷氨酰胺(1mM),将Cos7细胞接种在8孔腔室盖玻璃玻璃底中,密度为10,000个细胞/孔。
- 在含有5%CO2 的潮湿气氛中在37°C下培养细胞24小时。
- 取出培养基,每孔加入300μL新鲜完全培养基,并在37°C下预炙育细胞30分钟。
- 在50μL无血清DMEM中稀释0.5μg编码Thy-1蛋白的质粒DNA与eGFP25 融合。短暂涡旋混合。
- 在50μL无血清DMEM中稀释1.5μL DNA转染试剂,并将溶液充分混合。
- 将稀释的转染试剂直接加入制备的DNA溶液中,并立即混合化合物。
- 将制备的混合物在室温下孵育10至15分钟。
- 将10μL组合DNA/转染试剂复合物滴滴加入每个孔中的培养基上,并通过轻轻旋转板进行均质化。
- 将细胞在37°C下与5%CO2 孵育3小时。
- 孵育后,用400μL新鲜完全DMEM替换含有DNA/转染试剂复合物的培养基,并在svFCS实验前培养细胞16小时。
5. 制备用于svFCS测量的细胞
- 取出培养基。
- 用不含血清的汉克平衡盐溶液(HBSS)缓冲液温和地洗涤细胞两到三次,该缓冲液含有Ca2 + 和Mg2 + ,并补充有10mM(4-(2-羟乙基)-1-哌嗪乙烷磺酸)(HEPES),pH值为7.4(HBSS / HEPES)。
- 在所有选择性纤维化血酸监测源采集期间,将细胞维持在乙肝素/肝素缓冲液中。
6. 药物治疗
- 取出培养基,并用补充有10mM肝素的无血清HBSS洗涤细胞两到三次,pH值为7.4(HBSS / HEPES)。
- 将细胞与1 U / mL胆固醇氧化酶(CO酶)溶液在HBSS / HEPES缓冲液中在37°C下孵育1小时。
- 除去溶液,并在进行svFCS测量时将细胞维持在HBSS / HEPES缓冲液中存在0.1U / mL COase。
7. 光斑尺寸校准
- 在37°C下预热显微镜室。
- 通过连续稀释制备标准的2 nM Rh6G溶液。
- 将200μL 2 nM Rh6G溶液滴在置于水浸式物镜上的玻璃盖玻片上。
- 启动所有硬件和软件。
- 根据所用荧光探针的亮度和光稳定性,根据(1)荧光强度(在LabVIEW软件上)调整该功率,该功率应该是稳定的,(2)ACF形状(在相关器软件上),其形状应随时间变化恒定, (3)拟合参数,给出小腰部尺寸和每个分子的高计数率(每个分子每秒的光子,通常每秒每个分子几十到几百个光子)。
注意:ACF的振幅(称为G(0))与分子的数量(即荧光探针的浓度)成反比。对于腰围尺寸的校准,这是一个很好的质量控制候选参数。因此,G(0)对于每天相同的浓度应该是相似的,因为它将腰围大小和浓度联系起来。对于细胞测量,由于FCS对于低浓度更准确,因此G(0)应该很高以进行适当的参数拟合提取。 - 使用 LabVIEW 软件 设置 svFCS 照明/ 检测 显微镜 端口。
- 打开接入点。
- 关闭虹膜,直到信号下降以获得最小的腰围尺寸,或关闭虹膜以获得更大的腰围尺寸。
- 记录选定持续时间(即一次运行)的几个 ACF 以提高统计再现性,通常使用相关器软件进行 10 次运行,每次持续 20 秒。
- 关闭接入点。
- 使用 Igor Pro 软件检查并丢弃由于分子聚集体而出现强烈波动的游程。手动执行此步骤 - 在对用户进行培训后,它应该与用户无关。
- 使用 3D 扩散模型拟合保留的 AGF 的平均值。
- 从拟合参数中提取平均扩散时间
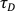 ,并将其保存到".txt"文件中(文件格式由 Igor Pro 软件指定)。
,并将其保存到".txt"文件中(文件格式由 Igor Pro 软件指定)。 - 通过将平均强度(从荧光迹线中提取)除以分子数量(从ACF中提取)来检查每秒每个分子的计数率(一个很好的性能指标)。
注意:对于相同的采集参数,请确保此值每天都很高且稳定。 - 了解Rh6G在37°C(D)和(见7.13)
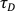 下水溶液中的扩散系数,根据以下公式计算实验腰围尺寸ω:
下水溶液中的扩散系数,根据以下公式计算实验腰围尺寸ω: 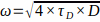
- 在绘制FCS扩散定律所需的每个腰部尺寸修改中,以及在svFCS数据采集的任何新的实验系列之前,应用该程序。
8. 电池上的选择性指纹识别系统数据采集
- 根据所用荧光探针的亮度和光稳定性,调整该功率以允许每个分子的高计数率(通常每个分子每秒数千个光子),同时保持低光漂白(即LabVIEW软件上的稳定强度迹线)。
- 在开始测量之前,将样品在37°C下平衡10分钟。
- 使用 LabVIEW 软件 设置 落射荧光照明显微镜。
- 选择具有适当荧光探针位置和(低)荧光信号强度的细胞。
注意:荧光越低,FCS测量效果越好(参见步骤8.1)。 - 使用 LabVIEW 软件 设置 svFCS 照明/ 检测 显微镜 端口。
- 打开接入点。
- 使用 LabVIEW 软件 对 所选 的 细胞 进行 xy 扫描。
- 执行z扫描,通过选择顶部的质膜,将共聚焦点定位在最大荧光强度处,然后开始数据采集。为了最大限度地分离两个膜,优选在细胞的核区域进行扫描。
- 记录一个连续 20 次运行的系列,持续 5 秒,每次使用相关器软件。
注意:确保每次运行的持续时间足够长,以获得噪声较低的 ACF。长期采集容易受到光漂白或意外实质性变化(例如,聚合体)的影响。根据样本调整运行次数、持续时间和系列数量,但要确保它们在相同的大部分实验中保持恒定,以确保可重复性。 - 关闭接入点。
- 使用 Igor Pro 软件丢弃意外运行。
- 使用 2 种 2D 扩散模型拟合平均 ACF。使该模型适应目标分子的扩散行为类型。
- 将管接头参数保存到上一个文件中(请参见步骤 7.13)。
- 在至少 10 个不同的单元格上执行 10 到 15 个系列的记录,并重现步骤 8.3 到 8.13。检查获得的单个文件是否包含腰围尺寸信息和 10–15 个录音的拟合参数。
- 要建立单一扩散定律,请分析至少四种在200至400nm之间变化的腰围尺寸。该范围由衍射光学极限定义,但与客观(数值孔径)和激光(波长)相关。
注意:由于腰围尺寸校准不是绝对的,并且具有一定程度的不确定性,因此构建了一个专用的MATLAB软件28 ,用于解释x和y误差(即ω2 和td)以适应扩散定律。 - 启动 MATLAB 软件 1 并选择一个文件夹,其中包含与至少四个腰围尺寸实验相对应的所有".txt"文件。
- 绘制<td>与<ω2>的关系图,即扩散定律。可以提取两个主要参数:y轴截距(t0)和有效扩散系数(Deff,与斜率成反比)。
9. 不同实验条件的扩散规律比较
注:如有必要,请针对不同的实验条件重现第7节和第8节。开发了一个专用软件(MATLAB 软件 2),用于根据 t0 和 Deff 值28 确定这些扩散定律是否相似。它检验两个假设:两个值不同,或者两个值在高于误报概率 (PFA) 的阈值设置时没有差异。任意 PFA 值 5% (T = 3.8) 被视为两个参数(t0 或 Deff)之间的显著性上限,表明两个值相同的几率为 5%。
- 创建一个".xls"文件,其中包含要比较的每个条件的特征扩散规律值(即,包含未处理 (NT) 和处理 (COase) 条件的 t 0、t0 错误、D eff 和 Deff 误差的文件)。
- 启动 MATLAB 软件 2.
- 选择".xls"文件。
- 分析生成的彩色编码 2D 图,其中 t0 和 Deff 统计检验分别绘制在 x 轴和 y 轴上(图 4)。T 越高,比较值之间的差值就越大。
10. 胆固醇浓度测量
- 细胞处理和裂解
- 将Cos7细胞一式三份接种在6孔板中,以4×10个5 个细胞/孔,并在37°C下在2mL完全DMEM中孵育,5%CO2 过夜,以使细胞附着在板上。
- 取出培养基并用磷酸盐缓冲盐水(PBS)洗涤细胞三次。
- 加入1 mL含有(或不含对照组)1 U / mL过酶的HBSS / HEPES缓冲液,并在37°C下用5%CO2孵育1小时。
- 用含有0.1U / mL过酶的1mL HBSS / HEPES替换培养基,并在37°C下用5%CO2孵育1小时。
- 取出溶液并收获细胞。
- 用PBS洗涤细胞三次,并在室温下以400× g 离心5分钟。
- 用放射免疫沉淀测定缓冲液(25mM HEPES,pH 7.4,150mM NaCl,1%NP40,10mM,MgCl2,1mM乙二胺四乙酸,2%甘油,蛋白酶和磷酸酶抑制剂混合物)在冰上裂解细胞30分钟。
- 在4°C下以10000× g 离心裂解物10分钟并收集上清液。
- 根据制造商的建议,使用工作溶液使用改进的 Bradford 蛋白质测定法,量化每个样品的总蛋白质浓度。
- 胆固醇浓度测量
- 要以酶促方式测定总细胞胆固醇水平,请根据制造商的建议使用适当的试剂盒(例如 Amplex 红胆固醇检测试剂盒)。
- 对于每个反应,将含有5μg蛋白质的样品与Amplex Red试剂/辣根过氧化物酶/胆固醇氧化酶/胆固醇酯酶工作溶液混合,并在黑暗中在37°C下孵育30分钟。
- 使用520nm的激发测量荧光,并使用酶标仪检测560-590nm处的发射。
- 从最终值中减去背景,并使用标准曲线确定胆固醇浓度。
- 计算每μg蛋白质的最终胆固醇含量(以ng胆固醇为单位)。
结果
我们生成了在Cos-7细胞中表达的Thy1-GFP的DL(图4,黑色方块)。扩散定律具有正 t0 值(19.47 ms±2 ms),表明Thy1-GFP被限制在质膜的纳米结构中。表达Thy1-GFP的细胞的胆固醇氧化酶处理导致DL t0 值±1.34ms(图4,灰色方块)的7.36偏移。这一观察结果证实,Thy1-GFP限制的性质取决于胆固醇含量,并且与脂筏纳米结构域有关。根据上述统计检验(参见步骤9.1.3),在 t0 和 Deff 值方面,这两个扩散定律被证明是不同的。此外,我们评估了未处理的Cos-7细胞中总细胞胆固醇与用COase处理的细胞的浓度。在COase处理时观察到总胆固醇含量的小而显着的降低(图5)。由于这种酶仅作用于质膜外小叶可进入的胆固醇池,我们假设观察到的胆固醇降低仅与质膜相关,并导致脂筏纳米域的不稳定。
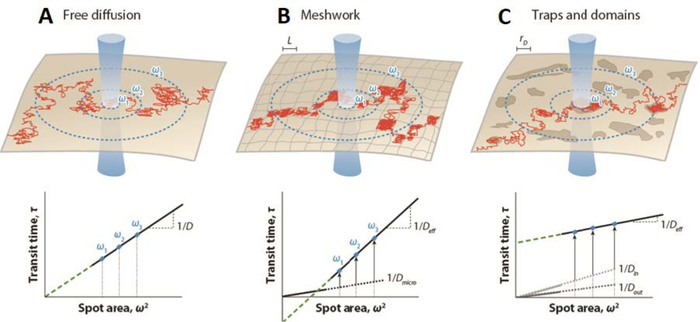
图 1:由点变异 FCS 针对不同形式的膜组织建立的模拟荧光相关光谱 (FCS) 扩散定律。 (上面板)膜组织的示意图 - (A)自由扩散,(B)网格屏障和(C)陷阱/域限制 - 为单个分子绘制轨迹(红色)。蓝色圆圈表示膜与腰部 ω激光束的交集。(下面板)FCS扩散定律表示为扩散时间 td 作为平方半径 ω2的函数。扩散定律投影(绿色虚线)在自由扩散的情况下在(A)原点(t0 = 0)处截取时间轴;(B)在负轴(t0 < 0)有网格障碍时,或(C)在正轴(t0 >0)有陷阱和域(脂筏)时。 D 是布朗运动的横向扩散系数; Deff,有效扩散系数; D微,网格内陷阱的微观扩散系数; D中,域内的扩散系数; D出,扩散系数为域外; L、正方形域边的大小;和 rD,圆形域的半径。这个数字是从他和马盖特6修改而来的。 请点击此处查看此图的大图。

图 2:svFCS 硬件控制的示意图。 计算机通过不同的通信协议控制所有设备:串行(显微镜,外部快门),USB(XYZ压电载物台,相关器)和PCI(采集板)。数据采集模块: 数据采集板, APD: 雪崩光电二极管, SPCM: 单光子计数模块, DO: 数字输出. 请点击此处查看此图的大图。
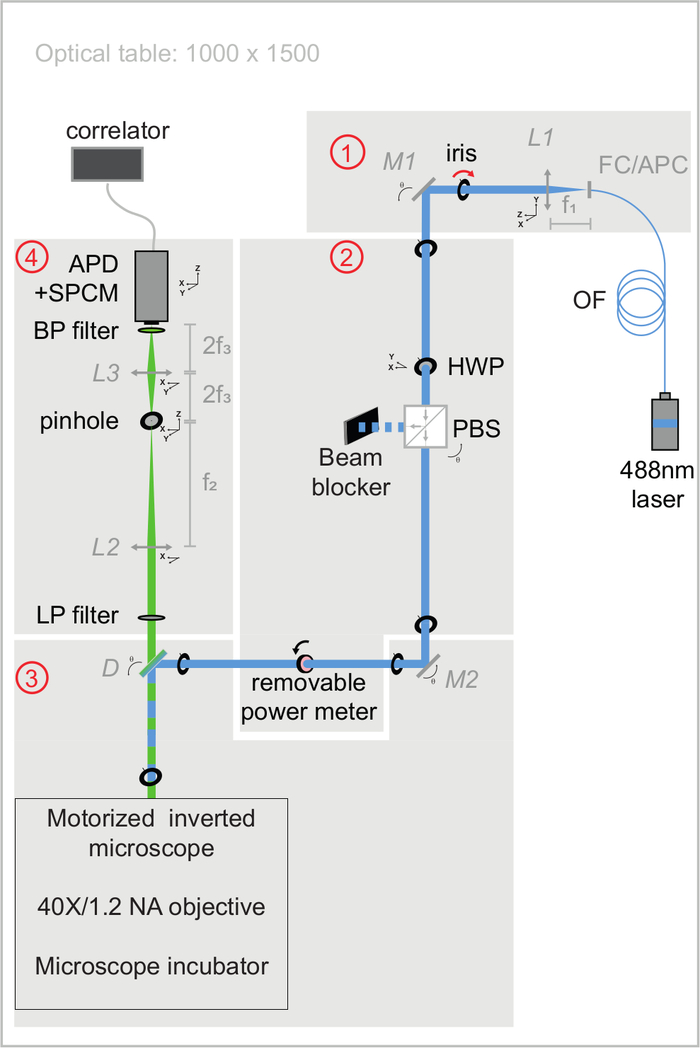
图 3:svFCS 设置的激发和发射光路示意图。 svFCS设置包含四个模块:(1)光纤488 nm激光器的输出被准直,(2)半波板和偏振分束器的组合设置光功率,(3)激光束在通过无管透镜的电动显微镜后聚焦在样品上,以及(4)荧光通过共聚焦检测路径检测到雪崩光电二极管,耦合到单个光子计数模块, 它将信号传递到硬件相关器。简单性使系统具有灵敏度,健壮性和易用性(在 补充材料中广泛评论)。 请点击此处查看此图的大图。
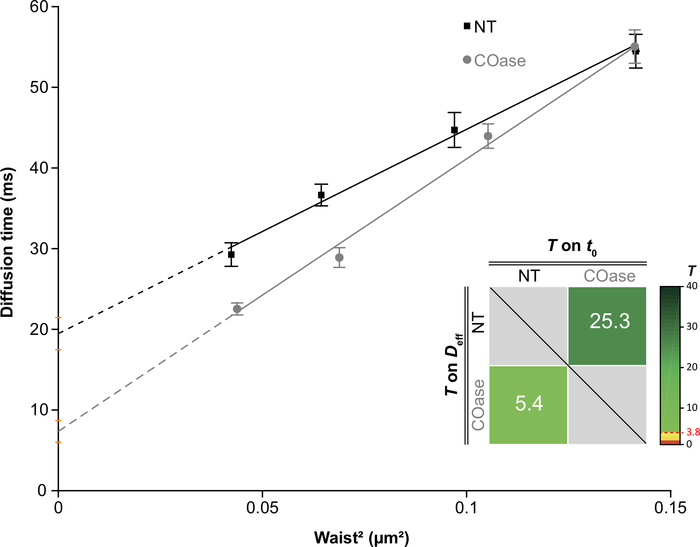
图 4:通过对以 Cos-7 表示的 Thy1-GFP 的扩散分析生成的 svFCS 扩散定律。 未经处理(NT,黑色方块)和胆固醇氧化酶处理(CO酶,灰色圆圈)的Cos-7细胞的svFCS扩散规律。图中的插入物表示对两种提出的svFCS扩散定律之间显着差异的统计测试(根据Mailfert等人28)。当两个扩散定律不同时,测试值(T)应高于设置为3.8的阈值。它越高,扩散定律之间的差异就越大。T 的值是用颜色编码的。 请点击此处查看此图的大图。
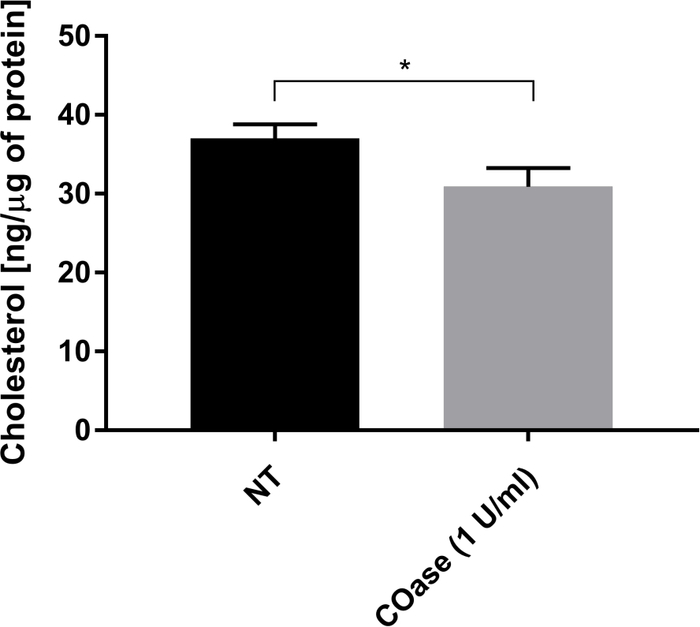
图5:Cos-7细胞中总胆固醇含量的比较。 将Cos-7细胞未经处理(NT)或用1 U / mL胆固醇氧化酶(COase)处理1小时。该数据代表了一个一式三份实验的示例。使用双尾,不成对 的t检验来评估统计差异(α= 0.05)。 请点击此处查看此图的大图。
材料表: svFCS 设置所需的光学元件列表。
补充材料: 本文档介绍如何从头开始构建 svFCS 设置。 请按此下载此档案。
讨论
在这里,我们描述了svFCS模块在标准荧光显微镜上的实现,这是一种强大的实验方法,可以通过FCS扩散规律分析来破译活细胞中质膜组织的动力学。从概念上讲,svFCS基于一个简单的原理:在时域中测量荧光的相关性,同时改变照明区域23的大小。该策略有助于从微观测量中推断出纳米信息,这有助于破译在稳态25和生理过程30,31,32,33下有助于质膜组织的主要物理化学元素。总而言之,这些svFCS分析明确证明了脂质依赖性纳米结构域在各种细胞类型中的存在及其对调谐不同信号传导事件的直接影响。
在此框架内,在构建svFCS设置以优化光子预算并最小化光学像差时,需要考虑一些光学方面。因此,我们建议使用显微镜,在执行svFCS测量时,可以从中取出管透镜。此外,单个光圈在svFCS设置中起着关键作用:它改变物镜后孔径处的光束尺寸,从而直接改变有效腰围尺寸(即有效激发体积)。光束直径应适合物镜背瞳,以获得最小的腰围尺寸34。此选项有助于调整腰围大小,确保优化光子预算,并且易于实施。最后,沿着光路使用最少数量的光学部件;系统越不复杂,丢失的光子就越少。所有这些选项都显著提高了svFCS实验的鲁棒性。
关于协议本身,必须考虑几个关键步骤。最重要的是光路的适当对准,这对于成功的svFCS测量至关重要(协议,第2节)。通过分析来自2 nM Rh6G溶液的荧光信号,在300 μW激光照射下,该荧光信号应为~200 kHz,这很容易检查。所有虹膜都应打开,并且ACF应具有重要的振幅(通常为G0~1.5-2.0)。另一个临界点涉及细胞及其制备用于svFCS分析(实验方案,第4-8节)。它们的密度必须进行调整,以便可以观察的分离细胞进行分析。非贴壁细胞必须通过使用聚-L-赖氨酸溶液固定在腔室盖玻片上。来自细胞标记的荧光信号不应太强,否则会导致难以拟合的非常平坦的ACF,并且拟合参数存在重要误差。此外,细胞中的非均匀标记和荧光聚集使svFCS测量值极难解释。最后,胆固醇氧化酶治疗影响细胞活力,svFCS分析不应超过治疗后一小时。记录来自上质膜的荧光波动也更好,因为它不附着在载体上,并且由于与载体的物理相互作用而没有阻碍分子扩散的风险。
由于调节检测体积的方式多种多样,svFCS技术已经取得了足够的进展,可以在不同的方法中使用,从而可以研究活细胞中的各种生物过程。调整激发体积大小的一种替代方法是使用可变扩束镜35。也可以通过记录来自质膜截距沿z方向36的荧光信号来简单地调节照明区域的大小。这可以在标准共聚焦显微镜上完成,该显微镜已经开发了一个理论框架来推导扩散定律37,38。
尽管svFCS方法提供了时空分辨率,这对于表征质膜的不均匀侧向组织是必要的,但限制的几何模式并不相互排斥。 t0 在一个方向或另一个方向上的偏差完全揭示了约束25 的主导模式。此外,本svFCS方法的另一个重要限制是由于经典的光学衍射极限(~200 nm)造成的。毫无疑问,这比限制细胞质膜内分子的域更大。因此,限制的分析是从扩散定律推断出的 t0 值推断出来的。
通过实现替代方法克服了此缺点。最初,使用用纳米孔钻孔的金属薄膜提供了照亮非常小的膜面积的可能性(即,低于半径在75至250nm之间的单个纳米孔径的光学衍射极限)39。因此,报道了从理论扩散规律预测的孤立域组织的过渡态,并允许细化纳米膜非均质性的特征尺寸,并定量估计脂质依赖性纳米域39所占据的表面积。或者,纳米照明也已经开发使用近场扫描光学显微镜40 或平面光学纳米天线41。最近,将受激发射耗尽(STED)和FCS相结合,提供了一种强大而灵敏的工具,以非常高的空间分辨率记录扩散定律。这种STED-FCS提供了在短时间内发生的纳米级分子扩散特性,允许研究质膜42,43处脂质探针的动态组织。然而,STED过程中荧光的不完全抑制挑战了FCS中自相关曲线的分析。
已经开发了一种新的拟合模型来克服这一困难,提高了扩散时间和平均分子数测量44的准确性。最后,对于质膜上的缓慢分子扩散,svFCS原理可以应用于通过图像相关光谱45记录的数据。最近,已经证明,将原子力显微镜(AFM)与成像全内反射FCS(ITIR-FCS)相结合有助于改进阻碍分子在质膜上扩散的机制的性质,特别是由于纳米结构域46的高密度,特别是在渗流阈值膜构型附近。
综上所述,svFCS建立的扩散规律为推断动态集体脂质和膜蛋白关联产生的局部异质性提供了实验证据。正如Wohland及其同事46所说,"FCS扩散定律分析仍然是从动态信息中推断出分辨率极限以下的结构和组织特征的宝贵工具"。尽管如此,我们仍然需要开发新的模型来完善扩散定律的解释,从而更好地理解质膜上发生的分子事件的动力学。
披露声明
作者没有什么可透露的。
致谢
SB,SM和DM得到了CNRS,Inserm和艾克斯 - 马赛大学的机构资金以及法国国家研究机构(ANR-17-CE15-0032-01和ANR-18-CE15-0021-02)和法国"阿文尼尔投资"(ANR-10-INBS-04法国生物成像,ANR-11-LABX-054实验室信息)的项目赠款的支持。KW承认"生物技术南",这是一个跨学科的环境博士研究计划,在生物技术和纳米技术领域知道。EB 感谢波兰国家科学中心 (NCN) 在 2016/21/D/NZ1/00285 项目下提供的财政支持,以及法国政府和法国驻波兰大使馆的财政支持。MŁ感谢波兰发展部(CBR POIR.02.01.00-00-0159/15-00/19)和国家研发中心(Innochem POIR.01.02.00-00-0064/17)的财政支持。TT感谢波兰国家科学中心(NCN)在项目编号2016/21/B/NZ3/00343和弗罗茨瓦夫生物技术中心(KNOW)的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| Aligment tool | Spanner Wrench for SM1-Threaded Retaining Rings | Thorlabs | SPW602 |
| Avalanche Photodiode and Single Photon Counting Module (SPCM) | Single-Photon Counting Module, Avalanche Photodiode | Excelitas | SPCM-AQRH-15 |
| BNC 50 Ω plug to 50 Ω plug lead 2 m | RS Components | 742-4315 | |
| Coaxial cable 415 Cinch Connectors, RG-316, 50 Ω With connector, 1.22 m, RoHS2 | RS Components | 885-8172 | |
| Tee 50Ω RF Adapter BNC Plug to BNC Socket 0 → 1GHz | RS Components | 546-4948 | |
| Brennenstuhl 2.5 m, 8 Socket Type E – French Extension Lead, 230 V | RS Components | 768-5500 | |
| Mascot, 6W Plug In Power Supply 5V dc, 1.2A, 1 Output Switched Mode Power Supply, Type C | RS Components | 452-8394 | |
| Crystek CCSMACL-MC-24 Reference Oscillator Power Cable RF Adapter | RS Components | 792-4079 | |
| Fluorescence filtering | 535/70 ET Bandpass, AOI 0° Chroma Diameter 25 mm | AHF filter | F47-539 |
| Laser Beamsplitter zt488 RDC, AOI 45° Chroma 25.5 x 36 x 1 mm | AHF filter | F43-088 | |
| 496/LP BrightLine HC Longpass Filter, AOI 0° Chroma Diameter 25 | AHF filter | F37-496 | |
| Hardware correlator | 80 MHz Digital Correlator | Correlator.com | Flex02-12D |
| Laser | LASER LASOS LDM-XT fiber coupled, 488 nm, 65 mW | Lasos | BLD-XT 488100 |
| Laser safety | High-Performance Black Masking Tape, 1" x 180' (25 mm x 55 m) Roll | Thorlabs | T743-2.0 |
| Lens Tissues, 25 Sheets per Booklet, 5 Booklets | Thorlabs | MC-5 | |
| Laser Safety Glasses, Light Orange Lenses, 48% Visible Light Transmission | Thorlabs | LG3B | |
| Microscope | Zeiss Axiovert 200M Motorized Inverted Fluorescence Microscope Fine and coarse focusing, reflector turret rotation, objective nosepiece rotation, switching camera ports, and internal light shutters | Carl Zeiss | |
| C-Apochromat 40x/1,2 W Korr.selected for FCS (D=0.14-0.19 mm) (WD=0.28 mm at D=0.17 mm), UV-VIS-IR | Carl Zeiss | 421767-9971-711 | |
| Adapter W0.8 / M27x0.75 H "5" | Carl Zeiss | 000000-1698-345 | |
| Middle ring W0.8 - W0.8 H "5" | Carl Zeiss | 000000-1698-347 | |
| Optical path | D25.4mm Mirror, Protected Silver | Thorlabs | PF10-03-P01 |
| D25.4mm, F=60.0.mm, Visible Achromat | Thorlabs | AC254-060-A | |
| D25.4mm, F=35.0.mm, Visible Achromat | Thorlabs | AC254-035-A | |
| 25 µm mounted pinhole | Thorlabs | P25S I | |
| 25.4mm Mounted Zero, Order 1/2 Waveplate 488 nm | Thorlabs | WPH10M-488 (HWP) | |
| 20mm Polarizing Beamsplitter Cube 420-680 nm | Thorlabs | PBS201 | |
| Rotation Stage 56 mm x 26 mm Threaded ID | Thorlabs | RSP1/M | |
| 52 mm x 52 mm Kinematic Platform Mount | Thorlabs | KM100B/M | |
| Adjustable Prism Clamp | Thorlabs | PM3/M | |
| Beam block - active area 19 mm x 38 mm | Thorlabs | LB1/M | |
| Iris Diaphragm 1 mm to 25 mm Aperture | Thorlabs | ID25/M | |
| Left-Handed Kinematic Cylindrical Lens Mount | Thorlabs | KM100CL | |
| 1" Optic Holder, M4 Tap | Thorlabs | MFF101/M | |
| 1" Stackable Lens Tube | Thorlabs | SM1L03 | |
| Stackable Lens Mount for 1" optic-usable depth ½ | Thorlabs | SM1L05 | |
| Stackable Lens Mount For 1"Optic-usable Depth 2" | Thorlabs | SM1L20 | |
| Small Optical Rails 600mm, metric | Thorlabs | RLA600/M | |
| Small Optical Rails 75mm, metric | Thorlabs | RLA075/M | |
| Small Optical Rails 150mm, metric | Thorlabs | RLA150/M | |
| Rail Carrier, Counterbored Hole 1"x 1" | Thorlabs | RC1 | |
| Rail Carrier, Perpendicular Dovetail | Thorlabs | RC3 | |
| High Precision Translating Lens Mount for 1 inch | Thorlabs | LM1XY/M | |
| ½ " (12mm) Dovetail Translation Stage | Thorlabs | DT12/M | |
| Rail Clamps | Thorlabs | CL6 | |
| Metric XYZ Translation Stage (Includes PT102) | Thorlabs | PT3/M | |
| Black Rubberized Fabric | Thorlabs | BK5 | |
| Ball Driver kit/ 6 tools | Thorlabs | BD-KIT/M | |
| Adapter with External M6 x 1.0 Threads and External M4 x 0.7 Threads | Thorlabs | AP6M4M | |
| Mounting Base, 25 mm x 58 mm x 10 mm, 5 Pack | Thorlabs | BA1S/M-P5 | |
| Lens Mount for 25.4mm optic | Thorlabs | LMR1/M | |
| SM1 FC/APC Adapter | Thorlabs | SM1FCA | |
| Kinematic Mirror Mount For 1 inch Optics | Thorlabs | KM100 | |
| Silicon Power Head, 400-1100nm, 50mW | Thorlabs | S120C | |
| 12.7 mm Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L=50 mm, 5 Pack | Thorlabs | PH50/M-P5 | |
| Post Holder with Spring-Loaded Hex-Locking Thumbscrew, L=20 mm | Thorlabs | PH20/M | |
| 12.7 mm x 50 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR50/M-P5 | |
| 12.7 mm x 75 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR75/M-P5 | |
| USB Power and Energy Meter Interface | Thorlabs | PM100USB | |
| 12.7 mm x 30 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR30/M | |
| 12.7 mm x 20 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR20/M | |
| 750 mm long Structural Rail (detection box) | Thorlabs | XE25L750/M | |
| 350 mm long Structural Rail (detection box) | Thorlabs | XE25L350/M | |
| Quick Corner Cube for 25 mm Rails | Thorlabs | XE25W3 | |
| Right-Angle Bracket for 25 mm Rails | Thorlabs | XE25A90 | |
| Black posterboard 20" x 30" (508 mm x 762 mm), 1/16" (1.6 mm) Thick, 5 Sheets | Thorlabs | TB5 | |
| Hinge for 25 mm Rail Enclosures | Thorlabs | XE25H | |
| Lid Stop for 25 mm Rail Enclosures | Thorlabs | XE25LS | |
| M4 Cap Screw Kit | Thorlabs | HW-KIT1/M | |
| M6 Cap Screw Kit and Hardware kit | Thorlabs | HW-KIT2/M | |
| Table Clamp, L-Shape, 5 Pack | Thorlabs | CL5-P5 | |
| SM1 Ring-Actuated Iris Diaphragm (Ø0.8 - Ø12 mm) | Thorlabs | SM1D12D | |
| Ø1" SM1-Mounted Frosted Glass Alignment Disk w/Ø1 mm Hole | Thorlabs | DG10-1500-H1-MD | |
| Honeycomb Optical Table Top, Standa | Standa | 1HB10-15-12 | |
| Optical Table support, Standa | Standa | 1TS05-12-06-AR | |
| Sample nano-positionning | Precision XYZ Nanopositioning | Physik Instrumente | PI P527-3.CD |
| Digital Multi-Channel Piezo Co, 3 Channels, -30 to 130 V Sub- D Connector(s), Capacitive Sensors, | Physik Instrumente | PI E727-3.CD | |
| Temperature chamber | Zeiss 200M Inverted Microscope Incubator System MATT BLK | Digital Pixel | |
| Dual Channel Microprocessor Temperature Controller | Digital Pixel | DP_MTC_2000_DUO | |
| Two Vibration Free Heater Modules | Digital Pixel | DP_150_VF | |
| PT100 Temperature Sensor | Digital Pixel | DP_P100_TS | |
| Biological Reagents and Materials | |||
| Cell culture and transfection | Cos7 cells | ATCC® | CRL-1651™ |
| 8- well Lab-Tek chambers | Thermo Fisher Scientific | 155411PK | |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 11965092 | |
| Fetal bovine serum | Thermo Fisher Scientific | 16000044 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| PBS buffer | Thermo Fisher Scientific | 14190144 | |
| PenStrep | Thermo Fisher Scientific | 15140122 | |
| PolyJet Transfection Reagent | SignaGen Laboratories | SL100688 | |
| Cholesterol content measurement | Amplex Red Cholesterol Assay Kit | Thermo Fisher Scientific | A12216 |
| Protease Inhibitor Cocktail | Thermo Fisher Scientific | 87786 | |
| Phosphatase Inhibitor Cocktail | Thermo Fisher Scientific | 78420 | |
| ROTI Nanoquant Working Solution | Roth | K880 | |
| GloMax Discover Microplate Reader | Promega | GM3000 | |
| svFCS measurements | HBSS buffer | Thermo Fisher Scientific | 14025092 |
| Hepes buffer | Thermo Fisher Scientific | 15630080 | |
| Cholesterol oxidase | Sigma-Aldrich | C8868 | |
| Rhodamine 6G | Sigma-Aldrich | 83697-1G |
参考文献
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Newton, A. C. Regulation of the ABC kinases by phosphorylation: protein kinase C as a paradigm. The Biochemical Journal. 370, Pt 2 361-371 (2003).
- Marguet, D., Lenne, P. F., Rigneault, H., He, H. T. Dynamics in the plasma membrane: how to combine fluidity and order. The EMBO Journal. 25 (15), 3446-3457 (2006).
- Edidin, M. The state of lipid rafts: From model membranes to cells. Annual Review of Biophysics and Biomolecular Structure. , (2003).
- Lingwood, D., Simons, K. Lipid rafts as a membrane-organizing principle. Science. , (2010).
- He, H. T., Marguet, D. Detecting nanodomains in living cell membrane by fluorescence correlation spectroscopy. Annual Reviews of Physical Chemistry. 62, 417-436 (2011).
- Rossy, J., Ma, Y., Gaus, K. The organisation of the cell membrane: Do proteins rule lipids. Current Opinion in Chemical Biology. 20 (1), 54-59 (2014).
- Nicolson, G. L. The Fluid - Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et Biophysica Acta - Biomembranes. 1838 (6), 1451-1466 (2014).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1081 (2002).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34, 351-378 (2005).
- Destainville, N., Salomé, L. Quantification and correction of systematic errors due to detector time-averaging in single-molecule tracking experiments. Biophysical Journal. 90 (2), 17-19 (2006).
- Wieser, S., Moertelmaier, M., Fuertbauer, E., Stockinger, H., Schütz, G. J. Un)confined diffusion of CD59 in the plasma membrane determined by high-resolution single molecule microscopy. Biophysical Journal. 92 (10), 3719-3728 (2007).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. , (1976).
- Petrášek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. , (2008).
- Elson, E. L. 40 Years of FCS: How it all began. Methods in Enzymology. , (2013).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. , (1974).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. , (1974).
- Schwille, P., Haupts, U., Maiti, S., Webb, W. W. Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two-photon excitation. Biophysical Journal. , (1999).
- Bouchaud, J. P., Georges, A. Anomalous diffusion in disordered media: Statistical mechanisms, models and physical applications. Physics Reports. , (1990).
- Yechiel, E., Edidin, M. Micrometer-scale domains in fibroblast plasma membranes. Journal of Cell Biology. 105 (2), 755-760 (1987).
- Salomé, L., Cazeils, J. L., Lopez, A., Tocanne, J. F. Characterization of membrane domains by FRAP experiments at variable observation areas. European Biophysics Journal. 27 (4), 391-402 (1998).
- Niv, H., Gutman, O., Kloog, Y., Henis, Y. I. Activated K-Ras and H-Ras display different interactions with saturable nonraft sites at the surface of live cells. The Journal of Cell Biology. 157 (5), 865-872 (2002).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophysical Journal. 89 (6), 4029-4042 (2005).
- Saxton, M. J. Fluorescence corralation spectroscopy. Biophysical Journal. , (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO Journal. 25 (14), 3245-3256 (2006).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. , (2015).
- Billaudeau, C., et al. Probing the plasma membrane organization in living cells by spot variation fluorescence correlation spectroscopy. Methods in Enzymology. 519, 277-302 (2013).
- Mailfert, S., Hamon, Y., Bertaux, N., He, H. T., Marguet, D. A user's guide for characterizing plasma membrane subdomains in living cells by spot variation fluorescence correlation spectroscopy. Methods in Cell Biology. 139, 1-22 (2017).
- Rege, T. A., Hagood, J. S. Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses. Biochimica et Biophysica Acta - Molecular Cell Research. , (2006).
- Cahuzac, N., et al. Fas ligand is localized to membrane rafts, where it displays increased cell death-inducing activity. Blood. , (2006).
- Guia, S., et al. Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance. Science Signaling. 4 (167), 21(2011).
- Blouin, C. M., et al. Glycosylation-dependent IFN-γR partitioning in lipid and actin nanodomains is critical for JAK activation. Cell. 166 (4), 920-934 (2016).
- Chouaki-Benmansour, N., et al. Phosphoinositides regulate the TCR/CD3 complex membrane dynamics and activation. Scientific Reports. , (2018).
- Wawrezinieck, L., Lenne, P. F., Marguet, D., Rigneault, H. Fluorescence correlation spectroscopy to determine diffusion laws: application to live cell membranes. Biophotonics Micro- and Nano-Imaging. , (2004).
- Masuda, A., Ushida, K., Okamoto, T. New fluorescence correlation spectroscopy enabling direct observation of spatiotemporal dependence of diffusion constants as an evidence of anomalous transport in extracellular matrices. Biophysical Journal. , (2005).
- Humpolíčková, J., et al. Probing diffusion laws within cellular membranes by Z-scan fluorescence correlation spectroscopy. Biophysical Journal. , (2006).
- Benda, A., et al. How to determine diffusion coefficients in planar phospholipid systems by confocal fluorescence correlation spectroscopy. Langmuir. , (2003).
- Ganguly, S., Chattopadhyay, A. Cholesterol depletion mimics the effect of cytoskeletal destabilization on membrane dynamics of the serotonin1A receptor: A zFCS study. Biophysical Journal. , (2010).
- Wenger, J., et al. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization. Biophysical Journal. 92 (3), 913-919 (2007).
- Manzo, C., Van Zanten, T. S., Garcia-Parajo, M. F. Nanoscale fluorescence correlation spectroscopy on intact living cell membranes with NSOM probes. Biophysical Journal. , (2011).
- Regmi, R., et al. Planar optical nanoantennas resolve cholesterol-dependent nanoscale heterogeneities in the plasma membrane of living cells. Nano Letters. , (2017).
- Mueller, V., et al. FCS in STED microscopy: Studying the nanoscale of lipid membrane dynamics. Methods in Enzymology. , (2013).
- Sezgin, E., et al. Measuring nanoscale diffusion dynamics in cellular membranes with super-resolution STED-FCS. Nature Protocols. , (2019).
- Wang, R., et al. A straightforward STED-background corrected fitting model for unbiased STED-FCS analyses. Methods. , (2018).
- Veerapathiran, S., Wohland, T. The imaging FCS diffusion law in the presence of multiple diffusive modes. Methods. , (2018).
- Gupta, A., Phang, I. Y., Wohland, T. To hop or not to hop: exceptions in the FCS diffusion law. Biophysical Journal. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。