Method Article
Canlı Hücrelerin Plazma Membranında Moleküler Difüzyonun Analizi için Spot Varyasyon Floresan Korelasyon Spektroskopisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, canlı hücrelerin plazma zarındaki moleküler difüzyonu ölçmek için nokta varyasyonu Floresan Korelasyon Spektroskopisi (svFCS) mikroskobunun nasıl oluşturulacağına dair bir protokol sunmayı amaçlamaktadır.
Özet
Plazma zarı organizasyonu ile ilişkili olanlar da dahil olmak üzere canlı hücrelerdeki dinamik biyolojik süreçler, sırasıyla nanometrelerden mikrometrelere ve mikrosaniyelerden dakikalara kadar değişen çeşitli mekansal ve zamansal ölçeklerde meydana gelir. Bu kadar geniş bir biyolojik süreç yelpazesi, geleneksel mikroskopi yaklaşımlarına meydan okuyor. Burada, özelleştirilen klasik bir floresan mikroskobu kullanarak nokta varyasyonu Floresan Korelasyon Spektroskopisi (svFCS) ölçümlerini uygulama prosedürünü detaylandırıyoruz. Protokol, svFCS kurulumunun özel bir performans kontrolünü ve fizyolojik koşullar altında canlı hücrelerin plazma zarı üzerinde svFCS tarafından moleküler difüzyon ölçümleri için kılavuzları içerir. Ek olarak, kolesterol oksidaz tedavisi ile plazma membran sal nanodomainlerini bozmak için bir prosedür sunuyoruz ve plazma zarının lateral organizasyonundaki bu değişikliklerin svFCS analizi ile nasıl ortaya çıkarılabileceğini gösteriyoruz. Sonuç olarak, bu floresan bazlı yöntem, plazma zarının lateral organizasyonu hakkında uygun mekansal ve zamansal çözünürlükle benzeri görülmemiş detaylar sağlayabilir.
Giriş
Plazma membran organizasyonunun karmaşıklığı
Hücre zarı organizasyonunun mevcut anlayışı birkaç yönü dikkate almalıdır1. İlk olarak, karmaşık bir lipit bileşimi sadece hücre tipleri arasında değil, aynı zamanda tek bir hücre içinde (membran organelleri / plazma zarı) da değişir. Ayrıca, ilişkili veya içsel membran proteinleri çoğunlukla dinamik multimerik komplekslerde organize edilir, büyük alanlar membranın dışına uzanır ve tek başına transmembran alanlarından önemli ölçüde daha büyük bir alanı oluşturur. Ayrıca, membranla ilişkili proteinler, protein fonksiyonunun düzenlenmesinde rol oynayan spesifik lipit bağlayıcı veya lipit etkileşimi kapasiteleri sergiler. Bunlar doğrudan lipitlerin yerel bileşimine ve erişilebilirliğine bağlıdır2.
Son olarak, membran proteinlerinin içsel asimetrik yapısı ve lipitlerin dağılımı nedeniyle iki membran broşürü arasında önemli düzeyde asimetri gözlenmektedir. Gerçekten de, sentez ve hidroliz arasındaki lipit metabolik dengesi, broşürler arasındaki lipit flip-flop ile birleştiğinde, böyle asimetrik bir dağılım oluşturur. Çift katmanlı herhangi bir taşıma, kutupsal kafa grubunu membranların hidrofobik iç kısmından hareket ettirmek için gereken serbest enerji tarafından kısıtlandığından, genellikle seçici taşıyıcılar tarafından desteklenir. Her hücre tipi için, asimetri sıkıca korunma eğilimindedir. Toplamda, bu faktörler plazma membranının lateral homojensizliğine veya bölümlenmesine katkıda bulunur 3,4.
Plazma zarının bu temsilini, çift katmanın içinde ve boyunca içsel moleküler difüzyonu dikkate alarak zenginleştiriyoruz, bu da dinamik yanal heterojenliğe onda biri ila yüzlerce nanometre ve mikrosaniyeler ila saniyeler arasında bir ölçekte katkıda bulunuyor. Örneğin, lipite bağımlı membran nanodomainleri - kolesterol olarak tanımlanan lipit salları ve sfingolipid bakımından zengin sinyal platformları - plazma zarının bölümlenmesine katkıda bulunur 5,6. Bununla birlikte, membran organizasyonunun mevcut görünümü sadece lipit salları ile sınırlı değildir. Membran nanodomainleri bileşim, köken ve fonksiyon bakımından daha karmaşık ve heterojendir. Yine de, plazma zarındaki varlıkları sıkı bir şekilde koordine edilmelidir ve proteinler ve lipitler arasındaki dinamik etkileşimler, membran nanoalanlarınınmekansal dağılımında ve kimyasal modifikasyonunda önemli görünmektedir 1,3,7,8.
svFCS prensibi ve plazma membranının organizasyonunu araştırmak için uygulanması
Membran alanlarının analizinde, esas olarak biyofiziksel tekniklerle çok ilerleme kaydedilmiş olmasına rağmen, plazma zarının yerel organizasyonunu belirleyen determinantların uygun mekansal ve zamansal çözünürlükle rafine edilmesi gerekir. Tek tek molekülleri izlemeye dayanan determinantlar, mükemmel uzamsal hassasiyet sağlar ve farklı hareket modlarınınkarakterizasyonuna izin verir 9,10,11,12, ancak klasik düşük kamera kare hızlarıyla sınırlı bir zamansal çözünürlüğe sahiptir ve önemli sayıda yörüngeyi kaydetmek için daha fazla deneysel çaba gerektirir. Alternatif olarak, membran bileşenlerinin difüzyon katsayısı, Fotobeyazlatma Sonrası Floresan Geri Kazanımı (FRAP)13 veya Floresan Korelasyon Spektroskopisi (FCS)14 ile değerlendirilebilir. İkincisi, esas olarak yüksek hassasiyeti ve seçiciliği, mikroskobik algılama hacmi, düşük invazivliği ve geniş dinamik aralığı15 nedeniyle daha fazla dikkat çekmiştir.
FCS'nin kavramsal temeli, Magde ve meslektaşları tarafından yaklaşık 50 yıl önce16,17 tanıtıldı. Floresan emisyonunun dalgalanmasının yüksek zamansal çözünürlükle (μs'den s'ye)18 kaydedilmesine dayanır. Modern versiyonunda, canlı hücrelerdeki ölçümler, bir ilgi alanına (örneğin, plazma zarında) yerleştirilmiş küçük bir konfokal uyarma hacmi (~ 0.3 femtolitre) ile gerçekleştirilir; Gözlem hacmine giren ve çıkan floresan moleküllerinin yayılmasıyla üretilen floresan sinyali, çok yüksek zamansal çözünürlükle (yani, her fotonun dedektöre varış zamanı) toplanır. Daha sonra, sinyal, bir molekülün odak hacmi içinde kaldığı ortalama td (difüzyon süresi), ACF'nin genliği ile ters orantılı olan gözlem hacminde bulunan ortalama parçacık sayısı (N) ile birlikte çıkarıldığı otokorelasyon fonksiyonunu (ACF) üretmek için hesaplanır. Bu son parametre, gözlem hacmi içindeki molekül konsantrasyonu hakkında yararlı bilgiler olabilir.
O zamandan beri, biyofotonikte hızla gelişen enstrümantasyon sayesinde giderek artan sayıda FCS modalitesi uygulanmakta ve canlı sistemlerde meydana gelen dinamik olayların tanımlanmasına izin verilmektedir. Yine de, moleküler bir tür, genellikle moleküllerin19. zamanda doğrusal olmayan bir ilişkiyle yayıldığı anormal bir difüzyon karakteristiği tarafından yansıtılan difüzyon katsayısı değerlerinin daha örtüşen bir dağılımını ve bu anormal subdifüzyonun biyolojik anlamını tanımlamada zorluk çekecektir. Geçmişte, bu zorluk, FRAP tarafından moleküler difüzyonun sadece bir alandan değil, çeşitli boyutlardaki alanlardan kaydedilmesiyle bir şekilde aşılmış ve böylece ek mekansal bilgi sağlanmıştır. Bu, örneğin, membran mikrodomainleri20,21,22'nin kavramsallaştırılmasını sağladı.
Bu stratejinin FCS ölçümlerine çevirisi (yani, spot varyasyon Floresan Korelasyon Spektroskopisi (svFCS)), gözlemin odak hacminin boyutunu değiştirerek floresandaki dalgalanmanın farklı uzamsal ölçeklerde kaydedilmesine izin vererek kurulmuştur23. Bu nedenle, svFCS yaklaşımı, incelenen moleküllerin moleküler difüzyon modlarının ve membran bölümleme tipinin (izole ve bitişik alanlar24) tanımlanmasına ve belirlenmesine izin veren dolaylı mekansal bilgi sağlar. Difüzyon süresi td'yi, bu durumda23,25 numaralı algılama ışını yarıçapı boyutuna karşılık gelen bel (ω) değeri tarafından tanımlanan çeşitli uzamsal ölçeklerin bir fonksiyonu olarak çizerek, belirli bir fizyolojik durumda belirli bir molekülün difüzyon yasasını karakterize edebilir. Bu nedenle svFCS, zaman alanı26'da tek parçacık izlemenin mükemmel bir analogudur. Brownian difüzyon kısıtlaması altında, difüzyon zamanı td ile bel ω arasında kesinlikle doğrusal bir ilişki beklenmelidir (Şekil 1)23,25. Difüzyon yasasının bu şemadan sapmasının kökeni, sitoiskelet ağı, moleküler kalabalıklaşma, nanodomainlerde dinamik bölümleme veya bunların ve diğer etkilerin herhangi bir kombinasyonu gibi münhasır olmayan nedenlere bağlanabilir (Şekil 1) ve deneysel olarak test edilmesi gerekir25.
Burada, sıfırdan inşa edilmiş özel yapım bir svFCS optik sisteminin günlük kullanımı için gerekli tüm kontrol noktalarını sağlıyoruz, bu da bu deneysel yaklaşımla ilgili önceki protokol incelemelerimiz27,28'i tamamlıyor. Ayrıca, kavramın bir kanıtı olarak, kurulumun kalibrasyonu, hücrelerin hazırlanması, veri toplama ve lipid-sal nanodomainlerinde lokalize olduğu bilinen bir plazma zarı glikozilfosfatidilinositol ile implante edilmiş bir protein olan Thy1-GFP için svFCS difüzyon yasasının (DL) oluşturulması için analiz ile ilgili kılavuzlar veriyoruz29. Son olarak, kolesterol oksidaz tedavisi ile lipid-sal nanodomainlerinin kısmi destabilizasyonunun Thy1-GFP'nin difüzyon özelliklerini nasıl etkilediğini gösteriyoruz. Ek olarak, sıfırdan bir svFCS kurulumu oluşturmanın ayrıntılı bir açıklaması Ek materyalde verilmiştir.
Protokol
1. Özel yapım svFCS kurulumunun montajı için ayar özellikleri
NOT: Önerilen svFCS kurulumunun basitliği, foton geri kazanımında verimlilik sağlarken düşük maliyetle kolay kurulum, çalıştırma ve bakım sağlar. Daha fazla ayrıntı için Ek materyal bölümüne bakın.
- Deney odası ve güvenlik
- Sistemi yaklaşık 21 ° C'de stabilize edilmiş bir odaya kurun.
- Pasif (veya aktif) optik tablada doğrudan hava akışından kaçının ve optik hizalama için lazer güvenlik kurallarına uyun.
- Donanım ve yazılım
NOT: Ek malzeme, Şekil 2'de gösterilen kurulum adımlarını detaylandırır.- LabVIEW'deki ana edinme ve kontrol yazılımını, çok işlevli bir edinme kartının denetleyicilerin çoğunu yönlendirdiği bir durum makinesi ve olay yapısı mimarisi kullanarak yazın.
NOT: Korelatör, lazer ve güç ölçer kendi yazılımları tarafından kontrol edilir veya izlenir. - Donanım ve yazılım yükleme prosedürlerini kullanılan donanıma göre uyarlayın.
- LabVIEW'deki ana edinme ve kontrol yazılımını, çok işlevli bir edinme kartının denetleyicilerin çoğunu yönlendirdiği bir durum makinesi ve olay yapısı mimarisi kullanarak yazın.
- Optik kurulum
NOT: Şekil 3 , optik hizalamaların kalitesini kontrol etmek için aşağıdaki bölümlerde kullanılan optik tezgah modüllerini göstermektedir. Tüm optik eleman özellikleri Malzeme tablosunda listelenmiştir. Kurulumu oluşturma prosedürü, Ek malzemede geniş ölçüde ayrıntılandırılmıştır. Bu sistem sürekli dalga lazeri, daldırma suyu hedefi ile donatılmış motorlu ters çevrilmiş bir mikroskop, tek bir foton sayma modülüne bağlı bir çığ fotodiyot dedektörü ve bir donanım korelatöründen oluşur. Titreşimsiz ısıtıcılara sahip bir mikroskop inkübasyon odası, canlı hücreler üzerindeki deneyler için sıcaklığı kontrol etmek üzere özel olarak tasarlanmıştır. Geleneksel olarak, XY ekseni optik yolun dik düzlemine karşılık gelir ve Z ekseni optik yola karşılık gelir.
2. Denemeyi çalıştırmadan önce günlük kontrol noktası
- Uyarma yolunu kontrol edin (Şekil 3,
 &
&  ).
).- Tüm iris diyaframlarını açın.
- İlk irisi tamamen açık tutarak lazer gücünü güç ölçerle ölçün.
- Maksimum gücü bulmak için yarım dalga plakasını (HWP) çevirin.
- Lazer gücü normalden düşükse süsenleri kullanarak hizalamayı kontrol edin ve gerekirse L1 ve M1'i dönüşümlü olarak hareket ettirin.
- Deney laboratuvarı not defterindeki güç değerini not alın.
- Algılama yolunu kontrol edin (Şekil 3,
 &
&  ).
).- Suyu, bir örtü parçasını ve 2 nM rodamin 6G (Rh6G) çözeltisinin bir damlacığını hedefe yerleştirin.
- Floresan sinyali (LabVIEW yazılımıyla kaydedilen APD'deki sayım numarası) normalden düşükse, Rh6G çözümünü yeniden yapın, objektif lens üzerindeki konumlandırmayı ve kapak kapağının numarasını kontrol edin veya varsa kabarcıkları ortadan kaldırın.
- Floresan sinyali hala normalden düşükse, ışını engellemek için güç ölçeri optik yolun içine yerleştirin.
- APD'yi kapatın (bundan böyle APD, APD'yi ve tek foton sayma modülünü ifade eder).
- Örneği çıkarın.
- Objektif lensi temizleyin ve yansıtıcı bir hedefle değiştirin.
- Güç ölçeri ışık yolundan çıkararak yansıtıcı hedef üzerindeki lazer ışınını kontrol edin. Hedefin ışınının ortalandığından ve geri yansımanın çizgideki
 ilk iris'e ulaştığından emin olun (Şekil 3).
ilk iris'e ulaştığından emin olun (Şekil 3). - Değilse, merkez konumlandırmayı M2 ile veya arka yansımayı dikroik ayna ile ayarlayın.
- Mikroskop bağlantısı doğruysa, objektif lensi geri itin, bir damla su, bir kapak kayması ve daha konsantre bir Rh6G çözeltisinin (yani, 200 nM) bir damlacığını ekleyin ve klasik ölçümlerden (birkaç μW) daha düşük bir lazer gücü ayarlayın.
- APD'yi açın ve yoğunluk sinyalini izlerken (LabVIEW yazılımı) ilgili XYZ ayar vidalarıyla APD ve iğne deliği hizalamasını dönüşümlü olarak optimize edin.
- Kapak kapağını değiştirin ve daha düşük bir Rh6G (2 nM) konsantrasyonu ekleyin. Moleküler parlaklık oranının arttığı ve belin minimum olduğu bir konum bulmak için iğne deliğini Z ekseni boyunca hareket ettirin.
- Sinyal düşene kadar irisi kapatın: lazer ışını boyutu, hedefin arka diyafram açıklığı boyutuna ulaşır (yani, minimum bel boyutu, Ek malzemeye bakınız).
- İlişkilendirici yazılımını başlatın ve verileri kaydedin (veri kaydı için bölüm 7'ye bakın).
- Düşük miktarda gürültü göstermesi, küçük bir bel boyutu vermesi ve saniyede molekül başına yüksek bir sayım oranı vermesi gereken ACF'yi kontrol edin (veri analizi ve bel boyutu değerlendirmesi için bölüm 7'ye bakın).
3. svFCS veri kaydı ve analizi için genel hususlar
- Bu genel şemayı izleyerek floresan verilerini kaydedin ve analiz edin (bkz. bölüm 7, 8 ve 9): (1) floresan kaydı ve ACF üretimi (korelatör yazılımı), (2) verilerin beklenmedik şekilde atılması, tutulan verilerin ortalaması, uygun modele uygun (ev yapımı Igor Pro yazılımıyla), (3) difüzyon yasası grafiği (ev yapımı MATLAB yazılımı 1) ve (4) isteğe bağlı difüzyon yasası karşılaştırması (ev yapımı MATLAB yazılımı 2). Talep üzerine farklı yazılım programları mevcuttur.
NOT: Donanım korelatörünün minimum örnekleme süresi 12,5 ns'dir (yani, 80 MHz'lik bir örnekleme frekansı). Çözelti içinde serbestçe yayılan küçük molekülün tipik yerleşik süresinden en az 1.000 daha düşük ve konfokal gözlem hacmi içindeki membran proteinlerinin difüzyon süresinden 106 daha küçük olan zamansal bir çözünürlük sağlar.
4. Hücre kültürü ve transfeksiyon
- Cos7 hücrelerini% 5 fetal sığır serumu, penisilin (100 U / mL), streptomisin (100 U / mL) ve L-glutamin (1 mM) ile desteklenmiş tam Dulbecco'nun Modifiye Kartal Ortamını (DMEM) kullanarak 10.000 hücre / kuyu yoğunluğunda #1.0 borosilikat cam tabana sahip 8 kuyucuklu kapaklı kapakta tohumlayın.
- Hücreleri 37 ° C'de, 24 saat boyunca% 5 CO2 içeren nemlendirilmiş bir atmosferde kültürleyin.
- Ortamı çıkarın, kuyucuk başına 300 μL taze tam kültür ortamı ekleyin ve hücreleri 37 ° C'de 30 dakika boyunca önceden inkübe edin.
- 50 μL serumsuz DMEM'de eGFP25 ile kaynaşmış Thy-1 proteinini kodlayan plazmid DNA'sının 0.5 μg'sini seyreltin. Vorteks kısaca karıştırmak için.
- DNA transfeksiyon reaktifinin 1.5 μL'sini 50 μL serumsuz DMEM'de seyreltin ve çözeltiyi iyice karıştırın.
- Seyreltilmiş transfeksiyon reaktifini doğrudan hazırlanan DNA çözeltisine ekleyin ve bileşikleri hemen karıştırın.
- Hazırlanan karışımı oda sıcaklığında 10 ila 15 dakika boyunca inkübe edin.
- Kombine DNA / transfeksiyon reaktif komplekslerinin 10 μL'sini her bir kuyucuktaki ortama damla damla ekleyin ve plakayı hafifçe döndürerek homojenleştirin.
- Hücreleri 37 ° C'de 3 saat boyunca% 5 CO2 ile inkübe edin.
- Kuluçkadan sonra, DNA / transfeksiyon reaktif komplekslerini içeren ortamı 400 μL taze tam DMEM ile değiştirin ve svFCS deneyinden önce hücreleri 16 saat boyunca kültürleyin.
5. svFCS ölçümleri için hücrelerin hazırlanması
- Kültür ortamını kaldırın.
- Hücreleri, 10 mM (4-(2-hidroksietil)-1-piperazineetansülfonik asit) (HEPES), pH 7.4 (HBSS / HEPES) ile desteklenmiş Ca 2+ ve Mg 2+ içeren serumsuz Hank'in dengeli tuz çözeltisi (HBSS) tamponu ile iki ila üç kez nazikçe yıkayın.
- Tüm svFCS alımları sırasında hücreleri HBSS/HEPES tamponunda tutun.
6. Farmakolojik tedavi
- Kültür ortamını çıkarın ve hücreleri 10 mM HEPES, pH 7.4 (HBSS / HEPES) ile desteklenmiş serumsuz HBSS ile iki ila üç kez yıkayın.
- Hücreleri HBSS / HEPES tamponunda 1 U / mL kolesterol oksidaz (COaz) çözeltisi ile 37 ° C'de 1 saat boyunca inkübe edin.
- Çözeltiyi çıkarın ve svFCS ölçümlerini gerçekleştirirken hücreleri HBSS / HEPES tamponunda 0,1 U / mL COaz varlığında tutun.
7. Spot boyutu kalibrasyonu
- Mikroskop haznesini 37 °C'de önceden ısıtın.
- Seri seyreltme ile standart bir 2 nM Rh6G çözeltisi hazırlayın.
- 200 μL'lik 2 nM Rh6G solüsyonunu suya daldırma hedefine yerleştirilmiş bir cam kapak kapağına bırakın.
- Tüm donanım ve yazılımları başlatın.
- Kullanılan floresan probun parlaklığına ve foto-kararlılığına bağlı olarak, bu gücü (1) kararlı olması gereken floresan yoğunluğuna (LabVIEW yazılımında), (2) zaman içinde sabit bir şekle sahip olması gereken ACF şekline (korelatör yazılımında) göre ayarlayın, ve (3) küçük bir bel boyutu ve molekül başına yüksek bir sayım oranı veren uydurma parametreleri (saniyede molekül başına fotonlar, tipik olarak saniyede molekül başına birkaç on ila yüzlerce foton).
NOT: ACF'nin genliği (G(0) olarak adlandırılır), molekülün sayısıyla (yani floresan probun konsantrasyonu) ters orantılıdır. Bel ölçüsü kalibrasyonu için bu iyi bir kalite kontrol adayı parametresidir. Bu nedenle, G (0), bel boyutunu ve konsantrasyonunu birbirine bağladığı için günden güne aynı konsantrasyon için benzer olmalıdır. Hücre ölçümleri için, FCS düşük konsantrasyon için daha doğru olduğundan, uygun parametre uydurma ekstraksiyonu için G (0) yüksek olmalıdır. - svFCS aydınlatma/algılama mikroskobu bağlantı noktasını LabVIEW yazılımıyla ayarlayın.
- APD'yi açın.
- Minimum bel boyutunu elde etmek için sinyal düşene kadar irisi kapatın veya daha büyük bel boyutu için kapatın.
- İstatistiksel tekrarlanabilirliği artırmak için seçilen süredeki birkaç ACF'yi (yani bir çalıştırmayı) kaydedin, tipik olarak korelatör yazılımıyla her biri 20 s süren 10 çalıştırma.
- APD'yi kapatın.
- Moleküler agregalar nedeniyle güçlü dalgalanmalarla çalışmaları kontrol etmek ve atmak için Igor Pro yazılımını kullanın. Bu adımı manuel olarak gerçekleştirin — kullanıcılar eğitildikten sonra kullanıcıdan bağımsız olmalıdır.
- Tutulan ACF'lerin ortalamasını 3B difüzyon modeliyle eşleştirin.
- Uydurma parametrelerinden ortalama difüzyon süresini
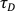 çıkarın ve bir ".txt" dosyasına kaydedin (dosya formatı Igor Pro yazılımı tarafından belirlenir).
çıkarın ve bir ".txt" dosyasına kaydedin (dosya formatı Igor Pro yazılımı tarafından belirlenir). - Ortalama yoğunluğu (floresan izinden ekstrakte edilen) molekül sayısına (ACF'den ekstrakte edilen) bölerek saniyede molekül başına sayım oranını (iyi bir performans göstergesi) kontrol edin.
NOT: Aynı alma parametreleri için bu değerin günden güne yüksek ve kararlı olduğundan emin olun. - Rh6G'nin sulu çözeltideki difüzyon katsayısını 37 ° C'de (D) bilerek ve
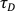 (bkz. 7.13), deneysel bel boyutunu ω aşağıdakilere göre hesaplayın:
(bkz. 7.13), deneysel bel boyutunu ω aşağıdakilere göre hesaplayın: 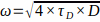 .
. - FCS difüzyon yasasını çizmek için gereken her bel ölçüsü değişikliği için ve svFCS veri toplamanın herhangi bir yeni deneysel serisinden önce prosedürü uygulayın.
8. svFCS hücreler üzerinde veri toplama
- Kullanılan floresan probun parlaklığına ve fotostabilitesine bağlı olarak, fotobeyazlatmayı düşük tutarken (yani, LabVIEW yazılımında kararlı bir yoğunluk izi) molekül başına yüksek bir sayım oranına (tipik olarak saniyede molekül başına birkaç bin foton) izin vermek için bu gücü uyarlayın.
- Ölçümlere başlamadan önce numuneleri 37 °C'de 10 dakika boyunca dengeleyin.
- Epi-floresan aydınlatma mikroskobunu LabVIEW yazılımı ile ayarlayın.
- Uygun bir floresan prob konumuna ve (düşük) floresan sinyal yoğunluğuna sahip bir hücre seçin.
NOT: Floresan ne kadar düşük olursa, FCS ölçümleri o kadar iyi olur (bkz. adım 8.1). - svFCS aydınlatma/algılama mikroskobu bağlantı noktasını LabVIEW yazılımıyla ayarlayın.
- APD'yi açın.
- LabVIEW yazılımıyla seçili hücrenin xy taramasını gerçekleştirin.
- Bir z-taraması yapın ve üstteki plazma membranını seçerek konfokal noktayı maksimum floresan yoğunluğunda bulun ve veri toplamaya başlayın. İki zar arasındaki ayrımı en üst düzeye çıkarmak için, tercihen taramayı hücrenin nükleer alanında gerçekleştirin.
- Her biri korelatör yazılımıyla 5 saniye süren 20 çalıştırmadan oluşan bir seri kaydedin.
NOT: Her çalıştırma süresinin, gürültüyü azaltılmış ACF'ler elde etmek için yeterince uzun olduğundan emin olun. Uzun kazanımlar fotobeyazlatmaya veya beklenmeyen önemli değişikliklere (örneğin, agregalar) karşı hassastır. Çalıştırma sayısını, sürelerini ve seri sayısını örneklere uyarlayın, ancak tekrarlanabilirlik için aynı deneme yığını içinde sabit kaldıklarından emin olun. - APD'yi kapatın.
- Igor Pro yazılımı ile beklenmeyen çalıştırmaları atın.
- Ortalama ACF'yi 2 tür 2B difüzyon modeliyle eşleştirin. Bu modeli hedef molekülün difüzyon davranışı tipine uyarlayın.
- Sığdırma parametrelerini önceki dosyaya kaydedin (bkz. adım 7.13).
- En az 10 farklı hücrede 10 ila 15 dizi kayıt gerçekleştirin ve 8,3 ile 8,13 arasındaki adımları yeniden oluşturun. Elde edilen tek dosyanın bel ölçüsü bilgilerini ve 10-15 kaydın uydurma parametrelerini içerdiğinden emin olun.
- Tek bir difüzyon yasası oluşturmak için, 200 ila 400 nm arasında değişen en az dört bel boyutunu analiz edin. Bu aralık kırınım optik sınırı ile tanımlanır, ancak objektif (sayısal diyafram) ve lazer (dalga boyu) bağımlıdır.
NOT: Bel ölçüsü kalibrasyonu mutlak olmadığından ve bir dereceye kadar belirsizliğe sahip olduğundan, x ve y hatasını (yani ω 2 ve td) hesaba katan özel bir MATLAB yazılımı28, difüzyon yasasına uyacak şekilde oluşturulmuştur. - MATLAB yazılımı 1'i başlatın ve en az dört bel boyutu deneyine karşılık gelen tüm ".txt" dosyalarını içeren bir klasör seçin.
- Arsa <td> karşı <ω2>, yani difüzyon yasası. İki ana parametre çıkarılabilir: y ekseni kesişimi (t0) ve etkili difüzyon katsayısı (Deff, eğimle ters orantılı).
9. Farklı deneysel durum karşılaştırmasının difüzyon yasaları
NOT: Gerekirse, farklı deney koşulları için bölüm 7 ve 8'i çoğaltın. Bu difüzyon yasalarının t0 ve Deff değerleri28'e göre benzer olup olmadığını belirlemek için özel bir yazılım (MATLAB yazılımı 2) geliştirilmiştir. İki hipotezi test eder: iki değer farklıdır veya iki değer yanlış alarm olasılığının (PFA) üzerinde ayarlanan bir eşikte farklı değildir. %5'lik rastgele bir PFA değeri (T = 3.8), iki parametre (t0 veya Deff) arasındaki anlamlılığın üst sınırı olarak kabul edilir, bu da iki değerin aynı olma ihtimalinin sadece% 5 olduğunu gösterir.
- Karşılaştırılacak her koşulun karakteristik difüzyon yasası değerlerini içeren bir ".xls" dosyası oluşturun (yani, tablo olarak işlenmemiş (NT) ve işlenmiş (COaz) koşullar için t 0, t0 hatası, D eff ve Deff hatasını içeren bir dosya).
- MATLAB yazılımı 2'yi başlatın.
- ".xls" dosyasını seçin.
- Oluşturulan renk kodlu 2B grafiği analiz edin, burada t0 ve Deff istatistiksel testleri sırasıyla x ve y eksenleri üzerinde çizilecektir (Şekil 4). T ne kadar yüksek olursa, karşılaştırılan değerler arasındaki fark o kadar büyük olur.
10. Kolesterol konsantrasyon ölçümleri
- Hücre tedavisi ve lizis
- Cos7 hücrelerini 4 × 10 5 hücre/kuyucukta 6 delikli plakalar halinde üçlü olarak tohumlayın ve hücrelerin plakaya yapışmasını sağlamak için gece boyunca%5 CO 2 ile 37 ° C'de2 mL tam DMEM'de inkübe edin.
- Kültür ortamını çıkarın ve hücreleri fosfat tamponlu salin (PBS) ile üç kez yıkayın.
- 1 U / mL Coase içeren (veya içermeyen) 1 mL HBSS / HEPES tamponu ekleyin ve% 5 CO2 ile 37 ° C'de 1 saat boyunca inkübe edin.
- Ortamı 0,1 U/mL Coase içeren 1 mL HBSS/HEPES ile değiştirin ve 37 °C'de %5 CO2 ile 1 saat inkübe edin.
- Çözeltiyi çıkarın ve hücreleri toplayın.
- Hücreleri PBS ile üç kez yıkayın ve oda sıcaklığında 5 dakika boyunca 400 × g'da santrifüj yapın.
- Radyoimmünopresipitasyon tahlil tamponu (25 mM HEPES, pH 7.4, 150 mM NaCl, %1 NP40, 10 mM, MgCl 2, 1 mM etilendiamin tetraasetik asit, %2 gliserol, proteaz ve fosfataz inhibitörü kokteyli) ile hücreleri buz üzerinde 30 dakika boyunca lize edin.
- Lisatları 10000 × g'da 4 ° C'de 10 dakika boyunca santrifüj edin ve süpernatanı toplayın.
- Üreticinin tavsiyelerine göre çalışma solüsyonunu kullanarak Bradford'un protein testini değiştirerek her numune için toplam protein konsantrasyonunu ölçün.
- Kolesterol konsantrasyonu ölçümü
- Toplam hücresel kolesterol seviyesini enzimatik olarak belirlemek için, üreticinin tavsiyelerine göre uygun kiti (örneğin, Amplex Kırmızı Kolesterol Tahlil Kiti) kullanın.
- Her reaksiyon için, 5 μg protein içeren numuneyi Amplex Red reaktifi / yaban turpu peroksidaz / kolesterol oksidaz / kolesterol esteraz çalışma çözeltisi ile karıştırın ve karanlıkta 37 ° C'de 30 dakika boyunca inkübe edin.
- 520 nm uyarma kullanarak floresanı ölçün ve bir mikroplaka okuyucu kullanarak 560-590 nm'deki emisyonu tespit edin.
- Arka planı nihai değerden çıkarın ve standart bir eğri kullanarak kolesterol konsantrasyonunu belirleyin.
- μg protein başına ng kolesterol cinsinden nihai kolesterol içeriğini hesaplayın.
Sonuçlar
Cos-7 hücrelerinde eksprese edilen Thy1-GFP için bir DL ürettik (Şekil 4, siyah kareler). Difüzyon yasası pozitif bir t0 değerine (19.47 ms ± 2 ms) sahiptir, bu da Thy1-GFP'nin plazma zarının nanodomain yapılarında sınırlı olduğunu gösterir. Thy1-GFP'yi eksprese eden hücrelerin kolesterol oksidaz tedavisi, DL t0 değerinin 7.36 ± 1.34 ms'ye kaymasıyla sonuçlanmıştır (Şekil 4, gri kareler). Bu gözlem, Thy1-GFP hapsinin doğasının kolesterol içeriğine bağlı olduğunu ve lipit sal nanodomainleri ile ilişkili olduğunu doğrulamaktadır. Bu iki difüzyon yasasının, yukarıda açıklanan istatistiksel teste göre (bkz. adım 9.1.3) t0 ve Deff değerleri açısından farklı olduğu gösterilmiştir. Ek olarak, tedavi edilmemiş Cos-7 hücrelerinde toplam hücresel kolesterol konsantrasyonunu, COaz ile tedavi edilen hücrelere karşı değerlendirdik. COaz tedavisi üzerine total kolesterol içeriğinde küçük ama anlamlı bir azalma gözlenir (Şekil 5). Bu enzim sadece plazma zarının dış broşüründe erişilebilen kolesterol havuzuna etki ettiğinden, kolesterolde gözlenen azalmanın sadece plazma zarı ile ilişkili olduğunu ve lipit sal nanodomainlerinin dengesizleşmesine neden olduğunu varsayıyoruz.
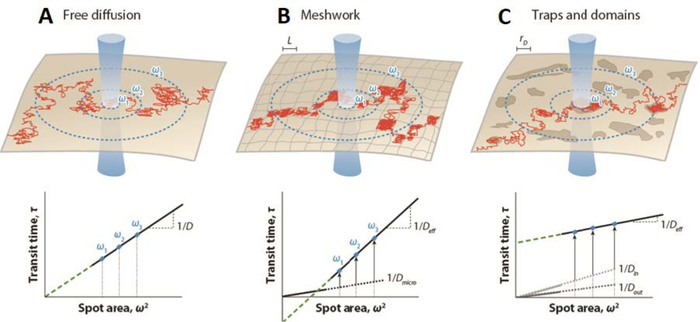
Şekil 1: Farklı membran organizasyonu formları için nokta varyasyonu FCS tarafından oluşturulan simüle edilmiş floresan korelasyon spektroskopisi (FCS) difüzyon yasaları. (Üst paneller) Membran organizasyonunun şematik gösterimi - (A) serbest difüzyon, (B) örgü bariyerleri ve (C) tuzak / etki alanı hapsedilmeleri - tek bir molekül için çizilen yörünge (kırmızı). Mavi daireler, zarın kesişimini ve bel ω lazer ışınını gösterir. (Alt paneller) FCS difüzyon yasaları, difüzyon zamanının t d'yi ω2 karesinin bir fonksiyonu olarak çizerek temsil edilir. Difüzyon yasası projeksiyonu (yeşil kesikli çizgi), serbest difüzyon durumunda (A) orijinde (t 0 = 0) zaman eksenini keser; (B) örgü bariyerleri olduğunda negatif eksende (t 0 < 0) veya tuzaklar ve alanlar (lipit salları) olduğunda (C) pozitif eksende (t0 > 0) D, Brownian hareketi için yanal difüzyon katsayısıdır; Deff, etkili difüzyon katsayısı; Dmikro, ağ tuzaklarının içindeki mikroskobik difüzyon katsayısı; Diçinde, etki alanları içindeki difüzyon katsayısı; Ddışarı, etki alanları dışındaki difüzyon katsayısı; L, kare bir alanın kenarının boyutu; ve rD, dairesel bir alanın yarıçapı. Bu rakam He ve Marguet6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: svFCS donanım denetiminin şematik görünümü. Bilgisayar tüm cihazları farklı iletişim protokolleri aracılığıyla kontrol eder: seri (mikroskop, harici deklanşör), USB (XYZ piezoelektrik aşama, korelatör) ve PCI (edinme kartı). DAQ: veri toplama kartı, APD: çığ fotodiyot, SPCM: tek foton sayma modülü, DO: dijital çıkış. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
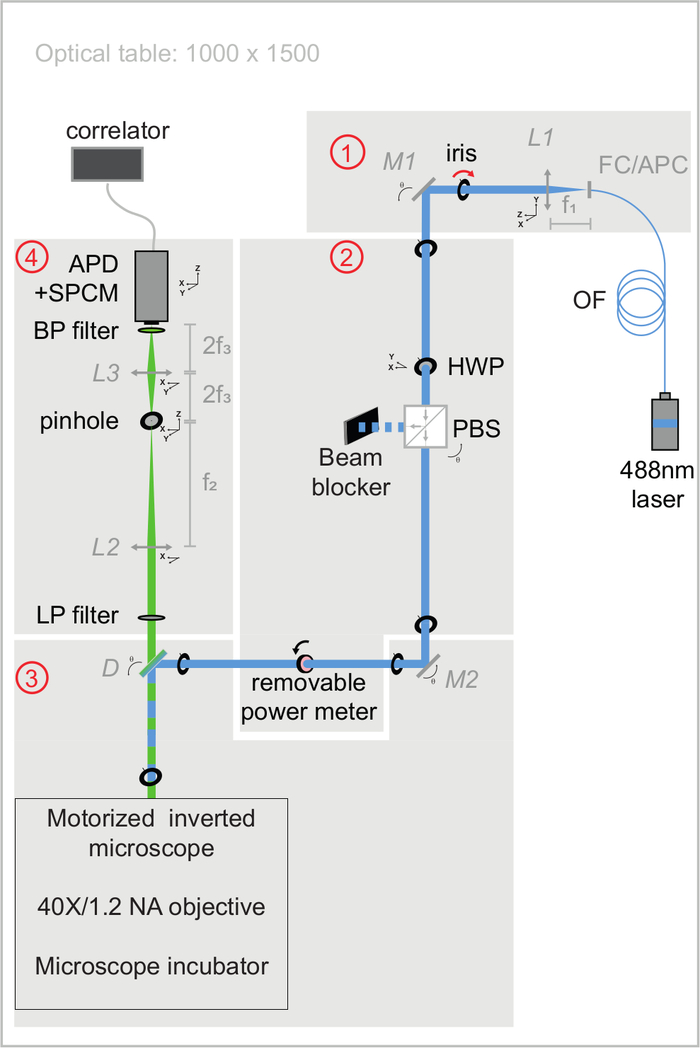
Şekil 3: svFCS kurulumunun uyarma ve emisyon optik yollarının şematik görünümü. svFCS kurulumu dört modül içerir: (1) fiberli bir 488 nm lazerin çıkışı harmanlanır, (2) yarım dalga plakası ve polarize edici ışın ayırıcının bir kombinasyonu optik gücü ayarlar, (3) tüp lenssiz motorlu mikroskoptan geçtikten sonra numuneye odaklanan lazer ışını ve (4) floresan, tek bir foton sayma modülüne bağlı bir çığ fotodiyotuna konfokal benzeri bir algılama yolu aracılığıyla tespit edilir, bu da bir donanım korelatörüne sinyal gönderir. Sadelik, sisteme hassasiyetini, sağlamlığını ve kullanım kolaylığını verir ( Ek materyalde yaygın olarak yorumlanmıştır). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
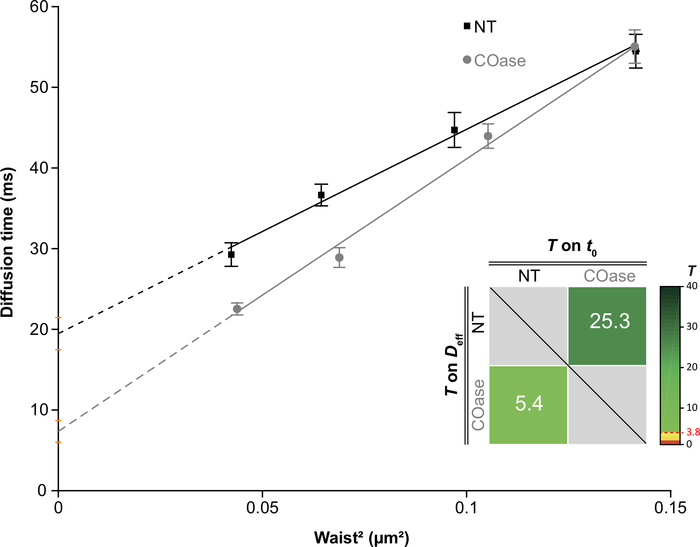
Şekil 4: Cos-7'de ifade edilen Thy1-GFP'nin difüzyon analizinden elde edilen svFCS difüzyon yasaları. Cos-7 hücrelerinin tedavi edilmeden (NT, siyah kareler) ve kolesterol oksidaz tedavisinden sonra (COaz, gri daireler) svFCS difüzyon yasaları. Grafikteki ek, sunulan iki svFCS difüzyon yasası arasındaki anlamlı farkın istatistiksel testini temsil etmektedir (Mailfert ve ark.28'e göre). Test değeri (T), her iki difüzyon yasası farklı olduğunda 3.8 olarak ayarlanan eşiğin üzerinde olmalıdır. Ne kadar yüksek olursa, difüzyon yasaları arasındaki fark da o kadar büyük olur. T değeri renk kodludur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
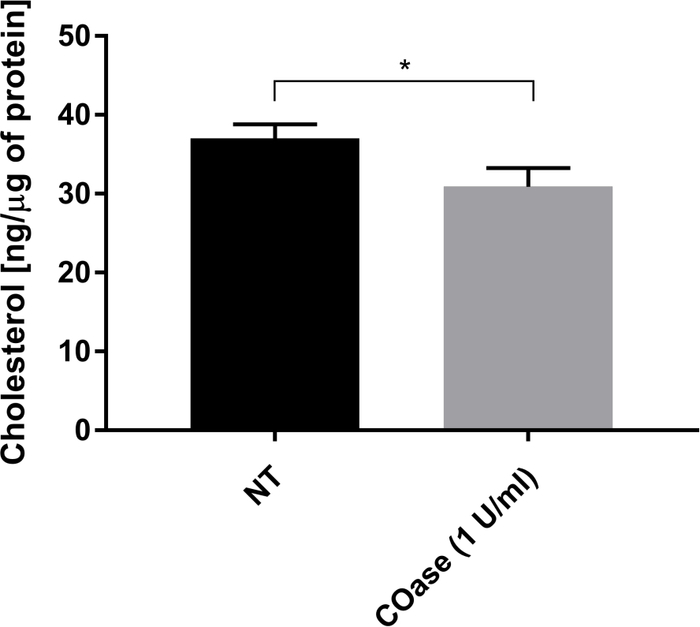
Şekil 5: Cos-7 hücrelerinde toplam kolesterol içeriğinin karşılaştırılması. Cos-7 hücreleri ya tedavi edilmedi (NT) ya da 1 saat boyunca 1 U / mL kolesterol oksidaz (COaz) ile tedavi edildi. Veriler, üçlü olarak yapılan bir denemenin bir örneğini temsil eder. İstatistiksel farkı değerlendirmek için iki kuyruklu, eşleşmemiş bir t-testi kullanıldı (α=0.05). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Malzeme tablosu: svFCS kurulumu için gereken optik elemanların listesi.
Ek materyal: Bu belgede, svFCS kurulumunun sıfırdan oluşturulması açıklanmaktadır. Bu dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada, svFCS modülünün standart bir floresan mikroskop üzerinde uygulanmasını, FCS difüzyon yasası analizi sayesinde canlı hücrelerdeki plazma membran organizasyonunun dinamiklerini deşifre etmek için güçlü bir deneysel yaklaşımı açıkladık. Kavramsal olarak, svFCS basit bir ilkeye dayanmaktadır: aydınlatma alanının boyutunu değiştirirken zaman alanındaki floresanın korelasyon ölçümleri23. Bu strateji, mikroskobik ölçümlerden nanoskopik bilgi çıkarmada etkili olmuştur, bu da plazma zarı organizasyonuna kararlı halde 25 ve fizyolojik süreçlerde 30,31,32,33'te katkıda bulunan ana fizikokimyasal elementlerin deşifre edilmesine yardımcı olmaktadır. Toplamda, bu svFCS analizleri, çeşitli hücre tiplerinde lipite bağımlı nanodomainlerin varlığını ve farklı sinyal olaylarının ayarlanmasında doğrudan etkilerini açıkça göstermektedir.
Bu çerçevede, foton bütçesini optimize etmek ve optik sapmaları en aza indirmek için svFCS kurulumunu oluştururken göz önünde bulundurulması gereken bazı optik hususlar vardır. Bu nedenle, svFCS ölçümü yapıldığında tüp lensin çıkarılabileceği bir mikroskop kullanmanızı öneririz. Dahası, tek bir iris, svFCS kurulumunda önemli bir rol oynar: hedefin arka açıklığındaki ışın boyutunu değiştirir, böylece etkili bel boyutunu (yani etkili uyarma hacmini) doğrudan değiştirir. Kiriş çapı, en küçük bel boyutu34'ü elde etmek için objektif arka göz bebeğine uymalıdır. Bel ölçüsünün ayarlanmasına yardımcı olan bu seçenek, foton bütçesinin optimizasyonunu sağlar ve uygulanması kolaydır. Son olarak, ışık yolu boyunca minimum sayıda optik parça kullanılır; sistem ne kadar az karmaşık olursa, kaybolan fotonlar o kadar az olur. Tüm bu seçenekler svFCS deneylerinin sağlamlığını önemli ölçüde artırır.
Protokolün kendisi ile ilgili olarak, birkaç kritik adım göz önünde bulundurulmalıdır. En önemlisi, başarılı svFCS ölçümleri için çok önemli olan optik yolların uygun bir şekilde hizalanmasıdır (protokol, bölüm 2). 300 μW lazer aydınlatma altında ~ 200 kHz olması gereken 2 nM Rh6G çözeltisinden gelen floresan sinyalini analiz ederek bunu kontrol etmek kolaydır. Tüm süsenler açılmalı ve ACF'ler önemli bir genliğe sahip olmalıdır (tipik olarak G0 ~ 1.5-2.0). Bir diğer kritik nokta ise hücreler ve bunların svFCS analizine hazırlanması ile ilgilidir (protokol, bölüm 4-8). Yoğunlukları, gözlemlenecek izole hücrelerin analiz için mevcut olması için uyarlanmalıdır. Yapışkan olmayan hücreler, poli-L-lizin çözeltisi kullanılarak odacıklı bir kapak camı üzerinde hareketsiz hale getirilmelidir. Hücre etiketlemesinden gelen floresan sinyali çok güçlü olmamalıdır, aksi takdirde sığması zor olan çok düz ACF'lere neden olur ve uyum parametreleri önemli bir hatayla yüklenir. Ek olarak, hücrelerdeki homojen olmayan etiketleme ve floresan agregaları, svFCS ölçümlerinin yorumlanmasını son derece zorlaştırır. Son olarak, kolesterol oksidaz tedavisi hücre canlılığını etkiler ve svFCS analizi tedaviden bir saat sonra geçmemelidir. Desteğe bağlı olmadığı için üst plazma zarından floresan dalgalanmalarını kaydetmek de daha iyidir ve destekle fiziksel etkileşimler nedeniyle moleküllerin difüzyonunun engellenmesi riski yoktur.
svFCS tekniğinde, algılama hacmini ayarlamak için kullanılan yöntemlerin çeşitliliği nedeniyle farklı yaklaşımlarda kullanımı için yeterli ilerleme kaydedilmiştir ve bu da canlı hücrelerdeki çeşitli biyolojik süreçleri incelemeyi mümkün kılmaktadır. Uyarma hacminin boyutunu ayarlamaya bir alternatif, değişken bir ışın genişletici35 kullanmaktır. Plazma zarının z yönü36 boyunca kesişmesinden gelen floresan sinyalini kaydederek aydınlatma alanının boyutunu modüle etmek de mümkündür. Bu, difüzyon yasası37,38'i türetmek için teorik bir çerçevenin geliştirildiği standart bir konfokal mikroskopta yapılabilir.
svFCS yöntemi, plazma zarının homojen olmayan yanal organizasyonunun karakterizasyonu için gerekli olan mekansal-zamansal çözünürlük sunsa da, geometrik hapsetme modları birbirini dışlamaz. Bir yönde veya diğerinde t0'lık bir sapma, yalnızca baskın bir hapsetme modunu ortaya çıkarır25. Ayrıca, mevcut svFCS yönteminin bir diğer önemli sınırlaması, klasik optik kırınım sınırından (~ 200 nm) kaynaklanmaktadır. Bu, hücre plazma zarı içindeki molekülleri sınırlayan alanlardan tartışmasız daha büyüktür. Bu nedenle, hapsedilmenin analizi, difüzyon yasasından çıkarılan t0 değerinden çıkarılır.
Bu dezavantaj, alternatif yöntemler uygulanarak aşılmıştır. Başlangıçta, nanodiyaframlarla delinmiş metalik filmlerin kullanılması, çok küçük bir membran alanını aydınlatma imkanı sundu (yani, 75 ila 250 nm arasında değişen yarıçaplı tek nanometrik açıklıkların optik kırınım sınırının altında)39. İzole etki alanı organizasyonu için teorik difüzyon yasasından öngörülen geçiş rejimi böylece rapor edildi ve nanometrik membran heterojenitelerinin karakteristik boyutunun iyileştirilmesine ve lipit bağımlı nanodomainler tarafından işgal edilen yüzey alanının nicel bir tahminine izin verdi39. Alternatif olarak, nanometrik aydınlatma, yakın alan taramalı optik mikroskopi40 veya düzlemsel optik nanoantenler41 kullanılarak da geliştirilmiştir. Daha yakın zamanlarda, uyarılmış emisyon tükenmesi (STED) ve FCS'yi birleştirmek, difüzyon yasasını çok yüksek uzamsal çözünürlükle belgelemek için güçlü ve hassas bir araç sağlamıştır. Bu STED-FCS, kısa bir süre içinde meydana gelen nano ölçekte moleküler difüzyon özelliklerine erişim sağlar ve plazma zarı42,43'teki lipit problarının dinamik organizasyonunun incelenmesine izin verir. Bununla birlikte, STED prosesinde floresanın eksik baskılanması, FCS'deki oto-korelasyon eğrilerinin analizini zorlaştırmaktadır.
Bu zorluğun üstesinden gelmek, difüzyon sürelerinin ve ortalama molekül sayısı ölçümlerinin doğruluğunu artırmak için yeni bir montaj modeli geliştirilmiştir44. Son olarak, plazma zarında yavaş moleküler difüzyon için, svFCS prensibi görüntü korelasyon spektroskopisi45 ile kaydedilen verilere uygulanabilir. Son zamanlarda, atomik kuvvet mikroskobunun (AFM) görüntüleme toplam iç yansıması-FCS (ITIR-FCS) ile birleştirilmesinin, plazma zarında moleküler difüzyonu engelleyen mekanizmanın doğasının iyileştirilmesine katkıda bulunduğu, özellikle de nanodomainlerin yüksek yoğunluğu nedeniyle perkolasyon eşiği membran konfigürasyonunun yakınında46 olduğu gösterilmiştir.
Sonuç olarak, svFCS tarafından difüzyon yasasının oluşturulması, dinamik kolektif lipitler ve membran proteinlerinin ilişkilerinin yarattığı yerel heterojenliği çıkarmak için deneysel kanıtlar sağlamıştır. Wohland ve iş arkadaşları46 tarafından belirtildiği gibi, "FCS difüzyon yasası analizi, dinamik bilgilerden çözünürlük sınırının altındaki yapısal ve organizasyonel özellikleri çıkarmak için değerli bir araç olmaya devam etmektedir". Yine de, plazma zarında meydana gelen moleküler olayların dinamiklerinin daha iyi anlaşılmasını sağlayacak difüzyon yasasının yorumlanmasını iyileştirmek için yeni modeller geliştirmemiz gerekiyor.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
SB, SM ve DM, CNRS, Inserm ve Aix-Marseille Üniversitesi'nden kurumsal fonlar ve Fransız Ulusal Araştırma Ajansı'ndan (ANR-17-CE15-0032-01 ve ANR-18-CE15-0021-02) ve Fransız "Investissement d'Avenir" (ANR-10-INBS-04 France-BioImaging, ANR-11-LABX-054 labex INFORM) program hibeleriyle desteklenmiştir. KW, Biyoteknoloji ve Nanoteknoloji alanında BİLİNEN disiplinlerarası çevre doktora çalışmaları programı olan "BioTechNan" ı kabul etmektedir. EB, Polonya Ulusal Bilim Merkezi'nin (NCN) 2016/21/D/NZ1/00285 proje no'lu proje kapsamında Fransız Hükümeti ve Polonya'daki Fransa Büyükelçiliği'nin mali desteğini kabul eder. MŁ, Polonya Kalkınma Bakanlığı'nın (CBR POIR.02.01.00-00-0159/15-00/19) ve Ulusal Araştırma ve Geliştirme Merkezi'nin (Innochem POIR.01.02.00-00-0064/17) mali desteğini kabul eder. TT, Polonya Ulusal Bilim Merkezi'nden (NCN) 2016/21/B/NZ3/00343 proje no'lu proje kapsamında ve Wroclaw Biyoteknoloji Merkezi'nden (KNOW) mali destek aldığını kabul etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aligment tool | Spanner Wrench for SM1-Threaded Retaining Rings | Thorlabs | SPW602 |
| Avalanche Photodiode and Single Photon Counting Module (SPCM) | Single-Photon Counting Module, Avalanche Photodiode | Excelitas | SPCM-AQRH-15 |
| BNC 50 Ω plug to 50 Ω plug lead 2 m | RS Components | 742-4315 | |
| Coaxial cable 415 Cinch Connectors, RG-316, 50 Ω With connector, 1.22 m, RoHS2 | RS Components | 885-8172 | |
| Tee 50Ω RF Adapter BNC Plug to BNC Socket 0 → 1GHz | RS Components | 546-4948 | |
| Brennenstuhl 2.5 m, 8 Socket Type E – French Extension Lead, 230 V | RS Components | 768-5500 | |
| Mascot, 6W Plug In Power Supply 5V dc, 1.2A, 1 Output Switched Mode Power Supply, Type C | RS Components | 452-8394 | |
| Crystek CCSMACL-MC-24 Reference Oscillator Power Cable RF Adapter | RS Components | 792-4079 | |
| Fluorescence filtering | 535/70 ET Bandpass, AOI 0° Chroma Diameter 25 mm | AHF filter | F47-539 |
| Laser Beamsplitter zt488 RDC, AOI 45° Chroma 25.5 x 36 x 1 mm | AHF filter | F43-088 | |
| 496/LP BrightLine HC Longpass Filter, AOI 0° Chroma Diameter 25 | AHF filter | F37-496 | |
| Hardware correlator | 80 MHz Digital Correlator | Correlator.com | Flex02-12D |
| Laser | LASER LASOS LDM-XT fiber coupled, 488 nm, 65 mW | Lasos | BLD-XT 488100 |
| Laser safety | High-Performance Black Masking Tape, 1" x 180' (25 mm x 55 m) Roll | Thorlabs | T743-2.0 |
| Lens Tissues, 25 Sheets per Booklet, 5 Booklets | Thorlabs | MC-5 | |
| Laser Safety Glasses, Light Orange Lenses, 48% Visible Light Transmission | Thorlabs | LG3B | |
| Microscope | Zeiss Axiovert 200M Motorized Inverted Fluorescence Microscope Fine and coarse focusing, reflector turret rotation, objective nosepiece rotation, switching camera ports, and internal light shutters | Carl Zeiss | |
| C-Apochromat 40x/1,2 W Korr.selected for FCS (D=0.14-0.19 mm) (WD=0.28 mm at D=0.17 mm), UV-VIS-IR | Carl Zeiss | 421767-9971-711 | |
| Adapter W0.8 / M27x0.75 H "5" | Carl Zeiss | 000000-1698-345 | |
| Middle ring W0.8 - W0.8 H "5" | Carl Zeiss | 000000-1698-347 | |
| Optical path | D25.4mm Mirror, Protected Silver | Thorlabs | PF10-03-P01 |
| D25.4mm, F=60.0.mm, Visible Achromat | Thorlabs | AC254-060-A | |
| D25.4mm, F=35.0.mm, Visible Achromat | Thorlabs | AC254-035-A | |
| 25 µm mounted pinhole | Thorlabs | P25S I | |
| 25.4mm Mounted Zero, Order 1/2 Waveplate 488 nm | Thorlabs | WPH10M-488 (HWP) | |
| 20mm Polarizing Beamsplitter Cube 420-680 nm | Thorlabs | PBS201 | |
| Rotation Stage 56 mm x 26 mm Threaded ID | Thorlabs | RSP1/M | |
| 52 mm x 52 mm Kinematic Platform Mount | Thorlabs | KM100B/M | |
| Adjustable Prism Clamp | Thorlabs | PM3/M | |
| Beam block - active area 19 mm x 38 mm | Thorlabs | LB1/M | |
| Iris Diaphragm 1 mm to 25 mm Aperture | Thorlabs | ID25/M | |
| Left-Handed Kinematic Cylindrical Lens Mount | Thorlabs | KM100CL | |
| 1" Optic Holder, M4 Tap | Thorlabs | MFF101/M | |
| 1" Stackable Lens Tube | Thorlabs | SM1L03 | |
| Stackable Lens Mount for 1" optic-usable depth ½ | Thorlabs | SM1L05 | |
| Stackable Lens Mount For 1"Optic-usable Depth 2" | Thorlabs | SM1L20 | |
| Small Optical Rails 600mm, metric | Thorlabs | RLA600/M | |
| Small Optical Rails 75mm, metric | Thorlabs | RLA075/M | |
| Small Optical Rails 150mm, metric | Thorlabs | RLA150/M | |
| Rail Carrier, Counterbored Hole 1"x 1" | Thorlabs | RC1 | |
| Rail Carrier, Perpendicular Dovetail | Thorlabs | RC3 | |
| High Precision Translating Lens Mount for 1 inch | Thorlabs | LM1XY/M | |
| ½ " (12mm) Dovetail Translation Stage | Thorlabs | DT12/M | |
| Rail Clamps | Thorlabs | CL6 | |
| Metric XYZ Translation Stage (Includes PT102) | Thorlabs | PT3/M | |
| Black Rubberized Fabric | Thorlabs | BK5 | |
| Ball Driver kit/ 6 tools | Thorlabs | BD-KIT/M | |
| Adapter with External M6 x 1.0 Threads and External M4 x 0.7 Threads | Thorlabs | AP6M4M | |
| Mounting Base, 25 mm x 58 mm x 10 mm, 5 Pack | Thorlabs | BA1S/M-P5 | |
| Lens Mount for 25.4mm optic | Thorlabs | LMR1/M | |
| SM1 FC/APC Adapter | Thorlabs | SM1FCA | |
| Kinematic Mirror Mount For 1 inch Optics | Thorlabs | KM100 | |
| Silicon Power Head, 400-1100nm, 50mW | Thorlabs | S120C | |
| 12.7 mm Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L=50 mm, 5 Pack | Thorlabs | PH50/M-P5 | |
| Post Holder with Spring-Loaded Hex-Locking Thumbscrew, L=20 mm | Thorlabs | PH20/M | |
| 12.7 mm x 50 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR50/M-P5 | |
| 12.7 mm x 75 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR75/M-P5 | |
| USB Power and Energy Meter Interface | Thorlabs | PM100USB | |
| 12.7 mm x 30 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR30/M | |
| 12.7 mm x 20 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR20/M | |
| 750 mm long Structural Rail (detection box) | Thorlabs | XE25L750/M | |
| 350 mm long Structural Rail (detection box) | Thorlabs | XE25L350/M | |
| Quick Corner Cube for 25 mm Rails | Thorlabs | XE25W3 | |
| Right-Angle Bracket for 25 mm Rails | Thorlabs | XE25A90 | |
| Black posterboard 20" x 30" (508 mm x 762 mm), 1/16" (1.6 mm) Thick, 5 Sheets | Thorlabs | TB5 | |
| Hinge for 25 mm Rail Enclosures | Thorlabs | XE25H | |
| Lid Stop for 25 mm Rail Enclosures | Thorlabs | XE25LS | |
| M4 Cap Screw Kit | Thorlabs | HW-KIT1/M | |
| M6 Cap Screw Kit and Hardware kit | Thorlabs | HW-KIT2/M | |
| Table Clamp, L-Shape, 5 Pack | Thorlabs | CL5-P5 | |
| SM1 Ring-Actuated Iris Diaphragm (Ø0.8 - Ø12 mm) | Thorlabs | SM1D12D | |
| Ø1" SM1-Mounted Frosted Glass Alignment Disk w/Ø1 mm Hole | Thorlabs | DG10-1500-H1-MD | |
| Honeycomb Optical Table Top, Standa | Standa | 1HB10-15-12 | |
| Optical Table support, Standa | Standa | 1TS05-12-06-AR | |
| Sample nano-positionning | Precision XYZ Nanopositioning | Physik Instrumente | PI P527-3.CD |
| Digital Multi-Channel Piezo Co, 3 Channels, -30 to 130 V Sub- D Connector(s), Capacitive Sensors, | Physik Instrumente | PI E727-3.CD | |
| Temperature chamber | Zeiss 200M Inverted Microscope Incubator System MATT BLK | Digital Pixel | |
| Dual Channel Microprocessor Temperature Controller | Digital Pixel | DP_MTC_2000_DUO | |
| Two Vibration Free Heater Modules | Digital Pixel | DP_150_VF | |
| PT100 Temperature Sensor | Digital Pixel | DP_P100_TS | |
| Biological Reagents and Materials | |||
| Cell culture and transfection | Cos7 cells | ATCC® | CRL-1651™ |
| 8- well Lab-Tek chambers | Thermo Fisher Scientific | 155411PK | |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 11965092 | |
| Fetal bovine serum | Thermo Fisher Scientific | 16000044 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| PBS buffer | Thermo Fisher Scientific | 14190144 | |
| PenStrep | Thermo Fisher Scientific | 15140122 | |
| PolyJet Transfection Reagent | SignaGen Laboratories | SL100688 | |
| Cholesterol content measurement | Amplex Red Cholesterol Assay Kit | Thermo Fisher Scientific | A12216 |
| Protease Inhibitor Cocktail | Thermo Fisher Scientific | 87786 | |
| Phosphatase Inhibitor Cocktail | Thermo Fisher Scientific | 78420 | |
| ROTI Nanoquant Working Solution | Roth | K880 | |
| GloMax Discover Microplate Reader | Promega | GM3000 | |
| svFCS measurements | HBSS buffer | Thermo Fisher Scientific | 14025092 |
| Hepes buffer | Thermo Fisher Scientific | 15630080 | |
| Cholesterol oxidase | Sigma-Aldrich | C8868 | |
| Rhodamine 6G | Sigma-Aldrich | 83697-1G |
Referanslar
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Newton, A. C. Regulation of the ABC kinases by phosphorylation: protein kinase C as a paradigm. The Biochemical Journal. 370, Pt 2 361-371 (2003).
- Marguet, D., Lenne, P. F., Rigneault, H., He, H. T. Dynamics in the plasma membrane: how to combine fluidity and order. The EMBO Journal. 25 (15), 3446-3457 (2006).
- Edidin, M. The state of lipid rafts: From model membranes to cells. Annual Review of Biophysics and Biomolecular Structure. , (2003).
- Lingwood, D., Simons, K. Lipid rafts as a membrane-organizing principle. Science. , (2010).
- He, H. T., Marguet, D. Detecting nanodomains in living cell membrane by fluorescence correlation spectroscopy. Annual Reviews of Physical Chemistry. 62, 417-436 (2011).
- Rossy, J., Ma, Y., Gaus, K. The organisation of the cell membrane: Do proteins rule lipids. Current Opinion in Chemical Biology. 20 (1), 54-59 (2014).
- Nicolson, G. L. The Fluid - Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et Biophysica Acta - Biomembranes. 1838 (6), 1451-1466 (2014).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1081 (2002).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34, 351-378 (2005).
- Destainville, N., Salomé, L. Quantification and correction of systematic errors due to detector time-averaging in single-molecule tracking experiments. Biophysical Journal. 90 (2), 17-19 (2006).
- Wieser, S., Moertelmaier, M., Fuertbauer, E., Stockinger, H., Schütz, G. J. Un)confined diffusion of CD59 in the plasma membrane determined by high-resolution single molecule microscopy. Biophysical Journal. 92 (10), 3719-3728 (2007).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. , (1976).
- Petrášek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. , (2008).
- Elson, E. L. 40 Years of FCS: How it all began. Methods in Enzymology. , (2013).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. , (1974).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. , (1974).
- Schwille, P., Haupts, U., Maiti, S., Webb, W. W. Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two-photon excitation. Biophysical Journal. , (1999).
- Bouchaud, J. P., Georges, A. Anomalous diffusion in disordered media: Statistical mechanisms, models and physical applications. Physics Reports. , (1990).
- Yechiel, E., Edidin, M. Micrometer-scale domains in fibroblast plasma membranes. Journal of Cell Biology. 105 (2), 755-760 (1987).
- Salomé, L., Cazeils, J. L., Lopez, A., Tocanne, J. F. Characterization of membrane domains by FRAP experiments at variable observation areas. European Biophysics Journal. 27 (4), 391-402 (1998).
- Niv, H., Gutman, O., Kloog, Y., Henis, Y. I. Activated K-Ras and H-Ras display different interactions with saturable nonraft sites at the surface of live cells. The Journal of Cell Biology. 157 (5), 865-872 (2002).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophysical Journal. 89 (6), 4029-4042 (2005).
- Saxton, M. J. Fluorescence corralation spectroscopy. Biophysical Journal. , (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO Journal. 25 (14), 3245-3256 (2006).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. , (2015).
- Billaudeau, C., et al. Probing the plasma membrane organization in living cells by spot variation fluorescence correlation spectroscopy. Methods in Enzymology. 519, 277-302 (2013).
- Mailfert, S., Hamon, Y., Bertaux, N., He, H. T., Marguet, D. A user's guide for characterizing plasma membrane subdomains in living cells by spot variation fluorescence correlation spectroscopy. Methods in Cell Biology. 139, 1-22 (2017).
- Rege, T. A., Hagood, J. S. Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses. Biochimica et Biophysica Acta - Molecular Cell Research. , (2006).
- Cahuzac, N., et al. Fas ligand is localized to membrane rafts, where it displays increased cell death-inducing activity. Blood. , (2006).
- Guia, S., et al. Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance. Science Signaling. 4 (167), 21(2011).
- Blouin, C. M., et al. Glycosylation-dependent IFN-γR partitioning in lipid and actin nanodomains is critical for JAK activation. Cell. 166 (4), 920-934 (2016).
- Chouaki-Benmansour, N., et al. Phosphoinositides regulate the TCR/CD3 complex membrane dynamics and activation. Scientific Reports. , (2018).
- Wawrezinieck, L., Lenne, P. F., Marguet, D., Rigneault, H. Fluorescence correlation spectroscopy to determine diffusion laws: application to live cell membranes. Biophotonics Micro- and Nano-Imaging. , (2004).
- Masuda, A., Ushida, K., Okamoto, T. New fluorescence correlation spectroscopy enabling direct observation of spatiotemporal dependence of diffusion constants as an evidence of anomalous transport in extracellular matrices. Biophysical Journal. , (2005).
- Humpolíčková, J., et al. Probing diffusion laws within cellular membranes by Z-scan fluorescence correlation spectroscopy. Biophysical Journal. , (2006).
- Benda, A., et al. How to determine diffusion coefficients in planar phospholipid systems by confocal fluorescence correlation spectroscopy. Langmuir. , (2003).
- Ganguly, S., Chattopadhyay, A. Cholesterol depletion mimics the effect of cytoskeletal destabilization on membrane dynamics of the serotonin1A receptor: A zFCS study. Biophysical Journal. , (2010).
- Wenger, J., et al. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization. Biophysical Journal. 92 (3), 913-919 (2007).
- Manzo, C., Van Zanten, T. S., Garcia-Parajo, M. F. Nanoscale fluorescence correlation spectroscopy on intact living cell membranes with NSOM probes. Biophysical Journal. , (2011).
- Regmi, R., et al. Planar optical nanoantennas resolve cholesterol-dependent nanoscale heterogeneities in the plasma membrane of living cells. Nano Letters. , (2017).
- Mueller, V., et al. FCS in STED microscopy: Studying the nanoscale of lipid membrane dynamics. Methods in Enzymology. , (2013).
- Sezgin, E., et al. Measuring nanoscale diffusion dynamics in cellular membranes with super-resolution STED-FCS. Nature Protocols. , (2019).
- Wang, R., et al. A straightforward STED-background corrected fitting model for unbiased STED-FCS analyses. Methods. , (2018).
- Veerapathiran, S., Wohland, T. The imaging FCS diffusion law in the presence of multiple diffusive modes. Methods. , (2018).
- Gupta, A., Phang, I. Y., Wohland, T. To hop or not to hop: exceptions in the FCS diffusion law. Biophysical Journal. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır