Method Article
살아있는 세포의 원형질막에서의 분자 확산 분석을위한 스팟 변이 형광 상관 분광법
* 이 저자들은 동등하게 기여했습니다
요약
이 기사는 살아있는 세포의 원형질막에서 분자 확산을 측정하기 위해 스팟 변이 형광 상관 분광법 (svFCS) 현미경을 구축하는 방법에 대한 프로토콜을 제시하는 것을 목표로합니다.
초록
원형질막 조직과 관련된 것을 포함하여 살아있는 세포의 동적 생물학적 과정은 각각 나노미터에서 마이크로미터 및 마이크로초에서 분에 이르는 다양한 공간적 및 시간적 스케일에서 발생한다. 이러한 광범위한 생물학적 과정은 기존의 현미경 검사 접근법에 도전합니다. 여기에서는 맞춤형 클래식 형광 현미경을 사용하여 스팟 변동 형광 상관 분광법 (svFCS) 측정을 구현하는 절차를 자세히 설명합니다. 이 프로토콜에는 svFCS 설정의 특정 성능 검사 및 생리적 조건 하에서 살아있는 세포의 원형질막에서 svFCS에 의한 분자 확산 측정에 대한 지침이 포함됩니다. 또한, 우리는 콜레스테롤 산화 효소 처리에 의해 원형질막 뗏목 나노 도메인을 파괴하는 절차를 제공하고 svFCS 분석에 의해 원형질막의 측면 조직의 이러한 변화가 어떻게 밝혀 질 수 있는지 보여줍니다. 결론적으로, 이러한 형광 기반 방법은 적절한 공간 및 시간적 분해능을 갖는 원형질막의 측방향 조직에 대한 전례 없는 세부사항을 제공할 수 있다.
서문
원형질막 조직의 복잡성
세포막 조직에 대한 현재의 이해는 몇 가지 측면1을 고려해야합니다. 첫째, 복합 지질 조성은 세포 유형뿐만 아니라 단일 세포 (막 소기관 / 원형질막) 내에서도 다양합니다. 게다가, 관련 또는 내재적 막 단백질은 대부분 동적 다량체 복합체로 조직되며, 막의 외부로 연장되는 큰 도메인이 막횡단 도메인 단독보다 훨씬 큰 면적을 차지한다. 더욱이, 막-관련 단백질은 단백질 기능을 조절하는데 역할을 하는 특이적 지질-결합 또는 지질-상호작용 능력을 나타낸다. 이들은 지질의 국소 조성 및 접근성에 직접적으로 의존한다2.
마지막으로, 막 단백질의 본질적인 비대칭 구조와 지질의 분포로 인해 두 막 전단지 사이에서 상당한 수준의 비대칭이 관찰됩니다. 실제로, 합성과 가수분해 사이의 지질 대사 균형은 전단지 사이의 지질 플립 플롭과 결합하여 그러한 비대칭 분포를 생성합니다. 이중층을 가로지르는 임의의 수송은 멤브레인의 소수성 내부를 통해 극성 헤드 그룹을 이동시키는 데 필요한 자유 에너지에 의해 제약되기 때문에, 그것은 일반적으로 선택적 수송기에 의해 보조된다. 각 세포 유형에 대해 비대칭은 단단히 유지되는 경향이 있습니다. 전체적으로, 이들 인자는 원형질막(3,4)의 측방향 불균질성 또는 구획화에 기여한다.
우리는 이중층 내부 및 전반에 걸친 고유 한 분자 확산을 고려하여 원형질막의 이러한 표현을 풍부하게하며, 이는 열 번째에서 수백 나노 미터 및 마이크로 초에서 초까지의 규모로 동적 측면 이질성에 기여합니다. 예를 들어, 지질 의존성 막 나노 도메인 - 콜레스테롤로 정의 된 소위 지질 뗏목과 스핑고지질이 풍부한 신호 전달 플랫폼 -은 원형질막 5,6의 구획화에 기여합니다. 그러나, 막 조직에 대한 현재의 견해는 지질 뗏목에만 국한되지 않는다. 막 나노도메인은 조성, 기원 및 기능에서 더 복잡하고 이질적이다. 여전히, 원형질막에서의 그들의 존재는 긴밀하게 조정되어야 하고, 단백질과 지질 사이의 동적 상호작용은 막 나노 도메인 1,3,7,8의 공간 분포 및 화학적 변형에 중요한 것으로 보인다.
svFCS 원리와 원형질막의 조직을 조사하기 위한 그것의 응용
주로 생물물리학적 기술을 통해 막 도메인의 분석에서 많은 진전이 이루어졌지만, 원형질막의 국소 조직을 지시하는 결정인자는 적절한 공간적, 시간적 분해능으로 정제될 필요가 있다. 개별 분자 추적에 기반한 결정인자는 우수한 공간 정밀도를 제공하고다양한 동작 모드의 특성화를 허용하지만 9,10,11,12의 다양한 모드의 특성화를 허용하지만 고전적인 낮은 카메라 프레임 속도로 제한된 시간 해상도를 가지며 상당한 수의 궤적을 기록하기 위해 더 많은 실험적 노력이 필요합니다. 대안적으로, 막 성분의 확산 계수는 광표백 후 형광 회수 (FRAP)13 또는 형광 상관 분광법 (FCS)14에 의해 평가될 수 있다. 후자는 주로 높은 감도와 선택성, 현미경 탐지량, 낮은 침습성 및 넓은 동적 범위15로 인해 더 많은 주목을 받았습니다.
FCS의 개념적 기초는 약 50 년 전16,17 년 전에 Magde와 동료들에 의해 소개되었습니다. 이는 높은 시간적 분해능(μs에서 s까지)을 갖는 형광 방출의 변동을 기록하는 것에 기초한다18. 현대 버전에서, 살아있는 세포에서의 측정은 관심 영역 내에 위치된 작은 공초점 여기 부피 (~0.3 펨톨리터)에 의해 수행된다 (예를 들어, 원형질막에서); 관찰 부피의 안팎으로 들어가는 형광 분자를 확산시킴으로써 생성된 형광 신호는 매우 높은 시간적 분해능(즉, 검출기 상의 각 광자의 도착 시간)으로 수집된다. 이어서, 신호는 자기상관 함수(ACF)를 생성하기 위해 계산되고, 이로부터 분자가 초점 부피 내에 머무르는 평균 시간td(확산 시간)가 추출되고, 입자의 평균 수와 함께, ACF의 진폭에 반비례하는 관찰 부피에 존재하는 (N)이 추출된다. 이 마지막 파라미터는 관찰 부피 내의 분자 농도에 대한 유용한 정보일 수 있다.
그 이후로, 바이오 포토닉스에서 빠르게 발전하는 계측 덕분에 점점 더 많은 FCS 양식이 구현되어 살아있는 시스템에서 발생하는 역동적 인 현상에 대한 설명이 가능해졌습니다. 그럼에도 불구하고, 분자 종은 확산 계수 값의 더 겹치는 분포를 경험할 것이며, 이는 일반적으로 분자가 시간19에서 비선형 관계로 확산되는 변칙적 확산 특성에 의해 반영되며,이 변칙적 인 하위 확산의 생물학적 의미를 식별하는 데 어려움이 있습니다. 과거에는 FRAP에 의한 분자 확산을 단지 하나의 영역이 아닌 다양한 크기의 영역으로부터 기록함으로써 이러한 어려움이 다소 극복되어 추가적인 공간 정보를 제공하였다. 이것은 예를 들어, 막 마이크로도메인20,21,22의 개념화를 가능하게 하였다.
FCS 측정(즉, 소위 스폿 변동 형광 상관 분광법(svFCS))에 대한 이 전략의 번역은 관찰의 초점 부피의 크기를 변화시킴으로써 확립되었고, 형광의 변동이 상이한 공간 스케일(23)에 기록될 수 있게 하였다. 따라서, svFCS 접근법은 연구된 분자의 분자 확산 모드 및 막 분할의 유형(단리된 대 인접 도메인(24))의 확인 및 결정을 허용하는 간접적인 공간 정보를 제공한다. 확산 시간td를 허리(ω) 값에 의해 정의된 다양한 공간 스케일의 함수로서 플로팅함으로써, 이 경우23,25의 검출 빔 반경 크기에 대응하나, 주어진 생리학적 조건에서 주어진 분자의 확산 법칙을 특성화할 수 있다. 따라서, svFCS는 시간 영역(26)에서 단일 입자 추적에 대한 완벽한 아날로그이다. 브라운 확산 제약 하에서, 확산 시간td와 허리 ω 사이의 엄격한 선형 관계를 기대해야 한다(그림 1)23,25. 이 계획으로부터의 확산 법칙의 편차의 기원은 세포 골격 메쉬 워크, 분자 우집, 나노 도메인에서의 동적 분할 또는 이들 및 기타 효과의 임의의 조합과 같은 비독점적 인 이유에 기인 할 수 있으며 (그림 1), 실험적으로 테스트 할 필요가 있습니다25.
여기에서는 처음부터 구축된 맞춤형 svFCS 광학 시스템을 매일 사용하는 데 필요한 모든 제어 체크포인트를 제공하며, 이는 실험적 접근 방식에 대한 이전 프로토콜 리뷰27,28을 보완합니다. 또한, 개념 증명으로서, 우리는 지질-래프트 나노도메인29에 국한된 것으로 알려진 원형질막 글리코실포스파티딜이노시톨-앵커드 단백질인 Thy1-GFP에 대한 svFCS 확산법(DL)의 확립을 위한 설정, 세포의 준비, 데이터 수집 및 분석의 교정에 관한 지침을 제공한다. 마지막으로, 우리는 콜레스테롤 옥시다제 처리에 의한 지질 - 뗏목 나노 도메인의 부분적 불안정화가 Thy1-GFP의 확산 특성에 어떻게 영향을 미치는지 보여줍니다. 또한 svFCS 설정을 처음부터 빌드하는 방법에 대한 자세한 설명은 보충 자료에 나와 있습니다.
프로토콜
1. 맞춤형 svFCS 설정 조립을 위한 사양 설정
참고: 제안된 svFCS 설정의 단순성으로 인해 저렴한 비용으로 설치, 작동 및 유지 보수가 용이하며 광자 복구의 효율성을 보장합니다. 자세한 내용은 보충 자료를 참조하십시오.
- 실험실 및 안전
- 약 21°C에서 안정화된 방에 시스템을 설치하십시오.
- 패시브(또는 액티브) 광학 테이블의 직접적인 공기 흐름을 피하고 광학 정렬에 대한 레이저 안전 규칙을 따르십시오.
- 하드웨어 및 소프트웨어
주: 보충 자료 는 그림 2에 표시된 설치 단계를 자세히 설명합니다.- LabVIEW에서 다기능 수집 보드가 대부분의 컨트롤러를 구동하는 상태 머신 및 이벤트 구조 아키텍처를 사용하여 기본 수집 및 제어 소프트웨어를 작성합니다.
참고: 상관기, 레이저 및 파워 미터는 자체 소프트웨어에 의해 제어되거나 모니터링됩니다. - 사용 된 하드웨어에 따라 하드웨어 및 소프트웨어 설치 절차를 조정하십시오.
- LabVIEW에서 다기능 수집 보드가 대부분의 컨트롤러를 구동하는 상태 머신 및 이벤트 구조 아키텍처를 사용하여 기본 수집 및 제어 소프트웨어를 작성합니다.
- 광학 설정
참고: 그림 3 은 광학 정렬의 품질을 제어하기 위해 다음 섹션에서 사용되는 광학 벤치 모듈을 보여 줍니다. 모든 광학 소자 사양은 재료 표에 나열되어 있습니다. 설정을 빌드하는 절차는 보충 자료에 자세히 설명되어 있습니다. 이 시스템은 연속파 레이저, 침수 목표를 갖춘 전동 반전 현미경, 단일 광자 계수 모듈에 결합된 눈사태 광 다이오드 검출기 및 하드웨어 상관기로 구성됩니다. 진동없는 히터가있는 현미경 배양 챔버는 살아있는 세포에 대한 실험을위한 온도를 제어하도록 특별히 설계되었습니다. 규칙에 따라 XY 축은 광 경로의 수직 평면에 해당하고 Z 축은 광 경로에 해당합니다.
2. 실험을 실행하기 전에 매일 체크포인트
- 여기 경로를 제어합니다(그림 3,
 &
&  ).
).- 모든 아이리스 다이어프램을 엽니다.
- 파워 미터로 레이저 파워를 측정하여 첫 번째 아이리스를 완전히 열어 두십시오.
- 반파 플레이트(HWP)를 돌려 최대 전력을 찾으십시오.
- 레이저 출력이 평소보다 낮 으면 홍채를 사용하여 정렬을 확인하고 필요한 경우 L1과 M1을 교대로 이동하십시오.
- 실험 실험실 노트북의 전력 값을 기록해 둡니다.
- 감지 경로를 제어합니다(그림 3,
 & 참조
& 참조  ).
).- 물, 커버슬립 및 2 nM 로다민 6G(Rh6G) 용액의 액적을 목적물 위에 놓는다.
- 형광 신호(LabVIEW 소프트웨어로 기록된 APD의 카운트 번호)가 평소보다 낮으면 Rh6G 솔루션을 리메이크하거나, 대물 렌즈의 위치 및 커버슬립 번호를 확인하거나, 기포가 있는 경우 제거하십시오.
- 형광 신호가 여전히 평소보다 낮 으면 파워 미터를 광 경로 내부에 배치하여 빔을 차단하십시오.
- APD를 끕니다(이하, APD는 APD와 단일 광자 계수 모듈을 의미합니다).
- 샘플을 제거합니다.
- 대물 렌즈를 청소하고 반사 타겟으로 교체하십시오.
- 광 경로에서 파워 미터를 제거하여 반사 타겟의 레이저 빔을 확인하십시오. 대상의 빔이 중앙에 있고 후면 반사가 선
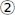 의 첫 번째 아이리스에 도달하는지 확인합니다(그림 3).
의 첫 번째 아이리스에 도달하는지 확인합니다(그림 3). - 그렇지 않은 경우 M2로 중심 위치를 조정하거나 이색성 거울을 사용하여 후면 반사를 조정하십시오.
- 현미경 커플링이 정확하다면 대물 렌즈를 뒤로 밀고 물 한 방울, 커버슬립 및 더 농축된 Rh6G 용액(즉, 200nM)의 물방울을 추가하고 기존 측정치(몇 μW)보다 낮은 레이저 파워를 설정합니다.
- APD를 켜고 APD 및 핀홀 정렬을 최적화하고, 강도 신호를 모니터링하면서 각각의 XYZ 조정 나사를 사용하여 최적화합니다(LabVIEW 소프트웨어).
- 커버슬립을 변경하고 더 낮은 농도의 Rh6G (2 nM)를 첨가하십시오. 핀홀을 Z축을 따라 움직여 분자 밝기 비율이 증가하고 허리가 최소인 위치를 찾습니다.
- 신호가 떨어질 때까지 아이리스를 닫습니다: 레이저 빔 크기가 목표물의 뒤쪽 조리개 크기에 도달합니다(즉, 최소 허리 크기, 보충 자료 참조).
- 상관기 소프트웨어를 실행하고 데이터를 기록합니다(데이터 기록은 섹션 7 참조).
- 낮은 양의 소음을 표시하고 허리 크기가 작고 초당 분자 당 높은 카운트 율을 제공해야하는 ACF를 확인하십시오 (데이터 분석 및 허리 크기 평가는 섹션 7 참조).
3. svFCS 데이터 기록 및 분석에 대한 일반적인 고려 사항
- 이 일반적인 계획에 따라 형광 데이터를 기록 및 분석(섹션 7, 8 및 9 참조): (1) 형광 기록 및 ACF 생성(상관기 소프트웨어), (2) 예기치 않은 데이터 폐기, 보유 데이터의 평균, 적절한 모델(수제 이고르 프로 소프트웨어 사용), (3) 확산 법칙 플롯(수제 MATLAB 소프트웨어 1) 및 (4) 선택적 확산법 비교(수제 MATLAB 소프트웨어 2). 요청시 다른 소프트웨어 프로그램을 사용할 수 있습니다.
참고: 하드웨어 상관기의 최소 샘플링 시간은 12.5ns(즉, 샘플링 주파수 80MHz)입니다. 이는 용액 중의 소분자를 자유롭게 확산시키는 전형적인 거주 시간보다 적어도 1,000 더 낮고 공초점 관찰 부피 내의 막 단백질의 확산 시간보다10,6 더 작은 시간 분해능을 제공한다.
4. 세포 배양 및 형질감염
- Cos7 세포를 #1.0 붕규산염 유리 바닥이 있는 8웰 챔버 커버글라스에 5% 태아 소 혈청, 페니실린(100 U/mL), 스트렙토마이신(100 U/mL) 및 L-글루타민(1 mM)이 보충된 완전한 둘베코의 변형 이글 배지(DMEM)를 사용하여 10,000 세포/웰의 밀도로 시드하십시오.
- 세포를 5% CO2를 함유하는 가습된 분위기에서 37°C에서24시간 동안 배양한다.
- 배지를 제거하고, 웰 당 300 μL의 신선한 완전 배양 배지를 첨가하고, 세포를 37°C에서 30분 동안 예비인큐베이션하였다.
- eGFP25 와 융합된 Thy-1 단백질을 코딩하는 플라스미드 DNA 0.5 μg을 무혈청 DMEM의 50 μL에 희석한다. 소용돌이 잠깐 혼합.
- 1.5 μL의 DNA 형질감염 시약을 50 μL의 무혈청 DMEM에 희석하고, 용액을 잘 혼합한다.
- 희석된 형질감염 시약을 준비된 DNA 용액에 직접 첨가하고, 화합물을 즉시 혼합한다.
- 제조된 혼합물을 실온에서 10 내지 15분 동안 인큐베이션한다.
- 결합된 DNA/형질감염 시약 복합체 10μL를 각 웰의 배지에 적하하고, 플레이트를 부드럽게 소용돌이치면서 균질화한다.
- 세포를 37°C에서 3시간 동안 5%CO2 와 함께 인큐베이션한다.
- 인큐베이션 후, DNA/형질감염 시약 복합체를 함유하는 배지를 400 μL의 신선한 완전 DMEM으로 교체하고, svFCS 실험 전에 세포를 16시간 동안 배양하였다.
5. svFCS 측정을 위한 세포의 제조
- 배양액을 제거한다.
- 10 mM (4-(2-하이드록시에틸)-1-피페라진에탄설폰산)(HEPES), pH 7.4 (HBSS/HEPES)로 보충된 Ca2+ 및 Mg2+를 함유하는 무혈청 행크의 균형 잡힌 염 용액(HBSS) 완충액으로 세포를 2~세 번 부드럽게 세척하십시오.
- 모든 svFCS 획득 중에 HBSS/HEPES 버퍼에 세포를 유지하십시오.
6. 약리학 적 치료
- 배양액을 제거하고, 세포를 10 mM HEPES, pH 7.4 (HBSS/HEPES)로 보충된 무혈청 HBSS로 두세 번 세척한다.
- 세포를 HBSS/HEPES 완충액 중 1U/mL의 콜레스테롤 산화효소(COase) 용액으로 37°C에서 1시간 동안 배양한다.
- 용액을 제거하고 svFCS 측정을 수행하는 동안 HBSS/HEPES 버퍼에 0.1U/mL의 COase가 있는 상태에서 세포를 유지하십시오.
7. 스팟 크기 교정
- 현미경 챔버를 37°C에서 예열한다.
- 직렬 희석에 의해 Rh6G의 표준 2 nM 용액을 준비한다.
- 200 μL의 2 nM Rh6G 용액을 유리 커버슬립 상에 떨어뜨려 수침 목적 상에 놓았다.
- 모든 하드웨어 및 소프트웨어를 시작합니다.
- 488nm 레이저 빔 파워를 300μW로 측정 및 조정합니다. 사용된 형광 프로브의 밝기 및 광 안정성에 따라, (1) 안정해야 하는 형광 강도(LabVIEW 소프트웨어 상에서), (2) 시간에 따라 일정한 형상을 가져야 하는 ACF 형상(상관기 소프트웨어 상)에 따라 이 전력을 조정하고, (3) 작은 허리 크기와 분자 당 높은 카운트 속도를 제공하는 피팅 매개 변수 (초당 분자 당 광자, 일반적으로 초당 분자 당 수십 ~ 수백 개의 광자).
참고: ACF의 진폭(G(0)이라고 함)은 분자의 수(즉, 형광 프로브의 농도)에 반비례한다. 허리 크기 교정의 경우, 이것은 좋은 품질 관리 후보 매개 변수입니다. 따라서 G(0)은 허리 크기와 농도를 연결하므로 매일 동일한 농도에 대해 유사해야 합니다. 세포 측정의 경우, FCS가 낮은 농도에 대해 더 정확하기 때문에 적절한 파라미터 피팅 추출을 위해 G(0)이 높아야 합니다. - LabVIEW 소프트웨어로 svFCS 조명/감지 현미경 포트를 설정합니다.
- APD를 켭니다.
- 신호가 떨어질 때까지 아이리스를 닫아 최소한의 허리 크기를 얻거나 허리 크기를 크게 줄이십시오.
- 통계적 재현성을 향상시키기 위해 선택된 기간(즉, 실행)의 여러 ACF를 기록하며, 일반적으로 상관기 소프트웨어를 사용하여 각각 20초 동안 지속되는 10개의 실행을 기록합니다.
- APD를 끕니다.
- Igor Pro 소프트웨어를 사용하여 분자 응집체로 인한 강한 변동으로 실행을 확인하고 폐기하십시오. 이 단계를 수동으로 수행하세요 — 사용자를 교육한 후에는 사용자 독립적이어야 합니다.
- 보유된 ACF의 평균을 3D 확산 모델에 맞춥니다.
- 피팅 매개 변수에서 평균 확산 시간을
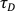 추출하여 ".txt"파일에 저장합니다 (파일 형식은 Igor Pro 소프트웨어에 의해 결정됩니다).
추출하여 ".txt"파일에 저장합니다 (파일 형식은 Igor Pro 소프트웨어에 의해 결정됩니다). - 평균 강도(형광 트레이스로부터 추출됨)를 분자 수(ACF로부터 추출)로 나눔으로써 초당 분자당 카운트 속도(양호한 성능 지표)를 확인한다.
참고: 동일한 수집 매개 변수에 대해 이 값이 매일 높고 안정적인지 확인하십시오. - 37°C에서 수용액 중의 Rh6G의 확산 계수를 알면(D) (
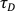 7.13 참조), 다음에 따라 실험 허리 크기 ω을
7.13 참조), 다음에 따라 실험 허리 크기 ω을 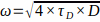 계산한다.
계산한다. - FCS 확산 법칙을 플로팅하는 데 필요한 모든 허리 크기 수정 절차와 svFCS 데이터 수집의 새로운 실험 시리즈 전에 적용하십시오.
8. 셀에 대한 svFCS 데이터 수집
- 2μW와 4μW 사이의 488nm 빔 전력을 측정하고 조정합니다. 사용된 형광 프로브의 밝기 및 광안정성에 따라, 광표백을 낮게 유지하면서 분자당 높은 카운트 속도(일반적으로 초당 분자당 수천 개의 광자)를 허용하도록 이 전력을 조정하십시오(즉, LabVIEW 소프트웨어에서 안정적인 강도 추적).
- 측정을 시작하기 전에 37°C에서 10분 동안 샘플을 평형화시킨다.
- LabVIEW 소프트웨어로 epi-fluorescence 조명 현미경을 설정합니다.
- 적절한 형광 프로브 위치 및 (낮은) 형광 신호 강도를 가진 세포를 선택하십시오.
참고: 형광이 낮을수록 FCS 측정이 더 좋습니다(단계 8.1 참조). - LabVIEW 소프트웨어로 svFCS 조명/감지 현미경 포트를 설정합니다.
- APD를 켭니다.
- LabVIEW 소프트웨어를 사용하여 선택한 셀의 xy 스캔을 수행합니다.
- z-스캔을 수행하고 상단에서 원형질막을 선택하여 공초점 스폿을 최대 형광 강도로 찾고 데이터 수집을 시작하십시오. 두 막 사이의 분리를 최대화하기 위해, 바람직하게는 세포의 핵 영역에서 주사를 수행한다.
- 5초 동안 지속되는 20개의 실행 시리즈를 기록하고, 각 시리즈에는 상관기 소프트웨어가 있습니다.
참고: 각 실행의 지속 시간이 노이즈가 감소된 ACF를 얻을 수 있을 만큼 충분히 길어야 합니다. 긴 획득은 광표백 또는 예기치 않은 실질적인 변형(예를 들어, 응집체)에 취약하다. 실행 수, 지속 시간 및 시리즈 수를 샘플에 조정하되 재현성을 위해 동일한 대량 실험 내에서 일정하게 유지되어야 합니다. - APD를 끕니다.
- Igor Pro 소프트웨어로 예기치 않은 실행을 삭제합니다.
- 평균 ACF를 2종 2D 확산 모델에 맞춥니다. 이 모델을 표적 분자의 확산 거동 유형에 적응시킨다.
- 피팅 매개변수를 이전 파일에 저장합니다(7.13단계 참조).
- 적어도 10개의 서로 다른 셀에서 10~15개의 일련의 레코딩을 수행하고 8.3~8.13단계를 재현합니다. 얻은 단일 파일에 허리 크기 정보와 10-15 개의 녹음의 피팅 매개 변수가 포함되어 있는지 확인하십시오.
- 단일 확산 법칙을 확립하려면 200nm와 400nm 사이에서 변화하는 적어도 4 개의 허리 크기를 분석하십시오. 이 범위는 회절 광학 한계에 의해 정의되지만, 객관적인-(수치 개구) 및 레이저(파장)-의존적이다.
참고: 허리 크기 보정이 절대적이지 않고 어느 정도의 불확실성을 갖기 때문에 x 및 y 오차(즉,ω2 및td)를 설명하는 전용 MATLAB 소프트웨어(28)가 확산 법칙에 맞게 구축되었습니다. - MATLAB 소프트웨어 1을 시작하고 최소 네 개의 허리 크기 실험에 해당하는 모든 ".txt" 파일이 들어 있는 폴더를 선택합니다.
- 플롯<d> 대 <ω2>, 즉 확산 법칙입니다. 두 가지 주요 파라미터가 추출될 수 있다: y축 절편(t0)과 유효 확산 계수(Deff, 기울기에 반비례).
9. 다른 실험 조건 비교의 확산 법칙
참고: 필요한 경우 섹션 7과 8을 다른 실험 조건에 대해 재현하십시오. 이러한 확산 법칙이 t0 및 Deff 값28에 따라 유사한지 여부를 결정하기 위해 전용 소프트웨어(MATLAB 소프트웨어 2)가 개발되었습니다. 두 가설을 테스트합니다: 두 값이 다르거나 두 값이 PFA(오경보 확률) 위에 설정된 임계값에서 다르지 않습니다. 5%(T=3.8)의 임의의 PFA 값은 두 파라미터(t0 또는 Deff) 사이의 유의성의 상한으로 간주되며, 이는 두 값이 동일할 확률이 5%에 불과하다는 것을 나타낸다.
- 비교할 각 조건의 특징적인 확산 법칙 값을 포함하는 ".xls" 파일(즉, 비처리(NT) 및 처리(COase) 조건에 대한 t0, t0 에러, Deff 및 Deff 에러를 포함하는 파일을 테이블로서 생성한다.
- MATLAB 소프트웨어 시작 2.
- ".xls" 파일을 선택합니다.
- 생성된 컬러 코딩된 2D 플롯을 분석하고, 여기서 t0 및 Deff 통계 테스트는 각각 x- 및 y축에 플롯팅됩니다(그림 4). T가 높을수록 비교된 값의 차이가 커집니다.
10. 콜레스테롤 농도 측정
- 세포 치료 및 용해
- Cos7 세포를 4 × 10 5 세포/웰의 6-웰 플레이트에 삼중으로 시드하고, 세포가 플레이트에 부착될 수 있도록 하룻밤 동안5 % CO2와 함께 37°C에서 완전한 DMEM2 mL에서 인큐베이션한다.
- 배양액을 제거하고 세포를 인산완충식염수(PBS)로 세 번 세척하였다.
- 1 U/mL의 코아제를 함유하는(또는 대조군의 경우) HBSS/HEPES 완충액 1 mL를 첨가하고, 5%CO2로 37°C에서 1시간 동안 인큐베이션한다.
- 배지를 0.1 U/mL의 코아제를 함유하는 1 mL의 HBSS/HEPES로 교체하고, 5%CO2로 37°C에서 1시간 동안 인큐베이션한다.
- 용액을 제거하고 세포를 수확하십시오.
- 세포를 PBS로 3회 세척하고, 실온에서 5분 동안 400 × g 에서 원심분리한다.
- 세포를 얼음 상에서 30분 동안 방사선면역침전 분석 완충액 (25 mM HEPES, pH 7.4, 150 mM NaCl, 1% NP40, 10 mM,MgCl2, 1 mM 에틸렌디아민 테트라아세트산, 2% 글리세롤, 프로테아제 및 포스파타제 억제제 칵테일)으로 용해시킨다.
- 용해물을 4°C에서 10분 동안 10000 × g 에서 원심분리하고 상층액을 수집한다.
- 제조업체의 권고에 따라 작업 용액을 사용하여 Bradford의 단백질 분석을 수정하여 각 샘플의 총 단백질 농도를 정량화하십시오.
- 콜레스테롤 농도 측정
- 효소적으로 총 세포 콜레스테롤 수치를 결정하려면 제조업체의 권장 사항에 따라 적절한 키트 (예 : Amplex Red Cholesterol Assay Kit)를 사용하십시오.
- 각 반응에 대해 5 μg의 단백질을 함유 한 샘플을 Amplex Red 시약 / 양고추냉이 퍼옥시다제 / 콜레스테롤 산화 효소 / 콜레스테롤 에스테라제 작동 용액과 혼합하고 어둠 속에서 37 °C에서 30 분 동안 배양하십시오.
- 520 nm의 여기(excitation)를 사용하여 형광을 측정하고, 마이크로플레이트 판독기를 사용하여 560-590 nm에서 방출을 검출한다.
- 최종 값에서 배경을 빼고 표준 곡선을 사용하여 콜레스테롤 농도를 결정합니다.
- 단백질의 μg 당 콜레스테롤의 ng 단위의 최종 콜레스테롤 함량을 계산하십시오.
결과
Cos-7 세포에서 발현된 Thy1-GFP에 대한 DL을 생성하였다(도 4, 검정 사각형). 확산 법칙은 양의 t0 값 (19.47 ms ± 2 ms)을 가지며, 이는 Thy1-GFP가 원형질막의 나노 도메인 구조에 국한되어 있음을 나타냅니다. Thy1-GFP를 발현하는 세포의 콜레스테롤 옥시다제 처리는 DL t0 값이 1.34 ms ± 7.36으로 이동되는 결과를 가져왔다 (도 4, 회색 사각형). 이 관찰은 Thy1-GFP 감금의 본질이 콜레스테롤 함량에 의존하고 지질 뗏목 나노 도메인과 관련이 있음을 확인합니다. 이들 두 확산 법칙은 t0 및 Deff 값의 관점에서 위에서 설명된 통계적 검정(단계 9.1.3 참조)에 따라 상이함을 나타내었다. 또한, 우리는 처리되지 않은 Cos-7 세포에서 COase로 처리 된 세포와 비교하여 총 세포 콜레스테롤의 농도를 평가했습니다. COase 처리 시 총 콜레스테롤 함량의 작지만 유의한 감소가 관찰됩니다(그림 5). 이 효소는 원형질막의 외부 전단지에서 접근 할 수있는 콜레스테롤 풀에서만 작용하기 때문에 콜레스테롤의 관찰 된 감소는 원형질막과 관련이 있으며 지질 뗏목 나노 도메인의 불안정화를 초래한다고 가정합니다.
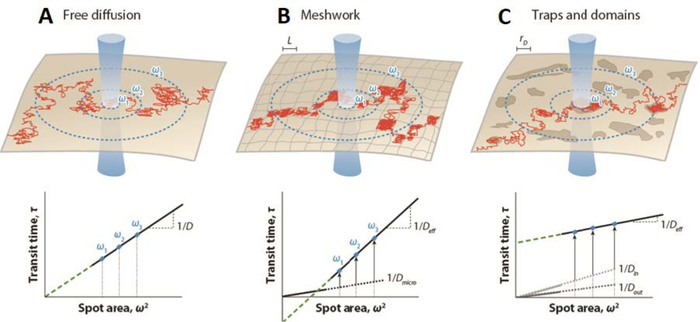
그림 1: 다양한 형태의 막 조직에 대해 스팟 변동 FCS에 의해 확립된 시뮬레이션된 형광 상관 분광법(FCS) 확산 법칙. (상부 패널) 막 조직의 개략적 표현 - (A) 자유 확산, (B) 메쉬 워크 장벽 및 (C) 트랩 / 도메인 감금 - 단일 분자 (빨간색)에 대해 그려진 궤적. 파란색 원은 허리 ω의 멤브레인과 레이저 빔의 교차점을 나타냅니다. (하부 패널) FCS 확산 법칙은 확산 시간 td를 제곱 반지름 ω2의 함수로 플로팅함으로써 표현된다. 확산 법칙 돌출부(녹색 점선)는 자유 확산의 경우에 (A) 원점(t0=0)에서 시간 축을 인터셉트하고; (B) 메쉬 워크 장벽이있을 때 음축 (t0 < 0)에서, 또는 트랩과 도메인 (지질 뗏목)이있을 때 양축 (t0 > 0)에서 (C). D는 브라운 운동에 대한 측면 확산 계수이고; Deff, 유효 확산 계수; D마이크로, 메쉬워크 트랩 내부의 미세한 확산 계수; D에서, 도메인 내부의 확산 계수; Dout, 외부 도메인 확산 계수; L, 정사각형 도메인의 측면의 크기; 및 rD, 원형 도메인의 반지름. 이 그림은 그분과 마르게트6에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: svFCS 하드웨어 제어의 개략도 컴퓨터는 직렬(현미경, 외부 셔터), USB(XYZ 압전 스테이지, 상관기) 및 PCI(수집 보드)와 같은 다양한 통신 프로토콜을 통해 모든 장치를 제어합니다. DAQ : 데이터 수집 보드, APD : 눈사태 광 다이오드, SPCM : 단일 광자 계수 모듈, DO : 디지털 출력. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
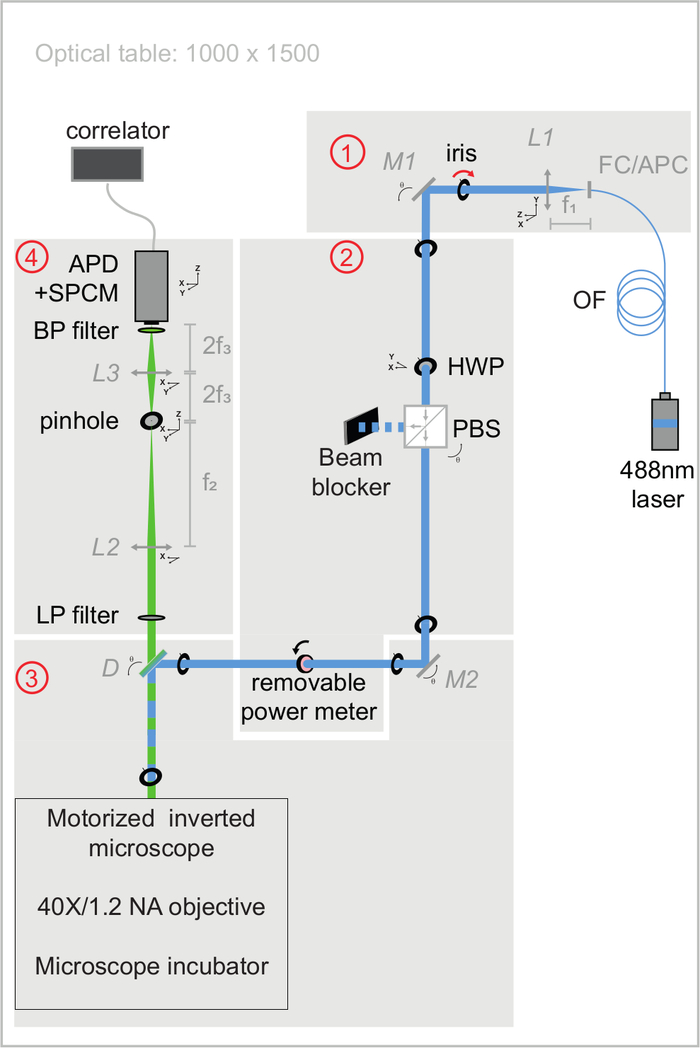
그림 3: svFCS 설정의 여기 및 방출 광 경로의 개략도. svFCS 셋업은 네 개의 모듈을 포함한다: (1) 광섬유 488nm 레이저의 출력이 시준되고, (2) 반파 플레이트와 편광 빔 스플리터의 조합이 광전력을 설정하고, (3) 튜브-렌즈 프리 전동 현미경을 통해 진행한 후 샘플에 초점을 맞춘 레이저 빔, 및 (4) 단일 광자 계수 모듈에 결합된 애벌런치 광 다이오드 상으로의 공초점 형상 검출 경로를 통해 형광이 검출되고, 하드웨어 상관기에 신호를 전달합니다. 단순성은 시스템에 감도, 견고성 및 사용 편의성을 제공합니다 ( 보충 자료에 널리 언급되어 있음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
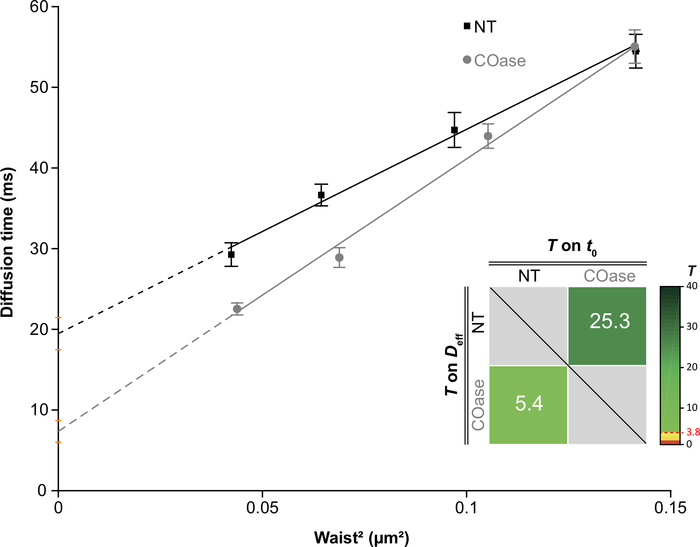
도 4: Cos-7에서 발현된 Thy1-GFP의 확산 분석으로부터 생성된 svFCS 확산 법칙. svFCS 처리하지 않고 Cos-7 세포의 확산 법칙 (NT, 검은 사각형) 및 콜레스테롤 산화 효소 처리 후 (COase, 회색 원). 그래프의 삽입물은 제시된 두 개의 svFCS 확산 법칙 사이의 유의한 차이에 대한 통계적 테스트를 나타낸다(Mailfert et al.28에 따름). 테스트 값(T)은 두 확산 법칙이 다를 때 3.8로 설정된 임계값을 초과해야 합니다. 높을수록 확산 법칙의 차이가 커집니다. T의 값은 색상으로 구분됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
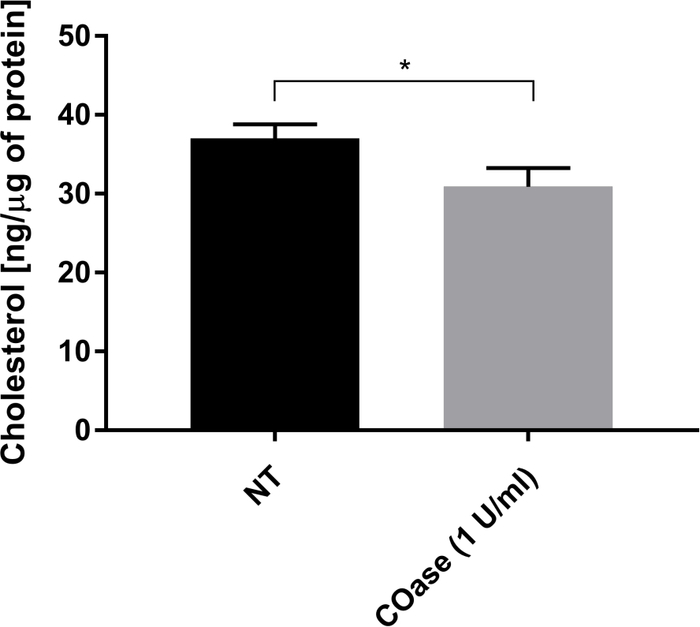
그림 5: Cos-7 세포에서 총 콜레스테롤 함량 비교. Cos-7 세포는 1시간 동안 비처리(NT) 또는 1U/mL의 콜레스테롤 산화효소(COase)로 처리되었다. 데이터는 삼중으로 한 실험의 예를 나타낸다. 두 꼬리, 짝을 이루지 않은 t-검정을 사용하여 통계적 차이를 평가하였다(α=0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
물자의 표: svFCS 설정에 필요한 광학 요소 목록입니다.
보충 자료: 이 문서에서는 처음부터 svFCS 설정을 빌드하는 방법에 대해 설명합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 FCS 확산법 분석 덕분에 살아있는 세포에서 원형질막 조직의 역학을 해독하는 강력한 실험 접근법 인 표준 형광 현미경에서 svFCS 모듈의 구현을 설명했습니다. 개념적으로, svFCS는 간단한 원리에 기초한다: 조명 영역(23)의 크기를 변화시키면서 시간 영역에서의 형광의 상관관계 측정. 이 전략은 현미경 측정에서 나노스코픽 정보를 추론하는 데 중요한 역할을 했으며, 이는 정상 상태(25) 및 생리적 과정 30,31,32,33에서 원형질막 조직에 기여하는 주요 물리화학적 요소를 해독하는 데 도움이 된다. 전체적으로, 이러한 svFCS 분석은 다양한 세포 유형에서 지질 의존성 나노 도메인의 존재와 다른 신호 전달 사건을 튜닝하는 데 직접적인 영향을 미친다는 것을 명확하게 보여줍니다.
이 프레임 워크 내에는 광자 예산을 최적화하고 광학 수차를 최소화하기 위해 svFCS 설정을 구축하는 동안 고려해야 할 몇 가지 광학적 측면이 있습니다. 따라서 svFCS 측정을 수행할 때 튜브 렌즈를 제거할 수 있는 현미경을 사용하는 것이 좋습니다. 또한, 단일 아이리스는 svFCS 설정에서 중요한 역할을 합니다: 목표물의 뒤쪽 조리개에서 빔 크기를 변경하여 효과적인 허리 크기(즉, 유효 여기 볼륨)를 직접 변경합니다. 빔 직경은 가장 작은 허리 크기(34)를 얻기 위해 객관적인 뒷동공에 맞아야 한다. 허리 크기를 조정하는 데 도움이되는이 옵션은 광자 예산의 최적화를 보장하고 구현하기 쉽습니다. 마지막으로, 최소 수의 광학 부품이 광 경로를 따라 사용됩니다. 시스템이 덜 복잡할수록 손실되는 광자가 줄어 듭니다. 이러한 모든 옵션은 svFCS 실험의 견고성을 크게 향상시킵니다.
프로토콜 자체와 관련하여 몇 가지 중요한 단계를 고려해야합니다. 가장 중요한 것은 성공적인 svFCS 측정에 중요한 광 경로의 적절한 정렬입니다 (프로토콜, 섹션 2). 이는 2 nM Rh6G 용액으로부터의 형광 신호를 분석함으로써 쉽게 확인할 수 있으며, 이는 300 μW 레이저 조명 하에서 ∼200 kHz이어야 한다. 모든 홍채를 열어야 하며 ACF는 중요한 진폭(일반적으로 G0~1.5–2.0)을 가져야 합니다. 또 다른 중요한 점은 세포와 svFCS 분석을위한 준비에 관한 것입니다 (프로토콜, 섹션 4-8). 그들의 밀도는 관찰 될 분리 된 세포가 분석에 사용할 수 있도록 적응되어야합니다. 비부착성 세포는 폴리-L-라이신 용액을 사용하여 챔버형 커버글라스 상에 고정화되어야 한다. 세포 표지로부터의 형광 신호는 너무 강하지 않아야하며, 또는 맞추기 어려운 매우 평평한 ACF를 초래할 것이며, 적합 매개 변수는 중요한 오류로 부담됩니다. 또한, 세포의 비균질한 표지 및 형광 응집체는 svFCS 측정을 해석하기가 매우 어렵게 만든다. 마지막으로, 콜레스테롤 산화 효소 처리는 세포 생존율에 영향을 미치며, svFCS 분석은 치료 후 한 시간을 초과해서는 안됩니다. 또한 지지체에 부착되지 않기 때문에 상부 원형질막으로부터의 형광 변동을 기록하는 것이 더 좋으며, 지지체와의 물리적 상호 작용으로 인해 분자의 확산이 방해받을 위험이 없습니다.
svFCS 기술은 검출량을 조정하기 위한 양식의 다양성 때문에 다양한 접근법에서 사용하기 위한 충분한 진보가 있었고, 살아있는 세포에서 다양한 생물학적 과정을 연구할 수 있게 되었다. 여기 부피의 크기를 조정하는 대안은 가변 빔 확장기(35)를 사용하는 것이다. 또한, z 방향(36)을 따라 원형질막의 인터셉트로부터 형광 신호를 기록함으로써 조명 영역의 크기를 간단하게 변조할 수도 있다. 이것은 확산 법칙37,38을 도출하기 위해 이론적 틀이 개발 된 표준 공초점 현미경에서 수행 할 수 있습니다.
svFCS 방법이 원형질막의 불균질한 측면 조직의 특성화에 필요한 시공간 분해능을 제공하지만, 기하학적 감금 모드는 상호 배타적이지 않습니다. 한 방향 또는 다른 방향에서 t0의 편차는 배타적으로 지배적인 감금 모드(25)를 드러낸다. 더욱이, 본 svFCS 방법의 또 다른 중요한 한계는 고전적인 광학 회절 한계 (∼200 nm)로부터 기인한다. 이것은 의심할 여지없이 세포 원형질막 내에 분자를 가두는 도메인보다 더 크다. 따라서, 감금의 분석은 확산 법칙으로부터 외삽된 t0 값으로부터 추론된다.
이러한 단점은 대체 방법을 구현함으로써 극복되었습니다. 초기에, 나노애퍼처로 뚫린 금속 필름을 사용하는 것은 매우 작은 막 영역(즉, 75nm와 250nm 사이에서 변하는 반경의 단일 나노메트릭 개구들의 광학 회절 한계 이하)39를 조명할 수 있는 가능성을 제공하였다. 단리된 도메인 조직에 대한 이론적 확산 법칙으로부터 예측된 전이 정권이 따라서 보고되었고, 나노메트릭 멤브레인 이질성의 특징적인 크기의 정제와 지질 의존성 나노도메인39에 의해 점유된 표면적의 정량적 추정을 허용하였다. 대안적으로, 나노메트릭 조명은 또한 근거리 스캐닝 광학 현미경(40) 또는 평면 광학 나노안테나(41)를 사용하여 개발되었다. 보다 최근에, 자극 방출 고갈(STED)과 FCS의 결합은 매우 높은 공간 분해능으로 확산 법칙을 문서화하는 강력하고 민감한 도구를 제공하였다. 이 STED-FCS는 단기간 내에 발생하는 나노스케일의 분자 확산 특성에 대한 액세스를 허용하여, 원형질막(42,43)에서 지질 프로브의 동적 조직에 대한 연구를 가능하게 한다. 그러나, STED 공정에서 형광의 불완전한 억제는 FCS에서의 자기상관곡선의 분석에 도전한다.
이러한 어려움을 극복하기 위해 새로운 피팅 모델이 개발되어 확산 시간 및 평균 분자 수 측정(44)의 정확도가 향상되었다. 마지막으로, 원형질막에서의 느린 분자 확산을 위해, svFCS 원리는 이미지 상관 분광법(45)에 의해 기록된 데이터에 적용될 수 있다. 최근에, 원자력 현미경 (AFM)과 이미징 총 내부 반사-FCS (ITIR-FCS)의 결합이 나노 도메인(46)의 고밀도로 인해 원형질막, 특히 퍼콜레이션 임계 막 구성 근처에서 분자 확산을 방해하는 메커니즘의 성질의 개선에 기여한다는 것이 입증되었다.
결론적으로, svFCS에 의한 확산 법칙을 확립하는 것은 동적 집단 지질 및 막 단백질의 연관성에 의해 생성 된 국소 이질성을 추론하기위한 실험 증거를 제공했다. Wohland와 동료(46)가 언급 한 바와 같이, "FCS 확산 법 분석은 동적 정보로부터 해결 한계 이하의 구조적 및 조직적 특징을 추론하는 데 유용한 도구로 남아 있습니다." 그럼에도 불구하고, 우리는 원형질막에서 발생하는 분자 사건의 역학에 대한 더 나은 이해를 허용해야하는 확산 법칙의 해석을 개선하기위한 새로운 모델을 개발해야합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
SB, SM 및 DM은 CNRS, Inserm 및 Aix-Marseille University의 기관 자금 지원과 프랑스 국립 연구 기관 (ANR-17-CE15-0032-01 및 ANR-18-CE15-0021-02)과 프랑스 "Investissement d'Avenir"(ANR-10-INBS-04 France-BioImaging, ANR-11-LABX-054 labex INFORM)의 프로그램 보조금으로 지원되었습니다. KW는 생명 공학 및 나노 기술 분야에서 학제 간 환경 박사 과정 인 "BioTechNan"을 인정합니다. EB는 프로젝트 번호 2016/21/D/NZ1/00285에 따라 폴란드 국립 과학 센터 (NCN)와 프랑스 정부 및 폴란드 프랑스 대사관의 재정 지원을 인정합니다. MŁ는 폴란드 개발부 (CBR POIR.02.01.00-00-0159/15-00/19)와 국립 연구 개발 센터 (Innochem POIR.01.02.00-00-0064/17)의 재정 지원을 인정합니다. TT는 프로젝트 번호 2016/21/B/NZ3/00343에 따라 폴란드 국립 과학 센터 (NCN)와 브로츠와프 생명 공학 센터 (KNOW)의 재정 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Aligment tool | Spanner Wrench for SM1-Threaded Retaining Rings | Thorlabs | SPW602 |
| Avalanche Photodiode and Single Photon Counting Module (SPCM) | Single-Photon Counting Module, Avalanche Photodiode | Excelitas | SPCM-AQRH-15 |
| BNC 50 Ω plug to 50 Ω plug lead 2 m | RS Components | 742-4315 | |
| Coaxial cable 415 Cinch Connectors, RG-316, 50 Ω With connector, 1.22 m, RoHS2 | RS Components | 885-8172 | |
| Tee 50Ω RF Adapter BNC Plug to BNC Socket 0 → 1GHz | RS Components | 546-4948 | |
| Brennenstuhl 2.5 m, 8 Socket Type E – French Extension Lead, 230 V | RS Components | 768-5500 | |
| Mascot, 6W Plug In Power Supply 5V dc, 1.2A, 1 Output Switched Mode Power Supply, Type C | RS Components | 452-8394 | |
| Crystek CCSMACL-MC-24 Reference Oscillator Power Cable RF Adapter | RS Components | 792-4079 | |
| Fluorescence filtering | 535/70 ET Bandpass, AOI 0° Chroma Diameter 25 mm | AHF filter | F47-539 |
| Laser Beamsplitter zt488 RDC, AOI 45° Chroma 25.5 x 36 x 1 mm | AHF filter | F43-088 | |
| 496/LP BrightLine HC Longpass Filter, AOI 0° Chroma Diameter 25 | AHF filter | F37-496 | |
| Hardware correlator | 80 MHz Digital Correlator | Correlator.com | Flex02-12D |
| Laser | LASER LASOS LDM-XT fiber coupled, 488 nm, 65 mW | Lasos | BLD-XT 488100 |
| Laser safety | High-Performance Black Masking Tape, 1" x 180' (25 mm x 55 m) Roll | Thorlabs | T743-2.0 |
| Lens Tissues, 25 Sheets per Booklet, 5 Booklets | Thorlabs | MC-5 | |
| Laser Safety Glasses, Light Orange Lenses, 48% Visible Light Transmission | Thorlabs | LG3B | |
| Microscope | Zeiss Axiovert 200M Motorized Inverted Fluorescence Microscope Fine and coarse focusing, reflector turret rotation, objective nosepiece rotation, switching camera ports, and internal light shutters | Carl Zeiss | |
| C-Apochromat 40x/1,2 W Korr.selected for FCS (D=0.14-0.19 mm) (WD=0.28 mm at D=0.17 mm), UV-VIS-IR | Carl Zeiss | 421767-9971-711 | |
| Adapter W0.8 / M27x0.75 H "5" | Carl Zeiss | 000000-1698-345 | |
| Middle ring W0.8 - W0.8 H "5" | Carl Zeiss | 000000-1698-347 | |
| Optical path | D25.4mm Mirror, Protected Silver | Thorlabs | PF10-03-P01 |
| D25.4mm, F=60.0.mm, Visible Achromat | Thorlabs | AC254-060-A | |
| D25.4mm, F=35.0.mm, Visible Achromat | Thorlabs | AC254-035-A | |
| 25 µm mounted pinhole | Thorlabs | P25S I | |
| 25.4mm Mounted Zero, Order 1/2 Waveplate 488 nm | Thorlabs | WPH10M-488 (HWP) | |
| 20mm Polarizing Beamsplitter Cube 420-680 nm | Thorlabs | PBS201 | |
| Rotation Stage 56 mm x 26 mm Threaded ID | Thorlabs | RSP1/M | |
| 52 mm x 52 mm Kinematic Platform Mount | Thorlabs | KM100B/M | |
| Adjustable Prism Clamp | Thorlabs | PM3/M | |
| Beam block - active area 19 mm x 38 mm | Thorlabs | LB1/M | |
| Iris Diaphragm 1 mm to 25 mm Aperture | Thorlabs | ID25/M | |
| Left-Handed Kinematic Cylindrical Lens Mount | Thorlabs | KM100CL | |
| 1" Optic Holder, M4 Tap | Thorlabs | MFF101/M | |
| 1" Stackable Lens Tube | Thorlabs | SM1L03 | |
| Stackable Lens Mount for 1" optic-usable depth ½ | Thorlabs | SM1L05 | |
| Stackable Lens Mount For 1"Optic-usable Depth 2" | Thorlabs | SM1L20 | |
| Small Optical Rails 600mm, metric | Thorlabs | RLA600/M | |
| Small Optical Rails 75mm, metric | Thorlabs | RLA075/M | |
| Small Optical Rails 150mm, metric | Thorlabs | RLA150/M | |
| Rail Carrier, Counterbored Hole 1"x 1" | Thorlabs | RC1 | |
| Rail Carrier, Perpendicular Dovetail | Thorlabs | RC3 | |
| High Precision Translating Lens Mount for 1 inch | Thorlabs | LM1XY/M | |
| ½ " (12mm) Dovetail Translation Stage | Thorlabs | DT12/M | |
| Rail Clamps | Thorlabs | CL6 | |
| Metric XYZ Translation Stage (Includes PT102) | Thorlabs | PT3/M | |
| Black Rubberized Fabric | Thorlabs | BK5 | |
| Ball Driver kit/ 6 tools | Thorlabs | BD-KIT/M | |
| Adapter with External M6 x 1.0 Threads and External M4 x 0.7 Threads | Thorlabs | AP6M4M | |
| Mounting Base, 25 mm x 58 mm x 10 mm, 5 Pack | Thorlabs | BA1S/M-P5 | |
| Lens Mount for 25.4mm optic | Thorlabs | LMR1/M | |
| SM1 FC/APC Adapter | Thorlabs | SM1FCA | |
| Kinematic Mirror Mount For 1 inch Optics | Thorlabs | KM100 | |
| Silicon Power Head, 400-1100nm, 50mW | Thorlabs | S120C | |
| 12.7 mm Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L=50 mm, 5 Pack | Thorlabs | PH50/M-P5 | |
| Post Holder with Spring-Loaded Hex-Locking Thumbscrew, L=20 mm | Thorlabs | PH20/M | |
| 12.7 mm x 50 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR50/M-P5 | |
| 12.7 mm x 75 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR75/M-P5 | |
| USB Power and Energy Meter Interface | Thorlabs | PM100USB | |
| 12.7 mm x 30 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR30/M | |
| 12.7 mm x 20 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR20/M | |
| 750 mm long Structural Rail (detection box) | Thorlabs | XE25L750/M | |
| 350 mm long Structural Rail (detection box) | Thorlabs | XE25L350/M | |
| Quick Corner Cube for 25 mm Rails | Thorlabs | XE25W3 | |
| Right-Angle Bracket for 25 mm Rails | Thorlabs | XE25A90 | |
| Black posterboard 20" x 30" (508 mm x 762 mm), 1/16" (1.6 mm) Thick, 5 Sheets | Thorlabs | TB5 | |
| Hinge for 25 mm Rail Enclosures | Thorlabs | XE25H | |
| Lid Stop for 25 mm Rail Enclosures | Thorlabs | XE25LS | |
| M4 Cap Screw Kit | Thorlabs | HW-KIT1/M | |
| M6 Cap Screw Kit and Hardware kit | Thorlabs | HW-KIT2/M | |
| Table Clamp, L-Shape, 5 Pack | Thorlabs | CL5-P5 | |
| SM1 Ring-Actuated Iris Diaphragm (Ø0.8 - Ø12 mm) | Thorlabs | SM1D12D | |
| Ø1" SM1-Mounted Frosted Glass Alignment Disk w/Ø1 mm Hole | Thorlabs | DG10-1500-H1-MD | |
| Honeycomb Optical Table Top, Standa | Standa | 1HB10-15-12 | |
| Optical Table support, Standa | Standa | 1TS05-12-06-AR | |
| Sample nano-positionning | Precision XYZ Nanopositioning | Physik Instrumente | PI P527-3.CD |
| Digital Multi-Channel Piezo Co, 3 Channels, -30 to 130 V Sub- D Connector(s), Capacitive Sensors, | Physik Instrumente | PI E727-3.CD | |
| Temperature chamber | Zeiss 200M Inverted Microscope Incubator System MATT BLK | Digital Pixel | |
| Dual Channel Microprocessor Temperature Controller | Digital Pixel | DP_MTC_2000_DUO | |
| Two Vibration Free Heater Modules | Digital Pixel | DP_150_VF | |
| PT100 Temperature Sensor | Digital Pixel | DP_P100_TS | |
| Biological Reagents and Materials | |||
| Cell culture and transfection | Cos7 cells | ATCC® | CRL-1651™ |
| 8- well Lab-Tek chambers | Thermo Fisher Scientific | 155411PK | |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 11965092 | |
| Fetal bovine serum | Thermo Fisher Scientific | 16000044 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| PBS buffer | Thermo Fisher Scientific | 14190144 | |
| PenStrep | Thermo Fisher Scientific | 15140122 | |
| PolyJet Transfection Reagent | SignaGen Laboratories | SL100688 | |
| Cholesterol content measurement | Amplex Red Cholesterol Assay Kit | Thermo Fisher Scientific | A12216 |
| Protease Inhibitor Cocktail | Thermo Fisher Scientific | 87786 | |
| Phosphatase Inhibitor Cocktail | Thermo Fisher Scientific | 78420 | |
| ROTI Nanoquant Working Solution | Roth | K880 | |
| GloMax Discover Microplate Reader | Promega | GM3000 | |
| svFCS measurements | HBSS buffer | Thermo Fisher Scientific | 14025092 |
| Hepes buffer | Thermo Fisher Scientific | 15630080 | |
| Cholesterol oxidase | Sigma-Aldrich | C8868 | |
| Rhodamine 6G | Sigma-Aldrich | 83697-1G |
참고문헌
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Newton, A. C. Regulation of the ABC kinases by phosphorylation: protein kinase C as a paradigm. The Biochemical Journal. 370, Pt 2 361-371 (2003).
- Marguet, D., Lenne, P. F., Rigneault, H., He, H. T. Dynamics in the plasma membrane: how to combine fluidity and order. The EMBO Journal. 25 (15), 3446-3457 (2006).
- Edidin, M. The state of lipid rafts: From model membranes to cells. Annual Review of Biophysics and Biomolecular Structure. , (2003).
- Lingwood, D., Simons, K. Lipid rafts as a membrane-organizing principle. Science. , (2010).
- He, H. T., Marguet, D. Detecting nanodomains in living cell membrane by fluorescence correlation spectroscopy. Annual Reviews of Physical Chemistry. 62, 417-436 (2011).
- Rossy, J., Ma, Y., Gaus, K. The organisation of the cell membrane: Do proteins rule lipids. Current Opinion in Chemical Biology. 20 (1), 54-59 (2014).
- Nicolson, G. L. The Fluid - Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et Biophysica Acta - Biomembranes. 1838 (6), 1451-1466 (2014).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1081 (2002).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34, 351-378 (2005).
- Destainville, N., Salomé, L. Quantification and correction of systematic errors due to detector time-averaging in single-molecule tracking experiments. Biophysical Journal. 90 (2), 17-19 (2006).
- Wieser, S., Moertelmaier, M., Fuertbauer, E., Stockinger, H., Schütz, G. J. Un)confined diffusion of CD59 in the plasma membrane determined by high-resolution single molecule microscopy. Biophysical Journal. 92 (10), 3719-3728 (2007).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. , (1976).
- Petrášek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. , (2008).
- Elson, E. L. 40 Years of FCS: How it all began. Methods in Enzymology. , (2013).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. , (1974).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. , (1974).
- Schwille, P., Haupts, U., Maiti, S., Webb, W. W. Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two-photon excitation. Biophysical Journal. , (1999).
- Bouchaud, J. P., Georges, A. Anomalous diffusion in disordered media: Statistical mechanisms, models and physical applications. Physics Reports. , (1990).
- Yechiel, E., Edidin, M. Micrometer-scale domains in fibroblast plasma membranes. Journal of Cell Biology. 105 (2), 755-760 (1987).
- Salomé, L., Cazeils, J. L., Lopez, A., Tocanne, J. F. Characterization of membrane domains by FRAP experiments at variable observation areas. European Biophysics Journal. 27 (4), 391-402 (1998).
- Niv, H., Gutman, O., Kloog, Y., Henis, Y. I. Activated K-Ras and H-Ras display different interactions with saturable nonraft sites at the surface of live cells. The Journal of Cell Biology. 157 (5), 865-872 (2002).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophysical Journal. 89 (6), 4029-4042 (2005).
- Saxton, M. J. Fluorescence corralation spectroscopy. Biophysical Journal. , (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO Journal. 25 (14), 3245-3256 (2006).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. , (2015).
- Billaudeau, C., et al. Probing the plasma membrane organization in living cells by spot variation fluorescence correlation spectroscopy. Methods in Enzymology. 519, 277-302 (2013).
- Mailfert, S., Hamon, Y., Bertaux, N., He, H. T., Marguet, D. A user's guide for characterizing plasma membrane subdomains in living cells by spot variation fluorescence correlation spectroscopy. Methods in Cell Biology. 139, 1-22 (2017).
- Rege, T. A., Hagood, J. S. Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses. Biochimica et Biophysica Acta - Molecular Cell Research. , (2006).
- Cahuzac, N., et al. Fas ligand is localized to membrane rafts, where it displays increased cell death-inducing activity. Blood. , (2006).
- Guia, S., et al. Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance. Science Signaling. 4 (167), 21(2011).
- Blouin, C. M., et al. Glycosylation-dependent IFN-γR partitioning in lipid and actin nanodomains is critical for JAK activation. Cell. 166 (4), 920-934 (2016).
- Chouaki-Benmansour, N., et al. Phosphoinositides regulate the TCR/CD3 complex membrane dynamics and activation. Scientific Reports. , (2018).
- Wawrezinieck, L., Lenne, P. F., Marguet, D., Rigneault, H. Fluorescence correlation spectroscopy to determine diffusion laws: application to live cell membranes. Biophotonics Micro- and Nano-Imaging. , (2004).
- Masuda, A., Ushida, K., Okamoto, T. New fluorescence correlation spectroscopy enabling direct observation of spatiotemporal dependence of diffusion constants as an evidence of anomalous transport in extracellular matrices. Biophysical Journal. , (2005).
- Humpolíčková, J., et al. Probing diffusion laws within cellular membranes by Z-scan fluorescence correlation spectroscopy. Biophysical Journal. , (2006).
- Benda, A., et al. How to determine diffusion coefficients in planar phospholipid systems by confocal fluorescence correlation spectroscopy. Langmuir. , (2003).
- Ganguly, S., Chattopadhyay, A. Cholesterol depletion mimics the effect of cytoskeletal destabilization on membrane dynamics of the serotonin1A receptor: A zFCS study. Biophysical Journal. , (2010).
- Wenger, J., et al. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization. Biophysical Journal. 92 (3), 913-919 (2007).
- Manzo, C., Van Zanten, T. S., Garcia-Parajo, M. F. Nanoscale fluorescence correlation spectroscopy on intact living cell membranes with NSOM probes. Biophysical Journal. , (2011).
- Regmi, R., et al. Planar optical nanoantennas resolve cholesterol-dependent nanoscale heterogeneities in the plasma membrane of living cells. Nano Letters. , (2017).
- Mueller, V., et al. FCS in STED microscopy: Studying the nanoscale of lipid membrane dynamics. Methods in Enzymology. , (2013).
- Sezgin, E., et al. Measuring nanoscale diffusion dynamics in cellular membranes with super-resolution STED-FCS. Nature Protocols. , (2019).
- Wang, R., et al. A straightforward STED-background corrected fitting model for unbiased STED-FCS analyses. Methods. , (2018).
- Veerapathiran, S., Wohland, T. The imaging FCS diffusion law in the presence of multiple diffusive modes. Methods. , (2018).
- Gupta, A., Phang, I. Y., Wohland, T. To hop or not to hop: exceptions in the FCS diffusion law. Biophysical Journal. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유