Method Article
Точечная вариационная флуоресцентная корреляционная спектроскопия для анализа молекулярной диффузии на плазматической мембране живых клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Целью этой статьи является представление протокола о том, как построить микроскоп точечной флуоресцентной корреляционной спектроскопии (svFCS) для измерения молекулярной диффузии на плазматической мембране живых клеток.
Аннотация
Динамические биологические процессы в живых клетках, в том числе связанные с организацией плазматической мембраны, происходят в различных пространственных и временных масштабах, начиная от нанометров до микрометров и микросекунд до минут соответственно. Такой широкий спектр биологических процессов бросает вызов традиционным подходам микроскопии. Здесь мы подробно описываем процедуру реализации измерений флуоресцентной корреляционной спектроскопии (svFCS) с использованием классического флуоресцентного микроскопа, который был настроен. Протокол включает в себя специальную проверку производительности установки svFCS и руководство по измерениям молекулярной диффузии svFCS на плазматической мембране живых клеток в физиологических условиях. Кроме того, мы предоставляем процедуру разрушения нанодоменов плота плазматической мембраны путем лечения холестериноксидазой и демонстрируем, как эти изменения в боковой организации плазматической мембраны могут быть выявлены анализом svFCS. В заключение, этот метод, основанный на флуоресценции, может предоставить беспрецедентные подробности о боковой организации плазматической мембраны с соответствующим пространственным и временным разрешением.
Введение
Сложность организации плазматических мембран
Современное понимание организации клеточных мембран должно учитывать несколько аспектов1. Во-первых, сложный липидный состав варьируется не только между типами клеток, но и внутри одной клетки (мембранные органеллы/плазматическая мембрана). Кроме того, ассоциированные или внутренние мембранные белки в основном организованы в динамические многомерные комплексы, с большими доменами, выходящими за пределы мембраны, что составляет значительно большую площадь, чем у одних только трансмембранных доменов. Кроме того, мембраноассоциированные белки проявляют специфические липидсвязывающие или липид-взаимодействующие способности, которые играют роль в регуляции функции белка. Они напрямую зависят от местного состава и доступности липидов2.
Наконец, наблюдается значительный уровень асимметрии между двумя мембранными листочками из-за внутренней асимметричной структуры мембранных белков и распределения липидов. Действительно, липидный метаболический баланс между синтезом и гидролизом в сочетании с липидным переворотом между листовками генерирует такое асимметричное распределение. Поскольку любой транспорт через бислой ограничен свободной энергией, необходимой для перемещения полярной головной группы через гидрофобную внутреннюю часть мембран, ему обычно помогают селективные транспортеры. Для каждого типа клеток асимметрия имеет тенденцию твердо поддерживаться. В совокупности эти факторы способствуют боковой неоднородности или компартментализации плазматической мембраны 3,4.
Мы обогащаем это представление плазматической мембраны, принимая во внимание внутреннюю молекулярную диффузию внутри и поперек бислоя, что способствует динамической боковой гетерогенности в масштабе от десятых до сотен нанометров и микросекунд до секунд. Например, липидозависимые мембранные нанодомены — так называемые липидные рафты, определяемые как холестерин, и богатые сфинголипидами сигнальные платформы — способствуют компартментализации плазматической мембраны 5,6. Однако современный взгляд на организацию мембран не ограничивается только липидными плотами. Мембранные нанодомены более сложны и неоднородны по составу, происхождению и функции. Тем не менее, их присутствие в плазматической мембране должно быть тесно скоординировано, а динамические взаимодействия между белками и липидами, по-видимому, важны для пространственного распределения и химической модификации мембранных нанодоменов 1,3,7,8.
Принцип svFCS и его применение для исследования организации плазматической мембраны
Хотя в анализе мембранных доменов был достигнут значительный прогресс, главным образом с помощью биофизических методов, детерминанты, которые диктуют локальную организацию плазматической мембраны, должны быть уточнены с соответствующим пространственным и временным разрешением. Детерминанты, основанные на отслеживании отдельных молекул, обеспечивают отличную пространственную точность и позволяют характеризовать различные режимы движения 9,10,11,12, но имеют ограниченное временное разрешение с классической низкой частотой кадров камеры и требуют больше экспериментальных усилий для записи значительного количества траекторий. Альтернативно, коэффициент диффузии мембранных компонентов может быть оценен с помощью флуоресцентного восстановления после фотоотбеливания (FRAP)13 или флуоресцентной корреляционной спектроскопии (FCS)14. Последнему уделяется больше внимания, главным образом из-за его высокой чувствительности и селективности, микроскопического объема обнаружения, низкой инвазивности и широкого динамического диапазона15.
Концептуальная основа FCS была введена Магде и его коллегами около 50 лет назад16,17. Он основан на регистрации флуктуаций флуоресцентного излучения с высоким временным разрешением (от мкс до с)18. В его современной версии измерения в живых клетках выполняются небольшим конфокальным объемом возбуждения (~0,3 фемтолитра), расположенным в интересующей области (например, на плазматической мембране); флуоресцентный сигнал, генерируемый диффузионными флуоресцентными молекулами, входящими и выходящими из объема наблюдения, собирается с очень высоким временным разрешением (т.е. временем прибытия каждого фотона на детектор). Затем сигнал вычисляется для генерации автокорреляционной функции (ACF), из которой извлекается среднее время td (время диффузии), в течение которого молекула остается в фокальном объеме, вместе со средним числом частиц (N), присутствующих в объеме наблюдения, которое обратно пропорционально амплитуде ACF. Этот последний параметр может быть полезной информацией о концентрации молекулы в объеме наблюдения.
С тех пор все большее число модальностей FCS было реализовано благодаря быстро развивающейся аппаратуре в биофотонике, позволяющей описывать динамические явления, происходящие в живых системах. Тем не менее, молекулярный вид будет испытывать более перекрывающееся распределение значений коэффициента диффузии, что обычно отражается аномальной характеристикой диффузии, в которой молекулы диффундируют с нелинейной зависимостью во времени19, и трудностями в определении биологического значения этой аномальной субдиффузии. В прошлом эта трудность была несколько преодолена путем регистрации молекулярной диффузии FRAP из областей различных размеров, а не только из одной области, тем самым обеспечивая дополнительную пространственную информацию. Это позволило, например, концептуализировать мембранные микродомены 20,21,22.
Перевод этой стратегии в измерения FCS (т.е. так называемая точечная вариационная флуоресцентная корреляционная спектроскопия (svFCS)) был установлен путем изменения размера фокального объема наблюдения, что позволило регистрировать флуктуации флуоресценции на разных пространственных масштабах23. Таким образом, подход svFCS предоставляет косвенную пространственную информацию, позволяющую идентифицировать и определять режимы молекулярной диффузии и тип мембранного разделения (изолированные и смежные домены24) исследуемых молекул. Построив время диффузии td как функцию различных пространственных масштабов, определяемых значением талии (ω), которое соответствует размеру радиуса луча обнаружения в данном случае23,25, можно охарактеризовать закон диффузии данной молекулы в данном физиологическом состоянии. Таким образом, svFCS является идеальным аналогом отслеживания одной частицы вовременной области 26. В соответствии с броуновским диффузионным ограничением следует ожидать строго линейной зависимости между временем диффузии td и талией ω (рисунок 1)23,25. Происхождение отклонения закона диффузии от этой схемы можно отнести к неисключительным причинам, таким как сетка цитоскелетов, молекулярная скученность, динамическое разделение в нанодоменах или любая комбинация этих и других эффектов (фиг.1), и нуждается в экспериментальном испытании25.
Здесь мы предоставляем все необходимые контрольные точки управления для ежедневного использования изготовленной на заказ оптической системы svFCS, построенной с нуля, которая дополняет наши предыдущие обзоры протокола27,28 по этому экспериментальному подходу. Кроме того, в качестве доказательства концепции мы даем рекомендации относительно калибровки установки, подготовки клеток, сбора данных и анализа для установления закона диффузии svFCS (DL) для Thy1-GFP, плазматической мембраны гликозилфосфатидинозитол-анкированного белка, который, как известно, локализован в липидных плотовых нанодоменах29. Наконец, мы демонстрируем, как частичная дестабилизация липидно-рафтовых нанодоменов при обработке холестериноксидазой влияет на диффузионные свойства Thy1-GFP. Кроме того, подробное описание сборки установки svFCS с нуля приведено в дополнительном материале.
протокол
1. Настройка спецификации для сборки пользовательской установки svFCS
ПРИМЕЧАНИЕ: Простота предлагаемой настройки svFCS позволяет легко устанавливать, эксплуатировать и обслуживать при низких затратах, обеспечивая при этом эффективность восстановления фотонов. Дополнительные сведения см. в разделе Дополнительные материалы.
- Экспериментальная комната и безопасность
- Установите систему в помещении, стабилизированном при температуре около 21 °C.
- Избегайте прямого воздушного потока на пассивном (или активном) оптическом столе и следуйте правилам лазерной безопасности для оптического выравнивания.
- Аппаратное и программное обеспечение
ПРИМЕЧАНИЕ: В дополнительном материале подробно описываются этапы установки, показанные на рисунке 2.- Запишите основное программное обеспечение для сбора и управления в LabVIEW, используя конечный автомат и архитектуру структуры событий, где многофункциональная плата сбора управляет большинством контроллеров.
ПРИМЕЧАНИЕ: Коррелятор, лазер и измеритель мощности контролируются или контролируются собственным программным обеспечением. - Адаптируйте процедуры установки аппаратного и программного обеспечения в соответствии с используемым оборудованием.
- Запишите основное программное обеспечение для сбора и управления в LabVIEW, используя конечный автомат и архитектуру структуры событий, где многофункциональная плата сбора управляет большинством контроллеров.
- Оптическая установка
ПРИМЕЧАНИЕ: На рисунке 3 показаны оптические стендовые модули, используемые в следующих разделах для контроля качества оптических выравниваний. Все спецификации оптических элементов перечислены в Таблице материалов. Процедура сборки установки подробно описана в дополнительном материале. Эта система включает в себя лазер непрерывной волны, моторизованный инвертированный микроскоп, оснащенный погружным водным объективом, лавинный фотодиодный детектор, соединенный с одним модулем подсчета фотонов, и аппаратный коррелятор. Инкубационная камера микроскопа с безвибрационными нагревателями была специально разработана для контроля температуры для экспериментов на живых клетках. По соглашению, ось XY соответствует перпендикулярной плоскости оптического пути, а ось Z соответствует оптическому пути.
2. Ежедневная контрольная точка перед запуском эксперимента
- Контролируйте траекторию возбуждения (рисунок 3 и
 ).
).- Откройте все диафрагмы радужной оболочки.
- Измерьте мощность лазера с помощью измерителя мощности, сохраняя первую радужную оболочку полностью открытой.
- Поверните полуволновую пластину (HWP), чтобы найти максимальную мощность.
- Проверьте выравнивание с помощью радужных оболочек, если мощность лазера ниже обычной, и при необходимости перемещайте L1 и M1 поочередно.
- Запишите значение мощности в экспериментальной лабораторной записной книжке.
- Управляйте путем обнаружения (рисунок 3 и
 ).
).- Поместите на цель воду, крышку и каплю раствора родамина 6G (Rh6G) 2 нМ.
- Если флуоресцентный сигнал (номер подсчета на APD, записанный с помощью программного обеспечения LabVIEW) ниже, чем обычно, переделайте решение Rh6G, проверьте позиционирование и номер крышки на объективе или устраните пузырьки, если таковые имеются.
- Если флуоресцентный сигнал все еще ниже, чем обычно, поместите измеритель мощности внутрь оптического пути, чтобы заблокировать луч.
- Выключите APD (далее APD относится к APD и модулю подсчета одиночных фотонов).
- Удалите образец.
- Очистите и замените объектив на отражающую мишень.
- Проверьте лазерный луч на отражающей цели, удалив измеритель мощности с светового пути. Убедитесь, что луч цели центрирован, а обратное отражение достигает первой радужки на линии
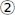 (рисунок 3).
(рисунок 3). - Если нет, отрегулируйте центральное позиционирование с помощью M2 или обратное отражение с помощью дихроичного зеркала.
- Если связь микроскопа верна, отодвиньте объектив назад, добавьте каплю воды, крышку и каплю более концентрированного раствора Rh6G (т. Е. 200 нМ) и установите меньшую мощность лазера, чем для классических измерений (несколько мкВт).
- Включите APD и оптимизируйте выравнивание APD и точечных отверстий, поочередно, с помощью соответствующих регулировочных винтов XYZ при мониторинге сигнала интенсивности (программное обеспечение LabVIEW).
- Измените крышку и добавьте более низкую концентрацию Rh6G (2 нМ). Переместите точечное отверстие вдоль оси Z, чтобы найти положение, где коэффициент молекулярной яркости увеличивается, а талия минимальна.
- Закройте диафрагму до тех пор, пока сигнал не упадет вниз: размер лазерного луча достигнет размера задней диафрагмы объектива (т. Е. Минимального размера талии, см. Дополнительный материал).
- Запустите программное обеспечение коррелятора и запишите данные (запись данных см. в разделе 7).
- Проверьте ACF, который должен отображать низкое количество шума, давать небольшой размер талии и высокую скорость подсчета на молекулу в секунду (см. раздел 7 для анализа данных и оценки размера талии).
3. Общие соображения по записи и анализу данных svFCS
- Запишите и проанализируйте данные флуоресценции в соответствии с этой общей схемой (см. разделы 7, 8 и 9): (1) флуоресцентная запись и генерация ACF (программное обеспечение коррелятора), (2) неожиданное отбрасывание данных, среднее значение сохраненных данных, соответствующее соответствующей модели (с самодельным программным обеспечением Igor Pro), (3) график закона диффузии (самодельное программное обеспечение MATLAB 1) и (4) дополнительное сравнение законов диффузии (самодельное программное обеспечение MATLAB 2). Различные программы предоставляются по запросу.
ПРИМЕЧАНИЕ: Аппаратный коррелятор имеет минимальное время дискретизации 12,5 нс (т.е. частоту дискретизации 80 МГц). Он обеспечивает временное разрешение, которое по меньшей мере на 1000 ниже, чем типичное резидентное время свободно диффундирующей малой молекулы в растворе и на 106 меньше, чем время диффузии мембранных белков в конфокальном объеме наблюдения.
4. Клеточная культура и трансфекция
- Засейте клетки Cos7 в 8-луночно камерное покровное стекло с боросиликатным стеклянным дном No 1,0 при плотности 10 000 клеток / хорошо, используя полную модифицированную орлиную среду Dulbecco (DMEM), дополненную 5% фетальной бычьей сывороткой, пенициллином (100 Ед / мл), стрептомицином (100 ЕД / мл) и L-глутамином (1 мМ).
- Культивировать клетки при 37 °C во увлажненной атмосфере, содержащей 5% CO2 в течение 24 ч.
- Удалить среду, добавить 300 мкл свежей полной культуральной среды на лунку и предварительно обубать клетки в течение 30 мин при 37 °C.
- Развести 0,5 мкг плазмидной ДНК, кодирующей белок Thy-1, слитой с eGFP25 в 50 мкл бессывороточного DMEM. Вихрь ненадолго перемешать.
- Развести 1,5 мкл трансфекционного реагента ДНК в 50 мкл бессывороточного DMEM и хорошо перемешать раствор.
- Добавьте разбавленный трансфекционный реагент непосредственно в приготовленный раствор ДНК и сразу же перемешайте соединения.
- Инкубировать приготовленную смесь в течение 10 - 15 мин при комнатной температуре.
- Добавьте 10 мкл комбинированных комплексов реагентов ДНК/трансфекции по каплям на среду в каждой лунке и гомогенизируйте, осторожно закручивая пластину.
- Инкубируют клетки при 37 °C с 5% CO2 в течение 3 ч.
- После инкубации замените среду, содержащую комплексы реагентов ДНК/трансфекции, 400 мкл свежего полного DMEM и культивируйте клетки в течение 16 ч перед экспериментом svFCS.
5. Подготовка клеток к измерениям svFCS
- Удалите культуральную среду.
- Тщательно промыть клетки два-три раза безымянным буфером сбалансированного солевого раствора Хэнка (HBSS), содержащим Ca2+ и Mg2+ , дополненным 10 мМ (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) (HEPES), рН 7,4 (HBSS / HEPES).
- Поддерживайте ячейки в буфере HBSS/HEPES во время всех приобретений svFCS.
6. Фармакологическое лечение
- Удалите культуральную среду и промыть клетки два-три раза безымянным HBSS с добавлением 10 мМ HEPES, рН 7,4 (HBSS / HEPES).
- Инкубируют клетки с 1 ЕД/мл раствора холестериноксидазы (COase) в буфере HBSS/HEPES в течение 1 ч при 37 °C.
- Удалите раствор и поддерживайте клетки в присутствии 0,1 ЕД/мл COase в буфере HBSS/HEPES при выполнении измерений svFCS.
7. Калибровка размера пятна
- Предваряют камеру микроскопа при 37 °C.
- Приготовьте стандартный 2 нМ раствор Rh6G путем последовательного разбавления.
- Нанесите 200 мкл раствора Rh6G 2 нМ на стеклянную крышку, помещенную на объектив погружения в воду.
- Запустите все аппаратное и программное обеспечение.
- Измерьте и отрегулируйте мощность лазерного луча 488 нм до 300 мкВт. В зависимости от яркости и фотостабильности используемого флуоресцентного зонда, адаптируйте эту мощность в соответствии с (1) интенсивностью флуоресценции (на программном обеспечении LabVIEW), которая должна быть стабильной, (2) формой ACF (на программном обеспечении коррелятора), которая должна иметь постоянную форму с течением времени, и (3) параметры подгонки, дающие небольшой размер талии и высокую скорость подсчета на молекулу (фотоны на молекулу в секунду, обычно от нескольких десятков до сотен фотонов на молекулу в секунду).
ПРИМЕЧАНИЕ: Амплитуда АКФ (называемая G(0)) обратно пропорциональна числу молекулы (т.е. концентрации флуоресцентного зонда). Для калибровки размера талии это хороший параметр кандидата на контроль качества. Поэтому G(0) должен быть одинаковым для одной и той же концентрации изо дня в день, поскольку он связывает размер талии и концентрацию. Для измерений клеток, поскольку FCS более точен для низкой концентрации, G(0) должен быть высоким для правильного извлечения параметра. - Установите порт микроскопа освещения/обнаружения svFCS с помощью программного обеспечения LabVIEW.
- Включите APD.
- Закройте радужную оболочку до тех пор, пока сигнал не упадет вниз, чтобы получить минимальный размер талии, или закройте ее для большего размера талии.
- Запишите несколько ACF выбранной продолжительности (а именно прогон) для улучшения статистической воспроизводимости, обычно 10 запусков продолжительностью 20 с каждый с программным обеспечением коррелятора.
- Выключите APD.
- Используйте программное обеспечение Igor Pro для проверки и отбрасывания прогонов с сильными флуктуациями из-за молекулярных агрегатов. Выполните этот шаг вручную — он должен быть независимым от пользователя после обучения пользователей.
- Подберите среднее значение сохраненных ACF с 3D-диффузионной моделью.
- Извлеките из параметров подгонки среднее время
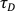 диффузии и сохраните его в файл «.txt» (формат файла диктуется программным обеспечением Igor Pro).
диффузии и сохраните его в файл «.txt» (формат файла диктуется программным обеспечением Igor Pro). - Проверьте скорость подсчета на молекулу в секунду (хороший показатель производительности), разделив среднюю интенсивность (извлеченную из флуоресцентного следа) на количество молекул (извлеченных из ACF).
ПРИМЕЧАНИЕ: Убедитесь, что это значение является высоким и стабильным изо дня в день для одних и тех же параметров приобретения. - Зная коэффициент диффузии Rh6G в водном растворе при 37 °C (D) и
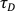 (см. 7,13), рассчитайте экспериментальный размер талии ω в соответствии с:
(см. 7,13), рассчитайте экспериментальный размер талии ω в соответствии с: 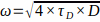 .
. - Применяйте процедуру для каждого изменения размера талии, необходимого для построения закона диффузии FCS и перед любой новой экспериментальной серией сбора данных svFCS.
8. Сбор данных svFCS по ячейкам
- Измерьте и отрегулируйте мощность пучка 488 нм от 2 до 4 мкВт. В зависимости от яркости и фотостабильности используемого флуоресцентного зонда, адаптируйте эту мощность, чтобы обеспечить высокую скорость подсчета на молекулу (обычно несколько тысяч фотонов на молекулу в секунду), сохраняя при этом низкое фотоотбеливание (т. Е. Стабильный след интенсивности в программном обеспечении LabVIEW).
- Уравновешивайте образцы в течение 10 мин при 37 °C перед началом измерений.
- Установите микроскоп эпифлуоресцентного освещения с помощью программного обеспечения LabVIEW.
- Выберите ячейку с соответствующим расположением флуоресцентного зонда и (низкой) интенсивностью флуоресцентного сигнала.
ПРИМЕЧАНИЕ: Чем ниже флуоресценция, тем лучше измерения FCS (см. шаг 8.1). - Установите порт микроскопа освещения/обнаружения svFCS с помощью программного обеспечения LabVIEW.
- Включите APD.
- Выполните xy-сканирование выбранной ячейки с помощью программного обеспечения LabVIEW.
- Выполните z-сканирование и найдите конфокальное пятно с максимальной интенсивностью флуоресценции, выбрав плазматическую мембрану наверху, и начните сбор данных. Чтобы максимизировать разделение между двумя мембранами, предпочтительно выполнять сканирование в ядерной области клетки.
- Запишите одну серию из 20 запусков продолжительностью 5 с, каждый с помощью программного обеспечения коррелятора.
ПРИМЕЧАНИЕ: Убедитесь, что продолжительность каждого пробега достаточно велика для получения ACF с пониженным уровнем шума. Длительные приобретения подвержены фотоотбеливанию или неожиданным существенным изменениям (например, агрегатам). Адаптируйте количество прогонов, их продолжительность и количество серий к образцам, но убедитесь, что они остаются постоянными в пределах одного и того же объема экспериментов для воспроизводимости. - Выключите APD.
- Откажитесь от неожиданных запусков с помощью программного обеспечения Igor Pro.
- Подойдите к среднему ACF с 2-видовой 2D-диффузионной моделью. Адаптируйте эту модель к типу диффузионного поведения молекулы-мишени.
- Сохраните параметры подгонки в предыдущем файле (см. шаг 7.13).
- Выполните от 10 до 15 серий записей по меньшей мере на 10 различных ячейках и воспроизведите шаги с 8,3 по 8,13. Убедитесь, что один полученный файл содержит информацию о размере талии и параметры подгонки 10–15 записей.
- Чтобы установить единый закон диффузии, проанализируйте по крайней мере четыре размера талии, варьирующиеся от 200 до 400 нм. Этот диапазон определяется дифракционным оптическим пределом, но зависит от объектива (числовая апертура) и лазера (длина волны).
ПРИМЕЧАНИЕ: Поскольку калибровка размера талии не является абсолютной и имеет некоторую степень неопределенности, специальное программное обеспечение MATLAB28 , учитывающее ошибку x и y (а именно ω2 и td), было построено в соответствии с законом диффузии. - Запустите программное обеспечение MATLAB 1 и выберите папку, содержащую все файлы «.txt», соответствующие как минимум четырем экспериментам с размером талии.
- График <td> против <ω2>, а именно закон диффузии. Можно извлечь два основных параметра: перехват по оси Y (t0) и эффективный коэффициент диффузии (Deff, обратно пропорционален наклону).
9. Законы диффузии сравнения различных экспериментальных условий
ПРИМЕЧАНИЕ: При необходимости воспроизведите разделы 7 и 8 для различных экспериментальных условий. Специальное программное обеспечение (программное обеспечение MATLAB 2) было разработано для определения того, сходны ли эти законы диффузии или нет в соответствии со значениями t0 и Deff 28. Он проверяет две гипотезы: два значения различны, или два значения не отличаются при пороговом значении, установленном выше вероятности ложной тревоги (PFA). Произвольное значение PFA 5% (T = 3,8) считается верхним пределом значимости между двумя параметрами (t0 или Deff), что указывает на то, что существует только 5% вероятность того, что эти два значения идентичны.
- Создайте файл ".xls", содержащий значения характеристического закона диффузии каждого условия для сравнения (т.е. файл, содержащий ошибку t0, t0 , ошибку Deff и Deff для необработанных (NT) и обработанных (COase) условий в виде таблицы).
- Запустите программное обеспечение MATLAB 2.
- Выберите файл ".xls".
- Проанализируйте сгенерированный 2D-график с цветовой кодировкой, где статистические тесты t0 и Deff должны быть построены на осях x и y соответственно (рисунок 4). Чем выше Т, тем больше разница между сравниваемыми значениями.
10. Измерение концентрации холестерина
- Лечение и лизис клеток
- Засейте клетки Cos7 в трипликат в 6-луночных пластинах при 4 × 105 клеток / лунку и инкубируйте в 2 мл полного DMEM при 37 ° C с 5% CO2 в течение ночи, чтобы позволить клеткам прикрепиться к пластине.
- Удалите питательную среду и трижды промойте клетки фосфатно-буферным физиологическим раствором (PBS).
- Добавьте 1 мл буфера HBSS/HEPES, содержащего (или нет, для контрольной группы) 1 ЕД/мл коазы, и инкубируйте в течение 1 ч при 37°C с 5% CO2.
- Заменить среду 1 мл HBSS/HEPES, содержащую 0,1 ЕД/мл коазы, и инкубировать в течение 1 ч при 37°С с 5% CO2.
- Извлеките раствор и соберите клетки.
- Промыть ячейки трижды PBS, а центрифугу при 400 × г в течение 5 мин при комнатной температуре.
- Лизируйте клетки радиоиммунопреципитационным буфером анализа (25 мМ HEPES, рН 7,4, 150 мМ NaCl, 1% NP40, 10 мМ, MgCl2, 1 мМ этилендиамина тетрауксусной кислоты, 2% глицерина, протеазы и ингибитора фосфатазы коктейля) в течение 30 мин на льду.
- Центрифугируют лизаты при 10000 × г в течение 10 мин при 4 °C и собирают супернатант.
- Количественная оценка общей концентрации белка для каждого образца путем модифицированного анализа белка Bradford с использованием рабочего раствора в соответствии с рекомендациями производителя.
- Измерение концентрации холестерина
- Для определения общего уровня клеточного холестерина ферментативно используйте соответствующий набор (например, Amplex Red Cholesterol Assay Kit) в соответствии с рекомендациями производителя.
- Для каждой реакции смешивают образец, содержащий 5 мкг белка, с реагентом Amplex Red/пероксидазой хрена/холистероксидазой/энергетическим раствором холестеринэстеразы и инкубируют в течение 30 мин при 37 °C в темноте.
- Измерьте флуоресценцию, используя возбуждение 520 нм, и обнаружите излучение на 560–590 нм с помощью считывателя микропластин.
- Вычтите фон из конечного значения, и определите концентрацию холестерина с помощью стандартной кривой.
- Рассчитайте конечное содержание холестерина в нг холестерина на мкг белка.
Результаты
Мы сгенерировали DL для Thy1-GFP, экспрессируемого в клетках Cos-7 (рисунок 4, черные квадраты). Закон диффузии имеет положительное значение t0 (19,47 мс ± 2 мс), указывающее на то, что Thy1-GFP ограничен нанодоменовыми структурами плазматической мембраны. Лечение холестериноксидазой клеток, экспрессирующих Thy1-GFP, привело к смещению значения DL t0 до 7,36 ± 1,34 мс (рисунок 4, серые квадраты). Это наблюдение подтверждает, что характер удержания Thy1-GFP зависит от содержания холестерина и связан с нанодоменами липидного плота. Показано, что эти два закона диффузии различаются в соответствии со статистическим тестом, описанным выше (см. шаг 9.1.3) в терминах значений t0 и Deff . Кроме того, мы оценили концентрацию общего клеточного холестерина в необработанных клетках Cos-7 по сравнению с клетками, обработанными COase. Небольшое, но значительное снижение содержания общего холестерина наблюдается при лечении COase (рисунок 5). Поскольку этот фермент действует только на пул холестерина, доступный на внешнем листке плазматической мембраны, мы предполагаем, что наблюдаемое снижение холестерина связано только с плазматической мембраной и приводит к дестабилизации нанодоменов липидного рафта.
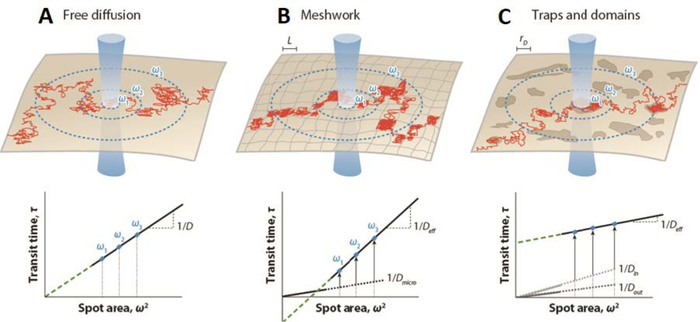
Рисунок 1: Смоделированные флуоресцентная корреляционная спектроскопия (FCS) диффузионные законы, установленные точечной вариацией FCS для различных форм мембранной организации. (Верхние панели) Схематическое изображение мембранной организации — (A) свободная диффузия, (B) сетчатые барьеры и (C) ловушки / доменные ограничения — с траекторией, нарисованной для одной молекулы (красный). Синие круги обозначают пересечение мембраны и лазерного луча талии ω. (Нижние панели) Законы диффузии FCS представлены построением времени диффузии td как функции квадратного радиуса ω2. Проекция закона диффузии (зеленая пунктирная линия) перехватывает ось времени при (A) начале координат (t0 = 0) в случае свободной диффузии; (B) в отрицательной оси (t0 < 0), когда имеются сетчатые барьеры, или (C) в положительной оси (t0 > 0), когда имеются ловушки и домены (липидные плоты). D — коэффициент боковой диффузии для броуновского движения; Deff, эффективный коэффициент диффузии; Dmicro, микроскопический коэффициент диффузии внутри сетчатых ловушек; Din, коэффициент диффузии внутри доменов; Dout, коэффициент диффузии вне доменов; L, размер стороны квадратного домена; и rD — радиус круговой области. Этот рисунок был изменен с He и Marguet6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Схематическое представление аппаратного управления svFCS. Компьютер управляет всеми устройствами через различные протоколы связи: последовательный (микроскоп, внешний затвор), USB (пьезоэлектрический каскад XYZ, коррелятор) и PCI (плата сбора). DAQ: плата сбора данных, APD: лавинный фотодиод, SPCM: однофотонный модуль подсчета, DO: цифровой выход. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
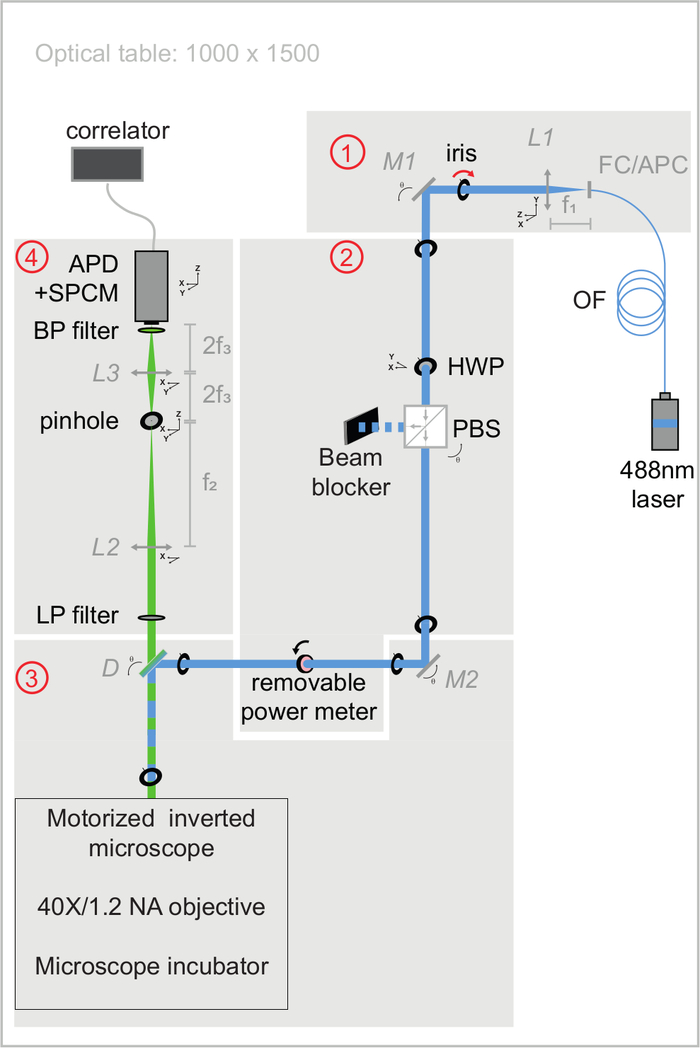
Рисунок 3: Схематическое представление оптических путей возбуждения и излучения установки svFCS. Установка svFCS содержит четыре модуля: (1) выход волоконного лазера 488 нм коллимирован, (2) комбинация полуволновой пластины и поляризационного луча-разветвителя задает оптическую мощность, (3) лазерный луч, сфокусированный на образце после прохождения через безпанланзионный моторизованный микроскоп, и (4) флуоресценция обнаруживается через конфокальный путь обнаружения на лавинном фотодиоде, соединенном с одним модулем подсчета фотонов, который подает сигнал на аппаратный коррелятор. Простота придает системе чувствительность, надежность и простоту использования (широко комментируется в дополнительном материале). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
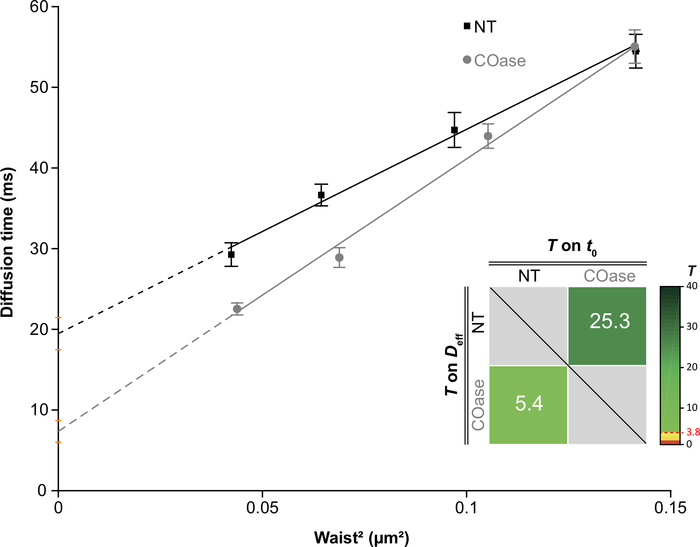
Рисунок 4: Законы диффузии svFCS, полученные в результате диффузионного анализа Thy1-GFP, выраженного в Cos-7. Законы диффузии svFCS клеток Cos-7 без лечения (NT, черные квадраты) и после лечения холестериноксидазой (COase, серые круги). Вставка на графике представляет собой статистическое тестирование существенной разницы между двумя представленными законами диффузии svFCS (согласно Mailfert et al.28). Испытательное значение (T) должно быть выше порогового значения, установленного на уровне 3,8, когда оба закона диффузии различны. Чем она выше, тем больше разница между законами диффузии. Значение T имеет цветовую кодировку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
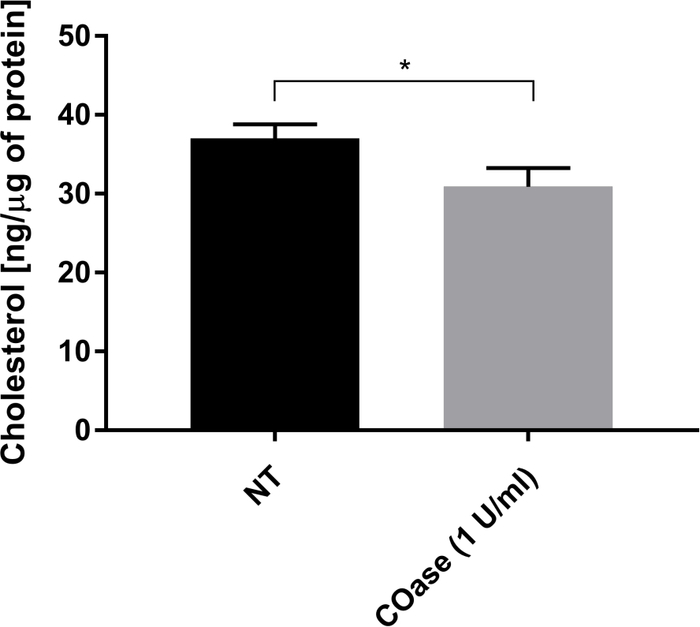
Рисунок 5: Сравнение содержания общего холестерина в клетках Cos-7. Клетки Cos-7 либо не обрабатывали (NT), либо обрабатывали 1 Ед/мл холестериноксидазы (COase) в течение 1 ч. Данные представляют собой пример одного эксперимента в трех экземплярах. Для оценки статистической разницы использовался двуххвостый непарный T-тест (α=0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица материалов: Список оптических элементов, необходимых для установки svFCS.
Дополнительные материалы: В этом документе описывается построение установки svFCS с нуля. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь мы описали реализацию модуля svFCS на стандартном флуоресцентном микроскопе, мощного экспериментального подхода к расшифровке динамики организации плазматической мембраны в живых клетках благодаря анализу закона диффузии FCS. Концептуально svFCS основан на простом принципе: корреляционные измерения флуоресценции во временной области при изменении размера областиосвещения 23. Эта стратегия сыграла важную роль в выведении наноскопической информации из микроскопических измерений, которая помогает расшифровать основные физико-химические элементы, способствующие организации плазматической мембраны в устойчивом состоянии25 и физиологических процессах 30,31,32,33. В целом, эти анализы svFCS однозначно демонстрируют существование липид-зависимых нанодоменов в различных типах клеток и их прямое влияние на настройку различных сигнальных событий.
В этих рамках существуют некоторые оптические аспекты, которые необходимо учитывать при построении установки svFCS для оптимизации бюджета фотонов и минимизации оптических аберраций. Таким образом, мы рекомендуем использовать микроскоп, из которого можно снять линзу трубки при измерении svFCS. Кроме того, одна радужка играет ключевую роль в настройке svFCS: она изменяет размер луча в задней диафрагме объектива, тем самым напрямую изменяя эффективный размер талии (т.е. эффективный объем возбуждения). Диаметр луча должен соответствовать объективному заднему зрачку, чтобы получить наименьший размер талии34. Этот вариант, который помогает настроить размер талии, обеспечивает оптимизацию бюджета фотонов и прост в реализации. Наконец, вдоль светового пути используется минимальное количество оптических частей; чем менее сложна система, тем меньше фотонов теряется. Все эти опции значительно повышают надежность экспериментов svFCS.
Что касается самого протокола, то необходимо рассмотреть несколько важных шагов. Наиболее важным является соответствующее выравнивание оптических путей, что имеет решающее значение для успешных измерений svFCS (протокол, раздел 2). Это легко проверить, проанализировав флуоресцентный сигнал от раствора Rh6G 2 нМ, который должен быть ~ 200 кГц при лазерной подсветке 300 мкВт. Все радужные оболочки должны быть открыты, а ACF должны иметь важную амплитуду (обычно G0 ~ 1,5-2,0). Еще один критический момент касается клеток и их подготовки к анализу svFCS (протокол, разделы 4–8). Их плотность должна быть адаптирована таким образом, чтобы изолированные клетки, подлежащие наблюдению, были доступны для анализа. Неадгезивные клетки должны быть иммобилизованы на камерном покровном стекле с использованием раствора поли-L-лизина. Флуоресцентный сигнал от маркировки клеток не должен быть слишком сильным, иначе это приведет к очень плоским ACF, которые трудно подходят, а параметры посадки обременены важной ошибкой. Кроме того, неоднородная маркировка и флуоресцентные агрегаты в клетках чрезвычайно затрудняют интерпретацию измерений svFCS. Наконец, лечение холестериноксидазой влияет на жизнеспособность клеток, и анализ svFCS не должен превышать одного часа после лечения. Также лучше регистрировать флуоресцентные флуктуации от верхней плазматической мембраны, так как она не прикреплена к опоре, и нет риска затрудненной диффузии молекул из-за физических взаимодействий с опорой.
В технике svFCS было достигнуто достаточно достижений для ее использования в различных подходах благодаря разнообразию модальностей для корректировки объема обнаружения, что позволяет изучать различные биологические процессы в живых клетках. Альтернативой регулировке размера объема возбуждения является использование расширителяпеременного пучка 35. Также можно просто модулировать размер области освещения путем записи флуоресцентного сигнала от перехвата плазматической мембраны вдоль направленияz 36. Это может быть сделано на стандартном конфокальном микроскопе, для которого была разработана теоретическая основа для получения закона диффузии37,38.
Хотя метод svFCS предлагает пространственно-временное разрешение, которое необходимо для характеристики неоднородной боковой организации плазматической мембраны, геометрические режимы удержания не являются взаимоисключающими. Отклонение t0 в ту или иную сторону обнаруживает исключительно доминирующий способ удержания25. Более того, еще одно важное ограничение настоящего метода svFCS вытекает из классического предела оптической дифракции (~200 нм). Это, несомненно, больше, чем домены, ограничивающие молекулы внутри клеточной плазматической мембраны. Поэтому анализ удержания выводится из значения t0 , экстраполированного из закона диффузии.
Этот недостаток был преодолен путем внедрения альтернативных методов. Первоначально использование металлических пленок, просверленных наноапертурами, предлагало возможность освещения очень малой площади мембраны (т.е. ниже предела оптической дифракции одиночных нанометрических апертур радиусов, варьирующихся между 75 и 250 нм)39. Таким образом, сообщалось о переходном режиме, предсказанном на основе теоретического закона диффузии для организации изолированных доменов, и это позволило уточнить характерный размер гетерогенностей нанометрической мембраны и количественную оценку площади поверхности, занимаемой липид-зависимыми нанодоменами39. Альтернативно, нанометрическое освещение также было разработано с использованием сканирующей оптической микроскопииближнего поля 40 или планарной оптической наноантенны41. Совсем недавно сочетание стимулированного истощения выбросов (STED) и FCS обеспечило мощный и чувствительный инструмент для документирования закона диффузии с очень высоким пространственным разрешением. Этот STED-FCS дает доступ к характеристикам молекулярной диффузии на наноуровне, происходящей в течение короткого периода времени, что позволяет изучать динамическую организацию липидных зондов на плазматической мембране42,43. Однако неполное подавление флуоресценции в процессе STED ставит под сомнение анализ кривых автокорреляции в FCS.
Для преодоления этой трудности была разработана новая модель подгонки, повышающая точность измерений времени диффузии и средних чисел молекул44. Наконец, для медленной молекулярной диффузии на плазматической мембране принцип svFCS может быть применен к данным, записанным с помощью спектроскопии корреляции изображений45. Недавно было продемонстрировано, что сочетание атомно-силовой микроскопии (АСМ) с визуализацией полного внутреннего отражения-FCS (ITIR-FCS) способствует уточнению природы механизма, препятствующего молекулярной диффузии на плазматической мембране, особенно вблизи конфигурации мембраны порога перколяции из-за высокой плотности нанодоменов46.
В заключение, установление закона диффузии с помощью svFCS предоставило экспериментальные доказательства для вывода локальной гетерогенности, созданной динамическими коллективными ассоциациями липидов и мембранных белков. Как заявили Воланд и его коллеги46, «анализ диффузионного права FCS остается ценным инструментом для вывода структурных и организационных особенностей ниже предела разрешения из динамической информации». Тем не менее, нам необходимо разработать новые модели для уточнения интерпретации закона диффузии, которые должны позволить лучше понять динамику молекулярных событий, происходящих на плазматической мембране.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
SB, SM и DM были поддержаны институциональным финансированием cnRS, Inserm и Университета Экс-Марселя и программными грантами Французского национального исследовательского агентства (ANR-17-CE15-0032-01 и ANR-18-CE15-0021-02) и французским «Investissement d'Avenir» (ANR-10-INBS-04 France-BioImaging, ANR-11-LABX-054 labex INFORM). KW признает «BioTechNan», программу междисциплинарных экологических докторских исследований KNOW в области биотехнологии и нанотехнологий. EB признает финансовую поддержку Национального научного центра Польши (NCN) в рамках проекта No 2016/21/D/NZ1/00285, а также правительства Франции и посольства Франции в Польше. MŁ признает финансовую поддержку со стороны Министерства развития Польши (CBR POIR.02.01.00-00-0159/15-00/19) и Национального центра исследований и разработок (Innochem POIR.01.02.00-00-0064/17). TT признает финансовую поддержку со стороны Национального научного центра Польши (NCN) в рамках проекта No 2016/21/B/NZ3/00343 и Вроцлавского биотехнологического центра (KNOW).
Материалы
| Name | Company | Catalog Number | Comments |
| Aligment tool | Spanner Wrench for SM1-Threaded Retaining Rings | Thorlabs | SPW602 |
| Avalanche Photodiode and Single Photon Counting Module (SPCM) | Single-Photon Counting Module, Avalanche Photodiode | Excelitas | SPCM-AQRH-15 |
| BNC 50 Ω plug to 50 Ω plug lead 2 m | RS Components | 742-4315 | |
| Coaxial cable 415 Cinch Connectors, RG-316, 50 Ω With connector, 1.22 m, RoHS2 | RS Components | 885-8172 | |
| Tee 50Ω RF Adapter BNC Plug to BNC Socket 0 → 1GHz | RS Components | 546-4948 | |
| Brennenstuhl 2.5 m, 8 Socket Type E – French Extension Lead, 230 V | RS Components | 768-5500 | |
| Mascot, 6W Plug In Power Supply 5V dc, 1.2A, 1 Output Switched Mode Power Supply, Type C | RS Components | 452-8394 | |
| Crystek CCSMACL-MC-24 Reference Oscillator Power Cable RF Adapter | RS Components | 792-4079 | |
| Fluorescence filtering | 535/70 ET Bandpass, AOI 0° Chroma Diameter 25 mm | AHF filter | F47-539 |
| Laser Beamsplitter zt488 RDC, AOI 45° Chroma 25.5 x 36 x 1 mm | AHF filter | F43-088 | |
| 496/LP BrightLine HC Longpass Filter, AOI 0° Chroma Diameter 25 | AHF filter | F37-496 | |
| Hardware correlator | 80 MHz Digital Correlator | Correlator.com | Flex02-12D |
| Laser | LASER LASOS LDM-XT fiber coupled, 488 nm, 65 mW | Lasos | BLD-XT 488100 |
| Laser safety | High-Performance Black Masking Tape, 1" x 180' (25 mm x 55 m) Roll | Thorlabs | T743-2.0 |
| Lens Tissues, 25 Sheets per Booklet, 5 Booklets | Thorlabs | MC-5 | |
| Laser Safety Glasses, Light Orange Lenses, 48% Visible Light Transmission | Thorlabs | LG3B | |
| Microscope | Zeiss Axiovert 200M Motorized Inverted Fluorescence Microscope Fine and coarse focusing, reflector turret rotation, objective nosepiece rotation, switching camera ports, and internal light shutters | Carl Zeiss | |
| C-Apochromat 40x/1,2 W Korr.selected for FCS (D=0.14-0.19 mm) (WD=0.28 mm at D=0.17 mm), UV-VIS-IR | Carl Zeiss | 421767-9971-711 | |
| Adapter W0.8 / M27x0.75 H "5" | Carl Zeiss | 000000-1698-345 | |
| Middle ring W0.8 - W0.8 H "5" | Carl Zeiss | 000000-1698-347 | |
| Optical path | D25.4mm Mirror, Protected Silver | Thorlabs | PF10-03-P01 |
| D25.4mm, F=60.0.mm, Visible Achromat | Thorlabs | AC254-060-A | |
| D25.4mm, F=35.0.mm, Visible Achromat | Thorlabs | AC254-035-A | |
| 25 µm mounted pinhole | Thorlabs | P25S I | |
| 25.4mm Mounted Zero, Order 1/2 Waveplate 488 nm | Thorlabs | WPH10M-488 (HWP) | |
| 20mm Polarizing Beamsplitter Cube 420-680 nm | Thorlabs | PBS201 | |
| Rotation Stage 56 mm x 26 mm Threaded ID | Thorlabs | RSP1/M | |
| 52 mm x 52 mm Kinematic Platform Mount | Thorlabs | KM100B/M | |
| Adjustable Prism Clamp | Thorlabs | PM3/M | |
| Beam block - active area 19 mm x 38 mm | Thorlabs | LB1/M | |
| Iris Diaphragm 1 mm to 25 mm Aperture | Thorlabs | ID25/M | |
| Left-Handed Kinematic Cylindrical Lens Mount | Thorlabs | KM100CL | |
| 1" Optic Holder, M4 Tap | Thorlabs | MFF101/M | |
| 1" Stackable Lens Tube | Thorlabs | SM1L03 | |
| Stackable Lens Mount for 1" optic-usable depth ½ | Thorlabs | SM1L05 | |
| Stackable Lens Mount For 1"Optic-usable Depth 2" | Thorlabs | SM1L20 | |
| Small Optical Rails 600mm, metric | Thorlabs | RLA600/M | |
| Small Optical Rails 75mm, metric | Thorlabs | RLA075/M | |
| Small Optical Rails 150mm, metric | Thorlabs | RLA150/M | |
| Rail Carrier, Counterbored Hole 1"x 1" | Thorlabs | RC1 | |
| Rail Carrier, Perpendicular Dovetail | Thorlabs | RC3 | |
| High Precision Translating Lens Mount for 1 inch | Thorlabs | LM1XY/M | |
| ½ " (12mm) Dovetail Translation Stage | Thorlabs | DT12/M | |
| Rail Clamps | Thorlabs | CL6 | |
| Metric XYZ Translation Stage (Includes PT102) | Thorlabs | PT3/M | |
| Black Rubberized Fabric | Thorlabs | BK5 | |
| Ball Driver kit/ 6 tools | Thorlabs | BD-KIT/M | |
| Adapter with External M6 x 1.0 Threads and External M4 x 0.7 Threads | Thorlabs | AP6M4M | |
| Mounting Base, 25 mm x 58 mm x 10 mm, 5 Pack | Thorlabs | BA1S/M-P5 | |
| Lens Mount for 25.4mm optic | Thorlabs | LMR1/M | |
| SM1 FC/APC Adapter | Thorlabs | SM1FCA | |
| Kinematic Mirror Mount For 1 inch Optics | Thorlabs | KM100 | |
| Silicon Power Head, 400-1100nm, 50mW | Thorlabs | S120C | |
| 12.7 mm Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L=50 mm, 5 Pack | Thorlabs | PH50/M-P5 | |
| Post Holder with Spring-Loaded Hex-Locking Thumbscrew, L=20 mm | Thorlabs | PH20/M | |
| 12.7 mm x 50 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR50/M-P5 | |
| 12.7 mm x 75 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR75/M-P5 | |
| USB Power and Energy Meter Interface | Thorlabs | PM100USB | |
| 12.7 mm x 30 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR30/M | |
| 12.7 mm x 20 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR20/M | |
| 750 mm long Structural Rail (detection box) | Thorlabs | XE25L750/M | |
| 350 mm long Structural Rail (detection box) | Thorlabs | XE25L350/M | |
| Quick Corner Cube for 25 mm Rails | Thorlabs | XE25W3 | |
| Right-Angle Bracket for 25 mm Rails | Thorlabs | XE25A90 | |
| Black posterboard 20" x 30" (508 mm x 762 mm), 1/16" (1.6 mm) Thick, 5 Sheets | Thorlabs | TB5 | |
| Hinge for 25 mm Rail Enclosures | Thorlabs | XE25H | |
| Lid Stop for 25 mm Rail Enclosures | Thorlabs | XE25LS | |
| M4 Cap Screw Kit | Thorlabs | HW-KIT1/M | |
| M6 Cap Screw Kit and Hardware kit | Thorlabs | HW-KIT2/M | |
| Table Clamp, L-Shape, 5 Pack | Thorlabs | CL5-P5 | |
| SM1 Ring-Actuated Iris Diaphragm (Ø0.8 - Ø12 mm) | Thorlabs | SM1D12D | |
| Ø1" SM1-Mounted Frosted Glass Alignment Disk w/Ø1 mm Hole | Thorlabs | DG10-1500-H1-MD | |
| Honeycomb Optical Table Top, Standa | Standa | 1HB10-15-12 | |
| Optical Table support, Standa | Standa | 1TS05-12-06-AR | |
| Sample nano-positionning | Precision XYZ Nanopositioning | Physik Instrumente | PI P527-3.CD |
| Digital Multi-Channel Piezo Co, 3 Channels, -30 to 130 V Sub- D Connector(s), Capacitive Sensors, | Physik Instrumente | PI E727-3.CD | |
| Temperature chamber | Zeiss 200M Inverted Microscope Incubator System MATT BLK | Digital Pixel | |
| Dual Channel Microprocessor Temperature Controller | Digital Pixel | DP_MTC_2000_DUO | |
| Two Vibration Free Heater Modules | Digital Pixel | DP_150_VF | |
| PT100 Temperature Sensor | Digital Pixel | DP_P100_TS | |
| Biological Reagents and Materials | |||
| Cell culture and transfection | Cos7 cells | ATCC® | CRL-1651™ |
| 8- well Lab-Tek chambers | Thermo Fisher Scientific | 155411PK | |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 11965092 | |
| Fetal bovine serum | Thermo Fisher Scientific | 16000044 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| PBS buffer | Thermo Fisher Scientific | 14190144 | |
| PenStrep | Thermo Fisher Scientific | 15140122 | |
| PolyJet Transfection Reagent | SignaGen Laboratories | SL100688 | |
| Cholesterol content measurement | Amplex Red Cholesterol Assay Kit | Thermo Fisher Scientific | A12216 |
| Protease Inhibitor Cocktail | Thermo Fisher Scientific | 87786 | |
| Phosphatase Inhibitor Cocktail | Thermo Fisher Scientific | 78420 | |
| ROTI Nanoquant Working Solution | Roth | K880 | |
| GloMax Discover Microplate Reader | Promega | GM3000 | |
| svFCS measurements | HBSS buffer | Thermo Fisher Scientific | 14025092 |
| Hepes buffer | Thermo Fisher Scientific | 15630080 | |
| Cholesterol oxidase | Sigma-Aldrich | C8868 | |
| Rhodamine 6G | Sigma-Aldrich | 83697-1G |
Ссылки
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Newton, A. C. Regulation of the ABC kinases by phosphorylation: protein kinase C as a paradigm. The Biochemical Journal. 370, Pt 2 361-371 (2003).
- Marguet, D., Lenne, P. F., Rigneault, H., He, H. T. Dynamics in the plasma membrane: how to combine fluidity and order. The EMBO Journal. 25 (15), 3446-3457 (2006).
- Edidin, M. The state of lipid rafts: From model membranes to cells. Annual Review of Biophysics and Biomolecular Structure. , (2003).
- Lingwood, D., Simons, K. Lipid rafts as a membrane-organizing principle. Science. , (2010).
- He, H. T., Marguet, D. Detecting nanodomains in living cell membrane by fluorescence correlation spectroscopy. Annual Reviews of Physical Chemistry. 62, 417-436 (2011).
- Rossy, J., Ma, Y., Gaus, K. The organisation of the cell membrane: Do proteins rule lipids. Current Opinion in Chemical Biology. 20 (1), 54-59 (2014).
- Nicolson, G. L. The Fluid - Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et Biophysica Acta - Biomembranes. 1838 (6), 1451-1466 (2014).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1081 (2002).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34, 351-378 (2005).
- Destainville, N., Salomé, L. Quantification and correction of systematic errors due to detector time-averaging in single-molecule tracking experiments. Biophysical Journal. 90 (2), 17-19 (2006).
- Wieser, S., Moertelmaier, M., Fuertbauer, E., Stockinger, H., Schütz, G. J. Un)confined diffusion of CD59 in the plasma membrane determined by high-resolution single molecule microscopy. Biophysical Journal. 92 (10), 3719-3728 (2007).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. , (1976).
- Petrášek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. , (2008).
- Elson, E. L. 40 Years of FCS: How it all began. Methods in Enzymology. , (2013).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. , (1974).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. , (1974).
- Schwille, P., Haupts, U., Maiti, S., Webb, W. W. Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two-photon excitation. Biophysical Journal. , (1999).
- Bouchaud, J. P., Georges, A. Anomalous diffusion in disordered media: Statistical mechanisms, models and physical applications. Physics Reports. , (1990).
- Yechiel, E., Edidin, M. Micrometer-scale domains in fibroblast plasma membranes. Journal of Cell Biology. 105 (2), 755-760 (1987).
- Salomé, L., Cazeils, J. L., Lopez, A., Tocanne, J. F. Characterization of membrane domains by FRAP experiments at variable observation areas. European Biophysics Journal. 27 (4), 391-402 (1998).
- Niv, H., Gutman, O., Kloog, Y., Henis, Y. I. Activated K-Ras and H-Ras display different interactions with saturable nonraft sites at the surface of live cells. The Journal of Cell Biology. 157 (5), 865-872 (2002).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophysical Journal. 89 (6), 4029-4042 (2005).
- Saxton, M. J. Fluorescence corralation spectroscopy. Biophysical Journal. , (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO Journal. 25 (14), 3245-3256 (2006).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. , (2015).
- Billaudeau, C., et al. Probing the plasma membrane organization in living cells by spot variation fluorescence correlation spectroscopy. Methods in Enzymology. 519, 277-302 (2013).
- Mailfert, S., Hamon, Y., Bertaux, N., He, H. T., Marguet, D. A user's guide for characterizing plasma membrane subdomains in living cells by spot variation fluorescence correlation spectroscopy. Methods in Cell Biology. 139, 1-22 (2017).
- Rege, T. A., Hagood, J. S. Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses. Biochimica et Biophysica Acta - Molecular Cell Research. , (2006).
- Cahuzac, N., et al. Fas ligand is localized to membrane rafts, where it displays increased cell death-inducing activity. Blood. , (2006).
- Guia, S., et al. Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance. Science Signaling. 4 (167), 21(2011).
- Blouin, C. M., et al. Glycosylation-dependent IFN-γR partitioning in lipid and actin nanodomains is critical for JAK activation. Cell. 166 (4), 920-934 (2016).
- Chouaki-Benmansour, N., et al. Phosphoinositides regulate the TCR/CD3 complex membrane dynamics and activation. Scientific Reports. , (2018).
- Wawrezinieck, L., Lenne, P. F., Marguet, D., Rigneault, H. Fluorescence correlation spectroscopy to determine diffusion laws: application to live cell membranes. Biophotonics Micro- and Nano-Imaging. , (2004).
- Masuda, A., Ushida, K., Okamoto, T. New fluorescence correlation spectroscopy enabling direct observation of spatiotemporal dependence of diffusion constants as an evidence of anomalous transport in extracellular matrices. Biophysical Journal. , (2005).
- Humpolíčková, J., et al. Probing diffusion laws within cellular membranes by Z-scan fluorescence correlation spectroscopy. Biophysical Journal. , (2006).
- Benda, A., et al. How to determine diffusion coefficients in planar phospholipid systems by confocal fluorescence correlation spectroscopy. Langmuir. , (2003).
- Ganguly, S., Chattopadhyay, A. Cholesterol depletion mimics the effect of cytoskeletal destabilization on membrane dynamics of the serotonin1A receptor: A zFCS study. Biophysical Journal. , (2010).
- Wenger, J., et al. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization. Biophysical Journal. 92 (3), 913-919 (2007).
- Manzo, C., Van Zanten, T. S., Garcia-Parajo, M. F. Nanoscale fluorescence correlation spectroscopy on intact living cell membranes with NSOM probes. Biophysical Journal. , (2011).
- Regmi, R., et al. Planar optical nanoantennas resolve cholesterol-dependent nanoscale heterogeneities in the plasma membrane of living cells. Nano Letters. , (2017).
- Mueller, V., et al. FCS in STED microscopy: Studying the nanoscale of lipid membrane dynamics. Methods in Enzymology. , (2013).
- Sezgin, E., et al. Measuring nanoscale diffusion dynamics in cellular membranes with super-resolution STED-FCS. Nature Protocols. , (2019).
- Wang, R., et al. A straightforward STED-background corrected fitting model for unbiased STED-FCS analyses. Methods. , (2018).
- Veerapathiran, S., Wohland, T. The imaging FCS diffusion law in the presence of multiple diffusive modes. Methods. , (2018).
- Gupta, A., Phang, I. Y., Wohland, T. To hop or not to hop: exceptions in the FCS diffusion law. Biophysical Journal. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены