Method Article
维持静止人类造血干细胞的文化方法
摘要
该协议通过使用丰富的脂肪酸、胆固醇、低浓度的细胞因子和缺氧来模拟骨髓微环境,使静默的人类造血干细胞在体外得以维持。
摘要
人类造血干细胞(HSCs)与其他哺乳动物HSC一样,在骨髓中维持终身造血。HSC在体内保持静默,不像更分化的祖细胞,在化疗或辐照后快速进入细胞周期,以治疗骨髓损伤或体外培养。通过在富脂肪酸、胆固醇、细胞因子浓度低和缺氧的情况下模拟骨髓微环境,人类HSC在体外保持静默。在这里,描述了在体外静默状态下维护功能 HSC 的详细协议。这种方法将使研究人类HSC在生理条件下的行为。
引言
造血干细胞(HSCs)和多能祖细胞(MPPs)协调地形成一个储层,用于持续补充分化细胞,以维持造血在人类的一生。细胞循环静止是HSC的一个突出特征,区别于MPP2。传统上,HSC被认为位于造血系统等级的顶点,产生所有分化的血细胞。这种分层模型主要是从移植实验3中推断出的。然而,最近的研究表明,与移植实验4、5、6、7相比,HSC的动态在体内有所不同。使用多个条形码系统的血统追踪实验表明,表型粘膜HSC不是一种独特的细胞类型,有助于稳定状态造血,而MPP在移植设置时自我更新活动有限,不断提供成熟的血细胞4、5、8。相比之下,HSC对成熟细胞的贡献在骨髓损伤4后得到增强。这可能是由于骨髓消融后微环境发生剧烈变化,包括骨髓移植。虽然将粘膜细胞的血统追踪应用于人类细胞是很困难的,但结合单细胞衍生菌落分离和全基因组测序相结合的植物学分析揭示了造血系统的类似特性,其中HSC和MPP都负责成熟细胞7的日常生产。因此,虽然移植对于检查穆林或人类HSC活动至关重要,但还需要其他实验模型来了解HSC在生理条件下的行为。
已详细研究HSC的培养方法,以了解其临床应用和特征。人类HSC可以在体外扩大使用细胞因子的组合,重组细胞外矩阵,去除自我更新拮抗剂,与中性细胞或内皮细胞共同培养,添加白蛋白或其替代品,自我更新转录因子的转导,以及添加小分子化合物9,10。其中一些方法,包括添加小化合物SR111和UM17112,已在临床试验中测试,有希望的结果9。考虑到 HSC 在体内的静默性质,保持 HSC 以最小的细胞循环是重新概括体外 HSC 行为的关键。静止和增殖的HSC表现出微分细胞周期条目13,代谢状态14,和耐受多重应力15。用于维持人类体外HSC静默的方法是有限的。
通过模仿骨髓的微环境(低氧和富含脂质)和优化细胞因子的浓度,可以在培养下保持人类HSC的无差别和静止。在体外回顾HSC的静默性质,将增进对HSC稳定状态特性的理解,并实现HSC的实验操作。
研究方案
该协议遵循国家全球健康和医学中心的指导方针。所有在小鼠身上进行的实验程序均由国家全球健康与医学中心动物实验委员会批准。
注:协议概述在 图1中说明。
1. 脂质准备
- 在指定浓度的玻璃管中溶解甲醇中的以下脂质:棕榈酸钠,16毫克/毫升:油酸钠,30毫克/百升;和胆固醇,4毫克/升。将脂质溶液储存在-30°C,并在使用前解冻样品。
- 将步骤 1.1 中准备的脂质溶液混合在新鲜玻璃管中,以获得最终浓度为 100μg/mL 棕榈酸盐、100μg/mL 油酸盐和 20μg/mL 胆固醇所需的剂量。例如,在准备 10 毫升培养介质时,在玻璃管中混合 62.5 μL 的棕榈酸盐溶液、33 μL 的油酸盐溶液和 50 μL 的胆固醇溶液。
- 通过脂质溶液(图2A和2B)通过氮气蒸发甲醇。如果没有氮气,则使用移液器辅助器将空气通过溶液传递。
- 通过在37°C(图2C)的水浴中加热玻璃管,完全蒸发剩余的甲醇。
注:在狭小空间内使用高浓度的N2 气体是潜在的有害。虽然协议中用于蒸发甲醇的体积有限,因此被认为是安全的,但充分通风房间和标记可能高浓度的 N2 气体区域非常重要,如果发生意外的气体泄漏。
2. 中等准备
- 准备杜尔贝科的改良鹰介质 (DMEM) / F12 介质 (与 HEPES 和谷氨酰胺).将青霉素和硫酸链霉素添加到介质中,最终浓度分别为 50 单位和 50 微克/mL。含有抗生素的 DMEM/F12 介质可在 4 °C 下储存至少 2 个月。
- 添加 4% w/v 牛血清白蛋白 (BSA) 到杜尔贝科的修改鹰介质 (DMEM) / F12 介质 (与 HEPES 和谷氨酰胺).
- 使用 NaOH 解决方案将介质的 pH 调整为 pH 7.4-7.8,通常调整为 pH 7.6。
- 将介质添加到步骤 1 中准备的玻璃管中。为了实现最大溶解度的解决方案,建议添加 3-15 mL 介质。
- 通过声波完全溶解脂质(最佳:超过20分钟的声波化)。BSA 和脂质溶解后,样品应储存在 -80 °C,并在 2 个月内使用。使用前立即解冻。
- 在 DMEM/F12 中加入 1/1,000 的胰岛素、转移林、塞莱尼特钠和乙醇胺 (ITS-X) 混合物。使用 0.22μm 滤镜(指定为"文化介质")过滤混合介质。在使用之前,在培养介质中加入人体干细胞因子(SCF)和人类血栓素(TPO),最终浓度为3 ng/mL。添加细胞因子和 ITS-X 后,介质无法存储。
- 染色缓冲:将 10% FCS 添加到无磷酸盐缓冲盐水 (PBS) 中。此解决方案可在 4 °C 下存储 2 周。
- 解冻介质:在 DMEM/F12 中添加 10% 的 FCS。此解决方案是一次性使用的。
- 细胞因子库存解决方案:在 20μg/mL 下溶解 PBS 中的每个人 SCF 或人类 TPO( Ca- 和 Mg 免费)。此解决方案可存储在 -80 °C 至少一年,而不会丢失活动。解冻后,将库存解决方案存储在 4 °C,并在 1 个月内使用。
注意:每次购买后检查批次,以避免 BSA 中的污染物发生变化。文化 HSC 同时与不同批次的 BSA 和检查表型 HSC 编号在第 7 天如下所述。如果 BSA 批次显示 CD34+ 单元的低数量或频率(例如,输入单元数量少于输入单元数的一半),则避免使用此批次。
3. 人类骨髓CD34+细胞的制备
- 购买人体CD34+ 骨髓细胞,并将细胞储存在液氮中,直到使用。或者,健康志愿者或新鲜脐带血细胞中的骨髓细胞经研究所伦理委员会批准和捐赠者同意后,可使用。
- 在 37 °C 水浴中,在 15 mL 圆锥管中加热 10 mL 解冻介质。
- 在 2 分钟内在 37 °C 水浴中解冻小瓶中的冷冻细胞。用70%乙醇擦拭小瓶以去除污染物后,将细胞转移到含有预热介质的15mL圆锥管中,从步骤3.2开始。
- 在室温下,以200× 克 的速度将15mL管离心15分钟。小心吸气超细剂,以保持颗粒完好无损(留下< 50μL 的介质)。用剩余的介质补充细胞,并将它们转移到冰上1.5 mL管。
注:直接接触粘膜中的人类衍生样本,包括眼睛或受伤的组织,可能导致已知或未知病原体感染:因此,在处理人体细胞时建议使用手套和眼镜。即使购买的CD34+ 细胞检测为乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和人类免疫缺陷病毒1(HIV1)阴性,如果发生接触发生,也应按照机构指南进行仔细监测。在处理暴露于人体细胞的材料时,遵循机构准则。
4. 对 HSC 进行排序
- 用荧光糖结合抗体标记细胞。混合 50 μL 的染色缓冲器加上 10 μL 的防 CD34-FITC、2μL 的反 CD38-PerCP-Cy5.5、5μL 的反 CD90-PE-Cy7 和 10 μL 的反 CD45RA-PE。在抗体混合物中补充细胞颗粒。在黑暗中以4°C孵育细胞30分钟。
- 添加1mL的染色缓冲器来清洗抗体。在 340 × g 下将管子离心 5 分钟,在 4 °C 下。 丢弃超自然人。
- 将细胞颗粒重新喷入 0.5 mL 的染色缓冲 + 0.1% 碘化物丙酸丙酸。使用 40μm 过滤器将悬架转移到 5 mL 管中。
- 在 PI - CD34 + CD38-CD90+CD45RA中门表型 HSC-使用 FACS Aria-IIIu 的分数,并将细胞分类为 1.5 mL 管,内充满 500 μL 的文化介质(图 3)。使用图3中显示的门控策略,CD34+细胞的±10%预计将是表型HSC。 记录排序的细胞编号,以计算介质的体积,以在第5.3步中恢复细胞。
注:门控策略按照先前16 个描述执行,同时省略了血统标记染色,因为CD34+CD38-健康个体17 中的血统标记表达较低。 - 在 340 × g 下将分拣的细胞分化 5 分钟,在 4 °C 下,然后丢弃超自然体。小心吸气超细剂,确保颗粒完好无损。
- 将分拣的细胞储存在冰上,直到培养。
注:在第一个实验中应执行光谱重叠的荧光补偿。
5. 细胞培养
- 将包含细胞因子的文化介质的 200 μL 转移到平底 96 井板中。
- 为避免介质蒸发,请向所有未使用的油井加满 100-200 μL 的 PBS。
- 在培养介质中恢复分类的 HSC,在 60 个细胞/μL 中不使用细胞因子。
- 将 600 个 HSC/井(10 μL 的细胞悬浮液)放入每个井中。可以更改单元格编号。少于300个细胞将导致更大的技术变异,因此每个条件需要更多的井来检测生物差异。由于细胞因子/营养物质的剥夺或不利细胞因子/化疗素的积累,应避免在一口井中培养超过1000个细胞。
- 在 5% 的 CO 2 和 1%O 2大气中,在 37 °C 的潮湿多气体孵化器中培养细胞。
- 对于超过 7 天的文化,建议每 3-4 天更换一半的媒体量。通过管道小心吸气 100 μL 的介质,并在每个井中加入 100 μL 的新制备含有细胞因子的文化介质。文化媒体应在 37 °C 预热。
6. 使用流动细胞学对标记表型进行分析
注:虽然细胞应在7天的培养后进行分析,但培养持续时间可以更改。
- 使用 8 通道移液器丢弃介质的 170 μL。
- 用抗体混合物标记细胞。混合 0.5μL 的抗 CD34-FITC、0.1μL 的抗 CD38-PerCP-Cy5.5、0.25 μL 的反 CD90-PE-Cy7、0.5μL 的防 CD45RA-PE 和 9μL 的染色缓冲器。将混合物的 10μL 添加到 96 井板中,并在黑暗中 4 °C 时孵育细胞 30 分钟。
- 要清洗抗体,请在井中加入 100 μL 的染色缓冲液,并在 4°C 时以 400 × g 的速度将板子离心 5 分钟,使用低加速和中速减速。
- 小心吸气100微L的超自然分子,以保持井底的细胞,然后在200μL的染色缓冲+0.1%v/v的PI+1%v/v荧光微层(例如,流检查荧光层)中恢复细胞。
- 设置流动细胞测量仪。以快速模式获取样品数据,采用混合样本模式,吸收量为 100 μL。
- 以 FCS 格式导出数据,并使用 FlowJo 等软件进行分析。细胞数量可以使用荧光微球珠数确定。例如,如果研究人员每口井添加 2000 个珠子,并且珠子计数为 700,则将每个分数的细胞数乘以 2000/700,以估计井中该分数的总细胞数。
注:荧光微球由于甲醛的存在而对培养细胞有毒。这可能会在分析过程中诱发细胞死亡。最大限度地减少连续分析的油井数量(<50口油井),以避免偏差。
7. 人体HSC移植
注:培养细胞的再填充活动通过移植到免疫缺陷小鼠身上来验证。所有程序都必须得到动物实验委员会或其同等程序的批准。
- 作为捐赠者,准备足够数量的8-12周免疫缺陷NOD-SCID-Il2rg-空(NOG)小鼠。由于NOG小鼠极易受到感染,因此尽可能保持育种笼清洁,并给小鼠提供绝育饮食和水。
- 培养足够的HSC用于移植,如第5步所述。例如,当 5000 个 HSC(相当于第 0 天)移植到 6 个受体小鼠时,在 96 井板的 40 口井(每口井 200μL 的文化介质)或 24 井板的 8 口井(每口井 1 mL 的文化介质)培养 35,000-40,000 个 HSC。在加湿的多气体孵化器中培养细胞2周,每3-4天半媒体变化一次,在37°C,5%的二 氧化碳和1%的O2。文化持续时间可以改变。
- 移植前以 6-24 小时以 2.5 Gy 辐射 NOG 小鼠。
- 在 1.5 mL 管中收集培养的 HSC。在 4°C 下以 340 ×g 的速度将管子离心 5 分钟。
- 小心吸附超纳特,以每200μL5000 HSC(日0等价物)的细胞密度将细胞重新用无菌冰冷染色缓冲器中补充细胞。要对染色缓冲区进行消毒,使用 0.22 μm 滤光片进行过滤。
- 移植前,通过吸气或异氟兰吸入对小鼠进行麻醉。
- 要移植 5000 个培养的 HSC(日 0 等价物),使用 1 mL 注射器和 27 口径针头将 200 μL 的细胞悬浮物注射到 NOG 小鼠的尾静脉或逆轨道鼻窦中。新鲜分离或解冻的骨髓HSC可以移植作为控制。手套应在每个程序之间用70%v/v乙醇消毒。
8. 分析外周血液中人类衍生细胞的频率
- 为了检查人类细胞的再聚变,在移植后1个月、2个月和3个月收集外周血液。
- 在收集外周血液之前,通过吸入吸气器对小鼠进行麻醉。
- 使用肝化玻璃毛细管从逆轨道鼻窦中收集 40-80 μL 的外周血液,并将此样本悬挂在 1.5 mL 管中的 1 mL PBS + 肝素 (1 U/mL) 中。
- 在 340 × g 下将血液悬浮在 4 °C 下,将血液悬浮3分钟。 丢弃超自然物,在室温下将颗粒在 1 mL 中重新喷出 1.2% w/v 德克斯特兰 (200 kDa)45 分钟。
- 将超自然人转移到另一个 1.5 mL 管和离心机,在 340 × g 3 分钟。
- 对于红细胞裂解,在0.17 M NH4Cl中恢复细胞5分钟。
- 离心机细胞悬架 340 × g 3 分钟在 4 °C。 将细胞重新吸收到含有 0.3μL 反鼠标 Fc 块的 50μL 染色缓冲器中。在 4 °C 下孵化此样本 5 分钟。
- 添加以下抗体用于表面标记染色:0.3 μL 的鼠标 CD45-PE-Cy7,0.3 μL 鼠标 Ter-119-PE-Cy7, 0.3 μL 人 CD45-BV421,0.3 μL 人类 CD13-PE,1.2μL 人类 CD33-PE,0.3 μL 人类 CD19-APC,0.3 μL 人类 CD3-APC-Cy7。在 4 °C 下孵化细胞 15 分钟。
- 用1mL的染色缓冲器和离心机在340×g清洗一次,在4°C下洗5分钟。
- 丢弃超自然物,在 200 μL 的染色缓冲器 +0.1% v/v 的 PI 中重新吸收细胞。
- 将细胞悬架传输到 96 井平底板,并在快速模式下使用流式细胞仪获取数据,并打开混合样本模式,吸收体积为 100 μL。
- 使用 FlowJo 等软件导出 FCS 格式的数据进行分析。
- 设置流量细胞仪。以快速模式获取样品数据,并打开混合样本模式,吸收量为 100 μL。
- 使用 FlowJo 等软件导出 FCS 格式的数据进行分析。
结果
经过7天的纯化HSC培养,高达80%的细胞显示CD34+CD38的标记表型- (图4A)。总细胞数取决于细胞因子浓度(图4B)。SCF和TPO的较高浓度诱导进入细胞周期、增殖和分化(图4B)。以CD34 +CD38 -CD90+CD45RA标记表型为特征的表型HSC数量与SCF或TPO浓度(图4B)成正比增加,而总细胞中的频率则有所下降(图4C)。在 1.5 ng/mL SCF 和 4 ng/mL TPO 和 3 ng/mL SCF 3 和 2 ng/mL TPO 组合中,总细胞数量相等,这表明 HSC 在最小的细胞周期激活期间处于静止。鉴于个体差异,建议每个骨髓捐献者进行细胞因子滴定。
经过3个月的培养成人骨髓HSC移植后,重组可以评估为其在人类CD45+穆林CD45-Ter119细胞外围血液中的频率。包括CD19+B细胞、CD13/CD33+骨髓细胞和CD3+T细胞在内的三个血统在用刚解冻的HSC或培养的HSC移植的NOG小鼠中进行了重组(图5)。
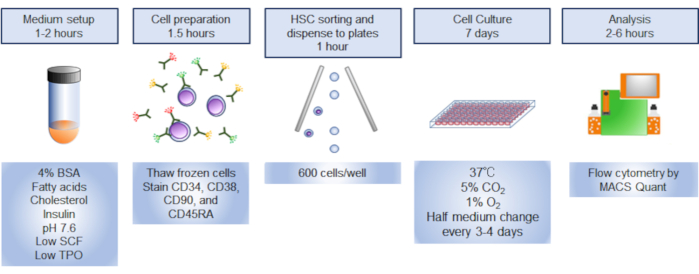
图1。程序概述。 该过程的图形摘要涉及分拣、培养和分析人类造血干细胞 (HSCs)。 请单击此处查看此图的较大版本。
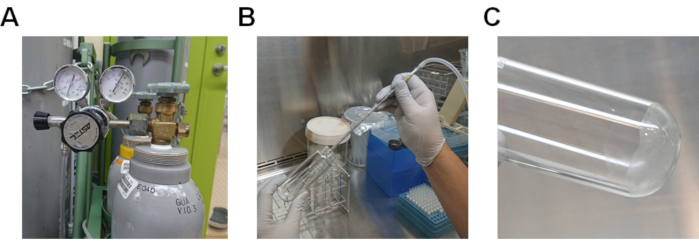
图2。从脂质溶液中蒸发甲醇的程序。 A) 带气体调节器的氮气瓶。B) 通过溶解在甲醇中的脂质溶液传递氮气的程序。C) 粘附在玻璃管底部的脂质。 请单击此处查看此图的较大版本。

图3。 分类 HSC 的加丁策略。图显示了封闭的 CD34+CD38-CD90+CD45RA- 单元格。大约 10% 的 CD34+ 细胞是表型 HSC。 请单击此处查看此图的较大版本。
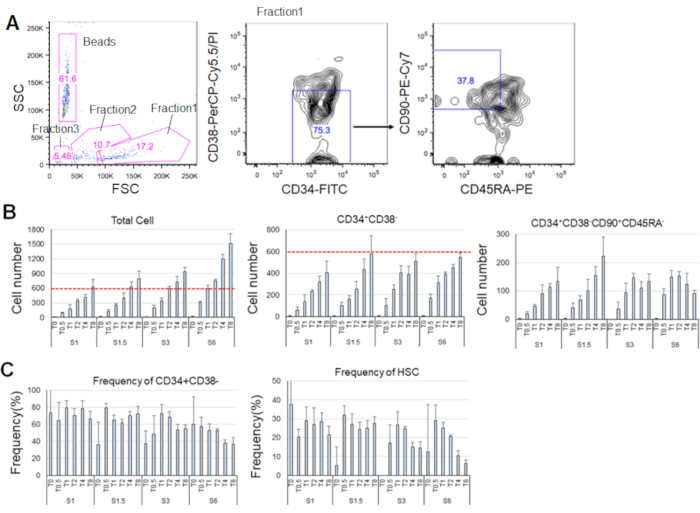
图4。经过7天的培养,具有代表性的细胞编号。A) 在 SCF (3 ng/mL) 和 TPO (2 ng/mL) 中培养 HSC 后,具有代表性的荧光激活细胞分拣图。分数 1 被丰富为活细胞,第 2 部分被丰富为死细胞,分数 3 被丰富为碎片。粉红色数字表示频率 (%)门控分数。B) 在指示的细胞因子条件下培养 600 个 HSC后,所有 HSC、CD34+CD38 - 细胞和 CD34 +CD38- CD90+CD45RA的细胞数量。红色虚线表示输入单元的初始数量。S: SCF, T: TPO.平均±标准偏差,n =4。S 和 T 以下的数字表示每个细胞因子的浓度 (ng/mL)。C) CD34+CD38的频率 - CD34+CD38-CD90+CD45RA-指示细胞因子条件下的细胞。S: SCF, T: TPO.平均±标准偏差,n =4。由于细胞值高(分别为37.7和47.9),因此省略了SCF(1 ng/mL)和TPO(0 ng/mL)培养细胞的错误条。请单击此处查看此图的较大版本。
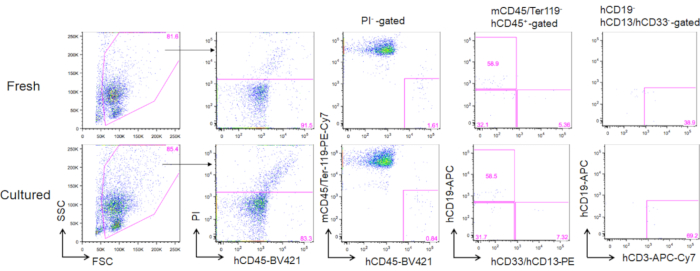
图5。经过3个月的移植后,代表FACS的捐赠小鼠地块。 总共将5000只刚解冻的(上板)和2周培养的HSC(3 ng/mL SCF和3ng/mL TPO;下板)移植到NOG小鼠体内。hCD19标记人类B细胞,hCD13和hCD33标记人类骨髓细胞,hCD3标记人类T细胞。请单击此处查看此图的较大版本。
讨论
最近,有几种方法可以扩展最小差异化的HSC,包括18、19、20、21。虽然这些方法非常出色,但 HSC 在细胞因子水平高的情况下被迫激活其细胞周期,这与 HSC 显示最少循环的体内情况不同。此协议通过回顾骨髓微环境,有助于保持 HSC 的静止状态,如体内观察到的那样。
通过在低细胞因子、富脂和缺氧条件下培养人类HSC,HSC在保持其标记表型的同时表现出最少的循环。本协议的关键步骤是准备含有高浓度脂肪酸和胆固醇的介质,以及低细胞因子浓度和缺氧下培养物(第 1 步、第 2 步和第 4 步)。如果没有胆固醇和/或脂肪酸,低细胞因子浓度下的HSC维持率会降低22。如前23日报道的那样,在缺氧条件下培养细胞也很重要。
除了细胞因子浓度外,这些培养条件与用于穆林HSC的条件相似。Murine HSC 在没有 TPO 的情况下生存,而人类 HSC 需要至少 2 ng/mL 的 TPO,而 SCF22的 TPO 为 3 ng/mL。由于TPO的浓度远远高于人类血清(+100 pg/mL),本协议中使用的条件可能缺少支持人类HSC生存的具体因素。 FLT3在人类HSC24上表达。增加其配体 FLT3LG 略低 TPO 维护 HSC22 的要求。
与粘液HSC相比,人类HSC需要更高的胆固醇浓度,大概是因为无法诱导胆固醇合成酶的表达,以及脂肪酸22下高浓度(>400微克/mL)下对脂毒性易感性。虽然只有棕榈酸、油性、亚油酸和固酸的组合进行了测试,这在人类血清中是大量发现的,但应评估其他脂质组合,以降低脂质氧化性,提高维持功能性HSC的速度。
虽然经过两周培养后,免疫缺陷小鼠培养的人类HSC的再填充活动已于22日得到证实,但这一培养系统并没有完全重新概括HSC在体内的利基功能。据报道,CD45RA的表达有所增加,重新人口容量低于新分类的HSC22。然而,在超生理水平上添加到介质中的营养物质(如葡萄糖、氨基酸、聚氨酯和胰岛素)的浓度可以优化。BSA中的污染物也可能损害HSC18,25的维护。此外,一些培养细胞经历细胞死亡,而另一些则经历细胞分裂:因此,保持总细胞数可能不表示每个细胞的静止状态。
尽管有这些限制,本研究中制定的协议中描述的文化条件将有助于推进HSC的研究和工程,特别是在近生理条件下。保持 HSC 的微分和循环活性的培养条件将适合测试专门作用于 HSC 的生物和化合物,通过扁豆病毒转导或基因组编辑来操纵 HSC,而不会失去干度,并阐明白血病相关基因诱导的转化的第一步。
披露声明
作者声明与这项研究没有利益冲突。
致谢
我们感谢原口和田崎女士的技术支持和实验室管理,感谢K.西罗希塔的拍照。香港部分得到来自MEXT/JSPS(第19K17847号赠款)和国家全球健康与医学中心的KAKENHI赠款的支持。KT 部分得到了来自 MEXT/JSPS 的 KAKENHI 赠款(赠款号为 18H02845 和 18K19570)、国家全球健康和医学中心(赠款号 26-001 和 19A2002)、AMED(赠款号) 的支持。JP18ck0106444、JP18ae0201014和JP20bm0704042)、小野医学研究基金会、关泽医学研究基金会和竹田科学基金会。
材料
| Name | Company | Catalog Number | Comments |
| Human bone marrow CD34+ progenitor cells | Lonza | 2M-101C | |
| NOD/Shi-scid,IL-2RγKO Jic | In-Vivo Science Inc. | https://www.invivoscience.com/en/nog_mouse.html | |
| Anti-human CD34-FITC (clone: 581) | BD biosciences | Cat# 560942; RRID: AB_10562559 | |
| Anti-human CD38-PerCP-Cy5.5 | BD biosciences | Cat# 551400; RRID: AB_394184 | |
| Anti-human CD45RA-PE | BD biosciences | Cat# 555489; RRID: AB_395880 | |
| Anti-human CD90-PE-Cy7 (clone: 5E10) | BD biosciences | Cat# 561558; RRID: AB_10714644 | |
| Anti-human CD13-PE (clone: WM15) | BioLegend | Cat# 301703; RRID: AB_314179 | |
| Anti-human CD33-PE (clone: WM53) | BD biosciences | Cat# 561816; RRID: AB_10896480 | |
| Anti-human CD19-APC (clone: SJ259) | BioLegend | Cat# 363005; RRID: AB_2564127 | |
| Anti-human CD3-APC-Cy7 (clone: SK7) | BD biosciences | Cat# 561800; RRID: AB_10895381 | |
| Anti-human CD45-BV421 (clone: HI30) | BD biosciences | Cat# 563880; RRID:AB_2744402 | |
| Anti-mouse CD45-PE-Cy7 (clone: 30-F11) | BioLegend | Cat# 103114; RRID: AB_312979 | |
| Anti-mouse Ter-119-PE-Cy7 (clone: TER-119) | BD biosciences | Cat# 557853; RRID: AB_396898 | |
| Fc-block (anti-mouse CD16/32) (clone: 2.4-G2) | BD Biosciences | Cat# 553142; RRID: AB_394657 | |
| Phosphate buffered saline | Nacalai Tesque | Cat# 14249-24 | |
| Fetal bovine serum | Thermo Fisher Scientific | Cat# 26140079 | |
| DMEM/F-12 medium | Thermo Fisher Scientific | Cat# 11320-033 | |
| ITS-X | Thermo Fisher Scientific | Cat# 51500056 | |
| Penicillin | Meiji Seika | PGLD755 | |
| Streptomycin sulfate | Meiji Seika | SSDN1013 | |
| Bovine serum albumin | Sigma Aldrich | Cat# A4503 | |
| Sodium palmitate | Tokyo Chemical Industry Co., Ltd. | Cat# P0007 | |
| Sodium oleate | Tokyo Chemical Industry Co., Ltd. | Cat# O0057 | |
| Cholesterol | Tokyo Chemical Industry Co., Ltd. | Cat# C0318 | |
| Ammonium Chloride | Fujifilm | Cat# 017-2995 | |
| Sodium Hydrogen Carbonate | Fujifilm | Cat# 191-01305 | |
| EDTA 2Na | Fujifilm | Cat# 345-01865 | |
| Heparine Na | MOCHIDA PHARMACEUTICAL CO., LTD. | Cat# 224122557 | |
| Sevoflurane | Fujifilm | Cat# 193-17791 | |
| Dextran | Nacalai Tesque | Cat# 10927-54 | |
| Recombinant Human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TPO | PeproTech | Cat# 300-18 | |
| Recombinant human Flt3 ligand | PeproTech | Cat# 300-19 | |
| Propidium iodide | Life Technologies | Cat# P3566 | |
| Flow-Check Fluorospheres | Beckman Coulter | Cat# 7547053 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| AutoMACS Pro | Miltenyi Biotec | N/A | |
| FACS Aria3u | BD Biosciences | N/A | |
| VELVO-CLEAR VS-25 (sonicator) | VELVO-CLEAR | N/A | |
| Nitrogen gas cylinder | KOIKE SANSHO CO., LTD | N/A | |
| Gas regulator | Astec | Cat# IM-055 | |
| Multigas incubator | Astec | Cat# SMA-30DR | |
| Glass tube, 16 mL | Maruemu corporation | N-16 | |
| Glass tube, 50 mL | Maruemu corporation | NX-50 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGPR33RS |
参考文献
- Scala, S., Aiuti, A. In vivo dynamics of human hematopoietic stem cells: novel concepts and future directions. Blood Advances. 3 (12), 1916-1924 (2019).
- Trumpp, A., Essers, M., Wilson, A. Awakening dormant haematopoietic stem cells. Nature Reviews Immunology. 10 (3), 201-209 (2010).
- Laurenti, E., Gottgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Sun, J., et al. Clonal dynamics of native haematopoiesis. Nature. 514 (7522), 322-327 (2014).
- Busch, K., et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature. 518 (7540), 542-546 (2015).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561 (7724), 473-478 (2018).
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25 (9), 2308-2316 (2018).
- Rodriguez-Fraticelli, A. E., et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 553 (7687), 212-216 (2018).
- Pineault, N., Abu-Khader, A. Advances in umbilical cord blood stem cell expansion and clinical translation. Experimental Hematology. 43 (7), 498-513 (2015).
- Wilkinson, A. C., Igarashi, K. J., Nakauchi, H. Haematopoietic stem cell self-renewal in vivo and ex vivo. Nature Reviews Genetics. 21 (9), 541-554 (2020).
- Wagner, J. E., et al. Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell. 18 (1), 144-155 (2016).
- Cohen, S., et al. Hematopoietic stem cell transplantation using single UM171-expanded cord blood: a single-arm, phase 1-2 safety and feasibility study. Lancet Haematology. 7 (2), 134-145 (2020).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Ito, K., Suda, T. Metabolic requirements for the maintenance of self-renewing stem cells. Nature Reviews Molecular Cell Biology. 15 (4), 243-256 (2014).
- Mendelson, A., Frenette, P. S. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nature Medicine. 20 (8), 833-846 (2014).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Xie, W., et al. Detection of molecular targets on the surface of CD34+CD38- bone marrow cells in myelodysplastic syndromes. Cytometry A. 77 (9), 840-848 (2010).
- Wilkinson, A. C., et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature. 571 (7763), 117-121 (2019).
- Bai, T., et al. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine. 25 (10), 1566-1575 (2019).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Kobayashi, H., et al. Environmental Optimization Enables Maintenance of Quiescent Hematopoietic Stem Cells Ex Vivo. Cell Reports. 28 (1), 145-158 (2019).
- Danet, G. H., Pan, Y., Luongo, J. L., Bonnet, D. A., Simon, M. C. Expansion of human SCID-repopulating cells under hypoxic conditions. Journal of Clinical Investigation. 112 (1), 126-135 (2003).
- Kikushige, Y., et al. Human Flt3 is expressed at the hematopoietic stem cell and the granulocyte/macrophage progenitor stages to maintain cell survival. Journal of Immunology. 180 (11), 7358-7367 (2008).
- Ieyasu, A., et al. An All-Recombinant Protein-Based Culture System Specifically Identifies Hematopoietic Stem Cell Maintenance Factors. Stem Cell Reports. 8 (3), 500-508 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。