Method Article
静止ヒト造血幹細胞を維持する培養法
要約
このプロトコルは、豊富な脂肪酸、コレステロール、サイトカインの低濃度、および低酸素症を使用して骨髄微小環境を模倣することによって、体外の静止したヒト造血幹細胞の維持を可能にする。
要約
ヒト造血幹細胞(HSC)は、他の哺乳類HSCと同様に、骨髄における生涯造血を維持する。HSCは、より分化された前駆物質とは異なり、生体内で静止したままであり、骨髄損傷またはインビトロ培養を治療するために化学療法または照射後に細胞周期に急速に入る。豊富な脂肪酸、コレステロール、低濃度のサイトカイン、および低酸素の存在下で骨髄微小環境を模倣することによって、ヒトHSCは、インビトロで静止を維持する。ここでは、インビトロで静止状態で機能HSCを維持するための詳細なプロトコルについて説明する。この方法は、生理学的条件下でのヒトHSCの挙動の研究を可能にする。
概要
造血幹細胞(HSC)および多能性前駆細胞(MpP)は、ヒトの生涯にわたって造血を維持するために分化細胞の連続補充のための貯留槽を協調的に形成する1。細胞周期静止は、HSCの顕著な特徴であり、それらをMpps2と区別する。従来、HSCは造血系の階層の頂点に存在すると考えられ、全ての分化した血液細胞を産生する。この階層モデルは、移植実験3から主に推定された。しかし、最近の研究では、HSCのダイナミクスは、移植実験4、5、6、7と比較して生体内で異なることを示した。いくつかのバーコードシステムを用いた系統トレース実験では、表現型マウスHSCは定常造血に寄与するユニークな細胞型ではないことを明らかにし、移植時に限られた自己再生活性を示すPPは、成熟した血液細胞4、5、8を連続的に供給する。対照的に、成熟細胞に対するHSCの寄与は、骨髄損傷4後に増強される。これは、骨髄移植を含む骨髄アブレーション後の微小環境の劇的な変化に起因する可能性がある。マウス細胞の系統トレースをヒト細胞に適用することは困難であるが、単細胞由来コロニー単離と全ゲノムシーケンシングを組み合わせた系統学的解析は、HSCとMMPの両方が成熟細胞の毎日の産生を担う造血系の同様の性質を明らかにした7。したがって、移植はマウスやヒトHSC活性を調べる上で不可欠であるが、生理学的条件下でのHSCの挙動を理解するためには他の実験モデルが必要である。
HSCの培養方法は、その臨床応用と特性を理解するために詳細に研究されてきた。ヒトHSCは、サイトカインの組み合わせ、細胞外マトリックスの再構成、自己再生アンタゴニストの除去、間葉細胞または内皮細胞との共培養、アルブミンまたはその置換、自己更新転写因子の導入、および小分子化合物の添加を用いてインビトロで拡大することができる。これらの方法のいくつかは、SR111およびUM17112の小さな化合物の添加を含め、有望な結果9を有する臨床試験で試験されている。生体内の HSC の静止性を考慮すると、最小限の細胞循環で HSC を維持することは、インビトロで HSC の動作を再現するために重要です。静止および増殖性HSCは、細胞周期の異なるエントリ13、代謝状態14、および複数のストレス15に対する耐性を示す。インビトロでヒトHSCの静止を維持するために使用される方法は限られている。
骨髄の微小環境(低酸素と脂質が豊富)を模倣し、サイトカインの濃度を最適化することにより、ヒトHSCは培養下で未分化および静止を維持することができる。インビトロでHSCの静止性を再現することで、HSCの定常状態特性の理解が向上し、HSCの実験的操作が可能になります。
プロトコル
このプロトコルは、国立国際保健医療センターのガイドラインに従っています。マウスに対して行われたすべての実験手順は、国立国際医療センター動物実験委員会によって承認されています。
注: プロトコルの概要を 図 1に示します。
1. 脂質製剤
- 示された濃度でガラス管中のメタノールに以下の脂質を溶解します: パルミチン酸ナトリウム, 16 mg/mL;オレイン酸ナトリウム、 30 mg/mL;コレステロール, 4 mg/mL.脂質溶液を-30°Cに保存し、使用前にサンプルを解凍してください。
- ステップ1.1で調製した脂質溶液を、パルミチン酸100μg/mLの最終濃度、100μg/mLオレイン酸、および20μg/mLコレステロールの最終濃度を得るために必要な用量で、新鮮なガラス管に混合します。例えば、10 mLの培養培地を調製する場合、パルミチン酸溶液62.5 μL、オレイン酸溶液33μL、および50μLのコレステロール溶液をガラス管に混ぜます。
- 脂質溶液を通して窒素ガスを通してメタノールを蒸発する(図2A及び2B)。窒素ガスが利用できない場合は、ピペットエイドを使用して溶液を通して空気を通過させます。
- 37°Cの水浴でガラス管を加熱することにより、残りのメタノールを完全に蒸発させる(図2C)。
注:限られたスペースでの高濃度のN2 ガスの使用は潜在的に有害である。メタノールを蒸発させるプロトコルで使用される容積は限られており、従って安全であると考えられるが、予期せぬガス漏れが発生した場合、部屋を十分に換気し、潜在的に高濃度のN2 ガスの標識領域が重要である。
2. 中程度の準備
- ダルベッコの改変イーグル培地(DMEM)/F12培地(HEPESおよびグルタミン付き)を準備します。ペニシリンとストレプトマイシン硫酸塩を培地に加えて、最終濃度の50単位と50μg/mLにそれぞれ加えます。抗生物質を含むDMEM/F12培地は、少なくとも2ヶ月間4°Cで保存することができる。
- 4%w/vのウシ血清アルブミン(BSA)をダルベックの修飾イーグル培地(DMEM)/F12培地(HEPESおよびグルタミン付)に加えます。
- NaOH溶液を用いて培地のpHを7.4-7.8に調整し、通常はpH 7.6に調整する。
- ステップ1で準備したガラス管に培地を追加します。最大溶解度の溶液を達成するために、3〜15 mL培地の添加が推奨される。
- 完全に超音波処理(最適:超音波処理の20分以上)によって脂質を溶解します。BSAと脂質が溶解した後、サンプルは-80°Cで保存し、2ヶ月以内に使用する必要があります。使用直前に解凍します。
- DMEM/F12にインスリン、トランスフェリン、セレニットナトリウム、エタノールアミン(ITS-X)混合物を1/1,000個加えます。0.22 μm フィルタ("培養メディア"として指定)を使用して混合培地をフィルタリングします。使用前に、ヒト幹細胞因子(SCF)およびヒトトロンボポエチン(TPO)を各3ng/mLの最終濃度で培養培地に添加する。サイトカインとITS-Xを追加した後、培地を保存することはできません。
- 染色バッファー: Ca-およびMgフリーリン酸緩衝生理食塩分(PBS)に10%FCSを加えます。この溶液は、4°Cで2週間保存することができます。
- メディアの解凍: DMEM/F12 に 10% FCS を追加します。このソリューションは単独で使用できます。
- サイトカインストック溶液:20μg/mLで、ヒトSCFまたはヒトTPOをPBS(Ca-およびMgフリー)に溶解します。この溶液は、活動を失うことなく、少なくとも1年間-80°Cで保存することができます。解凍したら、ストック液を4°Cで保存し、1ヶ月以内に使用してください。
注:BSAの汚染物質の変動を避けるために、すべての購入後にロットを調べます。BSAの異なるバッチを同時に培養HSCとし、7日目の表現型HSC数を以下に記載して調べる。BSA バッチが CD34+ セルの数または頻度が低い場合 (入力セルの数の半分以下など) は、このバッチの使用は避けてください。
3. ヒト骨髄CD34+細胞の調製
- ヒトCD34+骨髄細胞を購入し、使用するまで液体窒素に保存します。あるいは、健康なボランティアまたは新鮮な臍帯血球からの骨髄細胞は、研究所の倫理委員会とドナーの同意によって承認された場合に使用することができる。
- 37°Cの水浴で15 mL円錐形のチューブに10mLの解凍媒体を温めます。
- 37°Cの水浴で2分以内にバイアル中の凍結細胞を解凍します。70%エタノールでバイアルを拭いて汚染物質を除去した後、ステップ3.2から予め温めた培地を含む15mLの円錐チューブに細胞を移す。
- 室温で15分間200×gで15mLチューブを遠心します。上清を慎重に吸引してペレットをそのままに保つ(培地<50μLを残す)。残りの培地で細胞を再懸濁し、氷上の1.5mLチューブに移します。
注:目や傷ついた組織を含む粘膜に直接ヒト由来のサンプルへの暴露は、既知または未知の病原体による感染を引き起こす可能性があります。したがって、手袋や眼鏡は、人間の細胞を扱うときにお勧めします。購入したCD34+細胞がB型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、ヒト免疫不全ウイルス1(HIV1)に対して陰性を検査した場合でも、暴露の発生率が発生した場合は、制度ガイドラインに従って注意深くモニタリングする必要があります。ヒト細胞に曝露された物質を処分する際には、制度上のガイドラインに従ってください。
4. HSC のソート
- フルオロクロム共役抗体で細胞にラベルを付けます。50 μLの染色バッファーに抗CD34-FITC 10 μL、抗CD38-PerCP-Cy5.5の2 μL、抗CD90-PE-Cy7の5 μL、抗CD45RA-PEの10 μLを混合します。抗体混合物中の細胞ペレットを再懸濁する。暗い中で4°Cで30分間細胞をインキュベートする。
- 抗体を洗浄するために1mLの染色バッファーを加えます。4°Cで5分間340×gでチューブを遠心分離します。 上清を捨てます。
- 細胞ペレットを0.5 mLの染色バッファー+ 0.1% ヨウ化プロピジウムに再懸濁します。40 μmフィルターを使用して、サスペンションを5 mLチューブに移します。
- FACSAria-IIIuを使用して、PI - CD34+CD38-CD90+CD45RA-分数内のフェロチHSCをゲートし、500 μLの培養培地で満たされた1.5 mLチューブに細胞を並べ替える(図3)。図3に示す格紙の戦略を用いて、CD34+細胞の〜10%が、細胞のHSCを表見すると予想される。
注:格紙戦略は、健康な個体17 からのCD34+CD38-分数のリネージュマーカーの低い発現を与えられた系統マーカー染色を省略しながら、前に説明した16 のように行われる。 - 4°Cで5分間340×gで選別した細胞を遠心分離し、上清を捨てます。上清を慎重に吸引し、ペレットがそのまま残るようにします。
- 培養するまで、並べ替えられたセルを氷の上に保存します。
注: スペクトルオーバーラップの蛍光補償は、最初の実験で行う必要があります。
5. 細胞培養
- ステップ2で調製したサイトカインを含む培養培地200μLを平底96ウェルプレートに移します。
- 培地の蒸発を避けるために、使用されていないウェルをすべて100~200 μLのPBSで満たします。
- 60細胞/μLでサイトカインを使用せずに培養培地でソートしたHSCを再中断します。
- アリコート600 HSC/ウェル(細胞懸濁液の10 μL)を各ウェルに入します。セル番号は変更できます。300未満の細胞は、より大きな技術的変動をもたらすので、生物学的な違いを検出するために条件ごとにより多くの井戸が必要です。1つの井戸で1000以上の細胞を培養することは、サイトカイン/栄養不足または不利なサイトカイン/ケモカインの蓄積のために避けるべきです。
- 加湿した多気インキュベーター中の細胞を37°Cで5%CO2及び1%O2雰囲気で培養した。
- 7 日間を超えるカルチャの場合は、3 ~ 4 日ごとにメディアボリュームの半分を交換することをお勧めします。100μLの培地をピペットで慎重に吸引し、サイトカインを含む新たに調製した培養培地を100μLずつ各ウェルに添加します。培養培地は37°Cであらかじめ温める必要があります。
6. フローサイトメトリーを用いたマーカーのフェノタイプの解析
注: 7 日間培養した後にセルを分析する必要がありますが、培養期間は変更できます。
- 8チャンネルのピペットを使用して、培地の170μLを廃棄します。
- 抗体混合物で細胞にラベルを付けます。0.5 μLの抗 CD34-FITC、0.1 μLの抗 CD38-PerCP-Cy5.5、0.25 μL の抗 CD90-PE-Cy7、0.5 μL の抗 CD45RA-PE、および 9 μL の染色バッファーを 1 ウェルあたり混合します。混合物の10 μLを96ウェルプレートに加え、暗い4°Cで30分間培養します。
- 抗体を洗浄するには、100 μLの染色バッファーをウェルに加え、低加速と中減速を使用して400×gのプレートを400gで5分間遠心します。
- 慎重にウェルの底に細胞を維持するために上清の100 μLを吸引し、その後、200 μLの染色バッファー + 0.1% v/v の PI + 1% v/v の蛍光微小球 (例えばフローチェックフルオロスフィアス) の細胞を再懸濁します。
- フローサイトメトリー計器を設定します。混合サンプルモードで、100 μLの混合サンプルモードでサンプルのデータを取得します。
- データをFCS形式でエクスポートし、FlowJoなどのソフトウェアを使用して分析します。細胞数は蛍光微小球ビーズ数を用いて求めることができる。たとえば、研究者がウェルあたり 2000 ビーズを追加し、ビード数が 700 である場合、各分数のセル数に 2000/700 を掛けて、ウェル内の分数の総セル数を推定します。
注意:蛍光微小球はホルムアルデヒドの存在のために培養細胞に有毒である。これは、分析中に細胞死を誘発する可能性があります。バイアスを避けるために連続的に分析されるウェル(<50ウェル)の数を最小限に抑えてください。
7. ヒトHSC移植
注:培養細胞の再集団活性は、免疫不全マウスへの移植によって検証される。すべての手順は、動物実験委員会またはその同等物によって承認されなければなりません。
- ドナーとして、十分な数の8-12週間の免疫不全性NOD-SCID-Il2rg-null(NOG)マウスを調製する。NOGマウスは感染しやすいので、繁殖ケージをできるだけ清潔に保ち、殺菌された食事と水をマウスに供給します。
- 培養工程5に記載した移植のための十分な数のHSCを培養する。例えば、5000 HSC(0日目相当)を6匹のレシピエントマウスに移植すると、培養35,000-40,000 HSCを96ウェルプレート(ウェルあたり200μLの培養培地)の40ウェルまたは24ウェルプレートの8ウェル(ウェル当たり1mLの培養培地)で培養します。5%CO2及び1%O2で37°Cで加湿された多気インキュベーターで3〜4日毎に半培地変化で2週間細胞を培養する。カルチャの期間は変更できます。
- 移植前に6-24時間で2.5GyでNOGマウスを照射する。
- 培養したHSCを1.5mLチューブで回収します。4°Cで5分間340×gでチューブを遠心分離します。
- 上清を慎重に吸引し、200μLあたり5000 HSC(0日目相当)の細胞密度で無菌氷冷染色バッファー内の細胞を再懸濁します。染色バッファーを殺菌するには、0.22 μm フィルターを使用してフィルターします。
- 移植前に、セボフルランまたはイソファラン吸入によってマウスを麻酔する。
- 培養したHSCの5000μL(0日目相当)を移植するには、1mL注射器と27ゲージ針を用いて、ステップ7.1で照射したNOGマウスの尾静脈またはレトロ眼窩静脈に細胞懸濁液200μLを注入する。新たに単離または解凍された骨髄HSCをコントロールとして移植することができる。手袋は、各手順の間に70%のv/vエタノールで滅菌する必要があります。
末梢血におけるヒト由来細胞の頻度の解析
- ヒト細胞の再集団を調べるには、移植後1、2、3ヶ月で末梢血を採取する。
- 末梢血を採取する前に、セボフルラン吸入によってマウスを麻酔する。
- ヘパリン化ガラスキャピラリーチューブを使用して、レトロ軌道サイヌスから40〜80μLの末梢血液を採取し、1.5 mLチューブ内のPBS + ヘパリン(1 U/mL)の1mLでこのサンプルを一時停止します。
- 340×gで血液懸濁液を4°Cで3分間遠心分離する。 上清を捨て、PBSの1 mL+1.2%w/vデキストラン(200 kDa)を室温で45分間再懸濁します。
- 上清を340 ×mg で別の1.5mLチューブと遠心分離機に3分間移します。
- 赤血球のリシスの場合、細胞を0.17 M NH4Clで5分間再懸濁する。
- 細胞懸濁液340×gを4°Cで3分間遠心分離する。 0.3 μLの抗マウスFcブロックを含む染色バッファーの50 μLで細胞を再懸濁します。このサンプルを4°Cで5分間インキュベートします。
- 表面マーカー染色用の抗体を追加:0.3 μLのマウスCD45-PE-Cy7、 0.3 μLマウス Ter-119-PE-Cy7、ヒトCD45-BV421の0.3 μL、ヒトCD13-PEの0.3 μL、ヒトCD33-PEの1.2 μL、ヒトCD19-APCの0.3 μL、ヒトCD3-APC-Cy7の0.3 μL。4°Cで細胞を15分間インキュベートします。
- 1 mLの染色バッファーと遠心分離機を340×gで1回、4°Cで5分間洗浄します。
- 上清を捨てて、200 μLの染色バッファー + 0.1% v/v PI で細胞を再懸濁します。
- セルサスペンションを96ウェルフラットボトムプレートに移し、ミックスサンプルモードをオンにして100 μLの取り込みボリュームを使用して、高速モードのフローサイトメーターを使用してデータを取得します。
- FlowJo などのソフトウェアを使用して、分析用のデータを FCS 形式でエクスポートします。
- フローサイトメーターを設定します。ミックスサンプルモードをオンにして、取り込み体積を100 μLにして、高速モードでサンプルのデータを取得します。
- FlowJo などのソフトウェアを使用して、分析用のデータを FCS 形式でエクスポートします。
結果
精製されたHSCを培養した7日後、細胞の最大80%がCD34+CD38-のマーカーのフェノタイプを表示した(図4A)。総細胞数はサイトカイン濃度に依存する(図4B)。より高濃度のSCFおよびTPOは、細胞周期への侵入、増殖、および分化を誘導した(図4B)。CD34+ CD38 - CD90+CD45RAのマーカーフェノタイプによって特徴づけられる表型HSCの数は、SCFまたはTPO濃度(図4B)に比例して増加したのに対し、全細胞間の頻度は減少した(図4C)。総細胞数は、1.5 ng/mL SCFおよび4 ng/mL TPOおよび3ng/mL SCF 3および2ng/mL TPOの組み合わせにおいて等しく、HsCが最小細胞周期活性化中に静止していることを示唆した。個々の違いを考えると、サイトカイン滴定は、各骨髄ドナーに推奨されます。
培養成体骨髄HSCの移植の3ヶ月後、再構成は、ヒトCD45+マウスCD45-Ter119-細胞の末梢血におけるそれらの頻度として評価することができる。CD19+B細胞、CD13/CD33+骨髄細胞、およびCD3+T細胞を含む3系統を、解凍したばかりのHSCまたは培養HSCのいずれかで移植したNOGマウスで再構成した(図5)。
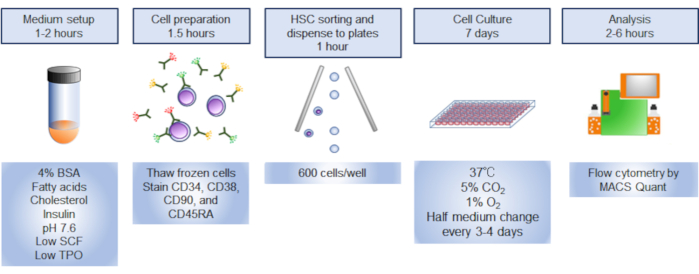
図 1.手順の概要。 手順のグラフィカルな要約には、ヒト造血幹細胞(HSC)の選別、培養、分析が含まれる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
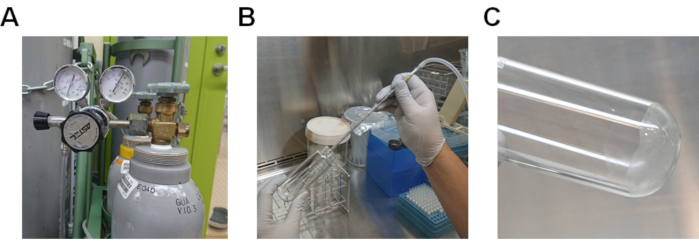
図 2.脂質溶液からメタノールを蒸発する手順。 A)ガスレギュレータ付き窒素ガスボンベ。B)メタノールに溶解した脂質溶液を通して窒素ガスを通過させる手順。C)ガラス管の底部に付着した脂質。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 3. HSC のソートのためのギャッティング戦略プロットは、ゲート付きCD34+CD38-CD90+CD45RA- 細胞を示しています。CD34+ 細胞の約10%が表向きHSCでした 。
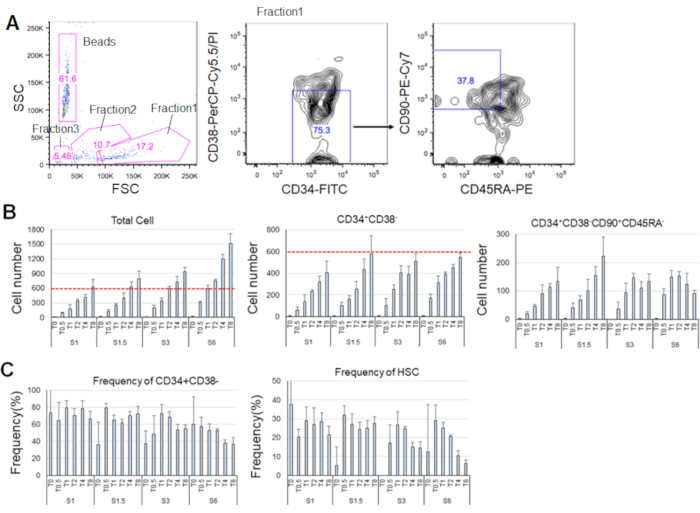
図 4.培養7日後の代表的な細胞数。A) SCF(3 ng/mL)およびTPO(2 ng/mL)でHSCを培養した後の代表的な蛍光活性化細胞選別プロット。分数1は生細胞に対して濃縮され、分数2は死細胞に対して濃縮され、分数3は破片に対して濃縮された。ピンク色の数字は周波数を示します(%)ゲート分数の。B)全HSCの数、CD34+CD38-細胞、およびCD34+CD38−CD90+CD45RA−細胞は、示されたサイトカイン条件下で600 HSCを培養した後である。 赤い破線は、入力セルの初期数を示します。S: SCF、 T: TPO.標準偏差±平均 n = 4。SとTに続く数字は、各サイトカインの濃度(ng/mL)を示す。C) CD34+CD38の周波数 - および CD34+CD38-CD90+CD45RA-示されたサイトカイン条件下の細胞。S: SCF、 T: TPO.標準偏差±平均 n = 4。SCF(1 ng/mL)およびTPO(0 ng/mL)で培養された細胞の誤差範囲は、それぞれ高い値(37.7および47.9)のため省略された。この図の大きなバージョンを表示するには、ここをクリックしてください。
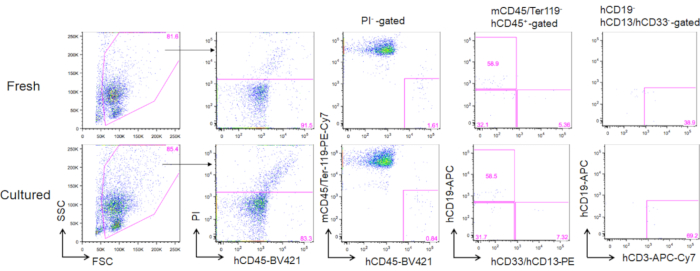
図 5.移植の3ヶ月後のドナーマウスの代表的なFACSプロット。 合計で5000個の解凍済み(上部パネル)と2週間培養されたHSC(3 ng/mL SCFおよび3 ng/mL TPO;下部パネル)をNOGマウスに移植した。hCD19はヒトB細胞をマークし、hCD13およびhCD33はヒト骨髄細胞をマークし、hCD3はヒトT細胞をマークする。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
最近、少ない分化でHSCを拡張するためのいくつかの方法が報告されている18,19,20,21.これらの方法は優れていますが、HSCは、HSCが最小限のサイクリングを示すインビボの状況とは異なる高レベルのサイトカインの存在下で細胞サイクルを活性化することを余儀なくされています。このプロトコルは、骨髄微小環境を再現することによって、生体内で観察されるように、HSCを静止として維持するのに有用である。
低サイトカイン、脂質が豊富、低酸素状態でヒトHSCを培養することにより、HSCはマーカーの型を維持しながら最小限のサイクリングを示した。このプロトコルの重要なステップは、低酸素下で高濃度の脂肪酸とコレステロールと低サイトカイン濃度および培養を含む培地の調製である(ステップ1、ステップ2、およびステップ4)。コレステロールや脂肪酸がない場合、低サイトカイン濃度の下でHSCの維持速度は22減少する。低酸素状態下での細胞の培養も重要である, 以前に報告されたように 23.
培養条件は、サイトカイン濃度を除いて、マウスHSCに使用されるものと類似していた。マウス HSC は TPO なしで生き残りますが、人間の HSC は SCF22の 3 ng/mL で TPO の少なくとも 2 ng/mL を必要とします。TPOの濃度はヒト血清(〜100pg/mL)においてよりはるかに高いので、このプロトコルで使用される条件は、ヒトHSCの生存を支える特定の因子を欠く可能性がある。そのリガンドFLT3LGの添加は、HsCs22を維持するためのTPOの要件をわずかに減少させる。
ヒトHSCは、マウスHSCと比較してコレステロールの濃度が高く、脂肪酸22の高濃度(>400μg/mL)下でコレステロール合成酵素の発現を誘導できないことや、リポ毒性に対する感受性が高いためと考えられた。パルミチン酸、オレイン酸、リノール酸、ステアリン酸の組み合わせのみが試験されたが、ヒト血清中に豊富に見られるが、脂質の他の組み合わせは、リポ毒性を低減し、機能性HSCを維持する速度を向上させるために評価されるべきである。
2週間後の免疫不全マウスにおけるヒトHSCの再集団化活性は22個確認されているが、この培養系は、生体内におけるHSCのニッチ機能を完全に再現するわけではない。CD45RAの発現は増加すると報告されており、再集団容量は、新たにソートされたHSC22のそれより劣っている。しかし、グルコース、アミノ酸、ピルビン酸、インスリンなどの栄養素の濃度は、上の生理学的レベルで培地に添加され、最適化することができます。BSA の汚染物質も HSC18,25のメンテナンスを損なう可能性があります。さらに、培養細胞の中には細胞死を受けるものもあれば、細胞分裂を受ける細胞もある。したがって、セル総数の維持は、各セルの静止状態を示さない場合があります。
これらの制限にもかかわらず、本研究で開発されたプロトコルに記載されている培養条件は、特に生理学的条件に近い状態下でHSCの研究と工学を進めるのに役立つ。HSCを最小限の分化およびサイクリング活性で維持する培養条件は、HSCに特異的に作用する生物学的および化学的化合物の試験、レンチウイルスの形質転換またはゲノム編集を介してステムを失うことなくHSCを操作し、白血病関連遺伝子によって誘発される形質転換の初期段階を解明するのに適している。
開示事項
著者らは、この研究に関連する利益相反を宣言しない。
謝辞
原口さんと多木さん、技術支援、研究室運営、白下K.の写真撮影に感謝します。HKは、MEXT/JSPSのKAKENHIグラント(19K17847)と国立国際保健医療センターによって支えられていました。KTは、MEXT/JSPS(グラント18H02845および18K19570)、国立国際保健医療センター(グラント26-001および19A2002)、AMED(グラントノーズ)のKAKENHI助成金によって部分的にサポートされました。JP18ck0106444、JP18ae0201014、JP20bm0704042)、小野医学研究財団、金沢医学研究財団、武田科学財団
資料
| Name | Company | Catalog Number | Comments |
| Human bone marrow CD34+ progenitor cells | Lonza | 2M-101C | |
| NOD/Shi-scid,IL-2RγKO Jic | In-Vivo Science Inc. | https://www.invivoscience.com/en/nog_mouse.html | |
| Anti-human CD34-FITC (clone: 581) | BD biosciences | Cat# 560942; RRID: AB_10562559 | |
| Anti-human CD38-PerCP-Cy5.5 | BD biosciences | Cat# 551400; RRID: AB_394184 | |
| Anti-human CD45RA-PE | BD biosciences | Cat# 555489; RRID: AB_395880 | |
| Anti-human CD90-PE-Cy7 (clone: 5E10) | BD biosciences | Cat# 561558; RRID: AB_10714644 | |
| Anti-human CD13-PE (clone: WM15) | BioLegend | Cat# 301703; RRID: AB_314179 | |
| Anti-human CD33-PE (clone: WM53) | BD biosciences | Cat# 561816; RRID: AB_10896480 | |
| Anti-human CD19-APC (clone: SJ259) | BioLegend | Cat# 363005; RRID: AB_2564127 | |
| Anti-human CD3-APC-Cy7 (clone: SK7) | BD biosciences | Cat# 561800; RRID: AB_10895381 | |
| Anti-human CD45-BV421 (clone: HI30) | BD biosciences | Cat# 563880; RRID:AB_2744402 | |
| Anti-mouse CD45-PE-Cy7 (clone: 30-F11) | BioLegend | Cat# 103114; RRID: AB_312979 | |
| Anti-mouse Ter-119-PE-Cy7 (clone: TER-119) | BD biosciences | Cat# 557853; RRID: AB_396898 | |
| Fc-block (anti-mouse CD16/32) (clone: 2.4-G2) | BD Biosciences | Cat# 553142; RRID: AB_394657 | |
| Phosphate buffered saline | Nacalai Tesque | Cat# 14249-24 | |
| Fetal bovine serum | Thermo Fisher Scientific | Cat# 26140079 | |
| DMEM/F-12 medium | Thermo Fisher Scientific | Cat# 11320-033 | |
| ITS-X | Thermo Fisher Scientific | Cat# 51500056 | |
| Penicillin | Meiji Seika | PGLD755 | |
| Streptomycin sulfate | Meiji Seika | SSDN1013 | |
| Bovine serum albumin | Sigma Aldrich | Cat# A4503 | |
| Sodium palmitate | Tokyo Chemical Industry Co., Ltd. | Cat# P0007 | |
| Sodium oleate | Tokyo Chemical Industry Co., Ltd. | Cat# O0057 | |
| Cholesterol | Tokyo Chemical Industry Co., Ltd. | Cat# C0318 | |
| Ammonium Chloride | Fujifilm | Cat# 017-2995 | |
| Sodium Hydrogen Carbonate | Fujifilm | Cat# 191-01305 | |
| EDTA 2Na | Fujifilm | Cat# 345-01865 | |
| Heparine Na | MOCHIDA PHARMACEUTICAL CO., LTD. | Cat# 224122557 | |
| Sevoflurane | Fujifilm | Cat# 193-17791 | |
| Dextran | Nacalai Tesque | Cat# 10927-54 | |
| Recombinant Human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TPO | PeproTech | Cat# 300-18 | |
| Recombinant human Flt3 ligand | PeproTech | Cat# 300-19 | |
| Propidium iodide | Life Technologies | Cat# P3566 | |
| Flow-Check Fluorospheres | Beckman Coulter | Cat# 7547053 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| AutoMACS Pro | Miltenyi Biotec | N/A | |
| FACS Aria3u | BD Biosciences | N/A | |
| VELVO-CLEAR VS-25 (sonicator) | VELVO-CLEAR | N/A | |
| Nitrogen gas cylinder | KOIKE SANSHO CO., LTD | N/A | |
| Gas regulator | Astec | Cat# IM-055 | |
| Multigas incubator | Astec | Cat# SMA-30DR | |
| Glass tube, 16 mL | Maruemu corporation | N-16 | |
| Glass tube, 50 mL | Maruemu corporation | NX-50 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGPR33RS |
参考文献
- Scala, S., Aiuti, A. In vivo dynamics of human hematopoietic stem cells: novel concepts and future directions. Blood Advances. 3 (12), 1916-1924 (2019).
- Trumpp, A., Essers, M., Wilson, A. Awakening dormant haematopoietic stem cells. Nature Reviews Immunology. 10 (3), 201-209 (2010).
- Laurenti, E., Gottgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Sun, J., et al. Clonal dynamics of native haematopoiesis. Nature. 514 (7522), 322-327 (2014).
- Busch, K., et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature. 518 (7540), 542-546 (2015).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561 (7724), 473-478 (2018).
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25 (9), 2308-2316 (2018).
- Rodriguez-Fraticelli, A. E., et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 553 (7687), 212-216 (2018).
- Pineault, N., Abu-Khader, A. Advances in umbilical cord blood stem cell expansion and clinical translation. Experimental Hematology. 43 (7), 498-513 (2015).
- Wilkinson, A. C., Igarashi, K. J., Nakauchi, H. Haematopoietic stem cell self-renewal in vivo and ex vivo. Nature Reviews Genetics. 21 (9), 541-554 (2020).
- Wagner, J. E., et al. Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell. 18 (1), 144-155 (2016).
- Cohen, S., et al. Hematopoietic stem cell transplantation using single UM171-expanded cord blood: a single-arm, phase 1-2 safety and feasibility study. Lancet Haematology. 7 (2), 134-145 (2020).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Ito, K., Suda, T. Metabolic requirements for the maintenance of self-renewing stem cells. Nature Reviews Molecular Cell Biology. 15 (4), 243-256 (2014).
- Mendelson, A., Frenette, P. S. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nature Medicine. 20 (8), 833-846 (2014).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Xie, W., et al. Detection of molecular targets on the surface of CD34+CD38- bone marrow cells in myelodysplastic syndromes. Cytometry A. 77 (9), 840-848 (2010).
- Wilkinson, A. C., et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature. 571 (7763), 117-121 (2019).
- Bai, T., et al. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine. 25 (10), 1566-1575 (2019).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Kobayashi, H., et al. Environmental Optimization Enables Maintenance of Quiescent Hematopoietic Stem Cells Ex Vivo. Cell Reports. 28 (1), 145-158 (2019).
- Danet, G. H., Pan, Y., Luongo, J. L., Bonnet, D. A., Simon, M. C. Expansion of human SCID-repopulating cells under hypoxic conditions. Journal of Clinical Investigation. 112 (1), 126-135 (2003).
- Kikushige, Y., et al. Human Flt3 is expressed at the hematopoietic stem cell and the granulocyte/macrophage progenitor stages to maintain cell survival. Journal of Immunology. 180 (11), 7358-7367 (2008).
- Ieyasu, A., et al. An All-Recombinant Protein-Based Culture System Specifically Identifies Hematopoietic Stem Cell Maintenance Factors. Stem Cell Reports. 8 (3), 500-508 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved