Method Article
Метод культуры для поддержания тихие человеческие гематопоэтические стволовые клетки
В этой статье
Резюме
Этот протокол позволяет поддержание тихие человеческие гематопоэтические стволовые клетки в пробирке, имитируя микрооквидение костного мозга с использованием обильных жирных кислот, холестерина, более низкие концентрации цитокинов, и гипоксии.
Аннотация
Человеческие гематопоэтические стволовые клетки (ГСК), как и другие млекопитающие ВКС, поддерживают пожизненный гематопоэз в костном мозге. HSCs остаются тихими in vivo, в отличие от более дифференцированных прародителей, и вступают в клеточный цикл быстро после химиотерапии или облучения для лечения травмы костного мозга или культуры in vitro. Имитируя микрооквидение костного мозга в присутствии обильных жирных кислот, холестерина, низкой концентрации цитокинов и гипоксии, ГКС человека поддерживают кияние в пробирке. Здесь описан подробный протокол для поддержания функциональных HSCs в состоянии quiescent in vitro. Этот метод позволит изукомить поведение человека HSCs в физиологических условиях.
Введение
Гематопоэтические стволовые клетки (ГСК) и многопотентные клетки-предшественники (MPPs) координируют формирование резервуара для непрерывного пополнения дифференцированных клеток для поддержания гематопоэза на протяжении всейжизни у человека 1. Сотовый цикл quiescence является важной особенностью HSCs, отличая их от MPPs2. Условно, HSCs, как полагают, находятся на вершине иерархии гематопоэтической системы, производя все дифференцированные клетки крови. Эта иерархическая модель была в основном выведена из трансплантации экспериментов3. Тем не менее, последние исследования показали, что динамика HSCs отличаются в vivo по сравнению с теми, втрансплантации экспериментов 4,5,6,7. Эксперименты по отслеживанию линий с использованием нескольких систем штрих-кодирования показали, что фенотипические murine HSCs не являются уникальным типом клеток, который способствует устойчивому состоянию гематопоеза, и MPPs, которые отображают ограниченную активность самообнажения при трансплантации настройки, непрерывно поставлять зрелыеклетки крови 4,5,8. В отличие от этого, вклад HSCs в зрелые клетки усиливается после травмы костного мозга4. Это может быть связано с резкими изменениями в микроокниронии после абляции костного мозга, включая трансплантацию костного мозга. Хотя применение отслеживания линии murine клеток к клеткам человека трудно, филогенетический анализ, сочетающий одноклеточных полученных колонии изоляции и всего генома секвенирования показали аналогичное свойство гематопоэтического системы, в которой как HSCs и MPPs несут ответственность за ежедневное производство зрелыхклеток 7. Таким образом, хотя трансплантация имеет важное значение для изучения активности мурина или человека HSC, другие экспериментальные модели необходимы, чтобы понять поведение HSCs в физиологических условиях.
Методы культивирования для HSCs были изучены подробно, чтобы понять их клиническое применение и характеристики. Человеческие ГКС могут быть расширены в пробирке с помощью комбинации цитокинов, восстановления внеклеточных матриц, удаления антагонистов самооб обновления, совместной культуры с мезенхимальными или эндотелиальными клетками, добавления альбумин или его замены, трансдукции факторов самооб обновления транскрипции, а также добавления маломоглякулярныхсоединений 9,10. Некоторые из этих методов, в том числе добавление небольших соединений SR111 и UM17112, были протестированы в клинических испытаниях с многообещающими результатами9. Учитывая тихие характер HSCs in vivo, поддержание HSCs с минимальным циклом клеток имеет решающее значение для повторения поведения HSC в пробирке. Куйки и размножающиеся HSCs обладаютдифференциальным клеточным циклом вступления 13,метаболический статус 14, и толерантность против несколькихнапряжений 15 . Методы, используемые для поддержания миокции человеческих HSCs в пробирке ограничены.
Подражая микроокниронированию костного мозга (гипоксического и богатого липидами) и оптимизируя концентрацию цитокинов, ГКС человека могут поддерживаться недифференцированными и тихими в условиях культуры. Повторение тихие характер HSCs in vitro улучшит понимание устойчивых свойств состояния HSCs и позволит экспериментальные манипуляции HSCs.
протокол
Протокол соответствует руководящим принципам Национального центра глобального здравоохранения и медицины. Все экспериментальные процедуры, выполняемые на мышах, одобрены Национальным центром глобального здравоохранения и медицины животных экспериментального комитета.
ПРИМЕЧАНИЕ: Обзор протокола проиллюстрирован на рисунке 1.
1. Липидная подготовка
- Растворить следующие липиды в метаноле в стеклянных трубках при указанных концентрациях: пальмитат натрия, 16 мг/мл; олеат натрия, 30 мг/мл; и холестерин, 4 мг/мл. Храните липидный раствор при -30 градусов по Цельсию и оттаивать образец перед использованием.
- Смешайте липидные растворы, приготовленные в шаге 1.1 в свежей стеклянной трубке в дозах, необходимых для получения окончательной концентрации 100 мкг/мл пальмитата, 100 мкг/мл олеата и 20 мкг/мл холестерина. Например, при подготовке 10 мл культурных средств массовой информации, смешать 62,5 мл пальмового раствора, 33 йл раствора олеата, и 50 мкл холестерина раствора в стеклянной трубке.
- Испарить метанол, передав азотный газ через липидный раствор(рисунок 2A и 2B). Если азотный газ недоступен, пройдите через раствор с помощью пипетки-помощи.
- Полностью испарить оставшийся метанол, нагревая стеклянную трубку в водяной бане при 37 градусов по Цельсию(рисунок 2C).
ПРИМЕЧАНИЕ: Использование высокой концентрации газа N2 в ограниченном пространстве потенциально вредно. Хотя объем, используемый в протоколе для испарения метанола, ограничен и, таким образом, считается безопасным, проветривание помещения надлежащим образом и маркировка областей потенциально высоких концентраций газа N2 имеет важное значение в случае неожиданной утечки газа.
2. Средняя подготовка
- Подготовка Dulbecco модифицированных Eagle среды (DMEM)/F12 среды (с HEPES и глутамина). Добавьте пенициллин и стрептомицин сульфат к средней до конечной концентрации 50 единиц и 50 мкг/мл, соответственно. DMEM/F12 средний, содержащий антибиотики могут храниться при 4 кк, по крайней мере 2 месяца.
- Добавьте 4% w/v из бычьего альбумина сыворотки (BSA) в модифицированную среду Орла Дулбекко (DMEM)/F12 (с HEPES и глутамином).
- Отрегулируйте рН среды до рН 7,4-7,8 с помощью раствора NaOH, как правило, до рН 7,6.
- Добавьте среду к стеклянной трубке, подготовленной в шаге 1. Для достижения решения с максимальной растворимости рекомендуется добавление 3-15 мл среды.
- Полностью растворить липиды с помощью звуковой (оптимальной: более 20 мин звуковой). После того, как BSA и липиды растворяются, образец должен храниться при -80 градусов по Цельсию и использоваться в течение 2 месяцев. Оттепель непосредственно перед использованием.
- Добавьте 1/1000 инсулина, трансферрина, натрия и этанола амина (ITS-X) смесь DMEM/F12. Фильтровать смешанную среду с помощью фильтра 0,22 мкм (обозначенного как "культурные медиа"). Перед использованием добавьте фактор стволовых клеток человека (SCF) и тромбопоэтин человека (TPO) в культурные средства массовой информации при конечной концентрации 3 нг/мл каждый. После добавления цитокинов и ITS-X среда не может храниться.
- Окрашивание буфера: Добавить 10% FCS к Ca- и Mg-бесплатный фосфат буферный солевой раствор (PBS). Это решение может храниться при 4 градусах Цельсия в течение 2 недель.
- Оттепель СМИ: Добавить 10% FCS к DMEM/F12. Это решение является одноразовым.
- Цитокиный фондовый раствор: Растворите каждый человеческий SCF или человека TPO в PBS (Ca- и Mg-free) при 20 мкг/мл. Это решение может храниться при -80 градусов по Цельсию, по крайней мере один год без потери активности. После оттаивания храните раствор бульона при 4 градусах Цельсия и используйте в течение 1 месяца.
ПРИМЕЧАНИЕ: Изучите много после каждой покупки, чтобы избежать изменений в загрязняющих веществ в BSA. Культура HSCs в то же время с различными партиями BSA и изучить фенотипические HSC номер на день 7, как описано ниже. Если пакет BSA показывает низкое количество или частоту клеток CD34 (например, менее половины числа входных ячеек), избегайте использования этой партии.
3. Подготовка костного мозга человека CD34
- Приобрети человеческие CD34и клетки костного мозга и храните клетки в жидком азоте до их использования. Кроме того, клетки костного мозга из здоровых добровольцев или свежих клеток пуповинной крови могут быть использованы после одобрения институтом этического комитета и согласия донора.
- Теплый 10 мл оттаивания средств массовой информации в 15 мл конической трубки в 37 градусов по Цельсию водяной бане.
- Оттепель замороженных клеток во флаконах в 37 градусов по Цельсию водяной бане в течение 2 минут. После вытирания флакона 70% этанола для удаления загрязняющих веществ, перенесите клетки в коническую трубку 15 мл, содержащую предварительно разогретую среду от шага 3.2.
- Центрифуга 15 мл трубки при температуре 200 × в течение 15 минут при комнатной температуре. Аспирировать супернатант тщательно, чтобы сохранить гранулы нетронутыми (оставляя < 50 мкл среды). Переусердуйте клетки с оставшейся средой и перенесите их в трубку 1,5 мл на льду.
ПРИМЕЧАНИЕ: Воздействие образцов, полученных человеком непосредственно в слизистой оболочке, включая глаз или раневых тканей может вызвать инфекцию известных или неизвестных патогенов; таким образом, перчатки и очки рекомендуется при обработке человеческих клеток. Даже если приобретенные клетки CD34и клетки тест отрицательный на вирус гепатита В (HBV), вирус гепатита С (ВГС) и вирус иммунодефицита человека 1 (HIV1), тщательный мониторинг должен быть проведен в соответствии с институциональными руководящими принципами, если происходит заболеваемость воздействием. Следуйте институциональным руководящим принципам при утилизации материалов, подвергшихся воздействию клеток человека.
4. Сортировка HSCs
- Этикетка клеток с фторхром-конъюгированных антител. Смешайте 50 л буфера окрашивания плюс 10 л анти-CD34-FITC, 2 л анти-CD38-PerCP-Cy5.5, 5 л анти-CD90-PE-Cy7 и 10 л анти-CD45RA-PE. Повторное использование клеточных гранул в смеси антител. Инкубировать клетки в течение 30 мин при 4 градусов по Цельсию в темноте.
- Добавьте 1 мл буфера окрашивания для мытья антител. Центрифуга труб при 340 градусах × в течение 5 мин при 4 градусах Цельсия. Отбросьте супернатант.
- Повторное увеличение клеточной гранулы в 0,5 мл буфера окрашивания и 0,1% йодида пропидия. Перенесите подвеску в трубку 5 мл с помощью 40 мкм фильтра.
- Ворота фенотипических HSCs в пределахPI - CD34иCD38 - CD90иCD45RA - фракцияс использованием FACS Aria-IIIu и сортировать клетки в 1,5 мл трубки заполнены 500 йл культурных средств массовой информации (Рисунок 3). Используя стратегию gating, показанную на рисунке 3,10% клеток CD34, как ожидается, будут фенотипическими HSCs. Запикайте отсортированное число ячеек для расчета объема мультимедиа для повторного перерасхода ячеек в шаге 5.3.
ПРИМЕЧАНИЕ: Gating стратегия выполняется, как описано ранее16 при опуская линии маркера окрашивания с учетом низкого выражения маркеров линии в CD34-CD38- фракция от здоровыхлюдей 17 . - Центрифуга отсортированных клеток при 340 × в течение 5 мин при 4 градусов по Цельсию и отбросить супернатант. Тщательно аспирировать супернатант, чтобы гарантировать, что гранулы остаются нетронутыми.
- Храните отсортированную клетку на льду до культуры.
ПРИМЕЧАНИЕ: Во время первого эксперимента должна быть выполнена компенсация флуоресценции спектрального перекрытия.
5. Культура клеток
- Передача 200 МКЛ культурных средств массовой информации, содержащих цитокины, подготовленные в шаге 2 в плоский нижний 96-хорошо пластин.
- Чтобы избежать испарения среды, заполните все неиспользованные скважины 100-200 МЛ PBS.
- Повторное сортировка отсортированных ГКС в культурных средах без цитокинов на уровне 60 клеток/ОЛ.
- Aliquot 600 HSCs/well (10 МКЛ клеточной подвески) в каждую колодец. Номер ячейки может быть изменен. Менее 300 клеток приведет к большим техническим изменениям, и, таким образом, для обнаружения биологических различий требуется больше скважин в единицу состояния. Культивирования более 1000 клеток в одной колодец следует избегать из-за лишения цитокинов/питательных веществ или накопления неблагоприятных цитокинов/хемокиных.
- Культура клеток в увлажненные мульти-газового инкубатора при 37 градусов по Цельсию в 5% CO2 и 1% O2 атмосферы.
- Для культур старше 7 дней рекомендуется заменить половину объема мультимедиа каждые 3-4 дня. Тщательно аспирировать 100 йл средств массовой информации путем трубопроводов и добавить 100 йл вновь подготовленных средств культуры, содержащих цитокины к каждой хорошо. Культурные средства массовой информации должны быть предварительно разогреты при 37 градусов по Цельсию.
6. Анализ маркерных фенотипов с использованием цитометрии потока
ПРИМЕЧАНИЕ: Хотя клетки должны быть проанализированы после 7 дней культуры, продолжительность культуры может быть изменена.
- Отбросьте 170 МКЛ среды с помощью 8-канального пипетки.
- Этикетка клеток с антителами смеси. Смешайте 0,5 л анти-CD34-FITC, 0,1 л анти-CD38-PerCP-Cy5.5, 0,25 л анти-CD90-PE-Cy7, 0,5 л анти-CD45RA-PE и 9 йл окрашивания буфера на колодец. Добавьте 10 мкл смеси в пластину 96-колодец и инкубировать клетки в течение 30 мин при 4 градусах цельсия в темноте.
- Чтобы промыть антитела, добавьте 100 МКЛ буфера окрашивания в скважины и центрифуга пластин при 400 × г в течение 5 мин при 4 градусах Цельсия с использованием низкого ускорения и среднего замедления.
- Тщательно аспирировать 100 МКЛ супернатанта для поддержания клеток на дне скважин, затем повторно использовать клетки в 200 МКЛ окрашивания буфера 0,1% v/v PI и 1% v/v флуоресцентных микросфер (например, Flow-Check Fluorospheres).
- Настройка инструмента цитометрии потока. Получение данных для образцов в быстром режиме со смешанным режимом выборки и объемы поглощения 100 КЛ.
- Экспортируйте данные в формате FCS и анализируйте их с помощью программного обеспечения, такого как FlowJo. Номера клеток можно определить с помощью флуоресцентного количества шариков микросферы. Например, если исследователь добавляет 2000 бусинок на колодец, а количество шариков составляет 700, умножьте количество клеток каждой фракции на 2000/700, чтобы оценить общее количество клеток фракции в колодец.
ПРИМЕЧАНИЕ: Флуоресцентные микросферы токсичны для культурных клеток из-за присутствия формальдегида. Это может привести к гибели клеток во время анализа. Свести к минимуму количество скважин (<50 скважин), анализируемых непрерывно, чтобы избежать смещения.
7. Трансплантация человеческих ГКС
ПРИМЕЧАНИЕ: Активность перенаселения культурных клеток подтверждается трансплантацией иммунодефицитным мышам. Все процедуры должны быть одобрены комитетами по экспериментам на животных или их эквивалентами.
- В качестве доноров подготовь достаточное количество 8-12-недельных иммунодефицитных мышей NOD-SCID-Il2rg-null (NOG). Как NOG мышей очень восприимчивы к инфекции, держать размножения клетки как можно более чистыми и кормить мышей с стерилизованной диеты и воды.
- Культура достаточное количество HSCs для трансплантации, как описано в шаге 5. Например, когда 5000 HSCs (эквивалент дня 0) пересажены 6 мышам-реципиентам, культура 35,000-40,000 HSCs в 40 скважинах плиты 96-наилучшим образом (200 qL средств культуры в наилучшим образом) или в 8 скважинах плиты 24-наилучшим образом (1 mL средств культуры в наилучшим образом). Культура клеток в течение 2 недель с половиной медиа изменения каждые 3-4 дня в увлажненной мульти-газового инкубатора при 37 градусов по Цельсию с 5% CO2 и 1% O2. Продолжительность культуры может быть изменена.
- Облучение мышей NOG на 2,5 Г.г. при 6-24 ч до трансплантации.
- Соберите культурные HSCs в 1,5 мл труб. Центрифуга труб при 340 градусах ×в течение 5 мин при 4 градусов по Цельсию.
- Тщательно аспирировать супернатанты и повторно использовать клетки в стерильных ледяного окрашивания буфера при плотности клеток 5000 HSCs (день 0 эквивалент) на 200 йл. Передача этой подвески на 3 мл полипропиленные трубки. Чтобы стерилизовать буфер окрашивания, отфильтруйте его с помощью фильтра 0,22 мкм.
- Перед трансплантацией обезболивать мышей путем вдыхания севофлюрана или изофлюрана.
- Для пересадки 5000 культурных HSCs (эквивалент дня 0), ввиснуть 200 МКЛ клеточной подвески в хвостовую вену или ретро орбитальной пазухи мышей NOG облученных в шаге 7.1 с помощью 1 мл шприца и 27-го калибра иглы. Свежеиспеченные или размороженные ГКС костного мозга могут быть пересажены в качестве контроля. Перчатки должны быть стерилизованы с 70% V / V этанола между каждой процедурой.
8. Анализ частоты клеток, полученных человеком в периферической крови
- Чтобы изучить перенаселенность клеток человека, соберите периферическую кровь на 1, 2 и 3 месяца после трансплантации.
- Перед сбором периферической крови, анестезировать мышей путем вдыхания севофлюран.
- Соберите 40-80 МКЛ периферической крови из ретро-орбитальной пазухи с помощью гепаринизированных стеклянных капиллярных трубок и приостановите этот образец в 1 мл PBS и гепарин (1 U/mL) в трубах 1,5 мл.
- Центрифуга суспензии крови при 340 × в течение 3 мин при 4 градусах Цельсия. Откажитесь от супернатанта и повторно посовелайте гранулы в 1 мл PBS 1,2% ж/в декстран (200 кДа) в течение 45 мин при комнатной температуре.
- Перенесите супернатант еще на 1,5 мл трубки и центрифуги при 340 × в течение 3 мин.
- Для лиза красных кровяных телец, повторное течение клеток в 0,17 M NH4Cl в течение 5 мин.
- Центрифуга клеточной суспензии 340 × в течение 3 мин при 4 градусах Цельсия. Повторное посынище клетки в 50 МКЛ окрашивания буфера, содержащего 0,3 МЛ анти-мышь Fc-блок. Инкубация этого образца при 4 градусов по Цельсию в течение 5 мин.
- Добавьте следующие антитела для окрашивания поверхностных маркеров: 0,3 МЛ мыши CD45-PE-Cy7, мышь Ter-119-PE-Cy7, 0,3 МЛ человека CD45-BV421, 0,3 МЛ человека CD13-PE, 1,2 МЛ человека CD33-PE, 0,3 МЛ человека CD19-APC, 0,3 мл человека CD3-APC-Cy7. Инкубировать клетки при 4 градусов по Цельсию в течение 15 мин.
- Вымойте один раз с 1 мл окрашивания буфера и центрифуги при 340 × в течение 5 мин при 4 градусов по Цельсию.
- Отбросьте супернатант и ассизент клетки в 200 йл окрашивания буфера 0,1% V / V PI.
- Перенесите подвеску ячейки на 96-хорошо плоскую нижнюю пластину и приобретайте данные с помощью цитометра потока в быстром режиме с режимом образца смеси и объемом поглощения 100 йл.
- Экспорт данных в формате FCS для анализа с использованием программного обеспечения, такого как FlowJo.
- Настройка цитометра потока. Приобретайте данные для образцов в быстром режиме с режимом образца смеси и объемом поглощения 100 йл.
- Экспорт данных в формате FCS для анализа с использованием программного обеспечения, такого как FlowJo.
Результаты
После 7 дней культивирования очищенных HSCs, до 80% клеток отображаютсямаркер фенотипы CD34 и CD38- ( Рисунок 4A). Общее количество клеток зависело от концентрации цитокинов(рисунок 4B). Более высокие концентрации SCF и TPO индуцированных вступления в клеточный цикл, пролиферации и дифференциации (рисунок 4B). Количество фенотипических ГСК, характеризующихся маркерными фенотипамиCD34и CD38 - CD90иCD45RA -увеличилось пропорционально концентрациям SCF или TPO(рисунок 4B), в товремя как частота среди общих клеток уменьшилась(рисунок 4C). Общее число ячеек было равным в комбинациях SCF 1,5 нг/мл и 4 нг/мл TPO и 3 ng/mL SCF 3 и 2 ng/mL TPO, что свидетельствует о том, что HSCs являются тихими при минимальной активации клеточного цикла. Учитывая индивидуальные различия, цитокины titration рекомендуется для каждого донора костного мозга.
После 3 месяцев трансплантации культурных взрослых костного мозга HSCs, восстановление может быть оценена как их частота в периферической крови человека CD45 "мурин CD45- Ter119-клеток. Три линии, включая CD19 "В-клеток, CD13/CD33" миелоидных клеток, и CD3 "Т-клеток были восстановлены в NOG мышей пересажены либо только что оттаяли HSCs или культурных HSCs (Рисунок 5).
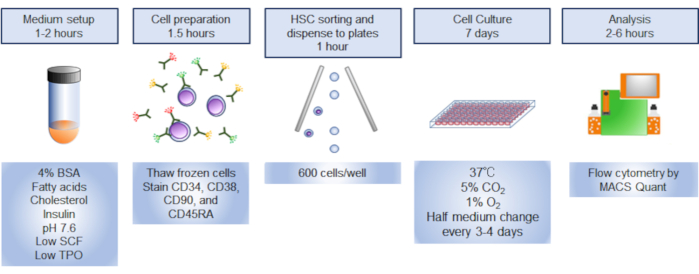
Рисунок 1. Обзор процедуры. Графическое резюме процедуры включало сортировку, культивирование и анализ гематопоэтических стволовых клеток человека (HSCs). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
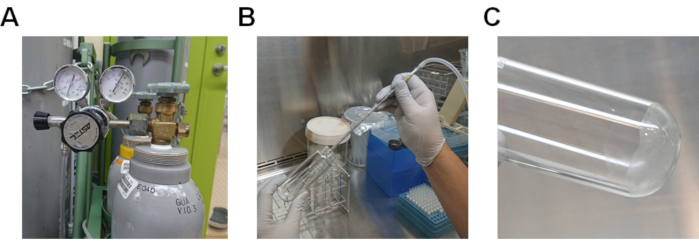
Рисунок 2. Процедура испарения метанола из липидного раствора. A) Газовый баллон с газовым регулятором. B) Процедура передачи азотного газа через липидный раствор, растворенный в метаноле. C) Липиды, прилипающие к нижней части стеклянной трубки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3. Стратегия Гэтинга для сортировки HSCs. Сюжеты показывают закрытые CD34иCD38-CD90иCD45RA- ячейки. Приблизительно 10% клеток CD34были фенотипическими HSCs. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
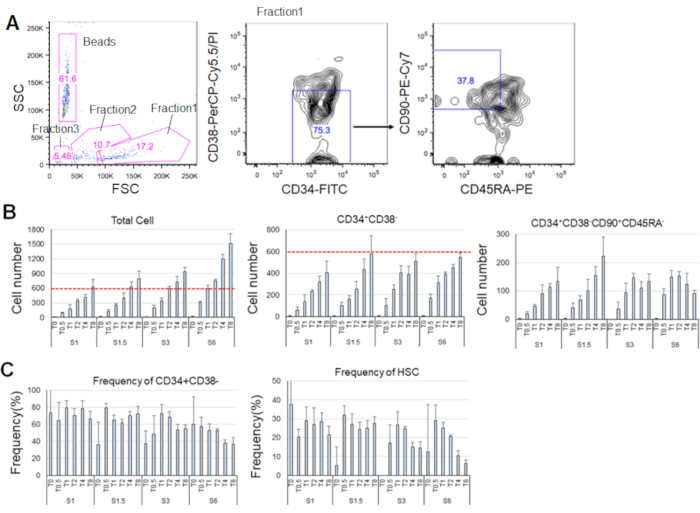
Рисунок 4. Представитель номера клеток после 7 дней культивирования. A) Представитель флуоресценции активированных клеток сортировки участка после культивирования HSCs в SCF (3 нг/мл) и TPO (2 нг/мл). Фракция 1 была обогащена для живых клеток, фракция 2 была обогащена для мертвых клеток, и фракция 3 была обогащена для мусора. Числа, окрашенные в розовый цвет, указывают на частоту (%) закрытой фракции. B) Количество всех HSCs,CD34и CD38- клетки, и CD34- CD38 - CD90иCD45RA -клетки после культивирования 600 HSCs в указанных условиях цитокинов. Красные пунктичные линии указывают на начальное количество входных ячеек. С: СКФ, Т: ТПО. Среднее ± стандартное отклонение, n No 4. Цифры, следующие за S и T, указывают на концентрацию (нг/мл) каждого цитокина. C) Частота CD34иCD38 - и CD34- CD38 - CD90-CD45RA- клетки в условиях указанного цитокина. С: СКФ, Т: ТПО. Среднее ± стандартное отклонение, n No 4. Бары ошибок для ячеек, обучтено в SCF (1 нг/мл) и TPO (0 нг/мл), были опущены из-за их высоких значений (37,7 и 47,9 соответственно). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
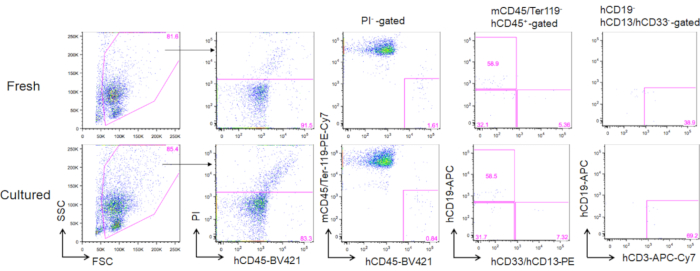
Рисунок 5. Представитель FACS участки донорских мышей после 3 месяцев трансплантации. В общей сложности 5000 свежеоттая (верхние панели) и 2-недельные культурные HSCs (3 нг/мл SCF и 3 нг/мл TPO; нижние панели) были пересажены в NOG мышей. hCD19 отмечает клетки B человека, hCD13 и hCD33 отмечают человеческие миелоидные клетки, а hCD3 отмечает Т-клетки человека. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В последнее время было зарегистрировано несколько методов расширения ГХК сминимальной дифференциацией 18,19,20,21. Хотя эти методы превосходны, HSCs вынуждены активировать свои клеточные циклы в присутствии высоких уровней цитокинов, что отличается от ситуации in vivo, в которой HSCs показывают минимальный цикл. Этот протокол полезен для поддержания HSCs как тихие, как наблюдается in vivo, путем повторения микроокноронности костного мозга.
Путем культивирования человеческих HSCs под низким содержанием цитокинов, богатых липидами и гипоксических условиях, HSCs показали минимальную езду на велосипеде, сохраняя при этом свои маркерные фенотипы. Критическим шагом в этом протоколе является подготовка среды, содержащей высокую концентрацию жирных кислот и холестерина и низкие концентрации цитокинов и культуры при гипоксии (Шаг 1, Шаг 2 и Шаг 4). Без холестерина и/или жирных кислот уровень содержания ВКС при низких концентрациях цитокинов снижаетсяна 22. Культивирование клеток в гипоксических условиях также важно, как сообщалось ранее23.
Условия культуры были аналогичны условиям, используемым для мурин HSCs, за исключением концентраций цитокинов. Murine HSCs выживают без TPO, в то время как человеческие HSCs требуют по крайней мере 2 нг/мл TPO с 3 нг/мл SCF22. Поскольку концентрация ТПО намного выше, чем в сыворотке крови человека (100 пг/мл), условия, используемые в этом протоколе, могут быть отсутствуют конкретные факторы для поддержки выживания человека HSCs. FLT3 выражается на человека HSCs24. Добавление его лиганд FLT3LG немного снижает потребность в TPO для поддержания HSCs22.
Человеческие ГКС требуют более высоких концентраций холестерина по сравнению с мурин HSCs, предположительно из-за неспособности вызвать выражение холестерина синтеза ферментов и восприимчивость к липопоксии при высоких концентрациях (> 400 мкг / мл) жирных кислот22. Хотя только сочетание пальмитических, олеитовых, линолевых и стеарный кислот был протестирован, которые в изобилии находятся в сыворотке крови человека, другие комбинации липидов должны быть оценены, чтобы уменьшить липоптоксичность и улучшить скорость поддержания функциональных HSCs.
Хотя активность перенаселения культурных человеческих HSCs у иммунодефицитных мышей после двух недель культуры былаподтверждена 22, эта система культуры не полностью резюмировать нишевые функции HSCs in vivo. Выражение CD45RA, как сообщается, увеличивается, и способность к перенаселению уступает свеже отсортированной HSCs22. Тем не менее, концентрации питательных веществ, таких как глюкоза, аминокислоты, пируват и инсулин, которые добавляются в среду на супрафизиологических уровнях, могут быть оптимизированы. Загрязнения в BSA также могут поставить под угрозу обслуживание HSCs18,25. Кроме того, некоторые культурные клетки подвергаются клеточной смерти, в то время как другие подвергаются клеточной деления; таким образом, содержание общего числа ячеев не может указывать на состояние тихие лампы каждой ячейки.
Несмотря на эти ограничения, культурные условия, описанные в протоколе, разработанном в данном исследовании, помогут продвинуть исследования и инженерные исследования ВКС, особенно в почти физиологических условиях. Культурные условия, которые поддерживают ГКС с минимальной дифференциацией и велосипедной активностью, были бы пригодны для тестирования биологических и химических соединений, специально действующих на ГКС, манипулирования ГКС с помощью лентивирусной трансдукции или редактирования генома без потери ствола, а также для выяснения первоначального этапа трансформации, вызванной генами, связанными с лейкемией.
Раскрытие информации
Авторы заявляют об отсутствие конфликта интересов, связанного с этим исследованием.
Благодарности
Мы благодарим М. Харагути и С. Тамаки за техническую поддержку и лабораторное управление, а также К. Широшиту за фотографирование. HK была частично поддержана грантом KAKENHI от MEXT/JSPS (грант No 19K17847) и Национальным центром глобального здравоохранения и медицины. КТ была частично поддержана грантами KAKENHI от MEXT/JSPS (грант No 18H02845 и 18K19570), Национальным центром глобального здравоохранения и медицины (грант No 26-001 и 19A2002), AMED (грант No. JP18ck0106444, JP18ae0201014 и JP20bm0704042), Фонд медицинских исследований Ono, Фонд медицинских исследований Кандавы и Научный фонд Такеды.
Материалы
| Name | Company | Catalog Number | Comments |
| Human bone marrow CD34+ progenitor cells | Lonza | 2M-101C | |
| NOD/Shi-scid,IL-2RγKO Jic | In-Vivo Science Inc. | https://www.invivoscience.com/en/nog_mouse.html | |
| Anti-human CD34-FITC (clone: 581) | BD biosciences | Cat# 560942; RRID: AB_10562559 | |
| Anti-human CD38-PerCP-Cy5.5 | BD biosciences | Cat# 551400; RRID: AB_394184 | |
| Anti-human CD45RA-PE | BD biosciences | Cat# 555489; RRID: AB_395880 | |
| Anti-human CD90-PE-Cy7 (clone: 5E10) | BD biosciences | Cat# 561558; RRID: AB_10714644 | |
| Anti-human CD13-PE (clone: WM15) | BioLegend | Cat# 301703; RRID: AB_314179 | |
| Anti-human CD33-PE (clone: WM53) | BD biosciences | Cat# 561816; RRID: AB_10896480 | |
| Anti-human CD19-APC (clone: SJ259) | BioLegend | Cat# 363005; RRID: AB_2564127 | |
| Anti-human CD3-APC-Cy7 (clone: SK7) | BD biosciences | Cat# 561800; RRID: AB_10895381 | |
| Anti-human CD45-BV421 (clone: HI30) | BD biosciences | Cat# 563880; RRID:AB_2744402 | |
| Anti-mouse CD45-PE-Cy7 (clone: 30-F11) | BioLegend | Cat# 103114; RRID: AB_312979 | |
| Anti-mouse Ter-119-PE-Cy7 (clone: TER-119) | BD biosciences | Cat# 557853; RRID: AB_396898 | |
| Fc-block (anti-mouse CD16/32) (clone: 2.4-G2) | BD Biosciences | Cat# 553142; RRID: AB_394657 | |
| Phosphate buffered saline | Nacalai Tesque | Cat# 14249-24 | |
| Fetal bovine serum | Thermo Fisher Scientific | Cat# 26140079 | |
| DMEM/F-12 medium | Thermo Fisher Scientific | Cat# 11320-033 | |
| ITS-X | Thermo Fisher Scientific | Cat# 51500056 | |
| Penicillin | Meiji Seika | PGLD755 | |
| Streptomycin sulfate | Meiji Seika | SSDN1013 | |
| Bovine serum albumin | Sigma Aldrich | Cat# A4503 | |
| Sodium palmitate | Tokyo Chemical Industry Co., Ltd. | Cat# P0007 | |
| Sodium oleate | Tokyo Chemical Industry Co., Ltd. | Cat# O0057 | |
| Cholesterol | Tokyo Chemical Industry Co., Ltd. | Cat# C0318 | |
| Ammonium Chloride | Fujifilm | Cat# 017-2995 | |
| Sodium Hydrogen Carbonate | Fujifilm | Cat# 191-01305 | |
| EDTA 2Na | Fujifilm | Cat# 345-01865 | |
| Heparine Na | MOCHIDA PHARMACEUTICAL CO., LTD. | Cat# 224122557 | |
| Sevoflurane | Fujifilm | Cat# 193-17791 | |
| Dextran | Nacalai Tesque | Cat# 10927-54 | |
| Recombinant Human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TPO | PeproTech | Cat# 300-18 | |
| Recombinant human Flt3 ligand | PeproTech | Cat# 300-19 | |
| Propidium iodide | Life Technologies | Cat# P3566 | |
| Flow-Check Fluorospheres | Beckman Coulter | Cat# 7547053 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| AutoMACS Pro | Miltenyi Biotec | N/A | |
| FACS Aria3u | BD Biosciences | N/A | |
| VELVO-CLEAR VS-25 (sonicator) | VELVO-CLEAR | N/A | |
| Nitrogen gas cylinder | KOIKE SANSHO CO., LTD | N/A | |
| Gas regulator | Astec | Cat# IM-055 | |
| Multigas incubator | Astec | Cat# SMA-30DR | |
| Glass tube, 16 mL | Maruemu corporation | N-16 | |
| Glass tube, 50 mL | Maruemu corporation | NX-50 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGPR33RS |
Ссылки
- Scala, S., Aiuti, A. In vivo dynamics of human hematopoietic stem cells: novel concepts and future directions. Blood Advances. 3 (12), 1916-1924 (2019).
- Trumpp, A., Essers, M., Wilson, A. Awakening dormant haematopoietic stem cells. Nature Reviews Immunology. 10 (3), 201-209 (2010).
- Laurenti, E., Gottgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Sun, J., et al. Clonal dynamics of native haematopoiesis. Nature. 514 (7522), 322-327 (2014).
- Busch, K., et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature. 518 (7540), 542-546 (2015).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561 (7724), 473-478 (2018).
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25 (9), 2308-2316 (2018).
- Rodriguez-Fraticelli, A. E., et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 553 (7687), 212-216 (2018).
- Pineault, N., Abu-Khader, A. Advances in umbilical cord blood stem cell expansion and clinical translation. Experimental Hematology. 43 (7), 498-513 (2015).
- Wilkinson, A. C., Igarashi, K. J., Nakauchi, H. Haematopoietic stem cell self-renewal in vivo and ex vivo. Nature Reviews Genetics. 21 (9), 541-554 (2020).
- Wagner, J. E., et al. Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell. 18 (1), 144-155 (2016).
- Cohen, S., et al. Hematopoietic stem cell transplantation using single UM171-expanded cord blood: a single-arm, phase 1-2 safety and feasibility study. Lancet Haematology. 7 (2), 134-145 (2020).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Ito, K., Suda, T. Metabolic requirements for the maintenance of self-renewing stem cells. Nature Reviews Molecular Cell Biology. 15 (4), 243-256 (2014).
- Mendelson, A., Frenette, P. S. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nature Medicine. 20 (8), 833-846 (2014).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Xie, W., et al. Detection of molecular targets on the surface of CD34+CD38- bone marrow cells in myelodysplastic syndromes. Cytometry A. 77 (9), 840-848 (2010).
- Wilkinson, A. C., et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature. 571 (7763), 117-121 (2019).
- Bai, T., et al. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine. 25 (10), 1566-1575 (2019).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Kobayashi, H., et al. Environmental Optimization Enables Maintenance of Quiescent Hematopoietic Stem Cells Ex Vivo. Cell Reports. 28 (1), 145-158 (2019).
- Danet, G. H., Pan, Y., Luongo, J. L., Bonnet, D. A., Simon, M. C. Expansion of human SCID-repopulating cells under hypoxic conditions. Journal of Clinical Investigation. 112 (1), 126-135 (2003).
- Kikushige, Y., et al. Human Flt3 is expressed at the hematopoietic stem cell and the granulocyte/macrophage progenitor stages to maintain cell survival. Journal of Immunology. 180 (11), 7358-7367 (2008).
- Ieyasu, A., et al. An All-Recombinant Protein-Based Culture System Specifically Identifies Hematopoietic Stem Cell Maintenance Factors. Stem Cell Reports. 8 (3), 500-508 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены