Method Article
Sessiz İnsan Hematopoetik Kök Hücrelerini Korumak İçin Bir Kültür Yöntemi
Bu Makalede
Özet
Bu protokol, bol miktarda yağ asidi, kolesterol, daha düşük sitokin konsantrasyonları ve hipoksi kullanarak kemik iliği mikroçevrimini taklit ederek sessiz insan hematopoetik kök hücrelerinin in vitro olarak korunmasını sağlar.
Özet
İnsan hematopoetik kök hücreleri (HSC'ler), diğer memeli HSC'ler gibi, kemik iliğinde ömür boyu hematopoez tutar. HSC'ler, daha farklılaştırılmış ataların aksine, in vivo olarak sessiz kalır ve kemik iliği yaralanmasını veya in vitro kültürünü tedavi etmek için kemoterapi veya ışınlamadan sonra hücre döngüsüne hızla girer. Bol yağ asitleri, kolesterol, düşük sitokin konsantrasyonu ve hipoksi varlığında kemik iliği mikroçevrimini taklit ederek, insan HSC'leri sessiz in vitro korur. Burada, sessiz durumdaki in vitroda fonksiyonel HSC'lerin korunması için ayrıntılı bir protokol açıklanmıştır. Bu yöntem, insan HSC'lerinin fizyolojik koşullar altında davranışlarının çalışmasını sağlayacaktır.
Giriş
Hematopoetik kök hücreler (HSC'ler) ve çok güçlü progenitör hücreler (MPP'ler), insanlarda yaşam boyunca hematopoez sağlamak için farklılaştırılmış hücrelerin sürekli yenilenmesi için koordineli bir rezervuar oluşturur1. Hücre döngüsü sessize almalarını, HSC'leriMPP'lerdenayıran önemli bir özelliktir 2 . Geleneksel olarak, HSC'lerin hematopoetik sistemin hiyerarşisinin tepe noktasında yer alan ve tüm farklılaştırılmış kan hücrelerini üreten olduğu düşünülmektedir. Bu hiyerarşik model çoğunlukla transplantasyon deneylerinden elde edildi3. Bununla birlikte, son çalışmalar HSC'lerin dinamiklerinin in vivo'da transplantasyon deneylerine göre farklılık gösterdiğini belirtmiştir4,5,6,7. Birkaç barkodlama sistemi kullanılarak yapılan soy izleme deneyleri, fenotipik murine HSC'lerin sabit durum hematopoezine katkıda bulunan benzersiz bir hücre tipi olmadığını ve transplantasyon ayarlarında sınırlı kendini yenileme aktivitesi gösteren MPP'lerin sürekli olarak olgun kan hücrelerini4,5,8sağladığını ortaya koydu. Buna karşılık, HSC'lerin olgun hücrelere katkısı kemik iliği yaralanmasından sonra geliştirilmiştir4. Bu, kemik iliği nakli de dahil olmak üzere kemik iliği ablasyonunu takiben mikroçevrinde ciddi değişikliklere bağlanabilir. Murin hücrelerinin insan hücrelerine soy izlemenin uygulanması zor olsa da, tek hücreli türevi koloni izolasyonu ve tüm genom dizilimini birleştiren filogenetik analiz, hemAtomopetik sistemin benzer bir özelliğini ortaya çıkardı, hem HSC'lerin hem de MPP'lerin olgun hücrelerin günlük üretiminden sorumlu olduğu7. Bu nedenle, murin veya insan HSC aktivitesinin incelenmesi için transplantasyon şart olsa da, HSC'lerin fizyolojik koşullar altındaki davranışlarını anlamak için diğer deneysel modellere ihtiyaç vardır.
HSC'ler için kült yöntemler, klinik uygulamalarını ve özelliklerini anlamak için ayrıntılı olarak incelenmiştir. İnsan HSC'leri sitokinlerin bir kombinasyonu, hücre dışı matrislerin yeniden uzlaştırılması, kendini yenileme antagonistlerinin uzaklaştırılması, mezenkimal veya endotel hücreleri ile ortak kültür, albümin veya değiştirilmesi, kendi kendini yenileme transkripsiyon faktörlerinin transdüksiyonu ve küçük moleküllü bileşiklerin eklenmesikullanılarakin vitro olarak genişletilebilir 9,10. SR111 ve UM17112küçük bileşiklerinin eklenmesi de dahil olmak üzere bu yöntemlerden bazıları, umut verici sonuçlarla klinik çalışmalarda test edilmiştir9. HSC'lerin sessiz doğası göz önüne alındığında, HSC'lerin minimum hücre döngüsü ile korunması, HSC davranışının in vitro olarak yeniden yakalanması için kritik öneme sahiptir. Sessiz ve çoğalan HSC'ler diferansiyel hücre döngüsü girişi13, metabolik durum14ve birden fazla gerilmelere karşı tolerans15 . İn vitro insan HSC'lerinin sessizliğini korumak için kullanılan yöntemler sınırlıdır.
Kemik iliğinin mikroçevrimi (hipoksik ve lipitler bakımından zengin) taklit edilerek ve sitokin konsantrasyonunun optimize edilmesiyle, insan HSC'leri kültür altında farklılaşmamış ve sessiz tutulabilir. HSC'lerin sessiz doğasının in vitro olarak yeniden ele alınması, HSC'lerin sabit durum özelliklerinin anlaşılmasını geliştirecek ve HSC'lerin deneysel manipülasyonunu sağlayacaktır.
Protokol
Protokol, Ulusal Küresel Sağlık ve Tıp Merkezi'nin yönergelerine uyar. Fareler üzerinde yapılan tüm deneysel prosedürler Ulusal Küresel Sağlık ve Tıp Merkezi hayvan deney komitesi tarafından onaylanmıştır.
NOT: Protokole genel bir bakış Şekil 1'de gösterilmiştir.
1. Lipid hazırlığı
- Aşağıdaki lipitleri belirtilen konsantrasyonlarda cam tüplerde metanolde çözün: sodyum palmitat, 16 mg / mL; sodyum oleat, 30 mg/mL; ve kolesterol, 4 mg/ mL. Lipid çözeltisini -30 °C'de saklayın ve kullanmadan önce numuneyi çözün.
- 1.1. adımda hazırlanan lipid çözeltilerini, 100 μg/mL palmitat, 100 μg/mL oleat ve 20 μg/mL kolesterolün son konsantrasyonunu elde etmek için gerekli dozlarda taze bir cam tüpte karıştırın. Örneğin, 10 mL kültür ortamı hazırlarken, cam tüpte 62,5 μL palmitat çözeltisi, 33 μL oleat çözeltisi ve 50 μL kolesterol çözeltisini karıştırın.
- Azot gazını lipit çözeltisi(Şekil 2A ve 2B)ile geçirerek metanol buharlaştırın. Azot gazı yoksa, pipet yardımı kullanarak çözeltiden hava geçirin.
- Cam tüpü 37 °C'de bir su banyosunda ısıtarak kalan metanolleri tamamenbuharlaştır (Şekil 2C).
NOT: Kapalı alanda yüksek konsantrasyondaN 2 gazı kullanımı potansiyel olarak zararlıdır. Metanol buharlaşmak için protokolde kullanılan hacim sınırlı olmasına ve bu nedenle güvenli olarak kabul edilmesine rağmen, beklenmedik bir gaz sızıntısı meydana gelmesi durumunda odanın yeterince havalandırılması ve potansiyel olarak yüksek konsantrasyonlarda N2 gazının etiketlenme alanları önemlidir.
2. Orta hazırlık
- Dulbecco'nun modifiye Eagle orta (DMEM)/F12 ortamını (HEPES ve glutamin ile) hazırlayın. Orta ila son konsantrasyona sırasıyla 50 birim ve 50 μg/ mL'lik penisilin ve streptomisin sülfat ekleyin. Antibiyotik içeren DMEM/F12 ortamı en az 2 ay boyunca 4 °C'de saklanabilir.
- Dulbecco'nun modifiye Eagle ortamına (DMEM)/F12 ortamına (HEPES ve glutamin ile) %4 w/v sığır serum albümini (BSA) ekleyin.
- NaOH çözümünü kullanarak ortamın pH'ını pH 7.4-7.8'e ayarlayın, genellikle pH 7.6'ya ayarlayın.
- 1. adımda hazırlanan cam boruya ortamı ekleyin. Maksimum çözünürlüğe sahip bir çözüm elde etmek için 3-15 mL ortam eklenmesi önerilir.
- Lipitleri sonication ile tamamen çözün (optimal: 20 dakikadan fazla sonication). BSA ve lipitler çözüldükten sonra, numune -80 °C'de saklanmalı ve 2 ay içinde kullanılmalıdır. Kullanmadan hemen önce çözün.
- DMEM/F12'ye insülin, transferrin, sodyum selenit ve etanol amin (ITS-X) karışımının 1/1.000'ini ekleyin. Karışık ortamı 0,22 μm filtre kullanarak filtreleyin ("kültür ortamı" olarak belirlenmiştir). Kullanmadan önce, kültür ortamına her biri 3 ng/mL'lik son konsantrasyonda insan kök hücre faktörü (SCF) ve insan trombopoietin (TPO) ekleyin. Sitokinler ve ITS-X ekledikten sonra ortam depolanamaz.
- Boyama tamponu: Ca ve Mg içermeyen fosfat tamponlu saline (PBS) %10 FCS ekleyin. Bu çözelti 2 hafta boyunca 4 °C'de saklanabilir.
- Çözülmüş ortam: DMEM/F12'ye %10 FCS ekleyin. Bu çözüm tek kullanımlıktır.
- Sitokin stok çözeltisi: Her bir insan SCF'sini veya insan TPO'larını PBS'de (Ca- ve Mg-free) 20 μg/ mL'de çözün. Bu çözelti -80 °C'de aktivite kaybı olmadan en az bir yıl saklanabilir. Çözdükten sonra, stok çözeltisini 4 °C'de saklayın ve 1 ay içinde kullanın.
NOT: BSA'daki kirleticilerin değişimini önlemek için her satın alma işleminden sonra lotu inceleyin. Farklı BSA partileri ile aynı anda kültür HSC'leri ve aşağıda açıklandığı gibi 7. BSA toplu işlemi CD34+ hücrelerinin düşük bir sayısını veya sıklığını gösteriyorsa (örneğin, giriş hücresi sayısının yarısından az), bu toplu işlemi kullanmaktan kaçının.
3. İnsan kemik iliği CD34+ hücrelerinin hazırlanması
- İnsan CD34+ kemik iliği hücreleri satın alın ve hücreleri kullanıma kadar sıvı nitrojende saklayın. Alternatif olarak, sağlıklı bir gönüllüden veya taze kordon kan hücrelerinden alınan kemik iliği hücreleri, enstitü etik komitesinin onayı ve donör onayı ile kullanılabilir.
- 37 °C'lik su banyosunda 15 mL konik tüpte 10 mL çözünme ortamı ısıtın.
- Donmuş hücreleri 2 dakika içinde 37 °C'lik bir su banyosunda şişelerde çözün. Kirleticileri gidermek için şişeyi% 70 etanol ile sildikten sonra, hücreleri adım 3.2'den önceden ısıtılmış ortamı içeren 15 mL konik tüpe aktarın.
- 15 mL'lik tüpü oda sıcaklığında 15 dakika boyunca 200 × g'da santrifüjlayın. Peletin sağlam kalması için süpernatantı dikkatlice emiş edin (< 50 μL orta bırakır). Kalan ortamla hücreleri yeniden biriktirin ve buz üzerinde 1,5 mL'lik bir tüpe aktarın.
NOT: Göz veya yaralı doku da dahil olmak üzere doğrudan mukozada insan kaynaklı örneklere maruz kalmak, bilinen veya bilinmeyen patojenler tarafından enfeksiyona neden olabilir; bu nedenle, insan hücrelerini kullanırken eldiven ve gözlük önerilir. Satın alınan CD34+ hücreleri hepatit B virüsü (HBV), hepatit C virüsü (HCV) ve insan immün yetmezlik virüsü 1 (HIV1) için negatif test etse bile, maruz kalma insidansı meydana gelirse kurumsal yönergelere göre dikkatli izleme yapılmalıdır. İnsan hücrelerine maruz kalan malzemeleri elden çıkarmak için kurumsal kurallara uyun.
4. HSC'leri Sıralama
- Hücreleri florokrom konjuge antikorlarla etiketle. 50 μL boyama tamponu artı 10 μL anti-CD34-FITC, 2 μL anti-CD38-PerCP-Cy5.5, 5 μL anti-CD90-PE-Cy7 ve 10 μL anti-CD45RA-PE karıştırın. Hücre peletini antikor karışımına yeniden koyun. Karanlıkta 4 °C'de hücreleri 30 dakika kuluçkaya yatırın.
- Antikorları yıkamak için 1 mL boyama tamponu ekleyin. Tüpleri 340 × g'da 4 °C'de 5 dakika santrifüj edin. Üstnatant atın.
- Hücre peletini 0,5 mL boyama tamponu + % 0,1 propidium iyodür içinde yeniden sunun. Süspansiyonu 40 μm filtre kullanarak 5 mL'lik bir tüpe aktarın.
- PI - CD34 + CD38-CD90+CD45RA- fraksiyonu içindeki FENotipik HSC'leri FACS Aria-IIIu kullanarak kapılayın ve hücreleri 500 μL kültür ortamıyla dolu 1,5 mL'lik bir tüpe ayırın (Şekil 3). Şekil 3'te gösterilen gating stratejisini kullanarak, CD34+ hücrelerinin ~%10'unun fenotipik HSC'ler olması beklenir.
NOT: Gating stratejisi, sağlıklı bireylerden CD34 + CD38- fraksiyonundaki soy işaretleyicilerin düşük ifadesi göz önüne alındığında soy işaretleyici lekeleme atlanırken daha önce açıklandığı gibi16 olarak gerçekleştirilir17 . - Sıralanmış hücreleri 340 × g'da 4 °C'de 5 dakika santrifüj edin ve süpernatantı atın. Peletin sağlam kalmasını sağlamak için süpernatantı dikkatlice emiş edin.
- Sıralanmış hücreleri kültüre kadar buzda saklayın.
NOT: Spektral örtüşmenin floresan telafisi ilk deney sırasında yapılmalıdır.
5. Hücre kültürü
- 2. adımda hazırlanan sitokinleri içeren kültür medyasının 200 μL'sini düz tabanlı 96 kuyu plakalarına aktarın.
- Ortamın buharlaşmasını önlemek için, kullanılmayan tüm kuyuları 100-200 μL PBS ile doldurun.
- Sıralanmış HSC'leri 60 hücre/μL'de sitokin olmadan kültür ortamlarında yeniden biriktirin.
- Her kuyuya Aliquot 600 HSC/kuyu (10 μL hücre süspansiyonu). Hücre numarası değiştirilebilir. 300'den az hücre daha büyük teknik varyasyona yol açacaktır ve bu nedenle biyolojik farklılıkları tespit etmek için durum başına daha fazla kuyuya ihtiyaç vardır. Sitokin/besin yoksunluğu veya elverişsiz sitokin/kemokin birikimi nedeniyle tek bir kuyuda 1000'den fazla hücrenin kültlenmesinden kaçınılmalıdır.
- Hücreleri% 5 CO2 ve% 1 O2 atmosferde 37 ° C'de nemlendirilmiş çok gazlı bir inkübatörde kültüre edin.
- 7 günden büyük kültürler için, her 3-4 günde bir medya hacminin yarısının değiştirilmesi önerilir. Pipetleme ile 100 μL medyayı dikkatlice emiş ve her kuyuya sitokin içeren 100 μL yeni hazırlanmış kültür ortamı ekleyin. Kültür ortamı 37 °C'de önceden ısıtılmalıdır.
6. Akış sitometrisi kullanılarak marker fenotiplerinin analizi
NOT: Hücrelerin 7 günlük kültürden sonra analiz edilmesi gerekirken, kültür süresi değiştirilebilir.
- 8 kanallı pipet kullanarak ortamın 170 μL'lik kısmını atın.
- Hücreleri antikor karışımı ile etiketleyin. 0,5 μL anti-CD34-FITC, 0,1 μL anti-CD38-PerCP-Cy5,5, 0,25 μL anti-CD90-PE-Cy7, 0,5 μL anti-CD45RA-PE ve kuyu başına 9 μL boyama tamponu karıştırın. Karışımın 10 μL'lik kısmını 96 kuyu plakasına ekleyin ve karanlıkta 4 °C'de 30 dakika boyunca hücreleri kuluçkaya yatırın.
- Antikorları yıkamak için kuyulara 100 μL boyama tamponu ekleyin ve plakaları düşük hızlanma ve orta yavaşlama kullanarak 4 °C'de 5 dakika boyunca 400 × g'da santrifüjleyin.
- Kuyuların altındaki hücreleri korumak için süpernatantın 100 μL'sini dikkatlice emiş, ardından hücreleri 200 μL boyama tamponunda + PI'nin% 0.1 v / v ' inde + floresan mikrokürelerin % 1 v / v'sinde (örneğin, Akış Kontrol Florosferleri) yeniden biriktirin.
- Akış sitometri aletini ayarlayın. 100 μL'lik karışık numune modu açık ve alım hacimleri ile numuneler için hızlı modda veri alın.
- Verileri FCS biçiminde dışa aktarın ve FlowJo gibi bir yazılım kullanarak analiz edin. Hücre numaraları floresan mikroküreci boncuk sayısı kullanılarak belirlenebilir. Örneğin, araştırmacı kuyu başına 2000 boncuk eklerse ve boncuk sayısı 700 ise, kuyudaki kesirin toplam hücre sayısını tahmin etmek için her kesirdeki hücre sayısını 2000/700 ile çarpın.
NOT: Floresan mikroküreler formaldehit varlığı nedeniyle kültürlü hücreler için toksiktir. Bu, analiz sırasında hücre ölümüne neden olabilir. Önyargıyı önlemek için sürekli analiz edilen kuyu sayısını (<50 kuyu) en aza indirin.
7. İnsan HSC'lerinin nakli
NOT: Kültürlü hücrelerin repopülasyon aktivitesi immün yetmez farelere nakil ile doğrulanır. Tüm prosedürler hayvan deney komiteleri veya eşdeğerleri tarafından onaylanmalıdır.
- Donör olarak, yeterli sayıda 8-12 haftalık immün yetmezlik nod-SCID-Il2rg-null (NOG) fare hazırlayın. NOG fareleri enfeksiyona karşı oldukça hassas olduğundan, üreme kafeslerini mümkün olduğunca temiz tutun ve fareleri sterilize edilmiş bir diyet ve su ile besleyin.
- 5. adımda açıklandığı gibi transplantasyon için yeterli sayıda HSC kültürü. Örneğin, 5000 HSC (0. gün eşdeğeri) 6 alıcı fareye nakledildiğinde, kültür 35.000-40.000 HSC'yi 96 kuyu plakasının 40 kuyusunda (kuyu başına 200 μL kültür ortamı) veya 24 kuyu plakasının 8 kuyusunda (kuyu başına 1 mL kültür medyası). %5 CO 2 ve %1O2 ile 37 °C'de nemlendirilmiş çok gazlı bir inkübatörde her 3-4 günde bir yarım ortam değişiklikleri ile hücreleri2 hafta boyunca kültürlendirin. Kültür süresi değiştirilebilir.
- NOG farelerini nakilden önce 6-24 saat 2.5 Gy'de ışınla.
- Kültürlü HSC'leri 1,5 mL tüplerde toplayın. Tüpleri 340 ×g'da 4°C'de 5 dakika santrifüj edin.
- Süpernatantları dikkatlice emiş edin ve steril buz gibi boyama tamponundaki hücreleri 200 μL başına 5000 HSC (gün 0 eşdeğeri) hücre yoğunluğunda yeniden depola. Boyama tamponu sterilize etmek için 0,22 μm filtre kullanarak filtreleyin.
- Transplantasyondan önce, fareleri sevofluran veya izofluran inhalasyonu ile uyuşturun.
- 5000 kültürlü HSC'yi (0. gün eşdeğeri) nakletmek için, 1 mL şırınga ve 27-gauge iğne kullanarak 7.1 adımında ışınlanan NOG farelerinin kuyruk damarına veya retro orbital sinüsüne 200 μL hücre süspansiyonu enjekte edin. Yeni izole edilmiş veya çözülmüş kemik iliği HSC'leri kontrol olarak nakledilebilir. Eldivenler her işlem arasında %70 v/v etanol ile sterilize edilmelidir.
8. Periferik kandaki insan kaynaklı hücrelerin sıklığının analizi
- İnsan hücrelerinin yeniden çoğalmasını incelemek için, periferik kanı transplantasyondan 1, 2 ve 3 ay sonra toplayın.
- Periferik kanı toplamadan önce, fareleri sevoflurane inhalasyon ile uyuşturun.
- Heparinize cam kılcal tüpler kullanarak retro-orbital sinüsten 40-80 μL periferik kan toplayın ve bu örneği 1,5 mL tüplerde 1 mL PBS + heparin (1 U/mL) olarak askıya alın.
- Kan süspansiyonu 340 × g'da 4 °C'de 3 dakika santrifüj. Süpernatant atın ve peleti oda sıcaklığında 45 dakika boyunca 1 mL PBS + % 1,2 w/v dektran (200 kDa) olarak yeniden depolayın.
- Süpernatantı 3 dakika boyunca 340 × g'da başka bir 1,5 mL tüpe ve santrifüje aktarın.
- Kırmızı kan hücresi lizisi için, hücreleri 0.17 M NH 4 Cl'de5dakika boyunca yeniden biriktirin.
- Hücre süspansiyonu 4 °C'de 3 dakika boyunca 340 × g santrifüj. Hücreleri 0,3 μL anti-fare Fc bloğu içeren 50 μL boyama tamponunda yeniden kullanın. Bu numuneyi 4 °C'de 5 dakika kuluçkaya yatır.
- Yüzey işaretleyici boyama için aşağıdaki antikorları ekleyin: 0,3 μL fare CD45-PE-Cy7, 0,3 μL fare Ter-119-PE-Cy7, 0.3 μL insan CD45-BV421, 0.3 μL insan CD13-PE, 1.2 μL insan CD33-PE, 0.3 μL insan CD19-APC, 0.3 μL insan CD3-APC-Cy7. Hücreleri 4 °C'de 15 dakika kuluçkaya yatırın.
- 4 °C'de 5 dakika boyunca 340 × g'da 1 mL boyama tamponu ve santrifüj ile bir kez yıkayın.
- Süpernatant atın ve hücreleri 200 μL boyama tamponu + %0,1 v/v PI'de yeniden biriktirin.
- Hücre süspansiyonu 96 kuyulu düz tabanlı bir plakaya aktarın ve mix numune modu açık ve 100 μL'lik bir alım hacmi ile akış sitometresini hızlı modda kullanarak veri elde edin.
- FlowJo gibi yazılımları kullanarak analiz için verileri FCS biçiminde dışa aktarabilirsiniz.
- Akış sitometresini kurun. Mix numune modu açık ve 100 μL'lik bir alım hacmi ile numuneler için verileri hızlı modda elde edin.
- FlowJo gibi yazılımları kullanarak analiz için verileri FCS biçiminde dışa aktarabilirsiniz.
Sonuçlar
Saflaştırılmış HSC'leri kültleştirdikten 7 gün sonra, hücrelerin% 80'ine kadar CD34+CD38 belirteç fenotipleri görüntülendi- (Şekil 4A). Toplam hücre sayısı sitokin konsantrasyonuna bağlı olarak (Şekil 4B). Hücre döngüsüne daha yüksek SCF ve TPO indüklenmiş giriş konsantrasyonları, çoğalma ve farklılaşma (Şekil 4B). CD34 + CD38-CD90+CD45RA'nın işaretleyici fenotipleri ilekarakterize edilen fenotipik HSC sayısı SCF veya TPO konsantrasyonları ile orantılı olarak artmıştır (Şekil 4B), toplam hücreler arasındaki sıklık azalırken (Şekil 4C). Toplam hücre sayısı 1,5 ng/mL SCF ve 4 ng/mL TPO ile 3 ng/mL SCF 3 ve 2 ng/mL TPO kombinasyonlarında eşitti ve bu da HSC'lerin minimal hücre döngüsü aktivasyonu sırasında sessiz olduğunu düşündürmektedir. Bireysel farklılıklar göz önüne alındığında, her kemik iliği donörü için sitokin titrasyonu önerilir.
Kültürlü erişkin kemik iliği HSC'lerinin 3 aylık naklinden sonra, rekonsyon insan CD45+ murine CD45- Ter119 hücrelerinin periferik kanında sıklığı olarak değerlendirilebilir. CD19+ B hücreleri, CD13/CD33+ miyeloid hücreler ve CD3+ T hücreleri dahil olmak üzere üç soy, yeni çözülmüş HSC'ler veya kültürlü HSC'lerle nakledilen NOG farelerinde yeniden inşa edildi (Şekil 5).
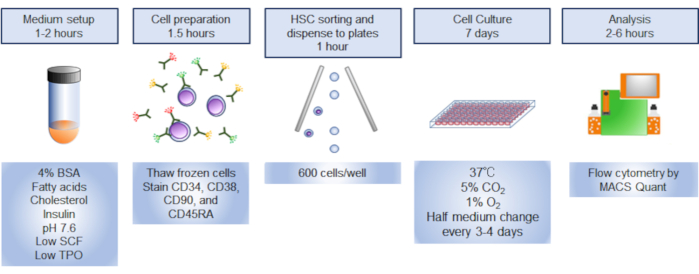
Şekil 1. Prosedüre genel bakış. Prosedürün grafiksel özeti, insan hematopoetik kök hücrelerinin (HSC) sıralandırılmasını, kült örüldürmesini ve analizini içeriyordu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
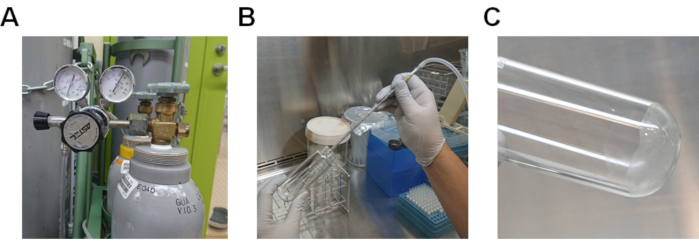
Şekil 2. Lipid çözeltisinden metanol buharlaştırma prosedürü. A) Gaz regülatörlü azot gazı silindiri. B) Azot gazının metanolde çözünmüş lipit çözeltisi üzerinden geçirilmesi prosedürü. C) Cam tüpün altına yaparak lipitler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3. HSC'leri sıralamak için gating stratejisi. Çizimler kapılı CD34+CD38-CD90+CD45RA- hücreleri gösterir. CD34+ hücrelerinin yaklaşık% 10'u fenotipik HSC'lerdi.
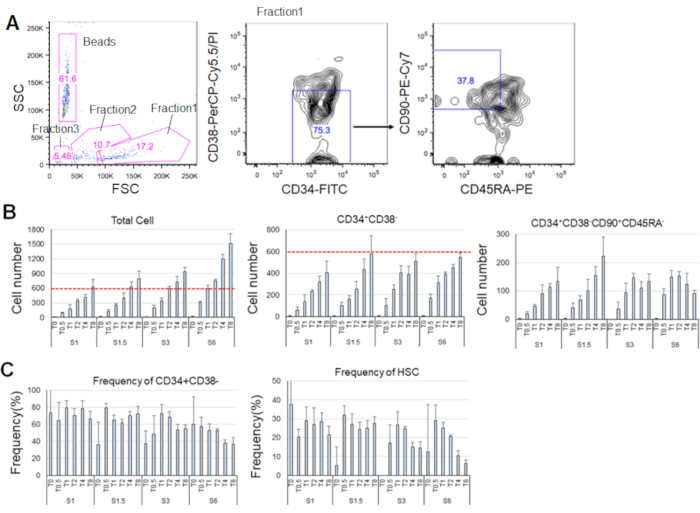
Şekil 4. 7 günlük kültlemeden sonra temsili hücre numaraları. A) SCF (3 ng/mL) ve TPO'daki (2 ng/mL) HSC'leri kültledikten sonra temsili floresan aktif hücre sıralama grafiği. Fraksiyon 1 canlı hücreler için zenginleştirilmiş, fraksiyon 2 ölü hücreler için zenginleştirilmiş ve fraksiyon 3 enkaz için zenginleştirilmiştir. Pembe renkteki sayılar frekansı gösterir (%) kapılı kesir. B) Belirtilen sitokin koşulları altında600 HSC kültlemeden sonra tüm HSC sayısı,CD34+ CD38 - CD38 - CD90+CD45RA- hücreler. Kırmızı kesikli çizgiler giriş hücrelerinin ilk sayısını gösterir. S: SCF, T: TPO. Ortalama ± standart sapma, n = 4. S ve T'yi takip eden sayılar her sitokinin konsantrasyonunun (ng/mL) olduğunu gösterir. C) CD34+CD38frekansı - ve CD34+CD38-CD90+CD45RA- belirtilen sitokin koşulları altındaki hücreler. S: SCF, T: TPO. Ortalama ± standart sapma, n = 4. SCF (1 ng/mL) ve TPO (0 ng/mL) olarak kültürlenmiş hücrelerin hata çubukları, yüksek değerleri (sırasıyla 37,7 ve 47,9) nedeniyle atlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
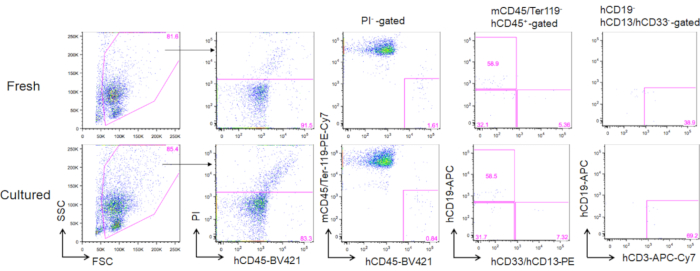
Şekil 5. 3 aylık transplantasyondan sonra donör farelerin temsili FACS planları. NOG farelerine toplam 5000 yeni çözülmüş (üst panel) ve 2 haftalık kültürlü HSC (3 ng/mL SCF ve 3 ng/mL TPO; alt panel) nakledildi. hCD19 insan B hücrelerini, hCD13 ve hCD33 insan miyeloid hücrelerini, hCD3 ise insan T hücrelerini işaretler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Son zamanlarda, HSC'leri minimum farklılaşma ile genişletmek için çeşitli yöntemler bildirilmiştir18,19,20,21. Bu yöntemler mükemmel olmasına rağmen, HSC'ler hücre döngülerini, HSC'lerin minimum bisiklet gösterdiği in vivo durumdan farklı olan yüksek sitokin seviyeleri varlığında etkinleştirmek zorunda kalırlar. Bu protokol, kemik iliği mikroçevrinimini yeniden yakalayarak HSC'leri in vivo olarak gözlemlendiği gibi sessiz tutmak için yararlıdır.
Düşük sitokin, lipid bakımından zengin ve hipoksik koşullar altında insan HSC'lerini kült haline getirirken, HSC'ler belirteç fenotiplerini korurken minimum bisiklete binme gösterdiler. Bu protokoldeki kritik adım, hipoksi altında yüksek konsantrasyonda yağ asitleri ve kolesterol ve düşük sitokin konsantrasyonları ve kültürü içeren ortamın hazırlanmasıdır (Adım 1, Adım 2 ve Adım 4). Kolesterol ve/ veya yağ asitleri olmadan, düşük sitokin konsantrasyonları altındaki HSC'lerin bakım oranı22azalır. Hücrelerin hipoksik koşullar altında kült örüldürürlüğü de daha önce bildirildiği gibiönemlidir 23.
Kültür koşulları, sitokin konsantrasyonları dışında murine HSC'ler için kullanılanlara benzerdi. Murine HSC'ler TPO olmadan hayatta kalırken, insan HSC'leri 3 ng/mL SCF 22 ile en az2ng/mL TPO gerektirir. TPO konsantrasyonu insan serumunda (~100 pg/mL) olduğundan, bu protokolde kullanılan koşullar insan HSC'lerinin hayatta kalmasını desteklemek için belirli faktörler eksik olabilir. FLT3 insan HSC'lerinde ifade edilir24. Ligand FLT3LG'nin eklenmesi, TPO'nun HSC22'yi koruma gereksinimini biraz azaltır.
İnsan HSC'leri, muhtemelen kolesterol sentezleyici enzimlerin ekspresyonunun ve yağ asitlerinin yüksek konsantrasyonları (>400 μg / mL) altında lipotoksisiteye duyarlılığın neden olamaması nedeniyle, murine HSC'lere kıyasla daha yüksek kolesterol konsantrasyonları gerektirir22. İnsan serumunda bolca bulunan palmitik, oleik, linoleik ve stearik asitlerin kombinasyonu test edilmiş olsa da, lipotoksisi azaltmak ve fonksiyonel HSC'leri koruma oranını artırmak için diğer lipit kombinasyonları değerlendirilmelidir.
Kültürlü insan HSC'lerinin iki haftalık kültürden sonra immün yetmez farelerde repopülasyon aktivitesi doğrulanmış olsa da22Bu kültür sistemi, HSC'lerin in vivo niş işlevlerini tam olarak yeniden yakalamaz. CD45RA ifadesinin arttığı bildirilmiştir ve yeniden depolama kapasitesi yeni sıralanmış HSC22'dendaha düşüktür. Bununla birlikte, ortama suprafizyolojik seviyelerde eklenen glikoz, amino asit, piruvat ve insülin gibi besin konsantrasyonları optimize edilebilir. BSA'daki kirleticiler de HSC18,25'in bakımınıtehlikeyeatabilir. Ek olarak, bazı kültürlü hücreler hücre ölümüne maruz, diğerleri ise hücre bölünmesine uğrar; bu nedenle, toplam hücre numarasının bakımı her hücrenin sessiz durumunu göstermeyebilir.
Bu sınırlamalara rağmen, bu çalışmada geliştirilen protokolde açıklanan kültür koşulları, özellikle fizyolojik koşullar altında HSC'lerin araştırma ve mühendisliğinin ilerletilmesine yardımcı olacaktır. HSC'leri minimum farklılaşma ve bisiklet aktivitesi ile koruyan kültür koşulları, özellikle HSC'ler üzerinde etkili olan biyolojik ve kimyasal bileşiklerin test edilmesi, LSC'lerin sap kaybı olmadan lentivirüs transdüksiyon veya genom düzenlemesi yoluyla manipüle edilmesi ve lösemi ile ilişkili genlerin neden olduğu dönüşümün ilk adımını aydınlatılması için uygun olacaktır.
Açıklamalar
Yazarlar bu çalışma ile ilgili herhangi bir çıkar çatışması beyanda bulunmamaktadır.
Teşekkürler
Teknik destek ve laboratuvar yönetimi için M. Haraguchi ve S. Tamaki'ye ve fotoğraf çektirdiği için K. Shiroshita'ya teşekkür ederiz. HK kısmen MEXT/JSPS'den KAKENHI Hibesi (19K17847 hibesi) ve Ulusal Küresel Sağlık ve Tıp Merkezi tarafından desteklendi. KT kısmen MEXT/JSPS (hibe no. 18H02845 ve 18K19570), Ulusal Küresel Sağlık ve Tıp Merkezi (hibe no. 26-001 ve 19A2002), AMED (hibe no. JP18ck0106444, JP18ae0201014 ve JP20bm0704042), Ono Tıbbi Araştırma Vakfı, Kanzawa Tıbbi Araştırma Vakfı ve Takeda Bilim Vakfı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Human bone marrow CD34+ progenitor cells | Lonza | 2M-101C | |
| NOD/Shi-scid,IL-2RγKO Jic | In-Vivo Science Inc. | https://www.invivoscience.com/en/nog_mouse.html | |
| Anti-human CD34-FITC (clone: 581) | BD biosciences | Cat# 560942; RRID: AB_10562559 | |
| Anti-human CD38-PerCP-Cy5.5 | BD biosciences | Cat# 551400; RRID: AB_394184 | |
| Anti-human CD45RA-PE | BD biosciences | Cat# 555489; RRID: AB_395880 | |
| Anti-human CD90-PE-Cy7 (clone: 5E10) | BD biosciences | Cat# 561558; RRID: AB_10714644 | |
| Anti-human CD13-PE (clone: WM15) | BioLegend | Cat# 301703; RRID: AB_314179 | |
| Anti-human CD33-PE (clone: WM53) | BD biosciences | Cat# 561816; RRID: AB_10896480 | |
| Anti-human CD19-APC (clone: SJ259) | BioLegend | Cat# 363005; RRID: AB_2564127 | |
| Anti-human CD3-APC-Cy7 (clone: SK7) | BD biosciences | Cat# 561800; RRID: AB_10895381 | |
| Anti-human CD45-BV421 (clone: HI30) | BD biosciences | Cat# 563880; RRID:AB_2744402 | |
| Anti-mouse CD45-PE-Cy7 (clone: 30-F11) | BioLegend | Cat# 103114; RRID: AB_312979 | |
| Anti-mouse Ter-119-PE-Cy7 (clone: TER-119) | BD biosciences | Cat# 557853; RRID: AB_396898 | |
| Fc-block (anti-mouse CD16/32) (clone: 2.4-G2) | BD Biosciences | Cat# 553142; RRID: AB_394657 | |
| Phosphate buffered saline | Nacalai Tesque | Cat# 14249-24 | |
| Fetal bovine serum | Thermo Fisher Scientific | Cat# 26140079 | |
| DMEM/F-12 medium | Thermo Fisher Scientific | Cat# 11320-033 | |
| ITS-X | Thermo Fisher Scientific | Cat# 51500056 | |
| Penicillin | Meiji Seika | PGLD755 | |
| Streptomycin sulfate | Meiji Seika | SSDN1013 | |
| Bovine serum albumin | Sigma Aldrich | Cat# A4503 | |
| Sodium palmitate | Tokyo Chemical Industry Co., Ltd. | Cat# P0007 | |
| Sodium oleate | Tokyo Chemical Industry Co., Ltd. | Cat# O0057 | |
| Cholesterol | Tokyo Chemical Industry Co., Ltd. | Cat# C0318 | |
| Ammonium Chloride | Fujifilm | Cat# 017-2995 | |
| Sodium Hydrogen Carbonate | Fujifilm | Cat# 191-01305 | |
| EDTA 2Na | Fujifilm | Cat# 345-01865 | |
| Heparine Na | MOCHIDA PHARMACEUTICAL CO., LTD. | Cat# 224122557 | |
| Sevoflurane | Fujifilm | Cat# 193-17791 | |
| Dextran | Nacalai Tesque | Cat# 10927-54 | |
| Recombinant Human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TPO | PeproTech | Cat# 300-18 | |
| Recombinant human Flt3 ligand | PeproTech | Cat# 300-19 | |
| Propidium iodide | Life Technologies | Cat# P3566 | |
| Flow-Check Fluorospheres | Beckman Coulter | Cat# 7547053 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| AutoMACS Pro | Miltenyi Biotec | N/A | |
| FACS Aria3u | BD Biosciences | N/A | |
| VELVO-CLEAR VS-25 (sonicator) | VELVO-CLEAR | N/A | |
| Nitrogen gas cylinder | KOIKE SANSHO CO., LTD | N/A | |
| Gas regulator | Astec | Cat# IM-055 | |
| Multigas incubator | Astec | Cat# SMA-30DR | |
| Glass tube, 16 mL | Maruemu corporation | N-16 | |
| Glass tube, 50 mL | Maruemu corporation | NX-50 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGPR33RS |
Referanslar
- Scala, S., Aiuti, A. In vivo dynamics of human hematopoietic stem cells: novel concepts and future directions. Blood Advances. 3 (12), 1916-1924 (2019).
- Trumpp, A., Essers, M., Wilson, A. Awakening dormant haematopoietic stem cells. Nature Reviews Immunology. 10 (3), 201-209 (2010).
- Laurenti, E., Gottgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Sun, J., et al. Clonal dynamics of native haematopoiesis. Nature. 514 (7522), 322-327 (2014).
- Busch, K., et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature. 518 (7540), 542-546 (2015).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561 (7724), 473-478 (2018).
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25 (9), 2308-2316 (2018).
- Rodriguez-Fraticelli, A. E., et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 553 (7687), 212-216 (2018).
- Pineault, N., Abu-Khader, A. Advances in umbilical cord blood stem cell expansion and clinical translation. Experimental Hematology. 43 (7), 498-513 (2015).
- Wilkinson, A. C., Igarashi, K. J., Nakauchi, H. Haematopoietic stem cell self-renewal in vivo and ex vivo. Nature Reviews Genetics. 21 (9), 541-554 (2020).
- Wagner, J. E., et al. Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell. 18 (1), 144-155 (2016).
- Cohen, S., et al. Hematopoietic stem cell transplantation using single UM171-expanded cord blood: a single-arm, phase 1-2 safety and feasibility study. Lancet Haematology. 7 (2), 134-145 (2020).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Ito, K., Suda, T. Metabolic requirements for the maintenance of self-renewing stem cells. Nature Reviews Molecular Cell Biology. 15 (4), 243-256 (2014).
- Mendelson, A., Frenette, P. S. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nature Medicine. 20 (8), 833-846 (2014).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Xie, W., et al. Detection of molecular targets on the surface of CD34+CD38- bone marrow cells in myelodysplastic syndromes. Cytometry A. 77 (9), 840-848 (2010).
- Wilkinson, A. C., et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature. 571 (7763), 117-121 (2019).
- Bai, T., et al. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine. 25 (10), 1566-1575 (2019).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Kobayashi, H., et al. Environmental Optimization Enables Maintenance of Quiescent Hematopoietic Stem Cells Ex Vivo. Cell Reports. 28 (1), 145-158 (2019).
- Danet, G. H., Pan, Y., Luongo, J. L., Bonnet, D. A., Simon, M. C. Expansion of human SCID-repopulating cells under hypoxic conditions. Journal of Clinical Investigation. 112 (1), 126-135 (2003).
- Kikushige, Y., et al. Human Flt3 is expressed at the hematopoietic stem cell and the granulocyte/macrophage progenitor stages to maintain cell survival. Journal of Immunology. 180 (11), 7358-7367 (2008).
- Ieyasu, A., et al. An All-Recombinant Protein-Based Culture System Specifically Identifies Hematopoietic Stem Cell Maintenance Factors. Stem Cell Reports. 8 (3), 500-508 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır