Method Article
Um método cultural para manter células-tronco hematopoiéticas humanas quiescentes
Neste Artigo
Resumo
Este protocolo permite a manutenção de células-tronco hematopoiéticas humanas quiescentes in vitro, imitando o microambiente de medula óssea usando ácidos graxos abundantes, colesterol, menores concentrações de citocinas e hipóxia.
Resumo
Células-tronco hematopoiéticas humanas (HSCs), como outros HSCs mamíferos, mantêm hematopoiese ao longo da vida na medula óssea. Os HSCs permanecem quiescentes in vivo, ao contrário de progenitores mais diferenciados, e entram no ciclo celular rapidamente após quimioterapia ou irradiação para tratar lesão de medula óssea ou cultura in vitro. Ao imitar o microambiente da medula óssea na presença de ácidos graxos abundantes, colesterol, baixa concentração de citocinas e hipóxia, os HSCs humanos mantêm quiescência in vitro. Aqui, é descrito um protocolo detalhado para a manutenção de HSCs funcionais no estado quiescente in vitro. Este método permitirá estudos sobre o comportamento dos HSCs humanos em condições fisiológicas.
Introdução
Células-tronco hematopoiéticas (HSCs) e células progenitoras multipotentes (MPPs) formam coordenadamente um reservatório para reposição contínua de células diferenciadas para manter hematopoiese ao longo da vida em humanos1. A quiescência do ciclo celular é uma característica proeminente dos HSCs, diferenciando-os dos MPPs2. Convencionalmente, acredita-se que os HSCs residam no ápice da hierarquia do sistema hematopoiético, produzindo todas as células sanguíneas diferenciadas. Este modelo hierárquico foi deduzido principalmente a partir de experimentos de transplante3. No entanto, estudos recentes indicaram que a dinâmica dos HSCs difere in vivo em relação às dos experimentos de transplante4,5,6,7. Experimentos de rastreamento de linhagem usando vários sistemas de codificação de barras revelaram que os HSCs de murina murina fenotípica não são um tipo de célula única que contribui para hematopoiese de estado estável, e MPPs, que exibem atividade limitada de auto-renovação nas configurações de transplante, fornecem continuamente células sanguíneas maduras4,5,8. Em contrapartida, a contribuição dos HSCs para as células maduras é aumentada após a lesão da medula óssea4. Isso pode ser atribuído a alterações drásticas no microambiente após a ablação da medula óssea, incluindo o transplante de medula óssea. Embora a aplicação do rastreamento de linhagem de células murinas em células humanas seja difícil, a análise filogenética que combina o isolamento de colônias derivadas de células únicas e o sequenciamento de genomas inteiros revelaram uma propriedade semelhante do sistema hematopoiético, no qual tanto os HSCs quanto os MPPs são responsáveis pela produção diária de células maduras7. Assim, embora o transplante seja essencial para examinar a atividade murina ou humana do HSC, outros modelos experimentais são necessários para entender os comportamentos dos HSCs em condições fisiológicas.
Métodos de cultivo para HSCs têm sido estudados detalhadamente para entender suas aplicações e características clínicas. Os HSCs humanos podem ser expandidos in vitro usando uma combinação de citocinas, reconstituição de matrizes extracelulares, remoção de antagonistas de auto-renovação, cocultura com células mesenquimais ou endoteliais, adição de albumina ou sua substituição, transdução de fatores de transcrição de autocon renovação e adição de compostos de pequenas moléculas9,10. Alguns desses métodos, incluindo a adição de pequenos compostos SR111 e UM17112,foram testados em ensaios clínicos com resultados promissores9. Considerando a natureza quiescente dos HSCs in vivo, manter HSCs com ciclo de células mínimas é fundamental para recapitular o comportamento do HSC in vitro. HSCs quiescentes e proliferadores apresentam entrada diferencial do ciclo celular13, estado metabólico14e tolerância contra múltiplas tensões15 . Os métodos utilizados para manter a quiescência dos HSCs humanos in vitro são limitados.
Ao imitar o microambiente da medula óssea (hipóxica e rica em lipídios) e otimizar a concentração de citocinas, os HSCs humanos podem ser mantidos indiferenciados e quiescentes sob a cultura. Recapitulando a natureza quiescente dos HSCs in vitro melhorará a compreensão das propriedades estatais estáveis dos HSCs e permitirá a manipulação experimental dos HSCs.
Protocolo
O protocolo segue as diretrizes do Centro Nacional de Saúde e Medicina Global. Todos os procedimentos experimentais realizados em camundongos são aprovados pelo Comitê Nacional de Experimentos em Animais e Saúde Global.
NOTA: Uma visão geral do protocolo é ilustrada na Figura 1.
1. Preparação lipídica
- Dissolver os seguintes lipídios em metanol em tubos de vidro nas concentrações indicadas: palmitato de sódio, 16 mg/mL; oleato de sódio, 30 mg/mL; e colesterol, 4 mg/mL. Armazene a solução lipídica a -30 °C e descongele a amostra antes de usar.
- Misture as soluções lipídicas preparadas na etapa 1.1 em um tubo de vidro fresco nas doses necessárias para obter a concentração final de 100 μg/mL palmitato, 100 μg/mL oleato e 20 μg/mL colesterol. Por exemplo, ao preparar 10 mL de mídia cultural, misture 62,5 μL de solução palmitate, 33 μL de solução oleate e 50 μL de solução de colesterol no tubo de vidro.
- Evaporar o metanol passando gás nitrogênio através da solução lipídica(Figura 2A e 2B). Se o gás nitrogênio não estiver disponível, passe o ar através da solução usando um auxílio-pipeta.
- Evapora completamente o metanol restante aquecendo o tubo de vidro em um banho de água a 37 °C (Figura 2C).
NOTA: O uso de uma alta concentração de gás N2 no espaço confinado é potencialmente prejudicial. Embora o volume utilizado no protocolo para evaporar o metanol seja limitado e, portanto, seja considerado seguro, ventilar a sala adequadamente e rotular áreas de concentrações potencialmente altas de gás N2 é importante caso ocorra um vazamento inesperado de gás.
2. Preparação média
- Prepare o meio Eagle modificado de Dulbecco (DMEM)/F12 (com HEPES e glutamina). Adicione sulfato de penicilina e estreptomicina ao médio até a concentração final de 50 unidades e 50 μg/mL, respectivamente. O meio DMEM/F12 contendo antibióticos pode ser armazenado a 4 °C por pelo menos 2 meses.
- Adicione 4% c/v de albumina de soro bovino (BSA) ao meio Eagle modificado (DMEM)/F12 modificado de Dulbecco (com HEPES e glutamina).
- Ajuste o pH do médio para o pH 7.4-7.8 usando a solução NaOH, tipicamente para pH 7.6.
- Adicione o meio ao tubo de vidro preparado na etapa 1. Para alcançar uma solução com solubilidade máxima, recomenda-se adição de 3-15 mL médio.
- Dissolva completamente os lipídios por sônica (ótimo: mais de 20 minutos de sônica). Após a dissolução da BSA e lipídios, a amostra deve ser armazenada a -80 °C e usada dentro de 2 meses. Descongele imediatamente antes do uso.
- Adicione 1/1.000 da mistura de insulina, transferrina, selenita de sódio e etanol (ITS-X) à mistura DMEM/F12. Filtre o meio misto usando um filtro de 0,22 μm (designado como "mídia cultural"). Antes do uso, adicione o fator célula-tronco humana (SCF) e a trombopoietina humana (TPO) aos meios de cultura em uma concentração final de 3 ng/mL cada. Depois de adicionar as citocinas e ITS-X, o meio não pode ser armazenado.
- Tampão de coloração: Adicione 10% de FCS ao soro fisco tampão tampão de fosfato livre de ca e mg (PBS). Esta solução pode ser armazenada a 4 °C por 2 semanas.
- Descongelamento da mídia: Adicione 10% de FCS ao DMEM/F12. Esta solução é de uso único.
- Solução de estoque cytokine: Dissolva cada SCF humano ou TPO humano em PBS (Ca- and Mg-free) a 20 μg/mL. Esta solução pode ser armazenada a -80 °C por pelo menos um ano sem perda de atividade. Uma vez descongelado, armazene a solução de estoque a 4 °C e use dentro de 1 mês.
NOTA: Examine o lote após cada compra para evitar variação nos contaminantes da BSA. Cultura HSCs ao mesmo tempo com diferentes lotes de BSA e examinar o número fenotípico HSC no dia 7, conforme descrito abaixo. Se um lote BSA mostrar um número baixo ou frequência de células CD34+ (por exemplo, menos da metade do número de células de entrada), evite usar este lote.
3. Preparação da medula óssea humana CD34+ células
- Compre células de medula óssea CD34+ e armazene as células em nitrogênio líquido até o uso. Alternativamente, as células de medula óssea de um voluntário saudável ou células sanguíneas frescas do cordão umbilical podem ser usadas mediante aprovação do comitê ético do instituto e do consentimento dos doadores.
- Aqueça 10 mL de descongelamento em um tubo cônico de 15 mL em um banho de água de 37 °C.
- Descongele as células congeladas em frascos em um banho de água de 37 °C dentro de 2 minutos. Depois de limpar o frasco com 70% de etanol para remover contaminantes, transfira as células para o tubo cônico de 15 mL contendo o meio pré-aquecido da etapa 3.2.
- Centrifugar o tubo de 15 mL a 200 × g por 15 min a temperatura ambiente. Aspire o supernatante cuidadosamente para manter a pelota intacta (deixando < 50 μL de média). Resuspenda as células com o meio restante e transfira-as para um tubo de 1,5 mL no gelo.
NOTA: A exposição a amostras derivadas do homem diretamente na mucosa, incluindo o tecido ocular ou ferido, pode causar infecção por patógenos conhecidos ou desconhecidos; assim, luvas e óculos são recomendados ao manusear células humanas. Mesmo que as células CD34+ compradores testem negativo para o vírus da hepatite B (HBV), o vírus da hepatite C (HCV) e o vírus da imunodeficiência humana 1 (HIV1), o monitoramento cuidadoso deve ser realizado de acordo com as diretrizes institucionais caso ocorra uma incidência de exposição. Siga as diretrizes institucionais ao descartar materiais expostos às células humanas.
4. Classificação de HSCs
- Rotule as células com anticorpos conjugados fluorocromo. Misture 50 μL de tampão de coloração mais 10 μL de anti-CD34-FITC, 2 μL de anti-CD38-PerCP-Cy5.5, 5 μL de anti-CD90-PE-Cy7 e 10 μL de anti-CD45RA-PE. Resuspende a pelota celular na mistura de anticorpos. Incubar as células por 30 min a 4 °C no escuro.
- Adicione 1 mL de tampão de coloração para lavar os anticorpos. Centrifugar os tubos a 340 × g por 5 min a 4 °C. Descarte o supernaspeso.
- Resuspene a pelota celular em 0,5 mL de tampão de coloração + 0,1% de iodeto de propidium. Transfira a suspensão para um tubo de 5 mL usando um filtro de 40 μm.
- Gate os HSCs fenotípicos dentro do PI-CD34+CD38-CD90+CD45RA- fração usando o FACS Aria-IIIu e classifique as células em um tubo de 1,5 mL preenchido com 500 μL de mídia cultural(Figura 3). Usando a estratégia de gating mostrada na Figura 3, ~10% das células CD34+ devem ser HSCs fenotípicas. Registre o número de células classificadas para calcular o volume de mídia para resuspensar as células na etapa 5.3.
NOTA: A estratégia de gating é realizada como descrito anteriormente16, omitindo a coloração do marcador de linhagem dada a baixa expressão de marcadores de linhagem na fração CD34+CD38 de indivíduos saudáveis17 . - Centrifugar as células classificadas a 340 × g por 5 min a 4 °C e descartar o supernacido. Aspire cuidadosamente o supernatante para garantir que a pelota permaneça intacta.
- Armazene as células classificadas no gelo até a cultura.
NOTA: A compensação da fluorescência da sobreposição espectral deve ser realizada durante o primeiro experimento.
5. Cultura celular
- Transfira 200 μL dos meios de cultura contendo citocinas preparadas na etapa 2 em placas de 96 poços de fundo plano.
- Para evitar a evaporação do meio, encha todos os poços nãousados com 100-200 μL de PBS.
- Resuspend os HSCs classificados em mídia cultural sem citocinas a 60 células/μL.
- Aliquot 600 HSCs/bem (10 μL de suspensão celular) em cada poço. O número do celular pode ser alterado. Menos de 300 células levarão a maior variação técnica e, portanto, mais poços por condição são necessários para detectar diferenças biológicas. A colheita de mais de 1000 células em um único poço deve ser evitada devido à citocina/privação de nutrientes ou acúmulo de citocinas/quimioterapias desfavoráveis.
- Cultume as células em uma incubadora multi-gás umidificada a 37 °C em uma atmosfera de 5% de CO2 e 1% O2.
- Para culturas ao longo de 7 dias, recomenda-se substituir metade do volume de mídia a cada 3-4 dias. Aspire cuidadosamente 100 μL de mídia por pipetação e adicione 100 μL de mídia de cultura recém-preparada contendo citocinas a cada poço. A mídia cultural deve ser pré-aquecida a 37 °C.
6. Análise de fenótipos marcadores utilizando citometria de fluxo
NOTA: Embora as células devam ser analisadas após 7 dias de cultura, a duração da cultura pode ser alterada.
- Descarte 170 μL do meio usando uma pipeta de 8 canais.
- Rotule as células com a mistura de anticorpos. Misture 0,5 μL de anti-CD34-FITC, 0,1 μL de anti-CD38-PerCP-Cy5.5, 0,25 μL de anti-CD90-PE-Cy7, 0,5 μL de anti-CD45RA-PE e 9 μL de tampão de coloração por poço. Adicione 10 μL da mistura à placa de 96 poços e incuba as células por 30 min a 4 °C no escuro.
- Para lavar os anticorpos, adicione 100 μL de tampão de coloração aos poços e centrifufique as placas a 400 × g por 5 min a 4 °C usando baixa aceleração e desaceleração média.
- Aspire cuidadosamente 100 μL do supernante para manter as células na parte inferior dos poços, em seguida, resuspend as células em 200 μL de tampão de coloração + 0,1% v/v de PI + 1% v/v de microesferas fluorescentes (por exemplo, Fluoroferas de Verificação de Fluxo).
- Configure o instrumento de citometria de fluxo. Adquira dados para as amostras em modo rápido com modo amostral misto ligado e volumes de captação de 100 μL.
- Exporte os dados no formato FCS e analise-os usando softwares como o FlowJo. Os números celulares podem ser determinados usando a contagem de contas da microesfera fluorescente. Por exemplo, se o pesquisador adicionar 2000 contas por poço e a contagem de contas for de 700, multiplique o número celular de cada fração por 2000/700 para estimar o número celular total da fração no poço.
NOTA: As microesferas fluorescentes são tóxicas para células cultivadas devido à presença de formaldeído. Isso pode induzir a morte celular durante a análise. Minimizar o número de poços (<50 poços) analisados continuamente para evitar viés.
7. Transplante de HSCs humanos
NOTA: A atividade de repopulação de células cultivadas é validada por transplante para camundongos imunodeficientes. Todos os procedimentos devem ser aprovados por comitês de experimentos animais ou seus equivalentes.
- Como doadores, preparem um número suficiente de camundongos nod-SCID-IL2rg-nulos (NOG) de 8-12 semanas. Como os camundongos NOG são altamente suscetíveis à infecção, mantenha as gaiolas de reprodução o mais limpas possível e alimente os camundongos com uma dieta esterilizada e água.
- Cultura um número adequado de HSCs para transplante, conforme descrito na etapa 5. Por exemplo, quando 5000 HSCs (dia 0 equivalente) são transplantados para 6 camundongos receptores, cultura 35.000-40.000 HSCs em 40 poços de uma placa de 96 poços (200 μL de mídia cultural por poço) ou em 8 poços de uma placa de 24 poços (1 mL de mídia cultural por poço). Cultura as células por 2 semanas com meias-mídia muda a cada 3-4 dias em uma incubadora multi-gás umidificada a 37 °C com 5% de CO2 e 1% O2. A duração da cultura pode ser alterada.
- Irradiar camundongos NOG a 2,5 Gy às 6-24 h antes do transplante.
- Colete os HSCs cultivados em tubos de 1,5 mL. Centrifugar os tubos a 340 ×g por 5 min a 4°C.
- Aspire cuidadosamente os supernantes e resuspenque as células em tampão de coloração gelo estéril a uma densidade celular de 5000 HSCs (dia 0 equivalente) por 200 μL. Transfira esta suspensão para tubos de polipropileno de 3 mL. Para esterilizar o tampão de coloração, filtre-o usando um filtro de 0,22 μm.
- Antes do transplante, anestesia os camundongos por sevoflurano ou inalação de isoflurano.
- Para transplantar 5000 HSCs cultivados (dia 0 equivalente), injete 200 μL de suspensão celular na veia da cauda ou seio orbital retrô de camundongos NOG irradiados na etapa 7.1 usando uma seringa de 1 mL e agulha de calibre 27. HSCs de medula óssea recém-isolados ou descongelados podem ser transplantados como controle. As luvas devem ser esterilizadas com 70% de v/v de etanol entre cada procedimento.
8. Análise da frequência de células derivadas do homem no sangue periférico
- Para examinar a repopulação das células humanas, recolham o sangue periférico em 1, 2 e 3 meses após o transplante.
- Antes de coletar o sangue periférico, anestesiar os camundongos por inalação de sevoflurano.
- Colete 40-80 μL de sangue periférico do seio retro-orbital usando tubos capilares de vidro heparinizados e suspenda esta amostra em 1 mL de PBS + heparina (1 U/mL) em tubos de 1,5 mL.
- Centrifugar a suspensão sanguínea a 340 × g por 3 min a 4 °C. Descarte o supernasciente e resuspenque a pelota em 1 mL de PBS + 1,2% w/v dextran (200 kDa) por 45 min a temperatura ambiente.
- Transfira o supernante para outro tubo de 1,5 mL e centrífuga a 340 × g por 3 min.
- Para lise de glóbulos vermelhos, resususpenda as células em 0,17 M NH4Cl por 5 min.
- Centrifugar a suspensão celular 340 × g por 3 min a 4 °C. Resuspenha as células em 50 μL de tampão de coloração contendo 0,3 μL de bloco fc anti-mouse. Incubar esta amostra a 4 °C por 5 min.
- Adicione os seguintes anticorpos para coloração do marcador de superfície: 0,3 μL de mouse CD45-PE-Cy7, 0,3 μL mouse Ter-119-PE-Cy7, 0,3 μL de CD45-BV421 humano, 0,3 μL de CD13-PE humano, 1,2 μL de CD33-PE humano, 0,3 μL de CD19-APC humano, 0,3 μL de CD3-APC-Cy7 humano. Incubar as células a 4 °C por 15 min.
- Lave uma vez com 1 mL de tampão de coloração e centrífuga a 340 × g por 5 min a 4 °C.
- Descarte o supernascimento e resuspenque as células em 200 μL de tampão de coloração + 0,1% v/v de PI.
- Transfira a suspensão da célula para uma placa de fundo plana de 96 poços e adquira dados usando o citômetro de fluxo no modo rápido com o modo de amostra de mixagem ligado e um volume de absorção de 100 μL.
- Exporte os dados em formato FCS para análise usando softwares como o FlowJo.
- Configure o citómetro de fluxo. Adquira dados para as amostras em modo rápido com o modo de amostra de mix e um volume de absorção de 100 μL.
- Exporte os dados em formato FCS para análise usando softwares como o FlowJo.
Resultados
Após 7 dias de cultivo dos HSCs purificados, até 80% das células exibiam fenótipos marcadores de CD34+CD38- (Figura 4A). O número total de células dependia da concentração de citocinas(Figura 4B). Maiores concentrações de SCF e TPO induziram a entrada no ciclo celular, proliferação e diferenciação(Figura 4B). O número de HSCs fenotípicos caracterizados pelos fenótipos marcadores de CD34+CD38-CD90+CD45RA- aumentou proporcionalmente às concentrações de SCF ou TPO(Figura 4B),enquanto a frequência entre as células totais diminuiu(Figura 4C). Os números totais de células foram iguais nas combinações de 1,5 ng/mL SCF e 4 ng/mL TPO e as combinações de 3 ng/mL SCF 3 e 2 ng/mL TPO, sugerindo que os HSCs são quiescentes durante a ativação mínima do ciclo celular. Dadas as diferenças individuais, recomenda-se a titulação de citocinas para cada doador de medula óssea.
Após 3 meses de transplante de HSCs de medula óssea adulta cultivada, a reconstituição pode ser avaliada como sua frequência no sangue periférico das células CD45+ murinas CD45-Ter119. Três linhagens, incluindo células CD19+ B, células mielóides CD13/CD33+, e células T CD3+ foram reconstituídas em camundongos NOG transplantados com HSCs recém-descongelados ou HSCs cultivados(Figura 5).
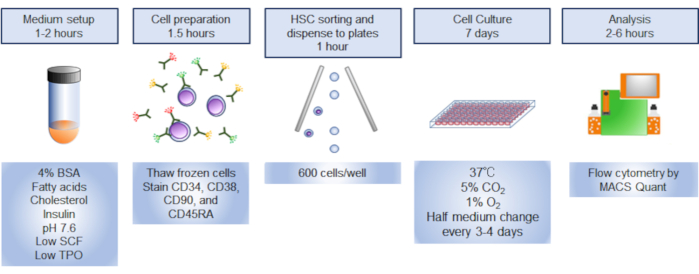
Figura 1. Visão geral do procedimento. O resumo gráfico do procedimento envolveu a triagem, a colheita e a análise de células-tronco hematopoiéticas humanas (HSCs). Clique aqui para ver uma versão maior desta figura.
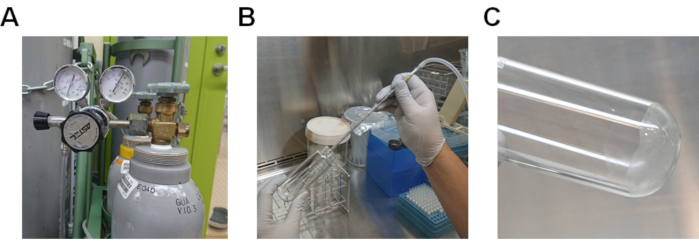
Figura 2. Procedimento para evaporar metanol da solução lipídica. A) Cilindro de gás nitrogênio com regulador de gás. B) Procedimento para a passagem de gás nitrogênio através da solução lipídica dissolvida em metanol. C) Lipídios aderindo ao fundo do tubo de vidro. Clique aqui para ver uma versão maior desta figura.

Figura 3. Estratégia de gating para classificação de HSCs. As tramas mostram células de CD34+CD38-CD90+CD45RA. Aproximadamente 10% das células CD34+ eram HSCs fenotípicas. Por favor clique aqui para ver uma versão maior desta figura.
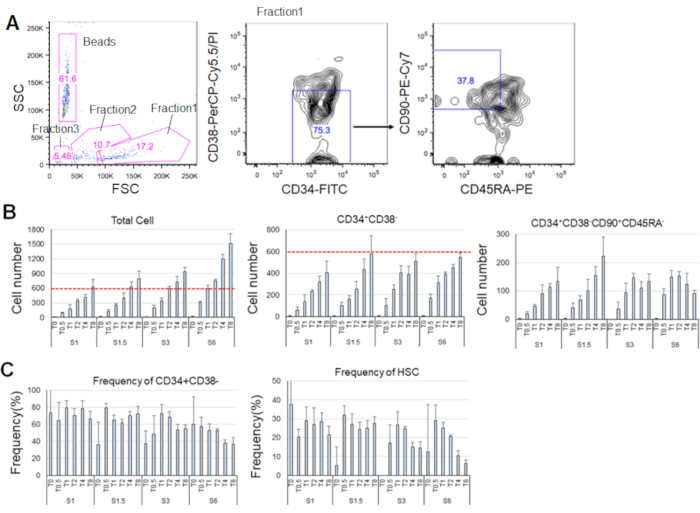
Figura 4. Números de células representativas após 7 dias de cultivo. A) Gráfico de classificação celular ativado pela fluorescência representativa após a cultura dos HSCs em SCF (3 ng/mL) e TPO (2 ng/mL). A fração 1 foi enriquecida para células vivas, a fração 2 foi enriquecida para células mortas, e a fração 3 foi enriquecida para detritos. Números coloridos em rosa indicam a frequência (%) da fração fechada. B) Número de todos os HSCs, CD34+CD38- células, e CD34+CD38-CD90+CD45RA- células após a culminar 600 HSCs sob as condições indicadas de citocinas. Linhas tracejadas vermelhas indicam o número inicial de células de entrada. S: SCF, T: TPO. Desvio padrão ± médio, n = 4. Os números seguintes a S e T indicam a concentração (ng/mL) de cada citocina. C) Frequência de células CD34+CD38- e CD34+CD38-CD90+CD45RA- sob as condições indicadas de citocina. S: SCF, T: TPO. Desvio padrão ± médio, n = 4. As barras de erro para células cultivadas em SCF (1 ng/mL) e TPO (0 ng/mL) foram omitidas devido aos seus altos valores (37,7 e 47,9, respectivamente). Clique aqui para ver uma versão maior desta figura.
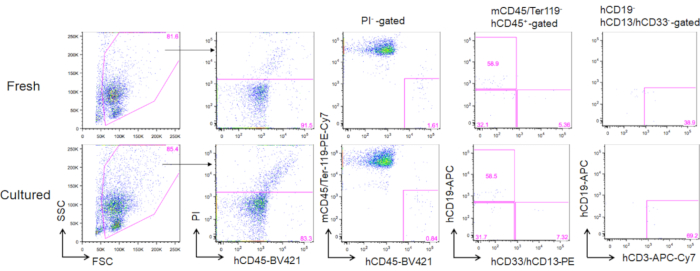
Figura 5. Representante FACS parcelas de camundongos doadores após 3 meses de transplante. Um total de 5.000 HSCs recém-descongelados (painéis superiores) e 2 semanas cultivados (3 ng/mL SCF e 3 ng/mL TPO; painéis inferiores) foram transplantados em camundongos NOG. hCD19 marca células B humanas, hCD13 e hCD33 marcam células mielóides humanas, e hCD3 marca células T humanas. Clique aqui para ver uma versão maior desta figura.
Discussão
Recentemente, vários métodos de expansão de HSCs com diferenciação mínima foram relatados18,19,20,21. Embora esses métodos sejam excelentes, os HSCs são forçados a ativar seus ciclos celulares na presença de altos níveis de citocinas, o que difere da situação in vivo em que os HSCs apresentam ciclos mínimos. Este protocolo é útil para manter os HSCs como quiescentes, como observado in vivo, recapitulando o microambiente da medula óssea.
Ao cultivar HSCs humanos sob condições de citocinas baixas, ricas em lipídios e hipoxicas, os HSCs mostraram ciclismo mínimo enquanto mantinham seus fenótipos marcadores. O passo crítico neste protocolo é a preparação de meio contendo alta concentração de ácidos graxos e colesterol e baixas concentrações de citocinas e cultura sob hipóxia (Passo 1, Passo 2 e Passo 4). Sem colesterol e/ou ácidos graxos, a taxa de manutenção dos HSCs sob baixas concentrações de citocinas diminui22. A colheita de células em condições hipóxiis também é importante, como relatado anteriormente23.
As condições de cultura foram semelhantes às utilizadas para HSCs murinas, com exceção das concentrações de citocinas. Os HSCs murine sobrevivem sem TPO, enquanto os HSCs humanos requerem pelo menos 2 ng/mL de TPO com 3 ng/mL de SCF22. Como a concentração de TPO é muito maior do que a do soro humano (~100 pg/mL), as condições utilizadas neste protocolo podem estar faltandofatores específicos para apoiar a sobrevivência dos HSCs humanos. A adição de seu ligante FLT3LG diminui ligeiramente a exigência de TPO para manter os HSCs22.
Os HSCs humanos requerem maiores concentrações de colesterol em comparação com os HSCs murine, presumivelmente devido à incapacidade de induzir a expressão de enzimas sintetizadoras de colesterol e suscetibilidade à lipotoxicidade sob altas concentrações (>400 μg/mL) de ácidos graxos22. Embora apenas a combinação de ácidos palmíticos, oleicos, linóricos e esteáricos tenha sido testada, que são abundantemente encontradas no soro humano, outras combinações de lipídios devem ser avaliadas para reduzir a lipotoxicidade e melhorar a taxa de manutenção de HSCs funcionais.
Embora a atividade de repopulação de HSCs humanos cultivados em camundongos imunodeficientes após duas semanas de cultura tenha sido confirmada22, este sistema de cultura não recapitula totalmente as funções de nicho dos HSCs in vivo. A expressão do CD45RA foi relatada para aumentar e a capacidade de repopulação é inferior à dos HSCs22recém-classificados . No entanto, as concentrações de nutrientes, como glicose, aminoácido, piruvato e insulina, que são adicionados ao meio em níveis suprafisiológicos, podem ser otimizadas. Contaminantes na BSA também podem comprometer a manutenção dos HSCs18,25. Além disso, algumas células cultivadas sofrem morte celular, enquanto outras passam por divisão celular; assim, a manutenção do número total da célula pode não indicar o estado quiescente de cada célula.
Apesar dessas limitações, as condições de cultura descritas no protocolo desenvolvido neste estudo ajudarão a avançar na pesquisa e engenharia dos HSCs, particularmente em condições quase fisiológicas. Condições culturais que mantenham HSCs com mínima diferenciação e atividade ciclística seriam adequadas para testar compostos biológicos e químicos que atuam especificamente em HSCs, manipulando HSCs via transdução de lentivírus ou edição de genomas sem a perda de caule, e elucidando o passo inicial de transformação induzido por genes associados à leucemia.
Divulgações
Os autores não declaram conflito de interesses associados ao presente estudo.
Agradecimentos
Agradecemos a M. Haraguchi e S. Tamaki pelo apoio técnico e gestão de laboratório e K. Shiroshita por tirar fotos. O HK foi apoiado em parte pelo KakenHI Grant da MEXT/JSPS (bolsa nº 19K17847) e pelo Centro Nacional de Saúde e Medicina Global. A KT foi apoiada em parte por subvenções kakenhi da MEXT/JSPS (subvenção nº 18H02845 e 18K19570), National Center for Global Health and Medicine (grant nos 26-001 e 19A2002), AMED (grant nos. JP18ck0106444, JP18ae0201014 e JP20bm0704042), Ono Medical Research Foundation, Kanzawa Medical Research Foundation e Takeda Science Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Human bone marrow CD34+ progenitor cells | Lonza | 2M-101C | |
| NOD/Shi-scid,IL-2RγKO Jic | In-Vivo Science Inc. | https://www.invivoscience.com/en/nog_mouse.html | |
| Anti-human CD34-FITC (clone: 581) | BD biosciences | Cat# 560942; RRID: AB_10562559 | |
| Anti-human CD38-PerCP-Cy5.5 | BD biosciences | Cat# 551400; RRID: AB_394184 | |
| Anti-human CD45RA-PE | BD biosciences | Cat# 555489; RRID: AB_395880 | |
| Anti-human CD90-PE-Cy7 (clone: 5E10) | BD biosciences | Cat# 561558; RRID: AB_10714644 | |
| Anti-human CD13-PE (clone: WM15) | BioLegend | Cat# 301703; RRID: AB_314179 | |
| Anti-human CD33-PE (clone: WM53) | BD biosciences | Cat# 561816; RRID: AB_10896480 | |
| Anti-human CD19-APC (clone: SJ259) | BioLegend | Cat# 363005; RRID: AB_2564127 | |
| Anti-human CD3-APC-Cy7 (clone: SK7) | BD biosciences | Cat# 561800; RRID: AB_10895381 | |
| Anti-human CD45-BV421 (clone: HI30) | BD biosciences | Cat# 563880; RRID:AB_2744402 | |
| Anti-mouse CD45-PE-Cy7 (clone: 30-F11) | BioLegend | Cat# 103114; RRID: AB_312979 | |
| Anti-mouse Ter-119-PE-Cy7 (clone: TER-119) | BD biosciences | Cat# 557853; RRID: AB_396898 | |
| Fc-block (anti-mouse CD16/32) (clone: 2.4-G2) | BD Biosciences | Cat# 553142; RRID: AB_394657 | |
| Phosphate buffered saline | Nacalai Tesque | Cat# 14249-24 | |
| Fetal bovine serum | Thermo Fisher Scientific | Cat# 26140079 | |
| DMEM/F-12 medium | Thermo Fisher Scientific | Cat# 11320-033 | |
| ITS-X | Thermo Fisher Scientific | Cat# 51500056 | |
| Penicillin | Meiji Seika | PGLD755 | |
| Streptomycin sulfate | Meiji Seika | SSDN1013 | |
| Bovine serum albumin | Sigma Aldrich | Cat# A4503 | |
| Sodium palmitate | Tokyo Chemical Industry Co., Ltd. | Cat# P0007 | |
| Sodium oleate | Tokyo Chemical Industry Co., Ltd. | Cat# O0057 | |
| Cholesterol | Tokyo Chemical Industry Co., Ltd. | Cat# C0318 | |
| Ammonium Chloride | Fujifilm | Cat# 017-2995 | |
| Sodium Hydrogen Carbonate | Fujifilm | Cat# 191-01305 | |
| EDTA 2Na | Fujifilm | Cat# 345-01865 | |
| Heparine Na | MOCHIDA PHARMACEUTICAL CO., LTD. | Cat# 224122557 | |
| Sevoflurane | Fujifilm | Cat# 193-17791 | |
| Dextran | Nacalai Tesque | Cat# 10927-54 | |
| Recombinant Human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TPO | PeproTech | Cat# 300-18 | |
| Recombinant human Flt3 ligand | PeproTech | Cat# 300-19 | |
| Propidium iodide | Life Technologies | Cat# P3566 | |
| Flow-Check Fluorospheres | Beckman Coulter | Cat# 7547053 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| AutoMACS Pro | Miltenyi Biotec | N/A | |
| FACS Aria3u | BD Biosciences | N/A | |
| VELVO-CLEAR VS-25 (sonicator) | VELVO-CLEAR | N/A | |
| Nitrogen gas cylinder | KOIKE SANSHO CO., LTD | N/A | |
| Gas regulator | Astec | Cat# IM-055 | |
| Multigas incubator | Astec | Cat# SMA-30DR | |
| Glass tube, 16 mL | Maruemu corporation | N-16 | |
| Glass tube, 50 mL | Maruemu corporation | NX-50 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGPR33RS |
Referências
- Scala, S., Aiuti, A. In vivo dynamics of human hematopoietic stem cells: novel concepts and future directions. Blood Advances. 3 (12), 1916-1924 (2019).
- Trumpp, A., Essers, M., Wilson, A. Awakening dormant haematopoietic stem cells. Nature Reviews Immunology. 10 (3), 201-209 (2010).
- Laurenti, E., Gottgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Sun, J., et al. Clonal dynamics of native haematopoiesis. Nature. 514 (7522), 322-327 (2014).
- Busch, K., et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature. 518 (7540), 542-546 (2015).
- Lee-Six, H., et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 561 (7724), 473-478 (2018).
- Osorio, F. G., et al. Somatic Mutations Reveal Lineage Relationships and Age-Related Mutagenesis in Human Hematopoiesis. Cell Reports. 25 (9), 2308-2316 (2018).
- Rodriguez-Fraticelli, A. E., et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 553 (7687), 212-216 (2018).
- Pineault, N., Abu-Khader, A. Advances in umbilical cord blood stem cell expansion and clinical translation. Experimental Hematology. 43 (7), 498-513 (2015).
- Wilkinson, A. C., Igarashi, K. J., Nakauchi, H. Haematopoietic stem cell self-renewal in vivo and ex vivo. Nature Reviews Genetics. 21 (9), 541-554 (2020).
- Wagner, J. E., et al. Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell. 18 (1), 144-155 (2016).
- Cohen, S., et al. Hematopoietic stem cell transplantation using single UM171-expanded cord blood: a single-arm, phase 1-2 safety and feasibility study. Lancet Haematology. 7 (2), 134-145 (2020).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Ito, K., Suda, T. Metabolic requirements for the maintenance of self-renewing stem cells. Nature Reviews Molecular Cell Biology. 15 (4), 243-256 (2014).
- Mendelson, A., Frenette, P. S. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nature Medicine. 20 (8), 833-846 (2014).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Xie, W., et al. Detection of molecular targets on the surface of CD34+CD38- bone marrow cells in myelodysplastic syndromes. Cytometry A. 77 (9), 840-848 (2010).
- Wilkinson, A. C., et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature. 571 (7763), 117-121 (2019).
- Bai, T., et al. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine. 25 (10), 1566-1575 (2019).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Kobayashi, H., et al. Environmental Optimization Enables Maintenance of Quiescent Hematopoietic Stem Cells Ex Vivo. Cell Reports. 28 (1), 145-158 (2019).
- Danet, G. H., Pan, Y., Luongo, J. L., Bonnet, D. A., Simon, M. C. Expansion of human SCID-repopulating cells under hypoxic conditions. Journal of Clinical Investigation. 112 (1), 126-135 (2003).
- Kikushige, Y., et al. Human Flt3 is expressed at the hematopoietic stem cell and the granulocyte/macrophage progenitor stages to maintain cell survival. Journal of Immunology. 180 (11), 7358-7367 (2008).
- Ieyasu, A., et al. An All-Recombinant Protein-Based Culture System Specifically Identifies Hematopoietic Stem Cell Maintenance Factors. Stem Cell Reports. 8 (3), 500-508 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados