需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从舌头上皮和梅森奇姆/胚胎日12.5和8周大的老鼠的结缔细胞分离
摘要
我们开发了一个通用的协议,将大量高质量的单细胞从胚胎和成年小鼠舌头的上皮和间质/结缔组织分离出来。
摘要
细胞分离是研究单细胞水平和/或细胞群水平(例如单细胞RNA测序和原细胞培养)的重要程序。大量产生可行、健康的细胞至关重要,因此最佳条件取决于组织。舌头上皮和底层间质/结缔组织的细胞群是异质的,组织结构在不同的区域和不同的发育阶段各不相同。我们已经测试了在早期发育[胚胎日12.5(E12.5)]和年轻成人(8周)阶段从小鼠舌头上皮和间质/结缔组织分离细胞的协议。上皮和底层间质/结缔组织之间的干净分离很容易实现。然而,要进一步处理和分离细胞,大量产生可行的健康细胞,并仔细选择酶消化缓冲器、孵化时间、离心速度和时间至关重要。在 0.25% Trypsin-EDTA 中孵化分离的上皮或底层 mesenchyme/结缔组织,在 37 °C 时 30 分钟,然后在 200 x g 处进行离心 8 分钟,从而以高存活率(>90%) 获得高细胞产量无论鼠标阶段和舌头区域。此外,我们发现,胚胎和成人舌头分离的上皮细胞和间皮/结缔组织细胞都可以在基于细胞培养的介质中存活至少3小时,而不会显著降低细胞的生存能力。这些协议将用于要求在早期发育(E12.5)和年轻成人(8周)阶段从小鼠舌头中培养分离细胞的研究,这些阶段需要细胞从不同的组织隔间分离出来。
引言
哺乳动物的舌头是一个复杂的器官,对口感、口语和食物加工至关重要。它由多种高度组织组织组成,由夹层 / 结缔组织分割而成,并覆盖着包含味觉和味蕾的分层上皮板。舌头上皮和间质/结缔组织的细胞群是异质的。为了更好地了解舌头中特定类型细胞的功能和分布,有必要使用分离细胞进行研究。例如,单细胞RNA测序是单细胞转录分析的一种强大而高通量的方法,旨在以单细胞分辨率1、2、3、4来理解复杂组织的转录。初级细胞培养已被证明是研究干细胞/祖细胞的功能和分化的味蕾5,6的有用工具。这些研究需要大量的高质量隔离细胞群(例如,具有适当浓度和高生存能力的足够总细胞数量)。
因此,有必要从语言组织的不同区域和处于不同发育阶段的细胞分离出来。目前,没有详细的协议可用于细胞脱离舌头上皮和基础间皮/结缔组织。在这里,我们报告了一种优化的细胞分离方法,为需要高质量活细胞的实验(如单细胞RNA测序和原发干细胞培养)做准备。我们发现,选择酶消化缓冲器、温和的管道、选择悬念介质以及最佳的离心时间和速度对于产生这些大量优质细胞至关重要。
研究方案
在整个研究过程中,动物使用(C57BL/6小鼠)得到了佐治亚大学机构动物护理和使用委员会的批准,并符合国家卫生研究院关于照顾和使用动物进行研究的指南。
1. 动物使用
注:在佐治亚大学动物和乳品科学系的动物设施中,老鼠在12小时昼夜循环下22°C繁殖和饲养。
- 指定小鼠阴道塞检测当天中午为胚胎 (E) 天 0.5。在E12.5和产后小鼠8周大时使用胚胎进行以下实验。
2. 实验前准备
注:本协议所需的文书列在 材料表中。
- 实验前的高压灭菌仪器。在实验期间使用珠子消毒器对仪器进行消毒。
- 使用 70% 乙醇湿巾清洁手术区、解剖显微镜和生物安全柜。打开生物安全柜的紫外线,在实验程序前保持20分钟。
- 准备1:1消散(5.0毫克/mL)和拼贴酶(2.0毫克/mL)的酶混合物,最终浓度分别为2.5毫克和1.0毫克/mL,并使用0.22微米注射器过滤器7过滤溶液。
- 为成人舌头准备 1 mL 酶混合物或 0.5 mL 用于特定的舌头区域(例如后舌或前舌)。
- 为胚胎舌头准备2mL的酶混合物。
- 在 0.1 M PBS 中制作 10 mL 的 2.5% BSA,并使用 1 mL 注射器和 0.22μm 注射器过滤器过滤解决方案。
- 在 DMEM/F12 中制作 500 μL 的 5% FBS。
- 制作 3 毫升 DMEM/F12,其中包含 10% FBS 和 1% BSA,并使用 1 mL 注射器和 0.22μm 注射器滤清器过滤溶液。
3. 将舌头上皮从骨髓/基础结缔组织分离
- 从E12.5鼠舌的中位分离上皮
- 安乐死携带E12.5胚胎的定时怀孕雌性小鼠,将其放置在CO2 室,然后进行宫颈错位。
注:在发现怀孕雌性小鼠的阴道塞后,于12日中午12时(下午)后采集E12.5的小鼠胚胎。 - 将小鼠转移到手术区。使用 70% 乙醇湿润鼠标腹部,以防止毛皮进入操作部位。
- 用解剖剪刀打开腹部,露出携带胚胎的子宫角。使用解剖剪刀解剖子宫角,并在 100 mm 培养皿中将其转移到 15 mL 的新鲜 Tyrode 溶液中。
- 使用迷你剪刀和细钳在解剖显微镜下从子宫角解剖胚胎(图1A1)。
- 使用细钳小心地打开口腔宽,并用迷你剪刀解剖从可操纵物上取下的舌头(图1A2)。
- 在 100 毫米培养皿中使用 15 mL 的新鲜无菌 Tyrode 溶液清洗舌头。
- 将组织转移到 35 毫米培养皿中,用铲子和细钳在生物安全柜中使用消遣(2.5 毫克/mL)和拼贴酶 (1.0 毫克/mL) 的酶混合物。在37°C孵育20分钟。
- 将舌头转移到 100 毫米培养皿中新鲜无菌 Tyrode 溶液中的 15 mL,然后使用细钳轻轻地从上皮中取出上皮上的 mesenchyme。
注:在孵化过程中,在没有机械力的情况下,可分离上皮板。 - 在 100 毫米培养皿中,用 15 mL 的新鲜无菌 Tyrode 溶液两次清洗分离的表皮和梅森奇姆。
注:在细胞分离过程中,EDTA 将抑制消散和拼贴酶的活动(第 4.1 步)。
- 安乐死携带E12.5胚胎的定时怀孕雌性小鼠,将其放置在CO2 室,然后进行宫颈错位。
- 舌头上皮与成年小鼠基础结缔组织分离
- 将小鼠放入二氧化碳 室,在8周大时将其安乐死。确认鼠标被安乐死,没有呼吸和前爪捏反应。
- 将小鼠转移到手术区。用70%的乙醇湿老鼠头,防止毛皮进入口腔。
- 用解剖剪刀切开嘴角,打开口腔。用可塑性(图1B1)解剖舌头,并将其放在塑料盘中,并包裹一层塑料。
- 使用手术钳在解剖显微镜下保持舌头,通过后舌的尖端(图1B1,箭头)在舌的子上皮空间中注入解析(2.5毫克/mL)和拼贴酶(1.0毫克/mL)的酶混合物。
- 将1mL的酶混合物均匀地注射到整个舌头上,以便从前舌和后舌头收集组织。
- 将 0 . 5 mL 的酶混合物局部注射到前舌,以便从舌尖或后舌收集组织,用于环状组织收集。
注:当酶积累时,舌头会膨胀(图1B2)。轻轻注射这种酶可以防止压力损害上皮,并尽可能多地保持酶在舌头上。
- 用塑料包装舌头,在37°C时将舌头孵育30分钟。
- 使用迷你剪刀解剖舌尖和/或包皮纸,并使用铲子和细钳将组织转移到15mL的新鲜无菌Tyrode的溶液在100毫米培养皿。
- 使用迷你剪刀将上皮与酶消化亚上皮空间中的基础结缔组织分离。根据下游实验的要求,将组织修剪成适当的大小。
- 在 100 mm 培养皿中,用 15 mL 的新鲜无菌 Tyrode 溶液将分离的上皮和底层结缔组织洗两次。
注:在细胞分离过程中,EDTA 将抑制消散和拼贴酶的活动(第 4.1 步)。
4. 细胞分离
注:此处描述的细胞分离协议可应用于E12.5胚胎和8周大小鼠的舌头上皮和间质/结缔组织。为了减少细胞悬架搅拌和转移过程中的细胞损失,请使用商业低保留移液器提示或预涂层移液器提示,在 pH 7.48的 0.1 M PBS 中使用 2.5% BSA 。
- 使用铲子和细钳将组织转移到 3 mL 的 0.25% trypsin-EDTA 中,在 37 °C 的新 35 mm 培养盘中 30 分钟。 每5分钟轻轻搅拌组织,1 mL移液器提示。
注意:不要切割移液器尖端,因为尖端会对分离的细胞造成物理损伤。 - 在 DMEM/F12 中加入 500 μL 的 5% FBS,以阻止反应,并将介质转移到 5 mL 低绑定离心机管中。
- 离心细胞在室温下在200 x g 下悬架8分钟,并去除超自然。
- 使用 1 mL 移液器尖端在 3 mL 的 DMEM/F12 中轻轻重新悬浮细胞,然后使用 35μm 细胞过滤器过滤细胞。
- 离心细胞在室温下在200 x g 下悬架8分钟。取出大部分介质,将 50-300 μL 作为重新悬浮细胞的最终体积。
注:通过改变单细胞悬浮的最终体积,根据下游实验的要求调整细胞的浓度。
5. 使用血细胞仪进行细胞计数和生存能力测试
注意:为了提高测量精度,建议每个样本进行 3 次技术复制。
- 将单个细胞悬架的 5-10 μL 与等量的 Trypan 蓝色轻轻混合,并添加到血细胞仪中。
注意:使用前使用 70% 乙醇彻底清洁测高仪。测高仪上的灰尘颗粒将染成深蓝色,影响可行性测试的准确性。在显微镜下检查测高仪。 - 使用倒显微镜与成像系统,分别在 4 个方块(图 2、箭头)中计算总细胞数、活细胞数(白色)和由 Trypan 蓝色(图 2,箭头)染色的死细胞数(图 2)。
- 计算细胞浓度:
细胞浓度=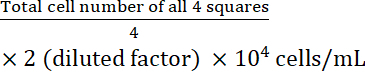
- 计算可行性:
可行性=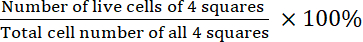
- 计算可行性:
结果
舌头上皮与底层的发痒/结缔组织分离
在胚胎小鼠舌头中,在适当的酶消化后,在亚上皮空间中可以看到间隙。在孵化过程中,某些舌头的上皮板在没有机械力的情况下被分离。
在成年小鼠舌头中,注射成功的酶通过注射区域的肿胀(图1B2)表示,这表明酶可以通过舌头进行。没有足够的酶和/或深针插入到中微和/或?...
讨论
迄今为止,还没有一个详细的协议可用于细胞脱离舌头上皮和基础间皮/结缔组织。此当前细胞分离协议提供了一个可重复的程序,以产生具有高细胞生存能力的单个细胞悬架(>90%)来自小鼠舌组织,包括上皮片和胚胎和产后阶段的脑膜/结缔组织,即使E12.5和成年小鼠的分离细胞大小不同。例如,E12.5小鼠舌头上皮和中微血球的分离细胞是一致的,小的,与8周大老鼠舌头的细胞大变异(从小到大?...
披露声明
未声明任何利益冲突。
致谢
这项研究得到了国家卫生研究院的支持,授予编号为R01DC012308和R21DC018089至HXL。我们感谢布雷特·马歇尔(佐治亚州大学、雅典大学)和埃贡·兰基尼(10X基因组学,普莱森顿,加利福尼亚州)在细胞分离方面的技术援助和咨询;弗朗西斯卡·吉布森·伯恩利(佐治亚州雅典大学)进行英语编辑。
材料
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
参考文献
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。