Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dissociation cellulaire de l’épithélium de la langue et du mesenchyme/tissu conjonctif des souris embryonnaires de 12,5 et de 8 semaines
Dans cet article
Résumé
Nous avons développé un protocole généralisé pour dissocier une grande quantité de cellules simples de haute qualité de l’épithélium et du mesenchyme/tissu conjonctif des langues embryonnaires et adultes de souris.
Résumé
La dissociation cellulaire a été une procédure essentielle pour les études au niveau de chaque cellule et/ou au niveau de la population cellulaire (p. ex. séquençage de l’ARN unicellulaire et culture cellulaire primaire). Il est essentiel de produire des cellules viables et saines en grande quantité, et les conditions optimales pour le faire dépendent des tissus. Les populations cellulaires dans l’épithélium de la langue et le mesenchyme/tissu conjonctif sous-jacent sont hétérogènes et les structures tissulaires varient selon les régions et à différents stades de développement. Nous avons testé des protocoles pour isoler des cellules de l’épithélium de langue de souris et du mesenchyme/tissu conjonctif aux stades de développement précoce [jour embryonnaire 12.5 (E12.5)] et de jeune adulte (8 semaines). Une séparation propre entre l’épithélium et le mesenchyme/tissu conjonctif fondamentaux était facile à accomplir. Cependant, pour traiter et isoler davantage les cellules, il est essentiel de produire des cellules saines viables en grande quantité et de sélectionner soigneusement le tampon de digestion enzymatique, le temps d’incubation et la vitesse et le temps de centrifugation. L’incubation de l’épithélium séparé ou du mésenchyme/tissu conjonctif sous-jacent dans 0,25 % de Trypsine-EDTA pendant 30 min à 37 °C, suivie d’une centrifugation à 200 x g pendant 8 min a donné un rendement élevé de cellules à un taux de viabilité élevé (>90 %) quels que soient les stades de la souris et les régions de la langue. D’ailleurs, nous avons constaté que les cellules épithéliales dissociées et mesenchymal/conjonctif de tissu des langues embryonnaires et adultes pourraient survivre dans le milieu basé sur la culture cellulaire pendant au moins 3 h sans diminution significative de viabilité cellulaire. Les protocoles seront utiles pour les études qui nécessitent la préparation de cellules isolées à partir de langues de souris à des stades de développement précoce (E12.5) et de jeune adulte (8 semaines) nécessitant une dissociation cellulaire de différents compartiments tissulaires.
Introduction
La langue des mammifères est un organe complexe essentiel pour le goût, la parole et la transformation des aliments. Il est composé de plusieurs types de tissus fortement organisés compartimentés par le mesenchyme/tissu conjonctif et recouverts d’une feuille épithéliale stratifiée contenant des papilles gustatives et des papilles gustatives. Les populations de cellules dans l’épithélium de langue et le mesenchyme/tissu conjonctif sont hétérogènes. Pour mieux comprendre les fonctions et la distribution d’un type particulier de cellules dans la langue, des études utilisant des cellules dissociées sont nécessaires. Par exemple, le séquençage de l’ARN unicellulaire est une méthode puissante et à haut débit pour le profilage transcriptomique dans des cellules individuelles, qui est conçue pour comprendre le transcriptome de tissus complexes à une résolution unicellulaire1,2,3,4. La culture cellulaire primaire s’est avérée être un outil utile pour étudier la fonction et la différenciation des cellules souches/progénitrices pour les papillesgustatives 5,6. Ces études nécessitent une grande quantité de populations de cellules isolées de haute qualité (p. ex. nombre total de cellules suffisant avec une concentration appropriée et une viabilité élevée).
Ainsi, il est nécessaire d’isoler les cellules de différentes régions des tissus linguaux et à différents stades de développement. Actuellement, il n’y a pas de protocole détaillé disponible pour la dissociation de cellules de l’épithélium de langue et du mesenchyme/tissu conjonctif sous-jacent. Ici, nous rapportons une méthode de dissociation cellulaire optimisée pour préparer les cellules à des expériences nécessitant une haute qualité de cellules vivantes telles que pour le séquençage de l’ARN unicellulaire et les cultures de cellules souches primaires. Nous avons constaté que la sélection du tampon de digestion enzymatique, le pipetage doux, la sélection du milieu de remise en suspension et le temps et la vitesse de centrifugation optimaux sont cruciaux pour générer ces grandes quantités de cellules de haute qualité.
Protocole
L’utilisation d’animaux (souris C57BL/6 tout au long de l’étude) a été approuvée par le Comité institutionnel de soins et d’utilisation des animaux de l’Université de Géorgie et était conforme aux lignes directrices des National Institutes of Health pour les soins et l’utilisation des animaux à des fins de recherche.
1. Utilisation des animaux
REMARQUE: Les souris ont été élevées et maintenues dans l’installation animale du département des sciences animales et laitières de l’Université de Géorgie à 22 ° C sous des cycles jour / nuit de 12 h.
- Désigner midi du jour de la détection des bouchons vaginaux chez la souris comme étant embryonnaire (E) jour 0,5. Utilisez des embryons à E12,5 et des souris postnatales à l’âge de 8 semaines pour les expériences suivantes.
2. Préparation avant l’expérience
REMARQUE : Les instruments requis pour ce protocole sont énumérés dans la table des matériaux.
- Instruments d’autoclave avant l’expérience. Stériliser les instruments à l’aide d’un stérilisateur de perles pendant l’expérience.
- Nettoyez la zone chirurgicale, le microscope de dissection et l’armoire de biosécurité à l’aide de lingettes à l’éthanol à 70%. Allumez la lumière UV de l’armoire de biosécurité et maintenez-la allumée pendant 20 minutes avant la procédure expérimentale.
- Préparer un mélange d’enzymes de 1:1 dispase (5,0 mg/mL) et de collagénase (2,0 mg/mL) à une concentration finale de 2,5 et 1,0 mg/mL respectivement, et filtrer la solution à l’aide d’un filtre à seringue de 0,22 μm7.
- Préparer 1 mL de mélange d’enzymes pour une langue adulte ou 0,5 mL pour une région spécifique de la langue (p. ex. langue postérieure ou antérieure).
- Préparer 2 mL de mélange d’enzymes pour les langues embryonnaires.
- Faire 10 mL de BSA à 2,5 % dans un PBS de 0,1 M et filtrer la solution à l’aide d’une seringue de 1 mL et d’un filtre à seringue de 0,22 μm.
- Faire 500 μL de FBS à 5% dans DMEM/F12.
- Faire 3 mL de DMEM/F12 contenant 10 % de FBS et 1 % de BSA et filtrer la solution à l’aide d’une seringue de 1 mL et d’un filtre à seringue de 0,22 μm.
3. Séparation de l’épithélium de la langue du mésenchyme/tissu conjonctif sous-jacent
- Séparation de l’épithélium du mesenchyme d’une langue de souris E12.5
- Euthanasier des souris femelles gravides chronométrées portant des embryons E12,5 en les plaçant dans une chambre de CO2 suivie d’une luxation cervicale.
REMARQUE: Les embryons de souris à E12.5 sont recueillis après 12 h (après-midi) le 12e jour suivant la détection du bouchon vaginal chez les souris femelles gravides. - Transférer les souris dans la zone chirurgicale. Mouiller l’abdomen de la souris à l’aide de 70 % d’éthanol pour empêcher la fourrure d’entrer dans le site d’opération.
- Ouvrez l’abdomen à l’aide de ciseaux disséquants pour exposer les cornes utérines portant des embryons. Disséquer les cornes utérines à l’aide de ciseaux disséquants et les transférer dans 15 mL de solution fraîche de Tyrode dans un plat de culture de 100 mm.
- Disséquer les embryons(figure 1A1)des cornes utérines sous un microscope de dissection à l’aide de mini-ciseaux et de pinces fines.
- Ouvrez soigneusement la cavité buccale en utilisant une pince fine et disséquez la langue de la mandibule à l’aide de mini-ciseaux(Figure 1A2).
- Laver les langues à l’aide de 15 mL de solution de Tyrode fraîchement stérile dans un plat de culture de 100 mm.
- Transférer les tissus dans 2 mL de mélange enzymatique de dispase (2,5 mg/mL) et de collagénase (1,0 mg/mL) dans un plat de culture de 35 mm avec une spatule et une pince fine dans une armoire de biosécurité. Incuber pendant 20 min à 37 °C.
- Transférer les langues à 15 mL de la solution de Tyrode stérile fraîche dans un plat de culture de 100 mm et retirer doucement le mésenchyme de l’épithélium de la face ventrale à l’aide d’une pince fine.
REMARQUE: Les feuilles épithéliales peuvent être séparées sans force mécanique pendant l’incubation. - Laver l’épithélium et le mésenchyme séparés deux fois dans 15 ml de solution de Tyrode fraîchement stérile dans un plat de culture de 100 mm.
REMARQUE: Les activités de la dispase et de la collagénase seront inhibées par l’EDTA dans la procédure de dissociation cellulaire (étape 4.1).
- Euthanasier des souris femelles gravides chronométrées portant des embryons E12,5 en les plaçant dans une chambre de CO2 suivie d’une luxation cervicale.
- Séparation de l’épithélium de la langue du tissu conjonctif sous-jacent des souris adultes
- Euthanasier la souris à l’âge de 8 semaines en la plaçant dans une chambre à CO2. Confirmer que la souris est euthanasiée sans respiration et sans réponse de pincement de la lacet.
- Transférer les souris dans la zone chirurgicale. Mouillez la tête de la souris à l’aide d’éthanol à 70% pour empêcher la fourrure de pénétrer dans la cavité buccale.
- Couper les coins de la bouche le long de la joue à l’aide de ciseaux disséquants pour ouvrir la cavité buccale. Disséquer la languette avec une mandibule(figure 1B1)et la placer dans un plat en plastique avec une couche de pellicule de plastique.
- À l’aide d’une pince chirurgicale pour maintenir la langue sous un microscope de dissection, injecter le mélange enzymatique de dispase (2,5 mg/mL) et de collagénase (1,0 mg/mL) dans l’espace sous-épithélial de la langue à travers le tranchant(figure 1B1,flèches) de la langue postérieure.
- Injectez 1 mL de mélange d’enzymes uniformément à la langue entière pour la collecte de tissu de la langue antérieure et postérieure.
- Injecter localement 0,5 mL de mélange d’enzymes à la langue antérieure pour la collecte de tissu de l’extrémité de la langue ou à la langue postérieure pour la collecte de tissu de papille circumvallate.
REMARQUE : La langue gonfle à mesure que l’enzyme s’accumule(figure 1B2). L’injection douce de l’enzyme peut empêcher la pression d’endommager l’épithélium et de garder autant d’enzymes que possible dans la langue.
- Envelopper la langue avec une pellicule de plastique et incuber la langue pendant 30 min à 37 °C.
- Utilisez des mini-ciseaux pour disséquer la pointe de la langue et/ou la papille circumvallate, et utilisez la spatule et la pince fine pour transférer le tissu à 15 mL de solution de Tyrode fraîchement stérile dans un plat de culture de 100 mm.
- Séparez l’épithélium du tissu conjonctif sous-jacent dans l’espace sous-épithélial enzymatique-digéré à l’aide de mini-ciseaux. Coupez les tissus à une taille appropriée selon les exigences des expériences en aval.
- Laver l’épithélium séparé et le tissu conjonctif sous-jacent deux fois dans 15 mL de solution de Tyrode fraîchement stérile dans un plat de culture de 100 mm.
REMARQUE: Les activités de la dispase et de la collagénase seront inhibées par l’EDTA dans la procédure de dissociation cellulaire (étape 4.1).
4. Dissociation cellulaire
REMARQUE: Le protocole de dissociation cellulaire décrit ici peut être appliqué à l’épithélium de la langue et au mesenchyme/tissu conjonctif chez les souris embryonnaires E12.5 et les souris âgées de 8 semaines. Pour réduire la perte de cellules pendant l’agitation et le transfert de la suspension cellulaire, utilisez des pointes de pipette commerciales à faible rétention ou des pointes de pipette pré-revêtues avec BSA à 2,5% dans un PBS 0,1 M à pH 7,48.
- Transférer les tissus à l’aide de spatule et de pinces fines à 3 mL de trypsine-EDTA à 0,25 % dans une nouvelle parabole de culture de 35 mm pendant 30 min à 37 °C. Agiter doucement les tissus toutes les 5 minutes avec des pointes de pipette de 1 mL.
REMARQUE: Ne coupez pas la pointe de la pipette, car le bord de coupe peut endommager physiquement les cellules dissociées. - Ajouter 500 μL de FBS à 5 % dans du DMEM/F12 pour arrêter la réaction et transférer le milieu dans un tube à centrifuger à faible liaison de 5 mL.
- Suspension de cellule centrifuge à 200 x g pendant 8 min à température ambiante et retirer le surnageant.
- Suspendre doucement les cellules dans 3 mL de DMEM/F12 contenant 10 % de FBS et 1 % de BSA à l’aide de pointes de pipette de 1 mL et filtrer les cellules à l’aide d’une passoire cellulaire de 70 μm, suivie d’une passoire cellulaire de 35 μm.
- Suspension de cellule centrifugeuse à 200 x g pendant 8 min à température ambiante. Retirez la majeure partie du milieu et laissez 50-300 μL comme volume final pour remettre en suspension les cellules.
REMARQUE: Ajustez la concentration des cellules en fonction des exigences des expériences en aval en modifiant le volume final de la suspension monocellulaire.
5. Comptage cellulaire et test de viabilité à l’aide de l’hémocytomètre
REMARQUE: Pour améliorer la précision de la mesure, 3 répétitions techniques sont recommandées pour chaque échantillon.
- Mélanger doucement 5-10 μL de la suspension unicellulaire avec un volume égal de bleu Trypan et ajouter sur l’hémocytomètre.
REMARQUE: Nettoyez soigneusement l’hémocytomètre à l’aide d’éthanol à 70% avant utilisation. Les particules de poussières sur l’hémocytomètre seront colorées en bleu foncé et affecteront la précision du test de viabilité. Vérifiez l’hémocytomètre au microscope. - Comptez le nombre total de cellules, le nombre de cellules vivantes (blanches) et le nombre de cellules mortes (bleu foncé) colorées par le bleu Trypan(Figure 2,flèches) respectivement en 4 carrés avec 16 grilles(Figure 2)à l’aide d’un microscope inversé avec système d’imagerie.
- Calculer la concentration cellulaire :
Concentration cellulaire =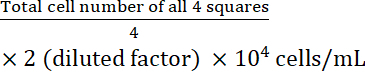
- Calculez la viabilité :
Viabilité =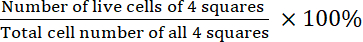
- Calculez la viabilité :
Résultats
Séparation de l’épithélium de langue du mesenchyme/tissu conjonctif sous-jacent
Dans la langue embryonnaire de souris, un espace dans l’espace sous-épithélial est visible après une digestion enzymatique appropriée. Les feuilles épithéliales de certaines langues sont séparées sans force mécanique pendant l’incubation.
Dans la langue de souris adulte, une injection d’enzymes réussie est indiquée par le gonflement dans les zones injectées (
Discussion
Jusqu’ici, il n’y a pas eu de protocole détaillé disponible pour la dissociation de cellules de l’épithélium de langue et du mesenchyme/tissu conjonctif fondamentaux. Ce protocole actuel de dissociation cellulaire fournit une procédure reproductible pour générer une suspension cellulaire unique avec une viabilité cellulaire élevée (>90%) des tissus de langue de souris, y compris les feuilles épithéliales et les tissus mésenchymes/conjonctifs aux stades embryonnaire et postnatal, même si les cellules i...
Déclarations de divulgation
Aucun conflit d’intérêts déclaré.
Remerciements
Cette étude a été soutenue par les National Institutes of Health, sous les numéros de subvention R01DC012308 et R21DC018089 à HXL. Nous remercions Brett Marshall (Université de Géorgie, Athènes, GA) et Egon Ranghini (10X GENOMICS, Pleasanton, CA) pour l’assistance technique et la consultation concernant la dissociation cellulaire; à Francisca Gibson Burnley (Université de Géorgie, Athènes, GA) pour l’édition anglaise.
matériels
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Références
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon