È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dissociazione cellulare dall'epitelio della lingua e dal mesenchima/tessuto connettivo dei topi embrionali di 12,5 e 8 settimane
In questo articolo
Riepilogo
Abbiamo sviluppato un protocollo generalizzato per dissociare una grande quantità di singole cellule di alta qualità dall'epitelio e dal mesenchima / tessuto connettivo delle lingue del topo embrionali e adulte.
Abstract
La dissociazione cellulare è stata una procedura essenziale per gli studi a livello di singola cellula e/o a livello di popolazione cellulare (ad esempio, sequenziamento dell'RNA a singola cellula e coltura cellulare primaria). Produrre cellule vitali e sane in grandi quantità è fondamentale e le condizioni ottimali per farlo sono dipendenti dai tessuti. Le popolazioni cellulari nell'epitelio della lingua e nel mesenchima sottostante /tessuto connettivo sono eterogenee e le strutture tissutali variano in diverse regioni e in diversi stadi di sviluppo. Abbiamo testato protocolli per isolare le cellule dall'epitelio della lingua del topo e dal mesenchima / tessuto connettivo nelle prime fasi di sviluppo [giornata embrionale 12.5 (E12.5)] e giovani adulti (8 settimane). Una separazione netta tra l'epitelio e il mesenchima/tessuto connettivo sottostante era facile da realizzare. Tuttavia, per elaborare e isolare ulteriormente le cellule, producendo cellule sane vitali in grandi quantità e un'attenta selezione del buffer di digestione enzimatica, del tempo di incubazione e della velocità e del tempo di centrifugazione sono fondamentali. L'incubazione di epitelio separato o mesenchima/tessuto connettivo sottostante nello 0,25% di tripsiderina-EDTA per 30 min a 37 °C, seguita da centrifugazione a 200 x g per 8 min ha portato a un alto rendimento delle cellule ad un alto tasso di vitalità (>90%) indipendentemente dalle fasi del mouse e dalle regioni della lingua. Inoltre, abbiamo scoperto che sia le cellule del tessuto epiteliale dissociato che mesenchimale /connettivo dalle lingue embrionali e adulte potrebbero sopravvivere nel mezzo a base di coltura cellulare per almeno 3 ore senza una significativa diminuzione della vitalità cellulare. I protocolli saranno utili per studi che richiedono la preparazione di cellule isolate dalle lingue del topo nelle prime fasi di sviluppo (E12.5) e giovani adulti (8 settimane) che richiedono la dissociazione cellulare da diversi compartimenti tissutali.
Introduzione
La lingua dei mammiferi è un organo complesso critico per il gusto, il parlare e la lavorazione degli alimenti. È composto da più tipi di tessuti altamente organizzati compartimentati da mesenchima / tessuto connettivo e coperti da un foglio epiteliale stratificato contenente papille gustative e papille gustative. Le popolazioni cellulari sia nell'epitelio della lingua che nel mesenchima/tessuto connettivo sono eterogenee. Per comprendere meglio le funzioni e la distribuzione di un particolare tipo di cellule nella lingua, sono necessari studi utilizzando cellule dissociate. Ad esempio, il sequenziamento dell'RNA a singola cella è un metodo potente e ad alta produttività per la profilazione trascrittamica nelle singole cellule, progettato per comprendere il trascrittame del tessuto complesso con una risoluzione a singola cellula1,2,3,4. La coltura cellulare primaria si è dimostrata uno strumento utile per studiare la funzione e la differenziazione delle cellule staminali/progenitrici per le papillegustative 5,6. Questi studi richiedono una grande quantità di popolazioni cellulari isolate di alta qualità (ad esempio, numero totale sufficiente di cellule con concentrazione adeguata e alta vitalità).
Pertanto, è necessario isolare le cellule da diverse regioni dei tessuti linguali e in diverse fasi di sviluppo. Attualmente, non esiste un protocollo dettagliato disponibile per la dissociazione cellulare dall'epitelio della lingua e dal mesenchima /tessuto connettivo sottostante. Qui, reportiamo un metodo di dissociazione cellulare ottimizzato per preparare le cellule per esperimenti che richiedono un'alta qualità di cellule vive come per il sequenziamento dell'RNA a singola cellula e le colture primarie di cellule staminali. Abbiamo scoperto che la selezione del tampone di digestione enzimatica, la pipettazione delicata, la selezione del mezzo di resuspensione e il tempo e la velocità di centrifugazione ottimali sono cruciali per generare queste grandi quantità di cellule di alta qualità.
Protocollo
L'uso degli animali (topi C57BL/6 durante tutto lo studio) è stato approvato dal Comitato istituzionale per la cura e l'uso degli animali dell'Università della Georgia ed è stato in conformità con le Linee guida del National Institutes of Health per la cura e l'uso degli animali per la ricerca.
1. Uso animale
NOTA: I topi sono stati allevati e mantenuti nella struttura animale del dipartimento di scienze animali e lattiero-casearie dell'Università della Georgia a 22 °C sotto i cicli giorno/notte di 12 ore.
- Designare mezzogiorno del giorno di rilevamento della spina vaginale nei topi come giorno embrionale (E) 0,5. Utilizzare embrioni a E12.5 e topi postnatali a 8 settimane di età per i seguenti esperimenti.
2. Preparazione prima dell'esperimento
NOTA: Gli strumenti necessari per questo protocollo sono elencati nella tabella dei materiali.
- Strumenti autoclave prima dell'esperimento. Sterilizzare gli strumenti utilizzando uno sterilizzatore di perline durante l'esperimento.
- Pulire l'area chirurgica, il microscopio sezionato e l'armadio per la biosicurezza utilizzando il 70% di salviette di etanolo. Accendere la luce UV dell'armadio di biosicurezza e tenerla in funzione per 20 minuti prima della procedura sperimentale.
- Preparare una miscela enzimatica di 1:1 dispasi (5,0 mg/ml) e collagenasi (2,0 mg/ml) ad una concentrazione finale rispettivamente di 2,5 e 1,0 mg/ml e filtrare la soluzione utilizzando il filtro siringa da 0,22 μm7.
- Preparare 1 mL di miscela enzimatica per una lingua adulta o 0,5 mL per una regione specifica della lingua (ad esempio, lingua posteriore o anteriore).
- Preparare 2 mL di miscela enzimatica per le lingue embrionali.
- Effettuare 10 ml di BSA al 2,5% in 0,1 M PBS e filtrare la soluzione utilizzando una siringa da 1 ml e un filtro siringa da 0,22 μm.
- Fare 500 μL di FBS al 5% in DMEM/F12.
- Effettuare 3 ml di DMEM/F12 contenenti 10% FBS e 1% BSA e filtrare la soluzione utilizzando una siringa da 1 ml e un filtro siringa da 0,22 μm.
3. Separazione dell'epitelio della lingua dal mesenchima/tessuto connettivo sottostante
- Separazione dell'epitelio dal mesenchima di una lingua del topo E12.5
- Eutanasia topi femmine gravidi a tempo che trasportano embrioni E12.5 posizionandolo in una camera di CO2 seguita da lussazione cervicale.
NOTA: Gli embrioni di topo a E12.5 vengono raccolti dopo le 12:00 (pomeriggio) del 12 ° giorno dopo il rilevamento della spina vaginale nei topi femmine in gravidanza. - Trasferire i topi nell'area chirurgica. Bagnare l'addome del topo usando il 70% di etanolo per evitare che la pelliccia entra nel sito operativo.
- Aprire l'addome usando forbici sezionanti per esporre le corna uterine che trasportano embrioni. Sezionare le corna uterine utilizzando forbici sezionanti e trasferirlo a 15 mL di soluzione di Tirolo fresco in un piatto da coltura da 100 mm.
- Sezionare gli embrioni (Figura 1A1) dalle corna uterina sotto un microscopio sezionante utilizzando mini-forbici e forcep fini.
- Aprire accuratamente la cavità orale ampia utilizzando forcep fini e sezionare la lingua dalla mattiera utilizzando mini-forbici (Figura 1A2).
- Lavare le lingue utilizzando 15 mL di soluzione di Tirolo sterile fresco in un piatto da coltura da 100 mm.
- Trasferire i tessuti a 2 mL di miscela enzimatica di dispasi (2,5 mg/mL) e collagenasi (1,0 mg/mL) in un piatto di coltura da 35 mm con spatola e forceps fini in un armadio di biosicurezza. Incubare per 20 min a 37 °C.
- Trasferire le lingue a 15 mL di soluzione di Tirolo sterile fresco in un piatto di coltura da 100 mm e rimuovere delicatamente il mesenchima dall'epitelio dal lato ventrale utilizzando forcep fini.
NOTA: I fogli epiteliali possono essere separati senza forza meccanica durante l'incubazione. - Lavare due volte l'epitelia separata e il mesenchima in 15 mL di soluzione di Tyrode sterile fresco in un piatto da coltura da 100 mm.
NOTA: Le attività della dispasi e della collagenasi saranno inibite dall'EDTA nella procedura di dissociazione cellulare (fase 4.1).
- Eutanasia topi femmine gravidi a tempo che trasportano embrioni E12.5 posizionandolo in una camera di CO2 seguita da lussazione cervicale.
- Separazione dell'epitelio della lingua dal tessuto connettivo sottostante dei topi adulti
- Eutanasia il topo a 8 settimane di età posizionandolo in una camera di CO2. Confermare che il mouse è eutanasiato senza respiri e risposta forepaw-pinch.
- Trasferire i topi nell'area chirurgica. Bagnare la testa del topo usando il 70% di etanolo per evitare che la pelliccia entra nella cavità orale.
- Tagliare gli angoli della bocca lungo la guancia usando forbici sezionanti per aprire la cavità orale. Sezionare la lingua con mattiglia(Figura 1B1) e posizionare in un piatto di plastica con uno strato di involucro di plastica.
- Utilizzando le forcep chirurgiche per tenere la lingua al microscopio sezionato, iniettare la miscela enzimatica di dispasi (2,5 mg/mL) e collagenasi (1,0 mg/mL) nello spazio sub-epiteliale della lingua attraverso il tagliente(Figura 1B1, frecce) della lingua posteriore.
- Iniettare 1 mL di miscela enzimatica uniformemente a tutta la lingua per la raccolta dei tessuti sia dalla lingua anteriore che posteriore.
- Iniettare 0,5 mL di miscela enzimatica localmente alla lingua anteriore per la raccolta dei tessuti dalla punta della lingua o alla lingua posteriore per la raccolta circonvallata dei tessuti di papilla.
NOTA: La lingua si gonfierà man mano che l'enzima si accumula(Figura 1B2). L'iniezione delicata dell'enzima può impedire che la pressione danneggi l'epitelio e mantenere il maggior enzima possibile nella lingua.
- Avvolgere la lingua con un involucro di plastica e incubare la lingua per 30 minuti a 37 °C.
- Utilizzare mini-forbici per sezionare la punta della lingua e / o la papilla circonvallata e utilizzare spatole e forcelle fini per trasferire i tessuti a 15 mL di soluzione di Tirolo sterile fresco in un piatto di coltura da 100 mm.
- Separare l'epitelio dal tessuto connettivo sottostante nello spazio sub-epiteliale digerito dall'enzima usando mini-forbici. Tagliare i tessuti a una dimensione adeguata in base al requisito degli esperimenti a valle.
- Lavare l'epitelio separato e il tessuto connettivo sottostante due volte in 15 mL di soluzione di Tirolo sterile fresco in un piatto di coltura da 100 mm.
NOTA: Le attività della dispasi e della collagenasi saranno inibite dall'EDTA nella procedura di dissociazione cellulare (fase 4.1).
4. Dissociazione cellulare
NOTA: Il protocollo di dissociazione cellulare qui descritto può essere applicato all'epitelio della lingua e al mesenchima / tessuto connettivo sia nei topi embrionali E12.5 che in quello di 8 settimane. Per ridurre la perdita di cellule durante l'agitazione e il trasferimento delle sospensioni cellulari, utilizzare punte commerciali a bassa ritenzione o punte di pipetta pre-rivestite con BSA al 2,5% in 0,1 M PBS a pH 7,48.
- Trasferire i tessuti utilizzando spatola e forcelle fini a 3 mL dello 0,25% di tripsiderina-EDTA in un nuovo piatto da coltura da 35 mm per 30 min a 37 °C. Agitare delicatamente i tessuti ogni 5 minuti con punte di pipetta da 1 mL.
NOTA: Non tagliare la punta della pipetta, poiché il tagliente può danneggiare fisicamente le cellule dissociate. - Aggiungere 500 μL di FBS al 5% in DMEM/F12 per interrompere la reazione e trasferire il mezzo in un tubo di centrifuga a bassa legatura da 5 ml.
- Centrifugare la sospensione cellulare a 200 x g per 8 minuti a temperatura ambiente e rimuovere il supernatante.
- Sospendere delicatamente le cellule in 3 mL di DMEM/F12 contenenti 10% FBS e 1% BSA utilizzando punte di pipetta da 1 mL e filtrare le cellule utilizzando un colino cellulare da 70 μm, seguito da un colino cellulare da 35 μm.
- Sospensione della cella di centrifuga a 200 x g per 8 minuti a temperatura ambiente. Rimuovere la maggior parte del mezzo e lasciare 50-300 μL come volume finale per sospendere di nuovo le celle.
NOTA: Regolare la concentrazione delle cellule in base alle esigenze degli esperimenti a valle modificando il volume finale della sospensione a singola cella.
5. Test di conteggio cellulare e vitalità con emocitometro
NOTA: Per migliorare la precisione di misura, sono consigliate 3 repliche tecniche per ogni campione.
- Mescolare delicatamente 5-10 μL della sospensione a singola cella con un volume uguale di blu Trypan e aggiungere all'emocitometro.
NOTA: Pulire accuratamente l'emocitometro utilizzando il 70% di etanolo prima dell'uso. Le particelle di polvere sull'emocitometro saranno macchiate di blu scuro e influenzeranno l'accuratezza del test di vitalità. Controllare l'emocitometro al microscopio. - Contare il numero totale di celle, il numero di celle vive (bianche) e il numero di celle morte (blu scuro) macchiate rispettivamente da Trypan blue (Figura 2, frecce) in 4 quadrati con 16 griglie (Figura 2) utilizzando il microscopio invertito con sistema di imaging.
- Calcolare la concentrazione cellulare:
Concentrazione cellulare =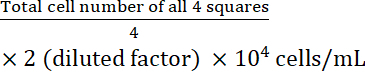
- Calcola la fattibilità:
Vitalità =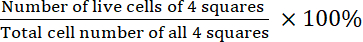
- Calcola la fattibilità:
Risultati
Separazione dell'epitelio della lingua dal mesenchima/tessuto connettivo sottostante
Nella lingua embrionale del topo, uno spazio nello spazio sub-epiteliale è visibile dopo una corretta digestione enzimatica. I fogli epiteliali di alcune lingue sono separati senza forza meccanica durante l'incubazione.
Nella lingua adulta del topo, un'iniezione enzimatica di successo è indicata dal gonfiore nelle aree iniettate (Figura 1B2...
Discussione
Ad oggi, non è stato disponibile un protocollo dettagliato per la dissociazione cellulare dall'epitelio della lingua e dal mesenchima /tessuto connettivo sottostante. Questo protocollo di dissociazione cellulare corrente fornisce una procedura riproducibile per generare una sospensione a singola cella con un'elevata vitalità cellulare (>90%) dai tessuti della lingua del topo, compresi i fogli epiteliali e i tessuti mesenchima/connettivi sia allo stadio embrionale che postnatale, anche se le cellule isolate di E12,5 e t...
Divulgazioni
Nessun conflitto di interessi dichiarato.
Riconoscimenti
Questo studio è stato supportato dai National Institutes of Health, dal numero di sovvenzione R01DC012308 e dall'R21DC018089 all'HXL. Grazie a Brett Marshall (Università della Georgia, Atene, GA) ed Egon Ranghini (10X GENOMICS, Pleasanton, CA) per l'assistenza tecnica e la consultazione sulla dissociazione cellulare; a Francisca Gibson Burnley (Università della Georgia, Atene, GA) per l'editing in inglese.
Materiali
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Riferimenti
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon