Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Disociación Celular Del Epitelio De La Lengua Y El Meténquima / Tejido Conectivo De Los Ratones Embrionarios-Día 12.5 Y 8-Semana-Viejo
En este artículo
Resumen
Hemos desarrollado un protocolo generalizado para disociar una gran cantidad de células individuales de alta calidad del epitelio y el meténquima / tejido conectivo de lenguas de ratón embrionarias y adultas.
Resumen
La disociación celular ha sido un procedimiento esencial para los estudios a nivel de células individuales y/o a nivel de población celular (por ejemplo, secuenciación de ARN unicelular y cultivo celular primario). Producir células viables y sanas en grandes cantidades es crítico, y las condiciones óptimas para hacerlo dependen del tejido. Las poblaciones celulares en el epitelio de la lengua y el tejido conectivo/meténquima subyacente son heterogéneos y las estructuras tisulares varían en diferentes regiones y en diferentes etapas de desarrollo. Hemos probado protocolos para aislar las células del epitelio de la lengua del ratón y del tejido del mesenchyme/conectivo en las etapas tempranas del desarrollo [día embrionario 12.5 (E12.5)] y del adulto joven (8 semanas). Una separación limpia entre el epitelio y el mesenchyme/el tejido conectivo subyacente era fácil de lograr. Sin embargo, para procesar y aislar aún más las células, el rendimiento de células sanas viables en grandes cantidades, y la selección cuidadosa de tampón de digestión enzimática, tiempo de incubación, y la velocidad y el tiempo de centrifugación son críticos. La incubación del epitelio separado o del tejido conectivo/del mesenchyme subyacente en el 0,25% Tripsina-EDTA durante 30 minutos en el °C 37, seguido por la centrifugación en 200 x g por 8 minutos dio lugar a un alto rendimiento de células en una alta tarifa de viabilidad (>90%) independientemente de las etapas del ratón y las regiones de la lengua. Por otra parte, encontramos que las células epiteliales y mesenquimales/conectivas disociadas del tejido de lengüetas embrionarias y adultas podrían sobrevivir en el medio cultivo-basado celular por lo menos 3 h sin una disminución significativa de la viabilidad de la célula. Los protocolos serán útiles para los estudios que requieren la preparación de células aisladas de lenguas de ratón en etapas de desarrollo temprano (E12.5) y adultos jóvenes (8 semanas) que requieren disociación celular de diferentes compartimentos tisulares.
Introducción
La lengua de los mamíferos es un órgano complejo crítico para el gusto, el habla y el procesamiento de alimentos. Se compone de múltiples tipos de tejidos altamente organizados compartimentados por el meténquima / tejido conectivo y cubiertos por una hoja epitelial estratificada que contiene papilas gustativas y papilas gustativas. Las poblaciones celulares tanto en el epitelio de la lengua como en el meténquima/tejido conectivo son heterogéneas. Para comprender mejor las funciones y la distribución de un tipo particular de células en la lengua, son necesarios estudios con células disociadas. Por ejemplo, la secuenciación de ARN unicelular es un método potente y de alto rendimiento para el perfilado transcriptómico en células individuales, que está diseñado para comprender el transcriptoma de tejidos complejos a una resolución unicelular1,2,3,4. El cultivo celular primario ha demostrado ser una herramienta útil para estudiar la función y diferenciación de las células madre/progenitoras para las papilas gustativas5,6. Estos estudios requieren una gran cantidad de poblaciones celulares aisladas de alta calidad (por ejemplo, suficiente número total de células con concentración adecuada y alta viabilidad).
Por lo tanto, existe la necesidad de aislar las células de diferentes regiones de los tejidos linguales y en diferentes etapas de desarrollo. Actualmente, no hay un protocolo detallado disponible para la disociación celular del epitelio de la lengua y el tejido conectivo/metanfimo subyacente. Aquí, se presenta un método de disociación celular optimizado para preparar las células para experimentos que requieren una alta calidad de las células vivas, tales como para la secuenciación de ARN unicelular y cultivos de células madre primarias. Encontramos que la selección de tampón de digestión enzimática, pipeteo suave, selección de medio de resuspensión, y el tiempo de centrifugación óptima y la velocidad son cruciales para generar estas grandes cantidades de células de alta calidad.
Protocolo
El uso de animales (ratones C57BL/6 a lo largo del estudio) fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Georgia y estuvo de acuerdo con las Directrices de los Institutos Nacionales de Salud para el cuidado y uso de animales para la investigación.
1. Uso animal
NOTA: Los ratones fueron criados y mantenidos en las instalaciones de animales del departamento de Ciencia Animal y Lechera de la Universidad de Georgia a 22 °C bajo ciclos día/noche de 12 h.
- Designar el mediodía del día de detección del tapón vaginal en ratones como embrionario (E) día 0,5. Utilice embriones en E12.5 y ratones postnatales a las 8 semanas de edad para los siguientes experimentos.
2. Preparación antes del experimento
NOTA: Los instrumentos necesarios para este protocolo se enumeran en la Tabla de materiales.
- Instrumentos de autoclave antes del experimento. Esterilice los instrumentos usando un esterilizador de cuentas durante el experimento.
- Limpie el área quirúrgica, el microscopio de disección y el gabinete de bioseguridad usando toallitas de etanol al 70%. Encienda la luz UV del gabinete de bioseguridad y manténgala encendla durante 20 minutos antes del procedimiento experimental.
- Preparar una mezcla enzimática de 1:1 dispasa (5,0 mg/mL) y colagenasa (2,0 mg/mL) hasta una concentración final de 2,5 y 1,0 mg/mL respectivamente, y filtrar la solución utilizando un filtro de jeringa de 0,22 μm7.
- Prepare 1 mL de mezcla enzimática para una lengua adulta o 0,5 mL para una región específica de la lengua (por ejemplo, lengua posterior o anterior).
- Preparar 2 mL de mezcla enzimática para lenguas embrionarias.
- Hacer 10 mL de BSA al 2,5% en PBS de 0,1 M y filtrar la solución con jeringa de 1 mL y filtro de jeringa de 0,22 μm.
- Hacer 500 μL de FBS al 5% en DMEM/F12.
- Hacer 3 mL de DMEM/F12 que contenga 10% de FBS y 1% de BSA y filtrar la solución usando 1 mL de jeringa y 0,22 μm de filtro de jeringa.
3. Separación del epitelio de la lengua del meténquima/tejido conectivo subyacente
- Separación del epitelio del mesenchyme de una lengüeta del ratón E12.5
- Eutanasia cronometar ratones hembras preñadas que llevan embriones E12.5 colocándolos en una cámara de CO2 seguido de dislocación cervical.
NOTA: Los embriones de ratón en E12.5 se recogen después de las 12 pm (tarde) en el día 12 después de la detección de tapón vaginal en los ratones hembras embarazadas. - Transferir ratones al área quirúrgica. Moje el abdomen del ratón usando etanol al 70% para evitar que el pelaje entre en el sitio de operación.
- Abra el abdomen usando tijeras de disección para exponer los cuernos uterinos que transportan embriones. Diseccione los cuernos uterinos usando tijeras de disección y transfiéralo a 15 mL de solución fresca de Tyrode en un plato de cultivo de 100 mm.
- Diseccionar los embriones(Figura 1A1)de los cuernos uterinos bajo un microscopio de disección utilizando mini-tijeras y fórceps finos.
- Abra cuidadosamente la cavidad bucal de par en par mediante el uso de fórceps finos y diseccione la lengua de la mandíbula usando mini-tijeras (Figura 1A2).
- Lave las lenguas usando 15 mL de solución de Tyrode estéril fresca en un plato de cultivo de 100 mm.
- Transferir los tejidos a 2 mL de mezcla enzimática de dispasa (2,5 mg/mL) y colagenasa (1,0 mg/mL) en un plato de cultivo de 35 mm con espátula y fórceps finos en un gabinete de bioseguridad. Incubar durante 20 min a 37 °C.
- Transfiera las lengüetas a 15 mL de solución de Tyrode estéril fresca en un plato de cultivo de 100 mm y retire suavemente el meténquima del epitelio del lado ventral usando fórceps finos.
NOTA: Las hojas epiteliales se pueden separar sin fuerza mecánica durante la incubación. - Lave los epitelios separados y el meténquima dos veces en 15 mL de solución de Tyrode estéril fresca en un plato de cultivo de 100 mm.
NOTA: Las actividades de dispasa y colagenasa serán inhibidas por EDTA en el procedimiento de disociación celular (paso 4.1).
- Eutanasia cronometar ratones hembras preñadas que llevan embriones E12.5 colocándolos en una cámara de CO2 seguido de dislocación cervical.
- Separación del epitelio de la lengua del tejido conectivo subyacente de ratones adultos
- Eutanasiar el ratón a las 8 semanas de edad colocándolo en una cámara de CO2. Confirme que el ratón está eutanásico sin respiraciones y la respuesta de anteoje.Confirm that the mouse is euthanized with no breaths and forepaw-pinch response.
- Transfiera los ratones al área quirúrgica. Moje la cabeza del ratón usando etanol al 70% para evitar que el pelaje entre en la cavidad oral.
- Corte las comisuras de la boca a lo largo de la mejilla usando tijeras de disección para abrir la cavidad oral. Diseccione la lengua con mandíbula (Figura 1B1) y colóquela en un plato de plástico con una capa de envoltura de plástico.
- Usando fórceps quirúrgicos para sujetar la lengua bajo un microscopio de disección, inyecte la mezcla enzimática de dispasa (2,5 mg/mL) y colagenasa (1,0 mg/mL) en el espacio subepitelial de la lengua a través del borde de corte(Figura 1B1,flechas) de la lengua posterior.
- Inyecte 1 mL de mezcla enzimática uniformemente a toda la lengua para la recolección de tejido de la lengua anterior y posterior.
- Inyecte 0,5 mL de mezcla enzimática localmente en la lengua anterior para la recolección de tejido desde la punta de la lengua o en la lengua posterior para la recolección de tejido de papila circunvalada.
NOTA: La lengua se hinchará a medida que la enzima se acumule (Figura 1B2). La inyección suave de la enzima puede evitar que la presión dañe el epitelio y mantener la mayor cantidad de enzima posible en la lengua.
- Envuelva la lengua con una envoltura de plástico e incube la lengua durante 30 min a 37 °C.
- Use mini-tijeras para diseccionar la punta de la lengua y/o la papila circunvalada, y use espátula y fórceps finos para transferir tejido a 15 mL de solución de Tyrode estéril fresca en un plato de cultivo de 100 mm.
- Separe el epitelio del tejido conectivo subyacente en el espacio subepitelial digerido por enzimas usando mini-tijeras. Recorte los tejidos a un tamaño adecuado de acuerdo con el requisito de los experimentos aguas abajo.
- Lave el epitelio separado y el tejido conectivo subyacente dos veces en 15 mL de solución de Tyrode estéril fresca en un plato de cultivo de 100 mm.
NOTA: Las actividades de dispasa y colagenasa serán inhibidas por EDTA en el procedimiento de disociación celular (paso 4.1).
4. Disociación celular
NOTA: El protocolo de disociación celular descrito aquí se puede aplicar al epitelio de la lengua y al tejido teniso/conectivo en ratones embrionarios E12.5 y de 8 semanas de edad. Para reducir la pérdida celular durante la agitación y la transferencia de la suspensión celular, utilice puntas de pipeta comerciales de baja retención o puntas de pipeta pre-recubiertas con BSA al 2,5% en PBS de 0,1 M a pH 7,48.
- Transferir los tejidos usando espátula y fórceps finos a 3 mL de tripsina-EDTA al 0,25% en un nuevo plato de cultivo de 35 mm durante 30 min a 37 °C. Agitar suavemente los tejidos cada 5 min con puntas de pipeta de 1 mL.
NOTA: No corte la punta de la pipeta, ya que el borde de corte puede dañar físicamente las células disociadas. - Añadir 500 μL de FBS al 5% en DMEM/F12 para detener la reacción y transferir el medio a un tubo de centrífuga de baja unión de 5 mL.
- Centrífuga suspensión de la célula a 200 x g durante 8 min a temperatura ambiente y retire el sobrenadante.
- Vuelva a suspender suavemente las células en 3 mL de DMEM/F12 que contengan 10% de FBS y 1% de BSA utilizando puntas de pipeta de 1 mL y filtre las células utilizando un colador de células de 70 μm, seguido de un colador de células de 35 μm.
- Suspensión de celda de centrífuga a 200 x g durante 8 min a temperatura ambiente. Retire la mayor parte del medio y deje 50-300 μL como volumen final para volver a suspender las células.
NOTA: Ajuste la concentración de células de acuerdo con los requisitos de los experimentos posteriores cambiando el volumen final de la suspensión unicelular.
5. Recuento celular y prueba de viabilidad con hemocitómetro
NOTA: Para mejorar la precisión de la medición, se recomiendan 3 réplicas técnicas para cada muestra.
- Mezcle suavemente 5-10 μL de la suspensión unicelular con un volumen igual de azul Trypan y agregue sobre el hemocitómetro.
NOTA: Limpie el hemocitómetro a fondo usando etanol al 70% antes de usarlo. Las partículas de polvo en el hemocitómetro se teñirán de azul oscuro y afectarán la precisión de la prueba de viabilidad. Revise el hemocitómetro bajo un microscopio. - Cuente el número total de células, el número de células vivas (blancas) y el número de células muertas (azul oscuro) teñidas por trypan azul(Figura 2,flechas) respectivamente en 4 cuadrados con 16 cuadrículas(Figura 2)utilizando microscopio invertido con sistema de imágenes.
- Calcular la concentración celular:
Concentración celular =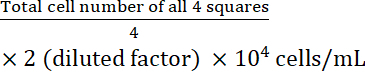
- Calcular la viabilidad:
Viabilidad =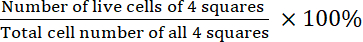
- Calcular la viabilidad:
Resultados
Separación del epitelio de la lengua del mesenquima/tejido conectivo subyacente
En la lengua embrionaria del ratón, un boquete en el espacio subepitelial es visible después de la digestión apropiada de la enzima. Las hojas epiteliales de algunas lenguas se separan sin fuerza mecánica durante la incubación.
En la lengua adulta del ratón, una inyección enzimática exitosa se indica por la hinchazón en las áreas inyectadas (Figura 1B
Discusión
Hasta la fecha, no ha habido un protocolo detallado disponible para la disociación de la célula del epitelio de la lengüeta y del tejido conectivo/del mesenchyme/del tejido conectivo subyacentes. Este protocolo de disociación celular actual proporciona un procedimiento reproducible para generar una suspensión unicelular con una alta viabilidad celular (>90%) de los tejidos de la lengua del ratón, incluyendo las hojas epiteliales y los tejidos del mesenchyme/connective en las etapas embrionarias y postnatales aunque...
Divulgaciones
No se declaran conflictos de intereses.
Agradecimientos
Este estudio fue apoyado por los Institutos Nacionales de Salud, número de subvención R01DC012308 y R21DC018089 a HXL. Damos las gracias a Brett Marshall (Universidad de Georgia, Athens, GA) y Egon Ranghini (10X GENOMICS, Pleasanton, CA) por la asistencia técnica y la consulta con respecto a la disociación celular; a Francisca Gibson Burnley (Universidad de Georgia, Athens, GA) para la edición en inglés.
Materiales
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Referencias
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados