Method Article
在囊性纤维化肺中的伪肌瘤和金黄色葡萄球菌生物膜的前体内模型中进行抗生素疗效测试
摘要
此工作流程可用于使用囊性纤维化个体肺部细菌生物膜的既定前活体模型进行抗生素易感性测试。使用此模型可以提高MBEC(最低生物膜根除浓度)检测的临床有效性。
摘要
抗生素的有效处方,目前存在于囊性纤维化(CF)的个人肺部细菌生物膜,是有限的抗生素易感性测试(AST)结果使用标准诊断方法(如肉汤微分,磁盘扩散,或Etest)和抗生素治疗后的临床结果之间的不良相关性。通过使用现成的生物膜生长平台改进 AST 的尝试显示效果几乎没有改善。体外生物膜系统模仿CF肺的物理化学环境的能力有限,因此细菌生理学和生物膜结构也阻碍了CF感染新疗法的发现。在这里,我们提出了一个协议,执行CF病原体的AST成长为成熟,在体内一样的生物膜,在一个前体内CF肺模型,由猪支气管组织和合成CF痰(前活体猪肺,EVPL)。
使用标准实验室介质或微粒板中合成 CF 痰的各种配方,存在多个体外检测生物膜易感性测试。生长介质和生物膜基板(聚苯乙烯板与支气管组织)都可能影响生物膜抗生素耐受性。我们表现出对临床伪肌氨酸和金黄色葡萄球菌分离的耐受性增强,抗生素治疗生物膜的效果与标准微分液测定中的最低抑制浓度(MIC)或磁盘扩散测定中的敏感/耐药性分类无关。
前活体平台可用于患者样本的定制生物膜 AST,并作为药物研发过程中潜在抗生物膜制剂的增强测试平台。通过使用更多类似体内的测试平台,改善抗生物膜药物的处方或加速发现,可以大大改善CF患者的健康结果,并降低临床治疗和发现研究的成本。
引言
慢性生物膜感染影响正常免疫防御能力受损的个人。有风险的群体包括那些有遗传条件囊性纤维化(CF)1。在婴儿期早期呼吸道中异常厚的粘液的殖民化导致支气管2、3的难以解决的生物膜感染。细菌作为广泛基质封装生物膜的生长是区分免疫功能低下的人的慢性感染与健康宿主的急性感染的一个因素,生物膜状态既保护细菌免受抗生素接触(由于通过基质的扩散减少),并降低其抗生素易感性(例如,通过诱导静默或上调节的排泄泵)4,5。然而,宿主组织生理学和化学的疾病特异性变化进一步改变了急性感染或标准实验室生长条件下观察到的细菌生理学。CF的主要例子包括使用不寻常的碳源,如脂肪酸和氨基酸从肺表面活性剂释放出来,由粘液的微生物降解产生,微量营养素的释放,如从受损组织的铁,和微生物6,7,8。
因此,特定生物膜感染环境中的特定物理化学条件会影响对抗生素的反应。首先,细胞外基质的结构和深度取决于当地的环境条件,如养分或剪切力。其次,环境线索可以触发特定抗生素耐药基因的表达。例如,CF病原体伪多莫纳斯阿鲁吉诺萨显示β-乳糖酶的表达增加,在CF痰中与体外9的毛刺表达减少,而另一个CF病原体,伯克霍尔迪亚塞诺塞帕西亚,在CF痰10中生长时,会调节β-乳酸酶和浮游泵。第三,宿主条件可以提示生理或遗传切换到抗生素耐药表型,这是很难在体外重述。其中包括CF病原体金黄色葡萄球菌11,12的小菌落变种。
所有这些数据都表明,当诊断实验室将单个克隆从致病生物膜中分离出来,并在标准实验室介质(肉汤微分化、磁盘扩散或 Etest)中对浮石或阿加板生长培养物执行 AST 时,结果通常无法预测哪些抗生素在体内实际有效。即使使用体外生物膜检测,由于所使用的介质和附件表面的差异,它们可能不会提示体内样的生物膜表型,因此使用流动细胞或高通量微板平台的检测可以高估抗生素敏感性13。同样的问题也适用于寻求开发新的抗生物膜制剂的学术界和工业界的研究人员:使用体外平台(如流细胞、微电板或疾病控制中心生物膜反应器)测试药物潜力可能会使生物膜疗效过低,并在研究、开发管道中产生误报。
在CF抗生素治疗后,AST结果与临床结果之间的不良相关性是众所周知的。许多临床医生只是忽略诊断实验室 AST,因为没有统一的 CF 特定指南来解释这些结果,而是根据具体情况做出处方决定。已尝试使用卡尔加里生物膜装置改进CF AST,该装置使用生长在含有标准AST介质(如经冰毒调整的穆勒-欣顿肉汤)14、15的微板井内塑料钉表面的生物膜。与标准浮石AST16相比,这种检测在预测哪些抗生素在体内起作用方面没有更好的效果。CF患者受到的影响是明显的。尽管反复使用抗生素(定期吸入抗生素,中位数为27天/年接受静脉注射抗生素的个人与CF在英国)17,频繁和不可预知的急性肺恶化事件导致渐进性肺损伤,并在大约90%的情况下,死于呼吸衰竭。在最近的一项分析中,细菌性肺部感染是CF中药物成本的最强预测,平均每年增加3.6万欧元/患者,直接医疗费用为18,19。
对于其他健康个体的急性感染,目前的研究和政策侧重于快速AST的基础上,例如,护理点基因组预测是理想的20。但是,在慢性CF感染的情况下,显然需要一种不同的方法:在宿主模拟模型中实施AST,以更好地回顾体内环境和病原代谢状态,并允许形成逼真的生物膜结构。
我们以前已经开发了一个CF生物膜模型,包括部分猪支气管在合成CF痰中孵育,并感染了P.阿鲁吉诺萨或金黄色葡萄球菌。未受感染的EVPL保留正常的组织病理学7天,但P.aeruginosa和S.Aureus的实验室或临床隔离物可重复地在组织周围形成类似体内的聚合物,模仿CF感染21、22、23的病因。我们提出了一个协议,使用这种高有效性,高通量模型作为量身定制的生物膜AST平台的CF和目前的示范性结果,显示病原体生物膜对临床使用的抗生素的高耐受性,当在模型中成长。该模型可以很容易地纳入研究、开发管道,用于管理或预防生物膜的形成,并有可能纳入AST诊断。大多数使用的设备(见材料表)可能很容易在典型的微生物实验室找到,虽然珠子打手是必不可少的,我们已经发现,从与合作者的工作,一个合适的紫外线杀菌柜可能也需要采购。由于肺源来自商业屠宰场或屠宰场,因此该模型没有道德问题。
研究方案
该协议使用猪肺来源于一个商业屠宰场,供应肉类供人类食用。根据英国立法,使用屠宰动物的剩余组织来屠宰肉类不需要道德批准;我们建议读者在开始工作前查看相关的地方法律和制度指南。
1. 合成 CF 痰介质 (SCFM) 的制备
- 要使SCFM用于EVPL组织,请按照帕尔默等人24 概述的食谱,修改葡萄糖从配方中去除。
注:Palmer等人的配方中含有自由氨基酸、酸离子、阳离子和乳酸,浓度代表CF患者精选痰样中的平均浓度。它已被证明可以提示可比的碳使用途径和法定人数感应信号的表达由 P.aeruginosa PA14到生长介质由狼化患者痰24。表 S1中提供了1 L修改SCFM的配方。 - 过滤器在制备后立即对 SCFM 进行消毒,并将在 4 °C 中存储长达 1 个月。
2. 前活体猪肺组织解剖和感染
- 解剖前,使用实验室中标准为P.aeruginosa/S.金黄色葡萄球菌(例如,溶酶汤+1.2%agar)的任何阿加,为感染准备一个agar板/s所需的细菌菌株/s。
- 计算实验需要多少猪支气管组织件,包括未受感染的控制组织片段。将这个数字乘以二,在两个复制的肺中重复实验,以确认结果的可重复性。
- 乘以 0.5 所需的组织件总数,以确定制作 agarose 垫所需的 SCFM agarose (mL) 体积,以制作足够的介质,用于 400 μL/组织件加上备用 SCFM agar,以解释制备过程中的任何管道错误或蒸发。
- 将 0.12 克的糖料添加到每 15 mL 的 SCFM 中,以使 SCFM 所需的总体积达到 0.8% 的重量/体积。
- 加热 SCFM agarose 溶液,直到糖完全溶解。建议使用低功耗的国产微波炉。所需时间取决于微波炉的功率。让阿加罗斯冷却到大约50°C(温暖到触摸,但舒适的举行)。不允许进一步冷却。
- 使用移液器,将SCFM的400μL添加到每块组织件需要的24井板的一口井中。
- 在紫外线下对含有 SCFM 的 24 井板/s 进行消毒 10 分钟。
- 准备三个复制洗涤每个完整的肺被解剖使用20毫升的无菌杜尔贝科的修改鹰介质(DMEM)加上20毫升的无菌罗斯韦尔公园纪念研究所(RPMI)1640补充50微克/mL安皮西林。
- 制作 40 mL SCFM 的别名,作为对被解剖的每一个完整肺的最后洗涤。所有洗涤可在 4 °C 下过夜或立即使用。
- 屠宰后尽快从指定来源获取肺,通过将肺移植到国内冷却箱中的实验室,确保肺保持寒冷。
注:接近屠宰日时,肺部的淤青较少,但屠宰后保存长达4天的组织也可以使用。由于冷却箱需要带入屠宰场或屠宰场,每次使用后必须按照当地实验室指南进行除污,并在不使用时存放在微生物实验室外,以降低污染和违反遏制的风险。 - 在消毒表面和火焰下工作,将肺放在一个干净的塑料切菜板上,上面覆盖着高压铝箔。检查支气管是否完好无损。如果屠宰场或运输过程中有任何损伤,肺部不适合使用。
- 在火焰下加热调色板刀,并非常短暂地触摸刀到支气管周围的肺部区域,以消毒组织表面。
- 使用无菌安装剃须刀刀片切割支气管周围的表面组织。使切口与支气管平行,以防止任何损坏。
- 一旦支气管暴露出来,在可见的最高点通过支气管切口,以释放支气管。
- 使用无菌钳子,轻轻握住支气管的任意端,并使用无菌安装剃须刀刀片切割任何剩余的不需要的组织。在可见任何分支从肺中取出支气管之前,在支气管上做最后的横截面切口。
- 将支气管放在第一个 DMEM/RPMI 1640 洗涤中。将支气管留在洗涤中,重复步骤 2.11-2.14,从同一肺中收获更多支气管部分,以产生足够的组织部分用于计划中的实验。
- 将同一肺部的任何额外支气管部分放入洗涤中(步骤 2.16)。在洗涤中至少留2分钟。
- 从第一次 DMEM/RPMI 1640 洗涤中取出支气管,并将样品放在无菌的培养皿中。
- 使用无菌钳子轻轻握住每个支气管,确保不会损坏组织。尽可能多地取出剩余的软组织,用无菌解剖剪刀将组织切成约5毫米宽的条状。
- 将所有支气管组织条放入第二个 DMEM/RPMI 1640 洗涤中。在洗涤中至少留2分钟。
- 使用无菌钳从第二次洗涤中取出组织条,注意不要损坏组织。将组织放在干净、无菌的培养皿中。
- 取出连接到支气管的任何剩余软组织,并用无菌解剖剪刀将条切成正方形(约 5 mm x 5 mm)。
- 将第三个 DMEM/RPMI 1640 洗涤添加到培养皿中。通过旋转盘子轻轻混合洗涤中的组织件。
- 将第三次洗净从培养皿中倒出,而不去除组织件。
- 将最终的 SCFM 洗涤剂添加到含组织的培养皿中,确保所有组织件都覆盖。
- 在紫外线下对 SCFM 中的组织件进行消毒 5 分钟。
- 使用无菌钳将每个消毒支气管组织片转移到含有 SCFM agarose 垫的 24 井板/s 的单独井中。
- 要用所需的细菌菌株感染每个组织片,触摸生长在 agar 板上的菌落,用 29 G 针尖连接到无菌的 0.5 mL 胰岛素注射器上。然后触摸菌落到组织片上,轻轻刺碎组织表面。
注意:使用配备 29 G 针头的胰岛素注射器,使针头能够准确舒适地保持,同时保持手指与针头和肺组织的安全距离。使用不附着在注射器上的 29 G 针头执行此步骤是可能的,但这需要更大的灵巧性,并增加针杆受伤的风险。胰岛素注射器是现成的。 - 对于未受感染的控制,用附着在无菌 0.5 mL 胰岛素注射器上的 29 G 针尖轻轻刺破每个组织件的表面。
- 使用移液器向每口井添加 500μL 的 SCFM。
- 在紫外线下,为每24个井板消毒透气密封膜10分钟(材料表)。
- 从 24 井板/s 中取出盖子/s,并更换为透气膜。
- 在 37 °C 处孵化板,以达到所需的潜伏(感染)时间,无需摇晃。检查未受感染的控制件(污染控制)上未出现接种病原体的明显生长。
注意:如果需要,可在第 2.5 步将安皮西林添加到 SCFM agarose 垫中,并在步骤 2.30 中覆盖 SCFM,最终浓度为 20 μg/mL。这将抑制肺部大多数内源性细菌的生长,而不影响 P.aeruginosa 或 S.Aureus 的生长,但是,由于安皮林的存在可能会影响对其他抗生素的易感性,读者可以根据他们想测试的菌株和抗生素做出选择。
3. 抗生素疗效的确定
注: 图S1中提供了详细描述此测定步骤的示意图。
- 为了测量EVPL上形成的生物膜的抗生素耐受性,必须在解剖和感染过程中从至少两个独立的肺部复制成套肺片。负对照需要一组片(不进行抗生素治疗),每组抗生素需要一组才能进行测试。
- 经过48小时的潜伏,目视检查未受感染的组织碎片。猪肺内源性细菌的一些生长可能发生,导致这些部分周围的SCFM浑浊。如果观察到所选研究物种的典型生长(例如,蓝绿色色素诊断的 P.aeruginosa),重新开始用新鲜肺的实验。
- 如果未受感染的组织部分显示没有或只有最小的细菌生长,准备一个24井洗盘和一个24井治疗板,每个含有500微L的新鲜SCFM没有抗生素或与抗生素的兴趣每井每肺组织片。
- 用火焰灭菌钳从孵化板中取出每个受感染的组织片,在洗盘的新鲜井中短暂旋转,去除任何非生物膜相关细菌细胞,并转移到处理板的适当井中。
- 用新鲜透气膜密封处理板。
- 在 37 °C 下孵化处理板/s,无需摇晃 18-24 小时。
- 使用火焰灭菌钳,从24井板中取出每个肺片,放入一个无菌的2mL均质管,内含1mL磷酸盐缓冲盐水(PBS)和1克金属珠(材料表)。
- 珠子以4米/秒的速度跳动40秒。
注意:用材料表中建议的特定珠子和同质化器敲击珠子不会引起细菌的显著裂解,但使用该协议的每个实验室应在开始 AST 检测之前检查其选定的珠子和同质化剂的效果。 - 使用 Lysogeny Broth (LB) agar 上的 PBS 和板连续稀释肺同质性,根据标准电镀方法确定单个未经治疗和抗生素治疗的组织片中的结肠形成单位 (CFU)。
注:可选:在选择性媒体上准备重复板,以确认殖民地身份;例如,使用曼尼托盐阿加为 金黄色葡萄球菌。
结果
EVPL 模型提供了一个高吞吐量检测平台,使得在一次(图 1和2)中筛选大量抗生素易感性细菌分离物或在一个实验中筛选出一系列抗生素浓度的菌株成为可能(图 3)。通过实践,我们发现大约200个支气管组织部分可以在2小时内从肺部准备。AST 的整个实验可以在正常工作时间内完成。伪氨基安鲁吉诺萨和金黄色葡萄球菌分离的生长和在模型中建立48小时生物膜是可靠的,当监测可行的细胞计数,产生一致的细菌负荷(图1和图2)。在我们的出版物21,23中,可以找到在EVPL中生长的伪多莫纳斯动脉鲁吉诺萨和金黄色葡萄球菌的组织相关生物膜的图像,以及准备光显微镜和组织染色的协议。然而,不同细菌物种的CFU计数的可重复性各不相同。这可以通过 ANOVA25之后的标准可重复性计算进行量化:我们发现,CFU在复制的金黄色葡萄球菌肺样本中,通常比对P.Aeruginosa有更大的差异。我们建议,在实验室采用该模型时,在试点实验中重复计算,以优化实验技术,并确定用于最终实验的样本大小(在 Sweeney 等人26的数据补充中可以找到这方面的一个例子)。
当生长在EVPL中时,与标准易感性相比,Aeruginosa和S.Aureus的生物膜对抗生素的耐受性更强,行业认可的肉汤MIC(图1)和使用标准介质的光盘检测(图2)。不同抗生素对EVPL已建立生物膜的各种影响是可区分的,例如,在EVPL中,使用4-16倍MIC环丙沙辛,而不是用4-8倍MIC氯霉素(图1)杀死阿鲁吉诺萨。每日两次剂量的600毫克线佐利德达到血清浓度高于MIC90易感病原体(4μg/mL)27,并被视为充分暴露没有不良副作用28。图2中提供的数据表明,受盘式测定中的线佐利德影响的金黄色葡萄球菌种群能够在EVPL中存活出目标血清浓度更高(12微克/mL)。MIC与抗生素对P.aeruginosa(图1)的EVPL生长生物膜的影响没有明显的相关性。获得更准确的体内抗生素耐受性测量方法很重要,因为抗生素的亚最佳剂量可能会增加选择慢性感染耐药性的风险。
众所周知,生物膜生长模式可以显著降低细菌对抗生素的易感性。这导致了许多体外生物膜检测的发展,并使用最低生物膜根除浓度(MBEC)14,15,而不是MIC作为更准确的预测在慢性感染的易感性。还建议使用SCFM(在不同的配方)用于MIC或MBEC测试29。在这里,我们表明,即使是优化的体外检测也不能准确预测P.阿鲁吉诺萨易感性在EVPL中的胆碱。实现 EVPL 生长细菌 3 日志10杀灭所需的抗生素量通常明显高于 MIC 或 MBEC 根据标准体外检测计算,即使使用 SCFM 进行这些检测(图3)。这与Cochrane的审查一致,该审查报告说,与标准易感性检测16相比,目前实施的体外生物膜易感性检测没有为CF中的抗生素处方提供任何增加的预测能力。
使用该模型评估抗生素对生物膜细菌的影响也很简单,因为可以接种足够的复制肺片,以便进行破坏性采样。除了区分抗菌剂之间的差异外,该模型还可以突出显示不同细菌生长阶段或生物膜年龄以及不同抗生素给药间隔的易感性变化。 图4 说明, 随着P.阿鲁吉诺萨 生物膜的成熟,它们对甲基苯丙烷的耐受性越来越强。这可能有助于确定新剂的功效,例如它们在快速细胞分裂期间是否更有效。在设定实验限制时,它也可能是一个重要的考虑因素,因为可能需要标准化和验证生物膜年龄,以避免年龄对结果产生影响。
在 图5中,在接触氟氯沙辛后,在4小时和24小时测量 金黄色葡萄球菌 存活率,并有可能观察到细菌细胞计数在时间和分离物之间减少的差异。这可能对药物开发有用,例如在定义药用动力学和药理动力学参数时,或在阐明新剂的操作模式时。
细菌负荷的变化往往随着培养时间的延长而增加。这可以在图 5 中未经治疗的控制中看到, 在 48 h 生物膜开发和进一步 24 h 暴露在抗生素给药间隔的帐户。变化是模型的内在因素:每个肺样本都独立于其他样本,反映了肺部的自然变化。因此,必须确保包括足够数量的复制品,以便进行验证和准确解释结果。我们建议读者对数据进行重复计算,以便选择强大的样本量。
为了简单起因,我们在每个实验中都提供了从单一肺部获得的复制组织部分获得的代表性数据,但在实践中,有必要对从复制动物身上采集的组织部分进行重复实验。这应该考虑到个体猪之间的任何生物变异,我们请读者参考我们发表的工作,例如从复制猪身上取出的组织之间结果如何一致,以及使用差异分析 (ANOVA) /一般线性模型 (GLM)21, 26对数据进行统计分析时如何解释这种变异。
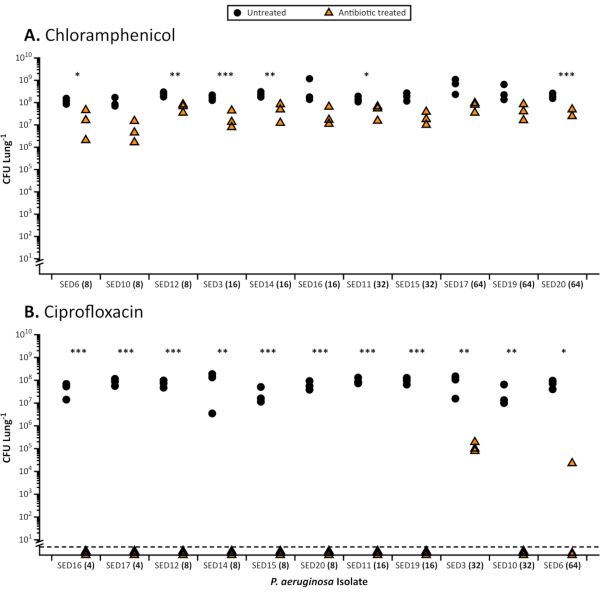
图1。使用抗生素治疗后从 EVPL 模型中恢复的 11 个 CF 伪多莫纳斯阿鲁吉诺萨 临床隔离剂的总 CFU。 EVPL 模型中 对丙基诺萨进行 抗生素治疗的代表性结果。每个菌株在EVPL组织上生长48小时,然后转移到抗生素(三角形)或PBS作为18小时的控制(圆圈),CFU/肺确定。标准 cation 调整 MHB 中确定的适当抗生素的 MIC 显示在每个菌株 (x 轴) 旁边的括号中。应变通过增加MIC值来订购。在适当的时候使用 t 测试分析数据,对非参数数据集进行曼-惠特尼 U 测试。治疗抗生素和未经治疗的组织之间的显著差异由星号表示(P < 0.05)。 A. 从EVPL模型中生长的 P.aeruginosa 生物膜中恢复可行计数,并使用64微克/mL氯霉素(记录的最高MIC值)进行处理。对于每个分离物,使用 Cohen 的 d 计算了氯霉素处理和未经处理的组织部分之间 CFU 的标准化均值差异 。 根据 Cohen 的 d (斯皮尔曼的排名相关性, rs = 0.45, p = 0.16) B, 标准测试中的 MIC 值与 EVPL 模型中可行细胞数的减少之间没有相关性。在EVPL模型中生长并处理64微克/mL的氟氯沙辛(记录的最高MIC值)的 P.阿鲁吉诺萨 生物膜的结果。虚线以下值低于检测限值。 请单击此处查看此图的较大版本。
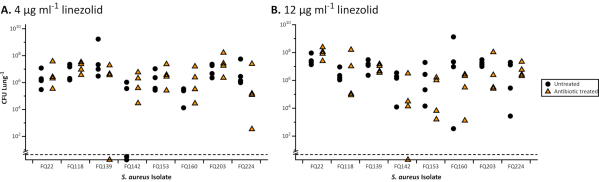
图2。8 金黄色葡萄球菌 CF 临床分离物的总 CFU,在与线佐利德治疗后从 EVPL 模型中恢复。 每个菌株在EVPL组织上生长48小时,然后转移到线佐利德(三角形)24小时或未经治疗作为控制(圆)。所有菌株都被发现对线佐利德敏感使用标准磁盘扩散检测遵循欧盟CAST准则30( 抑制区>21毫米)。在适当的时候使用 t 测试分析数据,对非参数数据集(P < 0.05)进行曼-惠特尼 U 测试。治疗的抗生素和未治疗的菌株之间没有显著差异。虚线以下值低于检测限值。 A. EVPL 模型中的 金黄色葡萄球菌 生物膜的结果,使用 4μg/mL 线佐利德处理(根据 EUCAST 分类31,敏感/耐药性的临床断点)。 B. EVPL 模型中的 金黄色葡萄球菌 生物膜处理结果为 12 μg/mL 线佐利德(从斯威尼等人23中转载的数据)。 请单击此处查看此图的较大版本。
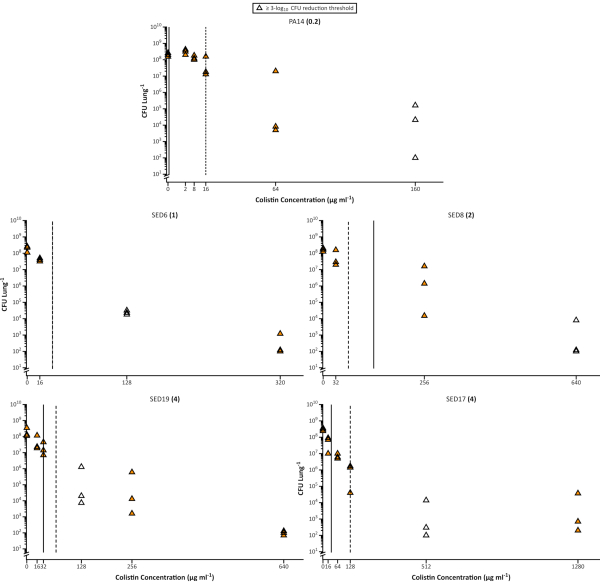
图3。可行的 伪多莫纳斯阿鲁吉诺萨 细胞计数的实验室菌株PA14和4 CF临床分离物从EVPL模型恢复后,治疗与不断增加的胆碱浓度。 每个菌株在EVPL组织上生长48小时,然后暴露在胆碱中18小时。在标准 cation 调整 MHB 介质中确定的 MIC 显示在每个菌株名称旁边的括号中。垂直线显示 MHB(固体)和 SCFM(已破折号)确定的 MBEC 值,SED6 除外,其中两种介质中值相同。未填充的数据点表示所测试的胆碱浓度最低,导致 CFU/肺的≥ 3 日志10 减少,与未经处理的样品(0μg/mL 科利斯汀)(从 Sweeney 等人26转载的数据)相比。 请单击此处查看此图的较大版本。
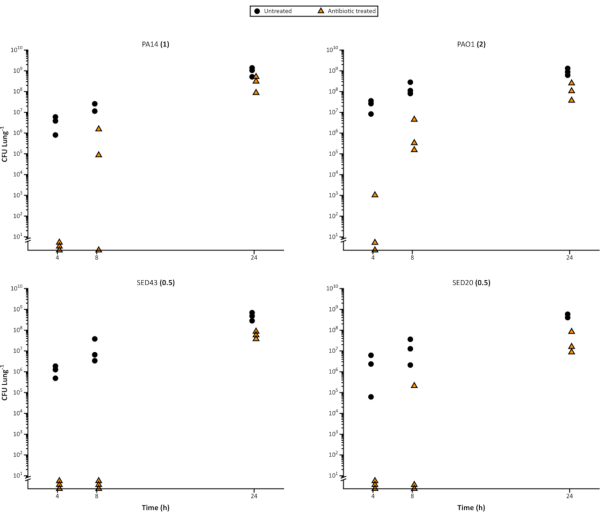
图4。具有代表性 的假多莫纳斯阿鲁吉诺萨 细胞计数从 EVPL 模型上超过 24 h 的生长时间过程,以及随后使用 64μg/mL 甲基苯丙胺进行的治疗。 实验室菌株 P.aeruginosa PA14和3 CF临床分离物生长在EVPL组织上的时间显示在x轴上,然后转移到甲基苯(三角形)24小时或离开未经治疗的控制(圆圈)。然后确定CFU/肺。在 cation 调整的 MHB 介质中确定的 MIC 显示在每个应变名称旁边的括号中。 请单击此处查看此图的较大版本。
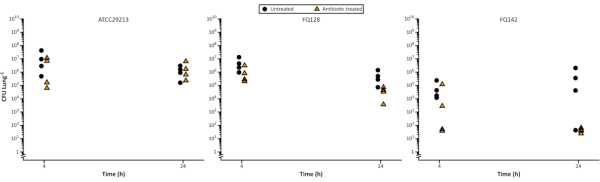
图5。具有代表性的金 黄色葡萄球菌 细胞在EVPL模型上生长后计数,然后在24小时的时间内用5微克/mL氟氯沙辛治疗。 控制菌株ATCC29213和两个CF临床分离物在EVPL组织上生长48小时,然后转移到氟氯沙辛(三角形)或未经治疗作为控制(圆圈)4小时和24小时,在CFU/肺确定之前(数据从斯威尼等人23转载)。请单击此处查看此图的较大版本。
图 S1。 请单击此处下载此图。
表S1。 请单击此处下载此表。
讨论
前活体肺模型的吞吐量高,价格低廉,而且由于它使用肉类行业的后消费者废物,因此没有道德问题。它旨在模仿长期感染的人类 CF 气道比目前可用的体外 AST 平台更好。这里介绍的结果表明,在这种情况下,它可以更准确地预测抗生素易感性。
协议中的关键步骤,将确保可靠和可重复的结果包括以下:
- 在肺部样本的屠宰、采集和处理之间使用一致的时间和储存方法。屠宰后尽快使用肺部,并将污染的可能性降到最低,这一点很重要。实验培养在肺部生长的能力差异,如果它们没有尽可能新鲜的话。
- 在SCFM的生产和肺片解剖中保持不育是必不可少的。健康的肺不是无菌的,因此共生细菌的存在可能反映了慢性感染的"自然"环境。然而,如前所述,多物种种群中的细菌相互作用可能会改变结果和对抗生素的易感性,因此应避免污染,在使用前应对肺部进行消毒。我们提倡使用紫外线灭菌,因为它似乎不会导致锡组织完整性的变化,如有必要,还会进行额外的抗生素清洗。然而,抗生素应谨慎使用,因为它们可能通过引入选择性压力影响结果,并可能改变测试细菌群中的基因表达。
- 使用在非选择性丰富介质上生长的模拟感染、负控制组织样本和细胞计数板,突出任何在灭菌过程中未去除的污染物或共生细菌的生长。这对于减轻这些细菌对 AST 的任何影响至关重要。它也有助于产生重复的,选择性的阿加,细胞计数板特定于感兴趣的有机体,因为重复的板加快了殖民地识别和细胞列举。
- 在首次使用模型时以及使用新菌株或细菌基因型进行试验性实验,以评估组织部分之间的生物膜 CFU 变异,允许通过使用功率计算选择最佳的实验样本大小(例如,从多少复制的肺中获取多少复制组织部分)。
- 检测使用非标准化的接种,因为这样可以快速接种后48小时的孵化和形成相对一致的生物膜负荷(特别是 P.aeruginosa)。要检测早期生物膜生长阶段的抗菌功效,请考虑用在 ASM 中悬浮的菌落生长细菌的标准化 CFU 进行接种。我们不建议接种浮石细菌:早期的试验表明,这会导致急性、侵入性生长,生物膜形成不可靠。
该协议产生了一个强大的原型模型,用于 与P.aeruginosa,有很大的发展潜力,用于 与S.Aureus,但它确实有一些限制,将需要解决某些应用程序在未来。组织是从单一的菌落接种,以允许克隆人的发展。结果表明,对于 P.阿鲁吉诺萨来说,这对48小时时的细胞数量影响甚微。然而, 在金黄色葡萄球菌 的细菌负荷中观察到更大的变异性,鉴于不同的细菌在模型中可能生长不同,标准化的开始接种和对相同大小和重量的组织样本的严格生产可能取决于研究的有机体。由于精确解剖/感染技术或本地猪种/陆地测量的差异,实验室之间也可能存在差异。为了评估细菌种群对模型个体实施的可重复性,我们建议使用可重复性计算作为结果 25 统计分析的一部分,并使用基于试点实验的可重复性/功率计算来计算最终实验中使用的最佳样本量。
EVPL 与传统板检测相比,其主要优点之一是,它允许在宿主环境中和细胞分化中对生长浮游生物或生物表面的细菌进行测试,而不是进行空间结构。这对于考虑物理化学和营养梯度对抗菌剂活性的影响,以及在慢性感染和细菌之间的细胞-细胞相互作用的不同微环境下提供和提供活性疗法具有重要影响。后一点特别重要,因为多物种感染在CF中经常观察到,并且对与其他呼吸系统疾病相关的感染(如哮喘和慢性阻塞性肺病)越来越重要。有可能开发此模型的 AST 为个性化患者痰样本在临床诊断。一项类似的试验已经开始使用外体内伤口模拟模型进行生长和慢性伤口脱脂生物膜的AST(德克萨斯州卢伯克的西南区域伤口护理中心,R.沃尔科特博士)。
此外,该模型使用验尸组织,因此宿主免疫反应对抗生素易感性的影响有限。当前体外模型也不考虑宿主免疫反应,因此我们不认为这是 AST 应用中未来使用该模型的障碍。但是,在确定药动力学和药理动力学参数以及抗生素服用指南时,会考虑免疫反应。虽然我们的研究表明,残余免疫细胞和组织内的反应23( 和S.Azimi,个人沟通),这是一个主要领域,进一步优化和发展模型,如果更大的匹配体内条件是需要的。
为 CF 提供更临床有效的 AST 将有助于满足 2008 年英国《健康、社会护理法案》的一项关键建议,即"应制定程序,确保谨慎开处方和进行抗菌管理"。我们相信EVPL是一个理想的候选模型,以帮助满足这一需求。
披露声明
作者没有什么可透露的。
致谢
我们感谢所有合著者在原论文中取得的模范成果。这项工作由MRC新调查员研究资助(授予FH 的MR/R001898/1号赠款):由 BBSRC 中部地区综合生物科学培训伙伴关系 (MIBTP) 授予 NEH 和 IA 的博士生奖学金;并由华威大学本科生研究支持计划颁发给FA进行暑假研究项目。我们感谢史蒂夫奎格利,儿子(库宾顿,沃里克郡)和约翰泰勒,儿子(厄尔斯登,考文垂)提供肺。我们还要感谢沃里克大学生命科学学院媒体准备设施的帮助,特别感谢塞里斯·哈里斯和卡罗琳·斯图尔特,以及沃里克抗菌筛选设施的安妮塔·凯瑟琳的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 mL insulin syringes with 29G needle attached | |||
| 24-well culture plates | |||
| 70% ethanol or similar for surface sterilizaton and flamin gof dissection equipment | |||
| Agar plates to prepare streaks of P. aeruginosa/S. aureus (any suitable medium) | |||
| Agarose | |||
| Aluminum foil - pre-sterilised by autoclaving - to cover the chopping board on whcih you wil dissect lungs. | |||
| Bead beater designed to take 2 mL tubes | MP Biomedicals | 116004500 | FastPrep-24 Classic bead beating grinder and lysis system |
| Breathe-easy or Breathe-easier sealing membrane for multiwell plates | Diversified Biotech | BEM-1 or BERM-2000 | |
| Bunsen burner | |||
| Chopping board - we recommend a plastic board to allow for easy decontamination with alcohol. | |||
| Coolbox to transport lungs to lab | |||
| Dissection scissors in different sizes | |||
| Dulbecco’s modified Eagle medium (DMEM) | |||
| Fisherbrand 2 mL reinforced tubes | Thermo Fisher | 15545809 | |
| Fisherbrand 2.38 mm metal beads | Thermo Fisher | 15505809 | |
| Germicidal UV cabinet | |||
| Insulin syringes - 0.5 mL with 29G needle attached. | VWR | BDAM324892 | |
| Large pallet knife | |||
| LB agar plates to assess CFU in lung biofilm homogenate | |||
| Mounted razor blades | |||
| Nalgene RapidFlow PES 75 mm x 0.1 µm x 500 ml sterile filter unit | Thermo Fisher | 10474415 | For filter-sterilizing SCFM |
| Petri dishes | |||
| Phosphate-buffered saline | |||
| Plastic chopping board and aluminium foil to create a sterile and cleanable dissection surface | |||
| Roswell Park Memorial Institute (RPMI) 1640 medium | |||
| SCFM ingredients as listed in Table S1 | |||
| Selection of forceps (blunt tips recommended) | |||
| Selective agar plates to specifically assess P. aeruginosa / S. aureus CFU in lung biofilm homogenate, if required. | |||
| Suitable containers for disposing of contaminated sharps and pig ung tissue, according to your institution's health & safety policies. |
参考文献
- Elborn, J. S. Cystic fibrosis. The Lancet. 388 (10059), 2519-2531 (2016).
- Høiby, N., et al. Diagnosis of biofilm infections in cystic fibrosis patients. APMIS. 125, 339-343 (2017).
- Bjarnsholt, T., et al. Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatric Pulmonology. 44 (6), 547-558 (2009).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents. 35 (4), 322-332 (2010).
- Penesyan, A., Gillings, M., Paulsen, I. Antibiotic discovery: Combatting bacterial resistance in cells and in biofilm communities. Molecules. 20 (4), 5286(2015).
- Son, M. S., Matthews, W. J., Kang, Y., Nguyen, D. T., Hoang, T. T. In vivo evidence of Pseudomonas aeruginosa nutrient Acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity. 75 (11), 5313-5324 (2007).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846(2016).
- Stites, S. W., Plautz, M. W., Bailey, K., O'Brien-Ladner, A. R., Wesselius, L. J. Increased concentrations of iron and isoferritins in the lower respiratory tract of patients with stable cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 160 (3), 796-801 (1999).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proceedings of the National Academy of Sciences. 115 (22), 5125-5134 (2018).
- Drevinek, P., et al. Gene expression changes linked to antimicrobial resistance, oxidative stress, iron depletion and retained motility are observed when Burkholderia cenocepacia grows in cystic fibrosis sputum. BMC Infectious Diseases. 8, 121(2008).
- Goerke, C., Wolz, C. Regulatory and genomic plasticity of Staphylococcus aureus during persistent colonization and infection. International Journal of Medical Microbiology. 294 (2-3), 195-202 (2004).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Roberts, A. E. L., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. Journal of Molecular Biology. 427, 3646-3661 (2015).
- Ceri, H., et al. The Calgary biofilm device: New technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. Journal of Clinical Microbiology. 37 (6), 1771-1776 (1999).
- Moskowitz, S. M., Foster, J. M., Emerson, J., Burns, J. L. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. Journal of Clinical Microbiology. 42 (5), 1915-1922 (2004).
- Smith, S., Waters, V., Jahnke, N., Ratjen, F. Standard versus biofilm antimicrobial susceptibility testing to guide antibiotic therapy in cystic fibrosis. Cochrane Database of Systematic Reviews. (6), (2020).
- Trust, C. F. Annual Data Report 2019. , (2019).
- Angelis, A., et al. Social and economic costs and health-related quality of life in non-institutionalised patients with cystic fibrosis in the United Kingdom. BMC Health Services Research. 15 (1), 428(2015).
- Eidt-Koch, D., Wagner, T. O. F., Mittendorf, T., von der Schulenburg, J. M. G. Outpatient medication costs of patients with cystic fibrosis in Germany. Applied Health Economics and Health Policy. 8 (2), 111-118 (2010).
- Longitude Prize. , Available from: http://longitudeprize.org (2020).
- Harrington, N. E., Sweeney, E., Harrison, F. Building a better biofilm - Formation of in vivo-like biofilm structures by Pseudomonas aeruginosa in a porcine model of cystic fibrosis lung infection. Biofilm. 2, 100024(2020).
- Harrison, F., Diggle, S. An ex vivo lung model to study bronchioles infected with Pseudomonas aeruginosa biofilms. Microbiology. 162, 1755-1760 (2016).
- Sweeney, E., et al. An ex vivo cystic fibrosis model recapitulates key clinical aspects of chronic Staphylococcus aureus infection. Microbiology. , DOI: 10.1099/mic.0.000987 (2020).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85 (4), 935-956 (2010).
- Sweeney, E., Sabnis, A., Edwards, A. M., Harrison, F. Effect of host-mimicking medium and biofilm growth on the ability of colistin to kill Pseudomonas aeruginosa. Microbiology. 166 (12), 1171-1180 (2020).
- Stalker, D. J., Jungbluth, G. L., Hopkins, N. K., Batts, D. H. Pharmacokinetics and tolerance of single- and multiple-dose oral or intravenous linezolid, an oxazolidinone antibiotic, in healthy volunteers. Journal of Antimicrobial Chemotherapy. 51 (5), 1239-1246 (2003).
- Ager, S., Gould, K. Clinical update on linezolid in the treatment of Gram-positive bacterial infections. Infection and Drug Resistance. 5, 87-102 (2012).
- Kirchner, S., et al. Use of Artificial Sputum Medium to Test Antibiotic Efficacy Against Pseudomonas aeruginosa in Conditions More Relevant to the Cystic Fibrosis Lung. Journal of Visualized Experiments: JoVE. (64), e3857(2012).
- The European Committee on Antimicrobial Susceptibility Testing. EUCAST Disk Diffusion Method for Antimicrobial Susceptibility Testing - Version 8.0. , Available from: www.eucast.org (2020).
- The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 10.0. , Available from: http://www.eucast.org (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。