Method Article
Tests d’efficacité des antibiotiques dans un modèle ex vivo de biofilms de Pseudomonas aeruginosa et de Staphylococcus aureus dans le poumon de la fibrose kystique
Dans cet article
Résumé
Ce flux de travail peut être utilisé pour effectuer des tests de sensibilité aux antibiotiques à l’aide d’un modèle ex vivo établi de biofilm bactérien dans les poumons des personnes atteintes de fibrose kystique. L’utilisation de ce modèle pourrait améliorer la validité clinique des essais MBEC (concentration minimale d’éradication du biofilm).
Résumé
La prescription efficace d’antibiotiques pour les biofilms bactériens présents dans les poumons des personnes atteintes de fibrose kystique (FK) est limitée par une faible corrélation entre les résultats des tests de sensibilité aux antibiotiques (AST) utilisant des méthodes de diagnostic standard (p. ex. microdilution de bouillon, diffusion sur disque ou Etest) et les résultats cliniques après le traitement antibiotique. Les tentatives d’amélioration de l’AST par l’utilisation de plateformes de croissance de biofilms prêtes à l’emploi montrent peu d’amélioration des résultats. La capacité limitée des systèmes de biofilm in vitro d’imiter l’environnement physicochimique du poumon de la FK et, par conséquent, la physiologie bactérienne et l’architecture du biofilm, agit également comme un frein à la découverte de nouvelles thérapies pour l’infection par la FK. Ici, nous présentons un protocole pour effectuer l’AST des agents pathogènes de CF cultivés en tant que biofilms matures et in vivo-like dans un modèle ex vivo de poumon de CF composé du tissu bronchiolaire de porc et des expectorations synthétiques de CF (poumon ex vivo de porc, EVPL).
Il existe plusieurs essais in vitro pour les essais de sensibilité au biofilm, utilisant soit un milieu de laboratoire standard, soit diverses formulations d’expectorations cf synthétiques dans des plaques de microtitration. Le milieu de croissance et le substrat du biofilm (plaque de polystyrène par rapport au tissu bronchiolaire) sont susceptibles d’affecter la tolérance aux antibiotiques du biofilm. Nous montrons une tolérance accrue des isolats cliniques de Pseudomonas aeruginosa et de Staphylococcus aureus dans le modèle ex vivo; les effets du traitement antibiotique des biofilms ne sont pas corrélés avec la concentration minimale inhibitrice (CMI) dans les essais de microdilution standard ou avec une classification sensible/résistante dans les essais de diffusion sur disque.
La plate-forme ex vivo pourrait être utilisée pour le biofilm AST sur mesure d’échantillons de patients et comme plate-forme de test améliorée pour les agents antibiofilm potentiels pendant la recherche et le développement pharmaceutiques. L’amélioration de la prescription ou de l’accélération de la découverte de médicaments antibiofilms grâce à l’utilisation de plateformes d’essai plus in vivo pourrait améliorer considérablement les résultats pour la santé des personnes atteintes de mucoviscidose, ainsi que réduire les coûts du traitement clinique et de la recherche axée sur la découverte.
Introduction
Les infections chroniques par biofilm affectent les personnes dont les défenses immunitaires normales sont compromises. Les groupes à risque comprennent les personnes atteintes de fibrose kystique (FK)1. La colonisation du mucus adhésif anormalement épais dans les voies respiratoires au début de la petite enfance conduit à des infections insurmontables du biofilm des bronchioles2,3. La croissance des bactéries sous forme de biofilms étendus encapsulés dans une matrice est un facteur qui distingue les infections chroniques des personnes immunodéprimées des infections aiguës d’hôtes sains et l’état du biofilm protège les bactéries de l’exposition aux antibiotiques (en raison de la diffusion réduite à travers la matrice) et diminue leur sensibilité aux antibiotiques (par exemple, par l’induction de la quiescence ou la régulation à la hausse des pompes à efflux)4,5. Cependant, les altérations spécifiques à la maladie de la physiologie et de la chimie des tissus de l’hôte modifient davantage la physiologie bactérienne par rapport à celle observée dans les infections aiguës ou dans les conditions de croissance standard en laboratoire. Les exemples clés dans la mucoviscidose comprennent l’utilisation de sources de carbone inhabituelles, telles que les acides gras et les acides aminés libérés par le tensioactif pulmonaire et produits par la dégradation microbienne de la mucine, la libération de micronutriments, tels que le fer des tissus endommagés, et la microaérobiose6,7,8.
Les conditions physicochimiques spécifiques dans un contexte particulier d’infection par biofilm peuvent donc influencer les réponses aux antibiotiques. Tout d’abord, la structure et la profondeur de la matrice extracellulaire dépendent des conditions environnementales locales, telles que les nutriments ou les forces de cisaillement. Deuxièmement, les signaux environnementaux peuvent déclencher l’expression de gènes spécifiques de résistance aux antibiotiques. Par exemple, l’agent pathogène de la FK Pseudomonas aeruginosa montre une expression accrue de la bêta-lactamase et une expression réduite des porines dans les expectorations de la FK par rapport à in vitro9,tandis qu’un autre agent pathogène de la FK, Burkholderia cenocepacia,régule à la hausse les bêta-lactamases et les pompes à efflux lorsqu’ils sont cultivés dans les expectorations de la FK10. Troisièmement, les conditions dans l’hôte peuvent indiquer un passage physiologique ou génétique aux phénotypes tolérants aux antibiotiques, qui sont difficiles à récapituler in vitro. Ceux-ci comprennent de petites variantes de colonie de l’agent pathogène de la FK Staphylococcus aureus11,12.
Toutes ces données indiquent que lorsque les laboratoires de diagnostic isolent des clones individuels à partir d’un biofilm pathogène et effectuent de l’AST sur des cultures cultivées en plaques planctoniques ou agarées dans des milieux de laboratoire standard (microdilution de bouillon, diffusion sur disque ou Etest), les résultats ne prédisent souvent pas quels antibiotiques fonctionneront réellement in vivo. Même si des essais sur biofilm in vitro sont utilisés, ils peuvent ne pas indiquer un phénotype de biofilm in vivo en raison de différences dans le milieu et la surface de fixation utilisés, de sorte que les essais utilisant des cellules d’écoulement ou des plates-formes de microplaques à haut débit peuvent surestimer la sensibilité aux antibiotiques13. Le même problème s’applique aux chercheurs du milieu universitaire et de l’industrie qui cherchent à développer de nouveaux agents antibiofilms : tester le potentiel des médicaments à l’aide de plateformes in vitro telles que des cellules d’écoulement, des plaques de microtitration ou des réacteurs à biofilm du Center for Disease Control peut mettre la barre de l’efficacité du biofilm trop bas et produire des faux positifs dans le pipeline de recherche et de développement.
La corrélation pauvre entre des résultats d’AST et des résultats cliniques après traitement antibiotique dans des CF est bien connue. De nombreux cliniciens ignorent tout simplement l’AST de laboratoire diagnostique, car il n’existe pas de lignes directrices uniformes spécifiques aux FC pour interpréter ces résultats et prennent plutôt des décisions au cas par cas pour la prescription. Des tentatives ont été faites pour améliorer l’AST cf en utilisant le dispositif de biofilm de Calgary, qui utilise des biofilms cultivés à la surface de chevilles en plastique fixées dans les puits d’une microplaque contenant un milieu AST standard (p. ex. bouillon Muller-Hinton à ajustement cationique)14,15. Ce test ne permet pas de mieux prédire quels antibiotiques fonctionneront in vivo que l’AST planctonique standard16. L’impact sur les patients atteints de FK est brutal. Malgré l’administration répétée d’antibiotiques (antibiotiques inhalés régulièrement et une médiane de 27 jours par an recevant des antibiotiques par voie intraveineuse pour les personnes atteintes de mucoviscidose au Royaume-Uni)17, des épisodes fréquents et imprévisibles d’exacerbation pulmonaire aiguë entraînent des lésions pulmonaires progressives et, dans environ 90 % des cas, la mort par insuffisance respiratoire. Dans une analyse récente, l’infection pulmonaire bactérienne était le meilleur prédicteur des coûts des médicaments dans la mucoviscidose, ajoutant en moyenne 3,6 K € / patient / an aux coûts directs des soins de santé18,19.
Pour les infections aiguës de personnes par ailleurs en bonne santé, la recherche et la politique actuelles axées sur l’AST rapide basée, par exemple, sur la prédiction génomique au point de service sontidéales 20. Mais dans le cas des infections chroniques par mucoviscidose, il est clair qu’une approche différente est nécessaire : la mise en œuvre de l’AST dans des modèles imitant l’hôte qui récapitulent mieux l’environnement in vivo et l’état métabolique de l’agent pathogène et permettent la formation d’une structure réaliste du biofilm.
Nous avons déjà développé un modèle de biofilm de la FK qui comprend des sections de bronchiole de porc incubées dans des expectorations synthétiques de la FK et infectées par P. aeruginosa ou S. aureus. Evpl non infecté conserve l’histopathologie normale pendant 7 jours, mais les isolats de laboratoire ou cliniques de P. aeruginosa et S. aureus reproductibles forment in vivo-like agrégats autour du tissu, imitant l’étiologie de l’infection par la FK21,22,23. Nous présentons un protocole pour l’utilisation de ce modèle à haute validité et à haut débit comme plate-forme AST de biofilm sur mesure pour la mucoviscidose et présentons des résultats exemplaires montrant la tolérance élevée des biofilms pathogènes aux antibiotiques utilisés cliniquement lorsqu’ils sont cultivés dans le modèle. Le modèle pourrait facilement être intégré dans les pipelines de recherche et de développement pour la gestion ou la prévention de la formation de biofilms et potentiellement dans l’AST diagnostique. La plupart de l’équipement utilisé (voir la table des matériaux) peut facilement être trouvé dans un laboratoire de microbiologie typique, bien qu’un batteur de perles soit essentiel, et nous avons constaté, en collaboration avec des collaborateurs, qu’une armoire germicide ultraviolette appropriée peut également devoir être achetée. Comme les poumons proviennent de bouchers commerciaux ou d’abattoirs, le modèle ne présente aucun problème éthique.
Protocole
Ce protocole utilise des poumons de porc provenant d’un abattoir commercial qui fournit de la viande destinée à la consommation humaine. En vertu de la législation britannique, l’utilisation de restes de tissus d’animaux abattus pour la viande ne nécessite pas d’approbation éthique; nous conseillons aux lecteurs de vérifier les lois locales pertinentes et les directives institutionnelles avant de commencer à travailler.
1. Préparation des expectorations synthétiques des FC (SCFM)
- Pour fabriquer des MCS pour une utilisation avec du tissu EVPL, suivez la recette décrite par Palmer et al.24 avec la modification que le glucose est retiré de la recette.
REMARQUE: La recette de Palmer et coll. contient des acides aminés libres, des cations, des anions et du lactate à des concentrations représentatives des concentrations moyennes trouvées dans une sélection d’échantillons d’expectorations provenant de patients atteints de mucoviscidose. Il a été démontré qu’il indique des voies d’utilisation du carbone comparables et l’expression de signaux de détection de quorum par P. aeruginosa PA14 à la croissance dans un milieu fabriqué à partir d’expectorations patientes lyophilisées24. Une recette de 1 L de SCFM modifié est fournie dans le tableau S1. - Filtrer stériliser le SCFM immédiatement après la préparation et conserver à 4 °C jusqu’à 1 mois.
2. Dissection et infection du tissu ex vivo du poumon de porc (EVPL)
- Avant la dissection, préparer une ou plusieurs plaques d’agar de la ou des souches bactériennes requises pour l’infection en utilisant la gélose standard en laboratoire pour P. aeruginosa/S. aureus (p. ex. bouillon de lysogenèse + gélose à 1,2 %).
- Calculer le nombre de morceaux de tissu bronchiolaire porcin requis pour l’expérience, y compris les morceaux de tissu témoin non infectés. Multipliez ce nombre par deux pour répéter l’expérience dans deux poumons répliqués afin de confirmer la répétabilité des résultats.
- Multipliez le nombre total de morceaux de tissu requis par 0,5 pour déterminer le volume d’agarose SCFM (mL) nécessaire pour fabriquer des coussinets d’agarose afin de faire suffisamment de milieu pour 400 μL/morceau de tissu plus une gélose SCFM de rechange pour tenir compte de toute erreur de pipetage ou évaporation pendant la préparation.
- Ajouter 0,12 g d’agarose à chaque 15 mL de SCFM requis pour obtenir le volume total souhaité de SCFM avec 0,8 % d’agarose poids/volume.
- Chauffer la solution d’agarose SCFM jusqu’à ce que l’agarose soit complètement dissoute. Un micro-ondes domestique à faible puissance est recommandé. Le temps nécessaire dépend de la puissance du micro-ondes. Laisser refroidir l’agarose à environ 50 °C (chaud au toucher mais confortable à tenir). Ne laissez pas refroidir plus loin.
- À l’aide d’une pipette, ajouter 400 μL d’agarose SCFM à un puits d’une plaque de 24 puits par morceau de tissu nécessaire.
- Stériliser la ou les plaques de 24 puits contenant de l’agarose SCFM sous la lumière ultraviolette pendant 10 min.
- Préparer trois lavages répétés pour chaque poumon intact disséqué à l’aide de 20 mL de milieu Eagle modifié (DMEM) de Dulbecco stérile plus 20 mL de Roswell Park Memorial Institute (RPMI) 1640 stérile complété par 50 μg/mL d’ampicilline.
- Faire une partie aliquote de 40 mL de SCFM comme lavage final pour chaque poumon intact disséqué. Tous les lavages peuvent être conservés pendant la nuit à 4 °C ou utilisés immédiatement.
- Obtenir les poumons de la source désignée dès que possible après l’abattage, en veillant à ce qu’ils soient conservés au froid en les transportant au laboratoire dans une glacière domestique.
REMARQUE: Les poumons plus proches du jour de l’abattage présentent moins d’ecchymoses provenant de l’entreposage, mais les tissus conservés dans un entrepôt frigorifique jusqu’à 4 jours après l’abattage peuvent également être utilisés. Comme la glacière doit être transportée dans la boucherie ou l’abattoir, elle doit être décontaminée conformément aux directives du laboratoire local après chaque utilisation et entreposée à l’extérieur du laboratoire de microbiologie lorsqu’elle n’est pas utilisée, afin de réduire le risque de contamination et de rupture du confinement. - En travaillant sur une surface stérilisée et sous une flamme, placez les poumons sur une planche à découper en plastique propre recouverte de papier d’aluminium autoclavé. Vérifiez que les bronchioles restent intactes. S’il y a eu des dommages à l’abattoir ou pendant le transport, les poumons ne sont pas adaptés à l’utilisation.
- Chauffer un couteau à palette sous une flamme et toucher très brièvement le couteau à la zone du poumon entourant la bronchiole pour stériliser la surface du tissu.
- Coupez le tissu de surface entourant la bronchiole à l’aide d’une lame de rasoir montée stérile. Faites des incisions parallèles à la bronchiole pour éviter tout dommage.
- Une fois que la bronchiole a été exposée, faites une incision transversale à travers la bronchiole au point le plus élevé visible pour libérer la bronchiole.
- À l’aide d’une pince stérile, tenez légèrement l’extrémité libre de la bronchiole et coupez tout tissu indésirable restant à l’aide d’une lame de rasoir montée stérile. Faites une incision transversale finale à travers la bronchiole avant toute ramification visible pour enlever la bronchiole des poumons.
- Placez la bronchiole dans le premier lavage DMEM/RPMI 1640. Laissez la bronchiole dans le lavage et répétez les étapes 2.11-2.14 pour récolter des sections supplémentaires de bronchiole du même poumon au besoin pour produire suffisamment de sections de tissu pour l’expérience prévue.
- Placez toute section bronchiolaire supplémentaire du même poumon dans le lavage (étape 2.16). Laisser au lavage pendant au moins 2 min.
- Retirez les bronchioles du premier lavage DMEM/RPMI 1640 et placez les échantillons dans une boîte de Petri stérile.
- Tenez chaque bronchiole légèrement à l’aide d’une pince stérile, en vous assurant de ne pas endommager le tissu. Retirez autant de tissus mous restants que possible et coupez le tissu en bandes d’environ 5 mm de large à l’aide de ciseaux de dissection stériles.
- Placez toutes les bandes de tissu bronchiolaire dans le deuxième lavage DMEM/RPMI 1640. Laisser au lavage pendant au moins 2 min.
- Retirez les bandes de tissu du deuxième lavage à l’aide d’une pince stérile, en prenant soin de ne pas endommager le tissu. Placez le tissu dans une boîte de Petri propre et stérile.
- Retirez tout tissu mou restant attaché à la bronchiole et coupez les bandes en carrés (~ 5 mm x 5 mm) à l’aide de ciseaux de dissection stériles.
- Ajouter le troisième lavage DMEM/RPMI 1640 dans la boîte de Petri. Mélangez légèrement les morceaux de tissu dans le lavage en faisant tourbillonner le plat.
- Versez le troisième lavage de la boîte de Pétri sans enlever les morceaux de tissu.
- Ajoutez le lavage SCFM final à la boîte de Petri contenant des tissus, en vous assurant que tous les morceaux de tissu sont recouverts.
- Stériliser les morceaux de tissu dans SCFM sous lumière UV pendant 5 min.
- Utilisez une pince stérile pour transférer chaque morceau de tissu bronchiolaire stérilisé dans des puits individuels d’une plaque de 24 puits contenant des tampons d’agarose SCFM.
- Pour infecter chaque morceau de tissu avec la souche bactérienne désirée, touchez une colonie cultivée sur une plaque de gélose avec la pointe d’une aiguille de 29 G attachée à une seringue à insuline stérile de 0,5 mL. Ensuite, touchez la colonie sur la pièce de tissu, en piquant doucement la surface du tissu.
REMARQUE: L’utilisation d’une seringue à insuline équipée d’une aiguille de 29 G permet à l’aiguille d’être maintenue avec précision et confortablement tout en gardant les doigts à une distance de sécurité de l’aiguille et du tissu pulmonaire. Il est possible d’effectuer cette étape en utilisant des aiguilles de 29 G qui ne sont pas attachées à une seringue, mais cela nécessite une plus grande dextérité et augmente le risque de blessure par piqûre d’aiguille. Les seringues à insuline sont facilement disponibles. - Pour les témoins non infectés, piquez doucement la surface de chacun des morceaux de tissu avec la pointe d’une aiguille de 29 G attachée à une seringue à insuline stérile de 0,5 mL.
- Utilisez une pipette pour ajouter 500 μL de SCFM à chaque puits.
- Stérilisez une membrane d’étanchéité respirante pour chaque plaque de 24 puits sous lumière ultraviolette pendant 10 min(Table des matériaux).
- Retirez le couvercle ou les couvercles de la ou des plaques de 24 puits et remplacez-les par la membrane respirante.
- Incuber les plaques à 37 °C pendant le temps d’incubation (infection) souhaité sans trembler. Vérifier qu’il n’y a pas de croissance visible de l’agent pathogène inoculé sur les pièces témoins non infectées (contrôle de la contamination).
NOTA : Si vous le souhaitez, de l’ampicilline peut être ajoutée aux tampons d’agarose SCFM à l’étape 2.5 et en couvrant scfm à l’étape 2.30 jusqu’à une concentration finale de 20 μg/mL. Cela supprimera la croissance de la plupart des bactéries endogènes sur les poumons sans affecter la croissance de P. aeruginosa ou de S. aureus, mais, comme la présence d’ampicilline peut affecter la susceptibilité à d’autres antibiotiques, le lecteur est laissé à faire ce choix en fonction des souches et des antibiotiques qu’il souhaite tester.
3. Détermination de l’efficacité des antibiotiques
NOTA : Un schéma détaillant les étapes de ce dosage est fourni à la figure S1.
- Pour mesurer la tolérance aux antibiotiques des biofilms formés sur EVPL, des ensembles répétés de morceaux pulmonaires, provenant d’au moins deux poumons indépendants, doivent être mis en place pendant la dissection et l’infection. Un ensemble de pièces est requis pour un témoin négatif (pas de traitement antibiotique), et un ensemble est requis pour chaque concentration d’antibiotique à tester.
- Après 48 heures d’incubation, inspectez visuellement les morceaux de tissu non infectés. Il se peut qu’une certaine croissance de bactéries endogènes au poumon du porc se soit produite, ce qui a amené la FMSC autour de ces sections à être turbide. Si une croissance typique des espèces sélectionnées est observée (p. ex. diagnostic de pigmentation bleu-vert de P. aeruginosa),recommencer l’expérience avec des poumons frais.
- Si les sections tissulaires non infectées ne montrent pas ou seulement une croissance bactérienne minime, préparer une plaque de lavage de 24 puits et une plaque de traitement de 24 puits, chacune contenant 500 μL de SCFM fraîche sans antibiotiques ou avec l’antibiotique d’intérêt par puits par morceau de tissu pulmonaire.
- Retirer chaque morceau de tissu infecté de la plaque d’incubation avec une pince stérilisée à la flamme, tourbillonner brièvement dans un puits frais de la plaque de lavage pour éliminer toute cellule bactérienne associée non au biofilm, et transférer dans le puits approprié de la plaque de traitement.
- Sceller les plaques de traitement avec une membrane respirante fraîche.
- Incuber la ou les plaques de traitement à 37 °C sans trembler pendant 18-24 h.
- À l’aide d’une pince stérilisée à la flamme, retirez chaque pièce pulmonaire de la plaque de 24 puits et mettez dans un tube d’homogénéisation stérile de 2 mL contenant 1 mL de solution saline tamponnée au phosphate (PBS) et 1 g de billes métalliques(Table des matériaux).
- Perle battu pendant 40 secondes à 4 m/s.
REMARQUE : Le battement de perles avec les perles et l’homogénéisateur spécifiques suggérés dans la table des matériaux ne provoque pas de lyse importante des bactéries, mais chaque laboratoire utilisant le protocole devrait vérifier les effets des perles et de l’homogénéisateur qu’il a choisis avant de commencer les essais d’AST. - Diluer en série l’homogénat de poumon utilisant le PBS et la plaque sur l’agar de bouillon de lysogeny (LB) pour déterminer les unités formant colonie (CFU) dans les morceaux individuels de tissu non traités et antibiotiques-traités selon les méthodes standard de placage.
NOTA : Facultatif : Préparer des plaques en double sur des supports sélectifs pour confirmer l’identité des colonies; p. ex., utiliser une gélose au sel de mannitol pour S. aureus.
Résultats
Le modèle EVPL fournit une plate-forme d’analyse à haut débit, permettant de dépister un grand nombre d’isolats bactériens pour la sensibilité aux antibiotiques en même temps(figures 1 et 2)ou de cribler des souches contre une gamme de concentrations d’antibiotiques dans une expérience(Figure 3). Avec la pratique, nous avons constaté qu’environ 200 sections de tissu bronchiolaire peuvent être préparées à partir des poumons en 2 heures. L’ensemble de l’expérience pour l’AST peut être achevé dans les heures normales de travail. La croissance des isolats de Pseudomonas aeruginosa et de Staphylococcus aureus et l’établissement d’un biofilm de 48 h dans le modèle sont fiables et, lorsqu’ils sont surveillés par un nombre de cellules viable, produisent des charges bactériennes constantes (figures 1 et 2). Des images de biofilms associés aux tissus de Pseudomonas aeruginosa et Staphylococcus aureus cultivés en EVPL peuvent être trouvées, ainsi que des protocoles de préparation à la photomicroscopie et à la coloration histologique, dans nos publications21,23. Cependant, la reproductibilité des dénombrements de l’UFC varie selon les espèces bactériennes. Ceci peut être quantifié à l’aide de calculs de répétabilité standard après ANOVA25; nous avons constaté qu’il y a généralement une plus grande variation entre l’UFC dans les échantillons pulmonaires répliqués pour S. aureus que pour P. aeruginosa. Nous recommandons que, lors de l’adoption du modèle par un laboratoire, des calculs répétés soient effectués sur des expériences pilotes afin d’optimiser les techniques expérimentales et de déterminer la taille des échantillons à utiliser dans les expériences finales (un exemple de ceci peut être trouvé dans le supplément de données pour Sweeney et al26).
Lorsqu’ils sont cultivés dans l’EVPL, les biofilms de P. aeruginosa et de S. aureus démontrent une tolérance accrue aux antibiotiques par rapport à la sensibilité dans les CMI de bouillon standard approuvées par l’industrie(figure 1)et les essais sur disque utilisant des milieux standard(figure 2). Les différents effets de différents antibiotiques sur le biofilm établi par EVPL sont distinguables, par exemple la mise à mort de P. aeruginosa est obtenue dans l’EVPL avec de la ciprofloxacine 4-16X MIC mais pas avec du chloramphénicol 4-8X MIC(figure 1). Une dose deux fois par jour de 600 mg de linézolide permet d’atteindre une concentration sérique supérieure à la CMI90 pour les agents pathogènes sensibles (4 μg/mL)27 et est considérée comme une exposition adéquate sans effets secondaires indésirables 28. Les données présentées à la figure 2 montrent que les populations de S. aureus, sensibles au linézolide dans le dosage discale, sont capables de survivre à des concentrations sériques cibles, et plus élevées (12 μg/mL), dans evpl. Il n’y a pas de corrélation claire entre la CMI et les effets antibiotiques sur les biofilms cultivés par l’EVPL pour P. aeruginosa (figure 1). Il est important d’obtenir une mesure plus précise de la tolérance aux antibiotiques in vivo, car un dosage sous-optimal des antibiotiques pourrait augmenter le risque de sélection pour la résistance dans les infections chroniques.
Il est bien connu que le mode de croissance du biofilm peut réduire considérablement la sensibilité bactérienne aux antibiotiques. Cela a conduit à la mise au point de nombreux essais in vitro sur biofilm et à l’utilisation de la concentration minimale d’éradication du biofilm (MBEC)14,15 au lieu de la CMI comme prédicteur plus précis de la susceptibilité dans les infections chroniques. L’utilisation de SCFM (dans différentes formulations) a également été recommandée pour l’utilisation dans les essais MIC ou MBEC29. Ici, nous montrons que même un test in vitro optimisé ne peut pas prédire avec précision la susceptibilité de P. aeruginosa à la colistine dans l’EVPL. La quantité d’antibiotique requise pour atteindre 3 log10 de destruction des bactéries cultivées par EVPL est souvent significativement plus élevée que le MIC ou le MBEC calculé à partir d’essais in vitro standard, même lorsque SCFM est utilisé pour ces tests (Figure 3). Ceci est cohérent avec une analyse documentaire Cochrane qui a rapporté que les implémentations actuelles des tests de sensibilité au biofilm in vitro ne fournissent pas de pouvoir prédictif accru pour la prescription d’antibiotiques dans la mucoviscidose par rapport aux tests de sensibilité standard16.
Il est également simple d’utiliser le modèle pour évaluer l’impact des antibiotiques sur les bactéries du biofilm au fil du temps, car suffisamment de répliques de poumons peuvent être inoculées pour permettre un échantillonnage destructeur. En plus de distinguer les différences entre les agents antimicrobiens, le modèle peut mettre en évidence des changements dans la sensibilité à différents stades de croissance bactérienne ou à l’âge du biofilm et pour différents intervalles de dosage des antibiotiques. La figure 4 illustre la tolérance croissante des biofilms de P. aeruginosa au meropenem à mesure qu’ils mûrissent. Cela pourrait être utile pour déterminer l’efficacité de nouveaux agents, par exemple s’ils sont plus efficaces lors d’une division cellulaire rapide. Il peut également s’agir d’une considération importante lors de l’établissement des contraintes d’une expérience, car il peut être nécessaire de normaliser et de valider l’âge du biofilm pour éviter que l’âge n’ait une influence sur les résultats.
Dans la figure 5,la survie de S. aureus a été mesurée à 4 h et 24 h après l’exposition à la flucloxacilline et il a été possible d’observer des différences dans la réduction du nombre de cellules bactériennes au fil du temps et entre les isolats. Cela peut être utile pour le développement de médicaments, par exemple pour définir des paramètres pharmacocinétiques et pharmacodynamiques ou pour élucider le mode d’action d’un nouvel agent.
Les variations de la charge bactérienne augmentent souvent avec les temps de culture prolongés. Ceci peut être vu dans le contrôle non traité dans la figure 5 suivant le développement de biofilm de 48 h et une exposition supplémentaire de 24 h pour tenir compte de l’intervalle de dosage antibiotique. La variation est intrinsèque au modèle ; chaque échantillon de poumon est indépendant des autres et reflète la variation naturelle des poumons. Il est donc important de s’assurer qu’un nombre suffisant de répétitions est inclus pour permettre la validation et une interprétation précise des résultats. Nous renvoyons le lecteur à notre recommandation d’effectuer des calculs répétés sur les données afin de permettre la sélection de tailles d’échantillon robustes.
Par souci de simplicité, nous avons présenté des données représentatives tirées de sections de tissus répliquées acquises à partir d’une seule paire de poumons dans chaque expérience, mais dans la pratique, il est nécessaire d’effectuer des expériences répétées sur des sections de tissus prélevées sur des animaux répliqués. Cela devrait être fait afin de tenir compte de toute variation biologique entre les porcs individuels, et nous renvoyons le lecteur à nos travaux publiés pour des exemples de la cohérence des résultats entre les tissus prélevés sur des porcs répliqués et de la façon dont cette variation est prise en compte dans l’analyse statistique des données à l’aide de l’analyse de la variance (ANOVA)/modèles linéaires généraux (GLM)21,26.
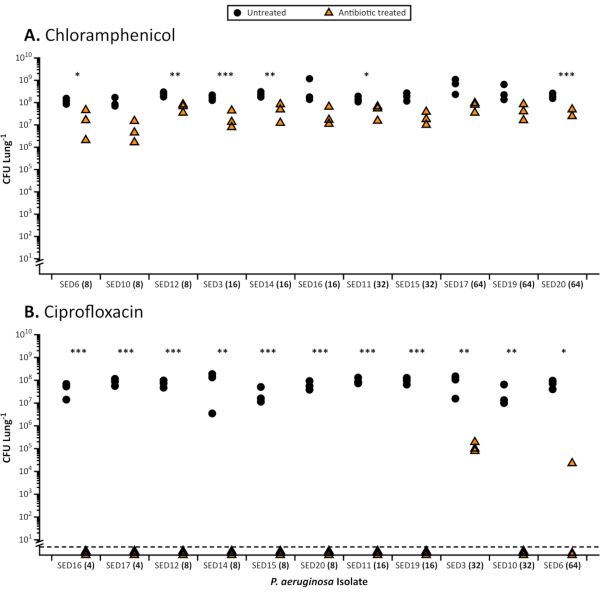
Figure 1. L’UFC totale de 11 isolats cliniques de Pseudomonas aeruginosa atteint de FK récupérés du modèle EVPL après un traitement antibiotique. Résultats représentatifs du traitement antibiotique de P. aeruginosa dans le modèle EVPL. Chaque souche a été cultivée sur du tissu EVPL pendant 48 h, puis transférée à l’antibiotique (triangles) ou au PBS en tant que témoin (cercles) pendant 18 h et l’UFC / poumon déterminé. Le CMI pour l’antibiotique approprié déterminé en MHB standard ajusté aux cations est indiqué entre parenthèses à côté de chaque souche (axe des x). Les déformations sont ordonnées en augmentant les valeurs MIC. Les données ont été analysées à l’aide de tests t, le cas échéant, et de tests U de Mann-Whitney pour les ensembles de données non paramétriques. Les différences significatives entre les tissus traités aux antibiotiques et non traités sont indiquées par des astérisques(P < 0,05). A. Dénombrements viables récupérés à partir de biofilms de P. aeruginosa cultivés dans le modèle EVPL et traités avec 64 μg/mL de chloramphénicol (valeur de CMI la plus élevée enregistrée). Pour chaque isolat, la différence moyenne normalisée d’UFC entre les sections de tissus traitées au chloramphénicol et non traitées a été calculée à l’aide du d de Cohen. Il n’y avait aucune corrélation entre la valeur mic dans le test standard et la diminution des nombres de cellules viables dans le modèle EVPL tel que mesuré par d de Cohen (corrélation de rang de Spearman, rs = 0,45, p = 0,16) B. Résultats des biofilms de P. aeruginosa cultivés dans le modèle EVPL et traités avec de la ciprofloxacine de 64 μg/mL (valeur de CMI la plus élevée enregistrée). Les valeurs inférieures à la ligne pointillée étaient inférieures à la limite de détection. Veuillez cliquer ici pour voir une version plus grande de cette figure.
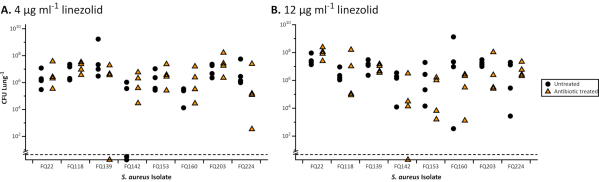
Figure 2. UFC totale de 8 isolats cliniques de Staphylococcus aureus CF récupérés à partir du modèle EVPL après traitement par linézolide. Chaque souche a été cultivée sur du tissu EVPL pendant 48 h puis transférée au linézolide (triangles) pendant 24 h ou n’a pas été traitée comme témoin (cercles). Toutes les souches se sont avérées sensibles au linézolide à l’aide de l’essai de diffusion sur disque standard suivant les lignes directricesEUCAST 30 (zone d’inhibition > 21 mm). Les données ont été analysées à l’aide de tests t, le cas échéant, et de tests U de Mann-Whitney pour les ensembles de données non paramétriques(P < 0,05). Aucune différence significative entre les souches traitées aux antibiotiques et non traitées n’a été constatée pour aucune des souches. Les valeurs inférieures à la ligne pointillée étaient inférieures à la limite de détection. A. Résultats des biofilms de S. aureus dans le modèle EVPL traités avec du linézolide de 4 μg/mL (point de rupture clinique pour sensible/résistant selon la classification EUCAST31). B. Résultats des biofilms de S. aureus dans le modèle EVPL traités avec du linézolide de 12 μg/mL (données reproduites à partir de Sweeney etcoll. 23). Veuillez cliquer ici pour voir une version plus grande de cette figure.
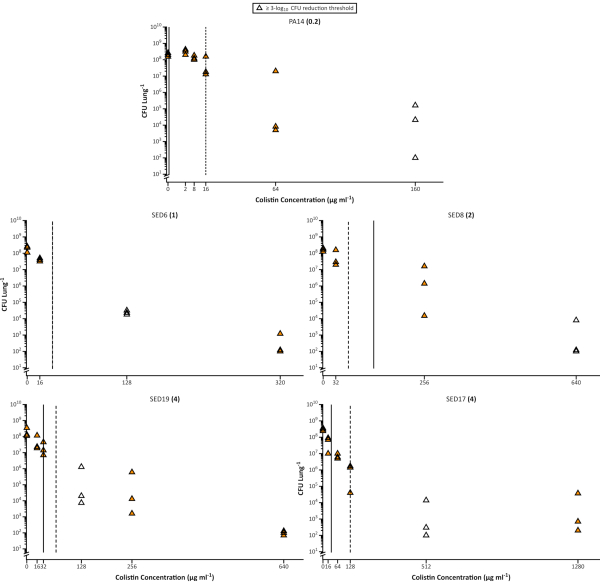
Figure 3. Comptes viables de cellules de Pseudomonas aeruginosa de la souche pa14 de laboratoire et 4 isolats cliniques de CF récupérés du modèle EVPL après traitement avec des concentrations croissantes de colistine. Chaque contrainte a été cultivée sur le tissu d’EVPL pendant 48 h puis exposée au colistin pendant 18 h. Le CMI déterminé dans un milieu MHB standard ajusté en cations est indiqué entre parenthèses à côté de chaque nom de souche. Les lignes verticales montrent la valeur MBEC déterminée en MHB (solide) et SCFM (pointillé), à l’exception de SED6, dans lequel la valeur était la même dans les deux milieux. Les points de données non remplis représentent la plus faible concentration de colistine testée qui a entraîné ≥ réduction de 3 log10 de l’UFC/poumon par rapport aux échantillons non traités (0 μg/mL de colistine) (données reproduites de Sweeney etcoll. 26). Veuillez cliquer ici pour voir une version plus grande de cette figure.
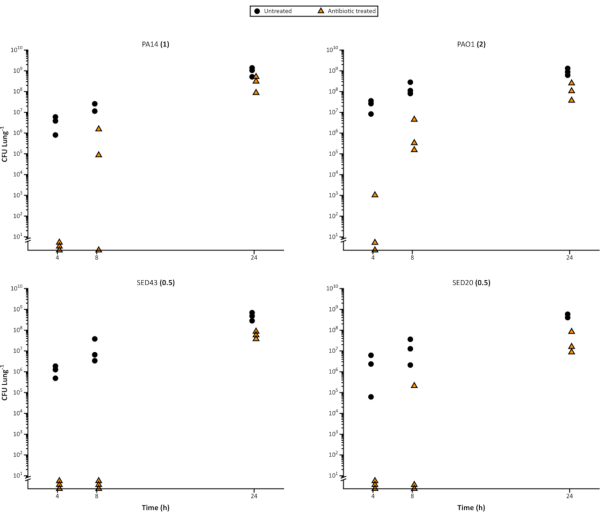
Figure 4. Nombre de cellules pseudomonas aeruginosa viables représentatives à partir d’une évolution temporelle de la croissance sur le modèle EVPL sur 24 h, et d’un traitement ultérieur avec 64 μg/mL de meropenem. La souche de laboratoire P. aeruginosa PA14 et 3 isolats cliniques de CF ont été cultivés sur le tissu EVPL pendant le temps indiqué sur l’axe des x, puis transférés au meropenem (triangles) pendant 24 h ou laissés non traités comme contrôle (cercles). L’UFC/poumon a été alors déterminé. Le MIC déterminé en milieu MHB ajusté aux cations est indiqué entre parenthèses à côté de chaque nom de souche. Veuillez cliquer ici pour voir une version plus grande de cette figure.
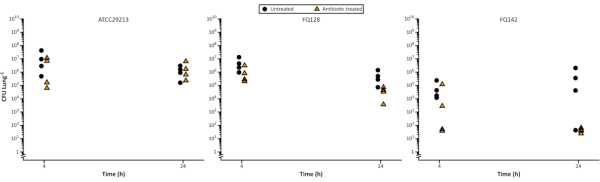
Figure 5. Nombre de cellules staphylococcus aureus viable représentatif après la croissance sur le modèle EVPL, puis traité avec 5 μg/mL de flucloxacilline sur un cours de 24 h. La souche témoin ATCC29213 et deux isolats cliniques de la FK ont été cultivés sur du tissu EVPL pendant 48 h, puis transférés à la flucloxacilline (triangles) ou laissés non traités comme témoin (cercles) pendant 4 h et 24 h, avant que l’UFC/poumon ne soit déterminé (données reproduites à partir de Sweeney etcoll. 23). Veuillez cliquer ici pour voir une version plus grande de cette figure.
Figure S1. Veuillez cliquer ici pour télécharger cette figure.
Tableau S1. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le modèle pulmonaire ex vivo est à haut débit et peu coûteux et, parce qu’il utilise des déchets post-consommation de l’industrie de la viande, il ne présente aucune préoccupation éthique. Il est conçu pour imiter les voies respiratoires humaines de CF chroniquement-infectées mieux que les plateformes in vitro d’AST actuellement disponibles. Les résultats présentés ici montrent qu’il peut prédire plus précisément la sensibilité aux antibiotiques dans ces circonstances.
Les étapes critiques du protocole, qui garantiront des résultats fiables et reproductibles, comprennent les suivantes:
- Utiliser des méthodes d’entreposage et de temps uniformes entre l’abattage, le prélèvement et le traitement des échantillons pulmonaires. Il est important d’utiliser les poumons dès que possible après l’abattage et de réduire au minimum le risque de contamination. Des différences dans la capacité des cultures expérimentales à se développer dans les poumons si elles ne sont pas aussi fraîches que possible ont été observées.
- Le maintien de la stérilité dans la production de SCFM et la dissection des morceaux de poumon est essentiel. Les poumons sains ne sont pas stériles et donc la présence de bactéries commensales peut refléter un environnement « naturel » pour l’infection chronique. Néanmoins, comme il a été mentionné précédemment, les interactions bactériennes au sein de populations multispécifiques peuvent modifier les résultats et la sensibilité aux antibiotiques, de sorte que la contamination doit être évitée et que les poumons doivent être stérilisés avant utilisation. Nous préconisons l’utilisation de la stérilisation UV, car elle ne semble pas entraîner de changements dans l’intégrité des tissus d’étain et, si nécessaire, des lavages antibiotiques supplémentaires. Cependant, les antibiotiques doivent être utilisés avec prudence, car ils peuvent influencer les résultats en introduisant des pressions sélectives et peuvent modifier l’expression des gènes dans les populations bactériennes d’essai.
- Utilisez des échantillons de tissus témoins négatifs infectés par des simulacres et des plaques de comptage cellulaire cultivées sur un milieu riche et non sélectif pour mettre en évidence la croissance de tout contaminant ou bactérie commensale qui n’a pas été éliminé pendant la stérilisation. Ceci est essentiel pour atténuer tout impact de ces bactéries sur l’AST. Il est également utile de produire des plaques de comptage cellulaire en double, sélectives et en gélose spécifiques à l’organisme d’intérêt, car les plaques en double accélèrent l’identification des colonies et le dénombrement cellulaire.
- Mener des expériences pilotes lors de la première utilisation du modèle et lors de son utilisation avec de nouvelles souches ou de nouveaux génotypes de bactéries pour évaluer les variations de l’UFC sur biofilm entre les sections tissulaires, ce qui permet de sélectionner des tailles d’échantillon expérimentales optimales (p. ex., combien de sections de tissus répliquées à acquérir à partir du nombre de poumons répliqués) à l’aide de calculs de puissance.
- Le test utilise un inoculum non normalisé, car cela permet une inoculation rapide après 48 heures d’incubation et la formation de charges de biofilms relativement cohérentes (en particulier pour P. aeruginosa). Pour analyser l’efficacité antibactérienne aux premiers stades de croissance du biofilm, envisagez d’inoculer avec une UFC normalisée de bactéries cultivées en colonies en suspension dans l’ASM. Nous ne recommandons pas l’inoculation avec des bactéries planctoniques: les premières expériences pilotes ont montré que cela conduit à une croissance aiguë et invasive et non à une formation de biofilm fiable.
Ce protocole produit un modèle prototype robuste pour une utilisation avec P. aeruginosa, avec un grand potentiel de développement pour une utilisation avec S. aureus, mais il a certaines limitations qui devront être abordées pour certaines applications à l’avenir. Le tissu a été inoculé des colonies simples pour permettre le développement des populations clonales. Les résultats montrent que, pour P. aeruginosa, cela a peu d’impact sur le nombre de cellules à 48 h. Cependant, une plus grande variabilité de la charge bactérienne a été observée pour S. aureus et, étant donné que différentes bactéries peuvent se développer différemment dans le modèle, un inoculum de départ normalisé et une production rigoureuse d’échantillons de tissus de taille et de poids identiques peuvent dépendre de l’organisme à l’étude. Il peut également y avoir des différences entre les laboratoires en raison de différences dans les techniques précises de dissection /infection ou de race porcine locale / race locale. Pour évaluer la reproductibilité des populations bactériennes pour les implémentations individuelles du modèle, nous suggérons l’utilisation de calculs de répétabilité dans le cadre de l’analyse statistique des résultats25 et l’utilisation de calculs de répétabilité/puissance basés sur des expériences pilotes pour calculer la taille optimale de l’échantillon pour leur utilisation dans les expériences finales.
L’un des principaux avantages de l’EVPL par rapport aux essais sur plaque traditionnels est que, plutôt que de tester les bactéries poussant planconiquement ou sur des surfaces abiotiques, il permet la structuration spatiale des biofilms bactériens dans un environnement hôte et avec différenciation cellulaire. Ceci a des implications importantes pour considérer l’impact des gradients physiochimiques et nutritifs sur l’activité des agents antimicrobiens aussi bien que la livraison et la disponibilité des thérapies actives à différents microenvironnements dans une infection chronique et l’interaction cellule-cellule entre les bactéries. Ce dernier point est particulièrement important, car des infections multispécifiques sont systématiquement observées dans la FK et deviennent de plus en plus importantes pour les infections associées à d’autres affections respiratoires, telles que l’asthme et la maladie pulmonaire obstructive chronique. Il est possible de développer ce modèle pour l’AST pour l’échantillonnage individualisé des expectorations des patients dans les diagnostics cliniques. Un essai analogue est déjà en cours à l’aide d’un modèle in vitro imitant les plaies pour la croissance et l’AST du biofilm débridé à partir de plaies chroniques (Southwest Regional Wound Care Center à Lubbock, au Texas, Dr R. Wolcott).
En outre, le modèle utilise du tissu post mortem, de sorte que l’influence de la réponse immunitaire de l’hôte sur la susceptibilité aux antibiotiques est limitée. Les modèles in vitro actuels ne tiennent pas non plus compte des réponses immunitaires de l’hôte, de sorte que nous ne voyons pas cela comme un obstacle à l’utilisation future du modèle dans les applications AST. Cependant, la réponse immunitaire est prise en considération lorsque les paramètres pharmacocinétiques et pharmacodynamiques et les directives de dosage des antibiotiques sont déterminés. Bien que nos études aient montré des preuves de cellules immunitaires résiduelles et de réponses dans le tissu23 (et S. Azimi, communication personnelle), il s’agit d’un domaine privilégié pour une optimisation et un développement ultérieurs du modèle si une plus grande correspondance avec les conditions in vivo est souhaitée.
Fournir un AST plus cliniquement valide pour les FC aidera à répondre à une recommandation clé de la Health, Social Care Act 2008 du Royaume-Uni selon laquelle « des procédures devraient être en place pour assurer une prescription prudente et une gestion prudente des antimicrobiens ». Nous croyons que l’EVPL est un modèle candidat idéal pour aider à répondre à ce besoin.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions tous nos co-auteurs pour les articles originaux dont nous avons tiré des résultats exemplaires. Les travaux ont été financés par une subvention de recherche de nouveau chercheur du CRM (numéro de subvention MR/R001898/1)accordée à FH; par des bourses de doctorat du BBSRC Midlands Integrative Biosciences Training Partnership (MIBTP) attribuées à NEH et IA; et par la bourse du programme de soutien à la recherche de premier cycle de l’Université de Warwick à FA pour mener un projet de recherche sur les vacances d’été. Nous remercions Steve Quigley, Sons (Cubbington, Warwickshire) et John Taylor, Son (Earlsden, Coventry) pour avoir fourni des poumons. Nous tenons également à souligner l’aide de l’Installation de préparation des médias de l’École des sciences de la vie de l’Université de Warwick, avec des remerciements particuliers à Cerith Harries et Caroline Stewart, et l’aide d’Anita Catherwood à l’Installation de dépistage antimicrobien de Warwick.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mL insulin syringes with 29G needle attached | |||
| 24-well culture plates | |||
| 70% ethanol or similar for surface sterilizaton and flamin gof dissection equipment | |||
| Agar plates to prepare streaks of P. aeruginosa/S. aureus (any suitable medium) | |||
| Agarose | |||
| Aluminum foil - pre-sterilised by autoclaving - to cover the chopping board on whcih you wil dissect lungs. | |||
| Bead beater designed to take 2 mL tubes | MP Biomedicals | 116004500 | FastPrep-24 Classic bead beating grinder and lysis system |
| Breathe-easy or Breathe-easier sealing membrane for multiwell plates | Diversified Biotech | BEM-1 or BERM-2000 | |
| Bunsen burner | |||
| Chopping board - we recommend a plastic board to allow for easy decontamination with alcohol. | |||
| Coolbox to transport lungs to lab | |||
| Dissection scissors in different sizes | |||
| Dulbecco’s modified Eagle medium (DMEM) | |||
| Fisherbrand 2 mL reinforced tubes | Thermo Fisher | 15545809 | |
| Fisherbrand 2.38 mm metal beads | Thermo Fisher | 15505809 | |
| Germicidal UV cabinet | |||
| Insulin syringes - 0.5 mL with 29G needle attached. | VWR | BDAM324892 | |
| Large pallet knife | |||
| LB agar plates to assess CFU in lung biofilm homogenate | |||
| Mounted razor blades | |||
| Nalgene RapidFlow PES 75 mm x 0.1 µm x 500 ml sterile filter unit | Thermo Fisher | 10474415 | For filter-sterilizing SCFM |
| Petri dishes | |||
| Phosphate-buffered saline | |||
| Plastic chopping board and aluminium foil to create a sterile and cleanable dissection surface | |||
| Roswell Park Memorial Institute (RPMI) 1640 medium | |||
| SCFM ingredients as listed in Table S1 | |||
| Selection of forceps (blunt tips recommended) | |||
| Selective agar plates to specifically assess P. aeruginosa / S. aureus CFU in lung biofilm homogenate, if required. | |||
| Suitable containers for disposing of contaminated sharps and pig ung tissue, according to your institution's health & safety policies. |
Références
- Elborn, J. S. Cystic fibrosis. The Lancet. 388 (10059), 2519-2531 (2016).
- Høiby, N., et al. Diagnosis of biofilm infections in cystic fibrosis patients. APMIS. 125, 339-343 (2017).
- Bjarnsholt, T., et al. Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatric Pulmonology. 44 (6), 547-558 (2009).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents. 35 (4), 322-332 (2010).
- Penesyan, A., Gillings, M., Paulsen, I. Antibiotic discovery: Combatting bacterial resistance in cells and in biofilm communities. Molecules. 20 (4), 5286 (2015).
- Son, M. S., Matthews, W. J., Kang, Y., Nguyen, D. T., Hoang, T. T. In vivo evidence of Pseudomonas aeruginosa nutrient Acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity. 75 (11), 5313-5324 (2007).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846 (2016).
- Stites, S. W., Plautz, M. W., Bailey, K., O'Brien-Ladner, A. R., Wesselius, L. J. Increased concentrations of iron and isoferritins in the lower respiratory tract of patients with stable cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 160 (3), 796-801 (1999).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proceedings of the National Academy of Sciences. 115 (22), 5125-5134 (2018).
- Drevinek, P., et al. Gene expression changes linked to antimicrobial resistance, oxidative stress, iron depletion and retained motility are observed when Burkholderia cenocepacia grows in cystic fibrosis sputum. BMC Infectious Diseases. 8, 121 (2008).
- Goerke, C., Wolz, C. Regulatory and genomic plasticity of Staphylococcus aureus during persistent colonization and infection. International Journal of Medical Microbiology. 294 (2-3), 195-202 (2004).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Roberts, A. E. L., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. Journal of Molecular Biology. 427, 3646-3661 (2015).
- Ceri, H., et al. The Calgary biofilm device: New technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. Journal of Clinical Microbiology. 37 (6), 1771-1776 (1999).
- Moskowitz, S. M., Foster, J. M., Emerson, J., Burns, J. L. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. Journal of Clinical Microbiology. 42 (5), 1915-1922 (2004).
- Smith, S., Waters, V., Jahnke, N., Ratjen, F. Standard versus biofilm antimicrobial susceptibility testing to guide antibiotic therapy in cystic fibrosis. Cochrane Database of Systematic Reviews. (6), (2020).
- Trust, C. F. . Annual Data Report 2019. , (2019).
- Angelis, A., et al. Social and economic costs and health-related quality of life in non-institutionalised patients with cystic fibrosis in the United Kingdom. BMC Health Services Research. 15 (1), 428 (2015).
- Eidt-Koch, D., Wagner, T. O. F., Mittendorf, T., von der Schulenburg, J. M. G. Outpatient medication costs of patients with cystic fibrosis in Germany. Applied Health Economics and Health Policy. 8 (2), 111-118 (2010).
- Harrington, N. E., Sweeney, E., Harrison, F. Building a better biofilm - Formation of in vivo-like biofilm structures by Pseudomonas aeruginosa in a porcine model of cystic fibrosis lung infection. Biofilm. 2, 100024 (2020).
- Harrison, F., Diggle, S. An ex vivo lung model to study bronchioles infected with Pseudomonas aeruginosa biofilms. Microbiology. 162, 1755-1760 (2016).
- Sweeney, E., et al. An ex vivo cystic fibrosis model recapitulates key clinical aspects of chronic Staphylococcus aureus infection. Microbiology. , (2020).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85 (4), 935-956 (2010).
- Sweeney, E., Sabnis, A., Edwards, A. M., Harrison, F. Effect of host-mimicking medium and biofilm growth on the ability of colistin to kill Pseudomonas aeruginosa. Microbiology. 166 (12), 1171-1180 (2020).
- Stalker, D. J., Jungbluth, G. L., Hopkins, N. K., Batts, D. H. Pharmacokinetics and tolerance of single- and multiple-dose oral or intravenous linezolid, an oxazolidinone antibiotic, in healthy volunteers. Journal of Antimicrobial Chemotherapy. 51 (5), 1239-1246 (2003).
- Ager, S., Gould, K. Clinical update on linezolid in the treatment of Gram-positive bacterial infections. Infection and Drug Resistance. 5, 87-102 (2012).
- Kirchner, S., et al. Use of Artificial Sputum Medium to Test Antibiotic Efficacy Against Pseudomonas aeruginosa in Conditions More Relevant to the Cystic Fibrosis Lung. Journal of Visualized Experiments: JoVE. (64), e3857 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon