Method Article
Antibiotika-Wirksamkeitstests in einem Ex-vivo-Modell von Pseudomonas aeruginosa und Staphylococcus aureus Biofilmen in der Mukoviszidose-Lunge
In diesem Artikel
Zusammenfassung
Dieser Workflow kann verwendet werden, um Antibiotika-Suszeptibilitätstests mit einem etablierten Ex-vivo-Modell des bakteriellen Biofilms in der Lunge von Personen mit Mukoviszidose durchzuführen. Die Verwendung dieses Modells könnte die klinische Validität von MBEC-Assays (Minimal Biofilm Eradication Concentration) verbessern.
Zusammenfassung
Die wirksame Verschreibung von Antibiotika für die bakteriellen Biofilme, die in der Lunge von Personen mit Mukoviszidose (CF) vorhanden sind, wird durch eine schlechte Korrelation zwischen den Ergebnissen der Antibiotika-Suszeptibilitätstests (AST) mit Standarddiagnosemethoden (z. B. Brühe-Mikrodilution, Bandscheibendiffusion oder Etest) und den klinischen Ergebnissen nach einer Antibiotikabehandlung eingeschränkt. Versuche, AST durch den Einsatz von handelsüblichen Biofilm-Wachstumsplattformen zu verbessern, zeigen wenig Verbesserung der Ergebnisse. Die begrenzte Fähigkeit von In-vitro-Biofilmsystemen, die physikalisch-chemische Umgebung der CF-Lunge und damit die bakterielle Physiologie und Biofilmarchitektur nachzuahmen, wirkt auch als Bremse für die Entdeckung neuartiger Therapien für CF-Infektionen. Hier präsentieren wir ein Protokoll zur Durchführung von AST von CF-Krankheitserregern, die als reife, in vivo-ähnliche Biofilme in einem ex vivo CF-Lungenmodell aus schweinebronchiolärem Gewebe und synthetischem CF-Sputum (ex vivo Schweinelunge, EVPL) gezüchtet wurden.
Es gibt mehrere In-vitro-Assays für Biofilm-Suszeptibilitätstests, die entweder Standard-Labormedium oder verschiedene Formulierungen von synthetischem CF-Auswurf in Mikrotiterplatten verwenden. Sowohl das Wachstumsmedium als auch das Biofilmsubstrat (Polystyrolplatte vs. Bronchiolgewebe) beeinflussen wahrscheinlich die Antibiotikatoleranz des Biofilms. Wir zeigen eine erhöhte Toleranz gegenüber klinischen Pseudomonas aeruginosa- und Staphylococcus aureus-Isolaten im Ex-vivo-Modell; Die Wirkungen der antibiotischen Behandlung von Biofilmen korrelieren nicht mit der minimalen inhibitorischen Konzentration (MIC) in Standard-Mikrodilutionsassays oder einer empfindlichen/resistenten Klassifizierung in Scheibendiffusionsassays.
Die Ex-vivo-Plattform könnte für maßgeschneiderte Biofilm-AST von Patientenproben und als verbesserte Testplattform für potenzielle Antibiofilm-Wirkstoffe während der pharmazeutischen Forschung und Entwicklung verwendet werden. Die Verbesserung der Verschreibung oder Beschleunigung der Entdeckung von Antibiotika durch den Einsatz von mehr In-vivo-ähnlichen Testplattformen könnte die Gesundheitsergebnisse für Menschen mit CF drastisch verbessern und die Kosten für klinische Behandlung und Entdeckungsforschung senken.
Einleitung
Chronische Biofilminfektionen betreffen Personen, deren normale Immunabwehr beeinträchtigt ist. Zu den Risikogruppen gehören Personen mit der genetischen Erkrankung Mukoviszidose (CF)1. Die Besiedlung des ungewöhnlich dicken, adhäsiven Schleims in den Atemwegen im frühen Säuglingsalter führt zu hartnäckigen Biofilminfektionen der Bronchiolen2,3. Das Wachstum von Bakterien als ausgedehnte matrixverkapselte Biofilme ist ein Faktor, der chronische Infektionen immungeschwächter Menschen von akuten Infektionen gesunder Wirte unterscheidet und der Biofilmzustand schützt Bakterien vor Antibiotikaexposition (aufgrund einer reduzierten Diffusion durch die Matrix) und verringert ihre Antibiotikaanfälligkeit (z. B. durch Induktion der Ruhe oder Hochregulierung von Ausflusspumpen)4,5. Krankheitsspezifische Veränderungen in der Physiologie und Chemie des Wirtsgewebes verändern die bakterielle Physiologie jedoch weiter von der, die bei akuten Infektionen oder bei Standard-Laborwachstumsbedingungen beobachtet wurde. Wichtige Beispiele bei CF sind die Verwendung ungewöhnlicher Kohlenstoffquellen wie Fettsäuren und Aminosäuren, die aus Lungentensiden freigesetzt und durch mikrobiellen Abbau von Mucin, die Freisetzung von Mikronährstoffen wie Eisen aus geschädigtem Gewebe und Mikroaerobiose hergestellt werden6,7,8.
Die spezifischen physikalisch-chemischen Bedingungen in einem bestimmten Biofilminfektionskontext können daher die Reaktionen auf Antibiotika beeinflussen. Erstens hängt die Struktur und Tiefe der extrazellulären Matrix von lokalen Umweltbedingungen wie Nährstoffen oder Scherkräften ab. Zweitens können Umwelthinweise die Expression spezifischer Antibiotikaresistenzgene auslösen. Zum Beispiel zeigt der CF-Erreger Pseudomonas aeruginosa eine erhöhte Expression einer Beta-Lactamase und eine reduzierte Expression von Porinen im CF-Sputum im Vergleich zu in vitro9,während ein anderer CF-Erreger, Burkholderia cenocepacia, Beta-Lactamasen und Ausflusspumpen hochreguliert, wenn er in CF-Sputum10gezüchtet wird. Drittens können Bedingungen im Wirt einen physiologischen oder genetischen Wechsel zu antibiotikatoleranten Phänotypen anzeigen, die in vitro schwer zu rekapitulieren sind. Dazu gehören kleine Kolonievarianten des CF-Erregers Staphylococcus aureus11,12.
All diese Daten deuten darauf hin, dass, wenn diagnostische Labore einzelne Klone aus pathogenem Biofilm isolieren und AST an planktonischen oder Agarplattenkulturen in Standardlabormedien (Brühe-Mikroverdrängung, Scheibendiffusion oder Etest) durchführen, die Ergebnisse oft nicht vorhersagen, welche Antibiotika tatsächlich in vivo wirken werden. Selbst wenn In-vitro-Biofilm-Assays verwendet werden, dürfen sie aufgrund von Unterschieden im verwendeten Medium und in der Bindungsoberfläche keinen In-vivo-ähnlichen Biofilm-Phänotyp anzeigen, so dass Assays mit Flusszellen oder Hochdurchsatz-Mikroplattenplattformen die Antibiotika-Empfindlichkeit überschätzen können13. Das gleiche Problem gilt für Forscher in Wissenschaft und Industrie, die neue Antibiofilmmittel entwickeln wollen: Die Prüfung des Arzneimittelpotenzials mit In-vitro-Plattformen wie Flusszellen, Mikrotiterplatten oder Biofilmreaktoren des Center for Disease Control kann die Biofilm-Wirksamkeitslatte zu niedrig ansetzen und falsche Positive in der Forschungs- und Entwicklungspipeline erzeugen.
Die schlechte Korrelation zwischen AST-Ergebnissen und klinischem Ergebnis nach Antibiotikabehandlung bei CF ist bekannt. Viele Kliniker ignorieren die AST im diagnostischen Labor einfach, da es keine einheitlichen, CF-spezifischen Richtlinien für die Interpretation dieser Ergebnisse gibt, und treffen stattdessen Einzelfallentscheidungen für die Verschreibung. Es wurden Versuche unternommen, CF AST zu verbessern, indem das Calgary-Biofilmgerät verwendet wird, das Biofilme verwendet, die auf der Oberfläche von Kunststoffstiften in den Vertiefungen einer Mikroplatte mit Standard-AST-Medium (z. B. kationenjustierte Muller-Hinton-Brühe)14,15gezüchtet wurden. Dieser Assay kann nicht besser vorhersagen, welche Antibiotika in vivo wirken werden, als Standard planktonische AST16. Die Auswirkungen auf Patienten mit CF sind stark. Trotz wiederholter Antibiotikagabe (regelmäßige inhalative Antibiotika und ein Median von 27 Tagen/Jahr, die intravenöse Antibiotika für Personen mit CF im Vereinigten Königreich erhalten)17, führen häufige und unvorhersehbare Episoden akuter pulmonaler Exazerbation zu fortschreitenden Lungenschäden und in etwa 90% der Fälle zum Tod durch Atemversagen. In einer kürzlich durchgeführten Analyse war die bakterielle Lungeninfektion der stärkste Prädiktor für die Medikamentenkosten bei CF und fügte im Durchschnitt 3,6.000 € / Patient / Jahr zu den direkten Gesundheitskostenhinzu 18,19.
Für akute Infektionen von ansonsten gesunden Personen ist die aktuelle Forschung und Politik, die sich auf schnelle AST konzentriert, basierend auf beispielsweise der genomischen Vorhersage am Point-of-Care, ideal20. Aber im Falle chronischer CF-Infektionen ist klar, dass ein anderer Ansatz erforderlich ist: die Implementierung von AST in wirtsahmenden Modellen, die die In-vivo-Umgebung und den Stoffwechselzustand des Krankheitserregers besser rekapitulieren und die Bildung einer realistischen Biofilmstruktur ermöglichen.
Wir haben zuvor ein CF-Biofilmmodell entwickelt, das Abschnitte von Schweinebronchiolen umfasst, die im synthetischen CF-Sputum inkubiert und mit P. aeruginosa oder S. aureusinfiziert sind. Nicht infizierte EVPL behält die normale Histopathologie für 7 Tage bei, aber Labor- oder klinische Isolate von P. aeruginosa und S. aureus bilden reproduzierbar in vivo-ähnliche Aggregate um das Gewebe herum und ahmen die Ätiologie der CF-Infektion nach21,22,23. Wir präsentieren ein Protokoll zur Verwendung dieses hochvaliditätigen Hochdurchsatzmodells als maßgeschneiderte Biofilm-AST-Plattform für CF und präsentieren beispielhafte Ergebnisse, die die hohe Toleranz von Pathogen-Biofilmen gegenüber klinisch eingesetzten Antibiotika zeigen, wenn sie im Modell gezüchtet werden. Das Modell könnte leicht in Forschungs-, Entwicklungspipelines für das Management oder die Prävention von Biofilmbildung und möglicherweise in diagnostische AST integriert werden. Die meisten verwendeten Geräte (siehe Materialtabelle) können leicht in einem typischen mikrobiologischen Labor gefunden werden, obwohl ein Perlenschläger unerlässlich ist, und wir haben aus der Arbeit mit Mitarbeitern herausgefunden, dass möglicherweise auch ein geeigneter ultravioletter Keimtötungsschrank beschafft werden muss. Da die Lungen von kommerziellen Metzgern oder Schlachthöfen bezogen werden, stellt das Modell keine ethischen Bedenken dar.
Protokoll
Dieses Protokoll verwendet Schweinelungen, die aus einem kommerziellen Schlachthof stammen, der Fleisch für den menschlichen Verzehr liefert. Nach britischem Recht erfordert die Verwendung von Übrig gebliebenem Gewebe von Tieren, die für Fleisch geschlachtet wurden, keine ethische Genehmigung. Wir empfehlen den Lesern, die relevanten lokalen Gesetze und institutionellen Richtlinien zu überprüfen, bevor sie mit der Arbeit beginnen.
1. Herstellung von synthetischen CF-Sputummedien (SCFM)
- Um SCFM für die Verwendung mit EVPL-Gewebe herzustellen, folgen Sie dem von Palmer et al.24 beschriebenen Rezept mit der Modifikation, dass Glukose aus dem Rezept entfernt wird.
HINWEIS: Das Rezept von Palmer et al. enthält freie Aminosäuren, Kationen, Anionen und Laktat in Konzentrationen, die für die durchschnittlichen Konzentrationen in einer Auswahl von Sputumproben von CF-Patienten repräsentativ sind. Es wurde gezeigt, dass es vergleichbare Kohlenstoffnutzungswege und die Expression von Quorum-Sensorsignalen durch P. aeruginosa PA14 auf das Wachstum in Medium aus lyophilisiertem Patientensputum24hinweist. Ein Rezept für 1 L modifiziertes SCFM ist in Tabelle S1 enthalten. - Filter sterilisieren Sie den SCFM sofort nach der Zubereitung und lagern Sie ihn bei 4 °C für bis zu 1 Monat.
2. Dissektion und Infektion von Ex-vivo-Schweinelungengewebe (EVPL)
- Bereiten Sie vor der Dissektion eine Agarplatte (n) der erforderlichen Bakterienstämme auf die Infektion vor, wobei das Agar im Labor für P. aeruginosa/S. aureus Standard ist (z. B. Lysogenbrühe + 1,2% Agar).
- Berechnen Sie, wie viele porcine bronchiolische Gewebestücke für das Experiment benötigt werden, einschließlich nicht infizierter Kontrollgewebestücke. Multiplizieren Sie diese Zahl mit zwei, um das Experiment in zwei replizierten Lungen zu wiederholen, um die Wiederholbarkeit der Ergebnisse zu bestätigen.
- Multiplizieren Sie die Gesamtzahl der Gewebestücke, die erforderlich sind, mit 0,5, um das Volumen der SCFM-Agarose (ml) zu bestimmen, die zur Herstellung von Agarose-Pads benötigt wird, um genügend Medium für 400 μL / Tissuestück plus Ersatz-SCFM-Agar zu erhalten, um Pipettierfehler oder Verdampfung während der Zubereitung zu berücksichtigen.
- Fügen Sie 0,12 g Agarose zu jedem 15 ml SCFM hinzu, der erforderlich ist, um das gewünschte Gesamtvolumen von SCFM mit 0,8% Gewicht / Volumen Agarose zu erzielen.
- Erhitzen Sie die SCFM-Agaroselösung, bis die Agarose vollständig aufgelöst ist. Eine Haushaltsmikrowelle mit geringer Leistung wird empfohlen. Der Zeitaufwand hängt von der Wattleistung der Mikrowelle ab. Die Agarose auf ca. 50 °C abkühlen lassen (warm im Griff, aber angenehm zu halten). Nicht weiter abkühlen lassen.
- Fügen Sie mit einer Pipette 400 μL der SCFM-Agarose zu einer Vertiefung einer 24-Well-Platte pro benötigtem Gewebestück hinzu.
- Sterilisieren Sie die SCFM-Agarose-haltige 24-Well-Platte/n unter ultraviolettem Licht für 10 min.
- Bereiten Sie drei Replikatwäschen für jede intakte Lunge vor, die mit 20 ml sterilem Dulbeccos modifiziertem Eagle Medium (DMEM) plus 20 ml sterilem Roswell Park Memorial Institute (RPMI) 1640 mit 50 μg/ ml Ampicillin seziert wird.
- Machen Sie ein Aliquot von 40 ml SCFM als letzte Wäsche für jede intakte Lunge, die seziert wird. Alle Waschungen können über Nacht bei 4 °C gelagert oder sofort verwendet werden.
- Erhalten Sie die Lungen so schnell wie möglich nach der Schlachtung aus der angegebenen Quelle und stellen Sie sicher, dass sie kalt gehalten werden, indem Sie sie in einer häuslichen Kühlbox zum Labor transportieren.
HINWEIS: Lungen, die näher am Schlachttag liegen, zeigen weniger Blutergüsse durch die Lagerung, aber auch Gewebe, das bis zu 4 Tage nach der Schlachtung im Kühlhaus aufbewahrt wird, kann verwendet werden. Da die Kühlbox in die Metzgerei oder den Schlachthof gebracht werden muss, muss sie nach jedem Gebrauch gemäß den örtlichen Laborrichtlinien dekontaminiert und bei Nichtgebrauch außerhalb des mikrobiologischen Labors gelagert werden, um das Risiko einer Kontamination und eines Verstoßes gegen das Containment zu verringern. - Arbeiten Sie auf einer sterilisierten Oberfläche und unter einer Flamme, legen Sie die Lunge auf ein sauberes Kunststoff-Schneidebrett, das mit autoklavierter Aluminiumfolie bedeckt ist. Überprüfen Sie, ob die Bronchiolen intakt bleiben. Bei Schäden am Schlachthof oder während des Transports sind die Lungen nicht für den Einsatz geeignet.
- Erhitzen Sie ein Palettenmesser unter einer Flamme und berühren Sie das Messer sehr kurz mit dem Bereich der Lunge, der die Bronchiole umgibt, um die Oberfläche des Gewebes zu sterilisieren.
- Schneiden Sie das Oberflächengewebe, das die Bronchiole umgibt, mit einer steril montierten Rasierklinge ab. Machen Sie Schnitte parallel zur Bronchiole, um Schäden zu vermeiden.
- Sobald die Bronchiole freigelegt wurde, machen Sie einen Querschnittsschnitt durch die Bronchiole an der höchsten sichtbaren Stelle, um die Bronchiole zu befreien.
- Halten Sie mit einer sterilen Zette das freie Ende der Bronchiole leicht und schneiden Sie das verbleibende unerwünschte Gewebe mit einer steril montierten Rasierklinge ab. Machen Sie einen letzten Querschnittsschnitt über die Bronchiole, bevor eine Verzweigung sichtbar ist, um die Bronchiole aus der Lunge zu entfernen.
- Legen Sie die Bronchiole in die erste DMEM/RPMI 1640 Wäsche. Lassen Sie die Bronchiole in der Wäsche und wiederholen Sie die Schritte 2.11-2.14, um zusätzliche Bronchiolabschnitte aus derselben Lunge zu entnehmen, die erforderlich sind, um ausreichende Gewebeabschnitte für das geplante Experiment zu erhalten.
- Legen Sie alle zusätzlichen bronchiolen Abschnitte aus derselben Lunge in die Wäsche (Schritt 2.16). Mindestens 2 min in der Wäsche ein geben.
- Entfernen Sie die Bronchiolen aus der ersten DMEM/RPMI 1640-Wäsche und legen Sie die Proben in eine sterile Petrischale.
- Halten Sie jede Bronchiole leicht mit einer sterilen Zette und achten Sie darauf, das Gewebe nicht zu beschädigen. Entfernen Sie so viel verbleibendes Weichgewebe wie möglich und schneiden Sie das Gewebe mit einer sterilen Dissektionsschere in ~ 5 mm breite Streifen.
- Legen Sie alle bronchiolischen Gewebestreifen in die zweite DMEM/RPMI 1640-Wäsche. Mindestens 2 min in der Wäsche ein geben.
- Entfernen Sie die Gewebestreifen aus der zweiten Wäsche mit einer sterilen Zette und achten Sie darauf, das Gewebe nicht zu beschädigen. Legen Sie das Gewebe in eine saubere, sterile Petrischale.
- Entfernen Sie das verbleibende Weichgewebe, das an der Bronchiole befestigt ist, und schneiden Sie die Streifen mit einer sterilen Dissektionsschere in Quadrate (~ 5 mm x 5 mm).
- Die dritte DMEM/RPMI 1640 Wäsche in die Petrischale geben. Mischen Sie die Gewebestücke in der Wäsche leicht, indem Sie die Schüssel schwenken.
- Gießen Sie die dritte Wäsche aus der Petrischale, ohne die Gewebestücke zu entfernen.
- Die endgültige SCFM-Wäsche in die gewebehaltige Petrischale geben und sicherstellen, dass alle Gewebestücke bedeckt sind.
- Sterilisieren Sie die Gewebestücke in SCFM unter UV-Licht für 5 min.
- Verwenden Sie eine sterile Zette, um jedes sterilisierte bronchiolische Gewebestück in einzelne Vertiefungen einer 24-Well-Platte / s mit SCFM-Agarose-Pads zu übertragen.
- Um jedes Gewebestück mit dem gewünschten Bakterienstamm zu infizieren, berühren Sie eine kolonie, die auf einer Agarplatte mit der Spitze einer 29-G-Nadel an einer sterilen 0,5-ml-Insulinspritze befestigt ist. Berühren Sie dann die Kolonie auf das Gewebestück und stechen Sie sanft in die Gewebeoberfläche.
HINWEIS: Durch die Verwendung einer Insulinspritze, die mit einer 29-G-Nadel ausgestattet ist, kann die Nadel genau und bequem gehalten werden, während die Finger einen sicheren Abstand von der Nadel und dem Lungengewebe halten. Es ist möglich, diesen Schritt mit 29 G-Nadeln durchzuführen, die nicht an einer Spritze befestigt sind, dies erfordert jedoch mehr Geschicklichkeit und erhöht das Risiko einer Nadelstichverletzung. Insulinspritzen sind leicht verfügbar. - Für die nicht infizierten Kontrollen stechen Sie vorsichtig die Oberfläche jedes Gewebestücks mit der Spitze einer 29 G-Nadel, die an einer sterilen 0,5-ml-Insulinspritze befestigt ist.
- Verwenden Sie eine Pipette, um 500 μL SCFM zu jeder Vertiefung hinzuzufügen.
- Sterilisieren Sie eine atmungsaktive Dichtungsmembran für jede 24-Well-Platte unter ultraviolettem Licht für 10 min (Materialtabelle).
- Entfernen Sie den Deckel von der 24-Well-Platte(n) und ersetzen Sie sie durch die atmungsaktive Membran.
- Inkubieren Sie die Platten bei 37 °C für die gewünschte Inkubationszeit (Infektion) ohne Zuschütteln. Überprüfen Sie, ob kein sichtbares Wachstum des geimpften Erregers auf den nicht infizierten Kontrollstücken vorliegt (Kontaminationskontrolle).
HINWEIS: Falls gewünscht, kann Ampicillin in Schritt 2.5 zu den SCFM-Agarose-Pads gegeben werden und SCFM in Schritt 2.30 bis zu einer Endkonzentration von 20 μg/ml abdecken. Dies wird das Wachstum der meisten endogenen Bakterien in der Lunge unterdrücken, ohne das Wachstum von P. aeruginosa oder S. aureus zu beeinträchtigen, aber da das Vorhandensein von Ampicillin die Anfälligkeit für andere Antibiotika beeinflussen kann, muss der Leser diese Wahl in Abhängigkeit von den Stämmen und Antibiotika treffen, die er testen möchte.
3. Bestimmung der Antibiotikawirksamkeit
HINWEIS: Ein Schema, in dem die Schritte dieses Assays detailliert beschrieben werden, finden Sie in Abbildung S1.
- Um die Antibiotikatoleranz von Biofilmen zu messen, die auf EVPL gebildet werden, müssen während der Dissektion und Infektion replizierte Sätze von Lungenstücken aus mindestens zwei unabhängigen Lungen eingerichtet werden. Für eine Negativkontrolle (keine Antibiotikabehandlung) ist ein Satz Stücke erforderlich, und für jede zu testende Antibiotikakonzentration ist ein Satz erforderlich.
- Nach 48 Stunden Inkubation die nicht infizierten Gewebestücke visuell inspizieren. Ein gewisses Wachstum von Bakterien, die endogen für die Schweinelunge sind, kann aufgetreten sein, was dazu führte, dass der SCFM um diese Abschnitte herum trüb war. Wenn ein für die ausgewählte Studienart typisches Wachstum beobachtet wird (z. B. blau-grüne Pigmentierungsdiagnostik von P. aeruginosa),beginnen Sie das Experiment mit frischen Lungen erneut.
- Wenn die nicht infizierten Gewebeabschnitte kein oder nur minimales Bakterienwachstum zeigen, bereiten Sie eine 24-Well-Waschplatte und eine 24-Well-Behandlungsplatte vor, die jeweils 500 μL frisches SCFM ohne Antibiotika oder mit dem interessierenden Antibiotikum pro Vertiefung pro Lungengewebestück enthalten.
- Entfernen Sie jedes infizierte Gewebestück mit einer flammensterilisierten Zündung von der Inkubationsplatte, wirbeln Sie kurz in einem frischen Brunnen der Waschplatte, um alle nicht mit Biofilm verbundenen Bakterienzellen zu entfernen, und übertragen Sie sie in die entsprechende Vertiefung der Behandlungsplatte.
- Versiegeln Sie die Behandlungsplatten mit frischer atmungsaktiver Membran.
- Inkubieren Sie die Behandlungsplatte(n) bei 37 °C ohne Schütteln für 18-24 h.
- Entfernen Sie mit einer flammensterilisierten Zette jedes Lungenstück von der 24-Well-Platte und legen Sie es in ein steriles 2-ml-Homogenisierungsröhrchen mit 1 ml phosphatgepufferter Kochsalzlösung (PBS) und 1 g Metallperlen (Materialtabelle).
- Perlenschlag für 40 Sekunden bei 4 m/s.
HINWEIS: Das Schlagen von Perlen mit den spezifischen Perlen und homogenisatoren, die in der Materialtabelle vorgeschlagen werden, verursacht keine signifikante Lyse von Bakterien, aber jedes Labor, das das Protokoll verwendet, sollte die Auswirkungen der von ihm gewählten Perlen und Homogenisatoren überprüfen, bevor es mit AST-Assays begann. - Verdünnen Sie das Lungenhomogenat seriell mit PBS und Platte auf Lysogeny Broth (LB) Agar, um die koloniebildenden Einheiten (CFU) in einzelnen unbehandelten und antibiotikabehandelten Gewebestücken nach Standardbeschichtungsmethoden zu bestimmen.
HINWEIS: Optional: Bereiten Sie doppelte Platten auf selektiven Medien vor, um kolonieidentitäten zu bestätigen. z.B. Verwendung von Mannitolsalz-Agar für S. aureus.
Ergebnisse
Das EVPL-Modell bietet eine Hochdurchsatz-Assay-Plattform, die es ermöglicht, eine große Anzahl von Bakterienisolaten gleichzeitig auf Antibiotikaanfälligkeit zu untersuchen (Abbildungen 1 und 2 ) oder Stämme in einemExperiment gegen eine Reihe von Antibiotikakonzentrationen zu screenen (Abbildung 3). Mit der Praxis haben wir festgestellt, dass etwa 200 bronchiolische Gewebeschnitte aus der Lunge in 2 Stunden hergestellt werden können. Das gesamte Experiment für AST kann innerhalb der normalen Arbeitszeiten abgeschlossen werden. Das Wachstum von Pseudomonas aeruginosa- und Staphylococcus aureus-Isolaten und die Etablierung eines 48-Stunden-Biofilms im Modell ist zuverlässig und erzeugt bei Überwachung durch lebensfähige Zellzahl konsistente Bakterienlasten (Abbildungen 1 und 2). Bilder von gewebekonsoziierten Biofilmen von Pseudomonas aeruginosa und Staphylococcus aureus, die in EVPL gezüchtet wurden, finden sich zusammen mit Protokollen zur Vorbereitung auf Die Lichtmikroskopie und histologische Färbung in unseren Publikationen21,23. Die Reproduzierbarkeit der CFU-Zählungen variiert jedoch für verschiedene Bakterienarten. Dies kann mit Standard-Wiederholbarkeitsberechnungen nach ANOVA25quantifiziert werden; Wir haben festgestellt, dass es typischerweise eine größere Variation zwischen CFU in replizierten Lungenproben für S. aureus als für P. aeruginosagibt. Wir empfehlen, dass bei der Übernahme des Modells durch ein Labor Wiederholungsberechnungen an Pilotexperimenten durchgeführt werden, um experimentelle Techniken zu optimieren und die Probengrößen zu bestimmen, die in endgültigen Experimenten verwendet werden sollen (ein Beispiel dafür findet sich im Datenzusatz für Sweeney et al26).
Wenn sie im EVPL gezüchtet werden, zeigen Biofilme von P. aeruginosa und S. aureus eine erhöhte Toleranz gegenüber Antibiotika im Vergleich zur Anfälligkeit in Standard-, industriezugelassenen Brühe MIC (Abbildung 1) und Disc-Assays mit Standardmedien (Abbildung 2). Die verschiedenen Wirkungen verschiedener Antibiotika auf EVPL etablierten Biofilm sind unterscheidbar, beispielsweise wird die P. aeruginosa-Abtötung in EVPL mit 4-16X MIC Ciprofloxacin erreicht, jedoch nicht mit 4-8X MIC Chloramphenicol(Abbildung 1). Eine zweimal tägliche Dosis von 600 mg Linezolid erreicht eine Serumkonzentration über dem MIC90 für anfällige Krankheitserreger (4 μg/ml)27 und gilt als ausreichende Exposition ohne nebenwirkungen28. Die in Abbildung 2 dargestellten Daten zeigen, dass S. aureus-Populationen, die im Disc-Assay anfällig für Linezolid sind, in der Lage sind, Zielserumkonzentrationen und höhere (12 μg/ml) in EVPL zu überleben. Es gibt keine eindeutige Korrelation zwischen MIC und antibiotischen Wirkungen auf EVPL-gezüchtete Biofilme für P. aeruginosa (Abbildung 1). Ein genaueres Maß für die In-vivo-Antibiotikatoleranz ist wichtig, da eine suboptimale Dosierung von Antibiotika das Risiko der Selektion für Resistenzen bei chronischen Infektionen erhöhen könnte.
Es ist bekannt, dass die Biofilm-Wachstumsart die bakterielle Anfälligkeit für Antibiotika signifikant reduzieren kann. Dies hat zur Entwicklung vieler In-vitro-Biofilm-Assays und zur Verwendung der minimalen Biofilm-Eradikationskonzentration (MBEC)14,15 anstelle von MIC als genaueren Prädiktor für die Anfälligkeit chronischer Infektionen geführt. Die Verwendung von SCFM (in verschiedenen Formulierungen) wurde auch für die Verwendung in MIC- oder MBEC-Tests empfohlen29. Hier zeigen wir, dass selbst ein optimierter In-vitro-Assay die Anfälligkeit von P. aeruginosa für Colistin im EVPL nicht genau vorhersagen kann. Die Menge an Antibiotika, die erforderlich ist, um eine 3 log10-Abtötung von EVPL-gezüchteten Bakterien zu erreichen, ist oft signifikant höher als die MIC oder die MBEC, die aus Standard-In-vitro-Assays berechnet wird, selbst wenn SCFM für diese Assays verwendet wird ( Abbildung3). Dies steht im Einklang mit einem Cochrane-Review, der berichtete, dass die aktuellen Implementierungen von In-vitro-Biofilm-Suszeptibilitätstests keine erhöhte Vorhersagekraft für die Verschreibung von Antibiotika bei CF im Vergleich zu Standard-Suszeptibilitätstests bieten16.
Es ist auch einfach, das Modell zu verwenden, um die Auswirkungen von Antibiotika auf Biofilmbakterien im Laufe der Zeit zu bewerten, da genügend Nachbildungen von Lungenstücken geimpft werden können, um eine zerstörerische Probenahme zu ermöglichen. Neben der Unterscheidung von Unterschieden zwischen antimikrobiellen Wirkstoffen kann das Modell Veränderungen der Anfälligkeit in verschiedenen bakteriellen Wachstumsstadien oder im Alter des Biofilms und für verschiedene Antibiotika-Dosierungsintervalle aufzeigen. Abbildung 4 zeigt die zunehmende Toleranz von P. aeruginosa-Biofilmen gegenüber Meropenem, wenn sie reifen. Dies könnte nützlich sein, um die Wirksamkeit neuartiger Wirkstoffe zu bestimmen, zum Beispiel, ob sie bei schneller Zellteilung wirksamer sind. Es kann auch eine wichtige Überlegung bei der Festlegung der Einschränkungen eines Experiments sein, da es notwendig sein kann, das Biofilmalter zu standardisieren und zu validieren, um zu vermeiden, dass das Alter einen Einfluss auf die Ergebnisse hat.
In Abbildung 5wurde das Überleben von S. aureus nach 4 h und 24 h nach Exposition gegenüber Flucloxacillin gemessen, und es war möglich, Unterschiede in der Reduktion der Bakterienzellzahl über die Zeit und zwischen den Isolaten zu beobachten. Dies kann für die Arzneimittelentwicklung nützlich sein, beispielsweise bei der Definition pharmakokinetischer und pharmakodynamischer Parameter oder bei der Aufklärung der Wirkungsweise eines neuartigen Wirkstoffs.
Variationen in der Bakterienlast nehmen oft mit längeren Kulturzeiten zu. Dies zeigt sich in der unbehandelten Kontrolle in Abbildung 5 nach 48-Stunden-Biofilmentwicklung und einer weiteren 24-Stunden-Exposition, um das Antibiotika-Dosierungsintervall zu berücksichtigen. Variation ist dem Modell intrinsisch; Jede Lungenprobe ist unabhängig von anderen und spiegelt die natürliche Variation der Lunge wider. Es ist daher wichtig sicherzustellen, dass eine ausreichende Anzahl von Replikaten enthalten ist, um eine Validierung und eine genaue Interpretation der Ergebnisse zu ermöglichen. Wir verweisen den Leser auf unsere Empfehlung, wiederholungsberechnungen an den Daten durchzuführen, um die Auswahl robuster Stichprobengrößen zu ermöglichen.
Der Einfachheit halber haben wir in jedem Experiment repräsentative Daten aus replizierten Gewebeschnitten vorgestellt, die aus einem einzigen Lungenpaar gewonnen wurden, aber in der Praxis ist es notwendig, Wiederholungsexperimente an Gewebeschnitten von replizierten Tieren durchzuführen. Dies sollte getan werden, um jede biologische Variation zwischen einzelnen Schweinen zu berücksichtigen, und wir verweisen den Leser auf unsere veröffentlichte Arbeit für Beispiele, wie konsistent die Ergebnisse zwischen Geweben von replizierten Schweinen sein können und wie diese Variation bei der statistischen Analyse von Daten mit Varianzanalyse (ANOVA) / allgemeinen linearen Modellen (GLM)21,26berücksichtigt wird.
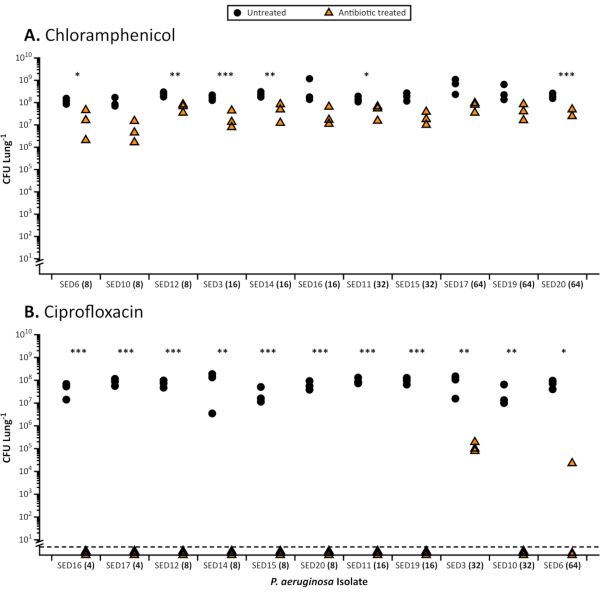
Abbildung 1. Gesamt-CFU von 11 klinischen CF Pseudomonas aeruginosa-Isolaten, die nach der Behandlung mit Antibiotika aus dem EVPL-Modell gewonnen wurden. Repräsentative Ergebnisse der antibiotischen Behandlung von P. aeruginosa im EVPL-Modell. Jeder Stamm wurde 48 h lang auf EVPL-Gewebe gezüchtet, dann für 18 h auf Antibiotika (Dreiecke) oder PBS als Kontrolle (Kreise) übertragen und die CFU / Lunge bestimmt. Das MIC für das geeignete Antibiotikum, das in standardkationenadjustiertem MHB bestimmt wird, ist in Klammern neben jedem Stamm (x-Achse) angegeben. Die Dehnungen werden durch steigende MIC-Werte geordnet. Die Daten wurden gegebenenfalls mit t-Tests und Mann-Whitney U-Tests für nicht-parametrische Datensätze analysiert. Signifikante Unterschiede zwischen antibiotikabehandeltem und unbehandeltem Gewebe werden durch Sternchen gekennzeichnet (P < 0,05). A. (A). Gewonnene lebensfähige Zählungen aus P. aeruginosa-Biofilmen, die im EVPL-Modell gezüchtet und mit 64 μg/ml Chloramphenicol behandelt wurden (höchster MIC-Wert aufgezeichnet). Für jedes Isolat wurde die standardisierte mittlere Differenz der CFU zwischen chloramphenicol-behandelten und unbehandelten Gewebeabschnitten mit Cohens d berechnet. Es gab keine Korrelation zwischen dem MIC-Wert im Standardtest und der Abnahme der lebensfähigen Zellzahlen im EVPL-Modell, gemessen mit Cohens d (Spearmans Rangkorrelation, rs = 0,45, p = 0,16) B. Ergebnisse von P. aeruginosa-Biofilmen, die im EVPL-Modell gezüchtet und mit 64 μg/ml Ciprofloxacin behandelt wurden (höchster mic-Wert aufgezeichnet). Werte unterhalb der gestrichelten Linie lagen unterhalb der Nachweisgrenze. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
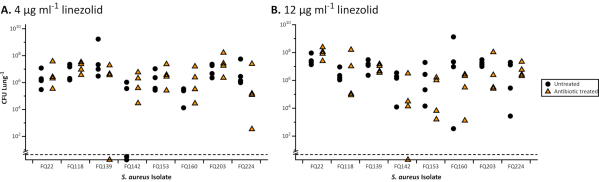
Abbildung 2. Gesamt-CFU von 8 klinischen Staphylococcus aureus CF-Isolaten, die nach der Behandlung mit Linezolid aus dem EVPL-Modell gewonnen wurden. Jeder Stamm wurde 48 h lang auf EVPL-Gewebe gezüchtet und dann für 24 h auf Linezolid (Dreiecke) übertragen oder als Kontrolle (Kreise) unbehandelt. Alle Stämme erwiesen sich mit dem Standard-Scheibendiffusionstest gemäß euCAST-Richtlinien30 (Hemmzone > 21 mm) als empfindlich gegenüber Linezolid. Die Daten wurden gegebenenfalls mit t-Tests und Mann-Whitney-U-Tests für nicht-parametrische Datensätze analysiert(P < 0,05). Für keinen der Stämme wurden signifikante Unterschiede zwischen behandelten und unbehandelten Antibiotika gefunden. Werte unterhalb der gestrichelten Linie lagen unterhalb der Nachweisgrenze. A. (A). Ergebnisse von S. aureus-Biofilmen im EVPL-Modell, die mit 4 μg/ml Linezolid behandelt wurden (klinischer Haltepunkt für empfindlich/resistent nach EUCAST-Klassifizierung31). B. Ergebnisse von S. aureus-Biofilmen im EVPL-Modell, die mit 12 μg/ml Linezolid behandelt wurden (Daten von Sweeney et al23). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
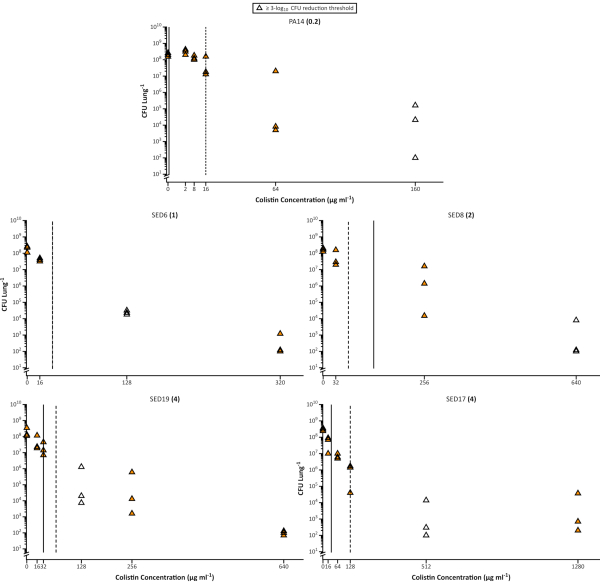
Abbildung 3. Lebensfähige Pseudomonas aeruginosa-Zellzahlen der klinischen Laborstämme PA14 und 4 CF,s, die nach der Behandlung mit steigenden Konzentrationen von Colistin aus dem EVPL-Modell gewonnen wurden. Jeder Stamm wurde 48 h lang auf EVPL-Gewebe gezüchtet und dann 18 h Colistin ausgesetzt. Das im standardkationenadjustierten MHB-Medium ermittelte MIC wird in Klammern neben jedem Dehnungsnamen angezeigt. Die vertikalen Linien zeigen den MBEC-Wert, der in MHB (durchgehend) und SCFM (gestrichelt) bestimmt wurde, mit Ausnahme von SED6, bei dem der Wert in beiden Medien gleich war. Die ungefüllten Datenpunkte stellen die niedrigste Konzentration von Colistin dar, die zu ≥ 3-log10-Reduktion der CFU/Lunge im Vergleich zu den unbehandelten Proben (0 μg/ml Colistin) führte (Daten reproduziert von Sweeney et al26). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
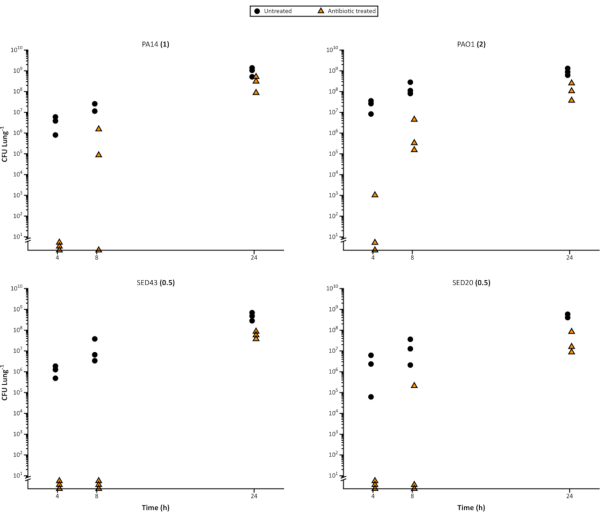
Abbildung 4. Repräsentativ lebensfähige Pseudomonas aeruginosa-Zellzahlen aus einem Zeitverlauf des Wachstums auf dem EVPL-Modell über 24 h und anschließender Behandlung mit 64 μg/ml Meropenem. Der Laborstamm P. aeruginosa PA14 und 3 CF klinische Isolate wurden auf EVPL-Gewebe für die auf der x-Achse gezeigte Zeit gezüchtet, dann für 24 h auf Meropenem (Dreiecke) übertragen oder unbehandelt als Kontrolle (Kreise) gelassen. Anschließend wurde die CFU/Lunge bestimmt. Das in kationenbereinigten MHB-Medium ermittelte MIC wird in Klammern neben jedem Dehnungsnamen angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
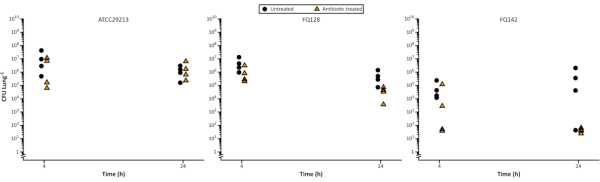
Abbildung 5. Repräsentativ lebensfähige Staphylococcus aureus-Zellzahlen nach dem Wachstum im EVPL-Modell, das dann über einen Zeitraum von 24 Stunden mit 5 μg/ml Flucloxacillin behandelt wurde. Der Kontrollstamm ATCC29213 und zwei klinische CF-Isolate wurden 48 h lang auf EVPL-Gewebe gezüchtet und dann auf Flucloxacillin (Dreiecke) übertragen oder 4 h und 24 h lang als Kontrolle (Kreise) unbehandelt gelassen, bevor CFU/Lunge bestimmt wurde (Daten reproduziert von Sweeney et al23). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung S1. Bitte klicken Sie hier, um diese Figur herunterzuladen.
Tabelle S1. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das Ex-vivo-Lungenmodell ist hochdurchsatzreich und kostengünstig und stellt aufgrund der Verwendung von Post-Consumer-Abfällen aus der Fleischindustrie keine ethischen Bedenken dar. Es wurde entwickelt, um chronisch infizierte menschliche CF-Atemwege besser nachzuahmen als derzeit verfügbare In-vitro-AST-Plattformen. Die hier vorgestellten Ergebnisse zeigen, dass es unter diesen Umständen die Antibiotikaanfälligkeit genauer vorhersagen kann.
Zu den kritischen Schritten im Protokoll, die zuverlässige und reproduzierbare Ergebnisse gewährleisten, gehören die folgenden:
- Verwenden Sie konsistente Zeit- und Lagermethoden zwischen Schlachtung, Entnahme und Verarbeitung von Lungenproben. Es ist wichtig, die Lunge so schnell wie möglich nach der Schlachtung zu verwenden und das Kontaminationspotenzial auf ein Minimum zu beschränken. Es wurden Unterschiede in der Fähigkeit experimenteller Kulturen beobachtet, in der Lunge zu wachsen, wenn sie nicht so frisch wie möglich sind.
- Die Aufrechterhaltung der Sterilität bei der Herstellung von SCFM und die Dissektion von Lungenstücken ist unerlässlich. Gesunde Lungen sind nicht steril und so kann das Vorhandensein von kommensalen Bakterien eine "natürliche" Umgebung für chronische Infektionen widerspiegeln. Wie bereits erwähnt, können bakterielle Interaktionen innerhalb von Mehrartenpopulationen die Ergebnisse und die Anfälligkeit für Antibiotika verändern, so dass eine Kontamination vermieden und die Lunge vor der Verwendung sterilisiert werden sollte. Wir befürworten die Verwendung der UV-Sterilisation, da sie keine Veränderungen der Integrität des Zinngewebes und gegebenenfalls zusätzliche Antibiotika-Wäschen zu verursachen scheint. Antibiotika sollten jedoch mit Vorsicht angewendet werden, da sie die Ergebnisse durch selektiven Druck beeinflussen und die Genexpression in Testbakterienpopulationen verändern können.
- Verwenden Sie pseudoinfizierte, negativ kontrollierte Gewebeproben und Zellzählplatten, die auf einem nicht selektiven, reichhaltigen Medium gezüchtet wurden, um das Wachstum von Verunreinigungen oder kommensalen Bakterien hervorzuheben, die während der Sterilisation nicht entfernt wurden. Dies ist wichtig, um die Auswirkungen dieser Bakterien auf AST zu mildern. Es ist auch hilfreich, doppelte, selektive Agar-Zellzahlplatten zu produzieren, die für den interessierenden Organismus spezifisch sind, da doppelte Platten die Identifizierung von Kolonien und die Zellaufzählung beschleunigen.
- Führen Sie Pilotexperimente durch, wenn Sie das Modell zum ersten Mal verwenden und es mit neuen Stämmen oder Genotypen von Bakterien verwenden, um Biofilm-CFU-Variationen zwischen Gewebeabschnitten zu bewerten, so dass die Auswahl optimaler experimenteller Probengrößen (z. B. wie viele replizierte Gewebeabschnitte aus wie vielen replizierten Lungen erworben werden sollen) durch die Verwendung von Leistungsberechnungen ermöglicht wird.
- Der Assay verwendet ein nicht standardisiertes Inokum, da dies eine schnelle Impfung nach 48 Stunden Inkubation und die Bildung relativ konsistenter Biofilmbelastungen (insbesondere für P. aeruginosa)ermöglicht. Um die antibakterielle Wirksamkeit in frühen Biofilmwachstumsstadien zu testen, sollten Sie die Impfung mit einer standardisierten CFU von koloniegewachsenen Bakterien in ASM in Betracht ziehen. Wir empfehlen von einer Impfung mit planktonischen Bakterien ab: Frühe Pilotversuche zeigten, dass dies zu akutem, invasivem Wachstum und nicht zu einer zuverlässigen Biofilmbildung führt.
Dieses Protokoll erzeugt ein robustes Prototypmodell für die Verwendung mit P. aeruginosa, mit einem großen Entwicklungspotenzial für die Verwendung mit S. aureus, aber es hat einige Einschränkungen, die für bestimmte Anwendungen in der Zukunft behoben werden müssen. Gewebe wurde aus einzelnen Kolonien geimpft, um die Entwicklung klonaler Populationen zu ermöglichen. Die Ergebnisse zeigen, dass dies bei P. aeruginosawenig Einfluss auf die Zellzahlen nach 48 h hat. Bei S. aureus wurde jedoch eine größere Variabilität der Bakterienbelastung beobachtet, und da verschiedene Bakterien innerhalb des Modells unterschiedlich wachsen können, kann ein standardisiertes Startinokum und eine rigorose Produktion von Gewebeproben gleicher Größe und Gewicht vom Untersuchten Organismus abhängen. Es kann auch Unterschiede zwischen Laboren aufgrund von Unterschieden in präzisen Sezierungs- / Infektionstechniken oder lokaler Schweinerasse / Landrasse geben. Um die Reproduzierbarkeit von Bakterienpopulationen für einzelne Implementierungen des Modells zu bewerten, empfehlen wir die Verwendung von Wiederholbarkeitsberechnungen als Teil der statistischen Analyse der Ergebnisse25 und die Verwendung von Wiederholbarkeits- / Leistungsberechnungen auf der Grundlage von Pilotexperimenten, um die optimale Stichprobengröße für ihre Verwendung in endgültigen Experimenten zu berechnen.
Einer der Hauptvorteile von EVPL gegenüber herkömmlichen Plattenassays besteht darin, dass es nicht auf Plankton oder auf abiotischen Oberflächen wachsende Bakterien testet, sondern die räumliche Strukturierung bakterieller Biofilme innerhalb einer Wirtsumgebung und mit Zelldifferenzierung ermöglicht. Dies hat wichtige Implikationen für die Berücksichtigung der Auswirkungen von physiochemischen und Nährstoffgradienten auf die Aktivität antimikrobieller Wirkstoffe sowie die Bereitstellung und Verfügbarkeit aktiver Therapien in verschiedenen Mikroumgebungen innerhalb einer chronischen Infektion und Zell-Zell-Interaktion zwischen Bakterien. Letzteres ist besonders wichtig, da Multispezies-Infektionen routinemäßig bei Cf beobachtet werden und für Infektionen im Zusammenhang mit anderen Atemwegserkrankungen wie Asthma und chronisch obstruktiver Lungenerkrankung immer wichtiger werden. Es besteht Potenzial, dieses Modell für die AST zur individualisierten Patienten-Sputum-Probenahme in der klinischen Diagnostik zu entwickeln. Eine analoge Studie ist bereits im Gange, bei der ein wundahmendes In-vitro-Modell für Wachstum und AST von debrided Biofilm aus chronischen Wunden verwendet wird (Southwest Regional Wound Care Center in Lubbock, Texas, Dr. R. Wolcott).
Darüber hinaus verwendet das Modell postmortales Gewebe, so dass der Einfluss der Immunantwort des Wirts auf die Antibiotikaanfälligkeit begrenzt ist. Aktuelle In-vitro-Modelle berücksichtigen auch keine Wirtsimmunantworten, so dass wir dies nicht als Hindernis für die zukünftige Verwendung des Modells in AST-Anwendungen sehen. Die Immunantwort wird jedoch berücksichtigt, wenn pharmakokinetische und pharmakodynamische Parameter und Antibiotika-Dosierungsrichtlinien bestimmt werden. Obwohl unsere Studien Hinweise auf verbleibende Immunzellen und Reaktionen im Gewebe23 (und S. Azimi, persönliche Kommunikation) gezeigt haben, ist dies ein hauptbereich für die weitere Optimierung und Entwicklung des Modells, wenn eine größere Übereinstimmung mit in vivo-Bedingungen gewünscht wird.
Die Bereitstellung einer klinisch gültigeren AST für CF wird dazu beitragen, eine wichtige Empfehlung des UK Health, Social Care Act 2008 zu erfüllen, dass "Verfahren vorhanden sein sollten, um eine umsichtige Verschreibung und antimikrobielle Verwaltung zu gewährleisten". Wir glauben, dass die EVPL ein ideales Kandidatenmodell ist, um diesen Bedarf zu decken.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken allen unseren Co-Autoren für die Originalarbeiten, aus denen wir beispielhafte Ergebnisse gezogen haben. Die Arbeit wurde durch einen MRC New Investigator Research Grant (Förderkennzeichen MR/R001898/1)an fh finanziert; durch Doktorandenstellen der BBSRC Midlands Integrative Biosciences Training Partnership (MIBTP), die an NEH und IA vergeben werden; und durch die Auszeichnung des Undergraduate Research Support Scheme der University of Warwick an FA zur Durchführung eines Sommerferienforschungsprojekts. Wir danken Steve Quigley, Sons (Cubbington, Warwickshire) und John Taylor, Son (Earlsden, Coventry) für die Versorgung mit Lungen. Wir möchten auch die Hilfe der Media Preparation Facility an der School of Life Sciences der University of Warwick danken, mit besonderem Dank an Cerith Harries und Caroline Stewart und die Hilfe von Anita Catherwood von der Warwick Antimicrobial Screening Facility.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mL insulin syringes with 29G needle attached | |||
| 24-well culture plates | |||
| 70% ethanol or similar for surface sterilizaton and flamin gof dissection equipment | |||
| Agar plates to prepare streaks of P. aeruginosa/S. aureus (any suitable medium) | |||
| Agarose | |||
| Aluminum foil - pre-sterilised by autoclaving - to cover the chopping board on whcih you wil dissect lungs. | |||
| Bead beater designed to take 2 mL tubes | MP Biomedicals | 116004500 | FastPrep-24 Classic bead beating grinder and lysis system |
| Breathe-easy or Breathe-easier sealing membrane for multiwell plates | Diversified Biotech | BEM-1 or BERM-2000 | |
| Bunsen burner | |||
| Chopping board - we recommend a plastic board to allow for easy decontamination with alcohol. | |||
| Coolbox to transport lungs to lab | |||
| Dissection scissors in different sizes | |||
| Dulbecco’s modified Eagle medium (DMEM) | |||
| Fisherbrand 2 mL reinforced tubes | Thermo Fisher | 15545809 | |
| Fisherbrand 2.38 mm metal beads | Thermo Fisher | 15505809 | |
| Germicidal UV cabinet | |||
| Insulin syringes - 0.5 mL with 29G needle attached. | VWR | BDAM324892 | |
| Large pallet knife | |||
| LB agar plates to assess CFU in lung biofilm homogenate | |||
| Mounted razor blades | |||
| Nalgene RapidFlow PES 75 mm x 0.1 µm x 500 ml sterile filter unit | Thermo Fisher | 10474415 | For filter-sterilizing SCFM |
| Petri dishes | |||
| Phosphate-buffered saline | |||
| Plastic chopping board and aluminium foil to create a sterile and cleanable dissection surface | |||
| Roswell Park Memorial Institute (RPMI) 1640 medium | |||
| SCFM ingredients as listed in Table S1 | |||
| Selection of forceps (blunt tips recommended) | |||
| Selective agar plates to specifically assess P. aeruginosa / S. aureus CFU in lung biofilm homogenate, if required. | |||
| Suitable containers for disposing of contaminated sharps and pig ung tissue, according to your institution's health & safety policies. |
Referenzen
- Elborn, J. S. Cystic fibrosis. The Lancet. 388 (10059), 2519-2531 (2016).
- Høiby, N., et al. Diagnosis of biofilm infections in cystic fibrosis patients. APMIS. 125, 339-343 (2017).
- Bjarnsholt, T., et al. Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatric Pulmonology. 44 (6), 547-558 (2009).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents. 35 (4), 322-332 (2010).
- Penesyan, A., Gillings, M., Paulsen, I. Antibiotic discovery: Combatting bacterial resistance in cells and in biofilm communities. Molecules. 20 (4), 5286 (2015).
- Son, M. S., Matthews, W. J., Kang, Y., Nguyen, D. T., Hoang, T. T. In vivo evidence of Pseudomonas aeruginosa nutrient Acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity. 75 (11), 5313-5324 (2007).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846 (2016).
- Stites, S. W., Plautz, M. W., Bailey, K., O'Brien-Ladner, A. R., Wesselius, L. J. Increased concentrations of iron and isoferritins in the lower respiratory tract of patients with stable cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 160 (3), 796-801 (1999).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proceedings of the National Academy of Sciences. 115 (22), 5125-5134 (2018).
- Drevinek, P., et al. Gene expression changes linked to antimicrobial resistance, oxidative stress, iron depletion and retained motility are observed when Burkholderia cenocepacia grows in cystic fibrosis sputum. BMC Infectious Diseases. 8, 121 (2008).
- Goerke, C., Wolz, C. Regulatory and genomic plasticity of Staphylococcus aureus during persistent colonization and infection. International Journal of Medical Microbiology. 294 (2-3), 195-202 (2004).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Roberts, A. E. L., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. Journal of Molecular Biology. 427, 3646-3661 (2015).
- Ceri, H., et al. The Calgary biofilm device: New technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. Journal of Clinical Microbiology. 37 (6), 1771-1776 (1999).
- Moskowitz, S. M., Foster, J. M., Emerson, J., Burns, J. L. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. Journal of Clinical Microbiology. 42 (5), 1915-1922 (2004).
- Smith, S., Waters, V., Jahnke, N., Ratjen, F. Standard versus biofilm antimicrobial susceptibility testing to guide antibiotic therapy in cystic fibrosis. Cochrane Database of Systematic Reviews. (6), (2020).
- Trust, C. F. . Annual Data Report 2019. , (2019).
- Angelis, A., et al. Social and economic costs and health-related quality of life in non-institutionalised patients with cystic fibrosis in the United Kingdom. BMC Health Services Research. 15 (1), 428 (2015).
- Eidt-Koch, D., Wagner, T. O. F., Mittendorf, T., von der Schulenburg, J. M. G. Outpatient medication costs of patients with cystic fibrosis in Germany. Applied Health Economics and Health Policy. 8 (2), 111-118 (2010).
- Harrington, N. E., Sweeney, E., Harrison, F. Building a better biofilm - Formation of in vivo-like biofilm structures by Pseudomonas aeruginosa in a porcine model of cystic fibrosis lung infection. Biofilm. 2, 100024 (2020).
- Harrison, F., Diggle, S. An ex vivo lung model to study bronchioles infected with Pseudomonas aeruginosa biofilms. Microbiology. 162, 1755-1760 (2016).
- Sweeney, E., et al. An ex vivo cystic fibrosis model recapitulates key clinical aspects of chronic Staphylococcus aureus infection. Microbiology. , (2020).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85 (4), 935-956 (2010).
- Sweeney, E., Sabnis, A., Edwards, A. M., Harrison, F. Effect of host-mimicking medium and biofilm growth on the ability of colistin to kill Pseudomonas aeruginosa. Microbiology. 166 (12), 1171-1180 (2020).
- Stalker, D. J., Jungbluth, G. L., Hopkins, N. K., Batts, D. H. Pharmacokinetics and tolerance of single- and multiple-dose oral or intravenous linezolid, an oxazolidinone antibiotic, in healthy volunteers. Journal of Antimicrobial Chemotherapy. 51 (5), 1239-1246 (2003).
- Ager, S., Gould, K. Clinical update on linezolid in the treatment of Gram-positive bacterial infections. Infection and Drug Resistance. 5, 87-102 (2012).
- Kirchner, S., et al. Use of Artificial Sputum Medium to Test Antibiotic Efficacy Against Pseudomonas aeruginosa in Conditions More Relevant to the Cystic Fibrosis Lung. Journal of Visualized Experiments: JoVE. (64), e3857 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten