Method Article
Тестирование эффективности антибиотиков в модели Ex vivo биопленок Pseudomonas aeruginosa и Staphylococcus aureus в легком муковисцидозе
В этой статье
Резюме
Этот рабочий процесс может быть использован для проведения тестирования чувствительности к антибиотикам с использованием установленной модели ex vivo бактериальной биопленки в легких людей с муковисцидозом. Использование этой модели может повысить клиническую обоснованность анализов MBEC (минимальная концентрация эрадикации биопленки).
Аннотация
Эффективное назначение антибиотиков для бактериальных биопленок, присутствующих в легких людей с муковисцидозом (МВ), ограничено плохой корреляцией между результатами тестирования чувствительности к антибиотикам (АСТ) с использованием стандартных методов диагностики (например, микроразбавливание бульона, диффузия диска или Etest) и клиническими результатами после лечения антибиотиками. Попытки улучшить АСТ с помощью готовых платформ для роста биопленки показывают незначительное улучшение результатов. Ограниченная способность систем биопленки in vitro имитировать физико-химическую среду легкого МУКовисцидоза и, следовательно, бактериальную физиологию и архитектуру биопленки, также действует как тормоз для открытия новых методов лечения инфекции муковисцидоза. Здесь мы представляем протокол для выполнения АСТ патогенов муковисцидоза, выращенных как зрелые, in vivo-подобные биопленки в модели легкого ex vivo CF, состоящей из бронхиолярной ткани свиньи и синтетической мокроты CF (ex vivo pig lung, EVPL).
Существует несколько анализов in vitro для тестирования чувствительности биопленки с использованием либо стандартной лабораторной среды, либо различных составов синтетической мокроты CF в микротитрных пластинах. Как среда роста, так и субстрат биопленки (полистирольная пластина против бронхиолярной ткани), вероятно, влияют на устойчивость биопленки к антибиотикам. Показана повышенная переносимость клинических изолятов Pseudomonas aeruginosa и Staphylococcus aureus в модели ex vivo; эффекты лечения биопленками антибиотиками не коррелируют с минимальной ингибирующей концентрацией (МИК) в стандартных анализах микроразбавливания или чувствительной/резистентной классификацией в дисковых диффузионных анализах.
Платформа ex vivo может быть использована для индивидуального АСТ биопленки образцов пациентов и в качестве расширенной платформы для тестирования потенциальных антибиопленковых агентов во время фармацевтических исследований и разработок. Улучшение рецептуры или ускорения открытия антибиопленковых препаратов за счет использования большего количества платформ тестирования in vivo может значительно улучшить результаты в отношении здоровья людей с муковисцидозом, а также снизить затраты на клиническое лечение и исследования открытий.
Введение
Хронические инфекции биопленки поражают людей, чья нормальная иммунная защита скомпрометирована. Группы риска включают лиц с генетическим состоянием муковисцидоза(МВ) 1. Колонизация аномально густой, адгезивной слизи в дыхательных путях в раннем младенчестве приводит к трудноизлечимым инфекциям биопленки бронхиол2,3. Рост бактерий в виде обширных инкапсулированных матрицей биопленок является одним из факторов, который отличает хронические инфекции людей с ослабленным иммунитетом от острых инфекций здоровых хозяев, а состояние биопленки защищает бактерии от воздействия антибиотиков (из-за снижения диффузии через матрицу) и снижает их восприимчивость к антибиотикам (например, путем индукции покоя или регуляции эффлюксных насосов)4,5. Однако специфические для заболевания изменения в физиологии и химии тканей хозяина еще больше изменяют физиологию бактерий по той, которая наблюдается при острых инфекциях или в стандартных лабораторных условиях роста. Ключевые примеры при муковисцидозе включают использование необычных источников углерода, таких как жирные кислоты и аминокислоты, высвобождаемые из поверхностно-активного вещества легких и продуцируемые микробной деградацией муцина, высвобождение микроэлементов, таких как железо, из поврежденных тканей и микроэробиоз6,7,8.
Поэтому специфические физико-химические условия в конкретном контексте биопленочной инфекции могут влиять на реакцию на антибиотики. Во-первых, структура и глубина внеклеточного матрикса зависит от местных условий окружающей среды, таких как питательные вещества или силы сдвига. Во-вторых, экологические сигналы могут вызывать экспрессию специфических генов устойчивости к антибиотикам. Например, патоген МУКовисцидоза Pseudomonas aeruginosa показывает повышенную экспрессию бета-лактамазы и сниженную экспрессию поринов в мокроте муковисцидоза по сравнению с in vitro9,в то время как другой патоген муковисцидоза, Burkholderia cenocepacia,повышает регуляцию бета-лактамаз и эфлюксных насосов при выращивании в мокроте CF10. В-третьих, условия в хозяине могут сигнализировать о физиологическом или генетическом переходе к антибиотикоустойчивым фенотипам, которые трудно резюмировать in vitro. К ним относятся малые колониальные варианты возбудителя муковисцида Staphylococcus aureus11,12.
Все эти данные указывают на то, что когда диагностические лаборатории изолируют отдельные клоны из патогенной биопленки и выполняют АСТ на планктонных или агаровых культурах, выращенных в стандартных лабораторных средах (микроразбавление бульона, диффузия диска или Etest), результаты часто не предсказывают, какие антибиотики действительно будут работать in vivo. Даже если используются анализы биопленки in vitro, они могут не сигнализировать о фенотипе биопленки in vivo из-за различий в используемой среде и поверхности прикрепления, поэтому анализы с использованием проточных клеток или высокопроизводительных платформ микропластин могут переоценить чувствительность к антибиотикам13. Та же проблема относится к исследователям в академических кругах и промышленности, стремящимся разработать новые антибиопленочные агенты: тестирование лекарственного потенциала с использованием платформ in vitro, таких как проточные клетки, микротитрные пластины или биопленочные реакторы Центра по контролю за заболеваниями, может установить слишком низкую планку эффективности биопленки и производить ложные срабатывания в процессе исследований, разработок.
Плохая корреляция между результатами АСТ и клиническим исходом после лечения антибиотиками при муковисцидозе хорошо известна. Многие клиницисты просто игнорируют диагностический лабораторный АСТ, поскольку нет единых, специфичных для муковисцидоза рекомендаций по интерпретации этих результатов, и вместо этого принимают решения о назначении в каждом конкретном случае. Были предприняты попытки улучшить CF AST с помощью устройства биопленки Калгари, которое использует биопленки, выращенные на поверхности пластиковых колышков, установленных в колодцах микропластины, содержащей стандартную среду AST (например, катион-скорректированный бульон Мюллера-Хинтона)14,15. Этот анализ не лучше предсказывает, какие антибиотики будут работать in vivo, чем стандартный планктонныйAST 16. Влияние на пациентов с муковисцидозом является резким. Несмотря на повторное введение антибиотиков (регулярное ингаляционное введение антибиотиков и в среднем 27 дней в год внутривенного введения антибиотиков для лиц с муковисцидозом в Соединенном Королевстве)17,частые и непредсказуемые эпизоды острого легочного обострения приводят к прогрессирующему повреждению легких и, примерно в 90% случаев, смерти от дыхательной недостаточности. В недавнем анализе бактериальная инфекция легких была самым сильным предиктором затрат на лекарства при муковисцидозе, добавив в среднем 3,6 тысячи евро / пациента / год к прямым расходам на здравоохранение18,19.
Для острых инфекций здоровых людей текущие исследования и политика, ориентированные на быстрый АСТ, основанные, например, на геномном прогнозировании в месте оказания медицинской помощи, идеально подходят20. Но в случае хронических инфекций муковисцидоза ясно, что необходим другой подход: реализация АСТ в моделях, имитирующих хозяина, которые лучше повторяют среду in vivo и метаболическое состояние патогена и позволяют формировать реалистичную структуру биопленки.
Ранее мы разработали модель биопленки CF, которая включает в себя участки бронхиол свиней, инкубированных в синтетической мокроте CF и инфицированных P. aeruginosa или S. aureus. Неинфицированный EVPL сохраняет нормальную гистопатологию в течение 7 дней, но лабораторные или клинические изоляты P. aeruginosa и S. aureus воспроизводимо образуются in vivo-подобные агрегаты вокруг ткани, имитируя этиологию инфекции CF21,22,23. Мы представляем протокол для использования этой высокой валидности, высокопроизводительной модели в качестве специализированной платформы биопленки AST для МВ и представляем примерные результаты, показывающие высокую толерантность патогенных биопленок к клинически используемым антибиотикам при выращивании в модели. Модель может быть легко включена в исследования, разработки для управления или предотвращения образования биопленки и, возможно, в диагностический АСТ. Большинство используемого оборудования (см. Таблицу материалов) можно легко найти в типичной микробиологической лаборатории, хотя бисер необходим, и мы обнаружили из работы с сотрудниками, что подходящий ультрафиолетовый гермицидный шкаф также может потребоваться приобрести. Поскольку легкие получают от коммерческих мясников или скотоскотобойн, модель не представляет никаких этических проблем.
протокол
Этот протокол использует легкие свиней, полученные из коммерческой скотобойни, которая поставляет мясо для потребления человеком. Согласно законодательству Великобритании, использование остатков ткани животных, забитых для мяса, не требует этического одобрения; мы советуем читателям ознакомиться с соответствующими местными законами и институциональными руководящими принципами перед началом работы.
1. Получение синтетических сред cf sputum (SCFM)
- Чтобы сделать SCFM для использования с тканью EVPL, следуйте рецепту, изложенному Palmer et al.24 с модификацией, что глюкоза удаляется из рецепта.
ПРИМЕЧАНИЕ: Рецепт Palmer et al. содержит свободные аминокислоты, катионы, ангионы и лактат в концентрациях, репрезентативных для средних концентраций, обнаруженных в выборке образцов мокроты у пациентов с муковисцидозом. Было показано, что он сигнализирует о сопоставимых путях использования углерода и экспрессии сигналов восприятия кворума P. aeruginosa PA14 к росту в среде, изготовленной из лиофилизированной мокроты пациента24. Рецепт 1 л модифицированного SCFM приведен в таблице S1. - Фильтр стерилизуют SCFM сразу после приготовления и хранят при 4 °C до 1 месяца.
2. Рассечение и инфицирование ткани ex vivo легкого свиньи (EVPL)
- Перед рассечением подготовьте агаровую пластину (пластины) необходимого бактериального штамма (ов) для инфекции, используя любой агар, стандартный в лаборатории для P. aeruginosa/S. aureus (например, лизогенезный бульон + 1,2% агара).
- Рассчитайте, сколько кусочков бронхиолярной ткани свиней требуется для эксперимента, включая неинфицированные кусочки контрольной ткани. Умножьте это число на два, чтобы повторить эксперимент в двух реплицированных легких, чтобы подтвердить повторяемость результатов.
- Умножьте общее количество кусочков ткани, необходимое для 0,5, чтобы определить объем агарозы SCFM (мл), необходимый для изготовления прокладок агарозы, чтобы сделать достаточное количество среды для 400 мкл / кусок ткани плюс запасной агар SCFM для учета любых ошибок пипетирования или испарения во время приготовления.
- Добавьте 0,12 г агарозы к каждым 15 мл SCFM, необходимым для получения желаемого общего объема SCFM с 0,8% веса /объема агарозы.
- Нагревайте раствор агарозы SCFM до полного растворения агарозы. Рекомендуется использовать бытовую микроволновую печь на низком энергопотреблении. Требуемое время зависит от мощности микроволновой печи. Дайте агарозе остыть примерно до 50 °C (тепло на ощупь, но удобно держать). Не дайте остыть дальше.
- Используя пипетку, добавьте 400 мкл агарозы SCFM в одну скважину из 24-скважинной пластины на необходимый кусок ткани.
- Стерилизуйте агарозсодержащую SCFM 24-скважинную пластину(с) под ультрафиолетовым светом в течение 10 мин.
- Подготовьте три повторных промывания для каждого неповрежденного легкого, рассеченного с использованием 20 мл стерильной модифицированной среды Дульбекко Eagle (DMEM) плюс 20 мл стерильного Roswell Park Memorial Institute (RPMI) 1640 с добавлением 50 мкг / мл ампициллина.
- Сделайте аликвоту из 40 мл SCFM в качестве окончательной промывки для каждого неповрежденного легкого, которое рассекается. Все стирки можно хранить в течение ночи при 4 °C или использовать немедленно.
- Добывайте легкие из назначенного источника как можно скорее после убоя, гарантируя, что они остаются холодными, транспортируя в лабораторию в домашней охлаждающей коробке.
ПРИМЕЧАНИЕ: Легкие ближе к дню убоя показывают меньше синяков от хранения, но ткань, хранятся в холодном хранилище до 4 дней после убоя, также может быть использована. Поскольку холодилка должна быть взята в мясную лавку или скотобойню, она должна быть обеззаражена в соответствии с местными лабораторными рекомендациями после каждого использования и храниться за пределами микробиологической лаборатории, когда она не используется, чтобы снизить риск загрязнения и нарушения защиты. - Работая на стерилизованной поверхности и под пламенем, поместите легкие на чистую пластиковую разделочную доску, покрытую автоклавной алюминиевой фольгой. Убедитесь, что бронхиолы остаются нетронутыми. Если на скотобойни или во время транспортировки были какие-либо повреждения, легкие не пригодны для использования.
- Нагрейте нож под пламенем и очень коротко прикоснитесь ножом к области легкого, окружающей бронхиол, чтобы стерилизовать поверхность ткани.
- Отрежьте поверхностную ткань, окружающую бронхиолы, с помощью стерильного лезвия бритвы. Сделайте разрезы параллельно бронхиоле, чтобы предотвратить любые повреждения.
- После того, как бронхиола была обнажена, сделайте поперечный разрез через бронхиолу в самой высокой точке, видимой для освобождения бронхиолы.
- Используя стерильные щипцы, слегка удерживайте свободный конец бронхиолы и отрежьте любую оставшуюся нежелательную ткань с помощью стерильного лезвия бритвы. Сделайте окончательный поперечный разрез через бронхиолу, прежде чем будет видно какое-либо ветвление, чтобы удалить бронхиолу из легких.
- Поместите бронхиолу в первую промывку DMEM/RPMI 1640. Оставьте бронхиолу в промывке и повторите шаги 2.11-2.14, чтобы собрать дополнительные участки бронхиол из того же легкого, которые необходимы для получения достаточного количества участков ткани для запланированного эксперимента.
- Поместите любые дополнительные бронхиолярные участки из того же легкого в промывку (шаг 2.16). Оставить в стирке не менее чем на 2 мин.
- Извлеките бронхиолы из первой промывки DMEM/RPMI 1640 и поместите образцы в стерильную чашку Петри.
- Держите каждую бронхиолу слегка, используя стерильные щипцы, следя за тем, чтобы не повредить ткань. Удалите как можно больше оставшихся мягких тканей и разрежьте ткань на полоски шириной ~ 5 мм с помощью стерильных ножниц для рассечения.
- Поместите все полоски бронхиолярной ткани во вторую промывку DMEM/RPMI 1640. Оставить в стирке не менее чем на 2 мин.
- Удалите полоски тканей со второго мытья с помощью стерильных щипцов, заботясь о том, чтобы не повредить ткань. Поместите ткань в чистую, стерильную чашку Петри.
- Удалите все оставшиеся мягкие ткани, прикрепленные к бронхиоле, и разрежьте полоски на квадраты (~ 5 мм х 5 мм) с помощью стерильных ножниц для рассечения.
- Добавьте третью промывку DMEM/RPMI 1640 в чашку Петри. Слегка перемешайте кусочки ткани в стирке, закручивая посуду.
- Вылейте третью промывку из чашки Петри, не удаляя кусочки ткани.
- Добавьте окончательную промывку SCFM в посуду Петри, содержащую ткань, гарантируя, что все кусочки ткани покрыты.
- Стерилизуйте кусочки ткани в SCFM под ультрафиолетовым светом в течение 5 мин.
- Используйте стерильные щипцы для переноса каждого стерилизованного кусочка бронхиолярной ткани в отдельные колодцы из 24-х скважинной пластины/с, содержащей агарозные прокладки SCFM.
- Чтобы заразить каждый кусочек ткани желаемым бактериальным штаммом, прикоснитесь к колонии, выращенной на агаревой пластине, кончиком иглы 29 г, прикрепленной к стерильному инсулиновому шприцу 0,5 мл. Затем прикоснитесь колонией к кусочку ткани, осторожно проколов поверхность ткани.
ПРИМЕЧАНИЕ: Использование инсулинового шприца, оснащенного иглой 29 г, позволяет точно и комфортно удерживать иглу, сохраняя пальцы на безопасном расстоянии от иглы и легочной ткани. Можно выполнить этот шаг с помощью игл 29 г, которые не прикреплены к шприцев, но это требует большей ловкости и увеличивает риск травмы иглой. Инсулиновые шприцы легко доступны. - Для неинфицированных контрольных органов осторожно проколите поверхность каждого кусочка ткани кончиком иглы 29 г, прикрепленной к стерильному инсулиновой шприцам 0,5 мл.
- Используйте пипетку, чтобы добавить 500 мкл SCFM в каждую скважину.
- Стерилизуйте дышащей уплотнительной мембраной для каждой 24-скважинной пластины под ультрафиолетовым светом в течение 10 мин (Таблица материалов).
- Снимите крышку(с) с 24-колоденой пластины(ы) и замените ее дышащей мембраной.
- Инкубировать пластины при 37 °C в течение желаемого времени инкубации (заражения) без встряхивания. Проверьте, что нет видимого роста инокулированного патогена на неинфицированных контрольных элементах (контроль загрязнения).
ПРИМЕЧАНИЕ: При желании ампициллин может быть добавлен к агарозным прокладкам SCFM на этапе 2.5 и покрыть SCFM на этапе 2.30 до конечной концентрации 20 мкг/мл. Это будет подавлять рост большинства эндогенных бактерий в легких, не влияя на рост P. aeruginosa или S. aureus, но, поскольку присутствие ампициллина может повлиять на восприимчивость к другим антибиотикам, читателю остается сделать этот выбор в зависимости от штаммов и антибиотиков, которые они хотят протестировать.
3. Определение эффективности антибиотика
ПРИМЕЧАНИЕ: Схема с подробным описанием этапов этого анализа приведена на рисунке S1.
- Чтобы измерить толерантность к антибиотикам биопленок, образующихся на EVPL, во время вскрытия и инфекции необходимо воспроизвести наборы легочных кусочков, по крайней мере, из двух независимых легких. Один набор кусочков требуется для отрицательного контроля (без лечения антибиотиками), и один набор требуется для каждой концентрации антибиотика, которая должна быть проверена.
- После 48 часов инкубации визуально осмотрите неинфицированные кусочки ткани. Возможно, произошел некоторый рост бактерий, эндогенных для легких свиньи, что привело к тому, что SCFM вокруг этих участков был мутным. Если наблюдается рост, характерный для выбранного исследуемого вида (например, сине-зеленая диагностика пигментации P. aeruginosa),повторно начинайте эксперимент со свежими легкими.
- Если неинфицированные участки ткани не показывают или только минимальный рост бактерий, приготовьте одну 24-луночную промывочную пластину и одну 24-луночную обработочную пластину, каждая из которых содержит 500 мкл свежего SCFM без антибиотиков или с антибиотиком, представляющим интерес, на каждую лунку легочной ткани.
- Удалите каждый инфицированный кусочек ткани из инкубационной пластины с помощью стерилизованных пламенно щипцов, ненадолго закрутите в свежем колодце моющая пластина, чтобы удалить любые бактериальные клетки, не связанные с биопленкой, и перенесите в соответствующий колодец лечебной пластины.
- Запечатайте лечебные пластины свежей дышащей мембраной.
- Инкубировать лечебную пластину(ы) при 37 °C без встряхивания в течение 18-24 ч.
- Используя пламенные стерилизованные щипцы, извлеките каждый кусочек легкого из 24-луночной пластины и поместите в стерильную гомогенизационную трубку 2 мл, содержащую 1 мл фосфатно-буферного физиологического раствора (PBS) и 1 г металлических шариков(Таблица материалов).
- Бисер бьется в течение 40 секунд со скоростью 4 м/с.
ПРИМЕЧАНИЕ: Биение бусин с конкретными шариками и гомогенизатором, предложенными в Таблице материалов, не вызывает значительного лизиса бактерий, но каждая лаборатория, использующая протокол, должна проверить эффекты выбранных ими шариков и гомогенизатора до начала анализов AST. - Последовательно разбавляйте гомогенат легких с помощью PBS и пластины на агаре Lysogeny Broth (LB) для определения колониеобразующих единиц (КОЕ) в отдельных необработанных и обработанных антибиотиками кусочках ткани в соответствии со стандартными методами покрытия.
ПРИМЕЧАНИЕ: Необязательно: Подготовка дубликатов табличек на отдельных носителях для подтверждения личности колонии; например, использование агара из соли маннитола для S. aureus.
Результаты
Модель EVPL обеспечивает высокопроизводительную платформу для анализа, что позволяет одновременно проверять большое количество бактериальных изолятов на чувствительность к антибиотикам(рисунки 1 и 2)или проверять штаммы на соответствие диапазону концентраций антибиотиков в одном эксперименте(рисунок 3). С практикой мы обнаружили, что примерно 200 участков бронхиолярной ткани могут быть подготовлены из легких за 2 часа. Весь эксперимент для АСТ может быть завершен в течение обычного рабочего времени. Рост изолятов Pseudomonas aeruginosa и Staphylococcus aureus и создание 48-ч биопленки в модели является надежным и при мониторинге жизнеспособного количества клеток приводит к постоянным бактериальным нагрузкам(рисунки 1 и 2). Изображения тканеасоциассированных биопленок Pseudomonas aeruginosa и Staphylococcus aureus, выращенных в EVPL, можно найти вместе с протоколами подготовки к световой микроскопии и гистологического окрашивания, в наших публикациях21,23. Однако воспроизводимость количества КОЕ варьируется для разных видов бактерий. Это может быть количественно определено с использованием стандартных расчетов повторяемости после ANOVA25; мы обнаружили, что, как правило, существует большая разница между КОЕ в реплицированных образцах легких для S. aureus, чем для P. aeruginosa. Мы рекомендуем, чтобы после принятия модели лабораторией проводились повторные расчеты пилотных экспериментов для оптимизации экспериментальных методов и определения размеров образцов, которые будут использоваться в окончательных экспериментах (пример этого можно найти в приложении к данным для Sweeney et al26).
При выращивании в EVPL биопленки P. aeruginosa и S. aureus демонстрируют повышенную толерантность к антибиотикам по сравнению с восприимчивостью в стандартных, одобренных промышленностью отварах MIC(Рисунок 1)и дисковых анализах с использованием стандартных сред(Рисунок 2). Различные эффекты различных антибиотиков на установленную биопленку EVPL различимы, например, убийство P. aeruginosa достигается при EVPL с 4-16X MIC ципрофлоксацином, но не с 4-8X MIC хлорамфениколом(Рисунок 1). Двукратная суточная доза 600 мг линезолида достигает концентрации в сыворотке крови выше MIC90 для восприимчивых патогенов (4 мкг/мл)27 и рассматривается как адекватное воздействие без побочных эффектов28. Данные, представленные на рисунке 2, показывают, что популяции S. aureus, восприимчивые к линезолиду в анализе диска, способны выживать при целевых концентрациях в сыворотке крови и выше (12 мкг/мл) при EVPL. Нет четкой корреляции между MIC и антибиотическим воздействием на выращенные EVPL биопленки для P. aeruginosa (Рисунок 1). Получение более точного измерения толерантности к антибиотикам in vivo важно, потому что неоптимальное дозирование антибиотиков может увеличить риск отбора на устойчивость при хронической инфекции.
Хорошо известно, что режим роста биопленки позволяет значительно снизить восприимчивость бактерий к антибиотикам. Это привело к разработке многих анализов биопленки in vitro и использованию минимальной концентрации эрадикатора биопленки (MBEC)14,15 вместо MIC в качестве более точного предиктора восприимчивости при хронической инфекции. Использование SCFM (в различных составах) также было рекомендовано для использования в тестировании MIC или MBEC29. Здесь мы показываем, что даже оптимизированный анализ in vitro не может точно предсказать восприимчивость P. aeruginosa к колистину в EVPL. Количество антибиотика, необходимое для достижения 3 log10 уничтожения бактерий, выращенных EVPL, часто значительно выше, чем MIC или MBEC, рассчитанные на основе стандартных анализов in vitro, даже если для этих анализов используется SCFM(рисунок 3). Это согласуется с Кокрейновской рецензией, в котором сообщается, что текущие реализации тестирования чувствительности биопленки in vitro не обеспечивают какой-либо повышенной прогностической силы для назначения антибиотиков при муковисцидозе по сравнению со стандартным тестированием чувствительности16.
Также легко использовать модель для оценки воздействия антибиотиков на бактерии биопленки с течением времени, поскольку можно привить достаточное количество реплик легких, чтобы обеспечить деструктивный отбор проб. В дополнение к различию различий между противомикробными агентами, модель может выделять изменения восприимчивости на разных стадиях роста бактерий или в возрасте биопленки и для различных интервалов дозирования антибиотиков. Рисунок 4 иллюстрирует растущую толерантность биопленок P. aeruginosa к меропенем по мере их созревания. Это может быть полезно для определения эффективности новых агентов, например, являются ли они более эффективными во время быстрого деления клеток. Это также может быть важным соображением при установлении ограничений эксперимента, поскольку может потребоваться стандартизация и проверка возраста биопленки, чтобы возраст не влиял на результаты.
На рисунке 5выживаемость S. aureus измеряли через 4 ч и 24 ч после воздействия флуклоксациллина, и можно было наблюдать различия в снижении количества бактериальных клеток во времени и между изолятами. Это может быть полезно для разработки лекарственного средства, например, при определении фармакокинетических и фармакодинамических параметров или при выяснении способа действия нового агента.
Вариации бактериальной нагрузки часто увеличиваются с увеличением времени культивируется. Это можно увидеть в необработанный контроль на рисунке 5 после развития биопленки в течение 48 ч и дальнейшего воздействия 24 ч с учетом интервала дозирования антибиотиков. Вариация присуща модели; каждый образец легких независим от других и отражает естественную изменчивость легких. Поэтому важно обеспечить, чтобы было включено достаточное количество реплик, позволяющих проводить проверку и точную интерпретацию результатов. Мы возвращаем читателя к нашей рекомендации провести повторные расчеты данных, чтобы обеспечить выбор надежных размеров выборки.
Для простоты мы представили репрезентативные данные, взятые из реплицированных участков ткани, полученных из одной пары легких в каждом эксперименте, но на практике необходимо проводить повторные эксперименты на участках тканей, взятых у реплицированных животных. Это должно быть сделано для того, чтобы учесть любые биологические вариации между отдельными свиньями, и мы отсылаем читателя к нашей опубликованной работе для примеров того, насколько последовательными могут быть результаты между тканями, взятыми у реплицированных свиней, и как эта вариация учитывается в статистическом анализе данных с использованием анализа дисперсии (ANOVA) / общих линейных моделей (GLM)21,26.
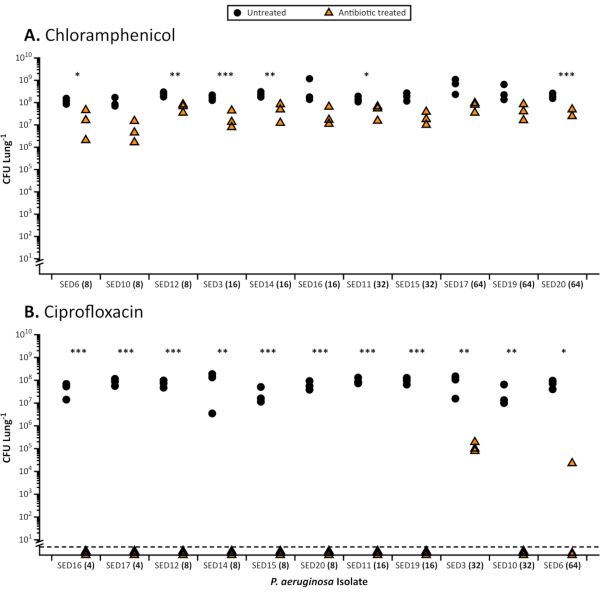
Рисунок 1. Всего КОЕ 11 CF Pseudomonas aeruginosa клинических изолятов, восстановленных из модели EVPL после лечения антибиотиками. Репрезентативные результаты лечения антибиотиками P. aeruginosa в модели EVPL. Каждый штамм выращивали на ткани EVPL в течение 48 ч, затем переводили на антибиотик (треугольники) или PBS в качестве контроля (круги) в течение 18 ч и определяли КОЕ/легкие. MIC для соответствующего антибиотика, определенного в стандартном катион-скорректированном MHB, показан в скобках рядом с каждым штаммом (ось X). Штаммы упорядочиваются путем увеличения значений MIC. Данные были проанализированы с использованием t-тестов, когда это было уместно, и тестов Mann-Whitney U для непараметрических наборов данных. Существенные различия между тканями, обработанными антибиотиками, и необработанными тканями обозначаются звездочками(Р < 0,05). А. Восстановленные жизнеспособные количества из биопленок P. aeruginosa, выращенных в модели EVPL и обработанных 64 мкг/мл хлорамфеникола (самое высокое зарегистрированное значение MIC). Для каждого изолята стандартизированная средняя разница в КОЕ между обработанными хлорамфениколом и необработанными участками ткани была рассчитана с использованием d Коэна. Не было никакой корреляции между значением MIC в стандартном тесте и уменьшением жизнеспособных чисел клеток в модели EVPL, измеренным по d Коэна (ранговая корреляция Спирмена, rs = 0,45, p = 0,16) B. Результаты биопленок P. aeruginosa, выращенных в модели EVPL и обработанных 64 мкг/мл ципрофлоксацина (самое высокое зарегистрированное значение MIC). Значения ниже пунктирной линии были ниже предела обнаружения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
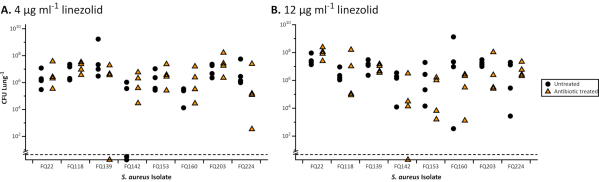
Рисунок 2. Всего КОЕ 8 клинических изолятов золотистого стафилококка CF, извлеченных из модели EVPL после лечения линезолидом. Каждый штамм выращивали на ткани EVPL в течение 48 ч, затем переносили в линезолид (треугольники) в течение 24 ч или не обработали в качестве контроля (круги). Было обнаружено, что все штаммы чувствительны к линезолиду с использованием стандартного дискового диффузионного анализа в соответствии с руководящими принципами EUCAST30 (зона ингибирования > 21 мм). Данные анализировались с использованием t-тестов, когда это было необходимо, и тестов Mann-Whitney U для непараметрических наборов данных(P < 0,05). Не было обнаружено существенных различий между антибиотиками, обработанными и необработанными, для любого из штаммов. Значения ниже пунктирной линии были ниже предела обнаружения. А. Результаты биопленок S. aureus в модели EVPL, обработанной линезолидом 4 мкг/мл (клиническая точка разрыва для чувствительных/резистентных по классификации EUCAST31). В. Результаты биопленок S. aureus в модели EVPL, обработанной линезолидом 12 мкг/мл (данные, воспроизведенные из Sweeney et al23). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
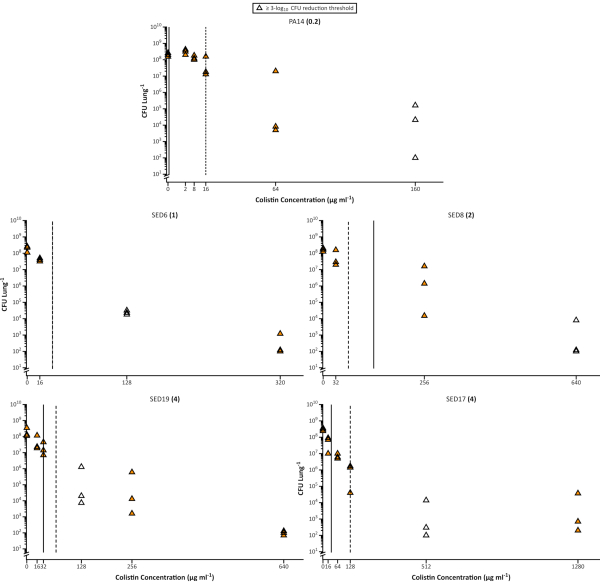
Рисунок 3. Количество клеток жизнеспособной Pseudomonas aeruginosa в клинических изолятах лабораторного штамма PA14 и 4 CF, восстановленных из модели EVPL после лечения с увеличением концентрации колистина. Каждый штамм выращивали на ткани EVPL в течение 48 ч, а затем подвергали воздействию колистина в течение 18 ч. ВПК, определяемый в стандартной среде MHB с поправкой на катионы, указан в скобках рядом с названием каждого штамма. Вертикальные линии показывают значение MBEC, определенное в MHB (сплошное тело) и SCFM (пунктирное), за исключением SED6, в котором значение было одинаковым на обоих носителях. Незаполненные точки данных представляют собой самую низкую концентрацию тестируемого колистина, которая привела к ≥ 3-log10 снижению КОЕ/легких по сравнению с необработанными образцами (0 мкг/мл колистина) (данные, воспроизведенные из Sweeney et al26). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
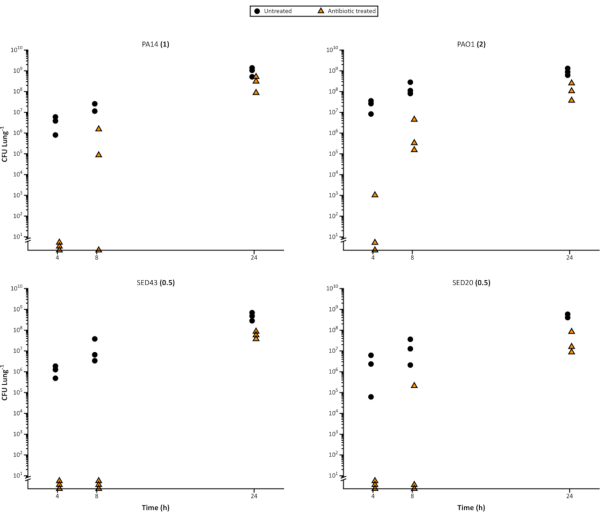
Рисунок 4. Репрезентативная жизнеспособная клетка Pseudomonas aeruginosa отсчитывается от временного курса роста по модели EVPL в течение 24 ч и последующего лечения меропенемом 64 мкг/мл. Лабораторные штаммы P. aeruginosa PA14 и 3 CF клинические изоляты выращивали на ткани EVPL в течение времени, показанного на оси X, затем переносили в меропенем (треугольники) в течение 24 ч или оставляли без лечения в качестве контрольной (круги). Затем определяли КОЕ/легкое. ВПК, определяемый в среде MHB с поправкой на катионы, показан в скобках рядом с каждым названием штамма. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
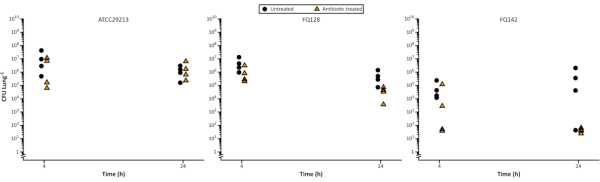
Рисунок 5. Репрезентативная жизнеспособная клетка четырёх стафилококка подсчитывается после роста на модели EVPL, затем обрабатывается флуклоксациллином 5 мкг/мл в течение 24 часов. Контрольный штамм ATCC29213 и два клинических изолята CF выращивали на ткани EVPL в течение 48 ч, затем переносили в флуклоксациллин (треугольники) или оставляли без лечения в качестве контроля (круги) в течение 4 ч и 24 ч, прежде чем определяли КОЕ/легкие (данные, воспроизведенные из Sweeney et al23). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок S1. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Таблица S1. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Модель ex vivo lung имеет высокую пропускную способность и недорогую, и, поскольку она использует отходы мясной промышленности после потребления, она не представляет никаких этических проблем. Он предназначен для имитации хронически инфицированных дыхательных путей человека CF лучше, чем доступные в настоящее время платформы IN vitro AST. Результаты, представленные здесь, показывают, что он может более точно предсказать восприимчивость к антибиотикам в этих обстоятельствах.
Критические шаги в протоколе, которые обеспечат надежные и воспроизводимые результаты, включают следующее:
- Используйте последовательное время и методы хранения между убоем, сбором и обработкой образцов легких. Важно использовать легкие как можно скорее после убоя и свести к минимуму вероятность загрязнения. Наблюдались различия в способности экспериментальных культур расти в легких, если они не настолько свежи, насколько это возможно.
- Поддержание стерильности при производстве SCFM и рассечении легочных кусочков имеет важное значение. Здоровые легкие не стерильны, и поэтому присутствие комменсальных бактерий может отражать «естественную» среду для хронической инфекции. Тем не менее, как отмечалось ранее, бактериальные взаимодействия в многовидовых популяциях могут изменить результаты и восприимчивость к антибиотикам, поэтому следует избегать загрязнения и стерилизовать легкие перед использованием. Мы выступаем за использование УФ-стерилизации, так как она, по-видимому, не вызывает изменений целостности оловянной ткани и, при необходимости, дополнительных промывок антибиотиками. Тем не менее, антибиотики следует использовать с осторожностью, так как они могут влиять на результаты путем введения селективного давления и могут изменить экспрессию генов в тестовых бактериальных популяциях.
- Используйте имитационную инфицированные, отрицательные контрольные образцы тканей и пластины подсчета клеток, выращенные на неселективной, богатой среде, чтобы подчеркнуть рост любых загрязняющих или комменсальных бактерий, которые не были удалены во время стерилизации. Это необходимо для смягчения любого воздействия этих бактерий на АСТ. Также полезно производить дубликаты, селективные агары, пластины подсчета клеток, специфичные для интересующего организма, поскольку дублирующие пластины ускоряют идентификацию колоний и перечисление клеток.
- Проводить пилотные эксперименты при первом использовании модели и при ее использовании с новыми штаммами или генотипом бактерий для оценки вариаций биопленки КОЕ между участками ткани, что позволяет выбрать оптимальные экспериментальные размеры выборки (например, сколько реплицируемых участков ткани получить из скольких реплицированных легких) с помощью расчетов мощности.
- В анализе используется нестандартизированный инокулят, так как это позволяет быстро привить после 48 часов инкубации и формирования относительно последовательных нагрузок биопленок (особенно для P. aeruginosa). Чтобы провести анализ антибактериальной эффективности на ранних стадиях роста биопленки, рассмотрите возможность инокуляции стандартизированной КОЕ колониальных бактерий, взвешенных в ASM. Не рекомендуется инокуляция планктонными бактериями: ранние пилотные эксперименты показали, что это приводит к острому, инвазивному росту не достоверного образования биопленки.
Этот протокол создает надежную прототипную модель для использования с P. aeruginosa,с большим потенциалом для разработки для использования с S. aureus,но у него есть некоторые ограничения, которые необходимо будет устранить для определенных приложений в будущем. Ткань была инокулирована из отдельных колоний, чтобы обеспечить развитие клональных популяций. Результаты показывают, что для P. aeruginosaэто мало влияет на количество клеток через 48 ч. Однако для S. aureus наблюдалась большая вариабельность бактериальной нагрузки, и, учитывая, что различные бактерии могут расти по-разному в рамках модели, стандартизированный начальный инокулят и строгое производство образцов тканей одинакового размера и веса могут зависеть от организма исследования. Также могут быть различия между лабораториями из-за различий в точных методах вскрытия / заражения или местной породы свиней / ландраса. Для оценки воспроизводимости бактериальных популяций для отдельных реализаций модели мы предлагаем использовать расчеты повторяемости в рамках статистического анализа результатов25 и использовать расчеты повторяемости/мощности на основе пилотных экспериментов для расчета оптимального размера выборки для их использования в итоговых экспериментах.
Одним из ключевых преимуществ EVPL перед традиционными пластинчатыми анализами является то, что вместо тестирования бактерий, растущих планктонально или на абиотических поверхностях, он позволяет пространственно структурировать бактериальные биопленки в среде хозяина и с дифференцировкой клеток. Это имеет важное значение для рассмотрения влияния физико-химических и питательных градиентов на активность противомикробных агентов, а также на доставку и доступность активной терапии в различных микросредах в рамках хронической инфекции и клеточно-клеточного взаимодействия между бактериями. Этот последний момент особенно важен, поскольку многовидовые инфекции обычно наблюдаются при муковисцидозе и становятся все более важными для инфекций, связанных с другими респираторными заболеваниями, такими как астма и хроническая обструктивная болезнь легких. Существует потенциал для разработки этой модели для АСТ для индивидуального забора мокроты пациента в клинической диагностике. Аналогичное испытание уже проводится с использованием модели in vitro, имитирующих раны, для роста и АСТ дебризой биопленки из хронических ран (Юго-западный региональный центр по уходу за ранами в Лаббоке, штат Техас, доктор Р. Уолкотт).
Кроме того, модель использует посмертную ткань, поэтому влияние иммунного ответа хозяина на восприимчивость к антибиотикам ограничено. Современные модели in vitro также не учитывают иммунные реакции хозяина, поэтому мы не рассматриваем это как барьер для будущего использования модели в приложениях AST. Однако иммунный ответ учитывается при определении фармакокинетических и фармакодинамических параметров и рекомендаций по дозированию антибиотиков. Хотя наши исследования показали доказательства остаточных иммунных клеток и реакций вткани 23 (и S. Azimi, личное общение), это основная область для дальнейшей оптимизации и развития модели, если желательно большее соответствие условиям in vivo.
Предоставление более клинически обоснованного АСТ для МВ поможет выполнить ключевую рекомендацию Закона Великобритании о здравоохранении и социальном обеспечении 2008 года о том, что «должны быть разработаны процедуры для обеспечения разумного назначения и управления противомикробными препаратами». Мы считаем, что EVPL является идеальной моделью-кандидатом, чтобы помочь удовлетворить эту потребность.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим всех наших соавторов за оригинальные статьи, из которых мы взяли образцовые результаты. Работа финансировалась за счет исследовательского гранта MRC New Investigator Research Grant (номер гранта MR/R001898/1),присужденного FH; аспирантами BBSRC Midlands Midlands Integrative Biosciences Training Partnership (MIBTP), присужденными NEH и IA; и присуждение Программой поддержки исследований бакалавриата Уорикского университета ФА за проведение исследовательского проекта на летних каникулах. Мы благодарим Стива Куигли, Сыновей (Каббингтон, Уорикшир) и Джона Тейлора, Сына (Эрлсден, Ковентри) за снабжение легких. Мы также хотели бы отметить помощь Центра подготовки средств массовой информации в Школе наук о жизни в Университете Уорика, с особой благодарностью Харрис и Кэролайн Стюарт, а также помощь Аниты Кэтервуд в Уорикском центре антимикробного скрининга.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL insulin syringes with 29G needle attached | |||
| 24-well culture plates | |||
| 70% ethanol or similar for surface sterilizaton and flamin gof dissection equipment | |||
| Agar plates to prepare streaks of P. aeruginosa/S. aureus (any suitable medium) | |||
| Agarose | |||
| Aluminum foil - pre-sterilised by autoclaving - to cover the chopping board on whcih you wil dissect lungs. | |||
| Bead beater designed to take 2 mL tubes | MP Biomedicals | 116004500 | FastPrep-24 Classic bead beating grinder and lysis system |
| Breathe-easy or Breathe-easier sealing membrane for multiwell plates | Diversified Biotech | BEM-1 or BERM-2000 | |
| Bunsen burner | |||
| Chopping board - we recommend a plastic board to allow for easy decontamination with alcohol. | |||
| Coolbox to transport lungs to lab | |||
| Dissection scissors in different sizes | |||
| Dulbecco’s modified Eagle medium (DMEM) | |||
| Fisherbrand 2 mL reinforced tubes | Thermo Fisher | 15545809 | |
| Fisherbrand 2.38 mm metal beads | Thermo Fisher | 15505809 | |
| Germicidal UV cabinet | |||
| Insulin syringes - 0.5 mL with 29G needle attached. | VWR | BDAM324892 | |
| Large pallet knife | |||
| LB agar plates to assess CFU in lung biofilm homogenate | |||
| Mounted razor blades | |||
| Nalgene RapidFlow PES 75 mm x 0.1 µm x 500 ml sterile filter unit | Thermo Fisher | 10474415 | For filter-sterilizing SCFM |
| Petri dishes | |||
| Phosphate-buffered saline | |||
| Plastic chopping board and aluminium foil to create a sterile and cleanable dissection surface | |||
| Roswell Park Memorial Institute (RPMI) 1640 medium | |||
| SCFM ingredients as listed in Table S1 | |||
| Selection of forceps (blunt tips recommended) | |||
| Selective agar plates to specifically assess P. aeruginosa / S. aureus CFU in lung biofilm homogenate, if required. | |||
| Suitable containers for disposing of contaminated sharps and pig ung tissue, according to your institution's health & safety policies. |
Ссылки
- Elborn, J. S. Cystic fibrosis. The Lancet. 388 (10059), 2519-2531 (2016).
- Høiby, N., et al. Diagnosis of biofilm infections in cystic fibrosis patients. APMIS. 125, 339-343 (2017).
- Bjarnsholt, T., et al. Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatric Pulmonology. 44 (6), 547-558 (2009).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents. 35 (4), 322-332 (2010).
- Penesyan, A., Gillings, M., Paulsen, I. Antibiotic discovery: Combatting bacterial resistance in cells and in biofilm communities. Molecules. 20 (4), 5286 (2015).
- Son, M. S., Matthews, W. J., Kang, Y., Nguyen, D. T., Hoang, T. T. In vivo evidence of Pseudomonas aeruginosa nutrient Acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity. 75 (11), 5313-5324 (2007).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846 (2016).
- Stites, S. W., Plautz, M. W., Bailey, K., O'Brien-Ladner, A. R., Wesselius, L. J. Increased concentrations of iron and isoferritins in the lower respiratory tract of patients with stable cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 160 (3), 796-801 (1999).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proceedings of the National Academy of Sciences. 115 (22), 5125-5134 (2018).
- Drevinek, P., et al. Gene expression changes linked to antimicrobial resistance, oxidative stress, iron depletion and retained motility are observed when Burkholderia cenocepacia grows in cystic fibrosis sputum. BMC Infectious Diseases. 8, 121 (2008).
- Goerke, C., Wolz, C. Regulatory and genomic plasticity of Staphylococcus aureus during persistent colonization and infection. International Journal of Medical Microbiology. 294 (2-3), 195-202 (2004).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Roberts, A. E. L., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. Journal of Molecular Biology. 427, 3646-3661 (2015).
- Ceri, H., et al. The Calgary biofilm device: New technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. Journal of Clinical Microbiology. 37 (6), 1771-1776 (1999).
- Moskowitz, S. M., Foster, J. M., Emerson, J., Burns, J. L. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. Journal of Clinical Microbiology. 42 (5), 1915-1922 (2004).
- Smith, S., Waters, V., Jahnke, N., Ratjen, F. Standard versus biofilm antimicrobial susceptibility testing to guide antibiotic therapy in cystic fibrosis. Cochrane Database of Systematic Reviews. (6), (2020).
- Trust, C. F. . Annual Data Report 2019. , (2019).
- Angelis, A., et al. Social and economic costs and health-related quality of life in non-institutionalised patients with cystic fibrosis in the United Kingdom. BMC Health Services Research. 15 (1), 428 (2015).
- Eidt-Koch, D., Wagner, T. O. F., Mittendorf, T., von der Schulenburg, J. M. G. Outpatient medication costs of patients with cystic fibrosis in Germany. Applied Health Economics and Health Policy. 8 (2), 111-118 (2010).
- Harrington, N. E., Sweeney, E., Harrison, F. Building a better biofilm - Formation of in vivo-like biofilm structures by Pseudomonas aeruginosa in a porcine model of cystic fibrosis lung infection. Biofilm. 2, 100024 (2020).
- Harrison, F., Diggle, S. An ex vivo lung model to study bronchioles infected with Pseudomonas aeruginosa biofilms. Microbiology. 162, 1755-1760 (2016).
- Sweeney, E., et al. An ex vivo cystic fibrosis model recapitulates key clinical aspects of chronic Staphylococcus aureus infection. Microbiology. , (2020).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85 (4), 935-956 (2010).
- Sweeney, E., Sabnis, A., Edwards, A. M., Harrison, F. Effect of host-mimicking medium and biofilm growth on the ability of colistin to kill Pseudomonas aeruginosa. Microbiology. 166 (12), 1171-1180 (2020).
- Stalker, D. J., Jungbluth, G. L., Hopkins, N. K., Batts, D. H. Pharmacokinetics and tolerance of single- and multiple-dose oral or intravenous linezolid, an oxazolidinone antibiotic, in healthy volunteers. Journal of Antimicrobial Chemotherapy. 51 (5), 1239-1246 (2003).
- Ager, S., Gould, K. Clinical update on linezolid in the treatment of Gram-positive bacterial infections. Infection and Drug Resistance. 5, 87-102 (2012).
- Kirchner, S., et al. Use of Artificial Sputum Medium to Test Antibiotic Efficacy Against Pseudomonas aeruginosa in Conditions More Relevant to the Cystic Fibrosis Lung. Journal of Visualized Experiments: JoVE. (64), e3857 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены