Method Article
颗粒模板化乳化可实现无微流体液滴检测
摘要
油包水液滴测定可用于分析化学、酶进化和单细胞分析,但通常需要微流体才能形成液滴。在这里,我们描述了颗粒模板化乳化,这是一种进行液滴测定的无微流体方法。
摘要
与散装液滴相比,在单分散液滴中进行的反应具有更高的准确性和灵敏度。然而,微流体形成受控液滴的要求对非专家施加了障碍,限制了它们的使用。在这里,我们描述了颗粒模板化乳化,这是一种在没有微流体的情况下产生单分散液滴的方法。使用模板化水凝胶球,我们通过简单的涡旋将样品封装在单分散的液滴中。我们通过使用它来执行无微流体数字PCR来演示该方法。
引言
与批量反应相比,液滴微流体利用皮升液滴中的区室化来提高测定的灵敏度和准确性,并且在化学筛选、蛋白质工程和下一代测序中具有许多应用1,2,3。例如,与本体定量聚合酶链反应 (qPCR) 相比,数字液滴聚合酶链反应 (ddPCR) 具有更高的准确性,可用于癌症的遗传变异、致病突变检测和产前诊断4,5,6。然而,液滴微流体的挑战是需要微流体装置来分割样品;虽然微流体对液滴特性具有出色的控制能力,但它们需要专业知识来构建和操作7,8。因此,基于液滴的方法主要限于专家实验室,或者在极少数情况下,可用于商业仪器的应用9,10。为了扩大液滴检测的使用范围,对专用微流体仪器的要求是必须克服的障碍。
在本文中,我们描述了颗粒模板化乳化(PTE),这是一种无微流体的方法,用于在单分散液滴中进行反应。在PTE中,模板颗粒通过简单的涡旋将样品吞没到载体油中的液滴中(图1)。随着系统的混合,水部分碎片成尺寸减小的液滴,直到液滴包含单个颗粒,此时不可能进一步破碎,因为它需要破坏颗粒。被吞没的样品将颗粒作为液滴中的壳包围,从而封装任何分散的细胞,试剂或功能部分(图1D)。因此,PTE不需要任何设备或专业知识来执行普通涡旋器以外的液滴反应。此外,与微流体的几分钟或几小时相比,液滴的产生需要几秒钟,并且产生的量与容器体积成正比,而不是设备操作时间,使其具有极高的可扩展性。这些优点使PTE非常适合在微流体不切实际的各种情况下进行液滴测定。在这里,我们演示了PTE并使用它来进行ddPCR。
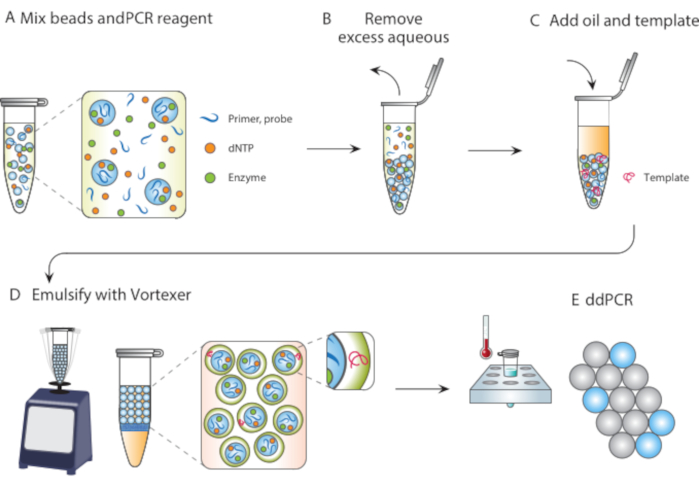
图 1.颗粒模板化乳化工艺概述。 (A)模板颗粒与试剂混合。(B)离心后除去多余的试剂。(C)模板分子的添加发生在添加油之前。(D)涡旋产生含有单个模板分子的液滴。(E)随后的热循环和成像允许对目标模板进行数字液滴分析。 请点击此处查看此图的放大版本。
研究方案
1.制备用于颗粒模板化乳化的水凝胶颗粒。
用于颗粒模板化乳化的水凝胶颗粒可以使用两种不同的方法制备。
- 使用市售颗粒进行制备
- 将0.5克与PTE兼容的干燥聚丙烯酰胺颗粒(例如,Bio-Gel P-60凝胶(Bio-Rad),直径45-90μm)加入30mL无菌水中,在50 mL锥形管中混合均匀。在室温下孵育30分钟。
- 使用微流体制备颗粒的制备方法
注意:与PTE兼容的聚丙烯酰胺颗粒可以使用市售的液滴制造商(例如,QX200液滴发生器(Bio-Rad),RayDrop(Fluigent)等)或通过定制的微流体设计来制备。- 定制母版的制作
- 使用计算机辅助设计 (CAD) 软件设计软光刻掩模。在电路板胶片上以10μm分辨率打印光掩模。
- 将 1 mL 光刻胶倒入 3 英寸硅晶圆的中心。使用旋转涂布机以500 rpm旋转30秒,然后以1250 rpm旋转30秒,从而形成50μm的光刻胶层。将晶圆放在设置为95°C的加热板上15分钟以蒸发溶剂。
- 用盖玻片将光掩模固定在硅晶圆上,并将晶圆暴露在准直的190 mW,365μm UV LED下2.5分钟。将威化片放在设置为95°C的加热板上5分钟,以进行曝光后烘烤。
- 通过将光刻胶硅片浸入100%丙二醇单甲醚醋酸酯(PGMEA)浴中长达15分钟来开发光刻胶硅片。用新鲜的100%PGMEA冲洗晶圆,然后用100%异丙醇冲洗晶圆。风干晶圆。
- 通过将晶圆在设置为95°C的加热板上干燥1分钟来除去任何残留的异丙醇。将威化片放入培养皿中干净的3中。
- 定制微流体装置的制造
- 将聚二甲基硅氧烷(PDMS)硅基和固化试剂以10:1的质量比混合。在室内真空下使用干燥器对混合的PDMS进行脱气,直到没有可观察到的气泡。
- 将脱气的PDMS倒在培养皿中的母杯上,确保硅晶圆完全浸没。对硅晶圆和PDMS进行脱气,以除去浇注过程中可能形成的任何气泡。
- 通过将硅晶圆和PDMS放入设置为65°C的烘箱中至少60分钟来固化PDMS。使用手术刀从培养皿中切除含有微流体特征的PDMS块。格外小心,以避免损坏芯片主站上存在的任何功能。
- 使用0.75 mm活检冲头将入口和出口打孔到与微流体装置中的入口和出口相对应的PDMS块中。通过重复应用去除任何灰尘和颗粒,并将包装胶带去除到PDMS块的表面。
- 清洁 50 mm x 75 mm 载玻片,方法是用 100% 异丙醇冲洗,然后风干表面。等离子体使用1 mbar的O2 等离子体处理载玻片和PDMS(朝上的特征),使用等离子体键合器1分钟。
- 通过将等离子体处理的PDMS与特征面朝下放置在载玻片上,等离子体处理的一面朝上,将PDMS贴在载玻片上。将载玻片放入设置为65°C的烤箱中至少30分钟以完成粘合。
- 用氟化表面处理处理所有微流体通道,以确保表面疏水性并防止润湿。将设备在65°C下烘烤至少10分钟。
- 模板粒子的制造
- 制备由6.2%丙烯酰胺,0.18%N,N′-亚甲基双(丙烯酰胺)和0.3%过硫酸铵组成的聚丙烯酰胺(PAA)溶液。将此溶液装入带有28G针头的1 mL注射器中。
- 在氢氟醚(HFE)油中制备由5%(w / w)氟表面活性剂和1%N,N,NN-四甲基乙二胺(TEMED)组成的不溶性连续相,用于产生和稳定液滴。将溶液装入新的1 mL注射器中。
- 将含有注射器的PAA和HFE溶液加载到注射器泵(例如,NE-501)中。使用插入注射器和设备的聚乙烯管将两个注射器连接到微流体装置。在连接之前,启动泵以从管道中除去空气。
注:根据型号的不同,注射泵可通过内置输入、制造软件或自定义脚本(https://github.com/AbateLab/Pump-Control-Program 提供)进行控制。 - 使用 PAA 和 HFE 油输入分别以 300 μL/h 和 500 μL/h 的速度运行液滴发生装置。将1mL液滴收集在15mL收集管中,并在室温下孵育3小时以进行聚合。孵育后,通过移液除去下层油。
- 将 1 mL HFE 油中的 20% (v/v) 全氟-1-辛醇 (PFO) 加入 15 mL 收集管中作为化学破乳剂。混合后,以2000× g 离心15 mL收集管旋转2分钟。通过移液去除PFO/HFE上清液。重复1次。
- 将2 mL己烷中的2%脱水山梨糖醇单油酸酯加入15 mL收集管中并涡旋混合。以3000 x g 旋转管3分钟。通过移液除去表面上活性剂/己烷溶液来除去上清液。重复2次。
- 加入5 mL TEBST缓冲液(20 mM Tris-HCl pH 8.0,274 mM NaCl,5.4 mM KCl,20 mM EDTA,0.2% Triton X-100)并充分混合。以 3,000 x g 的速度向下旋转 3 分钟。通过移液除去上清液。重复3次。
- 重悬于 5 mL TEBST 中。该溶液可以无限期地储存在4°C。
- 定制母版的制作
2.颗粒模板化乳化。
在制备模板颗粒之后,PTE用于将样品和试剂封装在液滴中。
- 通过以6000× g 离心1分钟以沉淀颗粒来制备用于颗粒模板化乳化的聚丙烯酰胺颗粒,然后通过移液除去上清液并使用无菌水重悬。重复3次以确保去除任何残留的TEBST。
- 使用血细胞计数器(或等效物)确定模板颗粒的浓度和直径。通过以像素为单位测量直径并转换为微米来计算单个颗粒直径。像素到微米的转换可以使用血细胞计数器(或等效物)作为校准载玻片进行计算,并以像素为单位测量已知的网格距离。
- 根据 表1,使用PCR预混液,适当的引物和荧光素水解探针在新鲜的1.5mL微量离心管中制备分散相。使用管旋转器在室温下在温和搅拌(10rpm)下孵育5分钟,以确保组件的均匀分布。
注:颗粒的体积和目标浓度基于泊松载荷。作为一般规则,粒子的数量应该比要封装的样品数量多一个数量级。对于未知浓度的样品,需要稀释系列以确保泊松负载。
| 卷 | 试剂 |
| 100 μL | 颗粒 (450 颗粒 / μL) |
| 200 μL | 2x PCR 预混液 |
| 18 μL | 10 μM 正向底漆 |
| 18 μL | 10 μM 反向引物 |
| 18 μL | 10 μM 探头 |
| 0.8 μL | 海卫一X100 |
| 45.2 μL | 无核酸酶水 |
表 1.与PTE一起制备用于数字液滴PCR的PCR预混液。
- 以6000× g 离心分散相1分钟,并除去上清液。记录提取的上清液的体积,并使用以 2.3 计算的总分散相体积确定沉淀体积。
注意:提取的上清液量将根据颗粒堆积,直径和浓度而变化,最小预期体积为300μL。 - 将1μL1.62pg / μL 酿酒酵母 基因组DNA从2.4加入沉淀中,并通过移液或剧烈敲击彻底混合。
注:过量含水物的存在会降低封装效率。如果样品体积超过沉淀体积的1%,则浓缩样品。如果样品无法浓缩,请根据样品体积缩放PCR预混液和所得沉淀体积。PTE允许乳化小(10μL)至大体积(2 mL)的模板颗粒。PCR预混液(2.3)和油(2.6)可以分别根据颗粒的靶标(2.3)和测量(2.4)体积进行缩放。 - 将HFE油中的200μL 2%含氟表面活性剂作为不溶性连续相加入管中进行乳化。确保通过移液或轻拍/轻拂试管来排出沉淀。然后以3000 rpm的速度涡旋30秒。
注:对应于 3000 rpm 的设置可能因品牌和型号而异。 - 让乳液沉降1分钟。除去100μL底油相,并用HFE油中的新鲜2%含氟表面活性剂代替该体积。轻轻翻转管子几次以混合。重复3-5次或直到小卫星液滴被移除。
3.数字液滴PCR和分析。
- 沉降2-5分钟后,除去底部油相。用氟碳油中的 5% 含氟表面活性剂(例如 FC-40)代替此体积。
- 使用宽孔移液器吸头,小心地将100 μL样品移入200 μL PCR管中。将PCR管放入热循环仪中,并按 表2运行。
| 步 | 温度 | 期间 | 笔记 |
| 1 | 95 °C | 2 分钟 | |
| 2 | 95 °C | 30 秒 | |
| 3 | 50 °C | 90 秒 | |
| 4 | 72 °C | 60 秒 | |
| 5 | 重复 x34 步骤 2 到 4 | ||
| 6 | 72 °C | 2 分钟 | |
| 7 | 2 °C | 拿 |
表 2.使用PTE乳液的数字液滴PCR的热循环条件。
- 使用宽孔移液器吸头将样品移液到计数载玻片上,以进行荧光成像。使用具有490 nm激发和525 nm发射检测波长的荧光显微镜对样品进行成像。
- 量化阳性荧光液滴(Np)和总液滴(NT)以验证是否存在,并使用阳性液滴(Np / NT)的比例和泊松统计来计算模板分子(λ)的数量:
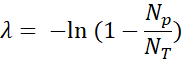
- 通过以下方式计算 95% 置信区间 (zc = 1.96):
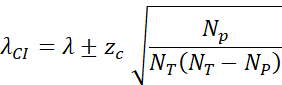
- 使用步骤 2.5中加入的样品的体积(ν,μL)计算样品浓度(分子/μL),使用下面给出的方程。使用技术重复确定样品浓度的平均值和标准偏差。
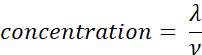
结果

图 2.使用颗粒模板化乳化将样品封装成液滴。 (一)模板化颗粒,用于颗粒模板化乳化。(B)离心后从上清液中分离模板颗粒沉淀。(C)颗粒模板化乳化产生的液滴,带有(D)可识别的水壳。 请点击此处查看此图的放大版本。
在PTE中,乳液的单分散性由模板颗粒的单分散性决定,因为液滴的直径略大于颗粒。因此,均匀的颗粒是受控PTE封装的核心11。产生均匀模板颗粒的方法多种多样,包括化学(溶胶-凝胶、乳液聚合)、流体动力学(膜乳化、均质化)和过滤方法。特别是微流体方法,提供了出色的单分散性(图2A),并允许额外的粒子工程来增强其在PTE12中的功能。或者,可以购买模板化颗粒,尽管它们的均匀性虽然足够,但通常小于微流体生成11。
为了进行PTE,将颗粒与要封装的样品混合(图1A),并通过离心和移液除去多余的上清液(图1B),如PCR管底部颗粒颗粒的照片所示(图2B)。然后加入含有稳定表面活性剂的封装油(图1C),并在涡旋前轻轻移液样品30秒(图1D),以生成乳液(图2C)。所得的液滴包含包含初始样品的颗粒核心和水壳,其中驻留着反应所需的试剂,靶分子和细胞(图2D)。就像在液滴微流体封装中一样,像小珠子或细胞这样的离散实体是随机封装的,并且符合泊松分布,尽管由于PTE物理学的性质,几乎所有液滴都含有模板粒子。

图 3.颗粒模板化乳化液滴的鉴定和净化。 (A)由于涡旋不足而产生具有多个颗粒的不均匀液滴的实例。(B)颗粒模板化乳化后预期存在卫星和液滴,以及(C)油包水分馏。(D)油洗后产生的乳液。(E)颗粒模板化乳化过程中残留的上清液产生的卫星生成过多。 请点击此处查看此图的放大版本。
即使在成功的PTE中,也存在双核或三核液滴,尽管它们通常对反应的贡献可以忽略不计,只要它们很少见。在保留足够壳体的同时实现低频率的多核液滴需要优化工艺参数,包括表面张力、颗粒间粘附力、样品粘度、容器尺寸以及涡流功率和时间。例如,优化不佳的乳化可能含有具有许多模板颗粒的多分散液滴(图3A),表明涡流不足以完全乳化样品。在这种情况下,可以添加洗涤剂以减少颗粒间附着力并降低表面张力,或者可以增加涡旋功率或时间。另一个常见的问题是产生过多的卫星,它们是小的空液滴(图3B)。在PTE乳液中,卫星可能是不可避免的,这取决于样品和载体油的界面张力和流变特性。然而,它们通常是由于在乳化之前没有充分去除多余的样品(图2B),或者以太大的功率涡旋,从液滴中剥离壳。在成功的PTE乳化中,卫星应占总封装样品体积的约10%(图3C)11。在这个水平上,它们通常对反应的贡献可以忽略不计,可以忽略不计。出于美学目的,可以通过用新鲜油洗涤它们从乳液中清除它们(图3D)。

图 4.颗粒模板化乳化数字液滴PCR的评价。 (A)液滴的荧光成像可识别阳性荧光液滴和阴性非荧光液滴。(B)用数字液滴PCR鉴定稀有模板或低浓度模板。(C)过度丰富的模板封装导致每个液滴的模板分子数量可变。 请点击此处查看此图的放大版本。
为了证明PTE的实用性,我们用它来执行无微流体的数字PCR11。使用该过程,我们封装了包含 酿酒酵母 基因组DNA的样品,并对其进行了热循环。在数字PCR中,含有扩增靶标的液滴变得荧光,而没有的液滴保持微弱。因此,荧光液滴指示靶标,允许通过计数阳性液滴直接定量靶标(图4A)。因此,荧光液滴的数量随靶分子比例,当靶标很少见时产生很少的阳性(图4B),当它丰富时产生许多阳性(图4C)。与其他离散组分的封装一样,靶标封装遵循泊松分布,允许正液滴部分转化为靶标浓度(图4D),从而证明了使用PTE11进行数字PCR的能力。
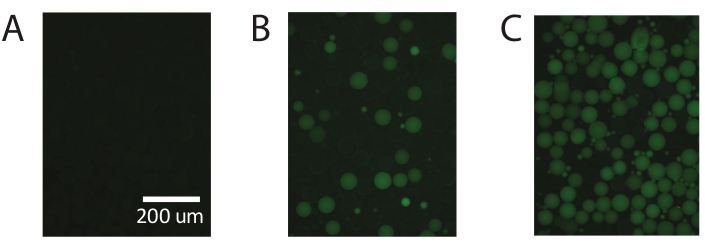
图 5.使用市售 PAA 演示数字液滴 PCR。 (A)液滴的荧光成像可识别阴性非荧光液滴。(B)用数字液滴PCR鉴定低浓度的模板。(C)用数字液滴PCR鉴定高浓度的模板。 请点击此处查看此图的放大版本。
这些结果可重复使用市售聚丙烯酰胺颗粒(图5),并证明了PTE能够使用市售聚丙烯酰胺颗粒进行标准数字PCR,从而在相同范围内实现精确测量。
补充文件。 请点击此处下载此文件。
讨论
PTE使用颗粒通过涡旋将样品封装在单分散的液滴中。除了简单性和可访问性之外,PTE还具有其他几个优点,包括允许立即产生大量液滴。此外,该过程可以在隔离管中进行,无需将样品转移到微流体设备,简化了整体工作流程并限制了样品污染或丢失的机会。模板颗粒还提供了一种设计所得液滴反应内容物的方法。例如,可以设计用于靶向生物分子或细胞捕获的粒径,化学和润湿性,而功能部分(如酶,活性物质或核酸)可以显示在颗粒上以促进反应,例如用于单细胞测序或功能表征。虽然这种方法是灵活的,但其使用仍然存在重要的限制。例如,目前不可能像通常使用微流体一样进行液滴添加,要求在封装之前引入所有反应组分;这要求试剂具有相容性和稳定性,直到可以产生液滴,并且在麻烦的组合的情况下,通常可以通过在冰上快速混合和乳化样品来解决。或者,可以使用可在外部用光或热触发的反应元件13。因此,PTE为进行非专家可访问的液滴测定提供了一种灵活且可扩展的方法。这一点,再加上其与生俱来的简单性和灵活性,使PTE成为执行和开发众多液滴应用的理想选择。
披露声明
作者没有什么可披露的。
致谢
开发该协议的工作得到了美国国立卫生研究院(R01-EB019453-02),国家情报总监办公室的支持,通过雷神BBN Technologies Corp(N66001-18-C-4507)进行的情报高级研究项目活动,Chan-Zuckerberg Biohub研究员计划,德克萨斯A&M大学的国防高级研究计划局(W911NF1920013)以及约翰霍普金斯大学应用疾病控制和预防中心的支持 物理实验室 (75D30-11-9C-06818 (CDC3)).此处包含的观点和结论是作者的观点和结论,不应被解释为必然代表上述组织或美国政府的明示或暗示的官方政策。美国政府有权出于政府目的复制和分发重印本,尽管其中有任何版权说明。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 | |
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ | |
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) |
参考文献
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501(2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。